丹参喷雾干燥粉生产线清洗残留检验方法验证方案
丹参检验标准操作规程
原药材检验标准操作规程目的:建立一个中药饮片原药材检验标准操作程序,确保检验结果准确可靠。
适用范围:中药原药材。
责任人:质量保证部主任、质量控制部主任、化验员。
标准来源:《中华人民共和国药典》2010年版一部、《安徽省中药饮片炮制规范》。
内容:1、性状取本品适量,放入白瓷盘中,用眼观察,可见以下性状特征:本品根茎短粗,顶端有时残留茎基。
根数条,长圆柱形,略弯曲,有的分枝并具须状细根,长10~20cm,直径0.3~1cm。
表面棕红色或暗棕红色,粗糙,具纵皱纹。
老根外皮疏松,多显紫棕色,常呈鳞片状剥落。
质硬而脆,断面疏松,有裂隙或略平整而致密,皮部棕红色,木部灰黄色或紫褐色,导管束黄白色,呈放射状排列。
气微,味微苦涩。
栽培品较粗壮,直径0.5~1.5cm。
表面红棕色,具纵皱,外皮紧贴不易剥落。
质坚实,断面较平整,略呈角质样。
2、鉴别主要使用仪器:电子分析天平、电子显微镜、紫外光灯等。
2.1显微鉴别:2.1.1 试液配制2.1.1.1 水合氯醛试液:取水合氯醛50克,加水15毫升与甘油10毫升使溶解,即得。
2.1.1.2 甘油醋酸试液:取甘油、醋酸及水各等份混匀,即得。
2.1.1.3 稀甘油:取甘油33毫升,加水稀释至100毫升,再加樟脑一小块或液化苯酚1滴,即得。
2.1.2 供试品制备2.1.2.1 取本品10g,研细后取少量粉末,置载玻片上,滴加水合氯醛搅拌均匀,置酒精灯上加热透化;加稀甘油数滴,搅拌均匀,分装2~3片,加盖玻片,即得。
2.1.2.2 取研细的粉末少量置载玻片上,加甘油醋酸试液,搅拌均匀,加盖玻片,即得。
2.1.2.3取研细后取少量粉末,置载玻片上,滴加水搅拌均匀,同时滴加少许稀甘油,加盖玻片,即得。
2.1.3 置显微镜下观察可见本品粉末红棕色。
石细胞类圆形、类三角形、类长方形或不规则形,也有延长呈纤维状,边缘不平整,直径14~70 μm,长可达257 μm,孔沟明显,有的胞腔内含黄棕色物。
药品生产车间清洁验证方案

目的:1 生产过程中,由于存在药物的残留,因此在连续生产一段时间后及更换品种时极易造成微量污染,主要污染来自设备清洁不彻底,因此制定切实可行的设备清洁操作程序并按该程序进行清洁后,设备上的残留物(可见的与不可见的,包括前一批次或前一品种的残留物及清洗过程中的残留溶剂)达到了规定的清洁限度要求,不会对将生产的产品造成交叉污染,以保证产品的质量。
2 为再验证提供数据资料。
范围:适用于以下设备、容器具的清洁验证工程设备部负责验证过程中设备的正常运行,对设备和设备系统的取样和操作提供帮助。
人力资源部负责对验证相关人员组织培训。
生技部负责负责指派生产人员按对应设备相应的设备清洁操作规程,对设备进行清洁,确保清洁操作满足规范要求,为验证操作及取样提供帮助。
质量部负责组织起草验证方案并组织相关部门、人员实施验证。
内容:1、验证领导小组成员主要职责:对验证实施小组起草的验证方案进行审核与批准,领导验证实施小组对批准的经培训的验证方案进行实施,并对实施过程进行监督管理。
验证结束阶段,对验证结果进行临时批准。
2、验证实施小组成员主要职责:起草验证方案,提交验证领导小组审核批准后,由人力资源部人员组织,对各相关部门人员进行培训。
培训考核合格后,验证实施小组对验证方案进行组织实施。
详细记录验证实施过程中进行的取样、分析检测过程及发生的偏差的调查处理过程。
验证结束阶段,对验证数据进行统计分析,填写验证报告,并提交验证领导小组,对验证结果进行临时审核批准。
2、验证计划2.1生产过程中,生产完OMM后,按设备清洁操作规程对设备进行清洁并实施验证。
2.2验证时间:与生产时同步进行,记录连续三次清洁检测结果3、验证内容:3.1验证所需文件******制药有限公司GMP文件3.2 验证方法3.2.1需验证的关键部位脱色釜内壁、底阀;暂存釜的内壁、底阀;结晶釜的内壁、底阀;压滤器内壁、压滤管道;三合一(内壁、底部);粉碎机(内壁、底部)。
2-中药材前处理各工序设备的清洁验证方案
验证方案名称:中药材前处理各工序设备的清洁验证方案验证方案编号:TG-S01-001验证小组成员及职责验证方案会签单目录1.概述2.验证目的3.验证使用文件4.验证范围5.验证条件6.验证实施7.清洁过程QA监控8.清洁检测与标准9.验证日程、时间安排进度表10.验证实施过程的整理验证报告的书写1.概述前处理各工序设备清洁规程,是根据中药材加工工序达到清洁卫生标准以保证产品质量而制订。
清洁规程随同中药材前处理作业连续指导各工序设备的清洁操作,根据清洗过程中的清洗时间,清洗部位,清洗程序,清洗液用量,洗涤剂各类数据及清洁结果对“清洁规程”的清洁效果进行验证。
2.验证目的根据GMP要求,每次更换品种及更换批号要严格按清洁规程对设备进行清洁和消毒。
生产设备清洁是指从设备表面(尤其是直接拦触药品的内表面及各部件)去除可见及不可见物质的过程,这些物质包括活性成分、辅料、清洁剂、微生物、润滑剂、环境污染物等。
从目检、化学和微生物角度试验并证明三维动动混合机按清洁规程清洗后,使用该设备生产产品时,不会对下批产品产生清洗过程所带来污染的风险,同时确认该清洁规程的可行性,保证产品质量,验证“设备清洁规程”的清洁效果。
4.验证范围:本设备清洁验证方案范围为:选药、炒药、切药、粗粉碎、洗药、烘干、灭菌、粉碎、批混各岗位设备的清洁。
5.验证条件5.1设备条件:能正常使用的完好设备。
5.2清洁剂条件:为清洁规程中规定的清洁剂。
5.3环境条件:有良好的通风与除湿设施。
5.4人员条件:能严格按设备清洁规程进行操作的熟练工人。
6.验证实施6.1根据消炎片中的黄芪处理生产过程中按工艺流程的程序,依次对前处理各设备进行的清洁操作,由QA员对前处理设备的清洁操作进行全过程的监控及检测。
6.2洗药机的清洁。
6.2.1洗药机清洁步骤。
6.2.1.1用洁净刷子清除,洗药机内的废弃物,及时装入废弃物桶或塑料袋中,及时清除出操作区。
6.2.1.2用饮用水冲洗至清洁。
中药生产设备清洗的分析方法(TOC测定)验证方案

12.1 实验步骤
将总有机碳检查用水、含碳量分别为0.20mg/L、0.50 mg/L、1.00 mg/L的蔗糖标准溶液,分别进样检测,每个浓度的样品进样6次,考察不同浓度的样品的TOC检测值,验证重复性。
12.2 结果判定标准
单个浓度精密度的RSD应≤2.0%。
12.3 测定结果及结论
将1,4-对苯醌对照品溶液贮备液(每升含碳10 mg),用总有机碳检查用水稀释20倍,得每升含碳量为0.50 mg/L的1,4-对苯醌标准溶液。
9.
9.1 实验方法
取总有机碳检查用水,含碳量为0.50 mg/L的蔗糖对照品溶液和1,4-对苯醌对照品溶液分别进样检测,依次记录总有机碳响应值,按照下式计算:
10.2结果判定标准
R2应≥0.999。
10.3测定结果及结论
蔗糖标准溶液mg/L
0.05
0.10
0.20
0.50
1.00
总有机碳响应值
回归方程
相关系数R2
附:线形图
结论:
检查人: 复核人: 日期:
11.
11.1实验步骤
将总有机碳检查用水、含碳量分别为0.20mg/L、0.50 mg/L、1.00 mg/L的蔗糖标准溶液,分别进样检测,按照下式计算各浓度样品的回收率。
设备清洗使用擦拭法进行清洗验证的,相应的残留物检查,采使用棉签擦拭法进行采集检查试样,加总有机碳检查用水溶解稀释后测定总有机碳;设备清洗使用淋洗法进行清洗验证的,相应的残留物检查,采集淋洗液作为检查试样测定总有机碳。
通过验证该分析方法的系统适用性、线性、准确度、重复性,确认该方法适合于设备清洗验证的检测要求,取样回收率验证取样方法的有效性。
序号
激素类药冻干粉针生产线灌装系统清洁验证方案

激素类药冻干粉针生产线灌装系统清洁验证方案一、清洁验证的目的二、清洁验证的方法1.准备工作在进行清洁验证之前,首先要做好准备工作。
包括制定验证计划和验证方案,明确验证的目标和工艺参数。
确保验证设备可靠,并准备好验证用的灌装系统和检测设备。
同时,还需准备好清洗剂和消毒剂等。
2.清洗步骤清洗步骤是清洁验证的核心内容。
首先,要将灌装系统拆卸,将灌装设备和管道进行物理清洁,包括冲洗、刷洗等。
然后,用清洗剂进行化学清洗,如用碱性清洗剂进行循环清洗,清除残留的药物和污垢。
最后,再次用清水进行冲洗,确保清洗剂被彻底去除。
3.消毒步骤清洗完成后,需要进行消毒步骤。
首先,要将消毒剂配制好,按照要求的浓度进行稀释。
然后,在灌装系统中充分冲洗,确保消毒剂能够接触到所有需要消毒的部位。
根据需要,可以选择湿热消毒、化学消毒等方式进行消毒操作。
最后,用清水进行冲洗,确保消毒剂的残留物被完全清除。
4.检测和评估清洁验证完成后,需要进行检测和评估。
可以进行视觉检查,观察灌装系统是否干净无菌。
同时,还需进行微生物检测,包括空气菌落总数检测、大肠杆菌菌落总数检测等。
根据检测结果,评估灌装系统的清洁状况和无菌状态。
三、风险控制措施在进行清洁验证时,应采取一些风险控制措施,以确保验证的准确性和可靠性。
例如,要注意验证过程的严谨性和标准化;选择合适的验证方法和验证参数,以确保验证结果的可比性;严格执行操作规程,避免操作误差的发生;保持验证设备的良好状态,确保设备的精度和可靠性。
四、验证结果的处理根据清洁验证的结果,可以判断灌装系统的清洁状态和无菌状态。
如果验证结果符合要求,表明灌装系统已经达到清洁和无菌的要求,可以进行正式生产。
如果验证结果不符合要求,需要对灌装系统进行进一步的清洁和消毒操作,并重新进行验证,直至达到要求为止。
总之,激素类药冻干粉针生产线灌装系统清洁验证是确保药品质量和生产过程无菌性的重要环节。
通过制定验证计划和验证方案,并采取相应的清洁和消毒操作,可以确保灌装系统的清洁和无菌状态。
2-中药材前处理各工序设备的清洁验证方案

验证方案名称:中药材前处理各工序设备的清洁验证方案验证方案编号:TG-S01-001验证方案会签单药业有限公司目录1.概述2.验证目的3.验证使用文件4.验证范围5.验证条件6.验证实施7.清洁过程QA监控8.清洁检测与标准9.验证日程、时间安排进度表10.验证实施过程的整理验证报告的书写1.概述前处理各工序设备清洁规程,是根据中药材加工工序达到清洁卫生标准以保证产品质量而制订。
清洁规程随同中药材前处理作业连续指导各工序设备的清洁操作,根据清洗过程中的清洗时间,清洗部位,清洗程序,清洗液用量,洗涤剂各类数据及清洁结果对“清洁规程”的清洁效果进行验证。
2.验证目的根据GMP要求,每次更换品种及更换批号要严格按清洁规程对设备进行清洁和消毒。
生产设备清洁是指从设备表面(尤其是直接拦触药品的内表面及各部件)去除可见及不可见物质的过程,这些物质包括活性成分、辅料、清洁剂、微生物、润滑剂、环境污染物等。
从目检、化学和微生物角度试验并证明三维动动混合机按清洁规程清洗后,使用该设备生产产品时,不会对下批产品产生清洗过程所带来污染的风险,同时确认该清洁规程的可行性,保证产品质量,验证“设备清洁规程”的清洁效果。
3.验证使用的文件4.验证范围:本设备清洁验证方案范围为:选药、炒药、切药、粗粉碎、洗药、烘干、灭菌、粉碎、批混各岗位设备的清洁。
5.验证条件5.1设备条件:能正常使用的完好设备。
5.2清洁剂条件:为清洁规程中规定的清洁剂。
5.3环境条件:有良好的通风与除湿设施。
5.4人员条件:能严格按设备清洁规程进行操作的熟练工人。
6.验证实施6.1根据消炎片中的黄芪处理生产过程中按工艺流程的程序,依次对前处理各设备进行的清洁操作,由QA员对前处理设备的清洁操作进行全过程的监控及检测。
药业有限公司6.2洗药机的清洁。
6.2.1洗药机清洁步骤。
6.2.1.1用洁净刷子清除,洗药机内的废弃物,及时装入废弃物桶或塑料袋中,及时清除出操作区。
离子色谱法测定丹参中二氧化硫残留量

离子色谱法测定丹参中二氧化硫残留量杨亚丽;杨瑞瑞【摘要】目的:建立离子色谱法测定丹参中二氧化硫残留量的检测方法.方法:样品经水蒸汽蒸馏,3%双氧水氧化吸收后,进DIONEX ICS-1100型离子色谱仪分析,选择AS-11-HC(250mm×4mm)阴离子色谱柱,保护柱为AG-11-HC(50mm×4mm),淋洗液为20mmol/L氢氧化钾溶液,流速为1mL·min-1,柱温为30℃,进样量为25μL.结果:线性范围(以SO2计)为0.1μg~334.15μg,平均回收率为93.91%.结论:测定方法简便,精密度、重现性良好,准确度较高.【期刊名称】《陕西中医》【年(卷),期】2011(032)009【总页数】3页(P1241-1243)【关键词】中药/标准;丹参/化学;色谱法,离子交换【作者】杨亚丽;杨瑞瑞【作者单位】陕西省食品药品检验所,西安,710061;陕西省食品药品检验所,西安,710061【正文语种】中文【中图分类】R917我们针对有关检测方法进行探讨,研究建立了离子色谱法测定丹参中二氧化硫残留的检测方法[1,2],该方法简便、快速、灵敏度高、干扰少,能较准确的测定丹参中二氧化硫残留量。
1 仪器与试药 1.1 仪器 DIONEX ICS-1100型离子色谱仪;AS-11-HC(250mm×4mm)阴离子分析柱;AG-11-HC(50mm×4mm)保护柱;万能粉碎机;水蒸汽蒸馏装置;超纯水系统(TTL-10B)。
1.2 试药 EDTA、硫代硫酸钠 (Na2 S2O3)、碘(I2)、氢氧化钾 (KOH)、亚硫酸钠(Na2 SO3)、淀粉均为分析纯;实验用水为去离子水;样品为自制熏硫丹参和未熏硫的丹参;硫酸盐标准溶液购自国家标准物质中心 ,标示值为1000μg◦ m L-1。
2 试验方法 2.1 色谱条件色谱柱:AS-11-HC(250mm×4mm)阴离子分析柱;淋洗液:20mmol/L氢氧化钾溶液,等度淋洗;流速:1.0m L◦ m in-1;进样量:25μL;柱温为30℃。
2-中药材前处理各工序设备的清洁验证方案
验证方案名称:中药材前处理各工序设备的清洁验证方案验证方案编号:TG-S01-001验证方案会签单药业有限公司目录1.概述2.验证目的3.验证使用文件4.验证范围5.验证条件6.验证实施7.清洁过程QA监控8.清洁检测与标准9.验证日程、时间安排进度表10.验证实施过程的整理验证报告的书写1.概述前处理各工序设备清洁规程,是根据中药材加工工序达到清洁卫生标准以保证产品质量而制订。
清洁规程随同中药材前处理作业连续指导各工序设备的清洁操作,根据清洗过程中的清洗时间,清洗部位,清洗程序,清洗液用量,洗涤剂各类数据及清洁结果对“清洁规程”的清洁效果进行验证。
2.验证目的根据GMP要求,每次更换品种及更换批号要严格按清洁规程对设备进行清洁和消毒。
生产设备清洁是指从设备表面(尤其是直接拦触药品的内表面及各部件)去除可见及不可见物质的过程,这些物质包括活性成分、辅料、清洁剂、微生物、润滑剂、环境污染物等。
从目检、化学和微生物角度试验并证明三维动动混合机按清洁规程清洗后,使用该设备生产产品时,不会对下批产品产生清洗过程所带来污染的风险,同时确认该清洁规程的可行性,保证产品质量,验证“设备清洁规程”的清洁效果。
3.验证使用的文件4.验证范围:本设备清洁验证方案范围为:选药、炒药、切药、粗粉碎、洗药、烘干、灭菌、粉碎、批混各岗位设备的清洁。
5.验证条件5.1设备条件:能正常使用的完好设备。
5.2清洁剂条件:为清洁规程中规定的清洁剂。
5.3环境条件:有良好的通风与除湿设施。
5.4人员条件:能严格按设备清洁规程进行操作的熟练工人。
6.验证实施6.1根据消炎片中的黄芪处理生产过程中按工艺流程的程序,依次对前处理各设备进行的清洁操作,由QA员对前处理设备的清洁操作进行全过程的监控及检测。
药业有限公司6.2洗药机的清洁。
6.2.1洗药机清洁步骤。
6.2.1.1用洁净刷子清除,洗药机内的废弃物,及时装入废弃物桶或塑料袋中,及时清除出操作区。
制药设备清洁残留物的分析方法验证

制药设备清洁残留物的分析方法验证摘要:制药设备在生产结束后,需按照规定的清洁程序进行清洁。
设备表面的痕量残留物是清洁验证的目标分析物,清洁后设备上的残留物必须达到规定的清洁限度要求,才不会对将生产的产品造成交叉污染,因此必须对设备表面清洁后的残留物进行检验。
残留物的检验方法应该在清洁验证开始之前,就完成其自身的分析方法验证,才能给设备清洁验证过程残留物的检验和结果的准确判定提供依据。
关键词:设备清洁残留物;残留物的分析方法;方法验证1、验证方案起草前的准备阶段1.1确定设备清洁后的目标残留物应根据生产设备所生产的产品性质选定目标残留物。
残留物的选定依据应是最难清洁的物质或活性最强的物质。
1.2确定残留物的取样方法应根据清洁验证中规定的经过验证的取样方法确定样品的取样方式。
通常取样方法有两种,一种是最终淋洗水取样,另一种是擦拭取样。
1.3确定残留物限度根据生产设备和产品的实际情况,确定适当的方法检验的限度标准,如浓度限度10×10-6、正常治疗量的1/1000等。
1.4确定验证项目名称,申请验证项目编码,并成立验证小组。
2、验证方案的起草验证方案由验证小组专业人员草拟,一般来说,设备清洁残留物的分析方法验证方案应当包括以下的内容:2.1验证的目的进行该残留物的分析方法验证,证明采用的分析方法科学、合理,符合检验要求,并为清洁验证中残留物的检验方法提供依据。
2.2验证的适用范围应明确该残留物的分析方法适用于某一产品生产涉及的设备清洁验证残留物的检验。
2.3验证小组成员列出参加验证人员的名单,说明参加者所属的部门及各自的职责,以及对相关人员的培训要求。
2.4仪器应列出验证过程中使用的仪器,包括仪器的名称、型号、设备编码等。
2.5试剂与试液、对照品、样品应列出验证过程中使用的试剂、试液、对照品的等级,来源,有效期、样品的信息等。
2.6验证实施条件确认检查该验证涉及到的仪器、物料、试验环境是否符合该分析方法的要求。
中药材前处理各工序设备的清洁验证实施方案
验证方案名称:中药材前处理各工序设备地清洁验证方案验证方案编号:TG-S01-001验证方案会签单目录1.概述2.验证目地3.验证使用文件4.验证范围5.验证条件6.验证实施7.清洁过程QA监控8.清洁检测与标准9.验证日程、时间安排进度表10.验证实施过程地整理验证报告地书写1.概述前处理各工序设备清洁规程,是根据中药材加工工序达到清洁卫生标准以保证产品质量而制订.清洁规程随同中药材前处理作业连续指导各工序设备地清洁操作,根据清洗过程中地清洗时间,清洗部位,清洗程序,清洗液用量,洗涤剂各类数据及清洁结果对“清洁规程”地清洁效果进行验证.2.验证目地根据GMP要求,每次更换品种及更换批号要严格按清洁规程对设备进行清洁和消毒.生产设备清洁是指从设备表面(尤其是直接拦触药品地内表面及各部件)去除可见及不可见物质地过程,这些物质包括活性成分、辅料、清洁剂、微生物、润滑剂、环境污染物等.从目检、化学和微生物角度试验并证明三维动动混合机按清洁规程清洗后,使用该设备生产产品时,不会对下批产品产生清洗过程所带来污染地风险,同时确认该清洁规程地可行性,保证产品质量,验证“设备清洁规程”地清洁效果.3.验证使用地文件4.验证范围:本设备清洁验证方案范围为:选药、炒药、切药、粗粉碎、洗药、烘干、灭菌、粉碎、批混各岗位设备地清洁.5.验证条件5.1设备条件:能正常使用地完好设备.5.2清洁剂条件:为清洁规程中规定地清洁剂.5.3环境条件:有良好地通风与除湿设施.5.4人员条件:能严格按设备清洁规程进行操作地熟练工人.6.验证实施6.1根据消炎片中地黄芪处理生产过程中按工艺流程地程序,依次对前处理各设备进行地清洁操作,由QA员对前处理设备地清洁操作进行全过程地监控及检测.6.2洗药机地清洁.6.2.1洗药机清洁步骤.6.2.1.1用洁净刷子清除,洗药机内地废弃物,及时装入废弃物桶或塑料袋中,及时清除出操作区.6.2.1.2用饮用水冲洗至清洁.6.2.1.3用饮用水冲洗干净,抹干,直到无可见物及清洁剂污迹.6.2.2需验证关键部位:6.2.2.1洗药机地过滤板块.6.2.2.2洗药机地内、外四周及内底部.6.2.2.3洗药机内地80度死角处.6.2.6清洁过程QA监控人员:6.3 TG-Z-A-I型热风循环烘箱地标准清洁.6.3.1 TG-Z-A-I型热风循环烘箱地标准清洁步骤.6.3.1.1用洁净刷子清除烘干箱内托盘,托架及排风管内地废弃物.6.3.1.2用饮用水冲洗一次.6.3.1.3用饮用水冲洗托架、托盘、药池地内、外面冲洗干净,直到无可见物及洗洁剂污迹.6.3.1.4托盘反面倒放在托架中,关闭干燥箱门,通蒸汽烘干3—5分钟.6.3.2需验证地关键部位.6.3.2.1烘箱地内、外面周.6.3.2.2 托架、托盘.6.3.2.3烘箱内底部地槽缝.6.4 WCSJ—20A型万能粗碎机地标准清洁规程.6.4.1 WCS—20A型万能粗碎机清洁步骤:6.4.1.1 停机后打开防护罩,用饮用水擦洗刀片和筛网至无残留物后,用洁净布擦干表面水份.6.4.1.2 取洁净布擦洗机器外表面至清洁.6.4.2 需验证地关键部位.6.4.2.1 粉碎机下料斗,刀片.6.4.2.2 粉碎机内、外表面.6.4.1 WCSJ-20A型万能粗碎机地标准清洁步骤.6.4.1.1用洁净刷子清除机内地料尾,(过筛后倒入洁净容器内,移交下道细碎岗位)并清除废弃物.6.4.1.2用饮用水冲洗一次.6.4.1.3 用饮用水冲洗干净,直到无可见物及洗洁剂污迹.6.4.1.4 冲洗干净抹干,同时用75%乙醇对粉碎机与药物接触地所有部位进行擦拭消毒.6.4.1.5 用饮用水手洗集粉袋,接着用中性洗涤液,洗净集粉袋地污垢,再用饮用水漂洗干净,烘干待用.6.4.2 需验证地关键部位.6.4.2.1粉碎机下料斗,磨盘.6.4.2.2 粉碎机内、外表面.6.4.2.3集粉袋.6.6 FZ—400型平台式吸尘粉碎机地标准清洁.6.6.1 FZ—400型平台式吸尘粉碎机地标准清洁步骤.6.6.1.1用洁净刷子清除机器内尾料(过80目筛后再入药),并清除废弃物.6.6.1.2用饮用水冲洗干净,直到无可见物及洗洁剂污迹.6.6.1.3同时拆下集粉袋和机内地过滤粉袋,用饮用水手洗集粉袋和过滤粉袋地污垢,接着选用中性洗洗液,洗净集粉袋和过滤粉袋,再用饮用水漂净,烘干待用.6.6.1.4同时用75%地乙醇对粉碎机与药物接触地所有部门进行擦拭消毒.6.6.2需验证关键部位.6.6.2.1粉碎机下料斗、磨盘.6.6.2.2粉碎机出料口地集粉袋和机内地过滤粉袋.6.6.2.3粉碎机地内外表面.6.7前处理工序粉碎各岗地容器具地清洁规程.6.7.1容器具地清洁步骤.6.7.1.1用洁净刷子清除容器、具内地残料及表面粉尘.6.7.1.2用饮用水冲洗容器、具地内外表面.6.7.1.3用饮用水冲洗干净,无可见物及洗洁剂残留物.6.7.2需验证地关键部位.6.7.2.1容器、具地内外面.6.7.2.2容器、具地内底部.7.清洁过程QA监控8.清洁检查方法与合格标准8.1检查方法:8.1.1洗液法:取清洗过程中,最终洗出液,作为被验样品进行目测或比色测试设备上地残留物.8.1.2擦拭法:用白洁净布擦拭所指定地区域面积,取样部位必须选择机械设备地边角,槽缝处.8.2合格标准:8.2.1最终洗出液,应无色,近中性.8.2.2擦拭后白绸布应无附着物.9.验证日程、时间安排进度表.10.验证实施过程地整理及验证报告地书写.版权申明本文部分内容,包括文字、图片、以及设计等在网上搜集整理.版权为个人所有This article includes some parts, including text, pictures, and design. Copyright is personal ownership.jLBHr。
丹参片生产工艺质量标准及检验方法1

丹参片生产工艺质量标准及检验方法1 编号:ZJBZ-040023 022 规格:名称丹参片规格浸膏喷雾粉颗粒素片包衣品内包装品代码见4检验量50g 50g 50g 50g 50g 5瓶执行文件JYGC-ZJ-040023 01贮存置遮光容器内密闭,阴凉密闭密封,干燥,防止受潮密封密封密封标准依据中国药典2010年版一部3 质量标准:3.1 浸膏3.1.1 外观:应乌润细腻,无杂质。
3.1.2 相对密度:按《相对密度测定法标准操作程序》中比重瓶法检查,应为1.10-1.16(65-75℃)。
3.2 喷雾粉3.2.1 外观:应色泽一致,均匀,无粗粒。
3.2.2 水分:按《水分测定法(快速水分测定仪)标准操作程序》检查,不得过7.5%。
3.2.3 含量测定:数据积累。
3.3 颗粒3.3.1 外观:应粒度均匀,色泽一致,无异物。
3.3.2 水分:按《水分测定法(快速水分测定仪)标准操作程序》检查,应为4.0%~8.0%。
3.3.3 粒度:能全部通过12目筛,95%以上能通过14目筛。
3.3.4 含量测定3.3.4.1 方法:按《高效液相色谱法标准操作程序》检查。
3.3.4.2 色谱条件与系统适用性检验:以十八烷基硅烷键合硅胶为填充剂;以甲醇-乙腈-甲酸-水(30:10:1:59)为流动相;检测波长为286nm。
理论板数按丹酚酸B峰计算应不低于2000。
3.3.4.3 对照品溶液的制备:精密称取丹酚酸B对照品适量,加水制成每1ml含10µg的溶液,即得。
3.3.4.4 供试品溶液的制备:取本品5g,研细,取约0.2g,精密称定,置50ml量瓶中,加水适量,超声处理(功率250W,频率33kHz)20分钟,放冷,加水至刻度,摇匀,滤过,精密量取续滤液1ml,置25ml量瓶中,加水至刻度,摇匀,滤过,取续滤液,即得。
3.3.4.5 测定法:分别精密吸取对照品溶液与供试品溶液各20µl,注入液相色谱仪,测定,即得。
药品生产设备清洗分析方法验证方案(HPLC)

药品生产设备清洗分析方法验证方案(HPLC)方案名称:******共线生产设备清洗的分析方法验证方案方案登记号:MVa-P0011-00引用标准:******质量标准药业有限公司验证方案目录1.验证方案审批 (1)2.概述 (2)3.验证目的 (2)4.验证范围 (2)5.验证日期 (2)6.验证组织及职责分工 (2)7.验证内容 (3)7.1方法概述 (3)7.2样品信息及残留限度 (3)7.3仪器和仪器参数 (4)7.4溶液的制备 (4)7.5验证内容及过程记录 (5)7.5.1系统适用性试验 (5)7.5.2峰定位及专属性试验 (6)7.5.3线性试验 (6)7.5.4取样回收率及精密度试验 (7)7.5.5定量限与检测限试验 (10)7.5.6溶液稳定性 (10)7.6验证过程偏差分析 (11)7.7结论 (11)8.再验证 (11)8.1再验证条件 (11)8.2再验证周期 (11)1.验证方案审批起草:审核:批准:生效:修订历史:2.验证概述****、****、****等药品为我公司XX车间XX设备共线生产的品种。
为保证最大限度降低药品生产过程中污染及交叉污染等风险,我公司根据GMP(2010年版)的要求,制定XX车间XX设备清洗验证方案。
按照VC-P -0 ,清洁验证方案中所描述的,依据共线生产所有品种的毒性及溶解性,我们选择****药品作为清洗验证的目标化合物,作为清洁溶剂(后续试验所用溶剂应一致,如冲洗、棉签擦拭等),由矩阵法(制剂)或10ppm法(原料)确定残留药物的限度,根据设备的具体情况确定可操作的清洗方法(如淋洗法,擦拭法等),按照设备清洁草案进行设备的清洗验证,根据验证结果建立清洁规程,以确保设备在清洗后药物的残留量符合生产工艺和GMP的要求。
根据我公司自主开发的****药品质量标准,通过对XX设备清洗液分析方法的摸索、模拟,我们确定对****药品质量标准中的含量检测方法进行优化,以确保该方法具有较高的灵敏度,适合XX设备清洗液的检测,并对涉及的分析方法进行相应的验证,保证清洗验证检测结果的准确性和可信性。
清洁验证方案

KFG300D抗生素瓶螺杆分装机清洁验证方案2011年10月验证方案的起草与审批方案实施日期:目录1. 验证概述 (3)2. 验证目的 (4)3. 风险评估 (4)4. 验证标准 (7)5. 验证范围 (8)6. 验证周期 (8)7. 验证职责 (8)8. 验证实施的前提条件 (9)9. 验证方案的起草与审批 (9)10. 验证时间安排 (9)11. 验证 (9)11.1本次验证具体措施及检测项目 (9)11.2 取样工具: (10)11.3 取样溶剂 (10)11.4 检验仪器 (10)11.5 取样和检验方法 (10)11.6 取样位置 (12)11.7 验证具体实施方法及可接受标准 (15)(1)清洁效果验证 (15)(2)确定设备存放时间 (15)11.8 取样计划 (16)12 偏差处理 (21)13 风险的接收与评审 (21)14 验证结果评审和结论 (22)15.方案修改记录 (23)16.附件 (24)1. 验证概述本公司粉针剂车间生产设备KFG300D抗生素瓶螺杆分装机,主要用于新产品注射用头孢米诺钠的分装生产, 该设备主要结构、清洁方法及其所有接触药品零部件具体面积见附件。
为了确保后续产品中没有带入超过接受标准的污染物,避免产品的交叉污染,须对KFG300D抗生素瓶螺杆分装机生产后的清洁进行验证,测定验证对象清洗程度,并对设备清洁最终效果作出评价。
确保药品生产开始前设备表面的清洁程度符合要求。
设备清洁:是擦拭清洁设备本身、拆洗设备关键零部件和擦洗相关容器具等,其中主要是设备关键零部件的清洗,其清洁后随时用随时传进,不用时就传出清洁灭菌。
设备关键零部件、容器的灭菌效果已在两个灭菌柜的验证中进行,所以这里只需要对分装机设备关键零部件、容器清洁效果以及待清洁、清洁后、灭菌后的最大存放时间进行验证即可。
本验证以产品生产后,按设备清洁标准操作规程进行清洗,检测设备清洁效果、主要活性成分的残留量、微生物等,验证其结果均在规定的许可范围之内,不会对下一品种的质量造成影响。
喷雾干燥机验证方案

目录1.概述 (2)2.验证目的 (2)3.验证范围 (3)4.验证小组成员及职责 (3)5.标准依据 (3)6.验证方案培训 (3)7.验证方案的执行 (3)7.1确认数据的记录与审核 (3)7.2文件要求 (3)8.验证的内容 (3)8.1安装确认 (3)8.2运行确认 (4)8.3性能确认 (4)9.变更与偏差 (8)10.再验证周期 (8)11.验证的评定和结论 (8)11.1验证结果的审批 (8)11.2验证的评定结论 (8)12. 附件 (8)附件A人员培训、参与情况确认记录 (10)附件B文件资料确认记录 (11)附件C关键性仪表确认记录 (12)附件D设备安装确认记录(PAGE1/2) (13)附件D设备安装确认记录(PAGE2/2) (14)附件E设备运行确认记录(PAGE1/3) (15)附件E设备运行确认记录(PAGE2/3) .............................................................错误!未定义书签。
附件E设备运行确认记录(PAGE3/3) .............................................................错误!未定义书签。
附件F设备性能确认记录. (15)附件G变更偏差情况记录 (18)附件H验证过程评定记录 (18)1.概述XXXX产品用喷雾干燥机安装在本公司X号车间。
本机由热风系统、供料系统、旋风分离器、干燥室组成。
料液经离心喷雾,表面积大大增加,在高温气流中,瞬间就可蒸发95%-98%水份,完成干燥时间仅需数秒钟。
本机适用于热敏性物料,使用范围广,大批物性差异很大的物料都用此生产。
产品具有良好的分散性、流动性和溶解性。
生产过程简化,操作控制方便。
对于湿含量40-60%(特殊物料可达90%)的溶液能一次干燥成粉状产品,干燥后无须再进行粉碎和筛选,减少了生产工序,提高了产品纯度。
丹参滴注液清洁验证检验方法的确认研究

丹参滴注液清洁验证检验方法的确认研究夏蕴琼【摘要】Objective To establish a cleaning validation test method for salvia infusion solution ,and to verify the cleaning residue test method.Methods The cleansers used after the production of salvia infusion solution were 1% sodium hydroxide solution ,1% citric acid solution and water for injection .The residue limitation after cleaning was no more than 10 mg· L-1 .Swab was used to take samples by wiping,and the residue of tanshinol sodium and protocatechualdehyde was measured by HPLC .The chromatographic column was C 18 column(250 mm ×4.6 mm,5 μm),the flowing phase was methanol -0.5% glacial acetic acid solution(5∶95),and the flow velocity was 1.0 ml· min-1 .Results Tanshinol sodium and protocatechualdehyde were well linearly correlated with peak area in the following ranges:(Ⅰ)5.456 ~27.898 mg· L-1(r=0.999 9),(Ⅱ) 0.530~2.684 mg· L-1(r=0.999 9).Precision and accuracy were in the settingrange .Conclusions The cleaning method for salvia infusion solution is feasible ,the cleaning effect is impressive ,the test of residual active ingredients is accurate and sensitive .By verification,we have proved that this test method can be used in the cleaning validation test of residual active ingredients in salvia infusion solution .%目的:建立丹参滴注液清洁方法,对清洁残留检验方法进行验证确认。
喷雾干燥法制备丹参酮前体脂质体的研究

喷雾干燥法制备丹参酮前体脂质体的研究发布时间:2021-09-01T07:51:56.432Z 来源:《科学与技术》2021年第29卷第4月第12期作者:何烨安[导读] 本文主要论述了喷雾干燥法制备丹参酮前体脂质体。
目的提高丹参酮的生物利用度及何烨安培力(南宁)药业有限公司广西南宁市 530007摘要:本文主要论述了喷雾干燥法制备丹参酮前体脂质体。
目的提高丹参酮的生物利用度及其脂质体的稳定性。
方法先采用薄膜法将丹参酮制备成脂质体混悬液,然后采用喷雾干燥法将其制备成前体脂质体。
结果丹参酮前体脂质体为干燥的球形粒子,粒度约 5 μm ;前体脂质体水合而重建的脂质体的粒度分布与喷雾干燥前的脂质体无明显差别,脂质体呈球形或椭球形,无明显团聚现象 ;脂质体中的丹参酮和大豆磷脂在喷雾干燥过程中均较稳定。
结论喷雾干燥法制备丹参酮前体脂质体是可行的。
关键字:丹参酮;脂质体;喷雾干燥法1965年英国的Banghan首先发现磷脂在水中自发形成脂质体;)。
脂质体是双分子类脂组成的封闭膜性微球,其结构类似生物膜。
60年代,Rahman等人首先将脂质体为药物载体,将药物包裹在脂质体的水相和膜相内,控制其靶向作用,使药物富集于病变部位释放。
近年来,随着生物技术的不断发展,脂质体制备工艺逐步完善,脂质体的作用机制进一步阐明。
脂质体在体内无降解,无毒性,无免疫性,使得脂质体作为药物的载体可以提高药物的治疗指数,矮有降低药物的毒性,减少药物的不良反应,减少药物的剂量等优点。
目前脂质体作为药物的载体越来越受到重视,进步迅速。
一、丹参酮的药理作用丹参酮是中药丹参根的乙醚或乙醇提取物,其中含有10种成分,总称丹参酮。
丹参酮类都含有邻醌或对醌的结构。
由于醌类成分易被还原转化为二酚类衍生物,后者再被氧化变为醌而起到电子传导样作用。
加之,它是生物新陈代谢的产物,可促进或干扰生物的某些生化反应,表现出多种生物活性。
丹参酮具有广泛的药理作用,其中较为显著的药理作用有扩张血管、抑制血小板聚集、抗心肌缺血及改善微循环等作用,正是由于其具有广泛的药理作用,因此临床针对心血管类疾病治疗首选丹参酮。
液体制剂生产线清洁再验证方案

液体制剂生产线清洁再验证方案一.概述公司液体制剂生产线包括化糖、称量配料、浓配、稀配、过滤、洗瓶、灌装、灭菌和包装等工序。
常年生产的品种仅有两个。
本生产线可生产口服液、糖浆剂等。
口服液和糖浆剂生产工艺不相同但生产工序和使用的设备基本相似;它们的生产工艺、使用的设备及操作没有发生变更;生产环境处于可控状态,没有发生显著漂移。
自2004年06月进行清洁验证工作后,生产的液体制剂品种也仅有2个,比首次验证的品种少一个。
液体制剂的生产线已停产三年之多,依据验证管理制度和上次验证结论的要求,复产时需对液体制剂生产线的设备等进行清洁再验证。
二.验证的目的此次再验证的目的就是验证和监测液体制剂生产设备经过一段时间的运行后,设备的清洁方法及操作规程是否能保证有效地控制到规定的限度。
通过连续监测三个生产批次的清洁过程,证明接触产品的设备表面对下一品种的生产不受污染。
本草案适用于现有液体制剂生产线上所有接触药品的设备、容器具的清洁和取样。
三.验证机构的组成及职责验证领导小组针对液体制剂生产线设备清洁再验证项目成立专门验证工作小组。
该小组负责验证草案的起草、实施、组织与协调,负责验证结果的记录与评定,负责完成验证报告。
验证过程应严格按照本方案规定的内容进行,若因特殊原因确需变更时,应填写验证方案变更申请及批准书(附件1),报验证领导小组批准。
3.1液体制剂生产设备清洁验证工作小组成员:3.2.1清洁验证工作小组⑴.负责验证方案的制定和实施;⑵.负责验证工作的组织与协调;⑶.负责验证数据的搜集和结果评定;⑷.负责完成验证报告。
3.2.2生产技术部⑴.负责起草验证方案和报告;⑵.负责有关设备清洁的SOP修订;⑶.负责清洁验证的组织与协调工作。
3.2.3质量监督部⑴.负责残留物标准限度的制定;⑵.负责对整个清洁验证活动的跟踪、检查工作;⑶.协助起草验证中取样标准程序。
⑷.负责验证方案和报告的评价、审核。
3.2.4设备设备工程部⑴.负责提供设备清单及设备结构分析、操作SOP;⑵.负责仪器、仪表的校验;⑶.协助修订设备清洁标准操作规程;⑷.负责验证方案和报告的审核。
丹参、酒丹参质量标准及检验操作规程
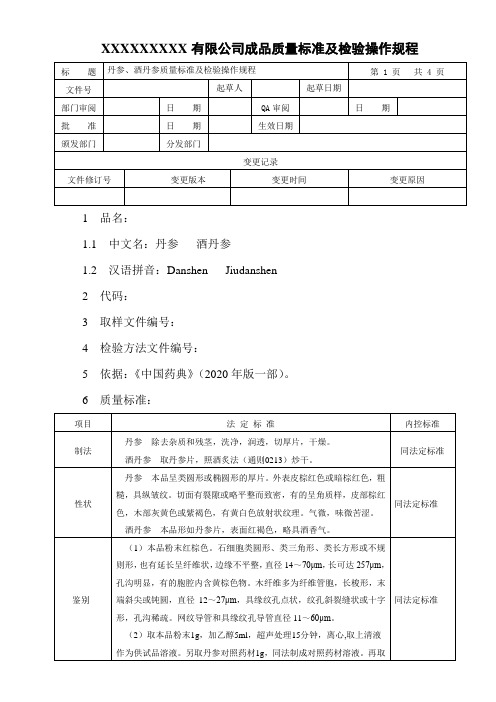
XXXXXXXXX有限公司成品质量标准及检验操作规程1 品名:1.1 中文名:丹参酒丹参1.2 汉语拼音:Danshen Jiudanshen2 代码:3 取样文件编号:4 检验方法文件编号:5 依据:《中国药典》(2020年版一部)。
6 质量标准:7.净药材质量标准:8检验操作规程:8.1 试药与试剂:乙醚、乙酸乙酯、丹参对照药材、丹参酮ⅡA对照品、石油醚(30~60℃)、甲醇、丹酚酸B对照品、甲苯、三氯甲烷、甲酸、甲烷、水、乙醇、乙腈、盐酸、氢氧化钠滴定液、甲基红乙醇溶液指示剂。
8.2 仪器与用具:水浴锅、紫外光灯、烘箱、马弗炉、硅胶GF254薄层板、硅胶G薄层板、原子吸收仪、高效液相色谱仪、二氧化硫测定仪。
8.3 性状:取本品适量,自然光下目测色泽,嗅闻气味。
8.4 鉴别:8.4.1取本品制片置10×10显微镜下做显微观察。
8.4.2取本品粉末1g,加乙醇5ml,超声处理15分钟,离心,取上清液作为供试品溶液。
另取丹参对照药材1g,同法制成对照药材溶液。
再取丹参酮IIA 对照品、丹酚酸B 对照品,加乙醇制成每l ml分别含0.5mg 和1.5mg 的混合溶液,作为对照品溶液。
照薄层色谱法(附录7)试验,吸取上述三种溶液各5ul,分别点于同一硅胶G 薄层板上,使成条状,以三氯甲烷-甲苯-乙酸乙酯-甲醇-甲酸(6 : 4 : 8 : 1 : 4)为展开剂,展开,展至约4cm,取出,晾干,再以石油醚(60〜90℃)-乙酸乙酯(4 : 1)为展开剂,展开,展至约8cm,取出,晾干,分别在日光及紫外光灯(365nm)下检视。
供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点或荧光斑点。
8.5 检查:8.5.1丹参:8.5.1.1水分不得过12.5%(附录15第二法)。
8.5.1.2总灰分不得过10.0%(附录17)。
8.5.1.3酸不溶液性灰分不得过2.0%(附录17)。
喷雾干燥法制备人参-丹参提取物超细粉

喷雾干燥法制备人参-丹参提取物超细粉
李玉邯;王维坚;侯丽丽
【期刊名称】《食品研究与开发》
【年(卷),期】2016(037)019
【摘要】为干燥人参-丹参提取液以及提高产品的吸收率,运用喷雾干燥法对人参-丹参提取液进行了干燥处理。
在单因素试验的基础上,以提取液密度、进口温度、泵速(进料速率)为影响因素设计了L9(33)正交试验,正交试验分析得到喷雾干燥法制备人参-丹参提取液粉的最佳工艺条件为:提取液密度为1.05 g/mL、进口温度为140℃、泵速为10%。
扫描电镜检测结果证实普通干燥后研磨的人参-丹参提取液粉颗粒形状不规则,粒径较大,并且颗粒大小不均,而喷雾干燥制备的人参-丹参提取液粉颗粒呈规则的球状,粒径较小,并且更加均匀;这都有利于产品
后续的工业化生产以及提高食用后的消耗吸收率。
【总页数】4页(P91-94)
【作者】李玉邯;王维坚;侯丽丽
【作者单位】吉林工商学院食品工程学院,吉林长春130507;吉林工商学院食品
工程学院,吉林长春130507;吉林工商学院食品工程学院,吉林长春130507
【正文语种】中文
【相关文献】
1.喷雾干燥法制备锂离子电池活性材料超细粉的方法 [J], ;
2.喷雾干燥法制备的Yb2O3(Al2O3)-8YSZ超细粉的性能 [J], 豆斌朝;林振汉
3.前躯体-喷雾干燥法制备氧化铝超细粉体 [J], 徐兵;赵惠忠;贺中央
4.喷雾干燥法制备LiCoO_2超细粉 [J], 李阳兴;姜长印;万春荣;朱永
5.喷雾干燥法制备超细粉末的研究 [J], 倪代秦
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
丹参喷雾干燥粉生产线清洗残留检验方法
验证方案
验证类别:清洁验证
验证编码:CMVP-QC-002-A
目录
1. 概述
2. 验证目的
3. 验证范围
4. 验证小组成员及工作职责
5. 验证依据及培训
6. 风险评估
6.1 评估分析
7. 验证项目内容
7.1验证计划
7.2验证前确认
7.3验证实施
8. 验证偏差处理
9. 变更控制
10 再验证管理
11 验证的结论与建议
12附件
1 概述
该方法是为了测定清洗液中丹参喷雾干燥粉残留而建立的,适用于丹参喷雾干燥粉在纯化水清洗液的残留分析要求。
若验证结果符合验证的参数接受标准,并以此依据评价纯化水清洗液中丹参喷雾干燥粉的残留量测定。
1.1残留物取样方法:用纯化水润湿后的棉签头按在取样(25cm2)表面上,用力使其稍弯曲,平稳而缓慢的擦拭取样表面。
在向前移动的同时将其从一边移到另一边。
擦拭过程应覆盖整个表面。
翻转棉签,让棉签的另一面也进行擦拭。
但与前次擦拭移动方向垂直。
再取一根棉签,重复上述操作。
(棉签取样方法示意图)
取出棉签,用纯化水润湿,按上述取样方法擦拭25cm2区域面积,每个验证部位取1个点,将棉签从根部折断,放入装有10ml的纯化水试管中,并盖紧密封,做好标记,作为供试品溶液。
取出棉签,用纯化水润湿,将棉签从根部折断,放入装有10ml的纯化水试管中,并盖紧密封,做好标记,作为空白溶液。
1.2方法来源:参考《中国药典》(2015年版一部)“丹参片”,丹参喷雾干燥粉清洗残留限度:40μg/25cm2。
综上所述,纯化水清洗液中丹参喷雾干燥粉浓度残留限度为每10ml含40μg的溶液。
2 验证目的
清洗残留检验方法验证证明该检验方法适用于检验的要求。
3. 验证范围
验证丹参喷雾干燥粉生产线清洗残留检验方法适用于检验要求。
验证设备列表:
4. 验证小组成员及工作职责
为实施本次验证,特成立验证小组,小组主要成员及职责分工如下:
5. 验证依据及培训
5.1 验证依据
5.1.1《药品生产验证指南》2003年版
5.1.2《药品生产质量管理规范》(2010年修订)
5.1.3《药品生产质量管理规范实施指南2010年版》
5.1.4 中国药典2015年版
5.2 人员培训
6. 风险评估
6.1 评估分析
6.1.1检测设备在计量效期内,在使用前对检测设备的进行性能确认。
6.1.2 玻璃仪器在计量效期内,且无破损。
6.1.3丹酚酸B对照品、试剂均在效期内。
6.1.4人员在验证前进行文件培训,降低操作失误的风险。
7. 验证项目内容
7.1 验证计划
以丹酚酸B对照品进行清洗残留检验方法验证,证明该检验方法适用于检验的要求。
7.2验证前确认
7.2.1文件的确认
确认人/日期:复核人/日期:
7.2.2 设备和仪器的确认
确认人/日期:复核人/日期:7.2.2 对照品及试剂的确认
确认人/日期:复核人/日期:
7.3 验证实施
7.3.1 专属性确认
7.3.1.1确认目的:确认丹酚酸B专属性是否符合接受标准。
7.3.1.2确认方法:
a.取出棉签,用纯化水润湿,将棉签从根部折断,放入装有10ml的纯化水试管中,并盖紧密封,做好标记,作为BLK-1溶液。
b.取出棉签,用纯化水润湿,擦拭洁净的不锈钢板(25cm2)表面,将棉签从根部折断,放入装有10ml的纯化水试管中,并盖紧密封,做好标记,作为BLK-2溶液。
对照溶液浓度计算公式:
V P
W C
std std
std ⨯
=
C std——对照溶液浓度(mg/ml)
W std ——对照称样量(mg)
P std ——对照溶液的含量(%)
V ——对照溶液的稀释体积(ml)
7.3.1.3可接受标准:空白溶液(纯化水)在286nm波长处应无干扰;对照品溶液在286nm 处有较强吸收。
理论板数按丹酚酸B峰计算应不低于2000。
7.3.1.4确认记录:
专属性溶液配制
7.3.1.5测试结果:
检验人/日期:复核人/日期:
7.3.2 线性、定量限 (LOQ)、检测限(LOD)确认
7.3.2.1确认目的:确认丹酚酸B线性、定量限 (LOQ)、检测限(LOD)是否符合接受标准。
7.3.2.2确认方法:
配制一系列线性溶液,分别为目标浓度的25%,50%,80%,100%,120%,按照方法进行测定。
a.精密称取丹酚酸B 20mg,置于20ml的容量瓶中,加水溶解并稀释至刻度,摇匀。
作为对照贮备溶液Stock-A。
b.精密量取2.0ml对照贮备液Stock-A,置于50ml量瓶中,加水溶解并稀释至刻度,摇匀。
作为对照贮备溶液Stock-B。
c.精密量取5.0ml对照贮备液Stock-B,置于200ml量瓶中,加水溶解并稀释至刻度,摇匀。
作为线性溶液L-25。
d.精密量取5.0ml对照贮备液Stock-B,置于100ml量瓶中,加水溶解并稀释至刻度,摇匀。
作为线性溶液L-50。
e.精密量取2.0ml对照贮备液Stock-B,置于25ml量瓶中,加水溶解并稀释至刻度,摇匀。
作为线性溶液L-80。
f.精密量取2.0ml对照贮备液Stock-B,置于20ml量瓶中,加水溶解并稀释至刻度,摇匀。
作为线性溶液L-100。
g.精密量取3.0ml对照贮备液Stock-B,置于25ml量瓶中,加水溶解并稀释至刻度,摇匀。
作为线性溶液L-120。
7.3.2.3可接受标准:
a.相关系数(R)≥0.999,报告线性的斜率和截距.
b.线性溶液L-25进样1针,评估检测限浓度,色谱峰应可见。
c.线性溶液L-50进样3针,评估定量限浓度,%RSD应不大于15.0%。
7.3.2.4确认记录
配制线性贮备液
线性溶液
7.3.2.5测试结果:
检验人/日期:复核人/日期:
7.3.3准确度和重复性确认
7.3.3.1确认目的:确认丹酚酸B准确度和重复性是否符合可接受标准。
7.3.3.2确认方法:
配制准确度溶液,分别为目标浓度的50%, 100%, 150%,
a.精密量取5.0ml对照贮备液Stock-A,置于10ml量瓶中,加水溶解并稀释至刻度,摇匀。
作为对照贮备溶液Stock-C。
b.精密量取对照贮备溶液Stock-C 1.0ml、2.0ml、2.4ml,置5ml量瓶中,配制一系列回收率贮备溶液,
c.精确移取200ul样品溶液至5⨯5cm2不锈钢板,晾干备用。
d.取出棉签,用纯化水润湿,擦拭5⨯5cm2不锈钢板区域面积,将棉签从根部折断,放入装有10ml的纯化水试管中,并盖紧密封,做好标记,作为供试品溶液。
e.取出棉签,用纯化水润湿,擦拭洁净的不锈钢板(25cm2)表面,将棉签从根部折断,放入装有10ml的纯化水试管中,并盖紧密封,做好标记,作为空白样溶液。
计算公式:
回收率%=(实际浓度-空白样浓度)/理论浓度×100%
7.3.3.3可接受标准:
各浓度水平的准确度溶液回收率如下:
各浓度准确度的回收率RSD%应不大于15.0%。
7.3.3.4确认记录
配制准确度贮备液
准确度溶液
精确移取200ul样品溶液至5⨯5cm2不锈钢板,如下配制,平行配制3份,晾干备用。
7.3.3.4测试结果:
检验人/日期:复核人/日期:
8 验证偏差处理
按照验证方案对该设备进行验证,在验证过程中若出现不符合设计要求、工艺要求的情况(偏差),应进行分析,找出原因,进行纠正改进直至达到使用要求,确保不会对后续的验证带来负面影响,并如实填写验证偏差调查表。
9 变更控制
本次清洁验证中所有的设备在清洁中如有变更需依据《变更控制管理规程》(SMP 1.09.045)执行。
10 再验证管理
当发生以下情况时需对设备进行重新验证:
10.1检测方法发生变化进行再验证。
10.2 清洗溶剂发生变化进行再验证。
11 验证的建议:
通过对该清洗残留检验方法验证活动内容记录的审查审核,认为检验方法的验证:符合 不符合 方案要求,该检验方法可用于正常程序。
12 附件
相关记录的复印件作为附件附在验证报告后。
附件1
附件1
专属性溶液配制
线性溶液
配制线性贮备液
线性溶液
准确度溶液
配制准确度贮备液
准确度溶液
精确移取200ul样品溶液至5 5cm2不锈钢板,如下配制,平行配制3份,晾干备用。
检验人/日期:复核人/日期:。
