第八章 氧化还原滴定法
氧化还原滴定分析

目录
CONTENTS
• 氧化还原滴定分析概述 • 氧化还原滴定法的应用 • 氧化还原滴定分析的实验技术 • 氧化还原滴定分析的优缺点 • 氧化还原滴定分析的未来发展
01 氧化还原滴定分析概述
CHAPTER
定义与原理
定义
氧化还原滴定分析是一种通过滴定法 测量物质含量的化学分析方法,利用 氧化还原反应来定量测定物质浓度。
测定物质的含量
化学反应机理研究
氧化还原滴定法可用于测定物质在溶 液中的含量,如金属离子、有机物等。
利用氧化还原滴定法可以研究化学反 应的机理,如电子转移过程、反应中 间产物等。
化学反应动力学研究
通过氧化还原滴定法可以研究化学反 应的动力学性质,如反应速率常数、 活化能等。
在环境监测中的应用
水中重金属离子检测
某些反应速度慢
某些氧化还原反应速度较慢,需 要较长的滴定时间,这可能会影 响测定结果的准确性。
改进方向
01
加强干扰因素的控制
为了减小干扰因素的影响,可以采取一些措施,如过滤、萃取、蒸馏等,
以去除干扰物质。
02
提高反应速度
可以通过改变反应条件来提高反应速度,如提高温度、调节酸度等,以
缩短滴定时间。
03
原理
通过加入已知浓度的氧化剂或还原剂 ,与被测物质发生氧化还原反应,利 用指示剂或电化学方法确定反应终点 ,从而计算被测物质的浓度。
氧化还原反应
氧化反应
物质失去电子的反应,通常表现为化合价升高的过程。
还原反应
物质得到电子的反应,通常表现为化合价降低的过程。
共轭反应
氧化反应和还原反应总是相互依存,形成一个氧化还 原对。
操作简便
氧化还原滴定

(2) 特殊指示剂 例:淀粉 + I2 (1 ×10-5mol·L-1) 生成深蓝色吸附化合物,
5
(3)氧化还原指示剂
指示剂
[H+ ] = 1molL-1
颜色变化 还原形 氧化形
次甲基蓝
0.52
二苯胺磺酸钠 0.85
邻苯氨基苯甲酸 0.89
+ 4H2O
1.7
Mn(H2P2O7)33- + e = Mn2+ + 3H2P2O72- 1.15
测定:Mn2+(如钢样中), 电位法确定终点。
11
(3). 弱酸性、中性、弱碱性
MnO4- + 2H2O + 3e = MnO2 +4OH- 0.59
测定:S2-,SO32-, S2O32-及某些有机物。
c(Red1) c(Ox1)
2
109
'
=
1
'-
2
'
=
0.059 2
lg109
=
0.27V
(3) n1=n2=2
K' = c(Ox2 ) c(Red1) 106 c(Red2 ) c(Ox1)
= 1
-
2
=
0.059 lg106 2
=
0.18V
△ >0.4V 反应就能定量进行
4
三、氧化还原滴定中的指示剂
环境水(地表水、引用水、生活污水) COD测定(高锰酸盐指数):
水样+ KMnO4(过) H2SO4, △ KMnO4(剩)
KMnO4
Na2C2O4(过) H2C2O4(剩)
氧化还原滴定法PPT课件

E1
E1'
0.059 n1
lg
cOX1 cRed1
Ox2 + n2 e = Red2
E2
E2'
0.059 n2
lg
cOX2 cRed2
当反应达到平衡时,E1 = E2,则
E1'
0.059 lg n1
cOX1 cRed1
E2'
0.05Biblioteka lg n2cOX2 cRed2
(E1' E2' )n 0.059
浓度均为1mol/L的实际电位。也称为式量 电位(formal potential)。
根据条件电位的大小,可判断某电对的实 际氧化还原能力。 迄今为止仍有许多体系的条件电位值未测 到,当缺少某条件下的条件电位值时,通常 用相近条件的条件电位代替。
例1 计算1mol/LHCl溶液,cCe(IV)=1.00×10-2 mol/L, cCe(III)=1.00×10-3mol/L 时Ce(IV)/Ce(III) 电对的电极电位。
氧化还原滴定法
氧化还原滴定法: 以氧化还原反应为基础的一类滴定方法。
特点: 反应机制比较复杂 反应往往分步进行 反应速度慢且常伴有副反应发生
分类: 高锰酸钾法、重铬酸钾法、碘量法、 硫酸铈法、溴酸钾法等。
第一节 氧化还原平衡
一、电极电位
1.氧化还原电对 氧化还原反应: Ox1+Red2 = Red1 + Ox2 氧化剂的还原反应: Ox1+ n e = Red1 电对: Ox1 / Red1 还原剂的氧化反应: Red2 = Ox2+n e 电对: Ox2 / Red2
二、 条件电位
氧化还原滴定法

氧化还原滴定法化学反应按其本质可分为氧化还原反应和非氧化还原反应两大类。
在工农业生产中运用氧化还原反应的地方非常多,如金属的冶炼;利用电解精练生产铜、镍;利用电镀来获得金属镀层防止金属的锈蚀;制药工业用来制备原料药和进行药品的分析等等;都是运用了氧化还原的原理,本章重点学习氧化还原滴定法。
5.1 氧化还原滴定法概述氧化还原滴定法是以氧化还原反应为基础的一类滴定分析方法,是滴定分析中应用较广泛的分析方法之一。
氧化还原反应不同于酸碱、沉淀和配位等以离子结合的反应,它是以溶液中氧化剂和还原剂之间的电子转移为基础的一种滴定分析方法。
在氧化还原反应中,失去电子的物质称为还原剂,得到电子的物质称为氧化剂。
还原剂失去电子后生成与之对应的氧化剂;氧化剂得到电子后生成与之相对应的还原剂。
氧化剂得到的电子数等于还原剂失去的电子数。
所以说,氧化还原反应的实质就是电子的得失。
例如:在实际应用中,氧化还原反应不仅可直接测定具有氧化性和还原性的物质,还可间接测定本身不具有氧化还原性,但能与氧化剂或还原剂定量反应的物质;不仅能测定无机物,也能测定有机物,如用亚硝酸钠法直接测定芳香族伯胺和仲胺类化合物含量的方法。
所以说氧化还原滴定法是滴定分析中十分重要的方法。
5.1.1氧化还原滴定法的分类根据配制标准溶液所用氧化剂的不同可分为:1. 高锰酸钾法是以高锰酸钾为标准溶液,在酸性溶液中测定还原性物质含量的方法。
2. 碘量法是以碘为氧化剂,或以碘化物为还原剂,进行氧化还原滴定的方法。
3. 亚硝酸钠法是以亚硝酸钠为标准溶液,在酸性溶液中直接测定芳香族伯胺和仲胺类化合物含量的方法。
除上述方法外,还有铈量法、溴酸盐法、高碘酸钾法、重铬酸钾法等。
本章主要介绍高锰酸钾法和碘量法。
5.1.2氧化还原反应的速度氧化还原反应机理较复杂,反应常常是分步进行的,反应速度通常比较慢。
甚至有许多氧化还原反应从反应完全程度上看是可行的,而实际上却因为反应速度太慢不能用于滴定分析。
氧化还原滴定法

a
2
授课内容
8.3 氧化还原滴定曲线 ——Ce(SO4)2滴定 FeSO4
8.4 氧化还原滴定前的预处理 1、预处理的意义 2、预处理的方法
8.5 氧化还原滴定法的应用 1、高锰酸钾法 2、重铬酸钾法 3、碘法和碘量法 4、其他氧化还原滴定法
8.6 氧化还原滴定法结果计算
a
3
重点与难点
1、氧化还原滴定法的理论基础 2、氧化还原滴定法指示剂指示终点的原理 3、氧化还原滴定各方法的特点及应用 4、氧化还原滴定法结果计算
第八章 氧化还原滴定法
a
1
授课内容
8.1氧化还原滴定法概述 1、氧化还原平衡 2、标准电极电位与条件电极电位 3、化学反应平衡常数 4、化学计量点的Esp值化学计量点的Esp值 5、氧化还原反应进行的方向 6、氧化还原速率与催化作用
8.2 氧化还原滴定指示剂 1、自身指示剂 2、氧化还原指示剂 3、专属指示剂
n2O1 + n1R2 = n1O2 + n2R1 K K 为氧化还原反应平衡常数
a
6
二、标准电极电位与条件电极电位(1)
• 电对电极电位的变化可用能斯特方程来估量:
EE R nF Tln O R
• 式中: R是气体常数,T 是绝对温度,F 是 法拉第常数,α表示活度。
• 在25Cº(298.15K)时,代入R、K值,该自然 对数为常用对数,并以平衡浓度代替活度,得:
• 通过上式,可求化学计量点时反应进行的程 度,同时,也可求得满足分析测定误差要求 的最小K值。
a
11
关于氧化还原平衡——问题 一
在氧化还原滴定中,氧化还 原平衡常数应有多大,才能满足 分析测定达到规定的误差要求?
a
氧化还原滴定法

p2 p1 aR a n ( E E O2 1 2) 1 lg K lg p2 p1 aO1 aR2 0.059
注:n为电子转移数n1和n2的最小公倍数
0.059 CO1 0.059 CO2 ' E1 lg E2 lg n1 CR1 n2 CR2
'
p2 p1 ' ' CR C n ( E E O2 1 2 ) 1 lg K ' lg p2 p1 CO1 C R2 0.059
若以 In(Ox) 和 In(Red) 分别表示指示剂的氧化 态和还原态,则:
In(O x) ne
氧化态色
17.10.16
In(Re d)
还原态色
26
EE
'
InO InR
0.059V cInO lg n cInR
与酸碱指示剂类似,氧化还原指示剂变 色范围:
0.059V E E In n
Ce4+ + Fe2+
1mol/L H2SO4
Ce3+ + Fe3+
Fe
2
ECe 4
Ce
3
1.44V
EFe3
0.68V
1.44 0.68 lg K 12.9 6 该反应进行相当完全 0.059
17.10.16 2
一、氧化还原电对性质
1. 可逆氧化还原电对:可迅速建立起氧化还原平衡,其
电势基本符合Nernst公式计算的理论电势. 例如:Fe3+/Fe2+, Fe(CN)63-/Fe(CN)64-, I2/I-
2. 不可逆氧化还原电对:不能在氧化还原反应的任一
第八章 氧化还原反应

符号为E (Ox/Red)
• 所有的气体分压均为1×105Pa; • 溶液中所有物质的活度均为1mol· -1; kg • 所有的纯液体或固体均为1×105Pa条件下 最稳定或最常见的形态。
参比标准 理论上将298K时标准氢电极的电势规定 为 0v,与之对应的半电极为: 2H+ + 2e- H2 E =0v
在一定程度上反映了水溶液中氧化还
原反应的实际过程。
平衡离子方程式时用H2O分子和它的两
个组成离子(H3O+ 和OH- )之一调整配
平电荷数和氢氧原子数。
酸性介质中的反应选用H3O+离子; 碱性介质中的反应选用OH-。 任何情况下不允许反应式中同时出现 H3O+和OH-。
8.1.2.2 半反应法
子,在多数情况下是H原子和O原子。 10HClO3 + 3P4 + 18H2O → 10HCl +12 H3PO4
5. 最后将箭头改为等号。
10HClO3 + 3P4 + 18H2O = 10HCl + 12H3PO4
例:配平 PbO2 + Mn2+ + H+ → Pb2+ + MnO4-
1. 标出氧化值
例:判断标准态条件下 2Au + 3Cl2 = 3Au3+ + 6Cl- 可否自发进行。
解:
Au → Au3+ + 3e
Cl2 +2e → 2Cl-
查表得: E (Au3+/Au) = +1.42V
E (Cl2/Cl- = +1.36V )
E =E (Cl2/Cl-)- E (Au3+/Au)
氧化还原滴定法

§8.1 氧化还原平衡
可逆电对:在氧化还原反应的任一瞬间能迅速建立平衡,其实际电势 与Nernst公式计算值基本相符的电对 不可逆电对则相反 对称电对:半反应中氧化态和还原态物质系数相同的电对 不对称电对:半反应中氧化态和还原态物质#43; ne- = Red
能斯特方程式:
1.44 0.68 2
1.06V
31
4、 化学计量点后
Ce4+ +Fe2+ = Ce3+ + Fe3+
ECe 4 /Ce3
E' Ce4 /Ce3
0.059 lg n1
cCe 4 cCe3
E' Ce 4 /Ce3
氧化还原滴定法
1
氧化还原滴定法:
是以氧化还原反应为基础的一种滴定分析方法。
反应特征如下:
(1)反应机理复杂,而且反应往往是分步完成的。 (2)反应需要一定的时间。 (3)常常伴随一些副反应。 (4)介质条件常常对反应速度及反应产物有影响。
2
例如: H2O2 + 2 I- + 2 H+ = I2 + 2H2O (1) H2O2 + 2 I- = IO- + H2O (最慢) (2) IO- + H+ = HIO
在溶液中加入NaHCO3,使溶液的pH=8.0时,则: H3AsO4的pKa1-pKa3: 2.20,7.00,11.50 H3AsO3的pKa1:9.22
E
0.56
0.059 2
lg 10 6.84 10 16 0.94
0.11(V )
E I 2 /I
0.54V
所以可以用As2O3来标定碘溶液。
氧化还原滴定法的原理

氧化还原滴定法的原理氧化还原滴定法是一种常用的分析化学方法,它通过观察物质的氧化还原反应来确定物质的含量。
在这种方法中,通常会使用一种已知浓度的氧化剂或还原剂溶液,通过滴定的方式逐渐加入到待测物质溶液中,直到达到化学计量的终点。
在这个过程中,我们可以根据滴定液的消耗量来确定待测物质的含量。
氧化还原滴定法的原理基于氧化还原反应。
在这种反应中,氧化剂会接受电子,而还原剂会释放电子。
当氧化剂和还原剂发生反应时,电子的转移会导致氧化还原指示剂的颜色发生变化,从而可以确定化学计量的终点。
通过观察滴定过程中指示剂颜色的变化,我们可以准确地确定待测物质的含量。
氧化还原滴定法广泛应用于各种化学分析中。
例如,在生活中,我们可以利用氧化还原滴定法来确定水中氯离子的含量,从而判断水的卫生状况。
在工业生产中,氧化还原滴定法也被用来确定金属离子的含量,以保证产品质量。
此外,氧化还原滴定法还可以用于医学、环境监测等领域。
在进行氧化还原滴定法分析时,我们需要注意一些关键的因素。
首先,选择合适的氧化剂或还原剂溶液非常重要,它们的浓度和滴定过程中的稳定性会直接影响到分析结果的准确性。
其次,选择合适的指示剂也是至关重要的,它应当能够在化学计量终点时准确地显示颜色变化。
此外,滴定过程中的操作技巧和仪器精度也会对结果产生影响,因此需要严格控制实验条件。
总的来说,氧化还原滴定法是一种简单而有效的分析方法,它通过观察氧化还原反应的化学计量终点来确定待测物质的含量。
在实际应用中,我们需要选择合适的试剂和指示剂,并严格控制实验条件,以确保分析结果的准确性和可靠性。
通过对氧化还原滴定法原理的深入理解和实践操作,我们可以更好地应用这种方法进行化学分析,并取得准确的分析结果。
第8章氧化还原反应与 氧化还原滴定法2
定剩余的MnO4- 。根据已知过量的KMnO4和还原剂标
准溶液的浓度和消耗的体积,即可计算出甲酸的含量
。
7
10-4 常用氧化还原滴定方法
二 、重铬酸钾法(Potassium Dichromate Method)
(一) 概述
K2Cr2O7在酸性条件下与还原剂作用: Cr2O72- + 14H+ + 6e = 2Cr3+ + 7H2O (2) 应用范围比KMnO4 法窄;
18
10-4 常用氧化还原滴定方法 2. 硫酸铜中铜的测定
三、 碘 量 法
2 Cu2+ + 4 I - = 2CuI↓ + I2
I2 + 2S2O32- = S2O32- + 2 I -
n Cu 2+ / n Na 2S2O3= 1 / 1
可逆反应,应加入过量 KI。CuI 沉淀表面吸附 I2导致结果
(4) 滴定终点:高锰酸钾自身指示终点(淡粉红色30秒不退)。
4
10-4 常用氧化还原滴定方法
一、 KMnO4法
(三) 高锰酸钾法应用示例 1. 过氧化氢的测定
可用KMnO4标准溶液直接滴定,其反应为: 5H2O2 + 2MnO4- + 6H+ = 2Mn2+ + 5O2 + 8H2O 室温、在硫酸或盐酸介质。开始时反应进行较慢。
最后以Na2S2O3标准溶液滴定析出的 I2。
22
10-4 常用氧化还原滴定方法
2
10-4 常用氧化还原滴定方法
一、 KMnO4法
(二) 标准溶液的配制与标定(间接法配制)
KMnO4自行分解反应:
氧化还原滴定法

氧化还原滴定法氧化还原滴定法是一种定量分析方法,常用于测定含氧化还原反应的物质的浓度。
在氧化还原反应中,电子会从被氧化的化合物转移到还原的化合物上,因此被称为氧化还原反应。
该方法通过滴加一种称为滴定剂的溶液来确定待测物质的浓度。
滴定剂与待测物质发生氧化还原反应,当待测物质的化合价发生改变时,滴定剂就不再反应,此时滴定完成。
原理氧化还原滴定法的原理基于以下事实:在氧化还原反应中,电子会从一个原子或分子转移到另一个原子或分子上,这样产生了电子的转移和化学计量量的变化。
因此,滴定剂可以被用来测定待测物质的化学计量量。
氧化还原反应中,电子可以从还原剂转移到氧化剂。
还原剂是一种能够给予电子的物质,它通常是一种容易氧化的物质,其化合价低于其氧化态。
氧化剂则是一种吸收电子的物质,通常是一种含氧化合物,其化合价高于其还原态。
在氧化还原滴定法中,将待测物质溶于适当的溶剂中,加入过量的还原剂,然后再滴加氧化剂,滴定至反应终点。
滴定时应注意滴定剂的选择,其氧化还原电位应当介于待测物质和还原剂之间。
当滴定剂的量与待测物质的量恰好相等时,反应终点即可确定,此时滴定完成。
操作步骤1.准备待测物质溶液,加入适当的溶剂并充分溶解;2.加入过量的还原剂;3.将寻找合适的滴定剂并确定滴定方法;4.开始滴定,滴定至反应终点(反应终点可以通过颜色变化、电位变化、气体产生等特征来确定);5.通过滴定前后的重量差或溶液浓度计算待测物质的化学计量量。
应用氧化还原滴定法广泛应用于分析化学、药学、食品工业、环境检测等领域。
例如,在药学中,可以用过氧化氢作为氧化剂来测定药物中的铁含量,氯亚铁作为还原剂来测定汞含量。
在环境检测中,可以使用铁离子和硫酸根离子来测定自然水样中的硫酸盐含量。
氧化还原滴定法是一种定量分析方法,可以通过滴加滴定剂来确定待测物质的浓度。
该方法基于化学计量量的变化,将还原剂加入待测物质溶液中,并滴加氧化剂,滴定至反应终点。
氧化还原滴定法在分析化学、药学、食品工业和环境检测等领域发挥着重要作用。
氧化还原滴定法(碘量法)

氧化还原滴定法氧化还原滴定法是以氧化还原反应为基础的滴定分析方法。
氧化还原反应是基于电子转移的反应反应机制比较复杂常伴有副反应发生反应较慢介质对反应也有较大影响。
因此氧化还原滴定中必须控制适宜的条件以保证反应定量、快速进行。
根据选用的滴定剂氧化剂不同氧化还原滴定法可分为、高锰酸钾法、亚硝酸钠法、重铬酸钾法等。
I2与I-组成电对的标准氧化势E0I2/2I-0.54见下表处于标准氧化还原电位表的中间位置。
凡是氧化势比I2/2I-电对小的还原性物质或氧化势比I2/2I-电对大的氧化性物质都可用碘量法直接或间接地测定因此碘量法在药物分析中应用较为广泛。
碘量法是以碘作为氧化剂或以碘化物作为还原剂进行氧化还原滴定的方法。
它们的电子得失分别用下式表示I22e 2I-2I--2e I2游离的I2能够取得电子变成碘离子因此I2是氧化剂。
I-则容易失去电子变成游离的I2。
表1 反应方程式E0VZn-2eZn2-0.76AsO33-2OH--2eAsO43-H0.71S2--2eS-0.51C2O42--2e2CO2-0.49H2气-2e2H0.002S2O32--2eS4O62-0.09Sn2-2eSn40.1521--2eI20.54MnO24OH--3eMnO4-2H 2O0.58HAsO22H2O-2eH3AsO42H0.58Fe2-eFe30.77HNO2H2O-2eNO3-3H0.942Cr37 H2O-6eCr2O72-14H1.332C1--2eC12溶液1.36Br-3H2O-6eBrO3-6H1.44Mn24H2O-5eMnO4-8H1.49MnO2固2H2O-3eMnO4-4H1.68①每一电位既与氧化型有关又与还原型有关。
②表中号的左边是还原剂还原性由上而下依次减弱右边是氧化剂氧化性从上到下依次增强。
③在表中相隔越远的电对电位差越大相互作用也越猛烈。
电对中氧化型的浓度越大氧化还原电位的数值也就越大但是反应生成物总是趋向于使反应逆向进行因此电对中还原型的浓度越大氧化还原的电位数值就越小。
第八章 氧化还原滴定法(3,4,5)

2. 反应应有一定的选择性
例:钛铁矿中Fe的测定 ETi 0.10V E 0.77V ( IV )/ Ti ( III ) Fe3 / Fe2
EZn 0.76V 2 / Zn ESn 0.15V 4 / Sn2
3. 过量的预氧化剂或预还原剂易除去 Sn2 HgCl2 (过量) Sn4 Hg2Cl (白丝) 2
分 析 化 学
第八章 氧化还原滴定
第三节
V
氧化还原滴定曲线
一、氧化还原滴定的滴定分数
设:c0(Ox1 ) c0( R e d2 ) ,V0
aOx1 bR e d2 aR e d1 bOx2
f bc0( Ox1 )V a c0( R e d2 )V0 bc0( Ox1 )V ac0( R e d 2 )V0
4
2、计量点
Ce4 Fe2 Ce3 Fe3
Esp ECe ( IV )/ Ce( III ) 0.059lg(cCe( IV ), sp cCe( III ), sp ) Esp EFe ( III )/ Fe( II ) 0.059lg(cFe( III ), sp cFe( II ), sp )
二、氧化还原滴定的指示剂 氧化还原指示剂是一类本身具有氧化还原性的有 机试剂,其氧化型和还原型具有不同的颜色。
0.1 cIn(Ox) cIn( Red )
0.059 10 E n
In
EIn
氧化还原指示剂、自身指示剂、专属指示剂
三、氧化还原滴定前的预处理
16
7
三、化学计量点电势的计算通式 对于对称电对的氧化还原反应通式:
aOx1 bR e d2 aR e d1 bOx2
第8章 氧化还原反应和氧化还原滴定法

例如:MnO4- 中Mn的氧化值为:x + 4×(-2)= -1 x = 7 Cr2O72-中Cr的氧化值为: 2x + 7×(-2)= -2 x = 6
注意:氧化值不一定是整数,也可能是分数或小数。元素 原子的氧化值与化合价(共价数)不同, 如CH4、CH3Cl、CHCl3、CCl4,C的共价数为4,但其氧 化值分别为-4,-2,0,+2,+4.
KClO3+HCl→KCl+Cl2+H2O KClO3+6HCl→KCl+3Cl2+3H2O
第二节 电极电势
一、原电池 二、 电极电势 三、能斯特方程 四、电极电势的应用
一、原电池
原电池在日常生活中的应用
MnO2+Zn = ZnO .Mn2O3 Pb+PbO2+2H2SO4 = 2PbSO4+2H2O
新课的引入
双电层理论
原电池中有电流的定向流动, 说明电池中两电极之间存在电 势差,那么电极电势是如何产 生呢?
Nernst提出双电层理论,较圆满地解释电极电势产生 的成因。
双电层理论
Nernst研究发现:金属和它的盐溶液之间存在金属溶解和离子沉积两 个倾向:
M(s)
溶解 沉积
Mn (aq)+ne
配平氧化还原方程式的步骤(以KMnO4和Na2C2O4在稀硫 酸中反应为例) (1)写出反应物和生成物的分子式,标出氧化数有变化 的元素,计算反应前后氧化数变化的数值;
+7
+2
KMnO4+Na2C2O4+H2SO4 → MnSO4+Na2SO4+CO2↑ +H2O+K2SO4
分析化学教学课件 第8章 氧化还原滴定法 2

Eθ Fe3/Fe2
0.0592lgγ γ((F Fe e3 2 ))α α((F Fe e2 3 ))0.0592lgc c((F Fe e3 2 ))
在一定条件下,上式中γ和α有固定值,因 而上式中前两项之和应为一常数,令其为 Eq′
E F θ e '3 /F e2 E F θ e3 /F e2 0 .0 5 9 2 lgγ γ ( (F F e e3 2 ) )α α ( (F F e e2 3 ) )
实验方法 理论计算:可逆体系
pH
14 化学计量点
12
10 酚酞
8
甲基红 6 甲基橙
4
2
滴定突跃 (pH=4.3~9.7)
0 10
20
30 40
v(NaOH/ml)
0.1000mol/L NaOH滴定0.1000mol/LHCl的滴定曲线
滴定过程中存在着两个电对:滴定剂电对和 被滴定物电对。
随着滴定剂的加入,两个电对的电极电位 不断发生变化,并随时处于动态平衡中。可由 任意一个电对计算出溶液的电位值,对应加入 的滴定剂体积绘制出滴定曲线。
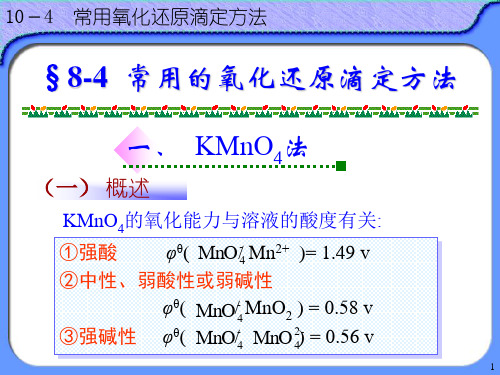
1.高锰酸钾法
KMnO4,强氧化剂
氧化能力 还原产物
与pH有关
酸性介质 MnO4- + 8 H+ + 5e = Mn2+ + 4H2O E° =1.51v
在中性或弱碱性
MnO4- + 2H2O + 3e = MnO2 + 4OH-
E° =0.59v
在碱性介质 MnO4- + e = MnO42-
E° =0.56v
c 生成络合物
氧化态形成的络合物更稳定,使电势降低,还 原性增加,反之则电势升高,氧化性增加
第八章氧化还原滴定法答案

第八章氧化还原滴定法练习题参考答案1 对Ox-Red 电对, 25℃时条件电位(Eө') 等于( D)(A) Eө+ 0059.lgnaaOxRed(B) Eө+ 0059.lgnccOxRed(C) Eө+ 0059.lgnaaγγOx OxRed Red⋅⋅(D) Eө + 0059.lgnaaγγOx RedRed Ox⋅⋅2 为降低某电对的电极电位, 可加入能与( 氧化)态形成稳定络合物的络合剂; 若要增加电极电位, 可加入能与( 还原)态形成稳定络合物的络合剂。
3. MnO4-/Mn2+电对的条件电位与pH的关系是( B)(A) Eө'= Eө -0.047pH (B) Eө'= Eө -0.094pH(C) Eө'= Eө -0.12pH (D) Eө'= Eө -0.47pH4. Fe3+与Sn2+反应的平衡常数对数值(lg K)为( B)(Eө (Fe3+/Fe2+)= 0.77 V, Eө (Sn4+/Sn2+)= 0.15 V)(A) (0.77-0.15)/0.059 (B) 2×(0.77-0.15)/0.059(C) 3×(0.77-0.15)/0.059 (D) 2×(0.15-0.77)/0.0595. 当两电对的电子转移数均为2时,为使反应完全度达到99.9%,两电对的条件电位至少大于( B)(A) 0.09V (B) 0.18V (C) 0.27V (D) 0.36V6 若两电对的电子转移数分别为1 和2, 为使反应完全度达到99.9%, 两电对的条件电位差至少应大于( C)(A) 0.09V (B) 0.18V (C) 0.27V (D) 0.36V7. 欲以氧化剂O T滴定还原剂Rx, O T+n1e=R T Ox=Rx-n2e,设n1=n2=1,要使化学计量点时,反应的完全程度达到99.9%,两个半反应的标准电位的最小差值应为( B)(A) 0.177V (B) 0.354V (C) 0.118V (D) 0.236V8. 下列现象各是什么反应?(填A,B,C,D)(1) MnO4-滴定Fe2+时, Cl-的氧化被加快_______D_________(2) MnO4-滴定C2O42-时, 速度由慢到快_______B _________(3) Ag+存在时, Mn2+氧化成MnO4-_______ A _________(4) PbSO4沉淀随H2SO4浓度增大溶解度增加_______ C _________(A) 催化反应(B) 自动催化反应(C) 副反应(D) 诱导反应9. 用Ce4+滴定Fe2+,当体系电位为0.68V时, 滴定分数为( B)[Eө' (Ce4+/Ce3+)=1.44V,Eө' (Fe3+/Fe2+)=0.68V](A) 0 (B) 50% (C) 100% (D) 200%10. 用铈量法测定铁时, 滴定至50% 时的电位是( A)[已知Eө' (Ce4+/Ce3+)= 1.44 V, Eө' (Fe3+/Fe2+)= 0.68 V](A) 0.68 V (B) 1.44 V(C) 1.06 V (D) 0.86 V11. 用K2Cr2O7滴定Fe2+, 在化学计量点时, 有关离子浓度的关系是( C)(A) [Fe3+] = [Cr3+], [Fe2+] = [Cr2O72-](B) 3[Fe3+] = [Cr3+], [Fe2+] = 6[Cr2O72-](C) [Fe3+] = 3[Cr3+], [Fe2+] = 6[Cr2O72-](D) [Fe3+] = 3[Cr3+], 6[Fe2+] = [Cr2O72-]12. 已知在1 mol/L HCl溶液中Eө' (Fe3+/Fe2+)=0.68 V, Eө' (Sn4+/Sn2+)=0.14 V。
第八章-氧化还原滴定法-习题解答

第八章氧化还原滴定法1. 答:标准电极电位E′是指在一定温度条件下(通常为25℃)半反应中各物质都处于标准状态,即离子、分子的浓度(严格讲应该是活度)都是1mol/l(或其比值为1)(如反应中有气体物质,则其分压等于1.013×105Pa,固体物质的活度为1)时相对于标准氢电极的电极电位。
电对的条件电极电位(E0f)是当半反应中氧化型和还原型的浓度都为1或浓度比为,并且溶液中其它组分的浓度都已确知时,该电对相对于标准氢电极电位(且校正了各种外界因素影响后的实际电极电位,它在条件不变时为一常数)。
由上可知,显然条件电位是考虑了外界的各种影响,进行了校正。
而标准电极电位则没有校正外界的各种外界的各种因素。
影响条件电位的外界因素有以下3个方面;(1)配位效应;(2)沉淀效应;(3)酸浓度。
2.答:一般讲,两电对的标准电位大于0.4V(K>106),这样的氧化还原反应,可以用于滴定分析。
实际上,当外界条件(例如介质浓度变化、酸度等)改变时,电对的标准电位是要改变的,因此,只要能创造一个适当的外界条件,使两电对的电极电位超过0.4V ,那么这样的氧化还原反应也能应用于滴定分析。
但是并不是平衡常数大的氧化还原反应都能应用于氧化还原滴定中。
因为有的反应K虽然很大,但反应速度太慢,亦不符合滴定分析的要求。
3. 答:影响氧化还原反应速度的主要因素有以下几个方面:1)反应物的浓度;2)温度;3)催化反应和诱导反应。
4. 答:1)高锰酸钾法.2MnO4+5H2O2+6H+==2Mn2++5O2↑+8H2O.MnO2+H2C2O4+2H+==Mn2++2CO2+2H2O2) 重铬酸甲法. Cr2O72-+14H++Fe2+===2Cr3++Fe3++7H2OCH3OH+Cr2O72-+8H+===CO2↑+2Cr3++6H2O3)碘量法 3I2+6HO-===IO3-+3H2O,2S2O32-+I2===2I-+2H2OCr2O72-+6I-+14H+===3I2+3Cr3++7H2O5. 答:应用于氧化还原滴定法的反应,必须具备以下几个主要条件:(1)反应平衡常数必须大于106,即△E>0.4V。
第八章 氧化还原反应与氧化还原滴定法

三、能斯特方程式
RT cOx ln nF cRe d
θ
当T=298.15K时: θ
0.05916 cOx lg n cRe d
应用能斯特方程式应注意下列问题:
1. 固体、纯液体或稀溶液中的溶剂不出现在能斯特方程式中。 2. 如果电极中的氧化态或还原态物质的计量数不是1时,则以计 量数作其浓度的指数。 3. 除氧化态和还原态物质外,若有H+或OH-参加电极反应,也应 出现在能斯特方程式中。 4. 电极中的氧化态或还原态物质是气体时,则用其相对分压。
Ca2+含量的计算公式:
5 cKMnO4VKMnO4 M Ca 10-3 Ca 2 % 2 100% ms
三、碘量法
一、基本原理
利用I2的氧化性或I-的还原性进行的氧化还原滴定法。
(因I2在水中溶解度小,通常将其溶解在KI溶液中。)
半电池反应
I2 + 2e I2 + I I3- + 2e
◆
返滴定法: 某些氧化性物质可用返滴定法测定。
间接滴定法: 某些非氧化还原性物质能与另一氧化剂或
还原剂定量反应,可采用间接滴定法进行测定。 如测定Ca2+含量时,首先将Ca2+沉淀为CaC2O4,过滤后,再 用稀H2SO4将CaC2O4溶解,然后用KMnO4滴定液滴定溶液 中的C2O42-,从而间接求得Ca2+含量。
基础化学 第2版
第八章
氧化还原反应与氧化还原滴定法
第八章
氧化还原反应与氧化还原滴定法 氧化还原反应
第一节
第二节
第三节
原电池与电极电势
氧化还原滴定法
学习要点
1.氧化还原反应的有关慨念及配平。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、标准电极电位与条件电极电位(1) 标准电极电位与条件电极电位( )
电对电极电位的变化可用能斯特方程来估量: 电对电极电位的变化可用能斯特方程来估量:
R T αO E=E + l n nF αR
θ
式中: R是气体常数,T 是绝对温度,F 是 式中: 是气体常数, 是绝对温度, 是气体常数 法拉第常数, 表示活度 表示活度。 法拉第常数,α表示活度。 在25C(298.15K)时,代入 、K值,该自然 代入R、 值 ( ) 对数为常用对数,并以平衡浓度代替活度, 对数为常用对数,并以平衡浓度代替活度,得:
一、氧化还原平衡
氧化还原反应是两个电对的反应,以O 表示电 对的氧化形,R 表示电对的还原形, n 表示得失电 子数目, Eθ表示标准电极电位,氧化还原反应的 半反应为: O1 + n1e O2+ n2e R1 R2 E1θ E2θ
若 E1θ > E2 θ,将发生如下反应: n2O1 + n1R2 = n1O2 + n2R1 K K 为氧化还原反应平衡常数
五、 氧化还原反应进行的方向(1) 氧化还原反应进行的方向( )
氧化还原反应方向一般可由参与反 应的两个电对的标准电极电位大小决定, 即标准电极电位较大的电对氧化形氧化 另一电对的还原形,生成他们的共轭产 物。
氧化还原反应进行的方向( ) 氧化还原反应进行的方向(2)
但是如果体系有副反应,由标准电极电 位E判断的反应方向可能改变,下面就沉 淀反应对氧化还原反应进行的方向的影 响举例说明。 例如下面的反应: 2Cu2+ + 4I- = 2CuI + I2
K ≥10
3(a+b)
0.059 E ≥ 3(a + b) × ab
θ'
化学计量点的E 四、 化学计量点的 sp值
对于如下反应 n2O1 + n1R2 = n1O2 + n2R1 可以推导出:
n1E1 + n2 E2 Esp = n1 + n2
θ'
θ'
Esp 值在氧化还原滴定法中对选择指示剂 有重要意义。
关于氧化还原平衡——问题 一 问题 关于氧化还原平衡
在氧化还原滴定中, 在氧化还原滴定中,氧化还 原平衡常数应有多大, 原平衡常数应有多大,才能满足 分析测定达到规定的误差要求? 分析测定达到规定的误差要求?
问题一 解释
n2O1 + n1R2 = n1O2 + n2R1 K 若以误差 若以误差≤0.1%为实际反应完全的标准 , 即被滴 为实际反应完全的标准, 为实际反应完全的标准 定物质R 仅剩余0.1%, 生成物 2 接近 定物质 2 仅剩余 , 生成物O 接近100%, 或 , 滴定剂O1 仅过量0.1%, 生成物R1 近似100%, 此 滴定剂 仅过量 , 生成物 近似 , 时反应的平衡常数为: 时反应的平衡常数为:
co2cR1 100×100 K = ≥ =106 co1cR2 0.1×0.1
'
lg K' ≥ 6 同理可求得 , 当 n1=n2=2时 , 对反应的要求亦是 同理可求得, 时 lgK’≥6
关于氧化还原平衡——问 题 二 问 关于氧化还原平衡
两电极电位差为多少时,可满足K值的要求? 两电极电位差为多少时,可满足 值的要求? 值的要求 根据 根据lgK’≥6的要求,从式 的要求, 的要求 lgK' = n (E1θ'-E2θ')/0.059 - 可求出在此条件时两电对的电极电位差: 可求出在此条件时两电对的电极电位差: 当n1=n2=1时,Eθ'≥0.354(V); 时 ; 当n1=n2=2时,Eθ'≥0.180(V)。 时 。 若电子转移数不等 , 如 n1=a,n2=b,则对平衡常数和 若电子转移数不等, , , 条件电极电位差值的要求为: 条件电极电位差值的要求为:
+
2CuI ↓ +I2 KSP(CuI ) [I ]
氧化还原反应进行的方向( ) 氧化还原反应进行的方向(4)
ECu2+ / Cu+ [Cu2+ ] = Eθ Cu2+ / Cu+ + 0.059lg [Cu+ ] [Cu2+ ][I ] θ 2+ = E Cu / Cu+ + 0.059lg KSP(CuI ) = Eθ Cu2+ / Cu+ + 0.059lg[ Cu2+ ][I ] 0.059lg KSP(CuI )
θ'
即:
n1 n2 co2cR1 ' K = n2 n1 co1 cR2
K' 是条件平衡常数,是以总浓度代替平衡 浓度时的平衡常数,经整理可得:
氧化还原反应平衡常数( ) 氧化还原反应平衡常数(2)
lgK' = n (E1θ'-E2θ')/0.059 (n 为两电对电子转移数的最小公倍数) 根据上式,可由电极电位的差值估计平衡常 数的大小,电极电位差值越大,K' 也越大, 反应进行越完全。 通过上式,可求化学计量点时反应进行的程 度,同时,也可求得满足分析测定误差要求 的最小K值。
0.059 [O] E=E + lg n [R]
θ
标准电极电位与条件电极电位( ) 标准电极电位与条件电极电位(2)
若溶液中物质的活度系数不为 1 ,氧化形 或还原形还有其他存在形式,则改用总浓度 总浓度代 总浓度 替平衡浓度 平衡浓度,且由活度、分布系数、总浓度之 平衡浓度 间的关系:α=γδc代入并整理得:
0.059 γ OδO 0.059 c0 E=E + lg + lg n γ RδR n cR
θ
γ—离子活度系数 δ—分布系数
标准电极电位与条件电极电位( ) 标准电极电位与条件电极电位(3)
取: 得:
0.059 γ OδO E =E + lg n γ RδR
θ' θ
从上式可以看到当CO=CR时,E=Eθ': Eθ'称为条件电极电位(亦称克式量电位),是在特定 条件下,氧化形和还原形总浓度相等、或都等于 1mol/L或它们的浓度比率为1时的实际的电对电极电位。 在应用时,应根据实际情况选择使用Eθ ' 。条件电极电 位由实验测得。
第八章 氧化还原滴定法
授课内容
8.1氧化还原滴定法概述 氧化还原滴定法概述 1、氧化还原平衡 、 2、标准电极电位与条件电极电位 、 3、化学反应平衡常数 、 4、化学计量点的 sp值化学计量点的 sp值 、化学计量点的E 值化学计量点的E 5、氧化还原反应进行的方向 、 6、氧化还原速率与催化作用 、 8.2 氧化还原滴定指示剂 氧化还原滴定指示剂 1、自身指示剂 、 2、氧化还原指示剂 、 3、专属指示剂 、
重点与难点
1、氧化还原滴定法的理论基础 、 2、氧化还原滴定法指示剂指示终点的原理 、 3、氧化还原滴定各方法的特点及应用 、 4、氧化还原滴定法结果计算 、
8.1 氧化还原滴定法概述
定义: 定义: 氧化还原滴定法是指以氧化还原反应 作为滴定反应测定物质含量的滴定分析方法。 应用:使用氧化剂或还原剂标准溶液,直接 应用 或间接测定氧化性或还原性物质及一些非氧化性 还原性物质。 方法: 根据使用的氧化性标准溶液名称分 方法 类,氧化还原滴定法有高锰酸钾法、重铬酸钾法、 碘法、铈量法、溴酸盐法等。 以下就通过详细的讨论来了解氧化还原滴定 法的原理、方法及其应用。
当[Cu2+]=[I-]=1mol/L时,可求得电对条件 电极电位:
ECu2+ / Cu+ = 0.1568 0.059lg1.1×1012 = 0.86V > Eθ I2 / I = 0.545V
氧化还原反应进行的方向( ) 氧化还反应进行的方向(5)
此时将发生Cu+氧化I-的反应,即由于有 生成沉淀的副反应,改变了反应进行的方 向。 实际分析工作中常利用此反应进行铜盐或 铜合金中铜含量的测定。
授课内容
8.3 氧化还原滴定曲线 ——Ce(SO4)2滴定 FeSO4 8.4 氧化还原滴定前的预处理 1、预处理的意义 、 2、预处理的方法 、 8.5 氧化还原滴定法的应用 1、高锰酸钾法 、 2、重铬酸钾法 、 3、碘法和碘量法 、 4、其他氧化还原滴定法 、 8.6 氧化还原滴定法结果计算
E
θ
Cu
2+
/ Cu
+
= 0.1568 , E V
θ
I2 / I
= 0.545 V
氧化还原反应进行的方向( ) 氧化还原反应进行的方向(3)
以标准电极电位判断,似乎应是I- 把Cu +氧化,反应向左进行,但实际上由于同 时存在形成CuI沉淀的反应:
2Cu + 2I
+
2CuI ↓
KSP(CuI ) =1.1×1012 合并两 式得 2Cu2+ + 4I [Cu ] =
0.059 c0 E=E + lg n cR
θ'
三、氧化还原反应平衡常数 (1) )
氧化还原反应平衡常数大小反映反应完全程 度。 当氧化还原反应 氧化还原反应反应平衡时,有:E1=E2。 氧化还原反应
0.059 cO1 0.059 cO2 θ' E1 + lg = E2 + lg n1 cR1 n2 cR1
