滚动小专题(二)溶解度曲线及其应用
滚动小专题(二)溶解度曲线及其应用

滚动小专题(二)溶解度曲线及其应用一、选择题1.(2016·德州)甲、乙两种固体物质的溶解度曲线如图所示。
下列叙述中正确的是(B)A.甲物质的溶解度大于乙物质的溶解度B.t1℃时,甲、乙两种物质饱和溶液的溶质质量分数一定相等C.t2℃时,将30克甲物质放入70克水中,所得饱和溶液的质量为100克D.t2℃时甲、乙两物质的饱和溶液降温到t1℃,析出晶体质量甲>乙2.(2016·连云港)甲、乙两种物质的溶解度曲线如右图所示。
下列说法正确的是(D)A.a1℃时甲的饱和溶液升温至a2℃时仍是饱和溶液B.乙的溶解度随温度的升高而增大C.相同温度时,甲的溶解度一定大于乙的溶解度D.分别将甲、乙的饱和溶液从a2℃将至a1℃时,所得溶液中溶质的质量分数相等3.(2016·成都)甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是(D)A.甲的溶解度大于乙B.t1℃时,A点表示乙的饱和溶液C.甲溶液从t2℃降温到t1℃,一定有晶体析出D.t2℃时,将甲和乙各15 g分别加入100 g水中,均能完全溶解4.(2016·重庆B卷)将质量均为30 g的甲、乙两种固体分别加入到50 g水中,充分搅拌后,剩余固体的质量与温度的关系如图所示,下列说法正确的是(D)A.甲的溶解度随温度升高而增大B.t1℃时,甲、乙的溶解度均为20 gC.温度由t2℃降低到t1℃时,甲溶液析出5 g固体D.A,B,C三点中溶质的质量分数由大到小的顺序是:C>A>B5.(2016·济宁)如图是氯化钠、氯化铵和碳酸氢钠三种物质的溶解度曲线。
分析曲线得到以下说法中,正确的是(B)①氯化钠和氯化铵是易溶物质,碳酸氢钠是可溶物质②在20 ℃时,三种物质饱和溶液的溶质质量分数为NH4Cl>NaCl>NaHCO3③在30 ℃时,氯化钠和氯化铵固体各20 g分别溶于50 g水,所得溶液都是饱和溶液④利用结晶法从氯化钠,氯化铵混合物中分离出氯化铵的最佳温度在10 ℃以下A.①②③B.①②④C.②③④D.①③④6.(2016·泰安)如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是(D)A.t1℃时,等质量的甲、丙溶液中所含溶质的质量分数为丙>甲B.t2℃时,20 g丙溶解于50 g水中能形成70 g溶液C.分别将三种物质的饱和溶液从t3℃降温至t2℃时,所得溶液溶质质量分数的大小关系为乙>甲=丙D.若要将组成在N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法7.(2016·德阳)海水晒盐提取食盐晶体后留下的母液叫卤水,卤水中除含NaCl外,还含有MgCl2、MgSO4等物质。
2020年中考化学总复习专题训练: 溶解度曲线及应用

溶解度曲线及其应用1.硝酸钾和氯化钾的溶解度曲线如图所示,下列叙述正确的是( )A.硝酸钾的溶解度一定大于氯化钾的溶解度B.降低温度可使接近饱和的硝酸钾溶液变饱和C.t℃时,硝酸钾和氯化钾两种溶液的溶质质量分数一定相等D.60℃时,100 g水中加入90 g硝酸钾,充分搅拌,可得到硝酸钾的饱和溶液【解析】选B。
未指明温度,无法比较两种物质溶解度的大小,A错误;硝酸钾的溶解度随温度的降低而减小,降低温度可使接近饱和的硝酸钾溶液变饱和,B正确;未指明溶液是否达到饱和,无法判断t℃时硝酸钾和氯化钾两种溶液的溶质质量分数是否相等,C错误;60℃时,硝酸钾的溶解度大于90 g,此温度下将90 g 硝酸钾放入100 g水中,得到硝酸钾的不饱和溶液,D错误。
2.如图表示的是甲、乙两种固体物质的溶解度曲线,下列叙述一定正确的是( )A.甲的溶解度大于乙的溶解度B.10℃时甲、乙两溶液的质量分数相等C.30℃时甲的饱和溶液的质量分数为60%D.降低温度可使接近饱和的甲溶液变成饱和溶液【解析】选D。
没有指明温度,无法判断甲、乙两种物质的溶解度大小,A错误;没有指明溶液是否饱和,无法判断10℃时甲、乙两溶液的质量分数是否相等,B错误;30℃时甲的溶解度为60 g,其饱和溶液的溶质质量分数为×100%=37.5%,C错误;甲的溶解度随温度的降低而减小,降低温度可使接近饱和的甲溶液变成饱和溶液,D正确。
3.如图是A、B、C三种物质的溶解度曲线。
下列叙述中错误的是( )A.t1℃时,三种物质的溶解度大小顺序为A<B<CB.t2℃时,A、B两种物质的溶解度相等C.t3℃时B的饱和溶液降温到t1℃,变成不饱和溶液D.若要将组成在N点的A溶液转变为M点的A溶液,可以采取恒温蒸发溶剂的方法【解析】选C。
从溶解度曲线上可以看出:t1℃时,三种物质的溶解度大小顺序为A<B<C;t2℃时,A、B两种物质的溶解度曲线相交,说明该温度下,两物质的溶解度相等,故A、B都正确;由于B的溶解度随温度的升高而增加,在降温时,饱和溶液中会有晶体析出,是该温度下的饱和溶液,故C错误;N点是A溶液在t3℃时的不饱和溶液,恒温蒸发溶剂可以使其变成饱和溶液,故D正确。
溶解度曲线及其应用

.
图像法: 横坐标表示:温度(℃) 纵坐标表示:溶解度(g)
表述:60℃时,硝酸钾的溶解度为110g
80 70
.
60 50
. 40 . 30 . . 20
10
0 10 20 30 40 50 60
70 80 90 100
溶解度曲线应用——1.根据温度查出某物质的溶解度
硝酸钾在20℃时的溶解度是____3_1_.6_g____ 硝酸钾在60℃时的溶解度是____1_1_0_g____ 氯化钠在20℃时的溶解度是____3_6_g_____ 氯化钠在60℃时的溶解度是____3_7_.3_g____ 氢氧化钙在20℃时的溶解度是__0_.1_8_g____ 氢氧化钙在_6_0_℃__ 时的溶解度是0.12g
溶解度曲线及应用
知识回顾:
水
1.固体溶解度:
在一定温度下 ,某固态物质在 100g溶剂 里到达 饱和 状态时所溶解
的 质量 。
固体溶解度四要素:
a.条件: 在一定温度下
b.溶剂的量:100g水 c.溶液的状态:饱和状态
d.单位: g
提笔小练:
判断正误:
1.l00g水中最多溶解38g氯化钠,所以氯化钠在水中的溶解度是
有固体剩余
温度/℃
C点
溶液不饱和
溶解度曲线应用——3.溶解度曲线上点的含义及转化
溶解度/g
线下方的点转化为线上方或线上的点: 溶液状态变化: 由不饱和状态变为饱和状态 方法:①向左平移:降低温度
②向上平移:加溶质或者蒸发溶剂
温度/℃
不饱和 溶液
增加溶质 蒸发溶剂
降低温度
饱和 溶液
溶解度曲线应用——3.溶解度曲线上点的含义及转化
专题复习:溶解度曲线的含义及其应用

D.t ℃时把36 g氯化钠溶解在100 g水中恰好饱和,所以t
℃时氯化钠的溶解度是36 g
经典例题2. 甲和乙两种物质的溶解度曲线如 右图表1所示,回答下列各题。
(1)甲和乙的溶解度都随温度的升高而______.
( 2 )两种物质中,______的溶解度受温度的影响大,溶解度最大的物质____ 。
⑵若将M点处C的不饱和溶液变成饱和溶 液,可以选择的方法是 ___(填序 号)。
A.降低温度 溶剂
B.增加溶质 C.蒸发
⑶t2℃时,将等质量的A、B、C的饱和溶
液都升温到t3℃,溶液中溶质的质量分数
图表4
的关系是___。
溶剂质量的大小关系是________(忽略 水的挥发)
(1)t1℃时,A物质的溶解度 ____ B物质的溶解度(填 “>”“<”或“=”)
(2)t2℃时,B物质的饱和溶 液中溶质与溶液的质量比为
____
(3)将A物质的某种溶液从 t3℃降至t1℃,溶液 __(填“一 定会”“可能会”或“一定不会”) 有晶体析出.
图表三
3、(2016重庆a卷)图表4为A、B、C 三种固体物质的溶解度曲线图(A、B、 C析出晶体时均不含结晶水),根据曲线 图回答下列问题。
A、t2 OC时,三种物质的溶解 度关系:甲>乙>丙
B、随着温度的升高,甲乙丙 三种物质的溶解度都增大
C、甲物质的饱和溶液从t1 OC 升高到t3 OC时,溶质质量分 数增大
D、t2 OC时,乙物质的饱和溶 液溶质的质量分数为20%
图表二
2.(2013•广安)A、B两种固 体物质的溶解度曲线如图表3 所示,请根据图回答下列问题:
例1 下列关于氯化钠溶解度的说法正确的是
2023中考化学专题训练:溶解度曲线及其应用

甲 > (选填“>”“=”或“<”)丙。
1
2
3
4
5
6
7
8
9 10 11 12 13 14 15
专题训练一 溶解度曲线及其应用
(3)t2 ℃时分别把15 g甲、乙、丙固体加入50 g水中,能形成饱和溶液的
1
2
3
4
5
6
7
8
9 10 11 12 13 14 15
专题训练一 溶解度曲线及其应用
2.(2022•四川内江)我国航天员王亚平在太空演示“冰雪”实验时用到 了过饱和醋酸钠溶液。下图是醋酸钠的溶解度曲线图,下列说法正确的 是( B ) A.常温下,醋酸钠属于微溶物质 B.图中P点所表示的醋酸钠溶液是 不饱和的 C.40 ℃时,饱和醋酸钠溶液的溶质 质量分数是65.6% D.将A点的饱和溶液降温至20 ℃, 溶质质量分数增大
7
8
9 10 11 12 13 14 15
专题训练一 溶解度曲线及其应用
12.(2022•四川达州)t1 ℃时,将相同质量的KNO3和KCl分别加入盛有100 g
水的甲、乙烧杯中,充分搅拌后现象如图Ⅰ所示,图Ⅱ为两物质的溶解度曲D 线。以下说法正确的是D ( ) A.甲烧杯中的溶质为KNO3 B.将温度升高到t2 ℃时,乙烧杯中 仍然有固体剩余
1
2
3
4
5
6
7
8
9 10 11 12 13 14 15
专题训练一 溶解度曲线及其应用
4.(2022•江苏宿迁)“侯氏制碱法”创立了更为先进的“制碱”工艺,主要反应是 NaCl+NH4HCO3 NaHCO3↓+NH4Cl。如图是三种物质的溶解度曲线图,下列
溶解度与溶解度曲线

溶解度与溶解度曲线溶解度是指在特定条件下,单位溶剂中可以溶解的最大溶质的量。
溶解度通常用溶质在单位溶剂中的摩尔或质量浓度来表示,单位常用mol/L或g/L。
溶解度受多个因素的影响,包括温度、压力和溶质与溶剂之间的相互作用力等。
其中,温度是溶解度影响最为显著的因素之一。
随着温度的升高,大部分固体溶质在溶剂中的溶解度会增加,而气体溶质的溶解度则会减小。
这是由于高温会增加溶质与溶剂之间的分子热运动,从而有利于克服溶剂与溶质之间的相互作用力,使溶质更容易溶解。
相反,低温下,热运动减弱,溶剂与溶质分子之间的相互作用力增强,导致溶质溶解度减小。
除了温度,压力也会对溶解度产生影响。
对于气体溶质,在一定温度下,随着压力的增加,气体溶质的溶解度也会增加。
这是由于增加压力会使气体溶质分子更加密集,更容易与溶剂分子发生相互作用,从而增加溶解度。
而固体或液体溶质的溶解度对压力影响较小,通常可以忽略不计。
溶剂选择也会对溶解度产生重要影响。
不同的溶剂有着不同的溶解度能力,这主要与溶剂与溶质之间的化学性质和极性相关。
相似的化学性质或极性的溶质和溶剂更容易彼此相互作用,从而溶解度较高。
此外,溶剂的溶解度也会受到温度和压力的影响,但影响程度可能与溶质的影响程度不完全相同。
溶解度曲线是描述溶解度随温度变化的曲线图。
根据溶解度与温度的关系,可以得到溶解度曲线的形状。
溶解度曲线通常可以分为两种类型:显热型和隐热型。
显热型溶解度曲线表示随着温度的升高,溶解度逐渐增加,形成一个正斜率的曲线。
这是由于溶解过程是放热的,温度升高会增加溶质与溶剂分子之间的热运动,从而有利于溶质溶解。
隐热型溶解度曲线表示随着温度的升高,溶解度逐渐减小,形成一个负斜率的曲线。
这是由于溶解过程是吸热的,温度升高会增加溶质与溶剂分子之间的热运动,导致溶质分子逃逸出溶液,从而减小溶解度。
根据溶解度曲线的形状,我们可以推断溶解过程中是否有热效应。
根据溶解度曲线的斜率,我们还可以判断溶解度对温度的敏感程度。
人教版九年级下册化学第九单元滚动小专题(二)溶解度和溶质的质量分数(习题)(带答案)
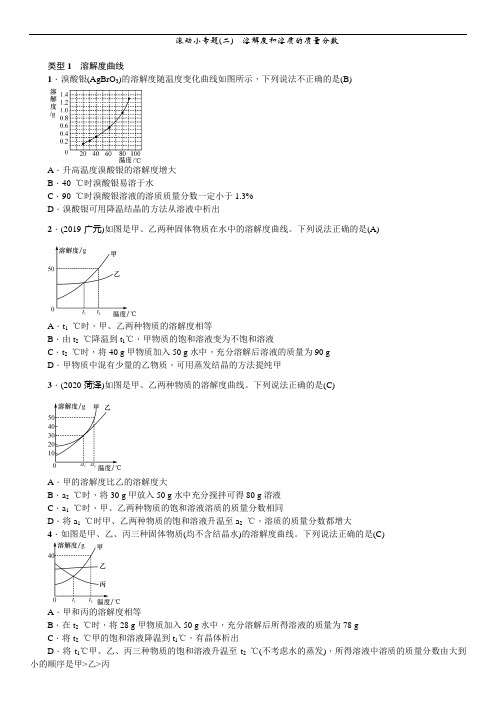
滚动小专题(二)溶解度和溶质的质量分数类型1溶解度曲线1.溴酸银(AgBrO3)的溶解度随温度变化曲线如图所示,下列说法不正确的是(B)A.升高温度溴酸银的溶解度增大B.40 ℃时溴酸银易溶于水C.90 ℃时溴酸银溶液的溶质质量分数一定小于1.3%D.溴酸银可用降温结晶的方法从溶液中析出2.(2019·广元)如图是甲、乙两种固体物质在水中的溶解度曲线。
下列说法正确的是(A)A.t1℃时,甲、乙两种物质的溶解度相等B.由t2℃降温到t1℃,甲物质的饱和溶液变为不饱和溶液C.t2℃时,将40 g甲物质加入50 g水中,充分溶解后溶液的质量为90 gD.甲物质中混有少量的乙物质,可用蒸发结晶的方法提纯甲3.(2020·菏泽)如图是甲、乙两种物质的溶解度曲线。
下列说法正确的是(C)A.甲的溶解度比乙的溶解度大B.a2℃时,将30 g甲放入50 g水中充分搅拌可得80 g溶液C.a1℃时,甲、乙两种物质的饱和溶液溶质的质量分数相同D.将a1℃时甲、乙两种物质的饱和溶液升温至a2℃,溶质的质量分数都增大4.如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。
下列说法正确的是(C)A.甲和丙的溶解度相等B.在t2℃时,将28 g甲物质加入50 g水中,充分溶解后所得溶液的质量为78 gC.将t2℃甲的饱和溶液降温到t1℃,有晶体析出D.将t1℃甲、乙、丙三种物质的饱和溶液升温至t2℃(不考虑水的蒸发),所得溶液中溶质的质量分数由大到小的顺序是甲>乙>丙5.两个烧杯中分别盛装X、Y的饱和溶液,两支试管中分别装有NaOH和NH4NO3固体,向两支试管中分别滴加适量水,现象如图一所示,结合图二判断下列说法正确的是(D)A.Y的溶解度曲线为b曲线B.降温可使X的饱和溶液变浑浊C.X的饱和溶液从t2℃降温到t1℃,溶质的质量分数变大D.t3℃时,X、Y的饱和溶液质量相等,则溶剂质量X>Y6.如图是甲、乙两种物质的溶解度曲线。
【火线100天】2015中考化学 滚动小专题(三)溶解度曲线及其应用

滚动小专题(三) 溶解度曲线及其应用一、溶解度曲线的意义1.溶解度曲线上的每个点表示的是某温度下某种物质的溶解度,即曲线上的任意一点都对应有相应的温度和溶解度。
2.溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。
曲线的坡度越大,说明溶解度受温度影响越大;反之,说明受温度影响较小。
3.两条溶解度曲线的交点表示该点所示的温度下两物质的溶解度相同,此时两种物质饱和溶液的溶质质量分数也相同。
4.在溶解度曲线上的每一个点都表示溶质在某温度下的溶解度,此时的溶液必然是恰好饱和的溶液;在溶解度曲线下方的点,则表示溶液是不饱和溶液;在溶解度曲线上方的点,则表示未溶解的溶质与饱和溶液共存的混合物或过饱和溶液。
二、溶解度曲线的应用1.溶解度曲线上的点有三个方面的作用:(1)根据已知温度查出有关物质的溶解度;(2)根据物质的溶解度查出对应的温度;(3)比较相同温度下不同物质溶解度的大小或者饱和溶液中溶质的质量分数的大小。
2.溶解度曲线也有三个方面的应用:(1)根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况;(2)根据溶解度曲线,比较在一定温度范围内的物质的溶解度大小;(3)根据溶解度曲线,选择分离某些可溶性混合物的方法。
3.如果要使不饱和溶液(曲线下方的一点)变成对应温度下的饱和溶液,方法有两种:第一种方法是向该溶液中添加溶质使之到达曲线上;第二种方法是蒸发一定量的溶剂。
类型1 溶解度曲线的意义例1 (2014·潍坊)甲、乙、丙三种固体物质的溶解度曲线如图所示。
下列说法正确的是( )A.把a1℃时甲、乙的饱和溶液升温到a2℃仍是饱和溶液B.a2℃时,丙的溶液的质量分数大于乙的溶液的质量分数C.三种物质的溶解度都随温度的升高而增大D.a3℃时,三种物质的溶解度大小关系:甲>丙>乙思路点拨:根据甲、乙、丙三种固体物质的溶解度曲线可知,a1℃时甲、乙的饱和溶液升温到a2℃都为不饱和溶液;a2℃时,乙和丙的溶液是否达到饱和都无法确定,所以无法比较其溶液中溶质质量分数的大小;丙物质的溶解度随温度的升高而减小。
人教版九年级下册化学 第九单元 溶液 滚动小专题(二) 溶解度及溶解度曲线

【解析】 t1℃时,相同质量的甲与丙两种物质的饱和溶液中溶质 质量相等,故A错误;乙溶解度受温度变化影响小,降 低温度时甲物质的溶解度变化较大,则乙中混有少量甲 时,应采用蒸发结晶的方法提纯乙,故B项错误;20 ℃ 时,溶解度大于10g的物质为易溶物质,根据图像,0 ℃ 时甲物质的溶解度为10 g,且随温度的升高,甲物质的 溶解度不断增大,所以甲属于易溶物质,故C正确; t2℃时,甲的溶解度为50 g,则在50 g水中最多只能溶解 25 g甲,形成75 g溶液,故D项错误。
减小,会析出晶体,溶质质量分数会减小,但t2℃时丙的溶解度 大于t1℃时甲的溶解度,故两种溶液中的溶质的质量分数丙大于 甲,B错误;甲的溶解度随温度的升高而增大,将t2℃时甲的饱和 溶液变为t3℃时甲的饱和溶液,可以采用蒸发水的方法,C正确; t3℃时三种物质的溶解度关系为甲>乙>丙,将t3℃时三种物质的 饱和溶液恒温蒸发等量水后,析出溶质的质量甲>乙>丙,D正确。
典例1 (2015•河北)甲、乙、丙三种固体物质的溶解度曲线如图所示,下 列叙述错误的是( B )
A.t1℃时,将等质量的甲、乙分别配成 饱和溶液,所得溶液质量:甲>乙
B.将t1℃时甲、丙的饱和溶液升温到t2℃, 两种溶液中溶质的质量分数相等
C.将t2℃时甲的饱和溶液变为t3℃时甲的饱和溶液,可以采用蒸 发水的方法
【解析】 比较②③数据可知,②中所得溶液是不饱和溶液,故A
错误;20 ℃ 时10 g 水最多溶解3.6 g NaCl,故B错误;
由表中数据可知,③④溶液都是饱和溶液,在相同温度
下,同种物质的饱和溶液的溶质质量分数相等,故C正
确;①所得溶液的溶质质量分数为
2g 100% 16.7% 2g+10g
2019年中考化学 第一单元 身边的化学物质 滚动小专题(二)溶解度曲线及其应用复习

2019年中考化学第一单元身边的化学物质滚动小专题(二)溶解度曲线及其应用复习一、溶解度曲线的意义1.溶解度曲线上的每个点表示的是某温度下某种物质的溶解度,即曲线上的任意一点都对应有相应的温度和溶解度。
2.溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。
曲线的坡度越大,说明溶解度受温度影响越大;反之,说明受温度影响较小。
3.两条溶解度曲线的交点表示该点所示的温度下两物质的溶解度相同,此时两种物质饱和溶液的溶质质量分数也相同。
4.在溶解度曲线上的每一个点都表示溶质在某温度下的溶解度,此时的溶液必然是恰好饱和的溶液;在溶解度曲线下方的点,则表示溶液是不饱和溶液;在溶解度曲线上方的点,则表示未溶解的溶质与饱和溶液共存的混合物或过饱和溶液。
二、溶解度曲线的应用1.溶解度曲线上的点有三个方面的作用:(1)根据已知温度查出有关物质的溶解度;(2)根据物质的溶解度查出对应的温度;(3)比较相同温度下不同物质溶解度的大小或者饱和溶液中溶质的质量分数的大小。
2.溶解度曲线也有三个方面的应用:(1)根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况;(2)根据溶解度曲线,比较在一定温度范围内的物质的溶解度大小;(3)根据溶解度曲线,选择分离某些可溶性混合物的方法。
3.如果要使不饱和溶液(曲线下方的一点)变成对应温度下的饱和溶液,方法有两种:第一种方法是向该溶液中添加溶质使之到达曲线上;第二种方法是蒸发一定量的溶剂。
类型1溶解度曲线的意义甲、乙、丙三种物质的溶解度曲线如图所示,请回答:(1)图中M点表示的意义:________________________________________________________________________________________________________________________________________________。
溶解度曲线学习知识点
溶解度曲线知识点一、正确理解溶解度曲线的涵义溶解度曲线就是在直角坐标系中,用来描绘物质的溶解度随温度变化而变化的曲线。
依据溶解度曲线可进行溶液的配制,混淆物的分别与提纯,以及进行物质结晶或溶解的计算。
最近几年来,以溶解度曲线为切入点的题目已成为中考、比赛命题的一个热门。
下边,我们从溶解度曲线的特色下手,对溶解度作进一步的理解。
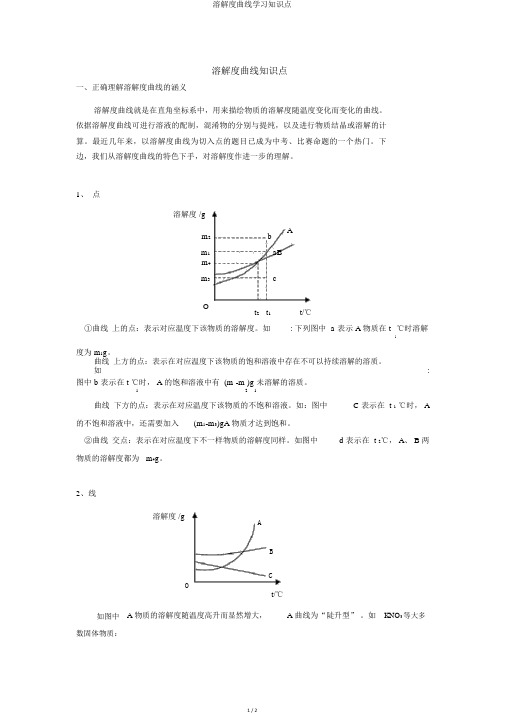
1、点溶解度 /gAm2 bm1 aBm4m3 cOt2 t1 t/℃①曲线上的点:表示对应温度下该物质的溶解度。
如: 下列图中 a 表示 A 物质在 t ℃时溶解1度为 m1g。
曲线上方的点:表示在对应温度下该物质的饱和溶液中存在不可以持续溶解的溶质。
如: 图中 b 表示在 t ℃时, A 的饱和溶液中有 (m -m )g 未溶解的溶质。
1 2 1曲线下方的点:表示在对应温度下该物质的不饱和溶液。
如:图中 C 表示在 t 1℃时, A 的不饱和溶液中,还需要加入(m1-m3)gA 物质才达到饱和。
②曲线交点:表示在对应温度下不一样物质的溶解度同样。
如图中 d 表示在 t 2℃, A、 B 两物质的溶解度都为 m4g。
2、线溶解度 /gABCOt/℃如图中 A 物质的溶解度随温度高升而显然增大, A 曲线为“陡升型”。
如KNO3等大多数固体物质:图中 B 物质的溶解度随温度变化不大, B 曲线为“缓升型” ,如NaCl 等少量固体物质。
图中 C 物质的溶解度随温度高升而减小, C 曲线为“降落型” ,如气体及 Ca(OH)2等很少量固体物质。
二、掌握溶解度曲线的应用1.溶解度曲线上的每一点,代表着某温度下某物质的溶解度,所以利用溶解度曲线能够查出某物质在不一样温度下的溶解度,并依据物质的溶解度判断其溶解性。
2.能够比较在同一温度下不一样物质溶解度的相对大小。
3.依据溶解度曲线的形状走向,能够看出某物质的溶解度随温度的变化状况。
并依据此状况能够确立从饱和溶液中析出晶体或进行混淆物分别提纯的方法。
