2013届高考化学第一轮配套复习课件01
合集下载
2013届高考化学第一轮复习调研课件(人教版选修5) 第5课时 高分子化合物 有机合成与推断

④性质:分子结构中含碳碳双键,易发生氧化反应,
38 ________,天然橡胶硫化后得硫化橡胶, 天然橡胶易○
硫化橡胶属于体型高分子化合物
考点一
有机高分子化合物
1.有机高分子化合物的特点 (1)相对分子质量只是一个平均值,一般高达 104~ 106。 (2)由若干个低分子化合物聚合而成,由各种相对分 子质量不等的同系物组成的混合物。 (3)每个分子都是由若干个重复结构单元组成。
③凡链节主链上只有碳原子,并存在碳碳双键结构 的高聚物,其规律是“凡双键,四个碳;无双键,两个 碳”划线断开,然后将单键变双键,双键变单键即得对 应单体。
(2)缩聚产物单体的判断方法
解析 根据丁腈橡胶结构特征及其链节中含有一 个碳碳双键知,它的单体是CH2===CH—CH===CH2和 CH2===CH—CN。
答案
C
互动训练2
DAP是电表和仪表部件中常用的一种
高分子化合物,其结构简式为: 则合成它的单体可能有:①邻苯二甲酸 ②丙烯醇 (CH2===CH—CH2—OH) 甲酸甲酯 A.①② C.①③ B.④⑤ D.③④ ③丙烯 ④乙烯 ⑤邻苯二
解析 解答此类题目,首先要根据高聚物的结 构简式判断高聚物是加聚产物还是缩聚产物,然后根据 推断单体的方法作出判断。该高聚物的形成过程属于加 聚反应,直接合成该高聚物的物质为
一、有机高分子化合物 1.高分子化合物的组成 (1)单体:能够进行聚合反应形成高分子化合物的低 分子化合物。 (2)链节:高分子化合物中化学组成相同、可重复的 最小单元。
(3)聚合度:高分子链中含有链节的数目。 催化剂 如 nCH2=CH2 ――→ CH2—CH2 单 体 是 ①_______ , 链 节 是 ②_______ 聚 合 度 是 ③_______。 2.合成高分子化合物的基本反应
2013年高考化学一轮复习——非金属及其化合物

导管口有气体生成, 酸性KMnO4溶液的 颜色不褪尽(或不褪 色,或不褪成无色)
C中加入的试剂是 足量酸性 KMnO4 溶液 ,作用是 除去SO2,并检验SO2是否除尽 。 D中加入的试剂是 澄清石灰水 ,作用是 检验 CO2 。 (4)实验时,C中应观察到的现象是 导管口有气泡冒出;溶液紫色逐渐变浅。 。
△
CaCl2+2NH3↑+2H2O
NH3· 2O+CaO=Ca(OH)2+NH3↑ H CaCO3+2HCl=CaCl2+CO2↑+H2O
确定实验方案
仪器、药品
CaCO3、HCl
饱和NaCl
浓氨水、生石灰
CaCO3、HCl
饱和碳酸氢钠
饱和NaCl
浓氨水、生石灰
CaCl2或P2O5
2-+2NH + === 2NH ↑+H SiO ↓ SiO3__________________________________________________。 4 3 2 3 _________
[即时应用]2.(2012· 安阳高三综合检测)某学习小组设计以下四个实 验探究氯水的成分,请根据下表回答问题。
(4)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3
溶液中的气体只有一种。为了确保实验结论的可靠性, 证明 最终通入AgNO3溶液的气体只有一种, 乙同学提出在某两个 装置之间再加一个装置。你认为装置应加在 F 与 G 之间
(填装置字母序号),装置中应放 淀粉KI溶液或湿润的淀粉KI试纸(或湿润的有色布条)
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处 滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是先加热V2O5后缓缓滴入浓硫酸 。 (4)Ⅳ处观察到的现象是 有无色晶体(或固体)生成 。 (5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会 减小 (填“增 大”“不变”或“减小”)。
C中加入的试剂是 足量酸性 KMnO4 溶液 ,作用是 除去SO2,并检验SO2是否除尽 。 D中加入的试剂是 澄清石灰水 ,作用是 检验 CO2 。 (4)实验时,C中应观察到的现象是 导管口有气泡冒出;溶液紫色逐渐变浅。 。
△
CaCl2+2NH3↑+2H2O
NH3· 2O+CaO=Ca(OH)2+NH3↑ H CaCO3+2HCl=CaCl2+CO2↑+H2O
确定实验方案
仪器、药品
CaCO3、HCl
饱和NaCl
浓氨水、生石灰
CaCO3、HCl
饱和碳酸氢钠
饱和NaCl
浓氨水、生石灰
CaCl2或P2O5
2-+2NH + === 2NH ↑+H SiO ↓ SiO3__________________________________________________。 4 3 2 3 _________
[即时应用]2.(2012· 安阳高三综合检测)某学习小组设计以下四个实 验探究氯水的成分,请根据下表回答问题。
(4)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3
溶液中的气体只有一种。为了确保实验结论的可靠性, 证明 最终通入AgNO3溶液的气体只有一种, 乙同学提出在某两个 装置之间再加一个装置。你认为装置应加在 F 与 G 之间
(填装置字母序号),装置中应放 淀粉KI溶液或湿润的淀粉KI试纸(或湿润的有色布条)
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处 滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是先加热V2O5后缓缓滴入浓硫酸 。 (4)Ⅳ处观察到的现象是 有无色晶体(或固体)生成 。 (5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会 减小 (填“增 大”“不变”或“减小”)。
【高考调研】高考化学一轮复习 第二章第1课时 物质的分类课件 新人教版

①甲同学没有选用饱和氯化铁溶液,而用稀氯化铁 溶液滴入沸水中,结果没有观察到________,其原因是 _________________________________________________ _________________________________________________ ______________________________________________。
【提示】 一种元素组成的物质可能是单质,但是 一种元素不一定只能形成一种单质。如O2和O3,金刚石 (C)、石墨、C60等,它们之间具有同素异形体关系,不 是同一种分子,应属于混和物。所以该说法不正确。
①交叉 ②树状 ③纯净物 ④金属 ⑤非金属 ⑥ 氧化物 ⑦酸 ⑧碱 ⑨盐 ⑩置换反应 ⑪分解反应 ⑫化合反应 ⑬复分解反应 ⑭离子参加或生成 ⑮电子 转移 ⑯可逆 ⑰不可逆 ⑱放热
(5)戊同学将Fe(OH)3胶体装入U形管内,用石墨作 电极,接通电流,通电一段时间后发现阴极附近的颜色 ________,这表明________,这种现象叫________。
解析 (1)制备Fe(OH)3胶体的方法是把饱和FeCl3 溶液逐滴加在沸水中继续煮沸至液体呈红褐色,立即停
止加热;离子方程式为Fe3++3H2O
①根据分散质粒子的大小来区分 分散质粒子大小在1nm~100nm间的分散系为胶 体,小于1nm的分散系为溶液。 ②根据有无丁达尔效应来区分
2下列几个方面不能用来区分胶体和溶液: ①是否均一、透明。因为胶体和溶液通常都是均 一、透明的分散系。 ②是否通过滤纸。因为胶体和溶液的分散质粒子均 能通过滤纸。
①先出现红褐色沉淀,原因是__________________ _______________________________________________。
2013版高考化学一轮复习课件第1单元-常用化学计量--山东科技版版

本资料由书利华教育网(又名数理 化网)为您整理 14
第一单元 │ 使用建议
1.钠及其化合物的教学要注意引导学生掌握:钠与水反 应的现象与化学方程式,过氧化钠的性质与用途等知识。并且 通过本讲内容的学习,使学生初步了解研究金属元素的思维顺 序:单质→氧化物→对应的碱→对应的盐。 2.氯及其化合物容易结合其他元素化合物的知识,联系 一些重大的社会热点如卫生保健、食品安全、环境保护等进行 命题。因此引导学生掌握:氯气的性质、制法及检验,全面了 解氯气的有关知识。
8
第一单元 │ 知识系统总览
本资料由书利华教育网(又名数理 化网)为您整理
9
第一单元 │ 高考纵览 高考纵览 2009年 2010年 2011年 考点 钠及 课标全国27;海 南3(选择);天 其 北京11(选择); 津2(选择);浙 福建9(选择); 化 全国7(选择)、 山东13(选 江12(选择);上 合 12(选择);重 择);四川 海10(选择);全 物 庆7(选择)、 国Ⅰ11(选择); 26(解答) 碱 9(选择) 全国Ⅱ8(选择); 金 四川29 属
13
第一单元 │ 使用建议 使用建议
► 教学建议 本单元的内容分为两部分:一是以钠、氯为主体的元素化 合物的教学,二是以物质的量为主体的理论教学。第一部分主 要掌握元素化合物的性质、制法等知识,在高考试题中主要以 实验、计算或综合形式呈现;第二部分比较抽象,概念性和综 合性强,易混淆知识点较多,物质的量、气体摩尔体积、物质 的量浓度等是高考常考的知识点,通常以选择题、填空题或计 算的形式出现,是历年高考命题的重点和热点。
本资料由书利华教育网(又名数理 化网)为您整理
15
第一单元 │ 使用建议
3.阿伏加德罗定律及其应用。命题的热点是已知同温同 压(或同温同容)下不同气体的某些条件,推断或比较某些物 理量(如体积、质量或密度)的大小;或者根据反应原理,结 合质量守恒定律、阿伏加德罗定律推断气体产物的化学式。由 于推导出的结论和公式比较多,学生容易弄混,学习时感到困 难。对于阿伏加德罗定律及其推论,引导学生自己推导,解题 时注意所给条件,仔细审题。把握相关知识点的命题规律及主 要题型的解题思路。通过课时作业加以强化巩固,紧扣相关理 论的本质,提高学生认识、分析、解决化学问题的能力。
第一单元 │ 使用建议
1.钠及其化合物的教学要注意引导学生掌握:钠与水反 应的现象与化学方程式,过氧化钠的性质与用途等知识。并且 通过本讲内容的学习,使学生初步了解研究金属元素的思维顺 序:单质→氧化物→对应的碱→对应的盐。 2.氯及其化合物容易结合其他元素化合物的知识,联系 一些重大的社会热点如卫生保健、食品安全、环境保护等进行 命题。因此引导学生掌握:氯气的性质、制法及检验,全面了 解氯气的有关知识。
8
第一单元 │ 知识系统总览
本资料由书利华教育网(又名数理 化网)为您整理
9
第一单元 │ 高考纵览 高考纵览 2009年 2010年 2011年 考点 钠及 课标全国27;海 南3(选择);天 其 北京11(选择); 津2(选择);浙 福建9(选择); 化 全国7(选择)、 山东13(选 江12(选择);上 合 12(选择);重 择);四川 海10(选择);全 物 庆7(选择)、 国Ⅰ11(选择); 26(解答) 碱 9(选择) 全国Ⅱ8(选择); 金 四川29 属
13
第一单元 │ 使用建议 使用建议
► 教学建议 本单元的内容分为两部分:一是以钠、氯为主体的元素化 合物的教学,二是以物质的量为主体的理论教学。第一部分主 要掌握元素化合物的性质、制法等知识,在高考试题中主要以 实验、计算或综合形式呈现;第二部分比较抽象,概念性和综 合性强,易混淆知识点较多,物质的量、气体摩尔体积、物质 的量浓度等是高考常考的知识点,通常以选择题、填空题或计 算的形式出现,是历年高考命题的重点和热点。
本资料由书利华教育网(又名数理 化网)为您整理
15
第一单元 │ 使用建议
3.阿伏加德罗定律及其应用。命题的热点是已知同温同 压(或同温同容)下不同气体的某些条件,推断或比较某些物 理量(如体积、质量或密度)的大小;或者根据反应原理,结 合质量守恒定律、阿伏加德罗定律推断气体产物的化学式。由 于推导出的结论和公式比较多,学生容易弄混,学习时感到困 难。对于阿伏加德罗定律及其推论,引导学生自己推导,解题 时注意所给条件,仔细审题。把握相关知识点的命题规律及主 要题型的解题思路。通过课时作业加以强化巩固,紧扣相关理 论的本质,提高学生认识、分析、解决化学问题的能力。
2013届高考一轮化学复习课件(人教版选修2):第3课时 化学与材料的制造和应用

(3)不锈钢含有的Cr元素是在炼钢过程的氧吹 ________(填“前”或“后”)加入,原因是 _________________________________________。 (4)炼铁和炼钢生产中,尾气均含有的主要污染物是 ________________________。从环保和经济角度考虑, 上述尾气经处理可用作______________________。
(4)铝是高耗能产品,废旧铝材的回收利用十分重 要。在工业上,最能体现节能减排思想的是将回收铝做 成________(填代号)。 a.冰晶石 c.铝锭 b.氧化铝 d.硫酸铝
解析
(1)Al2O3熔点高,熔化需要较多能量,加
入助熔剂就可降低其熔点,节约能量,降低成本。 (2)由于冰晶石(Na3AlF6)与氧化铝熔融物密度比铝的 小,所以铝在熔融液的下层。 (3)电解时阳、阴极电极材料均为石墨,因阳极生成 O2,高温下O2将石墨氧化为CO2,所以电解时阳极石墨 需定期补充。为充分利用能源,减少废弃物排放,可将 回收铝做成铝锭。
不同功能的高分子材 性能 料,具有不同的特征 性质 高分子分离膜、医疗 应用 器械、医药等
①天然高分子 高分子材料
②合成高分子 ⑥某些特殊功能的
③线型 ④体型
⑤传统
⑦两种或两种以上
考点一
金属的冶炼
金属的冶炼方法和金属活动性有着很大的关系,金 属的活泼程度不同,对应的冶炼方法也截然不同,根据 不同金属的活动性,冶炼方法大致如下:
体型高分子材料 部分塑料(如电木)
以共价键结合成高分子 以共价键构成高分子 结构 链,链与链之间以分子 链,链与链之间以共 特点 间作用力相结合 价键大量交联 没有弹性和可塑性, 具有弹性、可塑性,在 不能溶解或熔融,在 性质 溶剂中能溶解,加热能 溶剂中能溶胀,硬度 特点 熔融,硬度、脆性较小, 和脆性较大,不能导 不能导电 电
2013届高三一轮复习课件1-1-1

对细胞多样性和统一性认识的考查 该知识点中,“真核细胞与原核细胞的区别”是最常见的
高考试题的知识点之一,高考命题专家之所以把它列为高考必
考知识点,无非是看中了该知识的迷惑性。这也是考生最常犯 错误的地方。可采用列表比较的方法对相关知识加以比较区分。
常见的原核生物及与之易混淆的真核生物 常见的原核生物 细菌:细菌常带有“杆、 球、螺旋或弧”字 放线菌:放线菌属、链霉 菌属 蓝藻:念珠藻、发菜、鱼 腥藻 易与之混淆的真核生物
2:为什么不直接用高倍镜观察?在换高倍镜前为什么要先
将物像移到视野的中央? 提示:高倍镜观察的视野小,直接使用高倍镜不容易找到 目标。只有将要进一步放大的目标移到视野的中央,才能在高 倍镜下看到。
高倍镜的使用“四字诀” 找、移、转、调
找:先在低倍镜下“找”到物像,并调节至清晰。 移:将观察点“移”到视野中央。 转:“转”动转换器,换上高倍镜。 调:调节光圈或反光镜及细准焦螺旋,使物像清晰。
D. 真核生物细胞具有生物膜系统,有利于细胞代谢有序进
行
解析:本题主要考查原核生物与真核生物在结构与功能方
面的区别。原核细胞没有由核膜包被的成形细胞核,没有复杂
要成分是肽聚糖,植物细胞壁的主要成分是纤维素。在乙图所
示的植物细胞中,还具有与分泌蛋白的合成、加工和分泌有关 的细胞器:核糖体、内质网、高尔基体。此外,线粒体为此过 程提供能量。这四种细胞器缺一不可。
[答案]
(1)原核
无核膜(无成形细胞核) '(2)细胞壁'细胞膜
'细胞膜 ' (3)纤维素' 8、10、11、12
)
细胞生物依赖各种分化的细胞密切合作,共同完成复杂的生命
活动
[解析]
2013届高考一轮化学复习课件(人教版选修2):第2课时 化学与资源开发利用

电解 ⑪MgCl2(熔融) ====l +
- -
-
-
⑬SO2+Br2+2H2O===4H +2Br +SO 2 4
-
⑭2I +
-
Cl2===I2+2Cl
三、石油、煤和天然气的综合利用 1.石油的炼制
2.煤的综合利用
原理 干 馏 将煤 ⑨____________
【温馨提示】
电解饱和NaCl溶液而不能电解熔融
NaCl,否则得到Na和Cl2;电解时使用惰性电极而不能 使用Fe、Cu等活性电极,否则阳极得不到Cl2;阳离子 交换膜既防止了Cl2与NaOH两种产物之间的反应,又防 止了H2和Cl2的反应。
例1
(2011· 北京)氯碱工业中电解饱和食盐水的原理
示意图如图所示。
硫酸钡的溶度积小于碳酸钡,在盐水a中加入碳酸钡, 将有硫酸钡沉淀生成,从而除去SO2-,同时引入了 4 CO2 ,CO2 与Ca2 结合生成碳酸钙沉淀,从而除去钙 3 3 离子;10 m3盐水b中次氯酸钠的物质的量为 10×103×7.45×10-3 =1(mol),由电子守恒知, 74.5
- - +
④经过程Ⅲ处理,要求盐水c中剩余Na2SO3的含量 小于5 mg/L。若盐水b中NaClO的含量是7.45 mg/L,则 处理10 m3盐水b,至多添加10% Na2SO3溶液 ________kg(溶液体积变化忽略不计)。
解析 本题考查氯碱工业、电化学、工艺流程 等。根据钠离子的移动方向可知左边为阳极室,右边为 阴极室,阴极发生还原反应生成氢气和氢氧化钠,溶液 A为氢氧化钠溶液。碱性条件下镁离子形成氢氧化镁沉 淀,故盐泥a中还含有Mg(OH)2;碱性条件下,具有氧 化性的氯气将铵根离子氧化成氮气,氯气转化为氯离 子,离子方程式为2NH++3Cl2+8OH-===N2↑+6Cl- 4 +8H2O;
2013届高三化学一轮复习课件:10.3芳香烃和卤代烃(人教版)
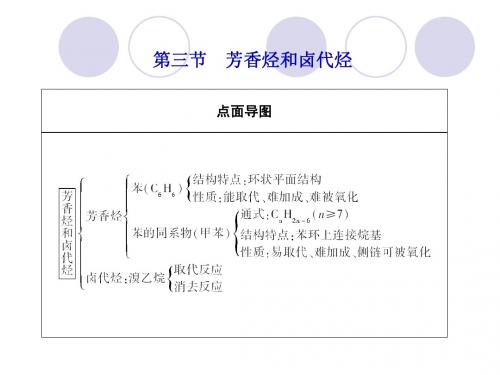
(2)写出下列反应过程的反应类型:丙烯直接形成高分子________; A→B________。 (3)1 mol A与2 mol NaOH反应发生消去反应的化学方程式为 _____________________________________________________。 B转化为C的化学方程式为____________________________。
(2)苯环上的氢原子与溴的取代反应,条件是铁或溴化铁做催 化剂。异丙苯的同分异构体有很多,如三甲苯、侧链为乙基和 甲基的结构等,其中一溴代物最少的为高度对称的1,3,5三 甲苯。(3)异丙苯发生取代反应生成氯代异丙苯:
4.(2011·全国Ⅰ高考,节选)下面是以环戊烷为原料制备环戊二 烯的合成路线:
CH2===CH2、CH≡CH、C6H6、
(2012·惠州一中质检)下列有机物分子中的所有碳原子不 可能处于同一平面的是( A.甲苯 C.2-甲基丙烯 ) B.硝基苯 D.2-甲基丙烷
【精讲精析】 甲苯、硝基苯中的碳原子都在苯环的平面上,
2-甲基丙烯中的所有碳原子都在双键的平面上,而2-甲基丙 烷中的碳原子所形成的化学键的空间排列为四面体。所以2-
上。
(4)苯分子(C6H6)是平面正六边形结构,所有原子共平面。 (5)甲醛分子(HCHO)是平面结构,所有原子共平面。
(6)有机物分子中的以单键相结合的原子,包括碳碳单键、碳氢
单键、碳氧单键等两端的原子都可以以单键为轴旋转。 (7)任何两个直接相连的原子在同一直线上。
(8)三键两端原子及其直接相连的原子在同一直线上。 (9)在中学所学的有机物中,所有的原子一定共平面的有:
【答案】 D
卤代烃的取代反应与消去反应 1.卤代烃取代反应和消去反应的比较 名称 反应物和 反应条件 断键方式 反应产物 结论
2013届高三化学一轮复习课件:3.2铝及其化合物(人教版)

【精讲精析】 由题图可知溶解Al(OH)3所需的NaOH
n(NaOH)=(0.18-0.16) L×5 mol/L=0.1 mol。
由Al(OH)3+OH-===AlO+2H2O知 n(Al)=n[Al(OH)3]=n(OH-)=0.1 mol。
m(Al)=0.1 mol×27 g/mol=2.7 g。
【答案】
B
热点探究—— 数形思想——Al(OH)3沉淀图象及数量关系探究 以化学知识为载体,将化学问题抽象成数学问题,利用数学工 具通过计算和推理,解决化学问题,是图象分析的解题特点。 “镁、铝图象题”是接触到最多的图象题。
(2)可溶性铝盐溶液与NaOH溶液反应的图象 可溶性铝盐溶液中 逐滴加入NaOH溶 液至过量 NaOH溶液中逐滴 加入可溶性铝盐溶 液至过量
沉淀Al3+所需n(NaOH)=0.1 mol×3=0.3 mol。
沉淀Mg2+所需n(NaOH)=(0.16-0.02)×5 mol-0.3 mol=0.4
3.向Mg2+与Al3+的酸性溶液中逐渐加入强碱溶液
无明显现象→出现沉淀→沉淀最 多→部分溶解→不变
现象
图象
离子方程式
H++OH-===H2O Al3++3OH-===Al(OH)3↓ + - Mg2 +2OH ===Mg(OH)2↓ Al(OH)3+OH-===AlO-+2H2O 2
将一定量的镁铝合金投入100 mL一定浓度的盐酸中,合金 即溶解。向所得溶液中滴加5 mol/L NaOH溶液,生成沉淀的 质量与加入的NaOH溶液的体积如图所示,由图中数据分析计 算:
【答案】 A
守恒思想——铝等金属与酸或碱反应
的有关计算
1.铝与酸或碱溶液反应生成 H2 的量的计算 铝分别与盐酸、氢氧化钠溶液反应的原理: 2Al+6HCl===2AlCl3+3H2↑, 2Al+2NaOH+2H2O===2NaAlO2+3H2↑。 Al 与酸、碱反应,实质上都是: +1 0 失3e- +3l,2H ――→H2,故铝与酸、碱溶液反应时,铝 得2e- 0 Al――→ A 与氢气的关系可利用 2Al~3H2 进行计算,也可以直接利 用电子得失守恒灵活计算。
2013届高三化学一轮复习课件:12.1化学实验的常用仪器和基本操作(人教版)

使用 仪器
药匙 (或纸槽)
镊子
托盘 天平
用试剂 瓶倾倒
3.物质的溶解 (1)固体的溶解 搅拌 一般在烧杯中进行,为了加速溶解,常采用研细、_____、振 荡或_____等措施。 加热
(2)液体的溶解
量筒 一般先用_____分别量取一定量的溶质和溶剂,然后先后倒入 烧 杯 里 搅 拌 而 溶 解 , 但 对 于 浓 H2SO4 的 溶 解 , 一 定 要 将 浓H2SO4 水 搅拌 __________缓缓倒入___中,并且边倒边______。
一、常见化学仪器及使用方法
1.可加热的仪器
(1)直接加热仪器 试管 向下倾斜
玻璃棒
圆底烧瓶
锥形瓶
烧杯
量筒
0.1
容量瓶
引流
酸式滴定管
酸
强氧化 碱
0.01
碱式滴定管
0.01
小烧杯
物品 砝码 0.1 温度计 支管口
3.分离提纯仪器 仪器图形与名称 主要用途 使用方法和注意事项
①可用于试剂注入; 贴 ①漏斗加滤纸后, 过滤时注意“一___、 低 靠 二___、三___” 可过滤液体 ②长颈漏斗用于 ②装配气体发生装置 装配气体发生装 时,应将长颈漏斗颈 插入液面下 口____________,防止 置 气体逸出
③量筒、滴定管、分液漏斗、长颈漏斗、容量瓶等仪器在使用 前必须检验是否漏水 ④烧瓶、坩埚、烧杯等仪器均可直接在酒精灯上灼烧 ⑤用温度计测量出酒精的沸点为78.5 ℃ 【答案】 (1)②⑤⑥ (2)⑤
二、化学基本操作 1.玻璃仪器的洗涤 (1)洗净标准 成股流下 玻璃内壁附着均匀的水膜,不聚滴,也不__________。 (2)常见附着物的洗涤 不易用水清洗的物质,根据其性质选不同的洗涤剂将其溶解, 然后再用水洗。例如:
2013届高三一轮复习课件1-1-2

[2012·福建宁德模拟]下列有关组成生物体化学元素的论述,
正确的是( )
A. 组成生物体和组成无机自然界的化学元素中,碳元素的 含量最多 B. 人、动物与植物所含的化学元素的种类差异很大 C. 组成生物体的化学元素在无机自然界都可以找到 D. 不同生物体内各种化学元素的含量比例基本相似
[解析]
量元素虽含量少,但其生理作用却不可替代,如Zn是DNA聚合 酶和RNA聚合酶的辅酶成分,缺Zn将导致DNA复制和RNA合 成不能正常进行。 (2)不同生物体内所含的化学元素的种类基本相同,但在不 同生物体内同种元素的含量差别较大;同一生物体内的不同元 素的含量也不相同,这是细胞统一性和差异性的表现。
A. 若图1表示细胞鲜重,则A、B化合物依次是H2O、蛋白 质 B. 若图2表示组成人体细胞的元素含量,则a、b、c依次是 O、C、H C. 地壳与活细胞中含量最多的元素都是a,因此说明生物
界与非生物界具有统一性
D. 若图1表示细胞完全脱水后化合物含量,则A化合物具有 多样性,其必含的元素为C、H、O、N
种类
生理功能
胆固 ①构成细胞膜的重要成分; 脂质 的运输 醇 ②参与血液中
性激 固 素 促进 醇
生殖器官的发育 和生殖细胞的形成
维生 促进肠道对 素D
钙和磷
的吸收
3:为什么同质量的脂肪和糖类相比氧化分解时释放的能量
较多? 提示:脂肪中氧的含量远远少于糖类,而氢的含量多于糖 类,因此,等质量的脂肪和糖类氧化分解时,脂肪所消耗的氧 气较多,同时释放的能量也多。
淀粉和糖原分别是植物、动物细胞内的储能物质,而纤维 素为非储能物质,脂肪是生物体的储能物质。
[2010·上海高考]下列选项中,含有相同元素的一
2013届高三化学一轮复习课件:12.2物质的检验、分离和提纯(人教版)

(5)升华:固体与有______特点的固体杂质分离。 升华 不互溶 (6)分液:_________液体的分离。 (7)萃取:利用溶质在两种互不相溶的溶剂里的________不同的 溶解度 分离方法。 溶液 (8)渗析:分离胶体和__________。 2.常用的化学方法 (1)加热法 混合物中混有热稳定性差的物质时,可直接加热,使热稳定性 差的物质分解而分离出去。例如:食盐中混有氯化铵,纯碱中
作阳极,精铜作阴极,电解液为含铜离子的溶液,通直流电,
粗铜及比铜活泼的杂质金属失电子,在阴极只有铜离子得电子 析出,从而提纯了铜。
3.(填一填)可用于分离或提纯物质的方法有: A.分馏 B.盐析 C.过滤
D.结晶
G.电解 J.灼热氧化
E.升华
F.渗析
H.加热分解 I.蒸馏
如欲分离或提纯下列各组混合物,请选择上述方法中最合适的,
(2)根据“实验现象的差异”鉴定物质
2.鉴别是指对两种或两种以上物质进行定性辨认 物质鉴别的一般类型有: (1)不用任何试剂的鉴别 ①先依据外观特征,鉴别出其中的一种或几种,然后再利用它
们去鉴别其他的几种物质。
②若均无明显外观特征,可考虑能否用加热或焰色反应区别开 来。 ③若以上两种方法都不能鉴别时,可考虑两两混合或相互滴加, 记录混合后的反应现象,分析确定。 ④若被鉴别物质为两种时,可考虑因试剂加入的顺序不同、现
液体或固体试剂“通入××中”。
(2012·恩平中学质检)能将分别含有Cu2+ 、Fe3+ 、 Al3+、Fe2+、Mg2+、NH、Na+等离子的七种溶液一次鉴别出 来的试剂是( ) B.KSCN溶液 D.NH3·H2O溶液
A.NaHCO3溶液 C.NaOH溶液
【精讲精析】 滴加 NaOH 溶液,含 Cu2+溶液有蓝色沉 + + 淀产生;含 Fe3 溶液有红褐色沉淀产生;含 Al3 溶液产生白色 + 沉淀,继续滴加 NaOH 溶液,沉淀溶解;含 Fe2 溶液有白色 沉淀产生,立即变成灰绿色最终变成红褐色;含 Mg2+溶液只 有白色沉淀生成;含 NH+溶液产生有刺激性气味的气体,含 4 + Na 溶液无明显现象。
《高考调研》高考一轮化学复习课件(人教版):第十一章第1课时 化学实验基本方法

长颈漏斗用于 装配气体发生 装置
体低于○37 ____边缘
(2)应将长管末端插入液面 下,防止气体逸出
第18页
第十一章 化学实验基础
高考调研
高三化学(新课标版)
仪器图形 与名称
主要用途
使用方法和注意事项
(1)注意活塞不得渗漏(2)分离液 (1)萃取、分液
(2)用于随时添 体时,下层液体由 ○38 ____,上
则将密度 ○21 ____的液体慢慢加入到密度 ○22 ____的液体
中。
第37页
第十一章 化学实验基础
高考调研
高三化学(新课标版)
③气体物质的溶解
a.溶解度不大的气体(Cl2等)选用○23 ________ b.易溶于水的气体(HCl、HBr、NH3等)选用○24 ___
____
第38页
第十一章 化学实验基础
第41页
第十一章 化学实验基础
高考调研
高三化学(新课标版)
(2)防暴沸:配制硫酸的水溶液或硫酸的酒精溶液 时,要将②__________缓慢倒入③____________中,并 用玻璃棒搅拌;加热液体混合物时要加④____________ (或⑤______________)。
第39页
第十一章 化学实验基础
高考调研
三、化学实验安全知识 1.常用危险化学药品的标志
高三化学(新课标版)
第40页
第十一章 化学实验基础
高考调研
高三化学(新课标版)
2.预防安全事故 (1)防爆炸:点燃可燃性气体(如H2、CO、CH4、 C2H2、C2H4)或用CO、H2还原Fe2O3、CuO之前,要 ①_______________________________________________ _________________________。
2013届高考一轮复习课件_选修三_第1讲_原子结构与性质

(2)有同学受这种划分的启发,认为d区内6、7纵行的部分 元素可以排在另一区,你认为应排在________区。
(3)请在元素周期表中用元素符号标出4s能级半充满的元素。
(4)请利用电子排布的相关知识解释Fe3+比Fe2+稳定的原因: ________________________________________________。
于22Ti来说,3p能级共有3个轨道,最多可以排6个电子,
如果排10个电子,则违反了泡利原理。 答案: A
1-3.下列原子构成的单质中既能与稀硫酸反应又能与
烧碱溶液反应且都产生H2的是 A.核内无中子的原子 B.外围电子排布为3s23p3的原子 C.最外层电子数等于倒数第三层的电子数的原子 ( )
D.除ds区外,以最后填入电子的轨道能级符号作为区
的符号
解析: A项,H为非金属,B项,p区左下角元素为金属, C项,d区内Cr为3d54s1。 答案: D
2-3.如图为一张没有填写内容的元素周期表。
(1)已知A、B、C、D、E、F六种短周期元素的原子半
径和某些化合价如下表所示: 元素 A B C D E F
化合价 -2
原子半
+5、- +4、- +6、- 3 0.075 4 0.077 2 0.102
+2
+1
径/nm
0.074
0.160 0.186
试将B、E两种元素的元素符号填入上图所示周期表中的相 应位置。
(2)写出基态G原子的电子排布式:
_______________________________________________。 (3)图中阴影部分所示区域的元素称为________元素,下列 元素属于该区域的是________。 A.Ba B.Fe
2013年高考化学一轮复习课件(人教版):第一单元 第1讲 物质的组成、分类

混合物
无固定的组成和结构 无固定的熔沸点 保持原有物质各自性质
(2)常见混合物。 ①高分子(如蛋白质、纤维素、聚合物、淀粉等); ②分散系(如溶液、胶体、浊液等); ③同分异构体(如二甲苯)。
(3)常见特殊名称的混合物:石油、石油的各种馏分、煤、
漂粉精、碱石灰、福尔马林、油脂、天然气、水煤气、钢铁、
+
(2)盐:分为正盐、酸式盐、碱式盐、复盐。
如:H3PO4 是三元酸,其钠盐
有正盐(Na3PO4)、酸式盐(NaH2PO4、
Na2HPO4);碱式盐如 Cu2(OH)2CO3; 复盐如 KAl(SO4)2· 2O。 12H 图1-1-3
【例2】用图 1-1-4 表示的一些物质或概念间的从属关 系中不正确的是( )。 X Y Z 选项 A 氧化物 化合物 纯净物 B 胶体 分散系 混合物 C 金属氧化物 碱性氧化物 氧化物 D 离子化合物 电解质 化合物
(4)溶解度曲线。
如图 1-1-1 是硝酸钾和氯化钠的溶解度曲线,是根据不 同温度下它们的溶解度值绘制的。
图 1-1-1
考点1
物质的组成
1.物质的组成
图 1-1-2
2.离子与基团的区别 离子 定义 带电的原子或原子团 基团 化学中对原子团和基的总称 不带电,为缺电子物质,
区别 带有正电荷或负电荷
图 1-1-4
思路指导:弄清物质的分类是解题的关键,注意一些特殊 情况,金属氧化物不一定是碱性氧化物(如Mn2O7 为酸性氧化 物,Al2O3 为两性氧化物,Na2O2 为过氧化物),酸性氧化物不一 定是非金属氧化物(如 Mn2O7)。
解析:从图中可以看出,Z 包含Y,Y 包含X。纯净物可
以分为单质和化合物,化合物又可以分为酸、碱、盐、氧化物 等,符合上述包含关系,A 对;分散系是一种混合物,它可以 分为溶液、胶体和浊液,符合上述包含关系,B 对;氧化物从 性质上可以分为酸性氧化物和碱性氧化物,碱性氧化物包括大
2013届高三化学一轮复习课件:10.1认识有机化合物(人教版)
第一节 认识有机化合物
点面导图
考向分析
本节高考重点考查: (1)同分异构体数目判断; (2)具有特定结构有机物结构简式书写; (3)有机物命名; (4)有机物分子结构的测定等。 多以填空题形式或有机结构的信息提示形式出现,试题难度 中等。预计2013年沿袭以往的考查形式。基于此,我们在复习时 注重同分异构体数目确定和分子结构与测定方法间的关系。
—OH _________
醛
醛基 ________
CH3CHO、 HCHO
羧酸
羧基 ________
醚
醚键
CH3CH2OCH2CH3
酯
酯基 __________
CH3COOCH2CH3
氨基酸
Hale Waihona Puke 氨基、羧基—NH2 —COOH
1.(填一填)下列有机化合物中,有的有多个官能团。
(1)可以看做醇类的是(填编号,下同)________; (2)可以看做酚类的是________; (3)可以看做羧酸类的是________; (4)可以看做酯类的是________。 【答案】 (1)BD (2)ABC (3)BCD (4)E
代烃的消去反应;C→D是醇的消去反应。
(5)F是C与乙酸(E)发生酯化反应生成的酯。 (6)G的同分异构体中,苯环上一硝化的产物只有一种的共有7
3.下面两种有机物的核磁共振氢谱图分别有几种峰,面积比是 多少? ①C6H5CH2CH2COOH________种,面积比为:________。
(5)F存在于栀子香油中,其结构简式为________;
(6)在G的同分异构体中,苯环上一硝化的产物只有一种的共有 ________个,其中核磁共振氢谱有两组峰,且峰面积比为1∶1 的是________(填结构简式)。
点面导图
考向分析
本节高考重点考查: (1)同分异构体数目判断; (2)具有特定结构有机物结构简式书写; (3)有机物命名; (4)有机物分子结构的测定等。 多以填空题形式或有机结构的信息提示形式出现,试题难度 中等。预计2013年沿袭以往的考查形式。基于此,我们在复习时 注重同分异构体数目确定和分子结构与测定方法间的关系。
—OH _________
醛
醛基 ________
CH3CHO、 HCHO
羧酸
羧基 ________
醚
醚键
CH3CH2OCH2CH3
酯
酯基 __________
CH3COOCH2CH3
氨基酸
Hale Waihona Puke 氨基、羧基—NH2 —COOH
1.(填一填)下列有机化合物中,有的有多个官能团。
(1)可以看做醇类的是(填编号,下同)________; (2)可以看做酚类的是________; (3)可以看做羧酸类的是________; (4)可以看做酯类的是________。 【答案】 (1)BD (2)ABC (3)BCD (4)E
代烃的消去反应;C→D是醇的消去反应。
(5)F是C与乙酸(E)发生酯化反应生成的酯。 (6)G的同分异构体中,苯环上一硝化的产物只有一种的共有7
3.下面两种有机物的核磁共振氢谱图分别有几种峰,面积比是 多少? ①C6H5CH2CH2COOH________种,面积比为:________。
(5)F存在于栀子香油中,其结构简式为________;
(6)在G的同分异构体中,苯环上一硝化的产物只有一种的共有 ________个,其中核磁共振氢谱有两组峰,且峰面积比为1∶1 的是________(填结构简式)。
2013届高考一轮化学复习课件(人教版选修2):第1课时 化学与工农业生产

5.工业生产中的有关计算 (1)关系式法(多步计算的简捷运算方法) 先写出多步反应的化学方程式,然后找出最初反应 物和最终生成物之间的物质的量之比,列出关系式。如 由硫酸工业反应原理可推算出, 理论上 1 mol S 完全转化 能生成 1 mol H2SO4,1 mol FeS2 完全转化生成 2 mol H2SO4,即 S~H2SO4,FeS2~2H2SO4。
(2)反应条件的选择 ①温度:400℃~500℃,根据平衡移动原理,应在 低温下进行,但低温时催化剂的活性不高,反应速率低, 实际生产中采用 400℃~500℃的温度。
②常压:根据平衡移动原理,应在高压下进行,但 增大压强对 SO2 的转化率提高不大,且加压会增大成本 和能量消耗,而常压下的转化率已很高,实际生产采用 常压操作。 ③适当过量的空气:目的是提高 SO2 的转化率。
⑦2NO+O2===2NO2 ⑧3NO2+H2O===2HNO3+NO ⑨NH3+HNO3===NH4NO3 ⑩2NH3+H2SO4===(NH4)2SO4 ⑪Ca3(PO4)2+2H2SO4(浓)===2CaSO4+Ca(H2PO4)2 ⑫Ca(H2PO4)2· 2O H ⑬KCl ⑭(NH4)2HPO4
填充剂、压滤、干燥、成型 ――→ 肥皂 分离提纯 25 ――→ ○
加压、加热 ①2NH3+CO2 ===== H2NCOONH4 加热 ②H2NCOONH4=====H2NCONH2+H2O ③NH3+H2O===NH3· 2O H ④NH3+HCl===NH4Cl ⑤NH3+H2O+CO2===NH4HCO3 Pt-Rh ⑥4NH3+5O2 ===== 4NO+6H2O △
的溶解度大,只有先通 NH3,后通 CO2,才能得到足够 的 HCO3 ,从而生成 NaHCO3 晶体析出。
高考化学一轮复习课件第讲 离子反应(PPT版)共张

Fe(OH)3↓+3H+(✕),因
只有易溶于水的强电解质能拆写成离子,其他物质均不能拆写。
如Ca(HCO3)2+2H+
Ca2++2CO2↑+2H2O(✕),因未将Ca(HCO3)2拆分成Ca2+和HC O3。
如Cl2+H2O 2H++Cl-+ClO-(✕),因将弱酸HClO拆分成了H+和ClO-。 ④“四查”是否漏写离子反应。
1.易错易混辨析(正确的画“√”,错误的画“✕”) (1)氨水导电,液氨不导电,所以氨水是电解质 ( ✕ ) (2)液氯不导电,氯水导电是因为氯气与水反应生成的电解质电离,故氯气是 非电解质 ( ✕ ) (3)强电解质都是离子化合物,弱电解质都是共价化合物( ✕ ) (4)HClO是弱酸,故NaClO是弱电解质 ( ✕ ) (5)H2SO4是强电解质,故浓硫酸具有很强的导电性 ( ✕ ) (6)盐酸的导电性一定强于醋酸溶液的导电性 ( ✕ ) (7)NaCl溶液在电流的作用下电离出钠离子和氯离子 ( ✕ )
解析 根据题意知,不断通入CO2,发生的化学反应为①Ca(OH)2+CO2 CaCO3↓+H2O,②CaCO3+CO2+H2O Ca(HCO3)2;当CO2不足量或恰好反应 时,发生的反应是①,碳酸钙是沉淀,水是弱电解质,随着反应的进行溶液中离 子浓度逐渐减小,导电能力逐渐减弱;当继续通入过量的二氧化碳时发生的反 应是②,生成的碳酸氢钙是强电解质,易溶于水,能电离出自由移动的离子,溶 液中离子浓度逐渐增大,导电能力逐渐增强。
N H4+CH3COO-
解析 AlCl3是盐,在溶液中完全电离出铝离子和氯离子,电离方程式为
2013届高三化学一轮复习课件:10.7有机合成(人教版)

①J→L 为 加 成 反 应 , J 的 结 构 简 式 为 _____________________________________________。 ②M→Q的反应中,Q分子中形成了新的________(填“C—C键” 或“C—H键”)。
④应用M→Q→T的原理,由T制备W的反应步骤为 第1步:________________________________________; 第2步:消去反应; 第3步:_______________。(第1、3步用化学方程式表示)
①凡链节为 结构的高聚物,其合成单体
必为一种。在亚氨基上加氢,在羰基碳原子上加羟基,即得高
聚物单体。
②凡链节中间(不在端上)含有肽键的高聚物,从肽键中间断开, 两侧为不对称性结构的,其单体为两种;在亚氨基上加氢,羰 基碳原子上加羟基,即得高聚物单体。
③凡链节中间(不在端上)含有
酯基结构的高聚
物,其合成单体为两种,从
2.功能高分子材料 (1)概念 既有传统高分子材料的机械性能,又有某些特殊功能的高分子 材料。 (2)分类 主要包括高分子分离膜、液晶高分子、导电高分子、医用高分 子、高吸水性树脂等。 3.复合材料 (1)概念:两种或两种以上材料组合成的一种新型材料,其中 一种材料作为基体,另一种作为增强材料。 (2)性能:强度高、质量轻、耐高温、耐腐蚀。 (3)应用:可用来做建筑材料和汽车、轮船、人造卫星、宇宙 飞船的外壳和构件等。
A.碳化硼(B4C3)、氮化硅(Si3N4)等陶瓷是新型无机非金属材 料 B.线型高分子具有热固性 C.“不粘锅”内壁涂的聚四氟乙烯CF2—CF2是通过缩聚 反应生成的
D.尼龙是天然高分子材料
【答案】 A
单体与高聚物的互推规律 1.由单体推断高聚物
2013届高三一轮复习课件1-2-1

也有质变。 (2)植物细胞外有起支持和保护作用的细胞壁,主要成分是 纤维素和果胶。酶解法去除细胞壁所用酶为纤维素酶和果胶酶。
[2012·泰安模拟]如图表示各种膜的组成成分含
量,图示不能说明的是(
)
A. 构成细胞膜的主要成分是蛋白质和脂质
B. 膜中的脂质和蛋白质含量的变化与膜的功能有关
C. 膜的功能越简单,所含蛋白质的数量越少 D. 蛋白质在进行细胞间的信息交流中具有重要作用 [思路点拨]
1. 细胞核的结构
名称 核膜 和核 孔 核仁 特点 ①核膜是双层膜,外膜表面有 核糖体附着 ②核膜不是连续的,其上有核 孔 折光性强,易与其他结构区分 ①易被碱性染料染成深色 ②主要由DNA和蛋白质组成 ③与染色体的关系, 功能
①核膜是化学反应的场所,核 膜上有酶附着,利于多种化学 反应的进行 ②核孔能控制物质进出,小分 子、离子通过核膜进出,大分 子物质通过核孔进出
必修一 分子与细胞
第二单元 细胞的基本结构和物质运输 功能
最新考纲
1.细胞膜系统的结构和功能 Ⅱ 2.主要细胞器的结构和功能 Ⅱ 3.细胞核的结构和功能 Ⅱ 4.物质出入细胞的方式 Ⅰ 实验: 1.观察线粒体和叶绿体 2.通过模拟实验探究膜的通 透性 3.观察植物细胞的质壁分离 和复原
热点提示 1.细胞膜的成分特点及生物膜系 统在结构和功能上的联系、应用 2.生物膜的结构特点和生理特性 及相关实验验证 3.关注细胞膜在细胞间信息交流 功能的方式及图像识别 4.各种细胞器的结构与功能相适 应的特点及各种细胞器之间的分 工合作 5.细胞核的结构与功能以及设计 实验探究细胞核的功能 6.细胞吸水和失水的原理应用及 实验探究设计 7.生物膜的特性在制药、人工肾 等方面的应用
1:制备细胞膜时为什么选用人或其他哺乳动物成熟的红细
[2012·泰安模拟]如图表示各种膜的组成成分含
量,图示不能说明的是(
)
A. 构成细胞膜的主要成分是蛋白质和脂质
B. 膜中的脂质和蛋白质含量的变化与膜的功能有关
C. 膜的功能越简单,所含蛋白质的数量越少 D. 蛋白质在进行细胞间的信息交流中具有重要作用 [思路点拨]
1. 细胞核的结构
名称 核膜 和核 孔 核仁 特点 ①核膜是双层膜,外膜表面有 核糖体附着 ②核膜不是连续的,其上有核 孔 折光性强,易与其他结构区分 ①易被碱性染料染成深色 ②主要由DNA和蛋白质组成 ③与染色体的关系, 功能
①核膜是化学反应的场所,核 膜上有酶附着,利于多种化学 反应的进行 ②核孔能控制物质进出,小分 子、离子通过核膜进出,大分 子物质通过核孔进出
必修一 分子与细胞
第二单元 细胞的基本结构和物质运输 功能
最新考纲
1.细胞膜系统的结构和功能 Ⅱ 2.主要细胞器的结构和功能 Ⅱ 3.细胞核的结构和功能 Ⅱ 4.物质出入细胞的方式 Ⅰ 实验: 1.观察线粒体和叶绿体 2.通过模拟实验探究膜的通 透性 3.观察植物细胞的质壁分离 和复原
热点提示 1.细胞膜的成分特点及生物膜系 统在结构和功能上的联系、应用 2.生物膜的结构特点和生理特性 及相关实验验证 3.关注细胞膜在细胞间信息交流 功能的方式及图像识别 4.各种细胞器的结构与功能相适 应的特点及各种细胞器之间的分 工合作 5.细胞核的结构与功能以及设计 实验探究细胞核的功能 6.细胞吸水和失水的原理应用及 实验探究设计 7.生物膜的特性在制药、人工肾 等方面的应用
1:制备细胞膜时为什么选用人或其他哺乳动物成熟的红细
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.铵盐 (1)物理性质 铵盐是由 ________ 和 ________ 构成的 ________ 化合物,都是白 色或无色晶体,都________溶于水。 (2)化学性质 ①受热分解 NH4Cl、NH4HCO3受热分解的化学方程式分别为: _______________________________________________; _______________________________________________。
(3)NH+ 4 的检验 取少量样品于试管中,然后加入 NaOH 固体,加热,将 ________靠近试管口,若变________,则证明样品中含有 NH4 (或 用蘸有浓盐酸的玻璃棒靠近试管口,若有 ________,则证明含有 NH4 )。
+ +
三、硝酸 1.硝酸的物理性质 色 味 态 : _____________ ; 挥 发 性 : __________________; 水 溶 性 : _____________ ; 发 烟 硝 酸 : ________________。 2.硝酸的化学性质 (1)强酸性 稀硝酸能使紫色石蕊试液变 ________ 色,浓硝 酸能使石蕊试液先变 ________ 色,微热后褪色。
②与非金属反应 与浓HNO3反应时,非金属单质一般被氧化为最高价氧化物或最 高 价 含 氧 酸 , 如 碳 与 浓 HNO3 反 应 的 化 学 方 程 式 为 _______________________________________________________ _________________________________。 ③与某些还原性化合物或离子的反应,例如:H2S、SO2、HBr、 HI、FeCl2等。 ④王水 王水由 ________ 与 ________ 按体积比 1∶3 混合所得,具有更强 的氧化性,能使Au、Pt溶解。
思考1:如何除去浓HNO3的黄色? 思考2:“浓HNO3与Cu反应产生NO2,稀HNO3 与Cu反应产生NO,则稀HNO3氧化性强。”这种 说法对吗?为什么?
放电 答案:一、1.(1)N2+O2 ===== 2NO 2NH3 2.(1)2NO+O2===2NO2 (2)无色 红棕色 刺激性气味 不 +NO 有毒 有毒 (3)硝酸型酸雨 光化学烟雾
(2)不稳定性: 浓硝酸显黄色,是因为__________________, 说 明 浓 硝 酸 具 有 ________ 性 , 化 学 方 程 式 为 __________。
(3)强氧化性 ①与金属的反应 a.除Pt、Au外,大部分金属均能与HNO3反应。 b . Cu 与浓、稀 HNO3 发生反应的化学方程式分 别 为 ____ , _________________________________________ _________。 c . Fe 、 Al 遇 冷 的 浓 HNO3 或 浓 H2SO4 能 发 生 ________ , 故 可 以 用 铁 、 铝 容 器 贮 存 冷 的 浓 HNO3、浓H2SO4。
NO2
与H2O反应方程式___________
毒性
(3)氮氧化物对环境的影响 ①形成________。②形成________。
二、氨和铵盐 1.氨 (1)结构与物理性质 电子式 密度 气味 水溶性 常温常压下,1 体积水大约能溶 解____体积氨 气
比空气 ____
____性 气味
(2)化学性质 ①与水: _________________________________________。
现象: ②与酸 (如与浓盐酸) 方程式:
; 。
③与盐 (如与 AlCl3): ________________________________。
④与O2:_______________________________________。
(3)制法 ①实验室制法: _________________________________________ _______________________________。 ② 工 业 制 法 : ____________________________________。 (4)用途:制HNO3、铵盐、纯碱、尿素、制冷剂 等。
基础回扣 一、N2和氮氧化合物 1.N2的主要性质 (1)N2的还原性:______________。
2.NO、NO2的主要性质 (1) 一氧化氮在常温下很容易与空气中的氧气反应,化学方程式 为____________________。 (2)比较NO与NO2的性质:
NO
颜色 气味 水溶性 ____溶
课堂探究
ቤተ መጻሕፍቲ ባይዱ
考点突破
课堂反馈
课时作业
单元综合测试
课 堂 探 究
条 分 缕 析· · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · 各 个 击 破
解读考纲
考点
考纲解读
氮及其氧化 1.了解氮及其氧化物的主要性质。 1 物的性质与 2.了解氮的氧化物对大气的污染及 应用 其防治。 1.了解氨的性质,用途及制法。 氨及铵盐的 2 2.了解铵盐的主要性质,认识它在 性质与应用 生产中的应用。 3 硝酸的性质 掌握硝酸的强氧化性。 及其应用
②与碱反应 (NH4)2SO4与NaOH共热反应的化学方程式: ________________________________________________。 若上述反应在溶液中进行,则离子方程式为 ________________________________________________。 ③水解反应 NH是弱碱的阳离子,水解反应离子方程式: _________________________________________________。
高温、高压 (2)N2+3H2 催化剂
3NO2+H2O===2HNO3
二、 1.(1)小
