Diels
dielsalder反应机理

dielsalder反应机理迪耳斯-阿尔德反应是一种重要的有机合成反应,反应的基本机理涉及到亲电烯和亲核烯(烯烃)之间的加成反应。
迪耳斯-阿尔德反应的基本步骤如下:1.亲电烯(由亲电试剂提供,如醛、酮、酯、羧酸等)通过加成反应形成亲电烯基中间体,即产生一个带有正电荷部分的化合物。
2.亲核烯(由亲核试剂提供,如烯烃、亚砜等)通过加成反应攻击亲电烯基中间体,与之发生共轭加成反应,形成稳定的六元环结构。
3.反应得到的产物可能是顺式产物(两个官能团在产物中相对位置保持不变)或反式产物(两个官能团在产物中相对位置发生改变)。
顺式产物的生成通常更加稳定,因此是主要产物。
下面以一个具体的例子来说明迪耳斯-阿尔德反应的机理:首先,假设我们有一个亲电烯A(如醛)和一个亲核烯B(如烯烃),它们通过迪耳斯-阿尔德反应形成一个六元环的产物C。
1.亲电烯A首先发生亲电加成反应,其中醛基上的羰基氧原子攻击亲电烯B的π键,生成一个带正电荷的中间体D。
该反应通常由酸性条件催化。
2.亲核烯B接下来作为亲核试剂,通过攻击中间体D上的亲电烯C-C双键,发生共轭加成反应。
整个过程中,π键电子从亲电烯转移到亲核烯上,形成新的六元环结构E。
3.最后,通过质子迁移或酸碱中和等步骤,从产物E中得到最终的六元环产物C。
这个步骤通常在碱性条件下进行。
需要注意的是,迪耳斯-阿尔德反应的机理具有多样性和复杂性。
具体的反应机理取决于反应物的结构、溶剂条件、催化剂等因素。
有时候还会发生一些副反应,如分子内和分子间的竞争反应等。
总结来说,迪耳斯-阿尔德反应是一种通过亲电烯和亲核烯之间的加成反应形成六元环结构的重要有机合成反应。
它的机理涉及亲电烯的加成生成中间体,然后亲核烯进攻该中间体,形成新的六元环产物。
虽然反应机理比较复杂,但它在有机合成中具有广泛的应用前景。
Diels-Alder反应(狄尔斯–阿尔德反应)

Diels-Alder反应(狄尔斯–阿尔德反应)Diels-Alder反应,反电⼦要求的Diels-Alder反应和Hetero-Diels–Alder reaction(杂-Diels–Alder反应)都是[4+2]环加成反应,都属于协同反应。
是由共轭双烯与亲双烯体构建环⼰烯⾻架的经典反应。
反应有丰富的⽴体化学呈现,兼有⽴体选择性、⽴体专⼀性和区域选择性等。
该反应是可逆反应,正向成环的反应温度较低,逆向开环反应需要较⾼的温度。
此反应⽤很少能量就可以合成六元环,是制备不饱和六元环的⾮常重要的环化⼿段之⼀,对推动有机化学反应理论的发展起到了重要作⽤。
Danishefsky⼆烯与⼀般的双烯相⽐,有更好的反应性及位置选择性。
因此,是熟为⼈知的有机合成试剂。
1950年的诺贝尔化学奖颁给了德国化学家奥托·迪尔斯(Otto Paul Hermann Diels)和他的学⽣库尔特·阿尔德(Kurt Alder),以表彰他们在1928年发现了著名的“Diels-Alder双烯合成反应”。
反应机理反应机理⼀般认为,在反应时两反应物彼此靠近,相互作⽤, 形成⼀个环状过滤态。
然后逐渐转化为产物分⼦,即旧键的断裂与新键的形成是相互协调地在同⼀步骤中完成的—协同反应,⽆中间体⽣成。
带有给电⼦基团的双烯体和带有吸电⼦基团的亲双烯体进⾏反应。
因为前沿轨道(双烯的HOMO和亲双烯体的LUMO)的能量差越⼩,能够使轨道相互作⽤⽽稳定,从⽽使反应更容易进⾏(电⼦要求型)。
同理,亲双烯体带有给电⼦基,共轭双烯带吸电⼦基的反应也容易进⾏(反电⼦要求型)。
反应是按协同反应顺式加成来进⾏的,优先⽣成endo加成产物(endo规则)。
电⼦要求型的Diels-Alder反应中,⼆次轨道相互作⽤⼤致能解释这⼀规则,但endo/exo选择性也受⽴体影响,根据不同底物,完全选择⽣成exo产物的例⼦也有报道。
除此之外分⼦内的Diels-Alder 反应由于环状结构固定,构型⾃由度较低,也不完全适⽤endo规则。
丁二烯 diels-alder反应 常温反应

丁二烯 Diels-Alder 反应是一种重要的烯烃加成反应,常温下能够有效进行,具有广泛的应用价值。
本文将从丁二烯 Diels-Alder 反应的基本原理、条件和机理入手,深入探讨其在化学合成中的重要作用和应用前景。
一、基本原理丁二烯 Diels-Alder 反应是一种经典的烯烃加成反应,通常在常温下能够顺利进行。
它是以德国化学家奥托·迪尔斯和克鲁珀共发现的,因此得名 Diels-Alder 反应。
该反应的基本原理是烯烃和烯烃二酮碳氧双键之间通过共轭加成,生成环烷化产物。
二、反应条件丁二烯Diels-Alder 反应的主要条件包括温度、溶剂和催化剂等方面。
在常温下,通常可以在无催化剂存在的情况下进行,但在一些需要改善反应速率和产物选择性的情况下,可以加入Lewis酸或贵金属催化剂。
选择合适的溶剂也是影响反应进行的重要因素,常用的溶剂包括二甲基亚硝胺、二甲基甲酰胺等。
三、反应机理丁二烯 Diels-Alder 反应的机理是一个独特的共轭四电子过程,通常经历以下几个步骤:首先是烯烃和烯烃二酮之间的轴向取向(alignment)、然后形成新的σ键和π键(cycloaddition)、接着进行sigma复合(sigmaplex)、最终生成环烷化产物。
四、应用价值丁二烯 Diels-Alder 反应作为一种高效的烯烃合成方法,在有机合成中具有广泛的应用价值。
它可以用于合成各种环烷化产物,如环戊烷、环己烷等,还可以用于制备农药、医药中间体、复杂天然产物等。
丁二烯 Diels-Alder 反应还可以作为合成新型功能材料的重要工具,如荧光染料、配位聚合物等。
五、展望与挑战随着合成化学的发展,丁二烯 Diels-Alder 反应在绿色化学合成和不对称合成领域的应用前景较为广阔,但也有一些挑战需要克服。
其中包括反应条件的优化、催化剂的开发、对手性产物的控制等方面,希望未来能够有更多的研究成果推动丁二烯 Diels-Alder 反应的应用与发展。
diels-alder反应

diels-alder反应
Diels-Alder反应,又称偶联反应,是一种多步骤反应,主要用于合成环状有机物,从而用于生产药物和高分子等。
这种反应由德国的奥斯坦·迪尔斯和意大利的阿尔弗雷德·奥尔德
发现,因此也被称为迪尔斯-阿尔德反应。
1928年,他们也获得了诺贝尔化学奖,以表彰
他们在偶联反应方面的杰出成就。
Diels-Alder反应的本质是一种复合反应。
它由一系列步骤组成,这些步骤涉及一系列的反应物和中间体的形成,最终形成目标有机物。
它的基本平台由一口定位于碳原子下方的共价双键和一个位于碳原子上方的单键组成。
此单稳定键与另一口碳—氧双键发生取代反应,从而形成反应中间体,最终发生1,4-偶联反应,形成环状有机物。
这种反应是自分子配体催化反应,因此不需要外加催化剂,也不会出现副反应。
在它可用于合成环状有机物时,通常不需要几步就可以完成,并且这些反应对环境友好,利用率非
常高。
由于它的良好的立体性和立体选择性,可以用于合成一些复杂的环状化合物,如:
医药,农药,杀虫剂,香料,表面活性剂等。
它也可以用于制造聚合物等特殊材料。
综上所述,Diels-Alder 反应是一种通用的反应,可以用于合成各种有机分子,如环状有机物,聚合物等,它的利用率及立体选择性良好,还具有环境友好的特性。
化学实验中的Diels-Alder反应

1,4-加成反应生成环状化合物
Diels-Alder反应的原理
这是一个一步完成的协同反应。没有中间体存
在,只有过渡态。 协同反应:一类键的断裂和形成同时发生的化 学反应。这类反应不受溶剂、催化剂等的影响, 反应机理既非离子型又非自由基型,而是往往 通过一个环状过渡态进行的(有环状过渡态的 协同反应又称周环反应
5、周环反应及类型?
在反应中不形成离子或自由基中间体,而是由
电子重新组织经过四或六中心环的过渡态而进 行,这种一步完成的多中心反应称为周环反应。 周环反应包括五种类型反应,即电环化和开环反 应、环加成反应、σ-迁移反应、螯移变反应和 基团转迁反应。
主要参考资料:
《实验化学》上册,陈虹锦
主编,科学出版社 网络资源:The End~谢谢观看!
[4+2] 环加成反应:Diels-Alder反应
实验用品及主要参数
蒽:含三个环的稠环芳烃 分子式C14H10 无色片状晶体;有蓝紫色荧光;熔点216℃,沸点
340℃,相对密度1.283(25/4℃);容易升华;不 溶于水,难溶于乙醇和乙醚,易溶于热苯 蒽还可以作为共轭二烯,与顺丁烯二酐等在 9,10位发生狄尔斯-阿尔德反应 分子量:178 用量:40mg
顺丁烯二酸酐 (马来酸酐或失水苹果酸酐, 常简称顺酐 )
无色结晶,有强烈刺激气味,凝固点52.8℃,
沸点202℃,易升华。主要由苯或碳四馏分中的 正丁烷或丁烯氧化而制得,是生产不饱和聚酯 及有机合成的原料 分子量:98 用量:20mg
仪器和药品
仪器:
50 ml锥型瓶、25 ml圆底烧瓶、冷凝管、 干燥管、试管、薄层板、电吹风、紫外灯。 药品: 顺丁烯二酸酐、蒽、乙酸乙酯(无水硫酸钠干 燥)、60-90 °C石油醚(无水氯化钙干燥),环 戊二烯(在170 °C以上的油浴上分馏收集到的 40-45 °C的馏分,放入冰箱保存)、稀高锰酸 钾溶液、稀溴四氯化碳溶液、二甲苯(无水氯 化钙干燥)、无水乙醚、30-60 °C石油醚
d-a反应

狄尔斯–阿尔德反应[编辑]维基百科,自由的百科全书(重定向自狄尔斯-阿德尔反应)跳转至:导航、搜索)又叫Diels–Alder反应、双烯加成反应,其中狄尔斯又译作第尔斯–阿尔德又译作阿德尔、阿德耳。
狄尔斯–阿尔德反应是一种有机反应(具体而言是一种环加成反应),共轭双烯与取代烯烃(一般称为亲双烯体)反应生成取代环己烯[1][2][3]。
即使新形成的环之中的一些原子不是碳原子,这个反应也可以继续进行。
一些狄尔斯–阿尔德反应是可逆的,这样的环分解反应叫做逆狄尔斯–阿尔德反应或逆Diels–Alder反应(retro-Diels–Alder)。
1928年德国化学家奥托·迪尔斯和他的学生库尔特·阿尔德首次发现和记载这种新型反应,他们也因此获得1950年的诺贝尔化学奖。
狄尔斯–阿尔德反应用很少能量就可以合成六元环,是有机化学合成反應中非常重要的碳碳键形成的手段之一,也是现代有机合成里常用的反应之一。
反应有丰富的立体化学呈现,兼有立体选择性、立体专一性和区域选择性等。
目录[隐藏]1 发现2 机理3 立体化学4 合成中的价值5 参见6 参考资料发现[编辑]本条目没有列出任何参考或来源。
(2012年2月1日)維基百科所有的內容都應該可供查證。
请协助添加来自可靠来源的引用以改善这篇条目。
无法查证的内容可能被提出异议而移除。
狄尔斯-阿尔德反应是1928年由德国化学家奥托·迪尔斯(Otto Paul Hermann Diels)和他的学生库尔特·阿尔德(Kurt Alder)发现的,他们因此获得1950年的诺贝尔化学奖。
最早的关于狄尔斯–阿尔德反应的研究可以上溯到1892年。
齐克(Zinke)发现并提出了狄尔斯-阿尔德反应产物四氯环戊二烯酮二聚体的结构;稍后列别捷夫(Lebedev)指出了乙烯基环己烯是丁二烯二聚体的转化关系。
但这两人都没有认识到这些事实背后更深层次的东西。
1906年德国慕尼黑大学研究生阿尔布莱希特(Albrecht)按导师惕勒(Thiele)的要求做环戊二烯与酮类在碱催化下缩合,合成一种染料的实验。
狄尔斯—阿德尔反应(Diels—Alder反应,D-A反应)知识总结
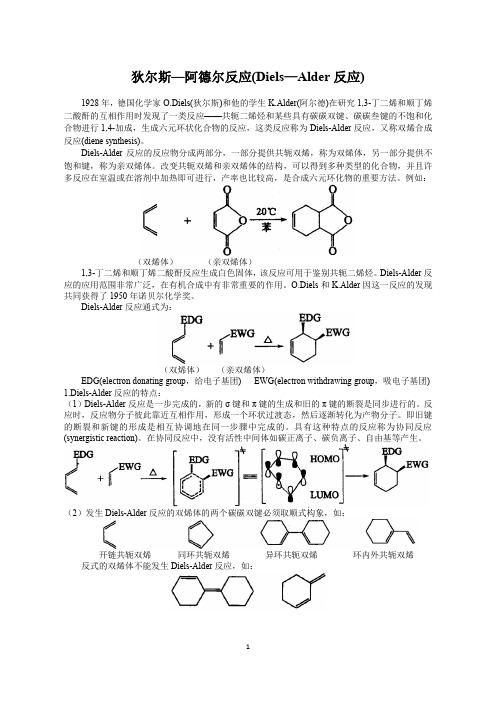
狄尔斯—阿德尔反应(Diels—Alder反应)1928年,德国化学家O.Diels(狄尔斯)和他的学生K.Alder(阿尔德)在研究1,3-丁二烯和顺丁烯二酸酐的互相作用时发现了一类反应——共轭二烯烃和某些具有碳碳双键、碳碳叁键的不饱和化合物进行1,4-加成,生成六元环状化合物的反应,这类反应称为Diels-Alder反应,又称双烯合成反应(diene synthesis)。
Diels-Alder反应的反应物分成两部分,一部分提供共轭双烯,称为双烯体,另一部分提供不饱和键,称为亲双烯体。
改变共轭双烯和亲双烯体的结构,可以得到多种类型的化合物,并且许多反应在室温或在溶剂中加热即可进行,产率也比较高,是合成六元环化物的重要方法。
例如:(双烯体)(亲双烯体)1,3-丁二烯和顺丁烯二酸酐反应生成白色固体,该反应可用于鉴别共轭二烯烃。
Diels-Alder反应的应用范围非常广泛,在有机合成中有非常重要的作用。
O.Diels和K.Alder因这一反应的发现共同获得了1950年诺贝尔化学奖。
Diels-Alder反应通式为:(双烯体)(亲双烯体)EDG(electron donating group,给电子基团) EWG(electron withdrawing group,吸电子基团) 1.Diels-Alder反应的特点:(1)Diels-Alder反应是一步完成的,新的σ键和π键的生成和旧的π键的断裂是同步进行的。
反应时,反应物分子彼此靠近互相作用,形成一个环状过渡态,然后逐渐转化为产物分子。
即旧键的断裂和新键的形成是相互协调地在同一步骤中完成的。
具有这种特点的反应称为协同反应(synergistic reaction)。
在协同反应中,没有活性中间体如碳正离子、碳负离子、自由基等产生。
(2)发生Diels-Alder反应的双烯体的两个碳碳双键必须取顺式构象,如:开链共轭双烯同环共轭双烯异环共轭双烯环内外共轭双烯反式的双烯体不能发生Diels-Alder反应,如:空间位阻因素对Diels-Alder反应的影响较大,有些双烯体的两个碳碳双键虽然是顺式构象,但由于1,4位取代基的位阻较大,也不能发生该类反应,如:值得说明的是,双烯体的2,3位有取代基对Diels-Alder反应不形成位阻,合适的取代基还能促使双烯体取顺式构象,此时对反应有利。
人名反应--Diels—Alder反应

Diels-Alder反应王亮大连大学环化学院化工系大连 116022摘要:自从1928年Diels和Alder报道环戊二烯与顺丁烯二酸酐的环加成反应后,Diels-Alder反应,几十年来一直吸引着有机化学家们的广泛兴趣。
这个反应为合成六元环化合物提供了一条简单的途径。
不仅产率高,而且反应的立体专一性和定位选择性强,成为有机合成中一个十分重要的反应。
本文对Diels-Alder反应的发现背景、相关原理及应用价值作一总结,使人们更好地了解Diels-Alder反应。
关键词:六元环背景原理应用1.发现背景Diels-Alder反应,又名双烯合成,由共轭双烯与烯烃或炔烃反应生成六元环的反应。
是有机化学合成反应中非常重要的碳碳键形成的手段之一,也是现代有机合成里常用的反应之一。
该反应是1928年由德国化学家奥托·迪尔斯(Otto Paul Hermann Diels)和他的学生库尔特·阿尔德(Kurt Alder)发现的,他们因此获得1950年的诺贝尔化学奖。
最早的关于狄尔斯-阿尔德反应的研究可以上溯到1892年。
齐克(Zinke)发现并提出了狄尔斯-阿尔德反应产物四氯环戊二烯酮二聚体的结构;稍后列别捷夫(Lebedev)指出了乙烯基环己烯是丁二烯二聚体的转化关系。
但这两人都没有认识到这些事实背后更深层次的东西。
1906年德国慕尼黑大学研究生阿尔布莱希特(Albrecht)按导师惕勒(Thiele)的要求做环戊二烯与酮类在碱催化下缩合,合成一种染料的实验。
当时他们试图用苯醌替代其他酮做实验,但是苯醌在碱性条件下很容易分解。
实验没有成功。
阿尔布莱希特发现不加碱反应也能进行,但是得到了一个没有颜色的化合物。
阿尔布莱希特提了一个错误的结构解释实验结果。
1920年德国人冯·欧拉(von Euler)和学生约瑟夫(Joseph)研究异戊二烯与苯醌反应产物的结构。
他们正确地提出了狄尔斯-阿尔德产物结构,也提出了反应可能经历的机理。
diels-alder反应机理

Diels-Alder反应是一种典型的烷基共轭加成反应,由德国化学家Diels 和Alder 在1928 年发现,是一种重要的有机合成反应,其机理如下:
Diels-Alder反应由一个具有4n+2 个π电子的底物(双烯或双炔)和一个具有2n π电子的二烯丙基底物(二烯)在催化剂的存在下反应生成六元环化合物的加成反应。
在反应中,二烯与双烯或双炔发生亲电性加成,形成一个带有反应中间体的共轭系统。
在加成过程中,二烯中的一个烯丙基碳原子被负电荷亲攻,双烯或双炔中的一个烯碳原子带正电荷,进行亲电性的反应,形成一个反应中间体。
接下来,反应中间体经历一个轮转的过程,形成一个四元环中间体。
这个过程中,原来的二烯丙基碳原子上的电子被向反应中间体的另一个烯丙基碳原子移动,同时产生了一个烷基键和一个新的烯键。
这个四元环中间体是Diels-Alder反应的关键中间体。
最后,通过一个轮转步骤,六元环化合物形成。
在这个步骤中,四元环中间体中的烯键与双烯或双炔中的烯键结合,产生了新的碳碳键,同时双键被裂解成两个单键。
总的来说,Diels-Alder反应的机理可以概括为以下几个步骤:亲电性加成、轮转、四元环中间体的生成、轮转、六元环化合物的生成。
丁二烯 diels-alder反应 反应条件

丁二烯是一种常见的不对称双烯烃,由于其结构的特殊性,使其在有机合成中具有重要的地位。
丁二烯分子中存在着两个共轭的烯基,这种分子结构使得它可以参与许多有机反应,其中最著名的就是Diels-Alder反应。
Diels-Alder反应是一种重要的环加成反应,由德国化学家Diels和Alder于1928年首次发现,因此得名。
这种反应能够将含有烯丙基和双烯基的两种亚体以加成方式连接成为一个环烷基化合物。
在许多有机合成反应中,Diels-Alder反应是制备六元环化合物的主要方法之一。
丁二烯是这种反应中最重要的反应物之一,下面我们将讨论丁二烯Diels-Alder反应的反应条件。
1. 气相条件:在气相条件下,通常采用丁二烯与烯丙基芳烃类化合物(如苯乙烯、甲苯乙烯等)或是丙烯酰苯等进行Diels-Alder反应。
在该条件下,通常需配合使用金属催化剂,如钌、铑和钯等金属催化剂。
反应温度一般为室温至60℃之间。
对于不同的底物,选择合适的金属催化剂和反应温度可以有效提高反应的选择性和产率。
2. 溶液条件:在有机溶剂中进行Diels-Alder反应时,通常会选择一些极性较小的溶剂,如苯、甲苯、二甲基亚砜等。
这些非极性溶剂对于反应物和产物都具有良好的溶解性,有利于反应的进行。
添加一些活性氢化合物促进反应的进行,如对二甲苯等。
在该条件下,反应通常需要加热到适当的温度,一般为80-120℃之间,也需要设置合适的反应时间,以充分完成反应。
3. 固相条件:固相条件下进行Diels-Alder反应通常选择具有较大的特殊表面积的固体载体作为催化剂底物,反应通常需要在高温下进行。
在工业生产中也可以考虑选择固相反应条件,以降低生产成本,提高反应效率。
4. 催化剂选择:除了金属催化剂外,也有一些非金属催化剂可以用于丁二烯Diels-Alder反应,如有机亚铁、有机钌、磷氮配体等。
这些催化剂在Diels-Alder反应中同样具有良好的催化性能,可以选择性地促进反应进行,提高产物的产率和纯度。
diels-alder反应 常见的亲双烯体

Diels-Alder反应是有机化学中常见的一种重要的环加成反应,它的发现与发展对于有机合成领域具有重要的意义。
Diels-Alder反应常见的亲双烯体包括烯烃和某些芳香化合物。
1.烯烃烯烃是Diels-Alder反应中常见的亲双烯体之一。
其中,共轭烯烃特别适合与受体双烯反应。
1,3-丁二烯是Diels-Alder反应中广泛使用的烯烃。
1,3-丁二烯具有两个共轭的双键,因此它能够与许多受体双烯反应,产生多种不同的环化合物。
2.芳香化合物某些芳香化合物也可以作为Diels-Alder反应的亲双烯体。
在这种情况下,通常需要引入一些特定的取代基来增加反应的亲核性和反应活性。
苯和邻苯二甲酸二酐可以反应生成环己二酮。
而苯和马来酸酐的反应则可以得到苯基丙烯酸酯。
3.反应机理Diels-Alder反应的机理相对复杂,但可以简要概括为烯烃通过π键与亲双烯体发生共轭加成,形成六元环产物的过程。
这一反应通常需要较高的反应温度和合适的催化剂来进行,且在适当的反应条件下,通常具有较高的化学选择性和产率。
4.应用Diels-Alder反应被广泛应用于有机合成领域。
通过合理选择亲双烯体和受体双烯,可以合成复杂的多环和多取代的环化合物。
这对于药物合成、材料化学等领域具有重要的应用价值。
值得一提的是,Diels-Alder反应也常用于构建天然产物的复杂骨架结构。
Diels-Alder反应常见的亲双烯体包括烯烃和某些特定的芳香化合物,它们通过共轭加成反应产生多种多样的环化合物。
Diels-Alder反应在有机化学合成领域具有重要的地位,其机理复杂但有着广泛的应用前景。
通过深入了解亲双烯体的特性和反应条件的选择,可以更好地实现Diels-Alder反应的高效合成。
Diels-Alder反应是有机合成领域中一种重要的环加成反应。
在该反应中,通过烯烃(亲烯体)与受体双烯结合,生成环状产物。
Diels-Alder反应具有高度的化学选择性和产率,因此被广泛应用于有机合成的多个领域。
名人反应

醛酮的制备 加特曼-科特(Gattermann-Koch reaction)反应
以CO及干燥HCl为原料,在无水AlCl3和Cu2Cl2催化下,可在苯 环的电子云密度大的位置上直接引入醛基,此为 加特曼-科特(Gattermann-Koch)反应
R
+ CO + HCl AlCl3 R
R COOAg + Br2 CCl4
R Br + CO2 + AgBr↓
淡黄色沉淀
该反应通过自由基历程,用方程式可清楚地表达这个过程, 见下页:
O
R C OAg + Br2
O R C OBr
O
R C OBr + AgBr
O
R C O + Br 均裂
O R CO
均裂 R
O
R + R' C OBr
+ CO2 O
钠失去一个电子转移到芳环上,生成了一个碳负离子游离基,环上共有 七个电子,其中一个电子在反键轨道上结构不稳定,很容易被质子化, 氨中质子难脱离,醇中的质子很容易脱离,即从乙醇中夺取一个质子生
成σ -配合物自由基,之后再获得电子和质子化生成1.4-环己二烯, 其中间体Ⅰ、Ⅱ、Ⅲ结构都有三个共振式结构。
卤苯参加反应,此反应称Ullmann(伍尔曼)反应。
Br + NaO
Cu
O
4、魏悌希(wittig reaction)反应
a: 合成魏悌希(preparation of wittig reagent)
(C6H5)3P + RCH2Br 苯
+
(C6H5)3P
-
CH2R Br
光催化 diels-alder反应 -回复

光催化diels-alder反应-回复光催化Diels-Alder 反应是一种基于光催化原理的化学反应,在该反应中,光能被用作驱动力来促进Diels-Alder 反应的进行。
这种催化方式与传统的热催化方式相比具有许多优势,包括选择性增加、反应速率的增加以及反应温度的降低等。
本文将一步一步地回答关于光催化Diels-Alder 反应的主题。
第一步:介绍光催化Diels-Alder 反应的基本原理和定义Diels-Alder 反应是一种重要的碳—碳键形成反应,在该反应中,二烯烃受到底物的亲电性攻击形成一个新的环状化合物。
光催化Diels-Alder 反应则利用光能来降低反应的活化能,从而加快反应速率。
光能的吸收可以激发底物中的电子,使其处于高能级的激发态。
这种高能态的底物可以与反应物发生化学反应,形成具有新碳—碳键的产物。
第二步:讨论光催化Diels-Alder 反应的优势和应用光催化反应具有许多优势,这使得它在有机合成领域得到广泛应用。
首先,光催化可以提供较高的选择性。
通过使用特定的光催化剂或控制反应条件,我们可以选择性地催化特定的化学反应路径,从而产生特定的产物。
其次,光催化能够加快反应速率。
由于光能可以直接提供激发能量,因此可以达到较高的反应速率,无需额外的热能。
光催化Diels-Alder 反应在有机合成中也具有广泛的应用。
例如,该反应可用于合成具有多种功能团的复杂有机化合物,如天然产物或药物分子。
光催化反应还可以用于合成含有杂原子的环状化合物,如含有氮、氧或硫等原子的化合物。
第三步:解释光催化Diels-Alder 反应的机理光催化Diels-Alder 反应的机理通常涉及两个关键步骤:吸收光能和反应底物的亲核攻击。
在光吸收步骤中,光催化剂(如有机染料或半导体纳米材料)吸收光能,并将其转化为激发态的能量。
这种能量被传递给底物分子中的双键,使其处于活化态。
在亲核攻击步骤中,活化态的底物受到反应底物的亲核性攻击,从而形成新的碳—碳键。
炔烃拉链反应

炔烃拉链反应炔烃拉链反应(Diels-Alder反应)是一种常见的有机反应,广泛应用于药物、材料以及新能源的合成上。
它的反应机理比较复杂,这也使得它具有极其多面的应用场景,是有机化学研究的重要内容。
炔烃拉链反应(Diels-Alder反应)的发现者是德国的化学家Otto Diels和Kurt Alder,于1928年发现,D-A反应是一种臭氧(ozonide)中间体生成的烯烃-烯烃共价键反应,在此反应中,一个具有亚稳定烯烃中间体添加到另一个反应物中,反应物形成了一个具有烯烃共价键的环状产物。
炔烃拉链反应(Diels-Alder反应)有几个显著的特点,它的反应机理可以被描述为一种共价键构建的反应,其中一种反应物被视为主酸,另一种反应物被视为主基,经过反应产生一种共价键,从而形成一个环状体。
炔烃拉链反应(Diels-Alder反应)有两个重要的步骤,第一步是中间体的生成,在这一步中,两个原始反应物通过共价键作用而构建起中间体,中间体经过反应一定的能量之后,就可以生成最终的产物,这一步称为合成反应,并且此反应对引发剂存在较大的依赖性;第二步是产物的构建,通过在前一步所得的中间体上构建共价键,能够将中间体形成环状体,这一步称为重排反应,这一步中也有一定的反应能量的要求。
炔烃拉链反应(Diels-Alder反应)也具有诸多有利的特点,最常见的特点是它的选择性极强,因此能有用的合成不同结构型的分子,从而达到最大限度地提高反应的选择性;其次,它的反应期非常短,因此不需要上述诸多部分,如固相介质和温控等,而且反应不产生污染物;最后,它可以将许多简单易得的有机物质有效率和高选择性的合成为更复杂的分子。
由于以上特点,炔烃拉链反应(Diels-Alder反应)广泛用于药物、材料以及新能源的合成上,它能有效地合成一些有机结构较复杂的产物,如围绕着PTC盈余拉链反应,也是炔烃拉链反应(Diels-Alder反应)研究的热门方向,PTC盈余拉链反应可以让原材料和终端产物的结构更复杂,从而更加温和、安全。
川芎泽泻的功能主治

川芎泽泻的功能主治1. 川芎•川芎是中草药中的一种,俗称阿魏。
其药材部位为多年生草本植物川芎(Don.)(学名为Angelica sinensis (Oliv.) Diels),属于伞形科植物。
•川芎主要分布于中国长江以北地区,常生长在山间草地和沟谷附近。
川芎的根部被用作药材,其呈棕黄色,断面呈棕黄色至黄棕色。
•川芎因其特殊的药用价值和药效在中医药中得到广泛应用,被誉为“女性之药”。
2. 泽泻•泽泻是中草药中的一种,又名薅盖、东泽泻、泽益。
其药材部位为多年生草本植物泽泻(L.) B.S.P.(学名为Alisma plantago-aquatica L.),属于天南星科植物。
•泽泻主要分布于中国各地湖泊、浅水沼泽、池塘等水域中。
泽泻的根部被用作药材,其根茎呈椭圆形或类喙状,外皮棕褐色。
•泽泻因其独特的功效和药理作用在中医药中应用广泛,被誉为“清利水湿之药”。
3. 川芎泽泻的功能主治•川芎泽泻是中草药中的常用组方,由川芎和泽泻两味药材组成。
川芎泽泻具有多种功能主治,主要包括以下方面:–补血活血:川芎泽泻具有活血化瘀的功效,对于瘀血引起的痛经、月经不调等妇科疾病有良好的疗效。
–利水通淋:川芎泽泻能够有效清利水湿,对于水肿、尿频、尿急、尿痛等泌尿系统疾病有一定的缓解作用。
–补肾益肝:川芎泽泻能够调节肾脏和肝脏功能,对于肾虚及肝气郁结引起的腰膝酸软、失眠健忘等症状有较好的改善效果。
–提神益气:川芎泽泻含有丰富的维生素和矿物质,能够提供身体所需的营养成分,增强体力,提高免疫力。
–缓解肠胃不适:川芎泽泻具有一定的消化道调理作用,可以缓解腹胀、腹痛、消化不良等肠胃问题。
–护肤美容:川芎泽泻能够改善皮肤问题,如黄褐斑、雀斑等,使肤色更加均匀,减少皮肤老化现象。
4. 川芎泽泻的用法用量•川芎泽泻常以药材比例为2:1配伍,具体用法用量如下:–冲服:取川芎10克,泽泻20克,加入适量开水冲服。
–煎服:取川芎10克,泽泻20克,加入适量水煎煮30分钟,取煎液分2-3次服用。
细辛及其混淆品种的鉴别

细辛及其混淆品种的鉴别摘要】本文对细辛的混乱情况从历史渊源到现在的混淆品种进行了初步的归纳和鉴别,发现有20余种混淆品分布于7个科属,并对其药材的真伪进行了性状鉴别。
【关键词】细辛徐长卿杜衡马兜铃科【中图分类号】R282 【文献标识码】B 【文章编号】2095-1752(2013)16-0302-02细辛是常用中药之一。
具有散寒解表,祛风止痛,温肺化痰等功效。
药典规定正品为马兜铃科植物北细节Asarum heterotropoids Fr。
Schmidt var。
mandshuricum(Maxim。
)Kitag。
及华细辛A。
sieboldii Miq。
的带根全草。
由于本品供不应求,经常短缺甚至脱销,因此各地区出现了不少所谓的“土”细辛以代替正品,其混乱情况已有很长的历史。
这些代替品的功效与正品细辛不尽相同,甚至完全不同。
为确保临床疗效,下面将细辛的“土”品种作一归纳,以澄清混乱。
一、细辛混乱的历史渊源细辛,首载《神农本草经》列为上品,其植物形态:“如葵叶,色赤黑,一根一叶相连”。
可能因描述太简单,又无绘图,故后来出现了不少误谬之品。
如《名医别录》于徐长卿条下云:其根正如细辛,小短扁扁尔,气也相似。
这就与细辛开始产生了纠葛。
接着《吴普本草》亦在徐长卿条下指出:后来一些医家,只看须根,不辩花叶茎实,依须根为准,因而又和细辛相混。
徐长卿便成了细辛的第一味混淆品种。
在《图经》细辛条下指出:“今人多以杜衡当之,杜衡吐人,用时须细辨耳。
”并对杜衡的形态作了详细的描述。
《本草衍义》亦云:“杜衡用根,市者往往乱细辛。
将杜衡与细辛相对,便见真伪。
”可见当时将杜衡误作细辛已很普遍了。
李时珍在《本草纲目》中更详细的归纳了当时和历史的细辛混乱情况:“太抵能乱细辛不止杜衡,皆当以根、苗、色、味、细辨之。
叶以小葵,柔茎细根,直而色紫,味极辛者细辛也;叶似马蹄,茎微粗,根曲而黄白色,味亦辛者杜衡也;一茎直上,味辛微苦者,鬼督邮也;似鬼督邮而色黑者,及已也;叶似小桑,根似细辛,微粗长而黄色,味腥而有臊气者,徐长卿也;叶似柳而根似细辛,粗长黄白色而味者,白薇也;似白薇而白直味甘者,白前也。
药用植物学论文范例(5篇)

药用植物学论文范例(5篇)自上世纪六十年代起,随着一些天然植物药的相继研发成功 ,从天然植物中寻找药物或药物先导化合物,成了众多化学工作者从事的热门研究领域之一。
我国植物资源丰富,其中部分植物作为我国的传统中药材,具有悠久的药用历史,为人们的健康做出了重要贡献。
然而,对于其中许多非传统药用植物品种,至今我们尚未知其内的基础物质成分,为了充分发掘这些宝贵的植物资源,对它们的化学成分及成分的生物活性进行研究,为它们的入药提供科学依据,对于发扬我国传统中医药事业显得非常有必要和有意义。
我们在这里为你提供一篇药用植物学论文,希望能帮助到你论文的写作。
关键词:法定药用植物;蕨类法定药用植物;植物基源考证法定药用植物的概念首先在《中国法定药用植物》一书提出,后笔者对法定药用植物的概念作了进一步的论述。
法定药用植物指历版国家标准或各省、自治区、直辖市历版地方标准及其附录收载的药材饮片的基源植物。
植物由于分类系统的变化、种等级分类群的改变、种的鉴定和归并等原因,造成同一植物有多个拉丁学名和中文名的状况,法定药用植物情况也是如此,这也是药材品种混乱的原因之一。
以往有学者对不同地区、不同民族对同一药材使用植物种类不同,同一药材名称各异或同一名称实际药材不同等情况进行过系统考证,但尚未见文献或着作对药材的植物基源由于分类鉴定等原因造成的混乱情况进行过考证研究 .为此,笔者收集了我国以中国药典为代表的收载药材的各类国家标准、全国各省、自治区和直辖市的药材标准120余册,对这些标准收载药材的植物基源进行考订归纳。
现首先报道蕨类法定药用植物基源考证的情况。
1蕨类法定药用植物考证概况我国蕨类法定药用植物共有27科88种,经考证,其中53种基源鉴定清晰,标准所用名称正确规范,不同标准间使用相同的中文名和拉丁学名,所用拉丁学名和中文名与《中国植物志》或Flora of China(以下简称FOC)相同,如扁枝石松Diphasiastrum complanatum (L.)Holub、卷柏Selaginella tamariscina (P.Beauv.)Spring、贯众Cyrtomium fortune J.Sm.等。
当归的作用功能主治是什么

当归的作用功能主治是什么1. 什么是当归当归是中药中十分重要的一种草药,其学名为Angelica sinensis (Oliv.) Diels,属于伞形科植物。
当归主要生长在中国东北、四川、云南等地。
它的根部是药用部分,具有多种药用价值。
2. 主要成分当归根具有特殊的香气,含有多种活性成分,包括挥发油、川芎酮、异黄酮类、纤维素、氨基酸和维生素等。
其中最具活性和药用价值的成分是川芎酮和异黄酮类物质。
3. 当归的作用与功能当归具有多种作用与功能,主要包括:3.1 补血活血当归是一种补血的药材,常被用于治疗贫血和月经不调等相关疾病。
当归中的挥发油和川芎酮能够促进血液循环,增加红细胞数量,改善贫血状况。
3.2 调经止痛当归在中医中有很重要的地位,被广泛应用于调理女性的月经问题。
当归能够活血化瘀,舒经止痛,对于痛经、月经不调等问题有较好的疗效。
3.3 抗氧化当归富含异黄酮类物质,具有较强的抗氧化能力,可以抑制体内自由基的产生,减少氧化应激损伤。
氧化应激是很多疾病发生的重要原因之一,如心脑血管疾病、肿瘤等,当归的抗氧化作用有助于预防这些疾病的发生。
3.4 免疫调节当归中含有多种活性物质,可以调节免疫系统功能,增强机体的免疫力。
当归中的活性成分能够提高机体的抗体水平,增强免疫细胞的活性,增加机体的抗病能力。
4. 主治疾病基于当归的作用与功能,它被广泛应用于中医领域,主要用于治疗以下疾病:4.1 女性疾病当归具有调经止痛的功效,常被用于治疗痛经、月经不调、功能性子宫出血等问题。
它能够活血化瘀,调理女性生理机能,对于经期不适、月经量少等问题也有一定的辅助治疗作用。
4.2 贫血当归是一种常见的补血药材,用于治疗贫血症状。
它可以促进红细胞生成,增加血红蛋白含量,改善贫血状况。
4.3 免疫调节当归可以调节免疫系统功能,增强机体的抵抗力,常被用于提高免疫力,预防感冒和其他免疫相关疾病。
4.4 心脑血管疾病当归具有抗氧化和血液循环促进的作用,可以保护心脑血管系统的健康。
狄尔斯-阿尔德反应实用PPT文档

当双烯和亲双烯体两者都有适当的取代基,使反应可能发生不同区位而得到两种产物时,事实上只有一种是主要的。 狄尔斯-阿尔德反应(Diels-Alder reaction)实质上是一种环加成反应。 南京科技职业学院高材1451班陈中山 例如异戊二烯与丁烯酮反应,以得到甲基-(4-甲基-3-环己烯基)甲酮为主, 在立体化学方面,这类反应都是顺式加成的,而且当反应
狄尔斯-阿尔德反应(Diels-Alder
reaction)实质上是一种环加成反应。共轭 双烯与取代烯烃(一般称为亲双烯体)反 当双烯和亲双烯体两者都有适当的取代基,使反应可能发生不同区位而得到两种产物时,事实上只有一种是主要的。
共轭双烯与取代烯烃(一般称为亲双烯体)反应生成取代环己烯。 反应机理是根据很多实验事实总结后提出的,它有一定的适用范围,能解释很多实验事实,并能预测反应的发生。
狄尔斯-阿尔德反应
狄尔斯-阿尔德反应是共轭双烯体系与 烯或炔键发生环加成反应而得环己烯或1,4环己二烯环系的反应。1928年德国化学家 O.P.H.狄尔斯和K.阿尔德在研究丁二烯与顺 丁烯二酐作用时发现这类反应:在这类反应 中,与共轭双烯作用的烯烃和炔烃称为亲双 烯体,亲双烯体上的亲电取代基(如羰基、 氰基、硝基、羧基等)和共轭双烯上的给电 子取代基都有使反应加速的作用。
的环分解反应叫做逆狄尔斯-阿尔德反应或 物有可能生成内型和外型两种产物时,一般只得内型化合物,例如环戊二烯与顺丁烯二酐的反应。
逆Diels-Alder反应。
反应机理
No (2)双烯体1,4位取代基位阻较大时,不能发生该反应。
(1)双烯体的两个双键必须取S-顺式构象。 南京科技职业学院高材1451班陈中山
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
表 明 , 在 水 相 D A反 应 中加 入 Lc 、 一 环糊 精 等 , 若 — ilB 由于 外 加 组 分 的 进 入 增 加 了疏水 效 应 , 反应 速
率 大大 加 快 . 如 , 例 分子 内的 D A 反应 : — O
0 H— H
\ /s > <
加 入 B 环 糊精 时产 率 为 9 % , 一 l 不加 时 产率 仅 为 2 %. 0 12离 子 液体 中 的 D . —A反 应
H O
S. .S
\/
简单 地 说 , 子 液体 就 是 完 全 由离 子组 成 的 液 , 如熔 融 状 态下 的 N C . 子 液 体通 常 在高 温下 离 例 aI 离 存在 , 但通 过 选 择合 适 材 料可 以制得 室 温 离 子液 体 . 如 把 N 例 一烷 基 吡 啶盐 加 到 A C 11 中并 稍许 加 热 , 固 体混 合 物 就 能 立 即变 成离 子 液 体 流 体 . 常用 的室 温离 子 液 体 是含 有 机 正 离 子 的物 质 . 最 它们 或 是有 机 盐 或 是 至少 包 含 一种 有 机组 份 的混 合 物 , 烷 基 铵盐 、 如 烷基 磷 酸 盐 、 一 烷 基 吡 啶和 N, 二 烷基 N N一 咪 唑 阳离 子等 . 目前 离 子液 体正 受到 人们 日益广 泛 的重 视 , 因为离 子 液体 作 为有 机 反应 的介 质具 有 以下 优 点 : 不
Dil— Ale 反 应 再 认 识 eS dr
姚 焕 英
( 南 师 范 学 院 化 学 系,陕 西 渭 南 7 4 0 ) 渭 100
摘 要 : 简单介 绍 了绿 色介 质 ( 、 水 离子液 体 ) 中进 行 的 D es le 反 应 的特 点 以及 反 il —A d r 双烯 合成 在有 机 化 学 中的 应 用前 号.
收稿 日期 :0 —1 2 01
作者简介 :  ̄
(92 )女 , 16 一 , 陕西渭南人 , 渭南师范学院化学 系讲师.
维普资讯
第 2期
姚焕英: il Ad r D es le 反应 再认 识 -
4 7
水 相 中 D—A 反应 的 速 率 之 所 以较 在 有 机 溶剂 中 快 , 主要 是 疏 水 效 应 和 氢 键 作 用 的结 果 . 究 研
点.
例如 , ,一 戊 二烯 与 丁烯 酮 在 水相 中发生 D l3 环 —A 反应 的速 率 比异 辛烷 中快 7 0倍 , 4 比甲酸 中快 5 8倍.
+ ]OH - C3 C
+
c
又如 双键 上 连 有 吸 电子 基 因 的亲 双烯 体 与共 轭 二烯 酸 盐 ( = a 在 水相 中发 生 D RN) —A 反应 时 , 室 温反应 5小 时产 率 就 能达 到 10 ; 0 % 而在 苯 ( E ) R= t 中进行 时 , 室温 反应 2 8小 时 产 率仅 为 5 %. 8 8
维普资讯
第 1 6卷 第 2期 20 0 2年 6月
商 洛师 范专 科 学 校 学 报
Ju n lo h n lo T a h r o e e or a fS a gu ec es C U g
Vo1 1 No2 .6 .
J n .0 2 u e2 0
0R
再 如 以 S ( T , 催 化剂 ,萘 醌与 环 戊 二烯 在 T F H O 中进 行 的 D c O0为 H— : —A 反 应 ,不 仅 产 率 高
( 3 , 立 体选 择性 好 (0 %内 向型产 物 ) 9 %)且 10 . O
+
0 0
0
( 向型 1o ) 内 o%
11水 相 中的 D . —A反 应
早在 2 0世 纪 三十 年 代就 有 人 发 现水 可 以作 为 D —A反 应 的 溶剂 , 由于反 应 物在 其 中 的溶 解 性 但 较差 , 致使 水相 中的 D —A 反应 没 有得 到 重视 . 到 2 直 0世 纪 8 0年代 大 量 研究 表 明 : 相 中 的 D 水 —A 反 应不 仅 可 以在 分 子 间 发生 , 能 在 分 子 内进 行 , 还 且具 有 反 应 速 率 快 、 立体 选 择 性 高 、 环 境 友 好 等 优 对
1 色 介 质 中进 行 的 D A 反 应 绿 D
传统 的 D A反应 大 多 是 在 有机 溶剂 中进行 的. 对 有 机溶 剂 产 生 的污 染 , — 针 寻找 绿色 替 代 溶 剂 便 是重 要研 究 内容. 目前 作 为 D A反 应 的绿 色替代 溶 剂 有水 、 — 离子 液 体 等.
De - Adr 应 ( 称 D i s le 反 l 简 —A 反 应 ) 1 2 是 9 8年 由德 国 的 化 学 家 D e i s和 A d r 人 发 现 的 有 机 l le 两 化学 中非 常重 要 的一 类 反应 .— A反 应是 指 含 共轭 二烯 结 构 的 双烯 体 和含 不饱 和键结 构 的 亲双 烯 体 D 通 过 l 4 加 成得 到 环状 烯 烃 , 又 称 为双 烯 合成 反 应. 实 质 是 双 烯体 和亲双 烯 体 通 过协 同作 用 进 ,一 故 其 行 的[+ 1 加 成 反 应 . 反 应 具 有 适 应 范 围广 、 择 性 高 、 途 广 泛 、 子 经 济 性 高 ( 子 利 用 率 为 4 2环 该 选 用 原 原 lO 等特 点 , 其 是绿 色 介 质 中进行 的 D O %) 尤 —A反 应更 是 人们 关 注 的热点 .
关键 词 : e - A d r Dis le 反应 ; l 离子液 体 ; 双 烯合 成 ; 0 反 C6 中 图分类 号 : 6 21 0 3 .5 文 献标 识码 : A 文 章编 号 :0 8 3 3 (0 2 0 — 0 6 0 10 — 0 0 2 0 )2 0 4 — 4
