使用 Exiqon 在线工具设计 mRNAncRNA 引物
snorna 引物设计流程

snorna 引物设计流程snorna是一类非编码RNA,其主要功能是在转录后修饰和加工rRNA 和snRNA。
为了研究snorna的功能和机制,需要进行snorna引物的设计。
下面将介绍snorna引物设计的流程。
1. 确定snorna序列:首先需要确定研究的snorna序列。
可以通过文献检索、数据库查询等方式获取目标snorna的序列信息。
2. 引物设计原则:在进行snorna引物设计时,需要遵循一些基本原则。
首先,引物的长度应该在18-25个碱基对之间,以确保特异性和敏感性。
其次,引物的GC含量应在40%-60%之间,以保证引物的稳定性。
此外,还需要避免引物之间的自身互补性和异源互补性。
3. 引物设计工具:为了方便snorna引物的设计,可以使用一些在线引物设计工具,如Primer3、NCBI Primer-BLAST等。
这些工具可以根据用户输入的snorna序列,自动设计合适的引物。
4. 引物特异性检验:设计好引物后,需要进行引物特异性检验。
可以使用BLAST等工具,将引物序列与相关数据库进行比对,判断引物的特异性。
引物的特异性越高,说明其在目标snorna上的结合效果越好。
5. 引物合成:合成合适的snorna引物后,可以选择将其合成或购买商业合成的引物。
引物的合成需要选择可靠的合成厂家,确保引物的质量。
6. 引物验证:合成的snorna引物需要进行验证。
可以通过PCR扩增、实时荧光定量PCR等方法,验证引物的特异性和敏感性。
同时,也可以通过Northern blot等方法,检测snorna在不同组织或条件下的表达情况。
7. 引物优化:在验证过程中,如果发现引物存在特异性不好、敏感性不高等问题,可以进行引物的优化。
可以尝试调整引物的长度、GC含量等参数,或者设计新的引物,以提高引物的性能。
总结:snorna引物的设计是研究snorna功能和机制的重要步骤。
通过确定snorna序列、遵循引物设计原则、使用引物设计工具、进行引物特异性检验、引物合成、引物验证和引物优化等步骤,可以设计出合适的snorna引物。
LncRNA引物设计-十年资深qPCR引物设计经验分享及常用LncRNA数据库介绍

LncRNA引物设计-⼗年资深qPCR引物设计经验分享及常⽤LncRNA数据库介绍LncRNA引物设计-⼗年资深qPCR引物设计经验分享及常⽤LncRNA数据库介绍LncRNA的qPCR引物如何设计?在设计的时候有没有需要特别注意的地⽅?如何能设计出最好的qPCR引物。
基于这些问题,总结⾃⼰10年qPCR引物设计经验分享给⼤家。
LncRNA的qPCR引物相⽐于编码基因,是要复杂。
导致其复杂的原因并不是引物设计原则上有特别之处,⽽是在于有太多的LncRNA数据库,数据库之间往往没有关联,且不同数据库的维护也不尽相同。
今天的⽂章分两块:LncRNA数据库介绍和LncRNA引物设计注意事项。
LncRNA数据库介绍1、NCBIRefSeqNCBI不多做介绍,通常LncRNA信息我们参考RefSeq数据库中的数据,RefSeq数据库中的数据参考数据,是经过⼈⼯审核,其数据信息可信,注释全⾯。
RefSeq数据库中LncRNA的命名通常是NR_或者XR_开头,后⾯加数字,其外显⼦信息位置,数量信息⾮常完整。
2、Ensembl相同的LncRNA,Ensembl数据库中信息往往要⽐NCBI多很多,特别是转录本数量。
且数据变化⾮常快且变化会很⼤,可能昨天浏览这个数据库中某个LncRNA只有2个转录本,隔天再去看的时候,可能就变成3个甚⾄更多。
NCBI就不同,尽管更新频率也⾮常的快,但是LncRNA的变化通常很⼩,转录本数量基本不变化,序列变化的可能性也⾮常的⼩。
3、UCSCUCSC数据库的LncRNA数据个⼈认为更新相对较慢,但有些LncRNA名称如uc001ylu就需要前往UCSC数据库查询其序列信息。
UCSCGenomeBrowser可以根据基因组的位置、基因ID、转录本等信息进⾏浏览查询。
4、RNAcentralRNAcentral整合了包括Ensembl、GENCODE、Greengenes、HGNC、LNCipedia、lncRNAdb、miRbase、NONCODE、RDP、RefSeq、Rfam、SILVA在内的多个数据库。
4 Exiqon公司miicroRNA LNA实时定量PCR探针

Exiqon公司LNA microRNA的PCR系统丹麦Exiqon公司的新型miRCURY TM LNA microRNA PCR系统能够快速、精确、灵敏地对microRNA进行定量,它所使用的是基于SYBR Green检测法的microRNA特异的实时定量PCR方法。
该系统是由以下三部分组成:miRCURY TM LNA 第一链(First-strand)cDMA KitmiRCURY TM LNA SYBR Green master mixmiRCURY TM LNA microRNA引物组这个系统提供了所有必需的组份,并对实时定量PCR实验的反应体系作了优化,确保对微量样本如10pg的总RNA也能达到很好的效果,可靠的检测底限为10个拷贝的microRNA。
这个系统提供了各种高品质的引物组,所有的microRNA引物都能确保获得低背景、高特异性和高灵敏度的结果。
miRCURY TM LNA microRNA的PCR系统主要优点:●灵敏度高✧即使样品的总RNA少于10pg,或者只来自一个细胞的总RNA都可用于实验。
✧可靠的检出少于10个拷贝的microRNA。
●线性范围广✧可精确定量的线性范围超过8个数量级。
✧可靠的检测同一样本中高表达和低表达的microRNA。
●特异性高✧具有单碱基差异的识别能力,能够特异的区分序列相近的microRNA家族成员。
✧能够区分microRNA成熟体和前体。
●重复性好✧两次实验之间的相关性超过98%。
●完全经过验证的microRNA实验✧高品质的基于LNA专利技术的microRNA特异引物组。
●快速可靠✧简单的两步法实验,能够在三小时内完成。
✧短PCR引物能够降低引物错配或二聚体形成的风险。
✧能够对microRNA进行高通量的分析。
快速稳健的聚合酶链反应程序miRCURY TM LNA microRNA PCR系统结合了LNA专利技术、SYBR Green染料和简单的两步法反应,包括从总RNA中对microRNA 进行特异的反转录以及进行实时定量PCR实验。
AnnotatedLncRNA的实时定量PCR引物设计教程
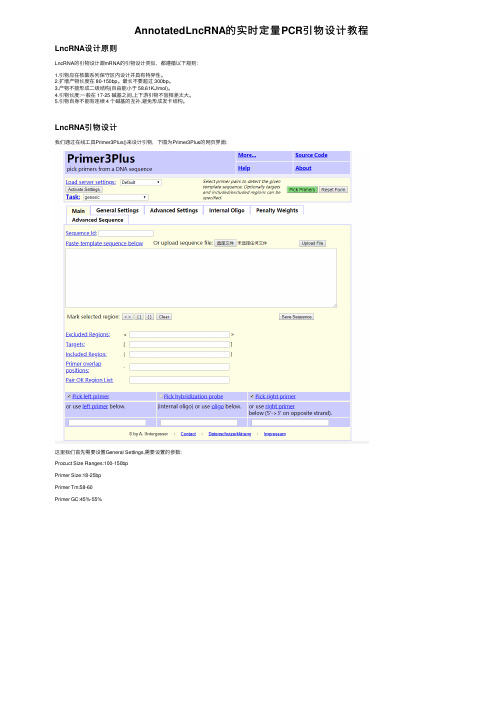
AnnotatedLncRNA的实时定量PCR引物设计教程LncRNA设计原则LncRNA的引物设计跟mRNA的引物设计类似,都遵循以下规则:1.引物应在核酸系列保守区内设计并具有特异性。
2.扩增产物长度在 80-150bp。
最长不要超过 300bp。
3.产物不能形成⼆级结构(⾃由能⼩于 58.61KJ/mol)。
4.引物长度:⼀般在 17-25 碱基之间,上下游引物不宜相差太⼤。
5.引物⾃⾝不能有连续 4 个碱基的互补,避免形成发卡结构。
LncRNA引物设计我们通过在线⼯具Primer3Plus()来设计引物,下图为Primer3Plus的⽹页界⾯:这⾥我们⾸先需要设置General Settings,需要设置的参数:Procuct Size Ranges:100-150bpPrimer Size:18-25bpPrimer Tm:58-60Primer GC:45%-55%设置完成后点击Load Settings,然后开始输⼊LncRNA的fasta序列,我们输⼊⼀个annotated的LncRNA序列:>ENST00000487094.1 GAGCAGGGAGGCTGCGGTGGATCAGCTGCCTGCTGTCTCTGACTGGAAGCCACTACCTTTAGGGCAGGGACTCCGACTACTTCACTCGCCACCGGATCATCTGGGTTTTGAAGAAACCAAGATGC然后点击绿⾊的Pick Primers,就能得到以下的引物序列:这⾥⼀共出来了5对引物,我们随便选择⼀条LncRNA的引物,这⾥我们选择第⼀条引物:TCCCACGATGATCCTGAGGTTGTTCCACAACGTCCTCACCLncRNA引物特异性分析⽹页⼯具:NCBI Blast ()1.将上下游引物复制过去2.勾选Standard databases(nr etc.):选项3.物种选择human (taxid:9606)4.勾选Somewhat similar sequence(blastn)选项5.点击BLAST然后得到以下结果:发现与AC011294.3匹配度为100%,与其他的最多为52%,⽽我们的LncRNA注释为AC011294.3,所以引物设计没有问题!。
mrna制备方法

mrna制备方法mRNA(messenger RNA)是一种重要的生物分子,它在细胞中起着转录和翻译的关键作用。
研究人员通过制备mRNA,可以在细胞内引入特定的基因信息,从而实现基因表达的调控和治疗目的。
本文将介绍一种常用的mRNA制备方法。
一、mRNA制备方法的基本原理mRNA制备方法的基本原理是通过体外转录反应,将DNA模板转录成mRNA分子。
这个过程主要依赖于RNA聚合酶的作用,该酶能够识别DNA模板上的启动子序列,并在这些序列的诱导下合成与DNA模板相对应的mRNA分子。
在转录反应中,还需要提供适当的酶促反应条件、核苷酸三磷酸(NTPs)和其他辅助因子。
二、mRNA制备方法的步骤1. DNA模板准备:首先需要准备含有目标基因的DNA模板。
这可以通过PCR扩增、基因克隆等方法获得。
确保DNA模板的纯度和浓度适当是成功的关键。
2. 启动子设计:选择一个适当的启动子序列用于mRNA的转录。
启动子一般位于DNA模板上游,可以通过在线数据库或相关文献中获取合适的启动子序列。
3. RNA聚合酶和辅助因子的选择:根据实验需要选择适当的RNA 聚合酶和辅助因子。
常用的RNA聚合酶包括T7 RNA聚合酶、SP6RNA聚合酶和T3 RNA聚合酶等。
辅助因子如Mg2+和酶聚合物也需要根据实验要求加入。
4. 反应体系的构建:将DNA模板、RNA聚合酶、辅助因子和NTPs按照一定比例混合,构建反应体系。
注意保持反应体系的稳定性和适当的pH值。
5. 转录反应的进行:将反应体系置于适当的温度和时间条件下进行转录反应。
反应时间一般在1-6小时左右,具体时间根据RNA聚合酶的选择和实验要求而定。
6. RNA纯化:转录反应结束后,需要对反应混合液进行RNA纯化。
常用的方法包括酚/氯仿提取、柱层析和琼脂糖凝胶电泳等。
纯化后的mRNA可用于后续实验。
三、mRNA制备方法的应用领域mRNA制备方法在生物学研究和基因治疗等领域有着广泛的应用。
长链非编码rna引物设计方法

长链非编码rna引物设计方法
自动化长链非编码RNA(lncRNA)引物设计方法在最近几年已经被广泛研究和利用。
这些设计方法允许无需任何化学组装,就可以用一个引物对RNA片段进行定量测序。
这些方法可以大大提高检测时间,并且可以在比原始metagenomic和metatranscriptomic测序方法更完整的基础上对RNA序列进行鉴定。
一种典型的自动化lncRNA引物设计方法是基于统计预测模型的计算方法,这些模型基于基因表达和结构数据,将不同的RNA结构特征纳入考虑。
根据这些模型,引物设计器将给出一组候选引物,其中的每个引物都可以较有效地结合到特定的RNA结构上。
自动化lncRNA引物设计软件工具也提供了一个交互式界面,可以让用户按照他们自己的标准选择和定制RNA探针,例如乌克兰莱特探针(Ligase Detection Reaction,LDR),DNA核苷酸损耗探针(DNA nucleotide depletion,DND)以及分子选择等技术。
引物设计工具还能够根据一定的筛选条件(例如Tm温度)来设计复杂的引物编码序列,以及在没有任何实验支持的情况下,可以使用仿制序列来分类lncRNA的RNA核苷酸和氨基酸分子。
Primer-Blast在线引物设计工具

Primer-Blast:在线引物设计工具生物信息学引物设计用于PCR 聚合酶链式反应⏹PCR:Polymerase Chain Reaction⏹PCR 是一种用于放大扩增特定的DNA片段的分子生物学技术,它可看作是生物体外的特殊DNA复制,PCR的最大特点,是能将微量的DNA大幅增加。
Why PCR?⏹在某个特定物种内1.qPCR用于测定mRNA表达量:mRNA/cDNA水平2.基因克隆:基因水平——引物设计的要求:引物在该基因组内或cDNA库中具备特异性⏹在一个已知基因序列的基因组A内设计引物,然后在另一个还未基因注释的(近缘)基因组B内扩增引物——引物设计的要求:(1)引物在该A基因组内或cDNA 库中具备特异性,并且(2)引物在A和B内是保守的,所以设计的引物在A基因组内往往处于基因的编码区域(编码区域在不同物种间比非编码区更保守)How to do PCR?变性退火延伸How: 引物设计原则⏹退火温度(Tm):两个引物的Tm值相差不能大于5℃,扩增产物与引物的Tm值相差不能大于10℃决定引物退火温度Tm值的最主要因素是引物长度Tm = 4*(G+C)+ 2*(A+T)⏹碱基组成(G+C含量):40%~60%,4种碱基要分布均匀⏹引物长度⏹不能有大于3bp的方向重复序列或自身互补序列存在⏹一个引物的3’末端序列不能结合到另一个引物的任何位点上⏹不要有局部的GC rich或AT rich(特别是3’端),避开T/C或A/G的连续结构较基础全面的引物设计解说Primer Design/GenWeb/Molecular/seq_anal/primer_design/primer_design.htm常用引物设计软件⏹Primer Premier 6 (P6)⏹Beacon Designer 8NCBI Primer-Blasthttps:///tools/primer-blast/index.cgi?LINK_LOC=BlastHome⏹NCBI Primer-Blast: Finding primers specific to your PCR template (using Primer3 and BLAST)⏹能在线设计引物,并验证设计好的引物。
手把手教你做PCR引物设计

手把手教你在线做PCR引物设计POST by Bingsen Xu前言:我是刚刚注册到丁香园,在PCR技术讨论版看见置顶贴,“请求助引物设计的战友先进来这里!”稍微浏览了一下,发现很多朋友对PCR引物设计还不是很熟悉,我愿意把自己积累的一点引物设计方面的经验和大家分享,希望不会做引物设计的朋友看完之后,可以不用再发求助贴而是自己动手做引物设计或者引物检验。
开始之前:其实非常简单,不需要你下载任何软件,但是你得有一台电脑能上网。
当然,最重要的是,你要很清楚用于做引物的模板序列,至于怎么找模板序列,不再本贴的讨论范围。
另外,要先对PCR目的序列的长度有个大致估计,好了,马上开始吧:第一步:找到Primer3的站点。
你不用记住这个站点,但是要记住“Primer3”这个词,然后打开GOOGLE首页,输入Primer3,跳出来的第一个项目就是了“Primer3 Input 0.4.0 (primer3-web/htdocs/input-040.htm)”网址是/。
第二步:贴上模板序列。
进入Primer3站点,可以看到一个引物设计的界面。
(附件Word文档里有图)在“Paste source sequence below (5'->3'…..”下面的大空框里面把你的模板序列粘帖进去。
注意是5'->3'方向的,数字或者空格都没关系,软件会自动过滤的。
第三步:重要参数设定。
首先是“Product Size Ranges”,如果你不希望软件给你随便做的话,首先要调整的就是这个参数。
默认的参数实际上是从100到1000,这个你得自己改,如果你希望产物的大小符合你的预期,尽可能把范围改小,比如480-500,具体看情况调整。
第二个参数是“Primer Size”,默认值一般可以用,但是,当你用熟了这个软件,你自己就知道该怎么改了。
第三个参数是”Primer Tm”这个和Primer Size差不多。
PCR引物设计及软件使用技巧

PCR引物设计及软件使用技巧PCR引物设计及软件使用技巧PCR(聚合酶链反应)是一种重要的分子生物学技术,在基因测序、基因突变检测、基因定量等领域具有广泛的应用。
而PCR引物的设计是PCR反应成功与否的关键因素之一。
本文将介绍PCR引物设计的原理和方法,并向读者介绍一些常用的PCR引物设计软件及其使用技巧。
一、PCR引物设计的原则和策略PCR引物设计的目标是选取一对特异性的引物,使其能在目标DNA序列的两侧结合并扩增出特定的DNA片段。
PCR引物的设计应遵循以下原则和策略:(一)特异性PCR引物应与目标DNA序列特异结合,避免与其他非目标DNA 序列结合产生非特异性扩增。
为了确保特异性,引物的设计中应避免高度保守的序列,尽量选择低度保守区域。
(二)长度和GC含量PCR引物的长度通常应在18-30个碱基对之间,过短会降低特异性,过长可能会导致扩增效率降低或产生非特异性扩增。
另外,引物的GC含量应在40%-60%之间,过高或过低都会影响扩增效果。
(三)避免二聚体和内外引物二聚体PCR引物设计时应避免引物之间以及引物与内外引物之间形成二聚体。
二聚体会影响引物的特异性和扩增效率,甚至导致PCR反应失败。
因此,引物设计时可以利用一些在线工具进行二聚体分析。
(四)避免引物间的交叉杂交和截断引物引物间的交叉杂交会导致非特异性扩增,而截断引物会导致扩增结果缺失或产物截断,因此引物设计时应避免以上情况的发生。
(五)引物间距和末尾相对于PCR引物的设计目标,引物间距相对固定,一般为100-500bp之间。
此外,引物的末端设计也要考虑,如添加限制性酶切位点、引入位点或尾部,以方便后续的克隆操作。
二、PCR引物设计的方法PCR引物设计可以采用多种方法,如序列比对、限制性酶切位点分析、引物簇设计等。
下面介绍一些常用的PCR引物设计方法。
(一)序列比对法序列比对法是一种简单易行的PCR引物设计方法。
通过将目标序列与参考序列进行比对,找出保守区域来设计引物。
(精编资料推荐)一步一步教你使用 NCBI 查找DNA、mRNA、cDNA、Protein、promoter、引物设计、BLAST 序列比

一步一步教你使用NCBI 查找DNA、mRNA、cDNA、Protein、promoter、引物设计、BLAST 序列比对等最近看到很多战友在论坛上询问如何查询基因序列、如何进行引物设计、如何使用BLAST 进行序列比对……,这些问题在NCBI 上都可以方便的找到答案。
现在我就结合我自己使用NCBI的一些经历(经验)跟大家交流一下BCBI 的使用。
希望大家都能发表自己的使用心得,让我们共同进步!我分以下几个部分说一下NCBI 的使用:Part one 如何查找基因序列、mRNA、PromoterPart two 如何查找连续的mRNA、cDNA、蛋白序列Part three 运用STS 查找已经公布的引物序列Part four 如何运用BLAST 进行序列比对、检验引物特异性特别感谢本版版主,将这个帖子置顶!从发帖到现在,很多战友对该帖给与了积极的关注,在此向给我投票的(以及想给我投票却暂时不能投票的)各位战友表示真诚的感谢,谢谢各位战友!请大家对以下我发表的内容提出自己的意见。
关于NCBI 其他方面的使用也请水平较高的战友给予补充First of all,还是让我们从查找基因序列开始。
第一部分利用Map viewer 查找基因序列、mRNA 序列、启动子(Promoter)下面以人的IL6(白细胞介素6)为例讲述一下具体的操作步骤1.打开Map viewer 页面,网址为:/mapview/index.html 在search 的下拉菜单里选择物种,for 后面填写你的目的基因。
操作完毕如图所示:2.点击“GO”出现如下页面:3.在步骤二图示的右下角有一个Quick Filter,下面是让你选择的几个复选框,在Gene 前面的小方框里打勾,然后点击Filter. 出现下图:说明一下:1、染色体的红色区域即为你的目的基因所处位置。
2、下面参考序列给出了三个,是不同的部门做出来的,经我验证,序列有微小的差异,但总体来说基本相同。
实时定量PCR引物和探针设计操作步骤Primer Express软件

实时定量PCR引物和探针设计操作步骤Primer Express软件Primer Express 是实时定量PCR引物和探针设计的专用软件。
遵守以下三个原则有助于快速建立定量PCR反应体系:1.所有扩增按照同样的原则设计 (Primer Express);2.所有PCR反应在ABI PRISM ?7000/7900上使用同样的热循环条件;3.所有反应使用相同的PCR试剂。
引物和探针的设计原则下述原则的重要程度由上往下越来越低,请尽量满足编号靠前的条件。
它们中有的已经在Primer Expre软件中设置成缺省值,有的则需要在选择引物和探针时由设计者加以运用。
如果是设计SYBRGreen 引物,也要选择TaqMan Primer and Probe design并遵守这些规则,但是只需要合成引物就可以了。
TaqMan 探针:1. 保持G-C含量在30-80%之间。
2. 避免同一碱基重复过多。
特别是G,不可超过4个及以上。
3. 5' end不能是G。
4. 尽量使探针中的Cs多于Gs。
如果不能满足,则使用互补链上的探针。
5. 对于单探针反应,用Primer Express?软件计算出来的Tm值应当在68-70 °C 之间。
引物:1. 在探针确定以后再选择引物。
2. 引物要尽可能地接近探针,但是不要重叠。
3. 保持G-C含量在30-80%之间。
4. 避免同一碱基重复过多。
特别是G,不可超过4个及以上。
5. 用Primer Express?软件计算出来的Tm值应当在58-60 °C之间。
6. 3' end 的5个碱基中G and/or C碱基的总数不能超过2个。
实时TaqMan 引物和探针设计Begin by opening Primer Express and selecting "File", "New", and "TaqMan? Primer & Probe Design". The following screen will appear. You can close the TaqMan? Primer & Probe Data box as shown.输入或插入序列Import or paste a sequence into the window (Import shown). To paste a sequence from a Word or text file, first copy it to the clipboard. Be sure to only select the sequence (including numbers or annotations is OK); do not include extraneous information such as accession numbers etc. Next, select "Edit" and "Paste". The sequence will appear in the Sequence screen of Primer Express. Or, to Import a Sequence, click the "Import DNA File" button as shown. The software will then ask you to locate the sequence file. Select it from a folder, hard drive, disk, or desktop. Again, no annotations should be present in this sequence.A file is then imported after selecting the file location.保存输入的序列Select "File" and "Save" to give the sequence a name. This will be displayed in the File Name Box and will save the sequence in the Archive Folder.引物和探针设计参数Click the "Parameters" tab. This displays the Universal default parameters used to search for suitable TaqMan? primer & probe sets for real-time assays. It is strongly recommended that you do not adjust any of the parameters.引物和探针的排序及选择Primer Express is now ready to find Primers and Probes. Click the "Primers" tab, select "Options" and "Find Primers/Probes Now". The software will display the progress in the small window below the sequence.** Please disregard the "Optimal Primer Pairs Only" checkbox and the "Penalty" heading. By checking the Optimal Primer Pairs Only box, you will be severely limiting the range of your search, since the parameters it employs are not based on TaqMan? design guidelines. The Penalty score assigned to your Primer & Probe set is based on factors such as amplicon length. Since the default TaqMan? design parameters keep amplicons under 150 bp, this can be disregarded as well.Primer/probe sets will be listed when the search is complete. Scroll to the right to view the Probes. Click on the "Start" heading under probes to sort probes by sequence. This will group similar probes, simplifying the search.探针的选择Select a probe that is less than 30 bp in length and contains more C's than G's. The probes displayed are on the sense strand only. If the probes displayed do not have more C's than G's, then you will need to use the complement probe (as illustrated in this example). If you need to use the complement, make sure that the probe selected here does not have a C at the 3' end of the probe (otherwise, the complement will have a G at the 5' end ? whichis not allowed).The probe selected meets the first criteria above, but not the second (9 G's, 5 C's). Highlight this probe.Return to the sequence by clicking the "Sequence" tab.Lock in the probe sequence by clicking the Probe Button on the Tool Bar and highlight the probe sequence. The probe will turn green and be displayed in lower case when it is locked.引物选择Find compatible primers by returning to the "Primers" tab, selecting "Options" and "Find Primers & Probes Now". This will find new primer sets that will work with the probe you have selected. You can click on "Start" under Forward Primer to sort the displayed sequences.Search for a primer from the list displayed the meets the following criteria:1.No more than 2 G's and/or C's within the last 5 bases on the 3' end of the primer; and2.No runs of identical nucleotides, especially 4 or more G's.From the list of forward primers displayed, select a primer that has no more than 2 G's and/or C's within the last 5 bases on the 3' end of the primer. Highlight one of the primers that matches this criteria. If no forward primer matches this criteria then select a primer with 3 G's and/or C's. The example shown below matches the criteria and will serve as a suitable forward primer. Once you have selected the appropriate primer click on the "Sequence" tab to return to the Sequence window.Lock the forward primer by clicking the "Forward Primer" button on the toolbar, then highlighting the forward primer sequence. A blue arrow will be displayed under the forward primer showing that it is locked.Click on the "Primers" tab and perform a new search. Scroll to the Reverse Primers displayed and select a reverse primer following the same criteria for forward primer selection (G/C rule on the 3' end of primer).Return to the Sequence page and lock in on the Reverse Primer using the Reverse Primer Tool.This now displays the primers and probe you have selected. Return to the Primers tab and perform one final search to display your results.保存搜索结果Click on "Save List" at the bottom of the screen to save your selection in a tab delimitedformat. Click "Order" to generate an editable/printable text file of your sequences:互补探针的选择In the example above, you must use the complementary probe so as to insure that the probe has more C's than G's. Remember, the probe you use cannot have a G at the 5' end, thus the sense probe used for this search cannot have a C at the 3' end.In order to generate the probe complement, return to the Sequence screen. Highlight the probe sequence, select "Edit", and "Copy Complement". You will not see the complementary sequence at this point; it is copied to the clipboard:Return to the Order window and "Paste" the complement in this window, overwriting the probe displayed. You have the option of editing the primer/probe names, and adding the reporter/quencher dyes to the probe sequence.This document can now be saved and put into a Word document or attached to an e-mail message.在Results Archive中保存搜索结果Your search can also be saved in the Results Archive Folder. Click on the "Results" tab. The forward and reverse primers are displayed in their respective boxes, and the probe sequence is displayed in the "Cycle Params" box The probe sequence displayed is the original strand. To view/save the complementary strand, highlight the probe from the Sequence and select "Copy Complement". "Paste" the complement probe into the "Cycle Params". The complementary probe strand is now displayed. It is important to note that if you leave the Results page, the probe sequence will default back to the original. Each time you returnto the Results page you will need to re-paste the complementary probe strand. Note: The information displayed below the selected primer and probe sequences should be ignored when performing TaqMan Assays. The Universal TaqMan? Guidelines do not require you to perform optimizations, thus, the cycling/concentration, etc. information displayed here can be ignored. Save the Results by selecting "Save Results". A message will display showing the results were saved.打印结果 To print the Results, select "Open Results" from the "File" menu. The last (newest) results file will be the last one in the list (at the bottom of the list): Highlight and click "Open".This is the relevant information needed to order your primer/probe set. To print, click and drag, highlighting the information you want and selecting "Copy" from the "Edit" menu, placing it on the clipboard. This should be everything from the Sequence name through the TaqMan? probe annealing information.This is the relevant information needed to order your primer/probe set. To print, click and drag, highlighting the information you want and selecting "Copy" from the "Edit" menu, placing it on the clipboard. This should be everything from the Sequence name through the TaqMan? probe annealing information.You can then paste your sequence information in to a Word document; from here you can print a copy for your records.订购信息Be sure to include information on your needed synthesis scale and the corresponding part number, your reporter dye(s), your quencher (TAMRA), and your personal information (name, institution, address, phone fax etc.).。
mrna引物设计原则

标题:mRNA引物设计原则:优化靶标特异性与扩增效率导言:mRNA引物设计是分子生物学研究中至关重要的一步,它直接影响到PCR扩增、逆转录以及定量PCR等实验的成功与否。
本文将介绍一些重要的mRNA引物设计原则,旨在帮助研究人员优化引物设计,提高实验结果的准确性和可靠性。
一、靶标特异性:1. 避免非特异性引物:在设计引物时,务必确保引物与靶标序列的互补性是特异性的,以避免扩增出非特异性产物。
使用序列比对工具,如BLAST等,可以帮助鉴定引物与非靶标序列的互补性。
2. 引物长度:引物长度应在18-25个核苷酸之间,过短的引物可能会导致非特异性扩增产物的出现,而过长的引物则可能影响扩增效率。
3. 引物Tm值:引物的熔解温度(Tm值)应在55-65℃之间,以确保适当的引物结合和扩增效率。
可以使用在线工具计算Tm值,并对引物进行优化。
二、引物序列设计:1. 引物序列中避免重复和自身互补:引物序列中不应包含重复的核苷酸序列,避免引物自身形成二级结构,影响扩增效率。
2. 引物末端碱基选择:引物的末端碱基应选择G或C,以增加引物与靶标序列的稳定性和特异性。
此外,引物末端不宜含有太多的G或C,以避免引物间二聚体的形成。
三、引物间的配对:1. 引物间的互补性:引物对之间的互补性应尽量避免,以减少引物间的二聚体形成和非特异性扩增的可能性。
引物对之间的互补性可以使用在线工具进行评估。
2. 引物对的G/C含量:引物对的G/C含量应适度,过高或过低的G/C含量都可能导致引物二聚体的形成或不稳定性。
四、引物的杂交特性:1. 引物的3'末端应具有较高的特异性:引物的3'末端是与靶标序列杂交的关键部位,它应具有较高的特异性,以确保引物的正确定位和扩增准确性。
2. 引物的GC含量分布:引物序列中的GC含量应均匀分布,避免片段的GC含量过高或过低,以确保引物与靶标序列的稳定性和特异性。
结论:mRNA引物设计是一项复杂而重要的任务,本文介绍了一些重要的设计原则,以帮助研究人员提高引物的特异性和扩增效率。
qPCR引物篇(5)BioTNTmRNA引物筛选,引物定制或specificprimer..

版本号:20100001BioTNTqPCR Primer Assay for specific mRNA genes目录号:SER-PCR –编号(500T);说明书Part A一、产品简介:本试剂盒是基于最可靠的SYBR® Green-based定量real-time PCR试剂盒并应用基因表达分析。
我们的实验为基因特异性定量PCR验证具有统一、高效和标准化特点的扩增反应条件。
每一对引物都是经过严格的实验验证的。
已经使用适当的real time PCR Mix的时候,合适的片段大小和高的扩增效率成为保证。
qRT-PCR Primer pair kits统一的扩增效率和条件为荧光定量pcr实验中多基因表达的检测提供了准确而灵活的解决方案。
完整的试剂盒说明书由part A 和Part B构成。
Part A 主要描述了本试剂盒的使用方法和注意事项,Part B主要注明了assay 的特异情况。
二、产品特点:本产品适用于有一定q PCR实验经验的客户或者无经验的客户在公司的技术指导下进行。
三、保存条件:可在常温下运输。
常期保存请在-20℃保存,效期12个月。
警告:本产品仅供科研使用,请勿用于医药、临床治疗、食品及化妆品等其他用途。
安全提示:本产品中部分试剂有腐蚀性或毒性,请勿直接接触皮肤或吞咽;操作时请穿戴实验服、防护镜和手套;如果接触皮肤,应立即用洗涤剂和大量清水冲洗;误食或其他危急情况,请及时到医院就治;部分试剂易燃,请注意消防安全。
四、注意事项:请在收到此试剂盒后立刻检查试剂盒组成,BioTNT公司只负责受理在试剂盒签收后三个工作日内的试剂缺失报告;五、试剂盒组成:其他特点请参照Part B。
六、保证结果可使用的qPCR试剂:BioTNT real time PCR Premix 货号:A2010A0112七、其他需要自己准备的:1、耗材:0.5 mL或1.5mL Eppendorf管(无菌、无酶、RNase-free;货号Axygen-MCT-150-C),Tips(RNase-free)(1000μL、200μL、10μL的枪头;);2、检测的样本CDNA;3、无菌无酶的 PCR 水(货号:A2010B0X03);4、离心机;移液器(10μL,200μL,1000μL);5、手套,口罩。
mrna药物开发流程

mrna药物开发流程摘要:1.mRNA 药物的概述2.mRNA 药物的开发流程3.mRNA 药物的优势和挑战4.我国在mRNA 药物研究方面的进展正文:mRNA 药物的概述mRNA 药物是一种新型的生物制药技术,通过合成特定的信使RNA (mRNA),来指导细胞合成相应的蛋白质,以达到治疗疾病的目的。
与传统的小分子药物和生物制品相比,mRNA 药物具有更高的灵活性和可编程性,可以实现对多种疾病的精准治疗。
mRNA 药物的开发流程mRNA 药物的开发流程可以分为以下几个阶段:1.靶点选择:首先需要确定药物作用的靶点,这通常是一个与疾病发生密切相关的蛋白质。
2. mRNA 设计:根据靶点蛋白质的氨基酸序列,设计出相应的mRNA 序列。
3.mRNA 合成:通过化学合成或生物合成的方法,制备出目标mRNA。
4.mRNA 递送:将mRNA 送入细胞内,通常需要使用纳米载体等工具。
5.药物评价:对药物的安全性、有效性进行评价,通常需要进行细胞实验和动物实验。
6.临床试验:在经过前期评价后,可以进行临床试验,以验证药物在人体中的效果和安全性。
mRNA 药物的优势和挑战mRNA 药物的优势主要体现在以下几个方面:1.可以实现对多种疾病的精准治疗,因为mRNA 可以指导细胞合成几乎任何蛋白质。
2.生产过程简单,不需要大规模的生物发酵设备。
3.药物的剂量和给药方式可以灵活调整,可以根据需要进行个性化治疗。
然而,mRNA 药物也面临一些挑战,例如:1.mRNA 的稳定性差,容易被降解。
2.mRNA 的递送难度大,需要使用特殊的递送工具。
3.安全性和有效性的评价难度大,因为mRNA 药物的作用机制复杂,可能出现未知的毒副作用。
我国在mRNA 药物研究方面的进展我国在mRNA 药物研究方面取得了一系列的进展。
例如,我国科研人员已经成功研发出多种mRNA 药物,包括新冠疫苗等。
mrna荧光定量pcr条件

mrna荧光定量pcr条件
mRNA荧光定量PCR(Polymerase Chain Reaction)是一种用于
定量检测mRNA水平的分子生物学技术。
在进行mRNA荧光定量PCR 时,需要考虑一系列条件和步骤。
首先,准备PCR反应体系。
通常反应体系包括模板RNA、引物、荧光探针、核酸酶和反应缓冲液等。
引物和荧光探针的设计需要考
虑到靶mRNA的特异性和PCR反应的效率。
其次,进行PCR反应。
PCR反应一般包括初步变性、引物结合、DNA合成和延伸等步骤。
在mRNA荧光定量PCR中,需要根据实验设
计确定PCR反应的温度梯度和时间参数。
接着,进行PCR产物检测。
在PCR反应进行完毕后,需要利用
荧光定量PCR仪器进行PCR产物的检测和定量。
荧光探针的设计和
荧光信号的检测是mRNA荧光定量PCR的关键步骤。
最后,数据分析和结果解读。
通过荧光定量PCR仪器获取的数
据需要进行相应的数据分析和结果解读。
这包括标准曲线的绘制、PCR产物的定量和mRNA水平的计算等步骤。
总的来说,进行mRNA荧光定量PCR需要考虑实验设计、PCR反应条件、荧光探针设计、PCR产物检测和数据分析等多个方面。
合理设计实验条件和严格控制实验步骤是保证mRNA荧光定量PCR结果准确可靠的关键。
干货PCR引物设计,3款在线软件就能搞定!

干货PCR引物设计,3款在线软件就能搞定!特别福利:解螺旋会员招募启动,限额百名内测福利多,了解详情和申请会员点击这里。
作者:解螺旋·子非鱼如需转载请注明来源:解螺旋·医生科研助手·导语·好的引物会让PCR实验成功一半,因而,引物设计一直都是PCR非常重要的环节。
PrimerPremier5和Oligo7这两款软件想必是备受科研汪们推崇的引物设计软件。
可是对于懒癌晚期的小鱼而言,下载这两款软件也是一件非常麻烦的事情。
有木有比这两款软件更简单粗暴的引物获取方法呢?在这里小鱼特地给大家推荐3款简单实用的在线PCR引物设计软件,让你分分钟搞定PCR引物。
No.1 :NCBI的Primer-Blast推荐指数:五颗星理由:这个工具整合了目前流行的Primer3软件,且加上NCBI的Blast进行引物特异性的验证;可以针对某一特定剪接变异体基因来设计引物。
网址链接:/tools/primer-blast/或者直接从Blast主页(/)上找到。
Primer-Blast的界面包括4个部分:PCRT emplate(模板区),Primer Parameters(引物区),Exon/intron Selection(外显子内含子设置)和specificity check(特异性验证区)。
1、设计引物2、验证引物好坏3、外显子内含子(Exon/intron)如果设计的引物是跨内含子和外显子的交界处,可在此处设置成为Primer must span an exon-exon junction。
外显子的匹配碱基数和内含子的长度等设置一般选择默认。
4、特异性(Specificitycheck)在specificity check区,选择设计引物或验证引物时的目标数据库和物种。
这一步是比较重要的。
这里提供了7种数据库:RefSeq mRNA,Genome (referenceassemblies from selected organisms),RefSeqrepresentative genomes,RefSeq RNA(refseq_rna),nr (the standard non-redundant database),Genome (chromosomesfrom all organisms)和custom。
实时定量 PCR 与上游方法简介:基因mRNA的查找,引物的设计,与RNA的提取与cDNA的合成

Ct B2 CtC 2
Ct Bn CtCn
C1 2
C2 2
Cn 2
RNA提取与cDNA的合成
OD260/OD280(1.8-2.2)
Kit
cDNA
TaqMan探针技术
Molecular beacon技术
SYBR Green I荧光染料技术
160000
扩增曲线各部分的意义
140000
120000
100000
80000
60000
Ct
40000 20000 0 0 100 200 300
VDR-1-1(NX) NX Housekeeping(E1-H1)30.00 ຫໍສະໝຸດ 8.2130.36 18.10
0.34 0.12
-
VDR GADPH
A1 2 B1 2
Ct A1 Ct B1 CtC1
A2 2 B2 2
Ct A2
An 2 Bn 2
Ct An
kA kB kC
• • • • • 产物长度范围100~400bp,扩增片段中避免出现强烈的二级结构; GC含量为30~80%,最佳范围50~60%; 引物的Tm值范围为62~67°C,上、下游引物的ΔTm小于2°C; 引物序列中避免出现连续4个相同的碱基; 避免引物本身或引物间形成二级结构,在引物3’端最后5个碱基中避 免出现2个以上的G或C; • 跨内含子,避免RNA纯化过程中基因组DNA的污染; • 特异性进行检查。(电泳&溶解曲线)&Blast
Real-Time PCR
Feng Yidong
160000
140000
120000
100000
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
使用Exiqon在线工具设计mRNA/ncRNA引物
每一位用户都可以登陆EXIQON网站(),使用在线工具设计引物、探针、Gapmer,也可以在线提交信息,定制合成属于您的LNA TM寡核苷酸。
注册成为Exiqon会员,让设计操作更加方便!
进入Exiqon官方网站(),点击右上角“Sign In”进入注册页面,按页面提示完成注册,开始便捷的在线设计体验!
开始设计引物
步骤1. 登录网址/custom-LNA-qPCR,界面如下图所示:
步骤2. 点击“Design primers ”,跳转至设计页面:
【*由于mRNA/ncRNA 序列长,设计灵活性高,所以Exiqon 的在线设计工具同样也提供了人性化、智能化的设计方案,请点击https:///ls/Pages/ODTHelpPage.aspx 查看设计工具应用范围等详细介绍,帮助您快速顺利的完成设计。
】
A. 从下拉列表中选择物种,目前在线工具能够提供人、大小鼠物种的引物设计
B. 通过输入特殊的序列ID (包括GenBank ,RefSeq ,Ensembl 中的注册ID 或序列的特定关键词,
例如:输入ID “NM_001101”或输入关键词“ACTB ”)设计引物
C. 直接输入fasta 、genbank 、embl 格式的序列或自行编辑的序列,最佳的输入方法是输入
FASTA 格式的序列,理想的序列长度为50-20,000 nt ,最低可达28nt ,更短的(<27 nt )序列请使用miRNA 设计工具
D. 也可以上传电脑中保存的含目的序列的文件
E. 清除已输入的内容
F. 如有特殊要求,可进入高级选项页面,根据实验需要调整一些设计参数,对设计结果进行限
制,详细参数说明及调整方法请点击网址https:///ls/Pages/ODTHelpPage.aspx 查看 G. 如有防止扩增到基因组DNA 的需要,可勾选“Automatically select intron spanning assays ” H. 点击“Next ”开始设计,页面进入设计状态如下图所示,设计过程需要几分钟,为了不耽误
您宝贵的时间,Exiqon 提供了人性化的提醒设置,设计完毕会自动发送提醒邮件到您预留的邮箱,请根据您的实际情况选择提醒功能。
该邮件属于国际邮件,请不要使用QQ 邮箱,避免漏接。
I. 页面进入设计状态如下图所示,设计过程需要几分钟,为了不耽误您宝贵的时间,Exiqon
提供了人性化的提醒设置,设计完毕会自动发送提醒邮件到您预留的邮箱,请根据您的实际情况选择提醒功能。
该邮件属于国际邮件,请不要使用QQ 邮箱,避免漏接。
A B C F H
E D G
步骤3. 经过几分钟精密内部计算,页面显示如下设计结果,按照得分从高到低的顺序排列,第一对为最优候选引物,以此类推,可选一对或多对引物。
页面还显示每个设计结果的扩增位置、扩增产物长度以及扩增产物Tm 值等信息,并有200次和500次两种规格可选:
A. 可以勾选理想的设计结果
B.引物扩增起始位置
C.
扩增产物的长度
D.扩增产物Tm 值
E. 引物有2种规格可供选择
F1/F2.将某个设计结果/将几个设计结果加入到购物篮中 G .点击“Details ”,会出现不同设计结果具体的位置和序列信息,如下图所示:
图中蓝线表示输入序列的总长,蓝线上方的灰色数字表示不同序号的设计结果的大致位置,上下两条信息相同。
点击左右箭头放大或缩小图标时,上方蓝线和数字没有变化,只有灰色的选取框来回移动显示查看的具体区域,与此同时下方的蓝线和数字会相应的放大,帮助您更好的查看细节,比如放大后就可以清楚查看2号设计结果的具体细节和信息,如下图所示:
F1 G A B C D F2 E
步骤4.将设计结果加入购物篮之后到页面上方查看,如下图所示,点击“Remove”可以移除所选结果,重新选择;如果确认选择无误后点击“View basket”
如果想修改产品名称,可在此处操作
步骤5.购物篮页面如下图所示:
A
B
A.选择合成份数
B.确认无误后点击“Get quote”获取报价
步骤6. 点击“Get quote”后页面跳转如下图所示,请准确填写必填项目,方便当地代理商与您取得联系,提供报价、订货等服务。
填写的“E-mail”邮箱将收到带有设计结果的PDF文件,用于订货使用,该文件属于国际邮件,请不要使用QQ邮箱,避免漏接。
最后点击“submit”,完成整个设计操作,稍等片刻即可打开邮箱,查收PDF文件。
必填项目。
