AtNUDT8过量表达的拟南芥转基因植株
拟南芥T-DNA插入突变
Virulence proteins recognise the border sequences (LB、RB)that define the T-DNA.
a
12
(3)筛选纯和合突变体 实1、验实方验案方设案计设计
• 1.确定所要研究的基因 通过生物信息学的方法推测出一些可能具 有赤霉素糖基转移酶的基因。
• 2.获得种子 进入如下网站/index.jsp,输入
种子基因型号。
a
13
(3)筛选纯和 合突变体
实验方案设计
a
6
2、反向遗传学的重要手段——T-DNA插入突变技术
the mechanism of T-DNA insertion
• In the plant cell, the T-DNA is coated with the single-stranded DNA-binding protein, VirE2.
•
在多个生长阶段发挥作用的基因,其突变可能导致早期胚 致死效应,因而也无法鉴定。
• 瞬间表达的基因、低水平表达的基因,以及在少数细胞中 表达的基因,都很难用基因敲除突变体鉴定。
(Patrick J. Krysan et al,1999 )
(赵霞,周波等,2009)
a
33
(4)表型鉴定
表型鉴定应对策略
a
11
• 目前已经完成测序的植物有三种:拟南芥 、水稻、毛果杨(Populus trichocarpa)。
拟南芥CDR6基因过表达载体构建及过量表达植株筛选鉴定

拟南芥CDR6基因过表达载体构建及过量表达植株筛选鉴定作者:董万春樊婷婷阳立波等来源:《安徽农业科学》2015年第13期摘要 [目的]以拟南芥为材料克隆CDR6基因,构建CDR6基因的过量表达载体并筛选鉴定获得过表达植株。
[方法]提取拟南芥mRNA,反转录成cDNA,并以此为模板克隆CDR6基因CDS全长,通过限制性内切酶切割、T4 DNA连接酶连接,将CDR6基因CDS全长连接到带有35S强启动子的pXB094载体上;然后转化至Trans1T1感受态细胞中,菌落PCR鉴定阳性单克隆并测序确认。
将重组质粒转化至根瘤农杆菌GV3101菌株,通过浸花法侵染拟南芥野生型植株,通过抗性筛选和鉴定获得预期的转基因植株。
[结果]菌落PCR鉴定和测序结果表明CDR6基因已成功构建至pXB094载体;通过抗性筛选并鉴定获得了过量表达阳性植株。
[结论]筛选和鉴定获得的过量表达植株为研究CDR6基因的分子功能奠定了基础。
关键词拟南芥;CDR6基因;过量表达载体;转基因植株中图分类号 S188 文献标识码 A 文章编号 0517-6611(2015)13-063-02Abstract [Objective] To build up the carrier of Arabidopsis CDR6 gene overexpression and isolate corresponding transgenic lines. [Method] Total RNA was extracted from Arabidopsis seedlings and reverse transcribed as PCR template. CDS fragments of CDR6 gene were amplified through RT PCR. Using the restriction endonuclease and T4 DNA ligase, CDS fragments were subsequently cloned into pXB094 vector, and then were transformed into TransT1 phage resistant competent cells. Bacterial colony PCR and DNA sequencing were performed to confirm that CDS of the Arabidopsis CDR6 gene was successfully cloned. The recombinant plasmids were transformed into Agrobacterium GV3101 cells. Wild type plants were transformed using floraldip method and screened to obtain the desired transgenic plants. [Result] Bacterial colony PCR and DNA sequencing were performed and recombinant plasmids were confirmed. Stably transgenic lines of CDR6 overexpression were obtained through antibiotic screening, and verified through genetic methods. [Conclusion] Construction of Arabidopsis CDR6 gene overexpression and screening of transgenic plants laid the foundation for functional analysis of CDR6.Key words Arabidopsis thaliana; CDR6; Overexpression carrier; Transgenic plant拟南芥CDR6基因cDNA全长1 120 bp,编码一种含有NC结构域的功能未知蛋白[1-3],目前对其生物学功能研究尚未见报道。
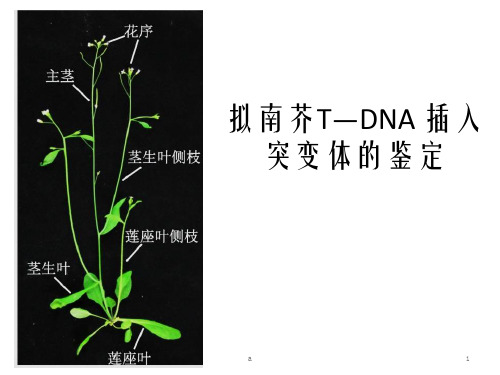
拟南芥T-DNA插入突变体的鉴定

拟南芥T-DNA插入突变体的鉴定摘要:我们用CTAB法提取拟南芥的T-DNA插入突变体的DNA,然后用三引物法进行PCR和琼脂糖凝胶电泳来判断其为突变纯合体还是突变杂合体。
通过这次实验,我们掌握了如何来判断纯和突变和杂合突变。
关键字:拟南芥 T-DNA插入突变突变体的鉴定前言:拟南芥拟南芥是十字花科的植物,它是植物遗传学、发育生物学和分子生物学的模式植物,其具有以下这些特点:①植株形态个体小,高度只有30cm左右;②生长周期快,从播种到收获种子一般只需8周左右;③种子多,每株可产生数千粒种子;④形态特征简单,生命力强,用普通培养基就可作人工培养;⑤遗传转化简单,转化效率高;⑥基因组小,只有5对染色体,125MB;⑦在2000年,拟南芥成为第一个基因组被完整测序的植物。
突变体突变体在植物基因分离及遗传学研究的最重要材料,通过自然突变或者人工诱变同源重组、基因沉默以及插入突变等方法都可以用来构建突变体,人工诱变是指利用物理因素(X射线,Y射线,紫外线,激光等)或化学诱变(如亚硝酸,硫酸二乙酯)来处理生物,使生物发生基因突变,这种方法可提高突变率,创造人类需要的变异类型。
目前,人工诱变拟南芥常用的方法有EMS诱变、T-DNA 插入突变、激活标签等。
T-DNA插入突变Ti质粒是土壤农杆菌的天然质粒,该质粒上有一段特殊的DNA区段,当农杆菌侵染植物细胞时,该DNA区段能自发转移,插入植物染色体DNA中,Ti质粒上的这一段能转移的DNA被叫做T-DNA。
人们根据这一现象,将Ti质粒进行改造,将感兴趣的基因放进T-DNA区段中,通过农杆菌侵染植物细胞,实现外源基因对植物的遗传转化。
T-DNA插入到植物染色体上的什么位置,是随机的。
如果T-DNA插入某个功能基因的内部,特别是插入到外显子区,将造成基因功能的丧失。
所以利用农杆菌Ti质粒转化植物细胞,是获得植物突变体的一种重要方法。
T—DNA插入突变最大的用处是构建突变体库,在此基础上构建侧翼序列库;目前在拟南芥中已经建立了接近饱和的T—DNA插入突变体库,该突变体库包含超过225 000个独立的T—DNA插入株系,在预测的29 454个基因中有21 700个基因发生了插入突变[6]。
拟南芥多效性基因CPR5转化水稻中花11的研究

SuhC iaN r a U i ri , u nzo 6 , hn ) ot hn om l nv sy G a gh u5 0 3 C ia e t 1 1
A s a t hs td v sgtdtet nf ai f li rpcgn tP 5it Z o g u 1 ( r— b t c :T i s yi et a a s r t no eo o i e e C R o h nh a1 Oy r u n i e h r o m o p t A n
1 0 % a d t e p r d o d c in c u d b h r n d u d r t e c n i o fc n i u u i h n 2 o 0 n h e i fi u t o l e s o e e n e o d t n o o t o s l t d 3 C o n o t h i n g a
第5 0卷
21 年 01
第 4期
7月
中山大学学报 ( 自然科学 版)
AC A S I T ARUM NAT RAL UM UN VER I T S S YAT E T C EN I U I I S TA I UN S NI
V0 _ O No 4 I5 .
J 1 2 1 u. 0 1
ge c p l o y,h we e ,t x r s in lv l5 a e di e e ti r n g n c p a tes o v r he e p e so e e r f r n n ta s e i l n lt . f
Ke od :Z o g u 1 ( r a sta L u s .jp nc ;A C R ;pe t pc gn ;gn t y w r s h n h a l Oy ai .sbp a oi z v a) t P 5 li r i e e e e c oo i
高考生物一轮复习 第十单元 现代生物科技 专题二十五 基因工程精练(含解析)-人教版高三全册生物试题

专题二十五基因工程考点1 基因工程的基本工具与操作程序1.[2020某某八校第一次联考,15分]利用农杆菌转化法可将抗病基因(来自拟南芥)导入玉米细胞而获得抗病植株。
根据所学知识回答下列问题:(1)若对拟南芥的抗病基因进行大量扩增,应用技术。
(2)获得抗病玉米植株工程中的核心步骤是,其目的是使抗病基因在受体细胞中稳定存在,并能遗传给下一代,同时使。
(3)农杆菌转化法利用农杆菌中的Ti质粒上的可以转移到受体细胞,并整合到受体细胞的上的特点,使抗病基因在受体细胞中的遗传特性得以稳定维持和表达。
(4)将含抗病基因的受体细胞培育为抗病植株的原理是。
(5)若要在个体水平上检测转基因玉米是否有抗病特性,需要做实验。
(6)为避免抗病基因通过花粉传播进入其他植物而导致“基因污染”,应将抗病基因导入(填“细胞核”或“细胞质”)。
2.[2020某某示X高中联考,15分]南极某种鱼含有抗冻基因,如图是获取转基因抗冻番茄植株的过程示意图。
请回答下列相关问题:(1)利用①过程的方法获取目的基因需要用到酶。
②过程中常需要用到的工具酶是。
(2)通过①、②过程成功构建的重组质粒,除目的基因外,还应该具备等。
(3)将目的基因导入番茄体细胞的方法是利用农杆菌的作用,其原理是。
(4)要确认抗冻基因是否在转基因番茄植株中表达出相应的蛋白质,可以采用方法,除进行分子检测外,有时还需要进行的鉴定。
考点2 基因工程的应用与蛋白质工程3.[2020某某某某模拟,10分]科学家将人的生长激素基因与pBR322质粒进行重组。
pBR322质粒含有两个抗生素抗性基因和五个限制酶切点(如图1)。
将重组质粒导入大肠杆菌,并成功地在大肠杆菌中表达。
据图回答问题。
图 1 图2(1)科学家从人体的(填“下丘脑”“垂体”或“甲状腺”)细胞中获取的mRNA,在酶的作用下可合成人的生长激素基因。
(2)将重组质粒导入大肠杆菌,用含抗生素的培养基进行培养(如图2),通过观察大肠杆菌的生长、繁殖情况判断,限制酶a的切点有以下几种可能:①受体菌在培养基A和培养基B上都能生长、繁殖形成菌落,则限制酶a的切点是图1中的切点2。
超量表达AtDWF4基因对芥菜生长发育及抗寒性的影响

超量表达AtDWF4基因对芥菜生长发育及抗寒性的影响植物激素在植株生长发育过程中发挥重要作用,对植物生长、发育、衰老、休眠以及抗逆性都具有重要的影响。
油菜素甾醇是最近新确认的植物激素,被称为继生长素、细胞分裂素、赤霉素、脱落酸、乙烯之后的第六大植物激素,广泛参与植物细胞伸长、维管分化、根生长、光反应、抗逆、衰老等方面的调控。
油菜素甾醇(BR)通过复杂的平行和交互代谢网络代谢途径,将植物甾醇前体成分转变为生物活性的甾酮以及油菜素内酯。
拟南芥DWF4基因编码一个P450细胞色素氧化酶,催化BR的C-22羟基化反应。
该反应是油菜素甾醇生物合成途径中的限速步骤,决定最终BR的合成数量。
芥菜(Brassica juncea Coss.)是重要的十字花科蔬菜作物,在我国西南地区及长江流域拥有广泛的栽培面积。
本论文拟在茎用芥菜中超量表达来自拟南芥的DWF4基因,研究DWF4基因对芥菜植株生长发育以及植株抗寒能力的影响,实现芥菜生物产量、种子产量以及抗寒性能力的提高。
获得的主要研究结果如下:1、DWF4转基因芥菜的获得通过农杆菌介导法,将表达载体pCABarDWF4转化芥菜,经含8 mg/L草丁膦(PPT)筛选培养基多次筛选,获得了pCABarDWF4转基因芥菜植株。
转基因植株PCR鉴定结果DWF4目的基因已被成功整合到芥菜基因组中。
2、pCABarDWF4转基因植株除草剂抗性以及DWF4基因的表达分析pCABarDWF4转基因芥菜后代和非转基因野生型芥菜,在苗期分别使用500mg/L浓度的PPT进行处理,结果显示,转基因植株后代具有明显的抗除草剂能力。
除草剂抗性植株进行DWF4基因的表达分析,结果显示DWF4基因在不同转基因植株中的表达各有差异,其中在D2、D3植株中表达水平较高。
3、T2代pCABarDWF4转基因芥菜苗期光照、黑暗条件下生长情况获得的转基因植株苗期在光照和黑暗处理条件下的下胚轴长和根长都不同程度高于对照野生型,说明dwf4基因超表达后可以促进转基因植株苗期的生长发育。
拟南芥AtNHX8基因的克隆及其功能研究的开题报告

拟南芥AtNHX8基因的克隆及其功能研究的开题报
告
一、研究背景
拟南芥(Arabidopsis thaliana)是一种受人们广泛研究的模式植物,在植物学研究和生物技术应用方面有着非常重要的作用。
离子调节是维持细胞内外离子平衡和维持植物生长发育的重要机制。
离子转运是植物维持细胞内外离子平衡的重要方式之一,NHX家族是
Na+/H+反向运输器家族中的一员,该家族在植物对低渗透压环境的适应中起着重要作用。
拟南芥基因组中存在8个NHX基因,它们在根、叶、
花器官中表达,其中AtNHX8的功能目前仍未明确。
二、研究目的
本研究旨在克隆拟南芥AtNHX8基因,分析其在拟南芥生长发育和
离子逆境下的表达模式和功能,为深入了解该家族在植物逆境适应中的
作用提供理论支持。
三、主要研究内容
1. 克隆拟南芥AtNHX8基因序列,包括其启动子、编码序列和终止
密码子。
2. 构建AtNHX8下游的GUS表达载体,大量表达该基因在拟南芥根、茎、叶、花器官中的表达模式。
3. 分析AtNHX8在拟南芥在NaCl、Na2SO4等高盐胁迫下的表达模
式及生长发育、离子平衡等方面的变化情况,进一步研究AtNHX8基因在植物逆境适应中的作用。
四、预期成果
1. 获得AtNHX8基因的全长序列和启动子序列,为深入研究该基因提供基础资料。
2. 揭示AtNHX8基因在拟南芥生长发育和离子逆境适应中的表达模式和作用途径,为进一步研究植物对环境逆境的适应提供理论基础。
3. 在拟南芥中建立起对AtNHX8功能的初步认识,为深入了解该家族在植物对高盐逆境的适应机制提供思路和方法。
拟南芥AT-hook基序核蛋白介导体细胞胚胎发生和基因组复制PPT

Result6 AHL15 overexpression-induced polyploidy occurs by endomitosis dueቤተ መጻሕፍቲ ባይዱto chromosome missegregation.
从p35s:AHL15体细胞胚再生的多倍体植株 的相当频率提出了一个问题,即多倍体何 时被诱导,它是否与SE诱导相关?甚至被 SE诱导促进?
存在2,4-D: pAHL15:AHL15-GUS ahl15/+ pAHL15:AHL15-GUS
通过比较p35S:BBM-GR构建体在野生型 ahl15 ahl19amiRAHL20三重突变背景中诱 导SE的有效性,研究了BBM诱导SE中对AHL 基因的需求。
在野生型背景中的554个原始p35s:BBM-GR 转化子中,诱导了40个(7%); 但在ahl15ahl19amiRAHL20三重突变背景 中背景中(351个原始转化子中诱导0个) 这一作用被完全消除。
Result4 AHL15 overexpression-mediated chromatin decondensation correlates with SE induction. AHL15在SE启动过程中调节了染色质结构
1、p35s:ahl15子叶原皮细胞染色体DNA碘化丙 啶(PI)染色显示异染色质明显分散(图4a)
由于强烈的染色质解聚,细胞多倍体 化发生在体细胞到胚胎重编程期间。 AHL15过度表达导致强烈的染色质解聚, 与体细胞中胚胎能力的诱导一致。这 阻止了某些细胞中的染色体分离,导 致产生多倍体胚胎细胞并随后产生多 倍体体细胞胚胎的内有丝分裂事件。
相比之下,2,4-D处理导致DAHL15表达 增强,该表达足以诱导体细胞到胚胎 重编程,但不足以诱导内有丝分裂所 需的染色质解聚水平。
碳饥饿诱导拟南芥衰老过程中自噬蛋白atg8e的鉴定

碳饥饿诱导拟南芥衰老过程中自噬蛋白ATG8e的鉴定摘要植物在生物胁迫和非生物胁迫条件下,会快速衰老。
植物衰老最明显的现象是叶片叶色变黄,衰老叶片中物质通过自噬途径降解成小分子供新生器官循环利用。
非生物胁迫,如碳饥饿可以使拟南芥植株在短时间内衰老,且会诱发植物产生ATG8e-PE参与的自噬发生。
本研究根据自噬研究的理论基础,制备多克隆抗体,构建尿素胶体系。
并利用实验室构建的碳饥饿体系,鉴定碳饥饿诱导植株衰老诱发自噬过程产生的条带为ATG8e和ATG8e-PE。
主要研究结果如下所示:1、构建pGEX-4T-1-ATG8e和pET28a-PBA1原核表达载体。
利用大肠杆菌表达系统诱导表达蛋白。
分离纯化目的蛋白后免疫家兔。
纯化获得的兔抗血清,成功制备ATG8e 和PBA1多克隆抗体。
2、在传统尿素胶的基础上,加入6M尿素作为变性剂,并将缓冲体系变为Tris-Tricine。
该改良版的尿素胶能够明显区分小分子膜蛋白ATG8e和ATG8e-PE。
3、采用液泡质子泵抑制剂Conanamycin A(终浓度为1μM),处理碳饥饿的野生型拟南芥植株,导致短时间内ATG8e和ATG8e-PE积累量增加;采用蛋白酶活性抑制剂E-64d(终浓度为20μM),处理碳饥饿的野生型拟南芥植株,导致短时间内ATG8e和ATG8e-PE积累量增加;采用自噬途径加强物质BTH(终浓度为100μM)处理光下生长7天的野生型拟南芥植株,导致短时间内ATG8e和ATG8e-PE积累量增加;提取ATG8e 过表达植株和野生型拟南芥植株蛋白,检测到前者ATG8e积累量增加;采用磷脂酶处理碳饥饿的野生型拟南芥植株,ATG8e-PE积累量减少;提取碳饥饿的野生型拟南芥和自噬缺陷突变体植株蛋白,在后者中没有ATG8e-PE的积累。
这些实验均证明黑暗碳饥饿胁迫体系诱导植株衰老,引发自噬过程产生的条带可能是ATG8e和ATG8e-PE。
关键词:自噬;ATG8;抗体制备;碳饥饿IDENTIFICATION OF PLANT AUTOPHAGY PROTEIN ATG8E IN PLANT AGING INDUCED BY CARBON STARV ATIONABSTRACTUnder the conditions of biological stress and abiotic stress,Plants will aging quickly.The most obvious phenomenon of plant senescence is that the leaves are yellowing and the substances in the senescent leaves are degraded into small molecules for the recycling of new organs by autophagic pathways.Abiotic stress,such as carbon starvation can cause Arabidopsis plants premature luteinization in a short time and induce plants to produce ATG8e-PE to participate in autophagy.In this study,polyclonal antibody was prepared and the urea gel system was constructed according to the theoretical basis of autophagy study.And using the laboratory-built carbon starvation system to identify carbon starvation induced plant autophagy generated ATG8e and ATG8e-PE.The main findings are as follows:1、Construct pGEX-4T-1-ATG8e and pET28a-PBA1prokaryotic expression vector. Expression of proteins by expression system of Escherichia coli.Rabbit was immunized after isolation and purification of the target protein.The purified rabbit antiserum was successfully prepared and the polyclonal antibody of ATG8e and PBA1was successfully prepared.2、On the basis of traditional urea glue,adds6M urea as a denaturant and the buffer system changes into Tris-Tricine.The new urea glue can distinguish small molecule membrane proteins ATG8e and ATG8e-PE significantly.3、The accumulation of ATG8e and ATG8e-PE in the short time was increased by the treatment of carbon-starved wild-type Arabidopsis thaliana plant with conanamycin A(final concentration of1μM);Protease activity inhibitor E-64d Concentration of20μM)treatment is the same to concanamycin A;Arabidopsis thaliana plant growing7days using autophagic pathway-enhanced substance BTH(final concentration of100μM),the amount of ATG8e and ATG8e-PE increased in a short time;The plant protein of ATG8e overexpressed and wild-type Arabidopsis thaliana was extracted.ATG8e was increased in ATG8e overexpressed plants.Phospholipase was used to treat carbon starved The wild type Arabidopsis thaliana and ATG8e-PE were reduced in the wild type Arabidopsis thaliana;Wild-type Arabidopsis thaliana and autophagic defeat mutant plant proteins were extracted,and no accumulation of ATG8e-PE was found in the mutant.These experiments demonstrate that the dark carbon starvation system induces plant senescence,and the autophagic processes may lead to ATG8e and ATG8e-PE.Keywords:autophagy;ATG8;antibody preparation;carbon starvation目录第一章文献综述 (1)1.1自噬的发现和发展历程 (1)1.2自噬的生物学意义 (1)1.3自噬的分类和生物学过程 (1)1.4植物自噬的分子调控机制 (1)1.4.1类泛素化耦联系统 (1)1.4.2ATG9膜脂循环系统 (3)1.4.3PtdIns3K复合体 (3)1.4.4Vti12SNARE复合体 (4)1.5植物细胞自噬的生理功能 (4)1.5.1自噬参与植物响应非生物胁迫 (4)1.5.2自噬参与植物生长发育 (4)1.5.3自噬参与植物细胞程序性死亡 (5)1.5.4自噬参与植物抵御病原体侵染 (5)1.6植物自噬的调控 (6)1.7自噬的研究方法 (8)1.7.1显微镜观察法 (8)1.7.2免疫印迹检测 (10)1.8研究目的及意义 (10)1.9研究内容 (10)第二章ATG8e多克隆抗体的制备 (12)2.1引言 (12)2.2材料与方法 (12)2.2.1材料 (12)2.2.2实验方法 (19)2.3结果与分析 (23)2.3.1鉴定pGEX-4T-1-ATG8e原核表达载体 (23)2.3.2重组蛋白的诱导表达和纯化 (24)2.3.3ATG8e多克隆抗体的有效性检测和其制备 (25)2.3.4ATG8e多克隆抗体对拟南芥内源ATG8e蛋白的特异性检测 (25)2.4讨论 (26)第三章PBA1多克隆抗体的制备 (28)3.1引言 (28)3.2材料与方法 (28)3.2.1材料 (28)3.2.2实验方法 (29)3.3结果与分析 (31)3.3.1鉴定pET28a-PBA1原核表达载体 (32)3.3.2重组蛋白的诱导表达和纯化 (31)3.3.3His-PBA1多克隆抗体的有效性检测和制备 (32)3.4讨论 (33)第四章ATG8e和ATG8e-PE条带的鉴定 (34)4.1引言 (34)4.2材料与方法 (34)4.2.1材料 (34)4.2.2实验方法 (38)4.3实验结果 (41)4.3.1野生型拟南芥植株碳饥饿5天实验结果 (41)4.3.2野生型拟南芥植株碳饥饿time-course实验结果 (42)4.3.3Conanamycin A处理野生型拟南芥植株 (45)4.3.4BTH处理野生型拟南芥植株 (46)4.3.5E-64d处理野生型拟南芥植株 (45)4.3.6在ATG8e过表达T3代植物中检测ATG8e和ATG8e-PE的表达 (43)4.3.7磷脂酶处理野生型拟南芥植株 (44)4.3.8突变体atg5-1和atg7-3植物中检测ATG8e和ATG8e-PE的表达 (45)4.4讨论 (47)第五章总结和展望 (48)参考文献 (49)缩略词 (56)致谢 (57)作者简介 (58)第一章文献综述1第一章文献综述1.1自噬的发现和发展历程1963年,比利时科学家Duve发现自噬现象并为其命名。
过量表达URO基因提高拟南芥的抗旱能力

背景介绍
拟南芥uro突变体中由于URO(UPRIGHTROS ETTE)基因的过量表达导致生长素含量明显提高。本 文结果表明,uro突变体的抗旱能力明显强于野生型, 但uro突变体的根长、表皮毛数目以及离体叶的脱水速 度都没有优于野生型。uro突变体对外源ABA不敏感, 且 在uro突变体中ABA响应基因的表达与野生型相比显著 推迟。另外,表型分析表明uro突变体的营养生长延长, 植株衰老延迟,特别是经过渗透胁迫后,uro植株内的 丙二醛含量低于野生型。由此可见,URO基因的过表 达使uro突变体通过ABA非依赖途径提高了抗旱能力, 而uro突变体衰老延迟可能与其干旱抗性提高有关。
目的: A 检测uro基因是否对ABA敏感
对照
0.1 umol/L ABA
1 umol/L ABA
10 umol/L ABA
图4
图5
1、从图4和图5可知,uro对ABA的敏感性明显低于野生型,在10 μmol·L1ABA处理下,野生型根的伸长几乎被彻底抑制,而uro突变体的根仍有明显 伸长。可见,uro突变体对外源ABA的敏感性降低,主根伸长受外源ABA的抑 制程度低于野生型。
途径、AREB/ABF途径和MYB/MYC途径。
2、ABA非依赖型 基因的表达不受ABA诱导 DREB1,2途径和NAC-eRD1途径 ABA:脱落酸
试验方法、现象、结果
一、方法:正常条件培养野生型和uro突变体 3周,浇水后连续21天不浇水,此后给与复 水处理。 目的:A 观察植物表形状态 B 统计根的长度与数目、表皮毛数 目
野生型
uro突变体
放大
放大
图1
从植物体表形可以明显发现,uro突变体的抗旱能力强于野生型
小麦TaYAB2基因的过量表达造成转基因拟南芥叶片近轴面特征趋向远轴面

作物学报 ACTA AGRONOMICA SINICA 2012, 38(11): 2042−2051 /zwxb/ISSN 0496-3490; CODEN TSHPA9E-mail: xbzw@本研究由国家高技术研究发展计划(863计划)项目(2006AA10Z150), 国家自然科学基金项目(31171475)和山东省优秀中青年科学家奖励基金(2006BS06004)资助。
*通讯作者(Corresponding author): 张宪省, E-mail: zhangxs@, Tel: 0538-******* **同等贡献(Contributed equally to this work)Received(收稿日期): 2012-01-10; Accepted(接受日期): 2012-06-10; Published online(网络出版日期): 2012-07-27. URL: /kcms/detail/11.1809.S.20120727.0842.006.htmlDOI: 10.3724/SP.J.1006.2012.02042小麦TaYAB2基因的过量表达造成转基因拟南芥叶片近轴面特征趋向远轴面赵翔宇** 谢洪涛** 陈祥彬 王帅帅 张宪省*山东农业大学生命科学学院 / 山东省作物生物学重点实验室 / 作物生物学国家重点实验室, 山东泰安 271018摘 要: 叶片极性的建立在叶片形态建成过程中有重要作用。
探讨小麦叶片发育的调控机制不仅可以丰富植株形态建成的基础知识, 也可以为小麦株型的设计提供理论依据。
本研究从小麦中分离出一个YABBY 基因家族成员TaYAB2, 对其序列特征、表达模式及功能进行了分析。
该基因编码的蛋白在N 端含有C 2C 2锌指结构域, C 端含有YABBY 结构域, 与拟南芥中AtYAB2和水稻中OsYAB2同源关系较近。
RT-PCR 结果显示, 该基因在大部分组织器官中广泛表达。
过表达细胞自噬基因ATG8f对植物耐受砷胁迫的影响_郭江波

2. 1 As2 O3 处理下拟南芥根长分析
通过分 析 3 组 平 行 试 验 的 结 果 可 以 得 出: ( 1) As2 O3 未处理时 Col 野生型拟南芥的平均根长均 略长于 ATG8f 转基因拟南芥的平均根长,但差异不 大; ( 2) 不同浓度 As2 O3 处理时,Col 野生型拟南芥 和 ATG8f 转基因拟南芥的根的生长受到抑制,并且 与 As2 O3 浓度的升高成反比; ( 3) Col 野生型拟南芥 的根长显著长于 ATG8f 转基因拟南芥,说明在拟南 芥中 过 表 达 ATG8f 基 因,增 加 了 转 基 因 植 物 对 As2 O3 的敏感性,结果见图 1( a,b) .
郭江波,等: 过表达细胞自噬基因 ATG8f 对植物耐受砷胁迫的影响
281
码类泛素蛋白,在自噬体的形成过程中起重要作用, 它与磷脂酰乙醇胺结合后进入自噬小泡的膜层,对 自噬小泡的延伸与成熟是必需的 . 通常 ATG8 被用 作自噬体的标记蛋白[2].
砷是一种毒性很强、能致癌且广泛分布于自然 界中的类金属,其中,我们熟知的砒霜即三氧化二砷 的毒性最强 . 随着砷的开采冶炼及在肥料、化工及 农药等工农业领域中的广泛应用,使得砷污染现象 愈发严重,对动植物和人类的生命及生态环境造成 极大隐患,已成为世界性的环境问题[3]. 砷不是植 物生长发育 中 的 必 需 元 素,但 砷 对 植 物 表 现 出“低 砷刺激,高砷抑制”的现象[4],严重时可导致作物的 产量和质量下降 . 例如,郭江波等[5]研究砷对本生 烟草处理结果表明,随着砷胁迫时间的增加,烟草叶 片叶绿素含量、超氧化物歧化酶和过氧化物酶活性 呈先升后降趋势,而过氧化氢酶活性呈下降趋势,说 明砷胁迫会对烟草造成一定的伤害 . 因此,研究植 物对砷的耐受能力意义重大 .
【免费】过量表达柳树两个SVP1s基因提高拟南芥抗盐胁迫能力

ISSN 1007-7626CN 11-3870/Q中国生物化学与分子生物学报http ://cjbmb.bjmu.edu.cnChinese Journal of Biochemistry and Molecular Biology2015年4月31(4):414 421DOI :10.13865/j.cnki.cjbmb.2015.04.12收稿日期:2014-10-20;接受日期:2015-01-07江苏省农业科技自主创新资金项目(No.CX (14)2098)*联系人Tel :0513-********;E-mail :yjnkyy@163.com#共同第一作者Received :October 20,2014;Accepted :January 7,2015Supported by Fund for Independent Innovation of Agricultural Sciences and Technology in Jiangsu Province (No.CX (14)2098)*Corresponding author Tel :0513-********;E-mail :yjnkyy@163.com#These authors contributed equally to this study过量表达柳树两个SVP 1s 基因提高拟南芥抗盐胁迫能力余春梅1)#,李敏2)#,何新雨1),李玉娟2),王莹2),谈峰2),张健2)*(1)南通大学生命科学学院,江苏南通226019;2)江苏沿江地区农业科学研究所,江苏如皋226541)摘要在拟南芥、水稻等草本植物中,人们对位于液泡膜上质子泵焦磷酸酶(VPase )进行了较为深入的研究,其通过水解焦磷酸释放的能量将H +从细胞质泵入液泡中,从而驱动Na +、K +等的运输,避免了细胞质中因过量的Na +、K +造成的伤害,保护了细胞的正常功能.但是木本植物如柳树中的VP 1基因(SVP 1)的功能尚未见报道.本研究检测了两个SVP 1s 同源基因在柳树L0911不同的组织(器官)中以及昼夜条件(以叶片为代表组织)下的表达模式,同时,分析了过量表达SVP 1s 拟南芥T3转基因株系的耐盐特性.结果表明:SVP 1.1在韧皮部中表达最高,而SVP 1.2在韧皮部和新生枝条是其在根部的4 5倍;叶片中两个SVP 1s 在白天稳定表达,18ʒ00后逐渐下降,在黑暗条件下,随着暗处理时间的延长SVP 1.2增幅较大;在盐胁迫条件下,SVP 1s 转基因拟南芥T3株系种子萌发率,叶片中与活性氧清除相关的酶,如SOD 、POD 和CAT 等活性的诱导强度高于野生型对照;SVP 1.1转基因株系叶片膜质氧化程度(MDA )低于野生型和35S :SVP 1.2株系.通过本研究显示,在拟南芥中过量表达柳树SVP 1.1s 提高了拟南芥的耐盐能力,揭示了木本植物中VP 1基因同样具备保护细胞,使细胞耐受高盐胁迫的功能,同时也为选育优良耐盐树木品种提供了理论依据.关键词柳树L0911(Salix “Hailiu 1”);SVP 1s 基因;拟南芥;耐盐性中图分类号S688Over-expression of Two Vacuolar H +-translocating Pyrophosphatase(SVP 1s )Genes of Willow Enhances Arabidopsis Salt ToleranceYU Chun-Mei 1)#,LI Min 2)#,HE Xin-Yu 1),LI Yu-Juan 2),WANG Ying 2),TAN Feng 2),ZHANG Jian 2)*(1)College of Life Sciences ,Nantong University ,Nantong 226019,Jiangsu ,China ;2)Institute of Agricultural Science in Regions along Yangtze River of Jiangsu ,Rugao 226541,Jiangsu ,China )Abstract In herb plant such as arabidopsis and rice ,membrane-bound vacuolar H +-translocatingpyrophosphatases (VPase )have been investigated deeply.It pumps protons (H +)from the cytoplasm to vacuoles using the energy from the hydrolyzation of inorganic pyrophosphate ,and then H +gradients promote ions such as Na +and K +entering into vacuoles through transporters and channels ,which can protect cell against the poison of extreme ion accumulating.But the functions of VP 1in wooden plant such as willow remain unclear.In this study ,we first analyzed organs (or tissues )transcriptional level ,and the day and night expression patterns in leaves of two SVP 1s from willow L0911.Then we introduced two SVP 1genes to Arabidopsis (Ecotype Col-0)by agrobacterium mediated transformation.Last ,we第4期余春梅等:过量表达柳树两个SVP1s基因提高拟南芥抗盐胁迫能力detected the germination rate,the enzyme activities such as SOD,POD and CAT in the T3lines over-expressing(OE)the SVP1.1s.The malonyldialdehyde(MDA)contents which reflected the peroxidation of the membranes lipid were also detected.Our results showed that SVP1.1expresses highest in the phloem,while SVP1.2exhibits highest expression in both phloem and new shoots.Both SVP1.1s’expression was very steady during6ʒ00to16ʒ00,after that it decline gradually,but SVP1.2increased quicker than SVP1.1as the time of dark extending.Germination rate of T3OE lines of two SVP1s were both higher than controls under100mmol/L NaCl treatment.In most cases,the activity of SOD,POD and CAT in OE lines(especially SVP1.1OE lines)were all higher than those of WT under same condition.SVP1.1OE lines had10% 25%lower MAD content in leaves than WT under stress conditions.Collectively,the OE lines showed more salt tolerance than WT.This research showed that VP1genes in wooden plant have the same function as its homologous gene in herb plant.The result and resources obtained in this research may be useful for further breeding of salt-tolerance willow varieties.Key words willow L0911(Salix“Hailiu1”);SVP1s;Arabidopsis;salt tolerance土壤盐碱化是一个世界性的问题,沿海滩涂是面积最大的盐碱地,也是潜力巨大的国土资源.因沿海盐碱地理化性状差,绝大都数植物在盐碱地上生长不良甚至不能成活,难于建立植被,制约了农林生产,影响生态环境[1].柳树为杨柳科柳属(Salix)落叶乔木,在我国有较广的分布,部分品种能在含盐量4.0‰左右、pH值10.4的土壤中正常生长,是我国极具潜力的沿海滩涂造林和生物质能源树种[2].挖掘柳树中的耐盐相关基因将具有积极的生产和生态意义.植物液泡膜上质子泵焦磷酸酶(vacuolar H+-translocating inorganic pyrophosphatase,VPase,VP,EC3.6.1.1)是植物中特有通过水解焦磷酸(PPi)驱动的质子泵,它与另一个质子泵H+-ATPase (EC3.6.1.3)(以ATP为动力)一起,在液泡膜的内外形成的质子梯度,促进了Na+、K+等离子进入液泡[3].在盐胁迫条件下,非盐生植物将过量Na+区隔化入液泡中,避免高浓度的盐对细胞的伤害[4,5].植物中的VP基因一般有多个成员,分为对K+敏感的I型和对K+不敏感的Ⅱ型,其中Ⅰ型VP基因在植物中发挥主要的功能[6-10].对水稻6个I型VP基因的研究表明,OVP1受冷处理诱导[11];在能够耐受洪水浸泡的品种中,OVP3受到缺氧(anoxia)的诱导[12].小麦中至少有3个基因编码I型VP,其中TaVP3只在发育的种子中检测到表达,TaVP2主要在茎器官中,叶片中该基因在脱水条件下的表达受到抑制,但在盐处理条件下,根中的TaVP2表达受到诱导;TaVP1在小麦器官中的表达比较丰富,但在根中的表达最高,且受到盐的诱导[13].葡萄中两个I型VP基因均在葡萄果实发育的后期表达,且受到冷害的诱导[10].可见,I型VP基因家族成员在植物中的表达存在组织器官和环境因子诱导的特异性,亦表明不同的I型VP成员在体内可能发挥不同的功能.植物在盐胁迫条件下,造成细胞内积累过量的超氧阴离子(O2-)、过氧化氢(H2O2)、羟自由基(.OH)和单线态1O2等活性氧(ROS),引起胞内和细胞膜上的脂肪酸过氧化,降低胞内大分子物质如蛋白质、核酸的合成以及蛋白质的功能[14].植物在进化过程中,产生了多种能够清除体内活性氧的酶,如超氧化物歧化酶(superoxide dismutase,SOD,EC1.15.1.1),利用细胞中的H+,将O2-转化为过氧化氢(H2O2)和O2.过氧化氢(H2O2)进一步被POD (peroxidases,EC1.11.1.7)和CAT(catalase,EC 1.11.1.6)等酶清除[15,16].多个研究表明,耐盐植物中一般具有或能诱导产生较高活性氧清除酶活,如Jin等[17]研究表明,在耐盐的大麦中,可诱导产生新的SOD和POD的同工酶;Wang等[18]研究表明,耐盐水稻中SOD和POD的活性均高于不耐盐的品种.我们前期的研究结果表明,柳树(Salix)中至少有两个I型VP成员:SVP1.1和SVP1.2[19].盐胁迫条件下,这两个成员在不同的柳树种中具有不同的表达特性,但这两个成员的功能尚需进一步验证.本研究对两个SVP1同源基因在L0911柳树中器官(组织)表达模式以及昼夜表达模式进行了研究.将这两个成员在拟南芥中进行异源表达,通过分析阳性转基因株系在盐胁迫条件下种子的萌发、活性氧清除相关酶的活性以及细胞膜膜质的氧化(MDA)等,对两个SVP1s的功能进行了研究.1材料与方法1.1材料柳树L0911(Salix“Hailiu1”)为江苏沿江地514中国生物化学与分子生物学报第31卷区农业科学研究所选育,本实验用2 3年生枝条,15 16cm 长,在1/2Hoglangd 培养液水培40 50d.拟南芥(Columbia 生态型,WT ),转基因株系,均采用1/2MS (Murashige 和Skoog )含1%蔗糖固体培养基中进行播种后,在泥炭土:蛭石1ʒ1进行土培.所有植物生长于温室,温度为24/18ħ(白天/黑夜),光照14h ,光照强度为600 1000μmol ·m -2·s -1.WT 拟南芥抽薹后大约7d 用于转化.5 6片莲座叶拟南芥用于分子鉴定.柳树SVP 1.1和SVP 1.2TA 克隆质粒[19],pWM101载体,大肠杆菌DH5α,农杆菌GV3101菌种等由南通大学生命科学学院生物学系实验室保存.所用的化学试剂购自上海生工生物技术有限公司和AMRESCO (美国).质粒提取试剂盒购自碧云天生物技术公司(江苏海门).内切酶、dNTP 、ExTaq 、定量表达用SYBRPremix ExTaq TM等分子生物学相关试剂购自宝生物公司(辽宁大连).引物合成为上海生工生物技术有限公司.1.2RNA 提取与cDNA 的合成用TRIzol Plus RNA 试剂(Life technologies ,上海)提取RNA ,具体方法按说明书方法进行.cDNA合成为PrimeScript TMDouble Strand cDNA Synthesis Kit (大连宝生物),具体方法参照说明书进行.1.3柳树中SVP 1s 基因定量表达分析在ABI7500定量PCR仪中进行定量PCR分析(soft V2.0.4),具体方法参见[19].柳树L0911根、木质部、树皮(主要为韧皮部)、叶片以及新生枝条(叶片未完全展开,长度为2 3cm )中合成的cDNA 用于器官表达模式.L0911的叶片从6ʒ00 24ʒ00每隔2h 取样,用于叶片中SVP 1s 昼夜表达模式的定量分析.UBQ (Ubiqutin Q )基因用于本实验cDNA 模板内参(Table 1)1.4植物表达载体构建将SVP 1.1和VP 1.2分别克隆到植物表达载体pWM101,形成pWM-SVP 1.1和pWM-SVP 1.2载体(Fig.1),所用引物如Table 1.具体方法参考分子克隆实验手册.质粒提取与酶切等按照试剂盒说明书进行.Table 1Primers used in this studyPrimer Sequence (from 5'to 3')UsageSVP-KpnI-F1atGGTACCATGGTTTCGGTGATTTTGCCAGSVP-PstI RagCTGCAGTCAGAATATCTTGAAGAGCAGG Construct pWM-SVP 1.1plant expressional vector SVP-KpnI-F2atGGTACCATGGGGATGTTGAGTGAA SVP-BamHI-RctGGATCCTCAGAAATATTTGAACAGC Construct pWM-SVP 1.2plant expressional vector HPT Foward ACACAGCCATCGGTCCAGAC 35S promoter RTCTCAGAAGAACAAAGGGC Identify the Arabidopsis transgenic plants VP1.1F2ATGGTCGAGGAAGTTCGCAG VP1.1R2GAGGGGTGTGAGCATGACAA Pair to detect expression of SVP 1.1in willow [19]VP1.2F2AATGCTCCCATACTGGTTCTC VP1.2R2GGCGATAAGTGGTGTAAGC Pair to detect expression of SVP 1.2in willow [19]UBQL TGAGGCTTGGGGAGGAACT UBQRGATCTTGGCCTTCACGTTGT Internal control gene using in the qPCR[19]OE VP1F2CTGGAGGTGCATGGGACAAT OE VP1R2ATCTTGAAGAGCAGGCCACC Detect SVP 1.1expression in Arabidopsis OE VP1F3AACTGTCGACGTCTTGACCC OE VP1R3GGATCTCCGATCGTGTCACC Detect SVP 1.2expression in Arabidopsis AtVP1F1TCATGGGTTGGCTTACCGAC AtVP1R1AGTTCTTTCACGGATGCGGTDetect endogenous AtVP 1gene expressionRestricted enzyme sites wereunderlinedFig.1Diagram of pWM-SVP 1vector TBL (R):T Border Left (Right );35S P :35S promoter ;35S En :35SEnhancer ;HPT :hygromycin B phosphotrasferase resistance gene ,VP 1.1and VP 1.2are two Salix VP 1genes614第4期余春梅等:过量表达柳树两个SVP1s基因提高拟南芥抗盐胁迫能力1.5农杆菌的转化农杆菌GV3101用CaCl2制备感受态,用冻融法将测序正确的pWM-SVP1.1和SVP1.2质粒转化农杆菌,并通过菌落PCR鉴定为阳性的单克隆,用于后续转化.1.6拟南芥侵染侵染方法采用浸花法[20].将转化pWM-SVP1.1和SVP1.2农杆菌在LB溶液中培养至A600=1,离心收集后,悬浮在等体积的1/2MS液体(含5%蔗糖,0.1% 0.3%Silwet)溶液中,用滴管滴加在WT花序的顶部,暗培养24h后,恢复正常培养.1.7拟南芥转基因阳性植株筛选和分子检测收获侵染过的拟南芥T1代种子经20%bleach 溶液消毒10min,蒸馏水洗涤5 6次,将种子点播于潮霉素(HPT+,15mg/L)1/2MS筛选培养基上筛选约14d后,表现抗性转基因长出真叶,盆栽培养.待在土培苗长出5 6片真叶后,取适量叶片提取基因组DNA(天根植物基因组提取试剂盒,DP320,具体方法参照试剂盒说明书),选用相应引物(Table 1,35S HPT Forward和35S PromoterR)进行PCR鉴定.T1植株进一步用于提取RNA,合成cDNA,并进行单株中两个外源SVP1s和拟南芥内源的AVP1(At1G15690)表达检测.对基因组、转录水平检测均为阳性的植株,繁殖至T3,T3表现无抗性分离的株系用于功能验证.1.8转基因拟南芥耐盐性检测1.8.1萌发率统计T3转基因拟南芥种子和及WT种子经消毒后点播于含100mmol/L NaCl的1/ 2MS+1%蔗糖培养基中,每皿种子各100粒,重复3次,培养7d后统计发芽种子数.1.8.2盐胁迫下抗氧化酶活性采用与1.7中相同的T3株系材料,土培至5 6片莲座叶,分别进行0,100,200mmol/L NaCl溶液处理7d后,检测过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和过氧化物酶(POD)等的活性,具体方法参照文献[21,22].1.8.3细胞膜损伤程度测定取0.500g样品,加5%三氯乙酸5mL,研磨后所得匀浆在3000r/min 下离心10min.取上清液2mL,加0.67%硫代巴比妥酸2mL,混匀后在100ħ水浴30min,冷却后3000r/min离心10min.取上清液测定在450nm、532nm和600nm处吸光度值.按文献[21,22]方法计算MDA浓度.上述方法对所有株系的测定均设3次生物样品重复和3次技术重复,每个参数测定取其平均值.1.9统计方法利用SPSS13.0软件进行显著性差异分析(Student’s t-test)2结果2.1两个SVP1s基因在柳树L0911中的器官表达模式通过器官表达模式的分析表明,SVP1.1韧皮部中表达相对较高,是其在根中的4 5倍,在木质部中表达相对较低,大约为根中的0.4 0.5倍.而SVP1.2在韧皮部和新生枝条中表达相对较高(Fig.2).两个基因不同的表达模式,可能表明两者在不同的组织或不同发育阶段发挥功能.Fig.2Transcriptional pattern analysis of two SVP1 genes in different organs of L0911All samples were collected from at least three individual cuttings and pooled together for isolating totalRNA.TheRNA was converted to cDNA.QuantitativeRT-PCRwas performed,in which the willow UBQ gene was used as the internal control.The transcriptional profiles in all samples were compared to that in roots.Data are meanʃS.E.M.(n≥3),*P<0.05,**P <0.01,***P<0.001,Student’s t-test2.2两个SVP1s基因在柳树L0911叶片中的昼夜表达模式在柳树L0911中,两个SVP1基因的表达在6ʒ00 16ʒ00间没有明显变化.但18ʒ00后两个基因的表达均呈现下降,到22ʒ00为最低值,大约为对照样品(6ʒ00)的0.5倍(Fig.3).随后,随着暗处理时间的延长,VP1.2的增加明显快于VP1.1,说明两个基因可能对暗处理的响应不相同.2.3pWM-SVP1s植物表达载体的构建以及重组农杆菌的获得通过Table1中引物分别以SVP1.1和VP1.2TA714中国生物化学与分子生物学报第31卷Fig.3Daily course of the accumulation of two SVP 1transcripts in L0911leavesLeaves were collected fromthree different cuttings and pooled together for isolating RNA.cDNA synthesis and RT q-PCRexperiments were conducted.The Ubiquitin Q gene was used as an internal control.All samples in transcriptional analysis were compared at the 6:00AM.The light was turn on at 6:00AM ,and off at 20:00PM.Data are mean ʃS.E.M.(n ≥3),*P <0.05,Student ’s t -test质粒为模板进行扩增后,通过相应的酶切处理载体和PCR产物后,经过连接,转化至大肠杆菌后,对获得单克隆进行鉴定.重组质粒经过酶切和测序验证后(Fig.4),用于后续的农杆菌转化.对农杆菌进行PCR鉴定后(结果未显示),用于后续拟南芥的转化.Fig.4Identification of the pWM-SVP 1s recombinantvectorRestriction enzymes digested products wereseparated by 1%agarose gel electrophoresis.1.pWM-VP 1.1recombinant plasmid.2.pWM-VP 1.2recombinant plasmid.3.pWM-VP 1recombinant plasmid without RE treatment.The upper and lower bands were the open circle and super coiled molecular of the recombinant plasmid ,respectively.4.pWM101vector.M.DNA molecular size standards2.4阳性转基因拟南芥的筛选与分子鉴定进行T1种子的潮霉素抗性筛选和T1植株的分子鉴定.如Fig.5A 所示,转基因阳性植株能正常生长呈现绿色,而阴性植株会逐渐黄化死亡.对表现抗性的植株通过T1植株进一步通过Table 1中的引物HPT foward 和35S promoter R进行验证.Fig.5B 显示了部分材料的鉴定结果,表明这些材料中具有pWM 101载体上35S 启动子和潮霉素基因序列,但目标基因是否能正常表达,尚需进一步验证.Fig.5Identification of positive Arabidopsis transgenic plants(A )T1seeds germinated on HPT (15mg /L )selective 1/2MS medium.Positive transgenic individual plants could grow true leaves ,while other plants died on the selective medium.The arrows showed the positive ones.(B )PCRproducts of primers HPT forward and 35S promoter Rwere separated by 1%agarose gel electrophoresis.The brightest bands were the DNA fragments spanning the 35S promoter and HPT gene on pWM 101vector.M :DNA molecular size standards.1:WT plants.2-8:T1individual plants which were screened by the HPT selective medium (only showed part of plant T1identified )2.5SVP 1s 基因的表达检测过量表达SVP 1.1和SVP 1.2成员的植株中同时含有内源AVP 1基因的表达.本研究设计了这3个基因特异引物(Table 1),检测T1单株VP 1s 转录水平.统计检测的材料,发现80%以上T1单株(总数为46株,结果未显示)能够表达外源基因;部分材料虽然在基因组水平检测到载体序列的存在,但目标SVP 1s 基因不表达(如Fig.5B ,Lane 2).2.6转基因植株耐盐性检测2.6.1盐胁迫条件下转基因拟南芥萌发率高于野814第4期余春梅等:过量表达柳树两个SVP 1s基因提高拟南芥抗盐胁迫能力Fig.6SVP 1expression in Arabidopsis T1transgenic plantsLeaves of T1individual plants (positive plantsscreened by HPT )were collected for isolating RNA.cDNA synthesis and RT-PCRwere conducted.The PCRproducts were separated by 1%agarose gel electrophoresis.1:WT ;2-4:SVP 1.1T1individual transgenic plants ;5-7:SVP 1.2T1transgenic plants.Arabidopsis AVP 1(At 1G 15690)as internal control生型对照在含有100mmol /L NaCl 的1/2MS培养Fig.7ROS scavenging related enzyme activities and MDA contents in leaves under salt stress (A )SOD enzymeactivities.(B )POD enzyme activities.(C )CAT enzyme activities.(D )MDA contents.WT ,Col-0ecotype ;SVP1.1OE2and OE7,SVP1.2OE3and OE6are T3lines come from T1which can express SVP 1s gene.OE lines and WT seedling with 5-6leaves were treated under 0,100and 200mmol /L NaCl for 7days and the leaves were collected for enzyme activities (orMDA contents )test.Data are mean ʃS.E.M.(n ≥3),*P <0.05,**P <0.01,***P <0.001,Student ’s t -test基上,转SVP 1.1基因拟南芥萌发率为85%ʃ4.7%,其根和子叶均能正常生长;而转SVP 1.2基因拟南芥萌发率为45%ʃ5.2%,主根和子叶生长速度慢;野生型拟南芥萌发率为31.5%ʃ2.3%,幼根短小、子叶展开困难.所有材料在未处理的1/2MS 培养基萌发率为95.3%ʃ2.5%.2.6.2盐胁迫下转基因拟南芥具有更高的活性氧清除酶活从Fig.7A 可知,SOD 酶活性,在WT 中,随着NaCl 浓度的增大,呈先升后降趋势.尽管转SVP 1.1s 株系间的SOD 酶活差别较大,但随着NaCl 浓度的增大,有较大的诱导;比较两个同源基因SVP 1.1和SVP 1.2株系,SVP 1.1转基因株系随着盐浓度的增大,酶活上升;SVP 1.2株系在高盐浓度下稍有下降.胁迫条件下,转基因株系的最高酶活是其自身对照的6 7倍,是野生型对照的4 5倍.随着NaCl 浓度的增大,转S VP 1.1s 拟南芥中的POD 酶活性(Fig.7B )高于对照WT ,且转SVP 1.1株系的酶活在两种盐胁迫条件下均高于转SVP 1.2914中国生物化学与分子生物学报第31卷植株.随着NaCl浓度的增大,所有植株中CAT活性均呈上升趋势,但VP1.1OE植株的CAT的活性比WT和VP1.2OE植株的活性的增长量大(Fig.7C).总体来说,OE植株中抗氧化酶活上升幅度一般高于野生型,说明两个SVP1都能提高盐胁迫条件下拟南芥的抗氧化能力.比较两个同源SVP1基因,SVP1.1转基因植株维持了更高的胞内SOD、POD和CAT活性,因此,可以更有效的清除氧自由基.2.6.3盐胁迫下转SVP1.1基因的拟南芥的膜质氧化程度相对较轻所有检测的材料均显示,随着NaCl浓度的增大,MDA含量呈不断上升趋势.在高盐胁迫下,WT和转SVP1.2OE植株叶中的MDA含量比SVP1.1OE植株高(Fig.7D),说明转SVP1.1 OE植株膜质的过氧化程度较低.3讨论本研究通过对两个SVP1基因在不同组织中表达模式的分析表明,它们在所有检测的器官中均有表达,但在树皮(主要为韧皮部)中的表达最高(Fig.2),可能与木本植物需要较为强大的动力将叶片光合作用的产物运输到根部有关[9].Gaxiola 等[9]综合植物中对VP1的研究结果,对位于不同部位的VP1酶的功能提出了如下假设:在叶肉细胞中,位于液泡膜中的VP1主要水解代谢副产物PPi (焦磷酸),促进光合作用;在筛管细胞中,其主要功能是PPi合成酶,促进蔗糖运输到根部.关于VP1作为PPi合成酶尚需要进一步的实验验证,我们的工作为揭示VP1在微管组织中发挥的功能奠定了基础,我们将会从细胞学、生理学的角度进一步揭示其在柳树中发挥的功能.同一基因家族的不同成员在植物中可能有功能冗余、或不同的成员的生物学功能、生化功能发生变化是在植物中较为普遍的现象[11-12,23-24].在本研究中,通过转录水平以及两个基因的拟南芥OE植株揭示以下2种可能:1).SVP1.2在体内发挥的功能可能与营养有关,在需能、需要营养物质较多的组织中,SVP1.2发挥更主要的功能.Fig.2显示,SVP1.2在新生枝条和韧皮部组织中的表达更高;2)SVP1s 编码的蛋白质可能活性不尽相同.本研究发现:SVP1.1OE株系的耐盐表现高于SVP1.2OE株系,其可能的原因是两个基因的OE株系表达水平不尽相同外(Fig.6),也可能存在生化活性的差异.SVP1.1和SVP1.2的一级氨基酸序列的相似性高达81.21%,在焦磷酸(PPi)和两个酸性化基序(acidic motif)(DX3DX3D)完全一致.在5个参与形成氢键的氨基酸残基中,SVP1.1发生了较为保守的R(精氨酸残基)到K(赖氨酸残基)变化外,其余4个残基完全一致.从其三维结构看,主要是N端的无规卷曲不能重合[19].拟南芥AVP1中,E229D (谷氨酸到天冬氨酸)的突变提高了AVP1水解焦磷酸和质子转移功能[23],两个SVP1s是否存在生化活性的差异尚需进一步的验证.比较已经测序的植物基因组的VP1基因,发现多种植物中的VP1存在多个成员(www.phytozome.net),如杨树中具有4个VP1基因,禾本科植物玉米(Zea mays)中至少有8个成员、水稻(Oryza sativa)中有6个成员[12].同一物种中,不同的VP1同源蛋白(同工酶)生化活性的分化,尚未见相关的研究报道,我们后续的研究将进一步揭示柳树(或其它植物)中,VP1基因成员的功能分化.通过本研究表明,将柳树中两个SVP1s基因转入拟南芥中,提高了拟南芥在盐胁迫条件下的萌发率,能够更好诱导活性氧清除相关的酶活,提高植物的抗氧化能力,在一定程度上降低了胁迫条件下植物的膜脂氧化程度.到目前为止,针对草本植物VP1的研究相对较多,如在苜蓿(alfalfa)、大麦[24,25]中表达拟南芥中的AVP1能显著提高植物耐盐和干旱胁迫的能力.木本多年生植物中VP1基因的报道相对较少,结合我们以及Dong等[26]的研究结果,木本多年生植物中的VP1基因与其在草本植物中的同源基因具有类似的功能,本研究丰富了对木本植物中有关VP1基因功能的认识,为研究VP1基因在微管组织较为丰富的植物中发挥的功能奠定了基础,同时为提高植物的耐盐性提供了基因资源.参考文献(References)[1]涂忠虞主编.柳树育种与栽培[M].南京:江苏科学技术出版社(Tu Zhong-Yu ed.Breeding and Cultivation of Willow[M].Nanjing:Jiangsu Science and Technology Press),1982,10[2]李敏,张健,冯立国,等.柳树液泡膜ATP酶B亚基基因克隆及在盐胁迫下表达的分析[J].江苏农业学报(Li M,ZhangJ,Feng LG,et al.Cloning and expression analysis of vacuolarATPase B subunit gene VHA-B in leaves of salt-stressed willow[J].Jiangsu J Agric Sci),2013,29(5):1149-1153[3]Isayenkov S,Isner JC,Maathuis FJ.Vacuolar ion channels:Roles in plant nutrition and signalling[J].FEBS Lett,2010,584(10):1982-1988[4]Hasegawa PM.Sodium(Na+)homeostasis and salt tolerance of plants[J].Environ Exp Bot,2013,92:19-31024第4期余春梅等:过量表达柳树两个SVP1s基因提高拟南芥抗盐胁迫能力[5]Janicka-Russak M,Kabala K,Wdowikowska A,et al.Modification of plasma membrane proton pumps in cucumber rootsas an adaptation mechanism to salt stress[J].J Plant Physiol,2013,170(10):915-922[6]Hsiao YY,Pan YJ,Hsu SH,et al.Functional roles of arginine residues in mung bean vacuolar H+-pyrophosphatase[J].Biochim Biophys Acta,2007,1767(7):965-973[7]Hsiao YY,VanRC,Hung SH,et al.Roles of histidine residues in plant vacuolar H+-pyrophosphatase[J].Biochim BiophysActa,2004,1608(2-3):190-199[8]GaxiolaRA,Palmgren MG,Schumacher K.Plant proton pumps [J].FEBS Lett,2007,581(12):2204-2214[9]GaxiolaRA,Sanchez CA,Paez-Valencia J,et al.Genetic manipulation of a“vacuolar”H+-PPase:from salt tolerance toyield enhancement under phosphorus-deficient soils[J].PlantPhysiol,2012,159(1):3-11[10]Venter M,Groenewald JH,Botha FC.Sequence analysis and transcriptional profiling of two vacuolar H+-pyrophosphataseisoforms in Vitis vinifera[J].J PlantRes,2006,119(5):469-478[11]Zhang J,Li J,Wang X,et al.OVP1,a vacuolar H+-translocating inorganic pyrophosphatase(V-PPase),overexpression improved rice cold tolerance[J].Plant PhysiolBiochem,2011,49(1):33-38[12]Liu Q,Zhang Q,BurtonRA,et al.Expression of vacuolar H+-pyrophosphatase(OVP3)is under control of an anoxia-induciblepromoter in rice[J].Plant Mol Biol,2010,72(1-2):47-60[13]Wang Y,Xu H,Zhang G,et al.Expression and responses to dehydration and salinity stresses of V-PPase gene members inwheat[J].J Genet Genomics,2009,36(12):711-720[14]Foyer CH,Shigeoka S.Understanding oxidative stress and antioxidant functions to enhance photosynthesis[J].PlantPhysiol,2011,155(1):93-100[15]Kim SG,Kim ST,Kang SY,et al.Proteomic analysis of reactive oxygen species(ROS)-related proteins in rice roots[J].PlantCellRep,2008,27(2):363-375[16]Mylona PV,Polidoros AN,Scandalios JG.Antioxidant gene responses toROS-generating xenobiotics in developing andgerminated scutella of maize[J].J Exp Bot,2007,58(6):1301-1312[17]Jin X,Huang Y,Zeng F,et al.Genotypic difference in response of peroxidase and superoxide dismutase isozymes and activities tosalt stress in barley[J].Acta Physiol Planta,2009,31(6):1103-1109[18]Wang X,Hou C,Liu J,et al.Hydrogen peroxide is involved in the regulation of rice(Oryza sativa L.)tolerance to salt stress[J].Acta Physiol Planta,2012,35(3):891-900[19]Li M,Yu C,Wang Y,et al.Cloning and characterisation of two H+-translocating organic pyrophosphatase genes in salix and theirexpression differences in two willow varieties with different salttolerance[J].Curr Genomics,2014,15:341-348[20]Zhang X,HenriquesR,Lin SS,et al.Agrobacterium-mediated transformation of Arabidopsis thaliana using the floral dip method[J].Nat Protoc,2006,1(2):641-646[21]郝建军,康宗利,于洋.植物生理学实验技术[M].北京:化学工业出版社(Hao JJ,Kang ZL,Yu Y.An ExperimentalProtocol of Plant Physiology[M].Beijing:Chemical IndustryPress),2006:158-159[22]Cakmak I,Horst WJ.Effect of aluminium on lipid peroxidation,superoxide dismutase,catalase,and peroxidase activities in roottips of soybean(Glycine max)[J].Physiol Plant,1991,83(3):463-468[23]ZhenRG,Kim EJ,Rea PA.Acidic residues necessary for pyrophosphate-energized pumping and inhibition of the vacuolarH+-pyrophosphatase by N,N’-dicyclohexylcarbodiimide[J].JBiol Chem,1997,272(35):22340-22348[24]Bao A,Wang S,Wu G,et al.Overexpression of the Arabidopsis H+-PPase enhanced resistance to salt and drought stress intransgenic alfalfa(Medicago sativa L.)[J].Plant Sci,2008,176(2):232-240[25]SchillingRK,Marschner P,Shavrukov Y,et al.Expression of the Arabidopsis vacuolar H+-pyrophosphatase gene(AVP1)improves the shoot biomass of transgenic barley and increasesgrain yield in a saline field[J].Plant Biotech J,2014,12(3):378-386[26]Dong Q,Liu D,An X,et al.MdVHP1encodes an apple vacuolar H+-PPase and enhances stress tolerance in transgenicapple callus and tomato[J].J Plant Physiol,2011,168(17):2124-2133124。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
N d ( ul s ed hs a si e m o t X 水解酶是需要 M ¨的一类酶, ui nc o d i o ht n dt s e iy ) x e i p p e lk o o m e g 广泛存在于包括
病毒 、 菌 、 核生物 ( 括植 物和人 类 ) 内的 20多种生 物 中 ; 细 真 包 在 5 它催 化 与其 他基 团 (一X) 合 的核 苷二 结 磷 酸 ( D X) N P 的水 解 , 物为 N 产 MP+P—X。这类 酶 的共 同特 征是 含有 高 度保 守 的 由 2 3个 氨基 酸残 基组 成 的 N dx基序 ( oi bx 。该酶 的底 物包 括核 苷三 磷 酸 、 ui m t/o) f 二核 苷 多 磷 酸 、 苷 一糖 复合 物 、 帽 m N 核 加 RA 和二 核苷辅 酶 ( CA) … 。 目前 , 如 o 等 国内外对 细菌 和人类 N d ui x水解 酶 的研 究 表 明 : 肠杆 菌 MuT具 有 大 t
收稿 日期 : 0 9— 6—1 20 0 4 基金项 目:中国热 带 农业 科 学 院 热带 生 物 技 术研 究 所 中 央级 公 益 性科 研 院所 基 本科 研 业 务 费 专 项 资助
(T B X 8 1 IB Z 0 1 )
作者简介 :张秀春( 92一) 女 , 17 , 福建永定人 , 中国热带农业科学院热带生物技术研究所副研究员. 通信作者 : 明( 96一) 男 , 彭 15 , 中国热带农业科学 院热带生物技术研究所所 长 , 研究员.
G 30 介导的渗透法转化野生型拟南芥 , V 11 通过卡那霉素筛选获得 了一批经 N r enb t ot r l 检测证 实的过量表 h o
达 AN D7 转 基 因 拟 南 芥 植 株 。 t U 8的
关键词 : t U 8 过量表达 ;拟南芥 ; AN DT ; 遗传转化
中验 材料 。
1 材 料 与方 法
1 1 材料 .
1 11 植 物材料 .. 112 菌株 和质粒 .. 113 试 剂 ..
拟 南芥 ( rb os ai a 哥 伦 比亚生 态型 , 实验 室提供 。 Aai pit ln ) d sh a 本 大 肠杆 菌 ( .oi H a 根 癌农 杆菌 (goatim t eai s 菌株 G 30 E cl )D 5 、 A rbc r u fcn) eu m e V 11和载
第 1卷 第 1期
21 0 0年 3月
热 带 生 物 学 报
J OURNAL OF TROPI CAL 0RGANI S SM
V 11 0 . No 1 . Ma. 0 0 r2 1
文 章 编 号 :64—7 5 ( 00 0 00 0 17 0 4 2 1 ) 1— 0 8— 4
体 p H 3由本实验室提供 ;M 1 一 et 购 自TK R 公司。 CF p D 8 Tvc r o aaa
分子 生物 学实 验用各 种 限制性 内切 酶 、 接 酶等 购 自T K R 公 司 , 化试 剂购 自 Sg 公 连 a aa 生 i ma 司 , 高辛标 记检测 试剂 盒购 自 R ce 司 。 地 oh 公
第1 期
张 秀春 等 :t U T8过量表达 的拟南 芥转 基因植株 AN D
9
114 引物合成 ..
所用 D A引物由上海生工生物工程有限公司合成。 N
! T c T A c A A T G T c G一 T TG T T c A G A TT 3
ANU 8基 因克 隆引物 序列 如下 : t DT
抑制 突变 的作用 … ; 类 NU T 人 D 1的突变 容易 导致 癌症发 生 ; 人类 NU 2 可 以水解 加 帽 m N 细菌 和人 DT 1 R A;
类 Nd ui x水解 酶至 少具 有两 大功 能 , 是清 除细胞 内产 生 的有害 的代谢 产 物 ; 一 二是 调 节各生 化途径 的 中间 代 谢产 物 的积累 ¨ 。与人 类 和大肠 杆 菌相 比 , 植物 N dx 解 酶基 因家族 的研 究起 步 比较 晚 , ui水 但对 拟 南 芥基 因组全 序列进 行分 析 已发现 拟南芥 存 在 2 4个 N dx 解酶 基 因( 名 为 ANU s ]分布 于细胞 质 u i水 命 t DT) , ( tU 1—1 ) 叶绿体 ( t DT2—1 ) AN DT 1、 ANU 1 8 和线 粒 体 ( t D 1 2 ) ANU T9— 4 中。 目前对 N dx 解 酶基 因家 族 ui水 的 了解 还不 够充分 甚 至在某些 认 识 上存 在 矛 盾 ¨。拟 南 芥 细 胞 质 中 多种 AN DT水 解 酶 的生 物 学 功 tU 能 还不 明确 , 得进 一步 深入研 究 。为此 , 值 笔者 拟从 拟南 芥 基 因组 中克 隆 AN D7 并构 建 植物 表达 载体 tU 8, 进 而转化 野生 型拟南 芥 , 希望 获得 过量 表达 ANU T t D 8的转基 因 拟南 芥 , 为进 一 步研 究 ANU T t D 8的功 能 提
洲 7 8过 量 表 达 的拟 南 芥 转 基 因植 株
张秀春 , 李文彬 夏亦荠 明 , ,彭
( .中国热带农业科学 院 热带 生物技术研究所 农业部热带作物生物技术重点开放实验室 ,海南 海 1 5 10 ; 1 3 7 1 1
2 .农业部转基因植物及植物用微生物环境安全监督 检验 测试中心 , 海南 海 1 5 10 ) 3 7 1 1 摘 要: 从拟南芥 基 因组 中克 隆 ANU I , 与 p H 3相 连 构建 了植 物 表达 载 体 p H N , 用 农杆 菌 t D ̄ 并 d CF C F8采
