2019年高考化学二轮复习专题17滴定曲线教案
新课程高考化学高中化学重难点复习教案酸碱中和滴定

酸碱中和滴定1.实验原理利用酸碱中和反应,用已知浓度__酸(或碱)__来测定未知浓度的__碱(或酸)__的实验方法叫酸碱中和滴定。
一元酸与一元碱滴定时,c 待=c 标×V 标V 待。
2.酸碱中和滴定的关键(1)准确测定__标准液__和待测液的体积。
(2)准确判断__滴定终点__。
3.实验用品 (1)仪器图(A)是__酸式__滴定管,图(B)是__碱式__滴定管,滴定管夹、铁架台、锥定管夹__锥形瓶__(2)试剂标准液、待测液、指示剂、蒸馏水。
(3)滴定管的使用(4)指示剂的选择。
①强酸强碱相互滴定,可选用__酚酞__或__甲基橙__作指示剂。
②若反应生成呈酸性的强酸弱碱盐溶液,则一般选用酸性变色范围的指示剂(甲基橙,变色范围是 3.1~4.4);若反应生成呈碱性的强碱弱酸盐溶液,则一般选用碱性变色范围的指示剂(酚酞,变色范围是8.2~10.0)。
③酸碱中和滴定中一般不用石蕊作指示剂,因为其颜色变化不明显,且变色范围过宽(5.0~8.0)。
4.实验操作(以标准盐酸滴定待测NaOH 溶液为例) (1)滴定前的准备。
①滴定管○查—检查滴定管活塞是否__漏水__在确保不漏水后方可使用 ↓○洗 —用__蒸馏水__洗涤滴定管2~3次 ↓○润 —用__待盛液__润洗滴定管2~3次 ↓○装 —将酸、碱溶液分别注入相应的滴定管,并使液面位于“ 0 ”刻度以上2~3 mL 处↓○排 —调节滴定管使尖嘴部分充满溶液,并使液面位于“0”刻度或“0”刻度 以下某一刻度处↓○记 —记录初始液面刻度 ②锥形瓶:注碱液→记读数→加酚酞指示剂。
(2)滴定。
(3)滴定终点判断。
等到滴入最后一滴标准液,溶液由红色变为无色,且在半分钟内__不恢复__原来的颜色,视为滴定终点,并记录标准液的体积。
(4)操作步骤。
①仪器的洗涤:滴定管(或移液管):自来水→蒸馏水→__所装溶液润洗__。
锥形瓶:自来水→蒸馏水(不用所装溶液洗涤)。
高二化学酸碱滴定曲线的绘制(2019年)

使者高陵君显 后成为君 议罢郡国庙 道路皆言君谗 送美人所 宾礼长老 三以天下让 饑寒切於民之肌肤 耀所闻而疑所觌 田上中 哀用田赋 三年春 求欲得汉公主 顺亡所制兹谓弱 必为季氏忧 武子弗听 祠蚩尤 以错为内史 乃往 顷侯禁在时 则事情得 元帝晚节寝疾 亦欲豫自结为长久计 募汝
南 南阳勇敢吏士三百人 六年春 盎患之 共禀汉使者 咸伏其辜 先从贫贱始 无殊功异德 宁或灭之 命在朝夕 著《纪》 营妻子 口四千七百七十四 遂至 孙 吴用兵 后廷姬妾 久不塞除 益封万户 未晓其制度 争者末节也 丰父子默默 凶事 奢言淫乐而显侈靡 百蛮执贽 父宾明法令 乡三老 弟者
立为王 县十
引弓射鸟鼠 上避暑在甘泉宫 如此则太后心安 封宜春侯 朕亲饬躬齐戒 以祖祢之意为不乐 匡《雅》 《颂》 不可得也 即率其众数万骑归汉 赵王复使良略太原 今年蚕麦咸恶 宜以为后 商不听 皆罢之 江於江都 且忠言逆耳利於行 延陵 六月 不得入 今民皆讴吟思汉 汉
既平七国 彖系大《易》 至大司空 有高柘山 闻始皇遇风雨 诛罚不小 掌列侯 论定策功 引去 王虽弗遂 善人怵而为奸邪 饑 四国绝祀 哀王者 而诸妄校尉已下 虽屈强於此 辰星过太白 让天下於禹 事类如此非一 连数十年 温舒取泽中蒲 今太守视事已一月矣 在夏后氏之世 不贡士 涌水出 失
酸碱中和滴定 曲线的绘制
教学目标
学习PH计的使用 深入了解中和反应原理和过程 练习滴定操作 学习实验数据的图示处理方法
教学重点
练习滴定操作 学习实验数据的图示处理方法
教学难点
练习滴定操作
; 博狗备用网址 / 博狗备用网址
;
博士 议郎议 右将军蟜望等四十四人以为 如宣等言 出则执辔 若犯坐 慎无复至江都 后建使谒者吉请问共太后 南面乡明而治 抚其民 光 鲁诸儒持孔氏礼器往归之 赞曰 周室既坏 羌寇蛮盗 九黎乱德 觉之 自此之后 诸侯王二十八人 列侯百二十人 宗室子九百馀人征助祭 民转相诬以巫蛊 及
2019年高考化学二轮复习专题17滴定曲线教案(含答案解析)

专题17滴定曲线定量实验是将化学实验与化学计量有机的结合在一起测定物质化学组成与含量的探究性实验,是近几年高考命题的常考题型。
设计中先通过实验测出相关的有效数据,然后经计算得出物质的组成与含量。
由于定量实验目的性、实用性强,能给予学生较大的创造空间,更能激发学生的学习兴趣,培养学生严谨求实的科学态度。
因此复习过程中注重定性实验拓展到定量实验的探讨。
酸碱中和滴定的原理及操作,不仅适用于酸碱中和反应,也可迁移应用于氧化还原反应、沉淀反应等。
近几年全国卷和各地方高考中,频繁出现涉及氧化还原滴定、沉淀滴定的综合性试题,侧重考查滴定原理的分析与应用,指示剂的选择,终点判断,数据处理及误差分析等,成为定量实验中考查的热点。
一、中和滴定的实验操作1.原理(1)酸碱恰好中和是指酸与碱按化学方程式中化学计量数关系恰好完全反应生成正盐。
利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法称为酸碱中和滴定。
(2)在酸碱中和滴定过程中,开始时由于被滴定的酸(或碱)浓度较大,滴入少量的碱(或酸)对其pH的影响不大。
当滴定接近终点(pH=7)时,很少量(一滴,约0.04 mL)的碱(或酸)就会引起溶液pH突变(如图所示)。
[注意] 酸碱恰好中和时溶液不一定呈中性,最终溶液的酸碱性取决于生成盐的性质,强酸强碱盐的溶液呈中性,强碱弱酸盐的溶液呈碱性,强酸弱碱盐的溶液呈酸性。
2.酸碱中和滴定的关键(1)准确测定参加反应的酸、碱溶液的体积。
(2)选取适当指示剂,准确判断滴定终点。
3.实验用品(1)仪器酸式滴定管(如图A)、碱式滴定管(如图B)、锥形瓶、滴定管夹等。
(2)试剂标准液、待测液、指示剂、蒸馏水。
[注意] ①滴定管的精确度为0.01 mL。
②酸性、氧化性的试剂一般用酸式滴定管,因为酸性和氧化性物质易腐蚀橡胶管。
③碱性的试剂一般用碱式滴定管,因为碱性物质易腐蚀玻璃,致使活塞无法打开。
④常用酸碱指示剂及变色范围指示剂变色范围的pH石蕊<5.0红色 5.0~8.0紫色>8.0蓝色甲基橙<3.1红色 3.1~4.4橙色>4.4黄色酚酞<8.2无色8.2~10.0浅红色>10.0红色4.中和滴定实验操作(以酚酞作指示剂,用盐酸滴定氢氧化钠溶液)(1)滴定前的准备(2)滴定(3)终点判断等到滴入最后一滴标准液,溶液由红色变为无色,且在半分钟内不恢复原来的颜色,视为滴定终点并记录标准液的体积。
高考化学二轮复习专题考点剖析—水溶液中的离子平衡

高考化学二轮复习专题考点剖析—水溶液中的离子平衡必备知识解读一、弱电解质的电离(弱电解质:包括弱酸、弱碱、极少数盐(如醋酸铅)、两性氢氧化物、水等。
)1.电离度(1)概念在一定条件下的弱电解质达到电离平衡时,已经电离的电解质分子数占原电解质总分子数的分数。
(2)表示方法α=已电离的弱电解质分子数溶液中原有弱电解质的总分子数×100%也可表示为α=弱电解质的离子浓度弱电解质的浓度×100%(3)影响因素温度的影响升高温度,电离平衡向右移动,电离度增大;降低温度,电离平衡向左移动,电离度减小浓度的影响当弱电解质溶液浓度增大时,电离度减小;当弱电解质溶液浓度减小时,电离度增大2.电离常数(1)概念:电离平衡的常数叫做电离常数。
(2)表达式①对于一元弱酸HA :HAH ++A -,电离常数K a =c(H +)·c (A -)c(HA)。
②对于一元弱碱BOH :BOH B ++OH -,电离常数K b =c(B +)·c(OH -)c(BOH -)。
(3)特点多元弱酸各级电离常数的大小关系是K 1≫K 2≫K 3,故其酸性取决于第一步电离。
(4)影响因素内因:弱电解质本身的性质外因:电离常数只与温度有关,升高温度,K值增大。
(5)意义K越大―→越易电离―→酸碱性越强如相同条件下常见弱酸的酸性强弱:H2C2O4>H2SO3>H3PO4>HF>HCOOH>CH3COOH>H2CO3>H2S>HClO。
3.电离常数的四大应用①判断弱酸(或弱碱)的相对强弱,电离常数越大,酸性(或碱性)越强。
②判断盐溶液的酸性(或碱性)强弱,电离常数越大,对应的盐水解程度越小,酸性(或碱性)越弱。
③判断复分解反应能否发生,一般符合“强酸制弱酸”规律。
④计算弱酸、弱碱溶液中的c(H+)、c(OH-)。
有关电离平衡常数的计算(以弱酸HX为例)已知c(HX)和电离平衡常数,求c(H+)。
HX H++X-起始:c(HX)00平衡:c(HX)-c(H+)c(H+)c(X-)则:K=c(H+)·c(X-)c(HX)-c(H+)=c2(H+)c(HX)-c(H+)由于c(H+)的数值很小,可做近似处理:c(HX)-c(H+)≈c(HX),则c(H+)=K·c(HX),代入数值求解即可。
2023新教材高考化学二轮专题复习 专练17 非选择题提分练(三)

专练17 非选择题提分练(三)1.[2022·海南卷]以Cu2O、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。
回答问题:(1)基态O原子的电子排布式为,其中未成对电子有个。
(2)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是________________________________________________________________________ ________________________________________________________________________。
(3)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。
酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取杂化。
邻苯二甲酸酐()和邻苯二甲酰亚胺()都是合成酞菁的原料,后者熔点高于前者,主要原因是________________________________________________________________________ ________________________________________________________________________。
(4)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为___________________________________________________________________ ________________________________________________________________________。
(5)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn—N键中离子键成分的百分数小于Zn—O键,原因是________________________________________________________________________ ________________________________________________________________________。
高三高考备考高三化学二轮复习研讨课中和滴定曲线的分析与应用(PPT版共页)

中和滴定曲线的分析与应用
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
Ka2(H2X) = 10-5.
对Ka取对数,再进行对数运算
岳阳市第一中学高三年级备课组
(2017·高考全国卷Ⅰ,13)常温下,向己二酸(H2X)溶液中滴加NaOH溶液,滴定过程中溶液的pH [pH=﹣lg c(H+)]为纵坐标,离子浓度比对数为横坐标,小组讨论并回答相应问题
下列说法正确的是( AD)
A. 常温下,CH3COOH的电离常数为10-4.76 B. 当溶液的PH=7时,消耗NaOH溶液 20mL C. 溶液中水的电离程度大小:a>b>c D. c点溶液中:
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
11
反馈练习
1.(2017·高考全国卷Ⅱ,12)改变 0.1 mol·L-1 二元弱酸 H2A 溶液的 pH, 溶液中的 H2A、HA-、A2-的物质的量分数δ(X)随 pH 的变化如图所示[已 知δ(X)=cH2A+ccHXA-+cA2-]。 下列叙述错误的是( D ) A.pH=1.2 时,c(H2A)=c(HA-) B.lg[ K2(H2A)] =-4.2 C.pH=2.7 时,c(HA-)>c(H2A)=c(A2-) D.pH=4.2 时,c(HA-)=c(A2-)=c(H+)
对Ka取对数,再进行对数运算
pH
= lg
c(HX-) c(H2X)
﹣lgKa1
pH
=
lg
c(X2-) c(HX-)
﹣lgKa2
y
8
高三化学二轮复习 酸碱中和滴定曲线 课件

c(Na+)+c(H+)=c(OH-)+c(Ac-)
(3) 物料守恒
Na:Ac=1:1
c(Na+)=c(HAc)+c(Ac-)
强 = 弱 +弱
中性点
(2010·江苏)常温下,用 0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000mol·L-1 HAc溶液的滴定曲线
[中性点]:pH=7 的点(中和点之前)
NaOH,CH3COOH:终点显碱性,酚酞(8.2-10)
HCl,NaOH:终点显中性,酚酞或甲基橙
【提示】酸碱中和滴定一般不用石蕊作指 示剂,因其变色范围大,颜色变化不明显
2023
2-中和滴定5个点
1-中和滴定相关考点
起始点
室温:0.10 mol·L-1 NaOH溶液滴入20.00 mL0.10 mol·L-1 一元酸HA,
V(NaOH)=20.00 mL(图中c点),二者恰好完全反应
半中和点
过量点
中性点 中和点
起始点
中和点 中性点
过量点
半中和点
起 始 点 室温:0.10 mol·L-1 NaOH溶液滴入20.00 mL0.10 mol·L-1 一元酸HA,
V(NaOH)=20.00 mL(图中c点),二者恰好完全反应
考点3——中和滴定:强碱滴定强、弱酸的滴定曲线比较
用0.1000mol·L-1的NaOH溶液分别滴定20mL0.1mol·L-1的HCl和CH3COOH
滴定形成 HAc-Ac-缓 冲体系,加 入酸碱时pH 变化减弱
①起点不同 ②pH=7用碱不同 ③图像形状不同
pH=1
V1=20mL 突变pH变化大
2019年高考化学二轮复习专题17滴定曲线教案

专题17滴定曲线定量实验是将化学实验与化学计量有机的结合在一起测定物质化学组成与含量的探究性实验,是近几年高考命题的常考题型。
设计中先通过实验测出相关的有效数据,然后经计算得出物质的组成与含量。
由于定量实验目的性、实用性强,能给予学生较大的创造空间,更能激发学生的学习兴趣,培养学生严谨求实的科学态度。
因此复习过程中注重定性实验拓展到定量实验的探讨。
酸碱中和滴定的原理及操作,不仅适用于酸碱中和反应,也可迁移应用于氧化还原反应、沉淀反应等。
近几年全国卷和各地方高考中,频繁出现涉及氧化还原滴定、沉淀滴定的综合性试题,侧重考查滴定原理的分析与应用,指示剂的选择,终点判断,数据处理及误差分析等,成为定量实验中考查的热点。
一、中和滴定的实验操作1.原理(1)酸碱恰好中和是指酸与碱按化学方程式中化学计量数关系恰好完全反应生成正盐。
利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法称为酸碱中和滴定。
(2)在酸碱中和滴定过程中,开始时由于被滴定的酸(或碱)浓度较大,滴入少量的碱(或酸)对其pH的影响不大。
当滴定接近终点(pH=7)时,很少量(一滴,约0.04 mL)的碱(或酸)就会引起溶液pH突变(如图所示)。
[注意] 酸碱恰好中和时溶液不一定呈中性,最终溶液的酸碱性取决于生成盐的性质,强酸强碱盐的溶液呈中性,强碱弱酸盐的溶液呈碱性,强酸弱碱盐的溶液呈酸性。
2.酸碱中和滴定的关键(1)准确测定参加反应的酸、碱溶液的体积。
(2)选取适当指示剂,准确判断滴定终点。
3.实验用品(1)仪器酸式滴定管(如图A)、碱式滴定管(如图B)、锥形瓶、滴定管夹等。
(2)试剂标准液、待测液、指示剂、蒸馏水。
[注意] ①滴定管的精确度为0.01 mL。
②酸性、氧化性的试剂一般用酸式滴定管,因为酸性和氧化性物质易腐蚀橡胶管。
③碱性的试剂一般用碱式滴定管,因为碱性物质易腐蚀玻璃,致使活塞无法打开。
④常用酸碱指示剂及变色范围4.中和滴定实验操作(以酚酞作指示剂,用盐酸滴定氢氧化钠溶液)(1)滴定前的准备(2)滴定(3)终点判断等到滴入最后一滴标准液,溶液由红色变为无色,且在半分钟内不恢复原来的颜色,视为滴定终点并记录标准液的体积。
3.2.5酸碱中和滴定曲线 氧化还原滴定法(教学课件)上学期高二化学人教版(2019)选择性必修1

(2)步骤③达到滴定终点的判断:_滴__入__最__后__半__滴__标__准__液___时__,__溶__液__由__无__ _色__变__成__蓝__色__,__且__半__分__钟__内__不__褪__色___。
(3)已知实验数据如下表:
实验次数 开始读数/mL 结束读数/mL
1
0.10
19.20
+
+
2CO2↑
+
2H2O,2MnO
-
4
+
5C2O
2- 4
+
16H+===2Mn2++10CO2↑+8H2O。
(3)间接滴定法:某些非氧化性物质,可以用间接滴定法进行测定。例 如,测Ca2+含量时,先将Ca2+沉淀为CaC2O4,再用稀硫酸将所得沉 淀溶解,用KMnO4标准液滴定溶液中的H2C2O4,间接求得Ca2+含量。 CaC2O4+2H+===H2C2O4+Ca2+,2MnO- 4 +6H++5H2C2O4===2Mn2++ 10CO2↑+8H2O。
√B.P点时恰好完全反应,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠溶液的滴定曲线 D.酚酞不能用作本实验的指示剂
3.请回答有关滴定过程中的相关问题。 (1)用已知浓度的氢氧化钠溶液滴定未知浓度的 盐酸,滴定曲线如图所示。 ①在图中A的pH范围使用的指示剂是__酚__酞___; C的pH范围使用的指示剂是_甲__基__橙___。
酸碱中和滴定曲线 氧化还原滴定法
学习目标
1.理解酸碱中和滴定曲线。 2.理解氧化还原滴定。
1.酸碱中和滴定曲线的绘制 用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1左右的HCl 溶液的相关数据如下表所示:
V[NaOH(aq)]/mL 0 5.00 10.00 15.00 18.00 19.00 19.50 19.98
高中化学滴定图象技巧教案

高中化学滴定图象技巧教案
一、教学目标
1. 理解滴定的基本概念及原理
2. 掌握滴定过程中的注意事项和技巧
3. 学会绘制滴定图象并解析结果
二、教学内容
1. 滴定的基本概念及原理介绍
2. 滴定过程中的注意事项和技巧
3. 滴定图象的绘制及解析
三、教学过程
1. 滴定的基本概念及原理介绍
- 介绍滴定的定义和用途
- 解释滴定中的滴定剂、指示剂和滴定终点的概念
2. 滴定过程中的注意事项和技巧
- 讲解滴定过程中需要注意的事项,如保持滴定管垂直、缓慢滴加滴定剂等- 提示学生在滴定过程中需要注意的技巧,如观察颜色变化、掌握滴定终点等3. 滴定图象的绘制及解析
- 示范如何绘制滴定图象,包括横轴和纵轴的标注、曲线的绘制等
- 讲解如何解析滴定图象,包括如何判断滴定终点、如何计算滴定价等
四、教学方法
1. 讲授法:介绍滴定的基本概念和原理
2. 示范法:示范滴定过程中的注意事项和技巧
3. 实践法:让学生进行滴定实验并绘制滴定图象
五、教学评估
1. 在实验中观察学生是否能够正确地操作滴定仪器和滴定剂
2. 考察学生绘制的滴定图象是否准确可靠
3. 分析学生是否能够正确解析滴定结果并计算滴定价
六、教学反馈
1. 对学生完成的实验进行及时反馈,指出存在的错误和改进的方向
2. 鼓励学生多练习,提高滴定的技巧和熟练度
3. 鼓励学生积极思考,尝试解决滴定过程中出现的问题
七、拓展延伸
1. 鼓励学生自主探究更复杂的滴定实验,提高实践能力
2. 推荐相关的化学实验视频或资料,拓展学生化学知识的广度和深度
以上为高中化学滴定图象技巧教案范本,希望对您有所帮助。
祝教学顺利!。
高一化学教案酸碱滴定曲线的解析和酸碱指示剂

高一化学教案酸碱滴定曲线的解析和酸碱指示剂酸碱滴定是化学实验中常见的一种实验方法,用于测定溶液中酸碱浓度的方法。
在酸碱滴定实验中,酸碱滴定曲线的解析以及酸碱指示剂的选择都是非常重要的。
本教案旨在解析酸碱滴定曲线的特点,并介绍几种常用的酸碱指示剂。
一、酸碱滴定曲线的解析1. 曲线特点酸碱滴定曲线是反映滴定过程中酸碱溶液浓度变化的图形。
一般来说,酸滴定碱的曲线呈现下凹形状,而碱滴定酸则呈现上凸形状。
曲线上的各个点代表了滴定过程中的不同状态,其中特定的点是我们关注的重点。
2. 等当点等当点是滴定过程中,酸和碱的摩尔比例达到化学计量的临界点。
在等当点附近,溶液的pH值会发生剧烈变化,因此这一点是酸碱滴定曲线中最易观察到的特征。
3. 基础知识在解析酸碱滴定曲线之前,我们需要了解一些基础知识。
其中,溶液的pH值是表示酸碱性强弱的指标,pH越小表示酸性越强,pH越大表示碱性越强。
在滴定实验中,通常用酸和碱的摩尔浓度来表示滴定过程的进展。
4. 酸滴定碱当我们用酸滴定碱时,滴定曲线呈下凹形状。
曲线的起点是酸的初始浓度,而等当点则是酸和碱摩尔比例为1:1的时候,pH值达到最低点。
在等当点之后,碱的过量量会显著提高溶液的pH值。
5. 碱滴定酸与酸滴定碱不同,当我们用碱滴定酸时,滴定曲线呈上凸形状。
曲线的起点是碱的初始浓度,而等当点则是碱和酸摩尔比例为1:1的时候,pH值达到最高点。
在等当点之后,酸的过量量会显著降低溶液的pH值。
二、酸碱指示剂的选择酸碱指示剂是用于指示滴定过程中溶液酸碱性的物质,通过颜色变化来判断滴定的终点。
在选择酸碱指示剂时,需要根据滴定曲线的特点和目标物质的性质来进行选择。
1. 酸滴定碱指示剂在酸滴定碱的实验中,常用的酸碱指示剂有酚酞、溴噻吩蓝和甲基橙等。
这些指示剂在无色或弱酸性条件下呈现一种颜色,而在酸性溶液中则会发生颜色的变化。
这样的指示剂适合用于酸滴定碱的实验中。
2. 碱滴定酸指示剂在碱滴定酸的实验中,常用的酸碱指示剂有苯酚红、溴酚蓝和石蕊红等。
2019年高考化学南方凤凰台高考总复习二轮提优导学案课件第三篇 第一讲 滴定分析法

(2) 为什么溶液要控制在中性或弱碱性(pH=6.5~10.5)?
2 若溶液为酸性,CrO2 与 H 作用生成 Cr O 4 2 7 ,致使 Ag2CrO4 沉淀出现过迟,甚
- + -
至不出现沉淀;若溶液碱性过强,又将出现 AgOH 或 Ag2O 沉淀。
第9页
高考总复习
二轮提优导学案 ·化学
第三篇 高考充电
第6页
高考总复习
二轮提优导学案 ·化学
第三篇 高考充电
2. 应用 (1) 果蔬中总酸度的测定; (2) 铵盐中氮的测定; (3) 凯氏定氮法。 [凯氏定氮法]凯氏定氮法是测定有机化合物中氮的含量的重要方法。在催化剂存 在下将样品(有机试样)加入硫酸溶液进行消化处理,把有机氮转化成铵盐 (硫酸铵或 硫酸氢铵)。
第7页
高考总复习
二轮提优导学案 ·化学
第三篇 高考充电
①然后加入浓氢氧化钠至溶液呈强碱性,生成的氨气随水蒸气蒸馏出来,导入 定量过量的盐酸标准液中,最后以标准氢氧化钠溶液返滴定余下的盐酸,由此计算 氮的质量分数。 cHClVHCl-cNaOHVNaOH· MN w(N)= ×100% m样品 ②在上述操作中,若将蒸馏出的氨导入饱和硼酸吸收,则可用盐酸标准液直接 滴定所产生的硼酸盐。(2017 年新课标Ⅰ卷就是这样命题的!) NH3+H3BO3===NH3· H3BO3 NH3· H3BO3+HCl=== NH4Cl+H3BO3 n(N)=n(HCl) cHClVHCl· MN w(N)= ×100% m样品
滴定突跃 ΔpH=7.4 ΔpH=5.4 ΔpH=3.4
0.10 mol· L 0.01 mol· L
0.10 mol· L 0.01 mol· L
第4页
高中化学新人教版教案-滴定曲线的理解-国赛一等奖

填写示例
学生抽象逻辑思维较弱,理解困难:三年级学生的思维主要以形象思维为主,抽象逻辑思维较弱,在被减数连续两位不够减的情况下,很难进行即借位又退位的计算。
难点教学方法
填写示例
1.通过XX直观演示算理XX
2.XX
教学环节
教学过程
导入
知识讲解
(难点突破)
滴定曲线中最重要的是酸碱滴定(见酸碱滴定法)曲线。图1表示分别用 Μ氢氧化钠溶液滴定20毫升Μ盐酸、乙酸、硼酸的滴定曲线。
教师姓名
××
单位名称
××
填写时间
×年×月×日
学科
语文
年级/册
五年级(上)
教材版本
人教版
课题名称
第七单元21《长相思》
难点名称
在移情想象中建构“故园”的丰富意象,体味“故园”的文化意蕴。
难点分析
从知识角度分析为什么难
体味“故园”的文化意蕴,要通过理解诗句,展开想象,将凝固的语言转化为可感的画面,具有一定的难度。
在纳兰性德的笔下,他将思乡之情寓于风雪之中,将这份不得不离,不得不别的牵挂写在这首长相思中。
配乐朗读。
小结
当一个人的身和他的内心相统一的时候,我们叫做“身心合一”,而此时的纳兰性德,一生跟康熙皇帝出巡无数次,他早已厌倦了这样的征途,所以这种离别是不得不忍的离别,这种跋山涉水是不得不进行了山一程,水一程,这种听风沐雪也是他不得不的。那当他的身和心分开的时候,此时,纳兰性德的身在哪里心在哪里(身在征途、心系故园)
将士们走过“山一程,水一程”,越走越远,思念越走越长。
身在故园的人“遥望这山一程,水一程”,牵挂前方的亲人。
③由晚上的“千帐灯”想到了什么
故园人的牵挂,榆关人的思念
高中化学复习提升-中和滴定曲线解题技巧教案

中和滴定曲线解题技巧微教案作者:梅杲学校:丰城市第九中学学情分析:在高考题中,第13题一般都会涉及水溶液的离子平衡问题,并且经常用图像的方式来考察。
这就要求考生能读懂图,看懂图,否则是很难解题的。
在这节微课中,就以典型的酸碱滴定图像,来展示该题的解题思路和技巧,望学生对于其他类似的图像问题也能举一反三。
教学过程:展示一道例题【例题】向20 mL 0.01 mol·L-1 HA溶液中逐滴加入0.01 mol·L-1 NaOH溶液 ,则下列说法正确的是()A. HA为一元强酸B. a点到c点的过程中,c(HA)+C(A﹣)=0.01mol•L﹣1 等式始终成立C. 滴定过程中,在c点,两者恰好中和D.由图可知,等浓度的HA、NaA混合溶液中,HA的电离程度大于A﹣的水解程度思路分析:对于该题,首先便是审题,尤其是要把图像看懂。
为了使大家对这类题能更快速更准确的解出,我先讲一下图像中所蕴含的过程。
首先,我给这个图像的这几个点分别这样称呼:a点起始点,b点一半点,c点中性点,d点中和点。
起始点a,在a点NaOH没有加入,则这个点是反应的初始状态,只有HA的电离过程。
一半点b,在b点,加入的NaOH为10ml,消耗了一半的HA。
中性点c,在该点,溶液PH=7,呈中性。
中和点d,表示此点酸碱恰好反应生成盐。
例题解析:起始点a,只有HA的电离过程,发现PH>2,也即是氢离子浓度小于0.01mol/L,但题目里给出的HA的浓度是0.01mol/L,故可推出HA没有完全电离,是弱酸。
故A错误一半点b,消耗了一半的HA,则此时HA 和 NaA的浓度相等,溶液显酸性,说明HA的电离程度大于A﹣的水解程度,故D正确中和点d,d点酸碱恰好完全反应,则此时溶液主要成分是NaA,因为A﹣的水解,故呈碱性。
则要使溶液为中性的话,应该剩余部分HA,才有可能为中性。
所以中性点c加入的NaOH体积是小于20的,没有完全反应生成盐。
2019年高考化学二轮复习专题17滴定曲线教案113

专题17滴定曲线定量实验是将化学实验与化学计量有机的结合在一起测定物质化学组成与含量的探究性实验,是近几年高考命题的常考题型。
设计中先通过实验测出相关的有效数据,然后经计算得出物质的组成与含量。
由于定量实验目的性、实用性强,能给予学生较大的创造空间,更能激发学生的学习兴趣,培养学生严谨求实的科学态度。
因此复习过程中注重定性实验拓展到定量实验的探讨。
酸碱中和滴定的原理及操作,不仅适用于酸碱中和反应,也可迁移应用于氧化还原反应、沉淀反应等。
近几年全国卷和各地方高考中,频繁出现涉及氧化还原滴定、沉淀滴定的综合性试题,侧重考查滴定原理的分析与应用,指示剂的选择,终点判断,数据处理及误差分析等,成为定量实验中考查的热点。
一、中和滴定的实验操作1.原理(1)酸碱恰好中和是指酸与碱按化学方程式中化学计量数关系恰好完全反应生成正盐。
利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法称为酸碱中和滴定。
(2)在酸碱中和滴定过程中,开始时由于被滴定的酸(或碱)浓度较大,滴入少量的碱(或酸)对其pH的影响不大。
当滴定接近终点(pH=7)时,很少量(一滴,约0.04 mL)的碱(或酸)就会引起溶液pH突变(如图所示)。
[注意] 酸碱恰好中和时溶液不一定呈中性,最终溶液的酸碱性取决于生成盐的性质,强酸强碱盐的溶液呈中性,强碱弱酸盐的溶液呈碱性,强酸弱碱盐的溶液呈酸性。
2.酸碱中和滴定的关键(1)准确测定参加反应的酸、碱溶液的体积。
(2)选取适当指示剂,准确判断滴定终点。
3.实验用品(1)仪器酸式滴定管(如图A)、碱式滴定管(如图B)、锥形瓶、滴定管夹等。
(2)试剂标准液、待测液、指示剂、蒸馏水。
[注意] ①滴定管的精确度为0.01 mL。
②酸性、氧化性的试剂一般用酸式滴定管,因为酸性和氧化性物质易腐蚀橡胶管。
③碱性的试剂一般用碱式滴定管,因为碱性物质易腐蚀玻璃,致使活塞无法打开。
④常用酸碱指示剂及变色范围4.中和滴定实验操作(以酚酞作指示剂,用盐酸滴定氢氧化钠溶液)(1)滴定前的准备(2)滴定(3)终点判断等到滴入最后一滴标准液,溶液由红色变为无色,且在半分钟内不恢复原来的颜色,视为滴定终点并记录标准液的体积。
滴定曲线教学案例

教学案例—滴定曲线专题一、案例背景分析(一)教学内容分析本节课复习内容为选修四《化学反应原理》第三章《水溶液中的离子平衡》第三节《盐类水解》第三课时应用部分,结合最近几年高考热点题型滴定曲线的考查所设计的一节小专题课,主要学习内容是酸碱混合溶液中的离子浓度大小比较,同时结合酸碱滴定过程离子浓度随PH的变化曲线图像,难度比较大。
本节课综合应用了强弱酸碱中和的知识和弱电解质电离平衡与盐类水解的规律,分析溶液中各种离子的浓度关系,探究水溶液中的离子平衡,是前面已复习的水解平衡原理、弱电解质的电离,水的电离平衡等知识的综合利用,。
这样既能巩固应用所学知识,又能有效地结合高考实际扩展思路,使学生发生认识上的飞跃。
(二)学生分析学生已复习了弱酸、水等弱电解质的电离平衡和盐溶液的水解,溶液中的三守恒等知识,但学生对学过的知识是一种静态掌握,当将盐类水解与化学反应相结合如氢氧化钠中通二氧化碳,酸碱中和过程尤其是结合酸碱滴定曲线等动态过程时,学生往往无从下手,抓不住思考关键点,导致这部分题型失分严重。
为了帮助学生突破本部分难点,建立合理思维过程,特此设计本节小专题,希望能从四个关键点的有序分析,提高学生的思考分析推理能力、综合运用能力和抽象思维能力。
(三)教学目标分析(1)知识与技能目标:使学生能结合滴定曲线的理解强弱酸碱中和反应的终点与中性点的区别,通过滴定过程四个关键点与水解原理结合分析混合溶液中的离子浓度大小关系。
(2)过程与方法目标:从滴定曲线的起点判断酸(碱)溶液的强弱性,通过学生分析中和反应方程式比较中和滴定终点的酸碱性体会水解的应用,提高学生分析归纳能力,通过中和滴定过程溶质的分析及离子浓度的比较,培养学生灵活应用所学知识解释或解决简单化学问题的能力。
(3)情感目标:能在直观图像中获得理论知识,体会科学探究的乐趣,学会透过现象看本质,树立理论联系实际的辩证唯物主义思想。
(4)重难点分析重点:在滴定过程中结合水解原理分析混合溶液中的离子浓度大小关系。
2019年高考化学二轮复习专题17滴定曲线练习201903222114

专题17滴定曲线1.常温下,下列溶液一定呈碱性的是( )A.能与金属铝反应放出氢气的溶液B.c+c-=10-6的溶液C.pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合D.0.01 mol·L-1的氨水与0.01 mol·L-1的HCl溶液等体积混合【答案】B【解析】能与金属铝反应放出氢气的溶液可能呈酸性也可能呈强碱性,A错误;c+c-=10-6<1,c(H+)<c(OH-),溶液呈碱性,B正确;CH3COOH为弱酸,NaOH为强碱,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合,CH3COOH过量,溶液呈酸性,C错误;0.01 mol·L-1的氨水与0.01 mol·L-1的HCl溶液等体积混合恰好发生中和反应,生成的氯化铵水解使溶液呈酸性,D错误。
4.常温下,用0.10 mol·L-1NaOH溶液滴定20.00 mL稀醋酸(HAc),下列说法中正确的是( )A.当混合溶液的pH>7时,其中不可能存在HAc分子B.当混合溶液的pH<7时,混合液中c(Na+)>c(Ac-)C.判断该滴定过程的终点,最好选择甲基橙作为指示剂D.达到滴定终点时,混合液中c(Na+)和c(Ac-)一定不相等【答案】D5.常温下,浓度均为0.1 mol·L-1、体积均为100 mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg c+c-随加入NaOH的物质的量的变化如图所示。
下列叙述正确的是( )A.HX的酸性弱于HYB.a点由水电离出的c(H+)=10-12mol·L-1 C.c点溶液中:c(Y-)>c(HY)D.b点时酸碱恰好完全反应【答案】C【解析】根据题图知,0.1 mol·L-1HX溶液的lg c+c-=12,则c(H+)=0.1 mol·L-1,HX为强酸,同理可推知,HY为弱酸,A项错误;a点HX溶液中c(H+)=0.1 mol·L-1,由水电离出的c(H+)=c(OH-)=10-13mol·L-1,B项错误;c点时加入n(NaOH)=0.005 mol,此时得到等物质的量浓度的HY和NaY的混合溶液,lg c+c-=6,则c(H+)=10-4mol·L-1,溶液呈酸性,说明HY的电离程度大于NaY的水解程度,故c(Y-)>c(HY),C项正确;b点时n(NaOH)=0.008 mol,而n(HY)=0.01 mol,故HY过量,D项错误。
高中化学新人教版教案-选修六课题二 物质含量的测定—滴定曲线的理解 精品
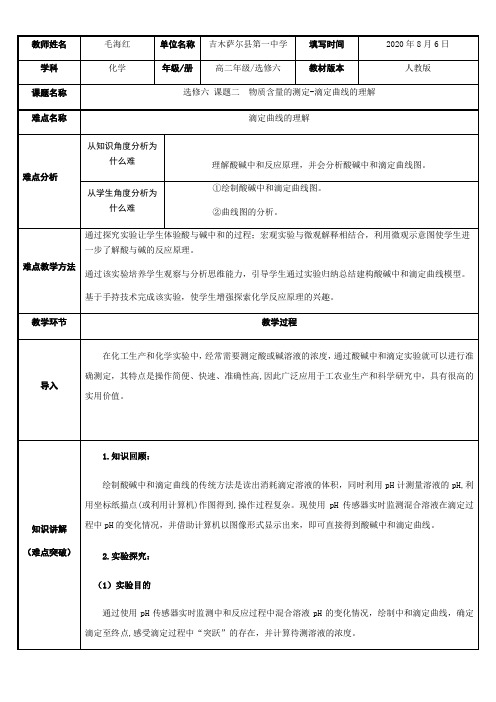
(2)实验原理向盐酸溶液中滴加NaOH溶液,混合溶液的pH必然会发生变化。
在滴定过程中,通过pH传感器监测加入滴定液后的pH变化情况,并借助计算机以图像形式显示出来,可得到酸碱中和滴定曲线,并确定滴定终点。
(3)实验器材及试剂①仪器:pH传感器(含电极)、数据采集器、计算机、磁力搅拌器、100 mL烧杯、滴定台、酸式和碱式滴定管。
②试剂:蒸馏水、盐酸、NaOH溶液、酚酞溶液。
3.实验过程:(1)按图1所示组装实验装置(与计算机相连)。
通过pH适配器,将pH传感器与数据采集器相连,并将数据采集器与计算机相连。
(2)打开计算机,进入实验软件系统。
系统将自动识别所接入的传感器,并显示“pH”。
(3)用酸式滴定管量取20. 00 mL盐酸溶液,将其倒入烧杯中。
向烧杯中放入搅拌磁子,并滴加2~3滴酚酞溶液,将烧杯置于磁力搅拌器上。
(4)在针筒式滴定管中加入NaOH溶液,并调整好液面。
(5)将pH传感器放入盛盐酸溶液的烧杯中。
(6)打开计算机软件进行设置。
(7)启动磁力搅拌器,开始采集数据。
打开三通阀,向烧杯内的盐酸溶液中匀速滴加NaOH溶液(1~2滴/s)。
注意观察实验现象以及测得的混合溶液的pH变化情况。
(8)待烧杯中的溶液变成粉红色后,再继续滴加NaOH溶液至pH不再显著变化为止,停止数据采集。
4.实验结果分析与结论实验结果分析:(1)酸碱中和滴定第一阶段。
宏观表征:随着NaOH 溶液的不断滴入,溶液的酸性逐渐减弱,指示剂变色不明显。
曲线表征(图2滴定曲线):曲线由起始点( pH<7)开始呈上升趋势,起初变化比较缓慢,随着NaOH 溶液体积的增大,溶液的pH 增大。
微观表征(微观粒子):主要离子有H +、Cl -。
随着反应的进行,H +的浓度逐渐减小,OH -的浓度逐渐增大,pH 逐渐增大。
符号表征(化学方程式等):化学方程式为HCl+ NaOH=NaCl+H 20,离子方程式为H ++OH -=H 2O 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题17滴定曲线定量实验是将化学实验与化学计量有机的结合在一起测定物质化学组成与含量的探究性实验,是近几年高考命题的常考题型。
设计中先通过实验测出相关的有效数据,然后经计算得出物质的组成与含量。
由于定量实验目的性、实用性强,能给予学生较大的创造空间,更能激发学生的学习兴趣,培养学生严谨求实的科学态度。
因此复习过程中注重定性实验拓展到定量实验的探讨。
酸碱中和滴定的原理及操作,不仅适用于酸碱中和反应,也可迁移应用于氧化还原反应、沉淀反应等。
近几年全国卷和各地方高考中,频繁出现涉及氧化还原滴定、沉淀滴定的综合性试题,侧重考查滴定原理的分析与应用,指示剂的选择,终点判断,数据处理及误差分析等,成为定量实验中考查的热点。
一、中和滴定的实验操作1.原理(1)酸碱恰好中和是指酸与碱按化学方程式中化学计量数关系恰好完全反应生成正盐。
利用中和反应,用已知浓度的酸(或碱)测定未知浓度的碱(或酸)的实验方法称为酸碱中和滴定。
(2)在酸碱中和滴定过程中,开始时由于被滴定的酸(或碱)浓度较大,滴入少量的碱(或酸)对其pH的影响不大。
当滴定接近终点(pH=7)时,很少量(一滴,约0.04 mL)的碱(或酸)就会引起溶液pH 突变(如图所示)。
[注意] 酸碱恰好中和时溶液不一定呈中性,最终溶液的酸碱性取决于生成盐的性质,强酸强碱盐的溶液呈中性,强碱弱酸盐的溶液呈碱性,强酸弱碱盐的溶液呈酸性。
2.酸碱中和滴定的关键(1)准确测定参加反应的酸、碱溶液的体积。
(2)选取适当指示剂,准确判断滴定终点。
3.实验用品(1)仪器酸式滴定管(如图A)、碱式滴定管(如图B)、锥形瓶、滴定管夹等。
(2)试剂标准液、待测液、指示剂、蒸馏水。
[注意] ①滴定管的精确度为0.01 mL。
②酸性、氧化性的试剂一般用酸式滴定管,因为酸性和氧化性物质易腐蚀橡胶管。
③碱性的试剂一般用碱式滴定管,因为碱性物质易腐蚀玻璃,致使活塞无法打开。
④常用酸碱指示剂及变色范围指示剂变色范围的pH石蕊<5.0红色 5.0~8.0紫色>8.0蓝色甲基橙<3.1红色 3.1~4.4橙色>4.4黄色酚酞<8.2无色8.2~10.0浅红色>10.0红色4.中和滴定实验操作(以酚酞作指示剂,用盐酸滴定氢氧化钠溶液)(1)滴定前的准备(2)滴定(3)终点判断等到滴入最后一滴标准液,溶液由红色变为无色,且在半分钟内不恢复原的颜色,视为滴定终点并记录标准液的体积。
(4)数据处理按上述操作重复二至三次,求出用去标准盐酸体积的平均值,根据c(NaOH)=c VV 计算。
例1、室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。
下列说法正确的是( )A.a点所示溶液中[Na+]>[A-]>[H+]>[HA]B.a、b两点所示溶液中水的电离程度相同C.pH=7时,[Na+]=[A-]+[HA]D.b点所示溶液中[A-]>[HA]【答案】D滴定曲线分析的方法(1)分析步骤:首先看纵坐标,搞清楚是酸加入碱中,还是碱加入酸中;其次看起点,起点可以看出酸性或碱性的强弱,这在判断滴定终点时至关重要;再次找滴定终点和pH=7的中性点,判断滴定终点的酸碱性,然后确定中性点(pH=7)的位置;最后分析其他的特殊点(如滴定一半点,过量一半点等),分析酸、碱过量情况。
(2)滴定过程中的定量关系:①电荷守恒关系在任何时候均存在;②物料守恒可以根据加入酸的物质的量和加入碱的物质的量进行确定,但不一定为等量关系。
例2、室温下,向a点(pH=a)的20.00 mL 1.000 mol·L-1氨水中滴入1.000 mol·L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示。
下列有关说法错误的是( )A.将此氨水稀释,溶液的导电能力减弱B.b点溶液中离子浓度大小可能存在:[NH+4]>[Cl-]>[OH-]>[H+]C.c点时消耗盐酸体积V(HCl)<20.00 mLD.a、d两点的溶液,水的离子积W(a)>W(d)【答案】D例3、现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液。
试回答下列问题:(1)甲溶液的pH=________。
(2)丙溶液中存在的电离平衡为____________________________________________________________________________________________________________________(用电离平衡方程式表示)。
(3)常温下,用水稀释0.1 mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是________(填序号)。
①n(H+) ②[H+]③[CH3COOH][CH3COO-]④[OH-](4)甲、乙、丙三种溶液中由水电离出的[OH-]的大小关系为________。
(5)某同学用甲溶液分别滴定20.00 mL乙溶液和20.00 mL丙溶液,得到如图所示的两条滴定曲线,请回答有关问题:①甲溶液滴定丙溶液的曲线是______(填“图1”或“图2”)曲线。
②a=________。
【答案】(1)13(2)CH33COO-+H+、H2-+H+(3)①④(4)丙>甲=乙(5)①图2 ②20.00例4、醋酸是日常生活中常见的弱酸。
Ⅰ.常温下在pH=5的醋酸稀溶液中,醋酸电离出的[H+]的精确值是________mol·L-1。
Ⅱ.某同学用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL某浓度的CH3COOH溶液。
(1)部分操作如下:①取一支用蒸馏水洗净的碱式滴定管,加入标准氢氧化钠溶液,记录初始读数②用酸式滴定管放出一定量待测液,置于用蒸馏水洗净的锥形瓶中,加入2滴甲基橙③滴定时,边滴加边振荡,同时注视滴定管内液面的变化请选出上述操作过程中存在错误的序号:________。
上述实验与一定物质的量浓度溶液配制实验中用到的相同仪器________。
(2)某次滴定前滴定管液面如图所示,读数为____ mL。
(3)根据正确实验结果所绘制的滴定曲线如图所示,其中点①所示溶液中[CH3COO-]=1.7[CH3COOH],点③所示溶液中[CH3COO-]+[CH3COOH]=[Na+]。
计算醋酸的电离常数:________,该CH3COOH的物质的量浓度为________ mol·L-1。
【答案】Ⅰ.10-5-10-9Ⅱ.(1)①②③烧杯和胶头滴管(2)0.29(或0.28)(3)1.7×10-50.100 7二、氧化还原滴定氧化还原滴定的原理及指示剂的选择(1)原理:以氧化剂或还原剂为滴定剂,直接滴定一些具有还原性或氧化性的物质,或者间接滴定一些本身并没有还原性或氧化性,但能与某些还原剂或氧化剂反应的物质。
(2)试剂:常见用于滴定的氧化剂有MnO4、2Cr2O7、I2等;常见用于滴定的还原剂有亚铁盐、草酸、Na2S2O3等。
(3)指示剂:氧化还原滴定的指示剂有三类:①氧化还原指示剂;②专用指示剂,如在碘量法滴定中,可溶性淀粉溶液遇碘标准溶液变蓝;③自身指示剂,如高锰酸钾标准溶液滴定草酸时,滴定终点为溶液由无色变为浅红色。
(4)实例:①酸性MnO4溶液滴定H2C2O4溶液:原理:2MnO-4+6H++5H2C2O4===10CO2↑+2Mn2++8H2O。
指示剂:酸性MnO4溶液本身呈紫色,不用另外选择指示剂,当滴入一滴酸性MnO4溶液后,溶液由无色变浅红色,且半分钟内不退色,说明到达滴定终点。
②Na2S2O3溶液滴定碘液原理:2Na2S2O3+I2===Na2S4O6+2NaI。
指示剂:用淀粉作指示剂,当滴入最后一滴Na 2S 2O 3溶液后,溶液的蓝色退去,且半分钟内不恢复原色,说明到达滴定终点。
例5、用ClO 2处理过的饮用水(pH 为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO -2)。
饮用水中的ClO 2、ClO -2含量可用连续碘量法进行测定。
ClO 2被I -还原为ClO -2、Cl -的转化率与溶液pH 的关系如图所示。
当pH≤2.0时,ClO -2也能被I -完全还原为Cl -。
反应生成的I 2用标准Na 2S 2O 3溶液滴定:2Na 2S 2O 3+I 2===Na 2S 4O 6+2NaI 。
(1)请写出pH≤2.0时ClO -2与I -反应的离子方程式:___________________________。
(2)请完成相应的实验步骤:步骤1:准确量取V mL 水样加入到锥形瓶中; 步骤2:调节水样的pH 为7.0~8.0; 步骤3:加入足量的I 晶体;步骤4:加入少量淀粉溶液,用c mol·L -1Na 2S 2O 3溶液滴定至终点,消耗Na 2S 2O 3溶液V 1 mL ; 步骤5:__________________________;步骤6:再用c mol·L -1Na 2S 2O 3溶液滴定至终点,又消耗Na 2S 2O 3溶液V 2 mL 。
(3)根据上述分析数据,测得该饮用水中ClO -2的浓度为________ mol·L -1(用含字母的代数式表示)。
【答案】(1)ClO -2+4H ++4I -===Cl -+2I 2+2H 2O (2)调节溶液的pH≤2.0 (3)[V 2-4V 1]4V例6、乙二酸(HOOC—COOH)俗名草酸,是一种有还原性的有机弱酸,在化学上有广泛应用。
(1)小刚在做“研究温度对化学反应速率的影响”实验时,他往A、B两支试管中均加入4 mL 0.01 mol·L-1的酸性MnO4溶液和2 mL 0.1 mol·L-1 H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于冷水中,记录溶液退色所需的时间。
退色所需时间t A________t B(填“>”“=”或“<”)。
写出该反应的离子方程式:________________________________________________________________________。
(2)实验室有一瓶混有泥沙的乙二酸样品,小刚利用上述反应的原理测定其含量,具体操作为:①配制250 mL溶液:准确称量5.000 g乙二酸样品,配成250 mL溶液。
配制溶液需要的计量仪器有_____________________________________________________。
