紫外-可见光谱法
第二章紫外-可见光谱
例如:
CH3OH: n→σ* 所产生的吸收带λmax为183nm. ε=150
三. 常见的光谱术语
1.发色团:
可以使分子在紫外-可见光区产生吸收带的基团. (一般为带π电子基团(C=C,C C,苯环,C=O,N=N,NO2)
如果一个化合物分子中:
-发色团之间不发生共轭: 吸收光谱包括发色团各自的 吸收带
-发色团之间彼此形成共轭体系: 原来各自发色团的吸 收带消失,而产生新的吸收谱带(波长和吸收强度比原 来明显加大)
2.助色团:
有些原子或基团单独在分子中存在时,本身在紫 外区和可见区不产生吸收的原子或基团,当连接发 色团后,使发色团的吸收带波长移向长波, 同时使 吸收强度增加.(助色团一般为带有p电子的原子或 原子团. 如-OH,-OR,-NHR, -SR, -Cl, -Br, I, 烷 基等)
λ/nm
5. 末端吸收
吸收峰随着波长变短而强度增强,直至仪器测量的极 限,而不显示峰型(这主要是因为其最大吸收在短波长 处),这种极限处吸收称为末端吸收.
6. 吸收带的分类
1). K吸收带(源于德文konjugierte, 共轭)
由共轭体系的π→π* 跃迁产生的强吸收带, 一般 εmax>104
2). R吸收带(源于德文radikalartig, 基团)
如果一个分子在不同的pH 值介质中形成阳离子或阴 离子, 吸收波长随离子化而改变
例如
Hale Waihona Puke NH2 H+_
OH
+ NH3
_
OH
O
_
OH
H+
λmax/nm (εmax)
原因
230(8600) 203(7500) 211(6200) 236(9400) 280(1470) 254(160) 270(1450) 287(2600)
5.紫外-可见吸收光谱法

•双波长分光光度计
双波长分光光度计的优点:是可以在有 背景干忧或共存组分吸收干忧的情况下 对某组分进行定量测定。 岛津UV-2700双光束双波长的
5.4 分析条件的选择 (一)显色反应的选择及类型 选择显色反应时应考虑的因素:
灵敏度高、选择性高、生成物稳定、显色剂在测定波 长处无明显吸收,两种有色物最大吸收波长之差:“对比 度”,要求△ > 60nm。
吸光度A与显色剂用量CR 的关系会出现如图所示的几种 情况。选择曲线变化平坦处。
2.反应体系的酸度
在相同实验条件下,分别测定不同pH值条件 下显色溶液的吸光度。选择曲线中吸光度较大且 恒定的平坦区所对应的pH范围。
3.显色时间与温度
由实验确定。
4.溶剂
一般尽量采用水相测定。
(三) 波长的选择
一般根据待测组分的吸收光谱,选择最大 吸收波长作为测定波长。
收物质最大限度的吸光能力,也反映了光度法测定该物质可 能达到的最大灵敏度。 (5)εmax越大表明该物质的吸光能力越强,用光度法测定该 物质的灵敏度越高。 ε>105:超高灵敏; ε=(6~10)×104 :高灵敏;
ε<2×104 :不灵敏。
3. 吸光度A与透光度T的关系
透过光的强度It与入射光的强度Io之比称 为透光度或透光率,用T表示。 T = I t / I0
⑶ π→π*跃迁
所需能量较小,吸收波长处于远紫外区的近紫外端或近 紫外区,摩尔吸光系数εmax一般在104 L· mol-1· cm-1以上,属于
强吸收。不饱和烃、共轭烯烃和芳香烃类均可发生该类跃迁 。如:乙烯π→π*跃迁的λmax为162 nm,εmax为1×104 L·mol1· cm-1。
在波长200-750nm内,基于分子内电子跃迁的吸收 光谱来确定物质的组成、含量,推测物质结构的一种 分析方法,又称为紫外-可见分光光度法。它属于分子 吸收光谱法。
紫外可见光谱法

紫外可见光谱法紫外可见光谱法在分析化学领域中,紫外可见光谱法是一种非常常见的分析方法。
它是利用化合物的吸收和反射能力来确定它们的化学结构和浓度。
该方法可以被广泛应用于许多不同领域,例如生物化学、食品科学、环境科学和医学等。
本文将通过以下五大方面介绍紫外可见光谱法的应用和原理。
一、紫外可见光谱法的基本原理紫外可见光谱法是一种分析方法,它利用化合物吸收和反射光谱的差异性来确定其化学结构和浓度。
在包括紫外线和可见光线在内的一定波长范围内照射样品时,如果样品中存在带有π电子的化合物,它们会吸收一定波长范围内的紫外线或可见光线,所以样品的吸收谱呈现出一定的规律性。
其中最大吸收峰的位置和强度可以用来确定样品中不同化合物的存在和浓度。
二、紫外可见光谱法在生物化学中的应用紫外可见光谱法在生物化学研究中被广泛应用。
例如,该方法可以用于检测DNA、RNA和蛋白质等生物分子的含量和损伤。
此外,生物样品的吸收谱也可以用来确定其空间构象和相互作用。
三、紫外可见光谱法在食品科学中的应用在食品科学中,紫外可见光谱法可以用来检测食品中的营养成分和添加剂。
例如,通过检测胡萝卜素的吸收谱,可以确定食品中维生素A 的含量。
利用这种方法可以提高食品的质量和安全性。
四、紫外可见光谱法在环境科学中的应用紫外可见光谱法在环境科学中也有着重要的应用。
例如,它可以用于检测水中污染物的含量和种类。
此外,该方法还可以用来检测空气中的有机化合物和大气污染物。
五、紫外可见光谱法在医学中的应用紫外可见光谱法在医学研究中也被广泛应用。
例如,它可以用来检测血清或尿液中的代谢产物和蛋白质分析。
此外,该方法还可以用来检测药物的吸收、分布和代谢过程。
结论:综上所述,紫外可见光谱法是一种广泛应用的分析方法。
它在生物化学、食品科学、环境科学和医学等领域中都有着重要的应用。
它的原理是基于化合物吸收和反射光谱的差异性,这使得该方法可以用来确定样品中不同化合物的存在和浓度。
有机波谱分析--紫外-可见光谱法

②呈一宽峰,且有精细结构。 ③当苯环被烷基以外的基团取代或溶剂极性增大时,精细
结构将会减弱甚至消失。
(4)E 带:芳香族化合物的特征谱带。
Ethylene
●E1带:苯环中“乙烯键”的π→π*跃迁产生的吸收带。 λmax=180~200nm,远紫外区; εmax=5×104L·mol-1·cm-1,强吸收。(不常用)
3.互变异构
4.氢键效应 1)溶质分子间氢键
使n→*共轭受限,轨道能差增大,波长蓝移。
2)分子内氢键:能差减小,波长红移。
例如:邻硝基苯酚和间硝基苯酚
分子内氢键
max=278nm =6.6103
无分子内氢键
max=273nm =6.6103
邻硝基苯酚, 由于分子内氢键的形成,红移了5nm。
3)溶质与溶剂间形成的氢键(属于溶剂效应)
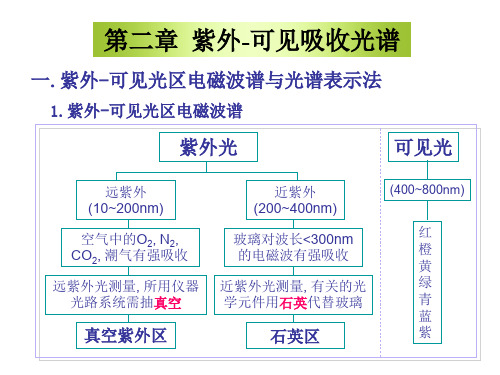
波谱范围:10~800nm
(1)远紫外光区10~200nm (2)近紫外光区200~400nm (3)可见区400~800nm.
一般的紫外光谱是指近紫外区。
1、紫外光谱产生的条件
2、有机分子的化学键类型
★构成分子的化学键主要有 键、 键,还 有未成键孤
对电子构成的非键(n 键)。
★ 5种轨道分别是:
54
2)单环共轭烯烃(乙醇溶剂) ◆母体值: ①共轭二烯不在同一环内
217nm
②共轭二烯在同一环内
◆扩展共轭: ◆取代基增加值: 烷基 卤素 ◆环外双键
253nm
+30nm
+5nm +17nm +5nm
55
●注意: (1)母体值只是指共轭二烯母体本身的λ值,不包括C=C-C=C
紫外可见吸收光谱法

-C-C- 如:乙烷: max=135nm C-H 如: 甲烷: max= 125nm
2) n * 跃迁
分子中未共用n电子跃迁到* 轨道
化合物种类:凡含有n电子的杂原子的饱和化合物
特点:跃迁所需要的能量较高
位置:远紫外光区和近紫外光区
150-250nm
ε=100 ~ 1000 L·cm-1 ·mol-1
Mn+-Lb- M(n+1)+-L(b+1)- (hν) [Fe3+-SCN-]2+ [Fe2+-SCN]2+ (这就是配合物λmax=490nm为血红色原因)
金属配合物的电荷转移吸收光谱,有三种类型:
1. 电子从配体到金属离子: 相当于金属的还原; 2. 电子从金属离子到配体; 产生这种跃迁的必要条件是金属离子容易被氧化
白炽光源: 热辐射光源:可见光区,340-2 500nm,影响因素:灯电压
如 钨丝灯和卤钨灯; 气体放电光源: 气体放电发光光源:紫外光
否相同。 在进行紫外光谱法分析时,必须正确选择溶剂。
三、紫外-可见分光光度计
光源 λ1、 λ2、 λ3、 …、 λn
分光系统
λmax
调制放大 记录系统→显示A
检测系统 光→电
I0→样品池→ It
紫外-可见分光光度计主要组成部件
光源
分光系统
样品池
检测系统
记录系统
1、光源
1.光源:提供入射光的元件。
3.电子从金属到金属
配合物中含有两种不同氧化态的金属时,电子可在其间转移,
这类配合物有很深的颜色,如普鲁士蓝 (磷、砷)钼蓝 H8 [SiMo2O5(Mo2O7)5 ]
紫外—可见分子光谱法

<三> 有机化合物的紫外—可见光谱:
(分子键主要为σ键) 1.饱和有机化合物:
饱和烃分子:σ→σ*跃迁,λmax<150nm 含N、O、S、X的饱和烃衍生物:n→σ*跃迁 λmax超出测量范 围,作溶剂使用
(分子键主要为π键) 2.单烯烃和共轭烯烃: π→π*跃迁 单烯烃:λmax在170~200nm以内
4.电荷迁移跃迁: 电磁辐射照射化合物时,电子从给予体向 与接受体相联系的轨道上跃迁,产生的吸收 光谱称电荷迁移吸收光谱。
●实质:是一个内氧化还—原过程
●跃迁的谱带较宽,吸收强度大,ε>104
<二> 几个术语: 在紫外、可见光谱区产生吸收的基 1.生色团: 团或结构系统。 2.助色团: 含有非键电子对的基团,称助色团。 在某些因素的影响下,化合物的 3.红移和紫移: 最大吸收波长λmax发生变化, 若λmax向长波方向移动,则称 为红移;若λmax向短波方向移 动,则称为紫移。 红移使吸收强度增强(增色效应), 紫移使吸收强度减小(减色效应)。
H
C H
O
p
n
1.σ→σ*跃迁: 需高激发能,对应于真空紫外区的辐射 频率,波长一般低于200nm,实际应用很 少。 2.n→σ*跃迁: 所需能量较σ→σ*跃迁能量小,可以由 150~250nm区域内的辐射引起,但大多数 吸收都出现在200nm以下的真空紫外区。 3. p→p*和n→p*跃迁: 所需能量都较σ→σ*跃迁低。产生的紫 外—可见光谱,对有机物分析十分有用。 n→p*跃迁属于禁阻跃迁,吸收较弱, ε=10~100。 p→p*跃迁为强吸收,一般εmax≥104。
一、组成: 辐 射 源
单 吸器
二、光度计类型: <一> 单光束分光光度计
紫外-可见吸收光谱法

紫外-可见吸收光谱法
紫外-可见吸收光谱法是一种常用的分析化学方法,也被称为UV-Vis吸收光谱法。
该方法通过检测样品溶液对紫外和可见光的吸收程度来确定分析物的浓度。
通常,该方法需要使用紫外-可见分光光度计。
该方法的原理是,当物质受到紫外或可见光的照射时,如果该物质能够吸收这些光线,那么它会吸收能量,并转移到一个高能级。
由于原子、离子或分子的能量级是固定的,因此只有特定波长的光线才能够被吸收。
因此,我们可以通过测量在特定波长下吸收的光的强度,来确定物质的浓度。
紫外-可见吸收光谱法可以用于分析各种样品,包括有机物、无机物、生物分子等。
在生物化学中,该方法通常用于测定核酸和蛋白质的浓度。
此外,该方法还可以用于检测水中的污染物浓度以及药物的含量等。
虽然紫外-可见吸收光谱法在分析化学中被广泛应用,但该方法也有一些局限性。
首先,该方法只适用于具有共轭结构的物质。
其次,该方法无法确定分子的化学结构,因为吸收峰只与分子的电子转移有关,而不考虑分子的化学结构。
因此,在使用紫外-可见吸收光谱法时,我们需要考虑到这些限制,并结合其他分析方法来进行综合分析。
紫外可见光谱法

紫外可见光谱法
contents
目录
• 紫外可见光谱法概述 • 紫外可见光谱法实验技术 • 紫外可见光谱法数据分析 • 紫外可见光谱法在各领域的应用 • 紫外可见光谱法的优势与局限 • 紫外可见光谱法实例分析
01
紫外可见光谱法概述
定义和原理
定义
紫外可见光谱法是一种基于物质吸收光子能量而产生化学反应的测量方法。
中药材中重金属的光谱分析
总结词
紫外可见光谱法可用于中药材中重金属的光 谱分析,通过对光谱特征的识别和解析,可 实现重金属的快速、准确检测。
详细描述
重金属是中药材中常见的污染物,过量摄入 会对人体健康造成严重影响。紫外可见光谱 法通过测量样品在特定波长范围内的吸光度 值,绘制出样品的紫外可见光谱图,从而分 析样品中重金属的种类和含量。该方法具有 操作简便、快速、准确等优点,为中药材中
重金属的监测提供了有力手段。
高分子材料的紫外光谱分析
总结词
紫外可见光谱法可用于高分子材料的紫外光谱分析, 通过对光谱特征的识别和解析,可实现高分子材料的 结构、性能和化学成分的快速、准确检测。
详细描述
高分子材料是一种重要的材料,广泛应用于工业、医 疗、信息等领域。紫外可见光谱法通过测量样品在特 定波长范围内的吸光度值,绘制出样品的紫外可见光 谱图,从而分析样品的结构、性能和化学成分。该方 法具有操作简便、快速、准确等优点,为高分子材料 的研发和应用提供了有力手段。
原理
紫外可见光谱法基于朗伯-比尔定律,物质在特定波长下吸光度与浓度成正比。 通过测量吸光度,可以确定样品中目标物质的浓度。
历史与发展
历史
紫外可见光谱法自20世纪初发展至今,已经广泛应用于各个 领域。
紫外可见光谱法

紫外可见光谱法紫外可见光谱法紫外可见光谱法,也被称为UV-Vis光谱法,是一种广泛应用于化学、生物、医药等领域的分析技术。
它可以快速、准确地测试样品中的化合物的组成和结构,也可以用于质量控制和成份分析等方面。
本文将介绍紫外可见光谱法的原理、应用及优缺点。
一、原理紫外可见光谱法的原理基于样品分子在紫外和可见光区域吸收辐射的现象。
当样品中的化合物受到光的照射时,它会吸收自己所能吸收的波长的光,导致光强度的降低。
通过比较样品前后的光强度差异,就可以确定其所含有的化合物的量。
二、应用紫外可见光谱法在化学、生物、医药等领域中具有重要应用。
以下是一些常见的应用领域:1.化学领域:用于分析化合物的结构和组成、溶液的浓度等。
2.生物领域:用于测定生物分子的含量和结构,如核酸和蛋白质的含量测定。
3.医药领域:用于药品的质量控制,检测药品中残留的杂质等。
4.环境领域:用于测定空气、水、土壤等中的污染物质浓度。
5.食品领域:用于检测食品中的添加剂、色素等成分。
三、优缺点紫外可见光谱法有多种优点,如准确、快速、简单易操作等。
同时,它也有一些缺点:1.受样品的溶液色和浓度等因素的影响较大,会影响测试准确性。
2.无法检测未吸收光的区域,有些化合物可能不会在紫外或可见光谱范围内吸收辐射。
3.分析结构复杂的混合物时,可能需要使用其他检测方法作为辅助手段。
总之,紫外可见光谱法是化学、生物和医学等领域中一种广泛应用的分析技术。
虽然它有一些局限性,但其准确性和简单易操作性仍使其成为研究和应用领域中不可或缺的一部分。
紫外-可见光光谱

(1)溶剂应能很好地溶解被测试样,溶剂对溶质应该是惰性的。 即所成溶液应具有良好的化学和光化学稳定性。
(2)在溶解度允许的范围内,尽量选择极性较小的溶剂。
(3)溶剂在样品的吸收光谱区应无明显吸收。
分析应用
应用范围
定性分析
在相同条件下,比较未知物与已知标准物的光谱 图,若两者相同,则可认为待测试样与已知化合物具 有相同的生色团。
在共轭体系中, *跃迁产生的吸收带又称为K带。
分析应用
有机分析
➢苯及其衍生物 苯有三个吸收带,它们都是由*跃迁引起的。E1带出现在
180nm(MAX = 60,000); E2带出现在204nm( MAX = 8, 000 );B带出现在255nm (MAX = 200)。在气态或非极性 溶剂中,苯及其许多同系物的B谱带有许多的精细结构,这是由 于振动跃迁在基态电子上的跃迁上的叠加而引起的。在极性溶剂 中,这些精细结构消失。当苯环上有取代基时,苯的三个特征谱 带都会发生显著的变化,其中影响较大的是E2带和B谱带。
例如,CH3Cl、CH3Br和CH3I的n* 跃迁分别出现在173、204和258nm处。 这些数据不仅说明氯、溴和碘原子引入甲烷后,其相应的吸收波长发生了红移, 显示了助色团的助色作用。
直接用烷烃和卤代烃的紫外吸收光谱分析这些化合物的实用价值不大。但是 它们是测定紫外和(或)可见吸收光谱的良好溶剂。
方法名称
激发方式
作用物质或机理
检测信号
原子发射 光谱法
电弧、火花、 等离子炬等
气态原子的外层电子 紫外、可见光
原子荧光 光谱法
高强度紫外、可见光 气态原子的外层电子
原子荧光
分子荧光 光谱法
紫外、可见光
分子
紫外-可见吸收光谱法.

分子轨道理论:成键轨道—反键轨道。
s
当外层电子吸收紫外或可见辐射后,就从基态向激发态(反 键轨道)跃迁。主要有四种跃迁所需能量Δ Ε 大小顺序为:
n→π * < π →π * < n→σ * < σ →σ *
03:33:40
1. σ→σ*跃迁
所需能量最大;σ 电子只有吸收远紫外光的能量才能发
生跃迁;
立体结构和互变结构的影响
03:33:40
三、无机化合物的吸收光谱
1. 金属离子d-d 配位场跃迁和 f – f 配位场跃迁
在配体的作用下过渡金属离子的d轨道和镧系、锕系的f轨
道裂分,吸收辐射后,产生d一d、 f 一f 跃迁;
必须在配体的配位场作用下才可能产生也称配位场跃迁; 摩尔吸收系数ε 很小,对定量分析意义不大。
子)均呈现n→σ * 跃迁。
化合物 H2O
CH3OH CH3CL
CH3I CH3NH2
max(nm) 167 184 173 258 215
max 1480 150 200 365 600
03:33:40
3. π→π*跃迁
所需能量较小,吸收波长处于远紫外区的近紫外端或近 紫外区,ε max一般在104L·mol-1·cm-1以上,属于强吸收。 (1) 不饱和烃π →π *跃迁
Mn+—Lb- h M(n-1) +—L(b-1) -
h
[Fe3+CNS-]2+
[Fe2+CNS]2+
电子给予体 电子接受体
分子内氧化还原反应; > 104 Fe2+与邻菲罗啉配合物的紫外吸收光 谱属于此。
03:33:40
H C
紫外可见光光谱

化合物的鉴定
• 利用紫外光谱可以推导有机化合物的分子骨架中是否含有共 轭结构体系,如C=C-C=C、C=C-C=O、苯环等。 • (1)如果一个化合物在紫外区是透明的,则说明分子中不存 在共轭体系,不含有醛基、酮基或溴和碘。可能是脂肪族碳 氢化合物、胺、腈、醇等不含双键或环状共轭体系的化合物。 • (2)如果在210~250nm有强吸收,表示有K吸收带,则可 能含有两个双键的共轭体系,如共轭二烯或α,β-不饱和酮等。 同样在260,300,330nm处有高强度K吸收带,在表示有三 个、四个和五个共轭体系存在。 • (3)如果在260~300nm有中强吸收(ε=200~1 000), 则表示有B带吸收,体系中可能有苯环存在。如果苯环上有共 轭的生色基团存在时,则ε可以大于10 000。 • (4)如果在250~300nm有弱吸收带(R吸收带),则可能 含有简单的非共轭并含有n电子的生色基团,如羰基等。
n
紫外可见光谱法测定蔬菜中的亚硝酸盐的含量
• 将绿色蔬菜(茄子与芹菜)分别经过处理后,蔬菜中所含有的亚 硝酸根与中性红指示剂在酸性介质中发生亚硝化反应,可在近紫 外区产生灵敏吸收,最大吸收波长为 360 nm。 • 分别准确移取一定量的亚硝酸根标准溶液于一系列50mL容量瓶 中,分别加入准确不同体积的10.00μg./mL亚硝酸根的标准溶液, 依次准确加入 1mL 中性红溶液,2 mL 盐酸溶液,用水稀释至刻 度,摇匀静置10min在360nm波长处,以试剂空白作参比,测定 吸光度。 • 称取 40.0 g 蔬菜 芹菜和茄子样品,经过压榨处理后,过滤后加 入少量氯仿萃取 取上层清液用去离子水稀释到100mL容量瓶中, 从中取10.0 mL于50mL容量瓶中,加1mL 中性红溶液和2 mL 盐 酸溶液 ,去离子水稀释至刻度摇匀10 min 后 在360 nm 处测其 吸光度。 • 按照实验方法,以试剂空白为参比,在不同波长处分别测定亚硝 化产物的吸光度。经测定,最大吸收波长处是 360 nm。
紫外-可见吸收光谱.

3.有机化合物的吸收光谱与分子结构
(2)不饱和烃及共轭烯烃
在不饱和烃类分子中,除含有键外,还含有 键,它们可以产生*和*两种跃迁。 *跃迁的能量小于 *跃迁。例如,在 乙烯分子中, *跃迁最大吸收波长为180nm。
第一节 紫外-可见吸收光谱 一、分子吸收光谱的产生
过程:
运动的分子外层电子---吸收外来辐射--产生电子能级跃迁----分子吸收光谱。
M h I0 M * It
一、分子吸收光谱的产生
在分子中,除了电子 相对于原子核的运动 外,还有核间相对位 移引起的振动和转动。 这三种运动能量都是 量子化的,并对应有 一定能级。左图为分 子的能级示意图。
丙酮
例:KMnO4紫红色,吸收的是绿光,λmax=525nm。它 对其它颜色的光吸收极小。吸收曲线形状是物质特有 的。当KMnO4的量不同,只使曲线沿纵座标上下移动, 但曲线形状不变。
图 KMnO----4的吸收光谱图 浓度:5、10、20、40μg/ml,1cm厚比色杯
四、分子跃迁类型及吸收光谱
max 较大 (104以上),可用于定量分析。
2.几个概念
生色团(Chromogenesis group)
有机化合物分子中含有非键或键的电子体系,
能吸收外来辐射时并引起n-* 和-*跃迁,可产生 此类跃迁或吸收的结构单元,称为生色团。
是一些具有不饱和健和含有孤对电子的基团。
如-C=C-、-C ≡ C-、—CH=O、—N=N—、-N=O 、—C≡N、—NO2等
材料表征方法第六章紫外可见光光谱

b. 助色基(团):
有一些含有n电子的基团(如-OH、-OR、-NH2 等),它们本身没有生色功能(不能吸收λ>200nm的 光),但当它们与生色团相连时,就会发生n—π共 轭作用,增强生色团的生色能力(吸收波长向长波 方向移动,且吸收强度增加),这样的基团称为助 色团。
C.红移与蓝移
有机化合物的吸收谱带 常常因引入取代基或改变溶
D + A hυ D+A-
D+、A-为络合物或一个分子中的两个体系,D是 给电子体,A是受电子体。
例如:黄色的四氯苯醌与无色的六甲基苯形成的 深红色络合物。
O
CL
CL
CL
+ CL
O
O
CL
CL
=
CL
CL
O
(黄色) (无色) (深红色)
f、配位体场微扰的d →d*跃迁
过渡元素的 d 或 f 轨道为简并轨道(Degeneration orbit),当与配位体配合时,轨道简并解除,d 或f 轨 道发生能级分裂,如果轨道未充满,则低能量轨道 上的电子吸收外来能量时,将会跃迁到高能量的 d 或 f 轨道,从而产生吸收光谱。
3、电荷转移跃迁;
4、配位体场的d →d*跃迁 产生。
3.常用光谱术语及谱带分类
常用光谱术语:
a、生色基也称发色基(团):
是指分子中某一基团或体系,由于存在能使分子 产生吸收而出现谱带,这一基团或体系即为生色基。
最有用的紫外-可见光谱是由π→π*和n→π*跃迁产 生的。这两种跃迁均要求有机物分子中含有不饱和基 团。这类含有π键的不饱和基团称为生色团。简单的生 色团由双键或叁键体系组成,如乙烯基、羰基、乙炔 基、亚硝基、偶氮基—N=N—等
紫外-可见吸收光谱法(UV-Vis)

max 一般 10
增大
A 1103 7 1 Cmin 1 10 mol L b 1104 1 1107 100 1108 g mL1 1000
3 ~104;灵敏
的 >104;个别的可达 105 106
若λ1= λ2
dA b dC
ε 1 = ε2= ε 在一定的浓度范围内 A= εbC
若λ1≠ λ2
2.303 f1 f 2b 2 ( λ1 λ 2 ) 210 ( λ1 λ 2 )bc d2A 0 λ 1bc λ 2bc 2 2 dC ( f110 f 210 )
1) 液气固介质均适用 2)入射光是单色光,平行光 3)稀溶液
朗伯-比尔定律
A = Kbc
(二)朗伯-比尔定律推导
Ix dIx S I0 db b It
-dIx ∝ Ix adn dn = csdb
-dIx∝ IxaCsdb -dIx/Ix=k Cdb
b dI x I0 I x k 0 cdb It
0
0
C
A = 0.434
(四)吸光系数
1. a ( L · g –1 · cm-1) 2.ε ( L · mol–1 · cm-1)
max
A KCb
A aCb A Cb
C: g / L C: mol/ L
吸光物质结构的特征参数;
吸光物质定量分析的灵敏度参数
3. 检出限与摩尔吸光系数 若可测量的吸光度为0.001
It ln kcb I0 It kcb lg Kcb I 0 2.303
A lg T Kbc
吸光度 与透射率
紫外可见光光谱分析法

实用价值; 乙烷λmax=135nm; 甲烷λmax=125nm
n→π*: 能量最小;对应紫外-可见光区,但摩尔吸收系数小,谱带
弱,属于禁阻跃迁。 羰基、硝基等简单生色基团
n→σ*
能量较高;对应远紫外和近紫外区;不易观察,且摩尔吸收小。
机物分子中含有不饱和官能团。
2、生色团与助色团 有机物中含有π键的基团,对200nm以上的辐射具有吸收
性;而且随着π键数目的增加,溶剂的极性增强时发生红移进 入可见光区,使物质具有颜色,因而,称含π键的基团为生色 基团(发色基团),通常表现为n →π*和π→π*跃迁。
如>C=C<(烯),>C=O(羰),-N=N-(偶氮), =C=S(硫羰),
(一) 分子吸收光谱
分子能级
有机物分子在紫外-可见光范围的吸收是由分子的能级跃迁
产生的;分子的能级组成有:
电子能级跃迁:20 ~ 1eV
紫外-可见光区
振动能级跃迁:0.05~1eV
中红外区
转动能级跃迁:0.005~0.05
远红外、微波
当分子受到辐射的作用时,则发生相应能量的能级跃迁
电子能级是分子能中最大的能级,分子在产生 电子能级跃迁的过程中,同时也产生振动能级的跃迁; 振动能级跃迁时也产生转动能级的跃迁;
*不饱和烃及共轭烯烃 在不饱和烃类分子中,除σ键外,还有π键;故不饱和烃产
生的跃迁类型有:σ→σ*和 π→π* 两种; 由于 E σ→σ* > E π→π* , 所以π→π*跃迁比较容易激发,最大吸收峰波长比σ→σ*跃迁
受激发的吸收峰的波长大;
λmaxπ→π* > λmax σ → σ* 乙烷:λmax=135nm 乙烯:λmax=165nm、193nm;
紫外-可见吸收光谱法

7. 溶剂效应
跃迁产生的吸收峰,随溶剂极性增加,形成氢键的能力增加, n-π* 跃迁产生的吸收峰,随溶剂极性增加,形成氢键的能力增加, 发生蓝移; 跃迁产生的吸收峰,随溶剂极性增加,发生红移。 发生蓝移;由 π-π* 跃迁产生的吸收峰,随溶剂极性增加,发生红移。随 溶剂极性增加,吸收光谱变得平滑,精细结构消失。 溶剂极性增加,吸收光谱变得平滑,精细结构消失。
红移与蓝移
有机化合物的吸收谱带常常 因引入取代基或改变溶剂使最大 吸收波长λ 吸收波长 max和吸收强度发生变 化:λmax向长波方向移动称为红 移,向短波方向移动称为蓝移 (或紫移)。吸收强度即摩尔吸光 或紫移) 系数ε增大或减小的现象分别称 为增色效应或减色效应, 为增色效应或减色效应,如图所 示。
第三章
紫外紫外-可见吸收光谱法
(Ultraviolet and Visible Spectrophotometry, UV-Vis)
第一节
•
概
述
紫外吸收光谱:分子价电子能级跃迁。 紫外吸收光谱:分子价电子能级跃迁。
• 波长范围:100-800 nm. 波长范围:100- 远紫外光区:100-200nm 1. 远紫外光区:100-200nm 2. 近紫外光区:200-400nm 近紫外光区:200-400nm 可见光区:400-800nm 3. 可见光区:400-800nm 可用于结构鉴定和定量分析。 可用于结构鉴定和定量分析。 电子跃迁的同时,伴随着振动转动能级的跃迁;带状光谱。 电子跃迁的同时,伴随着振动转动能级的跃迁;带状光谱。
分子的内能: 分子的内能:电子能量Ee 、振动能量Ev 、转动能量Er。 即:
E = Ee + Ev + Er
∆Ee > ∆Ev > ∆E r
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第五章紫外及可见分光光度法
一、选择题
1.在光学分析法中, 采用钨灯作光源的是( 3)
(1)原子光谱(2)分子光谱(3)可见分子光谱(4)红外光谱
2.在紫外光谱中,λmax 最大的化合物是 (4 )
3.物质的紫外-可见吸收光谱的产生是由于 ( 3)
(1) 分子的振动 (2) 分子的转动
(3) 原子核外层电子的跃迁 (4) 原子核内层电子的跃迁
4.按一般光度法用空白溶液作参比溶液,测得某试液的透射比为 10%,如果更改参
比溶液,用一般分光光度法测得透射比为 20% 的标准溶液作参比溶液,则试液的透
光率应等于 ( 3)
(1) 8% (2) 40% (3) 50% (4) 80%
5.用实验方法测定某金属配合物的摩尔吸收系数ε,测定值的大小决定于 (2 ) (1) 配合物的浓度 (2) 配合物的性质(3) 比色皿的厚度 (4) 入射光强度
6已知相对分子质量为320的某化合物在波长350nm处的百分吸收系数(比吸收系数)为
5000, 则该化合物的摩尔吸收系数为 (4 )
(1)1.6×104L/(moL·cm) (2)3.2×105 L/(moL·cm)
(3)1.6×106 L/(moL·cm) (4)1.6×105 L/(moL·cm)
7 分子运动包括有电子相对原子核的运动(E电子)、核间相对位移的振动(E
振动)
和转动(E转动)这三种运动的能量大小顺序为( 3 )
8.在分光光度法中,运用朗伯-比尔定律进行定量分析采用的入射光为(2 )(1)白光(2)单色光(3)可见光(4)紫外光
9.指出下列哪种因素对朗伯-比尔定律不产生偏差? ( 4)
(1) 溶质的离解作用 (2) 杂散光进入检测器
(3) 溶液的折射指数增加 (4) 改变吸收光程长度
10.基于发射原理的分析方法是 (2 )
(1) 光电比色法 (2) 荧光光度法 (3) 紫外及可见分光光度法 (4) 红外光谱法
11.在分子的电子能级跃迁中,下列哪种电子能级跃迁类型在该分子中不发生 (4 )
(1) σ→π * (2) π→σ * (3) n→σ * (4) n→π *
12.双光束分光光度计与单光束分光光度计相比,其突出优点是 (4 )
(1) 可以扩大波长的应用范围 (2) 可以采用快速响应的检测系统
(3) 可以抵消吸收池所带来的误差 (4) 可以抵消因光源的变化而产生的误差13.比较下列化合物的UV-VIS吸收波长的位置(λmax )( 4)
(1)a>b>c (2) c>b>a (3)b>a>c (4)c>a>b
14. 比较下列化合物的UV-VIS光谱λmax 大小( 2)
(1)a>b>c (2)c>a>b (3)b>c>a (4)c>b>a
15. 已知:h=6.63×10-34 J⋅s则波长为0.01nm 的光子能量为( 3)
(1) 12.4 eV (2) 124 eV (3) 12.4×105eV (4) 0.124 eV
16荧光分析法和磷光分析法的灵敏度比吸收光度法的灵敏度 (1 )
(1) 高 (2) 低 (3) 相当 (4) 不一定谁高谁低
17.可见光的能量应为(4 )
二、填空题
1. 在分光光度法中, 以__吸光度__为纵坐标, 以__波长__为横坐标作图, 可得光吸收曲线. 浓度不同的同种溶液, 在该种曲线中其最大吸收波长__不变__,相应的吸光度大小则___不同___.
2.紫外-可见分光光度法定量分析中,实验条件的选择包括___ 波长、狭缝宽度、吸光度值(有色物的形成)、溶液的pH 、显色剂用量、显色反应时间、温度、有色化合物的稳定性、掩蔽干扰______等方面。
3.在紫外-可见分光光度法中, 吸光度与吸光溶液的浓度遵从的关系式为____
A=εbc ( 或吸光度与浓度呈正比) ____
而在分子荧光光谱法中, 荧光强度与浓度遵从的关系式为I f=2.303Фf I0εbc ( 或荧光强度与浓度呈正比) ______
4.朗伯-比尔定律是分光光度法分析的基础,该定律的数学表达式为___ _ ______ A=-lg T=εbc ___ _____。
该定律成立的前提是:(1)___入射光是单色光___; (2) ___吸收发生在均匀的介质中____;(3)___吸收过程中,吸收物质互相不发生作用____ 。
5.在分子荧光光谱法中, 增加入射光的强度, 测量灵敏度_____增加( 或提高, 或增大) _______
原因是 ____荧光强度与入射光强度呈正比________
三、计算题
1.某化合物的最大吸收波长λmax = 280nm,光线通过该化合物的1.0×10-5mol/L 溶液时,透射比为50%(用2cm 吸收池),求该化合物在280nm 处的摩尔吸收系数。
2. 某亚铁螯合物的摩尔吸收系数为12000 L/(moL·cm),若采用1.00cm的吸收池, 欲把透射比读数限制在0.200 至0.650 之间, 分析的浓度范围是多少?
3.配体ERIOX与Mg2+在pH=10.00条件下,生成1:1的有色配合物。
现用光度法以Mg2+滴定ERIOX溶液。
滴定结果表明:在化学计量点处,〔Mg-ERIOX〕=〔ERIOX〕=5.0×10-7mol/L,计算Mg配合物的生成常数。
4.试计算化合物(如下式)的最大紫外吸收波长。
四、问答题( 共4题20分)
1. 下面为香芹酮在乙醇中的紫外吸收光谱, 请指出二个吸收峰属于什么类型, 并根据经验规则计算一下是否符合?
1. [答] 吸收较大的峰为C=C的π─→π*跃迁, 较小的吸收峰为C=O的n─→π*跃迁. 215nm + 10nm + 12nm =237nm(C=C-C=O) (α-取代) (β-取代)计算结果谱图吻合.
2..请画出紫外分光光度法仪器的组成图(即方框图),并说明各组成部分的作用?
作用:
光源:较宽的区域内提供紫外连续电磁辐射。
单色器:能把电磁辐射分离出不同波长的成分。
试样池:放待测物溶液
参比池:放参比溶液
检测器:检测光信号(将光信号变成电信号进行检测)
记录器:记录并显示成一定的读数。
3. 请将下列化合物的紫外吸收波长λmax值按由长波到短波排列, 并解释原因。
(1) CH2=CHCH2CH=CHNH2 (2) CH3CH=CHCH=CHNH2
(3) CH3CH2CH2CH2CH2NH2
[答] CH3CH=CHCH=CHNH2 > CH2=CHCH2CH=CHNH2 > CH3CH2CH2CH2CH2NH2
4.指出下列化合物的紫外吸收波长, 按由长波到短波吸收波长排列.。
