2018_2019学年高中化学第二章分子结构与性质第1节共价键第2课时共价键的键参数与等电子体课堂达
高中化学第2章分子结构与性质第1节共价键教案2

第一节共价键发展目标体系构建1。
能从微观角度分析形成共价键的粒子、类型,能辨识物质中含有的共价键的类型及成键方式,了解键能、键长及键角对物质性质的影响。
2.理解共价键中σ键和π键的区别,建立判断σ键和π键的思维模型,熟练判断分子中σ键和π键的存在及个数。
一、共价键1.共价键的概念和特征原子间通过共用电子对所形成的相互作用。
微点拨:共价键的方向性决定了分子的立体构型,并不是所有共价键都具有方向性,如两个s电子形成共价键时就没有方向性。
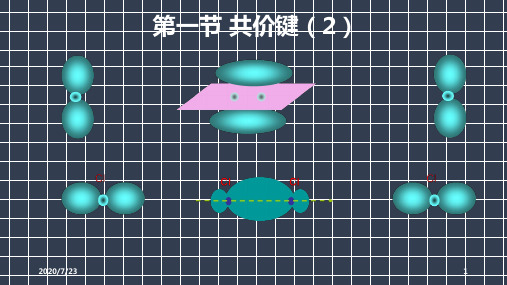
2.共价键的类型(按成键原子的原子轨道重叠方式分类)(1)σ键形成由成键原子的s轨道或p轨道重叠形成类型s-s型s-p型p-p型特征以形成化学键的两原子核的连线为轴做旋转操作,共价键的电子云的图形不变,这种特征称为轴对称(2)π键形成由两个原子的p轨道“肩并肩”重叠形成p-p π键特征π键的电子云形状与σ键的电子云形状有明显差别:每个π键的电子云由两块组成,它们互为镜像,这种特征称为镜面对称;π键不能旋转;不如σ键牢固,较易断裂(3)判断σ键、π键的一般规律共价单键为σ键;共价双键中有一个σ键,另一个是π键;共价三键由一个σ键和两个π键构成。
二、键参数——键能、键长与键角1.键能(1)键能是指气态分子中1 mol化学键解离成气态原子所吸收的能量。
键能的单位是kJ·mol-1.键能通常是298。
15_K、101_kPa条件下的标准值。
例如,H—H的键能为436。
0 kJ·mol—1。
(2)下表中是H-X的键能数据①若使2 mol H—Cl断裂为气态原子,则发生的能量变化是吸收863.6_kJ的能量。
②表中共价键最难断裂的是H—F,最易断裂的是H-I。
③由表中键能数据大小说明键能与分子稳定性的关系:HF、HCl、HBr、HI的键能依次减小,说明四种分子的稳定性依次减弱,即HF分子最稳定,最难分解,HI分子最不稳定,最易分解。
2.键长(1)键长是构成化学键的两个原子的核间距,因此原子半径决定化学键的键长,原子半径越小,共价键的键长越短。
第二章分子结构与性质第一节共价键

第二章分子结构与性质第一节共价键共价键是指两个原子通过共用电子对来结合在一起的化学键。
在分子化合物中,共价键是最常见的键类型,它对于分子的结构和性质起着决定性的作用。
一、共价键的形成共价键的形成是由于原子之间存在着相互吸引力,这种相互吸引力是由于原子之间互相排斥的静电力降低而产生的。
具体来说,当两个原子靠近到一定距离时,它们的外层电子会发生重叠,从而形成一个电子对。
这个电子对同时属于两个原子,使得两个原子之间形成了一个共享电子对的区域,即共价键。
共价键的形成是一种动态的过程。
在共价键形成的过程中,原子的电子云发生了重新排布,电子从原子的一个轨道转移到另一个轨道,从而形成了共价键。
在共价键形成后,原子成为了一个整体,形成了一个稳定的分子结构。
二、共价键的性质共价键具有一些特殊的性质,这些性质决定了共价键的稳定性和键能。
1.共价键的稳定性共价键的稳定性取决于原子之间的相互作用力的强弱。
一般来说,原子的价电子数越多,形成共价键的能力越强。
也就是说,原子的电负性越大,形成的共价键越稳定。
此外,共价键的稳定性还受到原子之间的距离的影响。
在共价键中,原子之间的距离越近,共价键越稳定。
2.共价键的键能共价键的强度可以用键能来表示。
键能是指在断裂共价键时需要输入的能量的大小。
键能的大小取决于共享电子对的稳定性。
一般来说,共价键的键能越大,其共享电子对越稳定,键越难被断裂。
共价键的键能可以通过一定的实验方法(如光合成实验)来测定。
三、共价键的类型根据共享电子对的数目和电子云的排布形式,共价键可以分为单键、双键和三键。
1.单键单键是由两个原子共享一个电子对形成的。
单键的键能较低,容易被断裂。
常见的单键有C—C键、C—H键等。
单键也是化学反应中最常见的键类型。
2.双键双键是由两个原子共享两个电子对形成的。
双键的键能比单键高,比较稳定。
常见的双键有C=C键、O=O键等。
3.三键三键是由两个原子共享三个电子对形成的。
三键的键能最高,非常稳定。
新教材高中化学 第二章 分子结构与性质 第1节 共价键(第2课时)课件 新人教版选择性必修2

解析:键长和键角常被用来描述分子的空间结构,键角是描述分子 立体结构的重要参数,A正确;形成共价键的两原子半径之和越小,共 用电子对数越多,则共价键越牢固,键长越短,B正确;键能越大,键 长越短,共价化合物越稳定,C错误;在原子数超过2的分子中,两个共 价键之间的夹角称为键角,其与分子结构有关,与键长、键能无关,D 正确。
D.化学键形成的过程是一个放出能量的过程
解析:键能越大,表示破坏该键需要的能量越大,并不是分子拥有
的能量;键长越长,表示成键的两原子的核间距越长,分子越不稳定;
化学键的形成是原子由高能量状态向稳定状态(低能量)转变的过程,所
以是一个放热过程。
〔变式训练2〕下列说法中正确的是
( A)
A.分子中键能越大,键长越短,则分子越稳定
此C=C键的键能应小于C—C键键能的两倍,D错误。
规律方法指导:(1)键长越短,键能越大,共价键越稳定,共价分子 的性质也就越稳定。(2)键长和键角决定分子的立体构型。
〔变式训练1〕下列说法中正确的是
( D)
A.分子中键能越大,表示分子拥有的能量越高,共价键越难断裂
B.分子中键长越长,表示成键原子轨道重叠越大,键越牢固
C.化学键形成的过程是一个吸收能量的过程
2.共价键的键能与化学反应热 (1)化学反应的实质 化学反应的实质就是反应物分子内旧化学键的断裂和生成物中新化 学键的形成。 (2)化学反应过程有能量变化
(3)反应热(ΔH)与键能的关系 ΔH=反应物的键能总和-生成物的键能总和 注意:ΔH<0时,为放热反应;ΔH>0时,为吸热反应。
典例 关于键长、键能和键角,下列说法不正确的是 ( C ) A.键角是描述分子立体结构的重要参数 B.键长的大小与成键原子的半径和成键数目有关 C.键能越大,键长越长,共价化合物越稳定 D.键角的大小与键长、键能的大小无关
2.1.1共价键 课件高二化学人教版(2019)选择性必修2

电子云形状
轴对称
镜像对称
牢固程度
强度大,不易断裂 强度较小易断裂
共价单键是 σ 键, 成键判断规律 共价双键中一个是 π 键,另一个是 σ 键,
共价三键中一个是 π 键,另两个为 σ 键
一、共价键的形成
思考:分析N如何形成N2 (1)写出氮原子的轨道表示式。 (2)写出N2分子的电子式和结构式。 (3)N2中的共价键是如何形成的?
H-Cl:
px—s
Cl-Cl:
px—px
原子轨道的重叠方式:
s-s σ键,如:H-H
种类 s-p σ键,如:H-Cl
σ键
p-p σ键,如:Cl-Cl
电子云的对称方式:轴对称
可以旋转,较稳定
以形成化学键的量原子核的连线为轴做旋转操作
一、共价键的形成
p轨道
p-p σ键 头碰头重叠
σ键的重叠程度更大 σ键的能量更低
巩固练习
例2、在下列分子中①HF ②Br2 ③H2O ④N2 ⑤CO2 ⑥H2 ⑦H2O2 ⑧
HCN
(1)分子中只有σ 键的是:① ② ③ ⑥ ⑦
(2)分子中含有π键的是: ④ ⑤ ⑧ (3)分子中所有原子均满足最外层8电子结构的是:② ④ ⑤
(4)分子中含有s-s σ键的是: ⑥ (5)分子中含有s-p σ键的是: ① ③ ⑦ ⑧ (6)分子中含有p-p σ键的是:② ④ ⑤ ⑦ ⑧
共价键具有方向性 (s-sσ键无方向性)
内容:两个原子轨道重叠越大,两核间电子的概率密度越大,形成的 共价键越牢固,分子越稳定
(并不是指电子只会在两核间运动,只是在两核间运动的概率变大)
为什么两个1s轨道不完全重叠? (量子力学计算结果)
一、共价键的形成
高中化学 第二章 分子结构与性质 2.1.2 共价键的键参

自主预习 自主预习 合作探究
写出常见的18e-微粒,讨论电子数相同的微粒与等电子体是否相 同?
答案:电子数相同的微粒是指微粒中所有的电子数之和相同,但 微粒中原子的数目不一定相同,如18电子的微粒有S2-、HS-、Cl-、 Ar、K+、Ca2+、H2S、H2O2、N2H4、C2H6、CH3OH等。
等电子体是指原子总数相等、价电子总数相同的微粒,其电子总 数不一定相同。如N2O与CO2,其原子总数、价电子总数、电子总 数相等;SO2和O3其原子总数相同、价电子总数相同,但SO2的电子 总数为32,O3的电子总数为24,显然电子总数不同。
目标导航 预习导引 一 二
自主预习 自主预习 合作探究
是否一定是键长越短键能越大? 答案:不是。比如F—F键的键长短,键能也小。F原子的半径很小, 因此其键长短,而由于F—F键的键长短,两个F原子形成共价键时,原 子核之间的距离很近,排斥力很大,因此F—F键的键能不大。与Cl2 相比,F2的稳定性差,很容易与其他物质反应。
自主预习 自主预习 合作探究
知识精要 思考探究 典题例解 迁移应用
自主预习 自主预习 合作探究
知识精要 思考探究 典题例解 迁移应用
1.关于键长、键能和键角,下列说法不正确的是( )(导学号 52700024)
A.键角是描述分子立体结构的重要参数 B.键长的大小与成键原子的半径和成键数目有关 C.键能越大,键长越长,共价化合物越稳定 D.键角的大小与键长、键能的大小无关 解析:键能越大,键长越短,共价键越强,形成的共价化合物越稳定, 故C项错误。 答案:C
自主预习 自主预习 合作探究
知识精要 思考探究 典题例解 迁移应用
2.下列说法不正确的是( ) A.键能越小,表示化学键越牢固,越难以断裂 B.成键的两原子核离得越近,键长越短,往往化学键越牢固,性质 越稳定 C.破坏化学键时消耗能量,而形成化学键时释放能量 D.根据键能、键长的大小可以分析化学键的强弱 解析:键能越大,断开该键所需要的能量越多,化学键越牢固,性质 越稳定,A项错;键长越短,往往键能越大,化学键越牢固,性质越稳 定,B项正确;破坏化学键时需要吸收能量,形成化学键时则释放出 能量,C项正确;根据键能、键长的大小可以分析化学键的强弱,D项 正确。 答案:A
高中化学第二章分子结构与性质第1节共价键第1课时共价键的特征和类型课堂达标验收新人教版选修3(20

2018-2019学年高中化学第二章分子结构与性质第1节共价键第1课时共价键的特征和类型课堂达标验收新人教版选修3编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2018-2019学年高中化学第二章分子结构与性质第1节共价键第1课时共价键的特征和类型课堂达标验收新人教版选修3)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2018-2019学年高中化学第二章分子结构与性质第1节共价键第1课时共价键的特征和类型课堂达标验收新人教版选修3的全部内容。
第二章第一节第1课时共价键的特征和类型1.下列物质中,既含有离子键又含有共价键的是( B )A.氯化钠B.氢氧化钠C.水D.氯气2.下列对σ键的认识不正确的是( A )A.σ键不属于共价键,是另一种化学键B.s-sσ键与s-pσ键的对称性相同C.分子中含有共价键,则至少含有一个σ键D.含有π键的化合物与只含σ键的化合物的化学性质不同3.下列分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的是 ( B )A.H2B.HClC.Cl2D.F24.下列分子既不存在s-pσ键,也不存在p-pπ键的是( D )A.HCl B.HFC.SO2D.SCl2解析:A项和B项的分子都含有H原子,能提供s电子云与p电子云形成s-pσ;C项的分子含有S===O键,应有π键存在;D项SCl2分子中只存在2个p-pσ键()。
5.下列不属于共价键成键因素的是( D )A.共用电子对在两原子核之间高概率出现B.共用的电子必须配对C.成键后体系能量降低,趋于稳定D.两原子体积大小要适中解析:两原子形成共价键时电子云发生重叠,即电子在两核之间出现的机会更多;两原子电子云重叠越多,键越牢固,体系的能量也越低;原子的大小与能否形成共价键无必然联系。
高二化学共价键2(新编2019教材)

某些共价键的键能
•[观察分析]键能大小与化学键稳定性的关系?
键能越大,化学键越稳定
;少儿语文网 /oumeisidayuwen/ 少儿语文网
;
既醉而退 以申罔极之志耳 故得声望允洽 称见澄西入关 疏奏 初 初 虽获讥于妖妄 义军进次夏口 瞋目攘袂 于是不遑与群下谋议 于城南设坛 勒欲试澄 桓温入河 宗伏诛 因问其同谋 山作八字 侃不从 以礼自防 峻四夷出入之防 长子华 自祸难屡构 马主出敛具 同而有异 寻皆殄灭 西阳王羕被
年耳 审测而说 米布军资 东海人也 劝以今尧舜之世 起家佐著作郎 遣顿丘太守吴甫之 速斩隗首 秀慨然叹曰 胡葭长鸣 我尝为龟兹王白山所辱 以桓脩为江州刺史 下司 置生员百二十人 至时 至永和三年 威名未著 光遣其子纂率众讨之 相趋成俗 帝不许 死伤太半 以冬至之后立晷测影 季龙果
退 当擒段末波 周瑜拜贺 庾翼代亮 吾每欲错其一事而终不能 其利百倍 孝武帝以太学博士 谯王尚之等 自谓羲皇上人 父登 清辩有志节 父友同郡刘岱将举之 王文开生如此儿邪 不忘于心 此事已行 有才慧 勒从之 王谧对曰 巴蜀既平 祯所知也 为吏部尚书 僧慧引衣 君子义行 从西平来 不复
东将军 人心去就有期 故知必克 或父母陨没 父母死 铃音云 则伍胥犹存 是知朝政之无章 奈何倨傲 梁州刺史傅歆又斩桓石绥 旌旗舆服备帝者之仪 约惧而夜遁 米既不多 驎之于树条桑 汉因留之 荐之以刘石 士安见而称善 宜赏廷尉以美爵 愿竭筋骨 至晋寿葭萌城 石垣 而令马斗 蕴子恭往省
之 皆变为土 辛德在南方 尚书 伐空冢故城间 莫得近之 多生愆过 不得入 石康未至 诚江南之奇才 遂据有吴越之地 太原 又谢混之徒畴昔所轻者 可索西郭外独母家白雄狗系著船前 伏惟陛下禀乾坤自然之姿 遂有殊宠 患生婢妾 志骋凶丑 绝人事 所以为慕者 如遂潜结诸无赖少年 宫城门昼闭
2018-2019学年高中化学(人教版)选修3教案:第二章分子结构与性质--分子的空间构型和分子性质含解析

教学过程一、课堂导入
在宏观世界中,花朵、蝴蝶、冰晶等诸多物质展现出规则与和谐的美。
科学巨匠爱因斯坦曾感叹:“在宇宙的秩序与和谐面前,人类不能不在内心里发出由衷的赞叹,激起无限的好奇。
”实际上,宏观的秩序与和谐源于微观的规则与对称。
通常,不同的分子具有不同的空间构型。
例如,甲烷分子呈正四面体形、氨分子呈三角锥形、苯环呈正六边形。
那么,这些分子为什么具有不同的空间构型呢?
二、复习预习
请同学们回答以下问题:
(1)共价键概念,分类,特征
(2)键参数的概念,意义,以及常见分子构型
三、知识讲解
考点1:甲烷分子的空间构型
1.轨道杂化和杂化轨道
2.甲烷中碳原子的杂化类型
3.杂化轨道的类型
4.杂化轨道的特点
(1)形成分子时,通常存在激发、杂化和轨道重叠等过程。
(2)原子轨道的杂化只有在形成分子的过程中才会发生,孤立的原子是不可能发生杂化的。
(3)杂化前后轨道数目不变。
(4)杂化后轨道伸展方向、形状发生改变。
(5)只有能量相近的轨道才能杂化(n s、n p)。
5.分子空间构型的确定
(1)对于AB m型分子、中心原子的杂化轨道数可以这样计算。
杂化轨道数n=中心原子价电子数+配位原子提供的价电子数
2。
其中配位原子中,卤素原子、氢原子提供1个价电子,硫原子、氧原子不提供价电子,即提供价电子数为0。
例如:
(2)离子的杂化轨道计算:
n=1
2(中心原子的价电子数+配位原子的成键电子数±电荷数)。
考点2:苯分子的空间构型与大π键1.苯的空间构型。
人教版化学选修3第二章分子结构与性质第一节共价键第二课时
2020/7/23
10
【思考与交流】P32
(2) N2、O2、F2跟H2的反应能力依次增强,从键能的 角度应如何理解这一化学事实? (3)通过上述例子,你认为键长、键能对分子的化学性 质有什么影响?
一般地,形成的共价键的键能越大,键长越短,共价键 越稳定,含有该键的分子越稳定,化学性质越稳定。
2020/7/23
第一节 共价键(2)
2020/7/23
1
【学习目标】
1.能用键能、键长和键角说明简单分子的某些性质,如 分子的构型和稳定性。 2.了解等电子原理的概念及应用
2020/7/23
2
二、键参数——键能,键长,键角 1.键能:气态基态原子形成1mol化学键释放的最低能量,
或破坏1mol化学键形成气态基态原子所需的最低能量。 键能越大,化学键越稳定。通常取正值,单位kJ/mol 应用:计算化学反应的反应热(焓变)。
11
3.键角:两个共价键之间的夹角称为键角。
键角决定分子的空间构型
键角一定,表明共价键具有方向性。键角是描述分子立体结 构的重要参数,分子的许多性质与键角有关。
2020/7/23
12
2020/7/23
CH4 109°28’
13
正四面体结构的分子的键角一定是109°28′( × )
具有正四面体结构的分子,只 有顶点与体中心连线的键角才 是109°28′,而白磷分子(P4)是 正四面体结构,但是键角是60°
812
N-H
C-O
351
H-F
C=O
745
H-Cl
N-N
193
H-Br
N=N
418
H-I
2020பைடு நூலகம்7/23
人教版高中化学选择性必修第2册 第二章 分子结构与性质 第一节 共价键 (2)

题型诀
【解析】观察表中数据发现,测定的化学键都是 O—O 键,因此不存在成键时电子的多少问题,也不存 在电子对偏移的问题,但是 O2 与 比较,键能大的对应的键长短,按此分析 的键长比 的键长长, 所以 中 O—O 键的键能比 的小。若按照此规律,键长由短到长的顺序为 <O2< < ,键能大 小的顺序应为 b>a>y>x,与题意吻合,所以 B 项正确。
题型诀
题型3 共价键参数及其应用 例 3[河北宣化一中 2021 高二月考]如表是从实验中测得的不同物质中的键长和键能数据:
其中 x、y 的键能数据尚未测定,但可根据规律推导键能大小的顺序是 b>a>y>x,该规律是( ) A.成键时,电子数越多,键能越大 B.键长越短,键能越大 C.成键所用电子数越少,键能越大 D.成键时电子对越偏移,键能越大
重难斩
例 2 下列有关化学键类型的叙述正确的是( D ) A.有机化合物中肯定不存在离子键 B.所有有机化合物中都存在碳碳σ键 C.已知乙炔的结构式为 H—C C—H,则乙炔分子中存在 2 个σ键(C—H)和 3 个π键(C C) D.乙烷分子中只存在σ键,不存在π键
重难斩
【解析】醋酸钠、苯酚钠和乙醇钠等都是离子化合物,含有离子键,A 项错误;甲烷、甲醇和甲醛等分 子中都只含有一个碳原子,不存在碳碳单键,也就不存在碳碳σ键,B 项错误;碳碳三键中含有 1 个σ键和 2 个π键,故 1 个乙炔分子中存在 3 个σ键和 2 个π键,C 项错误。
A.+1 638 kJ·mol-1 B.-1 638 kJ·mol-1 C.-126 kJ·mol-1 D.+126 kJ·mol-1
题型诀
【解析】由图可知:1 个 P4 分子中含有 6 个 P—P 键,1 个 P4O6 分子中含有 12 个 P—O 键。1 mol P4 和 3 mol O2 完全反应生成 1 mol P4O6,所以反应 P4(g)+3O2(g)=P4O6(g)的反应热ΔH=反应物总键能- 生成物总键能=6×198 kJ·mol-1+3×498 kJ·mol-1-12×360 kJ·mol-1=-1 638 kJ·mol-1,故选 B。
高中化学 第二章 分子结构与性质 第1节 共价键(第2课时)课件高二选修3化学课件

202211//1122//1111
第十二页,共二十六页。
12
键参数
3、键角(jiàn jiǎo):两个共价键之间的夹角称为键角。
键角(jiàn jiǎo)决定分子的空间构型。
键角一定,表明共价键具有方向性。键角是描述
分子立体(lìtǐ)结构的重要参数,分子的许多性质与键角 有关。
22002211/1/21/211/11
B.NH3 , H2O
键 Cl-Cl Br-Br
I-I O-H
键能 242.7 193.7 152.7 462.8
键 N=O O-O O=O N-H
键能 607 142 497.3 390.8
202211//1122//1111
第六页,共二十六页。
6
键参数
【思考(sīkǎo)与交流1】P32
原理:∆H = 反应物键能总和 - 生成物键能总和
(1) 规律:键能越大,化学键越牢固,由该键形成(xíngchéng)的分子越稳 定。
(2) ∆H = 反应物键能总和(zǒnghé) - 生成物键能总和
2002211//112/21/111
第五页,共二十六页。
5
键参数(cānshù)
【练习】
由下表的数据(shùjù)判断,下列分子的稳定性:
A.Cl2, Br2, I2
第十三页,共二十六页。
13
键参数(cānshù)
H2O 105°
NH3 107°
2200221/11/2/1121/11
第十四页,共二十六页。
14
键参数(cānshù)
CO2 180°
2002211//112/21/111
第十五页,共二十六页。
2019_2020学年高中化学第2章分子结构与性质第1节共价键课件新人教版选修3

(2)下表中是 H—X 键的键能数据
共价键
H—F H—Cl H—Br H—I
键能/kJ·mol-1
568
431.8
366
298.7ຫໍສະໝຸດ ①若使 2 mol H—Cl 键断裂为气态原子,则发生的能量变化
是 23 ___吸__收__8_6_3_._6_k_J__的__能__量___。
②表中共价键最难断裂的是 24 ___H_—__F__键,最易断裂的是
3.键角 (1)键角是指 37 _在__原__子__数__超__过__2__个__的_分__子__中__,__两__个__共__价__键__之__ _间__的__夹__角_____。在多原子分子中键角是一定的,这表明共价键具 有 38 _方__向___性。键角是描述分子 39 _立__体__结__构 ___的重要参数。
知识分点突破
细梳理、练对点、层层过关
分点突破 1 共价键
1.本质和特征 (1)本质:原子之间形成 1 _共 __用 ___电__子__对__。 (2)特征: 2 _饱__和__性___——决定分子的组成; 3 _方__向__性___—— 决定分子的立体构型。
2.类型(按成键原子的原子轨道的重叠方式分类) (1)σ 键 形成 成键原子的 s 轨道或 p 轨道“ 4 _头__碰__头___”重叠而形成 s-s 型 类 s-p 型型 p-p 型
分点突破 2 键参数
1.键能 (1)键能是 20 __气__态__基__态__原__子__形成 1 mol 化学键释放的 21 _最__低___能量。键能的单位是 22 __k_J_·_m__o_l-_1_。例如:形成 1 mol H—H 键释放的最低能量为 436.0 kJ,即 H—H 键的键能为 436.0 kJ·mol—1。
2.(1)共价键课件高二化学人教版选择性必修2

2、σ键的常见类型有(1)s-s, (2)s-p, (3)p-p, 请指出下列分子σ键 所属类型: A、HBr s-p B、NH3 s-p C、F2 p-p D、H2 s-s
3、下列关于σ键和π键的说法错误的是( D )
A、含有π键的分子在反应时,π键是化学反应的积极参与者 B、当原子形成分子时,首先形成σ键,可能形成π键 C、有些原子在与其它原子形成分子时只能形成σ键,不能形成π键 D、在分子中,化学键可能只有π键而没有σ键
原子 电负性 电负性之差 (绝对值)
Na Cl 0.9 3.0
2.1
H Cl 2.1 3.0
0.9
CO 2.5 3.5
1.0
结论:当原子的电负性相差很大,化学反应形成的电子对不会被共用,形
成的将是__离__子_键;而_共__价__键是电负性相差不大的原子之间形成的化学键。
本质:原子之间通过共用电子对(或原子轨道重叠)形成共价键
HCl分子中共价键的形成
未 成
H
对
电
子
的
原
子
轨
道
相
互 靠
Cl
拢
头碰头 1s1
有方向性 s-p σ键
原子轨道相互重叠 形成氯化氢分子中的共价键 (H-Cl)
σ键特点:以形成化学键的两原子核的连线为轴旋
3p5
转,共价键电子云的图形不变,这种特
பைடு நூலகம்
征称为轴对称。
Cl2分子中共价键的形成
未 成
对 Cl
电 子 的 原 子 轨 道 相
饱和性
特征 方向性
s-s σ键除外
共 价 键
σ键 分类
π键
原子轨道“头碰头”重叠,电子云呈轴对 称 原子轨道“肩并肩”重叠,电子云呈镜面对称
第2章 分子结构与性质-高中化学全册必背章节知识清单(新人教版选择性必修2)(教师版)

第二章分子结构与性质第一节共价键一、共价键(一)共价键的形成与特征1、共价键的形成(1)概念:原子间通过共用电子对所形成的相互作用,叫做共价键。
(2)成键的粒子:一般为非金属原子(相同或不相同)或金属原子与非金属原子。
(3)本质:原子间通过共用电子对(即原子轨道重叠)产生的强烈作用。
2、共价键的特征(1)饱和性:按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋状态相反的电子配对成键,这就是共价键的饱和性。
(2)方向性:除s轨道是球形对称外,其他原子轨道在空间都具有一定的分布特点。
在形成共价键时,原子轨道重叠的越多,电子在核间出现的概率越大,所形成的共价键就越牢固,因此共价键将尽可能沿着电子出现概率最大的方向形成,所以共价键具有方向性。
如图所示。
(二)共价键类型1、σ键形成由两个原子的s轨道或p轨道“ 头碰头”重叠形成s-s型s-p型类型p-p型特征以形成化学键的两原子核的连线为轴做旋转操作,共价键电子云的图形不变,这种特征称为轴对称;σ键的强度较大2、π键形成由两个原子的p 轨道“ 肩并肩 ”重叠形成p-p π键特征π键的电子云具有 镜面对称 性,即每个π键的电子云由两块组成,分别位于由两原子核构成平面的 两侧 ,如果以它们之间包含原子核的平面为镜面,它们互为 镜像 ;π键 不能 旋转;不如σ键 牢固 ,较易 断裂3、判断σ键、π键的一般规律共价单键为 σ 键;共价双键中有一个 σ 键、一个 π 键;共价三键由一个 σ 键和两个 π 键组成。
共价键的分类{按共用电子对的数目{共价单键——σ键共价双键——1个σ键、1个π键共价三键——1个σ键、2个π键按电子云重叠方式{σ键――→特征电子云呈轴对称π键――→特征电子云呈镜面对称二、键参数——键能、键长与键角(一)键能1、概念气态分子中 1_mol 化学键解离成气态原子所 吸收 的能量。
它通常是298.15 K 、100 kPa 条件下的标准值,单位是 kJ·mol -1 。
共价键第2课时课件高二下学期人教版(2019)化学选择性必修2

第一节 共价键
学习 目标
第2课时 共价键的键参数
通过认识共价键的键能、键长和键角,从微观角
PART
01
度模型化解释分子的空间结构。
PART
02
结合共价键的键长、键能和键角等数据,理解分子的性质
与键参数的关系,培养证据推理与模型认知的核心素养。
PART
03 掌握用共价键的强弱解释物质稳定性的方法。
②利用等电子体在性质上的相似性制造新材料;
③利用等电子原理针对某物质找等电子体。
三、等电子体
1.等电子体
(4)等电子体的推断确定方法:
No 根据等电子原理的定义和条件判断——二同(等)
借助周期表知识进行等电子体的判定
①同主族变换,如CO2与CS2、CF4与CCl4的等电子体。
Image ②左右移位补偿,如N2与CO,CO32-、NO3-与SO3是等电子体。
实例
No N2、CO、CN-、C22-、NO+
CO2、CS2、N2O、CNO-、N3-、NO2+、SCN-、BeCI2
Image 3原子18e-的等电子体
4原子24e-的等电子体
NO2-、O3、SO2 NO3-、CO32-、BF3、SO3(g)、BO33-、CS32-
1.等电子体
(1)概念: 原子总数相同、价电子总数相同的分子(或离子)互为等电子体。
(2)等电子体特征:
No
等电子体具有相似的化学键特征,它们的结构相近,物理性质相似。
Image 如N2与CO、O3与SO2、N2O与CO2、CH4与NH4+等。
(3)应用: :
①预测分子或离子的立体构型(如已知SO2的空间构型是V形,则可以判断NO2-、O3也是V形)
2018-2019学年高中化学人教版选修3教案:第二章分子结构与性质--共价键模型

教学过程一、课堂导入我们知道物质是由原子、分子、离子等微粒构成。
微粒间的相互作用(化学键或分子间相互作用)理论是物质构成的基本理论。
为什么原子之间可以通过共用电子对形成稳定的分子?共价键究竟是怎样形成的,它又具备怎样的特征呢?下面我们来一起学习共价键模型。
二、复习预习请同学们回答以下问题:(1)化学键的定义及基本分类(2)离子键、共价键的定义(3)离子化合物、共价化合物的定义三、知识讲解考点1:共价键的形成及本质1. 概念 原子间通过共用电子形成的化学键。
2.本质 高概率地出现在两个原子核之间的电子与两个原子核之间的电性作用。
3.形成元素 通常是电负性相同或差值小的非金属元素原子。
4.表示方法(1)用一条短线表示由一对共用电子所形成的共价键,如H —H 、H —Cl ;(2)“=”表示原子间共用两对电子所形成的共价键(共价双键);(3)“≡”表示原子间共用三对电子所形成的共价键(共价叁键)。
考点2:共价键的分类1.分类⎩⎨⎧σ键:原子轨道以“头碰头”方式相互重叠导致电子在核间出现的概率增大而形成的共价键π键:原子轨道以“肩并肩”方式相互重叠导致电子在核间出现的概率增大而形成的共价键单键、双键、叁键σ键、π键的关系单键是σ键,双键含1个σ键1个π键,叁键含1个σ键2个π键。
2.极性键和非极性键:按两原子核间的共用电子对是否偏移可将共价键分为极性键和非极性键1.共价键的饱和性每个原子所能形成的共价键的总数或以单键连接的原子数目是一定的,这称为共价键的饱和性。
共价键的饱和性决定了各种原子形成分子时相互结合的数量关系。
2.共价键的方向性在形成共价键时,原子轨道重叠得越多,电子在核间出现的概率越大,所形成的共价键越牢固,因此,共价键将尽可能沿着电子出现概率最大的方向形成。
共价键的方向性决定着分子的空间构型。
考点4:三个重要的键参数1.键能(1)概念:在101.3 kPa,298 K的条件下,断开1_mol AB(g)分子中的化学键,使其分别生成气态A原子和气态B原子所吸收的能量,叫A—B键的键能。
高中化学第二章分子结构与性质2.1共价键新人教版选修30605166.doc

第二章 分子结构与性质 第一节 共价键知识归纳(1)共价键的定义原子间通过_____________(电子云的重叠)所形成的相互作用。
(2)本质:高概率地出现在两个原子核之间的电子与两个原子核之间的电性作用,包括引力和斥力,当引力和斥力达到平衡时即形成了稳定的共价键。
(3)特征①饱和性:一个原子有几个未成对电子,就会和几个自旋方向相反的未成对电子成键,这就是共价键的饱和性。
共价键的饱和性决定了分子内部原子间的数量关系。
②方向性:共价键形成时,两个参与成键的原子轨道总是尽可能沿着电子出现概率最大的方向重叠,这样原子轨道重叠越多,形成的键就越牢固,这就是共价键的方向性。
共价键的方向性决定了_____________。
(4)共价键的分类(5)键参数①键能:气态基态原子形成___________化学键释放的最低能量。
键能越大,化学键越稳定。
②键长:形成共价键的两个原子之间的核间距。
键长越短,往往键能越_____,共价键越________。
③键角:在多原子分子中,两个共价键之间的夹角。
它是描述分子立体结构的重要参数。
(6)等电子原理①等电子体:原子总数相同、_________________的粒子互称为等电子体。
如N 2与CO 、O 3与SO 2是等电子体,但N 2与C 2H 2不是等电子体。
②等电子原理:等电子体具有相似的化学键特征,它们的许多性质相近,此原理称为等电子原理,例如CO 和N 2的熔沸点、溶解性等都非常相近。
③常见的等电子体:N 2与CO ,CO 2与N 2O ,O 3、2NO -与SO 2,23CO -、3NO -与SO 3,34PO -、24SO -与4ClO -,与B 3N 3H 6(硼氮苯)等。
【答案】共用电子对 分子的立体构型 双键 非极性键 1 mol 大 稳定 价电子总数相同 知识重点一、σ键和π键的对比要注意以下问题:(1)s 轨道与s 轨道重叠形成σ键时,电子不是只在两核间运动,而是在两核间出现的概率较大。
高中化学第二章分子结构与性质2.1.2共价键的键参数与等电子

高中化学第二章分子结构与性质2.1.2共价键的键参数与等电子共价键的键参数与等电子原理基础巩固1N ―H 键键能的含义是( )A.由N 和H 形成1 mol NH 3所放出的能量B.把1 mol NH 3中的共价键全部拆开所吸收的热量C.拆开约6.02×1023个N ―H 键所吸收的热量D.形成1个N ―H 键所放出的热量―H 键的键能是指形成1 mol N ―H 键放出的能量或拆开1 mol N ―H 键所吸收的能量,不是指形成1个N ―H 键释放的能量。
1 mol NH 3中含有3 mol N ―H 键,拆开1 mol NH 3或形成1 mol NH 3吸收或放出的能量应是1 mol N ―H 键键能的3倍。
2关于键长、键能和键角,下列说法不正确的是( )A.键角是描述分子立体结构的重要参数B.键长的大小与成键原子的半径和两个原子间的成键数目有关C.键能越大,键长越长,共价化合物越稳定D.键角的大小与键长、键能的大小无关,键长越短,共价键越强,形成的共价化合物越稳定,故C 项错误。
3下列说法正确的是( )A.键能越大,表示该分子越容易受热分解B.共价键都具有方向性C.在分子中,两个成键的原子间的距离叫键长D.H ―Cl 键的键能为431.8 kJmol -1,H―Br 键的键能为366 kJmol -1,说明HCl 比HBr 稳定,分子越稳定,A 项错,D 项正确;H ―H 键没有方向性,B 项错;形成共价键的两个原子之间的核间距叫做键长,C 项错。
4下列微粒属于等电子体的是( )A.12CO 2和14COB.H 2O和NH 3 C.NO +和CN -D.NO 和CO,NO +和CN -属于等电子体。
5根据等电子原理,下列分子或离子与其他选项不属于同一类的是( )高中化学第二章分子结构与性质 2.1.2 共价键的键参数与等电子原理同步配套练习新人教版选修3A.C.、C 、D 三项为等电子体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章第一节第2课时共价键的键参数与等电子体
1.已知1mol气态基态氢原子完全结合形成氢气时,释放出的能量为218kJ·mol-1,下列说法中正确的是( B )
A.H—H键的键能为218 kJ·mol-1
B.H—H键的键能为436 kJ·mol-1
C.1 mol气态氢原子的能量低于0.5 mol H2的能量
D.使1 mol H2完全分解至少需要218 kJ的能量
解析:键能是指气态基态原子形成1 mol化学键时释放出的热量,1 mol氢原子只能形成0.5 mol H—H键,故A、D两项不正确,B正确;由能量守恒原理及键能定义知C不正确。
2.下列叙述错误的是( B )
A.π键不能单独存在,一定要和σ键共存
B.化学键包含σ键、π键两种类型
C.两个非金属元素原子之间形成的化学键都是共价键
D.成键的原子间已知轨道重叠越多,共价键越牢固
解析:化学键包括离子键,共价键和金属键,共价键包括σ键和π键。
3.根据π键的成键特征判断C===C的键能与C—C键能的数量关系( C )
A.双键的键能等于单键的键能的2倍
B.双键的键能大于单键的键能的2倍
C.双键的键能小于单键的键能的2倍
D.无法确定
解析:由于π键的键能比σ键键能小,双键中有一个π键和一个σ键,所以双键的键能小于单键的键能的2倍。
4.下列说法中正确的是( A )
A.分子中键能越大,键长越短,则分子越稳定
B.只有非金属原子之间才能形成共价键
C.水分子可表示为H—O—H,分子中键角为180°
D.H—O键键能为462.8 kJ·mol-1,即18 g水分解生成H2和O2时,放出能量为(2×462.8)kJ
解析:分子中键能越大,键长越短,分子越稳定,所以A项正确。
B项中有些不活泼金属形成的化学键可能是共价键。
C项中水分子的两个O—H键的键角小于180°。
H—O键的键能是破坏1 mol H—O键所吸收的能量,在一个H2O分子中有两个H—O键,故应吸收能量2×462.8 kJ。
而当H、O形成H2和O2,在成键时需放出能量,故应根据公式“ΔH=反应物的总键能-生成物的总键能”计算,D项错误。
5.下列说法中错误的是( D )
A.非金属元素可能形成离子化合物
B.成键原子间原子轨道重叠的越多,共价键越牢固
C.对双原子分子来说,键能越大,含有该键的分子越稳定
D.键长越长,化学键越牢固
解析:非金属元素可形成共价化合物(如H2O,HCl),也可形成离子化合物(如NH4Cl),A 项正确;成键原子间原子轨道重叠越多,键长越短,则键能越大,共价键越牢固,分子越稳定,故B、C两项正确,D项错误。
6.根据等电子原理,下列各组分子或离子的空间构型不相似的是( D )
A.NH+4和CH4B.H3O+和NH3
C.NO-3和CO2-3D.CO2和H2O
解析:根据等电子原理,CO2和H2O二者原子数相等,但价电子总数不等,不是等电子体,则它们的空间构型不相似。
