最新-金属的化学性质(3) 精品
初中化学课件金属的化学性质课件

目录
• 金属的物理性质 • 金属的化学性质 • 金属的活动性顺序 • 金属的冶炼 • 金属的腐蚀与防护
01
金属的物理性质
金属的颜色
金属的颜色
金属呈现不同的颜色,如银白色 (如金、银、铝)、红色(如铜 )等,这与其原子结构有关。
金属光泽
大多数金属具有明亮的金属光泽 ,这是由于金属原子密集排列, 反射出光线所致。
金属活动性顺序表的局限性
金属活动性顺序表仅适用于水溶液中的反应,对于非水体系或高温下的反应可能不适用。
金属活动性顺序表仅适用于单质和化合物的标准电极电势进行排序,对于一些非标准状态下 的反应可能不适用。
金属活动性顺序表仅适用于一般情况下的反应,对于某些特殊情况下的反应可能不适用。例 如,某些过渡金属在水溶液中表现出非常特殊的性质,可能与金属活动性顺序表中的位置不 符。
比较金属的活动性强弱
金属活动性顺序表可以用来比较不同金属的活动性强弱,例如,钾的活性强于钠,而钠的 活性强于镁。
判断金属能否与盐发生置换反应
根据金属活动性顺序表,可以判断出一种金属能否将另一种金属从其盐溶液中置换出来。 例如,锌可以与硫酸铜溶液中的铜发生置换反应,而铜不能与硫酸锌溶液中的锌发生置换 反应。
还原反应。
铝工业
通过电解熔融氧化铝制 备铝,涉及电化学反应
。
铜工业
通过火法或湿法冶炼铜 ,涉及氧化还原反应。
锌工业
通过湿法冶炼锌,涉及 溶液中的化学反应。
05
金属的腐蚀与防护
金属的腐蚀
化学腐蚀
腐蚀速率的影响因素
金属与接触到的物质发生化学反应, 导致金属表面被破坏。
金属的种类、环境条件(如温度、湿 度、氧气浓度等)、接触的物质等。
《金属的化学性质》PPT精品课件

注意:与金属反应生成氢气的速率与金属活动性顺序有关,金属的位置越靠前,反 应速率越快。
应用二:位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来;反 之,不能。
注意:
1、金属化合物必须是可溶的,且必须为溶液;
Hale Waihona Puke 2、由于钾、钙、钠过于活泼,不能从其后金属化合物的溶液中置换出金属。
强,
从反应物和生成物的物质类别的角度分析,这些反应都有什么共同点?
Mg + 2HCl = MgCl2 + H2 Zn + 2HCl = ZnCl2 + FHe2 + 2HCl = FeCl2 + H2
Mg + H2SO4 = MgSO4 + H2
置换反应
Zn +H2SO4 = ZnSO4 +H2
单质 化合物 化合物 单质
第八章 -.
目录
CONTENTS
01.课堂导入 02.新课讲授 03.课堂小结 04.典型例题
你有没有发现,日常生活中使用的 铝制品的表面总是光亮的。为什么 铝制品不易生锈呢?
金属 铝(片)
现象
化学方程式 4Al+3O2=== 2Al2O3
镁(条) 铁(丝)
发出耀眼的白光,放出大量的热, 生成一种白色固体
2Cu+O2 △ 2CuO
5.金高温也不与氧气反应
“真金不怕火炼”
金属与氧气反应的难易和剧烈程度首先与金属本身的性质有关,其次还与金属 粉碎的程度、与氧气的接触面积、氧气的浓度、温度等因素有关。
镁、铝比较活泼,铁、铜次之,金最不活泼。
判断金属活动性的方法之一: 根据金属与氧气反应的难易程度或者反应现象的剧烈程度判断
【初中化学】初中化学知识点:金属的化学性质

【初中化学】初中化学知识点:金属的化学性质金属的化学性质:普通金属能与氧、盐酸、硫酸和盐溶液发生反应。
常见金属的化学性质:一金属和氧气的反应金属在空气中在氧气中方程式镁常温下表面逐渐变暗。
点燃猛烈燃烧,发出耀眼的白光,生成白色固体点燃、猛烈燃烧并发光眼的白光,生成白色固体2mg+o22mgo铝在室温下,铝表面变暗并形成层致密氧化膜,保护铝不再被腐蚀光熊熊燃烧,火星到处都是,放出大量的热,生成白色固体22al2o3铁持续加热发红,离火变冷火星无处不在,散发着大量的热量,生成黑色固体3fe+2o2fe3o4铜加热,生成黑色物质,在潮湿的在空气中,铜绿形成并被腐蚀加热,生成黑色固体2cu+o22cuo金即使在高温下,它也不会与氧气发生反应结论大多数金属都能喝氧气反应,但反应的难易程度和剧烈程度不同二金属与酸的反应盐酸稀硫酸反应现象(两种酸中相同)镁mg+2hcl==mgcl2+h2↑mg+h二so四==mgso四+h二↑这种反应是剧烈的,会产生大量的毒素气泡,溶液仍为无色,生成这种气体可以燃烧并产生气体生淡蓝色火焰铝2al+6hcl==2alcl三+3h二↑2al+3h2所以4==al2(so4)+3h2↑锌zn+2hcl==h2↑+氯化锌2锌+氢2所以4==znso4+h2↑反应缓慢,有气泡产生,溶液体逐渐从无色变为浅绿色,生成的气体能够燃烧,并且产生淡蓝色火焰铁fe+2hcl==fecl2+h2↑fe+h二so四==feso四+h二↑铜不反应没有反应无三金属与盐的反应将锌片、铁丝和铜丝分别放入硫酸铜溶液、硝酸银溶液和氯化钠溶液中观察现象 cuso四溶液阿格诺3解决方案nacl溶液锌锌表面有一层红色金属析出,溶液由蓝色变为无色锌+铜4==znso4+特写锌表面有一层银白色金属析出zn+2agno3==zn(否)3)+2ag无变化,不反应铁铁表面有一层红色金属析出,溶液由蓝色变为浅绿色铁+铜4==feso4+特写铁表面有一层银白色金属析出,溶液由无色变为浅绿色 fe+2agno3==fe(否)3)2+2ag无变化,不反应铜无变化,不反应铜表面沉淀一层银白色金属,溶液由无色变为蓝色cu+2agno三==cu(no)二+2ag没有变化,没有反应易错点:一、(1)通常,金属活性顺序表中氢前面的金属(也称为活性金属)可以代替酸中的氢;例如,氢背后的金属铜和银不能与盐酸和稀硫酸反应。
金属的化学性质简介

金属的化学性质简介金属分为活性金属和钝性金属两种。
根据金属活动性顺序,氢前金属称为活性金属,氢后金属就是钝性金属。
今天小编在这给大家整理了金属的化学性质,接下来随着小编一起来看看吧!金属的化学性质金属元素原子的最外层电子数少于4,只能失去电子,不能得到电子,金属元素只有正价;金属单质只有还原性,没有氧化性。
当电子层数相同时,最外层电子数越少,越容易失去电子,金属性越强。
金属是一种具有光泽(即对可见光强烈反射)、富有延展性、容易导电、导热等性质的物质。
金属的上述特质都跟金属晶体内含有自由电子有关。
在自然界中,绝大多数金属以化合态存在,少数金属例如金、铂、银、铋以游离态存在。
金属矿物多数是氧化物及硫化物。
其他存在形式有氯化物、硫酸盐、碳酸盐及硅酸盐。
金属之间的连结是金属键,因此随意更换位置都可再重新建立连结,这也是金属延展性良好的原因。
金属元素在化合物中通常只显正价。
相对原子质量较大的被称为重金属。
钾钙钠镁铝锌铁锡铅 (氢) 铜汞银铂金K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au1、氢前面的金属能与弱氧化性强酸反应,置换出酸中的氢(浓硫酸、硝酸强氧化性强酸与金属反应不生成氢气)。
如:Fe + 2HCl ═ FeCl2 + H2↑2、活动性强的金属能与活动性弱的金属盐溶液反应。
3、大多数金属能与氧气反应。
4、排在H前面的金属,理论上讲都能与水发生化学反应。
在常温下,钾,钙,钠等能与水发生剧烈反应,镁、铝等能与热水反应,铁等金属在高温下能与水蒸气反应。
5、金属均无氧化性,但金属离子有氧化性,活动性越弱的金属形成的离子氧化性越强。
6、金属都有还原性,活动性越弱的金属还原性越弱。
金属化学性能金属化学性能是指金属材料与周围介质扫触时抵抗发生化学或电化学反应的性能。
1、耐腐蚀性:指金属材料抵抗各种介质侵蚀的能力。
2、抗氧化性:指金属材料在高温下,抵抗产生氧化皮能力。
金属之最地壳中含量最高的金属元素:铝(含量为7.73%)人体中含量最高的金属元素:钙(含量为1.5%)目前世界年产量最高的金属:铁密度最小的金属:氢(2016年1月英国科学家在爱丁堡大学首次制成金属态氢,氢成为密度最小的金属)密度最大的金属:锇(22.48×10?㎏/m?)最硬的金属:铬(莫氏硬度约为9)最软的金属:铯(莫氏硬度约0.5)导电性最强的金属:银导热性最强的金属:银制造新型高速飞机最重要的金属:钛(被科学家称为“二十一世纪的金属”或“未来的钢铁”)海水中储量最大的放射性元素:铀(陆地铀矿的总储量约200万吨,海洋里含铀的总量高达40万万吨)含同位素最多的元素:锡(有10种稳定的同位素)含同位素最少的元素:钠(只有Na-23稳定)展性最强的金属:金(最薄的金厚度只有1/10000mm)延性最好的金属:铂(最细的铂丝直径只有1/5000mm)熔点最高的金属:钨(熔点:3410±20℃)熔点最低的金属:汞(熔点-38.8℃)熔沸点相差最大的元素是镓(熔点30℃,沸点2403℃)地壳中含量最少的金属是钫(即使是在含量最高的矿石中,每吨也只有37×10负13次方克;地壳中的含量约为1×10^-21 %) 光照下最易产生电流的金属元素:铯(当其表面受到光线照射时,电子便能获得能量从表面逸出,产生光电流)金属性最强的金属:铯世界上最贵的金属:锎(每克1千万美元,比金贵50多万倍)世界上最便宜的金属:铁最易应用的超导元素:铌(把它冷却到-263.9℃的超低温时,会变成一个几乎没有电阻的超导体)最能吸收气体的金属元素:钯(1体积胶状钯能吸收氢气1200体积)。
初中化学课件金属的化学性质课件(优秀版)

酸的性质
介绍不同酸的性质以及与金属反应时产生的化学变 化。
金属与酸的反应
深入探讨金属和酸反应的机理和实际应用。
碱和金属的反应
碱的性质
描述碱的化学性质和与金属反应的特点。
金属与碱的反应
阐述金属与碱反应的过程和结果。
氧和金属的反应
金属氧化
解释金属在氧气环境中发生 氧化反应的机制和现象。
金属氧化物
详细介绍不同金属的氧化物, 并分析其性质。
3
金属的锈蚀和防腐讲解金属在与气接触时的反应,以及防腐措施的重要性。
金属与非金属元素的反应
1 电子转移
2 离子共享
解释金属与非金属元素之 间电子转移的过程和原理。
说明金属与非金属元素之 间离子共享的机制和重要 性。
3 生成化合物
列举金属与非金属元素反 应生成的化合物,并分析 其性质。
酸和金属的反应
金属离子的导电性
探讨金属离子在溶液中的导电性和相关的实验现象。
金属的物理性质和化学性质的对比
1 物理性质
对比金属的物理性质,例如导电性和热导率。
2 化学性质
对比金属的化学性质,例如活泼性和容易氧化性。
初中化学课件金属的化学 性质课件(优秀版)
这个课件将介绍金属的化学性质,包括与非金属元素的反应、酸和金属的反 应、金属与水的反应等多个方面,帮助学生更好地理解金属的性质。
金属的化学性质
1
金属的活泼性
介绍金属材料的活泼性以及不同金属之间的反应性差异。
2
金属的氧化还原反应
探讨金属在氧化还原反应中的行为和特性。
熟悉的氧化反应
列举一些日常生活中常见的 金属氧化反应,并了解其原 理。
氯和金属的反应
(完整版)初三化学:金属的化学性质
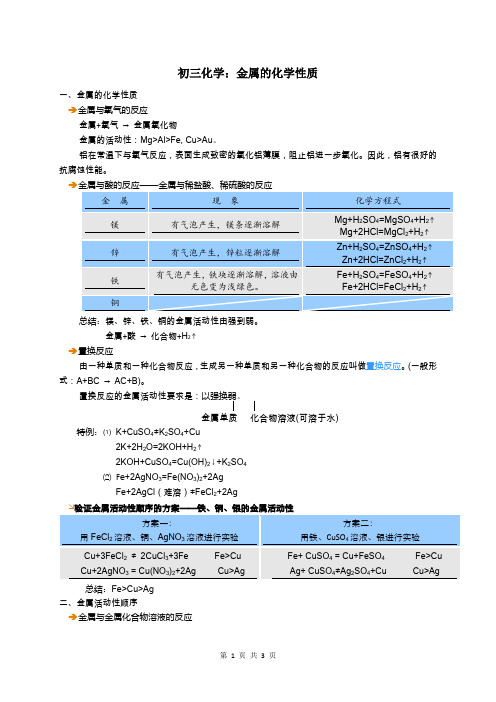
Ag+ CuSO4≠Ag2SO4+CuCu>Ag
总结:Fe>Cu>Ag
二、金属活动性顺序
金属与金属化合物溶液的反应
实 验
现 象
化学方程式
铝丝浸入硫酸铜溶液中
溶液的蓝色变浅,铝丝上附着一层红色固体。
2Al+3CuSO4=Al2(SO4)3+3Cu
铜丝进入硝酸银溶液中
3.钾、钙、钠等非常活泼的金属不能从它们的盐溶液里置换出来。
金属活动性顺序的使用:
1.在金属活动性顺序里,只有氢前面的金属才能与酸反应生成氢气。
2.在金属活动性顺序里,只有排在前面的金属才能把排在后面的金属从它们的化合物溶液中置换出来。
3.当溶液中含有多种离子时,活泼的金属总是先置换那些最不活泼的金属离子。
金属+酸→化合物+H2↑
置换反应
由一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应叫做置换反应。(一般形式:A+BC → AC+B)。
置换反应的金属活动性要求是:以强换弱。
金属单质化合物溶液(可溶于水)
特例:⑴K+CuSO4≠K2SO4+Cu
2K+2H2O=2KOH+H2↑
2KOH+CuSO4=Cu(OH)2↓+K2SO4
初三化学:金属的化学性质
一、金属的化学性质
金属与氧气的反应
金属+氧气→金属氧化物
金属的活动性:Mg>Al>Fe,Cu>Au。
铝在常温下与氧气反应,表面生成致密的氧化铝薄膜,阻止铝进一步氧化。因此,铝有很好的抗腐蚀性能。
金属的化学性质知识点总结

金属的化学性质知识点总结金属的化学性质知识点总结总结是事后对某一阶段的学习、工作或其完成情况加以回顾和分析的一种书面材料,它能使我们及时找出错误并改正,为此要我们写一份总结。
你想知道总结怎么写吗?下面是小编精心整理的金属的化学性质知识点总结,欢迎大家分享。
金属的化学性质知识点总结1具有可燃性,还原性的物质:氢气,一氧化碳,单质碳。
具有可燃性的三种气体是:氢气(理想),一氧化碳(有毒),甲烷(常用)。
CO的三种化学性质:可燃性,还原性,毒性。
三大矿物燃料:煤,石油,天然气。
(全为混合物)三种黑色金属:铁,锰,铬。
铁的三种氧化物:氧化亚铁,三氧化二铁,四氧化三铁。
炼铁的三种氧化物:铁矿石,焦炭,石灰石。
常见的三种强酸:盐酸,硫酸,硝酸。
浓硫酸的三个特性:吸水性,脱水性,强氧化性。
氢氧化钠的三个俗称:火碱,烧碱,苛性钠。
碱式碳酸铜受热分解生成的三种氧化物:氧化铜,水(氧化氢),二氧化碳。
金属的化学性质知识点总结2金属的化学性质1、大多数金属可与氧气的`反应2、金属+酸盐+H23、金属+盐另一金属+另一盐(条件:前换后,盐可溶)Fe+CuSO4=Cu+FeSO4(湿法冶金原理)常见金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au金属活动性由强逐渐减弱在金属活动性顺序里:(1)金属的位置越靠前,它的活动性就越强(2)位于氢前面的金属能置换出盐酸、稀硫酸中的氢(不可用浓硫酸、硝酸)(3)位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来。
(除K、Ca、Na)金属的化学性质知识点总结3一、空气的成分和组成1、空气的成分:空气成分N2O2稀有气体CO2其它气体和杂质体积分数78%0.94%0.03%0.03%2、空气中氧气含量的测定:观察到的现象:有大量白烟产生,广口瓶内液面上升约1/5体积,反应的化学方程式:4P5O2点燃4P2O5;结论:空气是混合物;O2约占空气体积的1/5,氮气约占空气体积的4/5。
金属的化学性质_课件3

4、铝能跟碱溶液的反应
总之:金属越活泼,反应越容易发生。
Fe:空气中缓慢氧化生成Fe2O3 氧气中点燃生成Fe3O4
Cu:氧气中加热或缓慢氧化,现象及产物相同
2、金属与其它非金属的反应
①与氮气的反应 3Mg + N2点=燃Mg3N2
②与硫的反应 2Na + S = Na2S
三、金属与水和酸的反应
1、金属与酸的反应
Na 2Na +2H+=2Na+ +H2↑
Mg Mg +2H+=Mg2+ +H2↑
Al 2Al +6H+=2Al3+ +3H2↑
Fe
Fe +2H+=Fe2+ +H2↑
Cu Cu +2H+≠
从Na至Cu反应越来越不剧烈
2、金属与水的反应
实验: 1、钠块放入水中
现象: 浮 密度比水小,0.97g/cm3 游 有气体生成 熔 反应放热,钠的熔点低。97.81℃ 响 反应剧烈 红 生成物呈碱性
金属越活泼,与水反应越剧烈
为什么铝不与水的反应??
四、铝与碱溶液的反应 实验:
铝片放入NaOH溶液中
2Al+2NБайду номын сангаасOH+2H2O=2NaAlO2+3H2↑
五、金属的其他反应
1、金属与盐溶液的反应 活泼金属可与不活泼金属的盐溶液 发生置换反应,但金属钠除外
2、镁与二氧化碳的反应
Mg +CO2=MgO +2C 镁着火不可用二氧化碳来灭火!
切开 Na质软
变暗
-1
4Na + O2 = 2Na2O(白色)
氧化钠
燃烧:黄色火2N焰a+O2=△Na-2O1 2(淡黄色)
金属的化学性质

FeCl2+H2↑ MgCl2+H2↑ ZnCl2+H2↑ FeSO4+H2↑ MgSO4+H2↑ ZnSO4+H2↑
• CuSO4
硫酸铜
• Al2(SO4)3硫酸铝
• AlCl3
氯化铝
CuSO4+Fe 6HCl+2Al 3H2SO4+2Al
金属的化学性质
请在此输入您的副标题
学习目标
1、知道铝制品易生锈,铁制品不易生锈的原因 2、学会金属和氧气的反应 3、理解金属和酸的反应、金属和盐的反应都是置换反 应,并能准确写出反应方程式。
金属的化学性质
• 4Al+3O2
2Al2O3 铝和氧气反
应
△
• 2Cu+O2 点 燃 2CuO 铜和氧气反 应
置换反应
• 单质+化合物==新单质+新化合物 • 单质:只含一种元素的纯净物,有化学式 • 化合物:含多种元素的纯净物,有化学式
• HCl 稀盐酸,浓盐酸,氯化氢气体
• H2SO4稀硫酸,浓硫酸 • FeCl2 氯化亚铁 FeSO4硫酸亚铁 • MgCl2 氯化镁 MgSO4硫酸镁 • ZnCl2 氯化锌 ZnSO4硫酸锌
• 3Fe+2O2 应
Fe3O4 铁和氧气反
铝制品不易生锈
常温下,铝与空气中的氧气反应, 表面生成一层致密的氧化铝薄膜, 从而阻止铝进一步氧化。
4Al+3O2
2Al2O3
铁生锈
• 铁与氧气、水反应生成铁锈。 • 防止铁生锈的方法:涂油,刷
九年级化学金属的化学性质3

2Al+3CuSO4
Al2(SO4)3 +3Cu
铜丝浸入 硝酸银溶
液中
红色的铜表面有白 色的物质生成,溶 液由无色变成蓝色
Cu+2AgNO3
Cu(NO3)2+2Ag
铜丝浸入 硫酸铝溶
液中
无现象
金属活动性:Al>Cu>Ag
3 金属活动性顺序表
锡铅
铂金
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属的化学性质
一 金属与氧气的反应
讨论:你能从下列的化学方程式得到什么信息?
点燃
2Mg+O2 点燃
4Al+3O2 点燃
3Fe+2O2 加热
2Cu+O2
2MgO 2Al2O3 Fe3O4 2CuO
Au+O2
不反应
综合上述信息可知:
1、大多数金属都能与 氧气 反应,反应的剧烈程度不同 (相同或不同);
金属活动性由强逐渐减弱
金属与酸、化合物溶液发生置换反应的一些规律:
1、 在金属活动性顺序表里,金属的位置越靠前,它的活动性越强 2、 在金属活动性顺序表里,位于氢前面的金属能置换出盐酸,稀硫酸中的氢 3 、在金属活动性顺序表里,位于前面的金属能把位于后面的金属从它
们的化合物的溶液里置换出来 4 、铁与酸,铁与化合物溶液发生置换反应,生成亚铁化合 物
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
练习:
1.判断下列各组物质能否发生反应? 可以反应的写出方程式
(1)银和稀盐酸
不反应
(2)铝和稀硫酸 2Al + 3H2SO4
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
金属的化学性质(3)一、选择题l .下列变化属于化学变化的晕 ······································································ 【 】 A.晾干的咸菜上出魂食盐晶体 B..铜器上生铜绿 C.日光灯通电发光D.花生油在冬天冻结2.下列物质中,可由金属跟稀硫酸反应直接制取的是 ····································· 【 】A.Ag 2SO 4B.CuSO 4C.Fe 2(SO 4)3D.A12(SO 4)3 3.下列各种材料中,属于有机合成材料的是 ················································· 【 】A.钢铁B.水泥C.聚乙烯D.石灰石4.公元二世纪,我国古代炼丹家魏伯阳著有(简易参同契)是世界上现存最早的一部炼丹专著。
书中描写道:“金入于猛火,色不夺精光。
”这句话是指黄金的性质在强热条件下 ·· 【 】 A.很稳定 B.很活泼 C.易氧化 D.易还原 5.下列反应中属于置换反应的是 ································································ 【 】 A.2Cu+O 2−−−→加热2CuOB.Fe+CuSO 4→FeSO 4+CuC.CuO+CO −−−→加热Cu+CO 2D.NaCl+AgNO 3→AgCl ↓+NaNO 36.将金属,R 和M 分别浸入稀硫酸里,R 溶解而M 不溶解.将M 浸入金属T 的硝酸盐溶液里,M 的表面析出T 。
这三种金属由弱到强的顺序是 ············································ 【 】 A.T 、R 、MB.R 、M 、TC.T 、M 、RD.M 、R 、T7.在硝酸铜和硝酸银的混合溶液中,加入一定量的铁粉,充分反应后,过滤上述反应的混合物,在滤液中滴加盐酸有白色沉淀产生,则过滤得到的金属是 ································ 【 】 A.Fe 、CuB.CuC.Fe 、AgD.Ag8.用相同质量的锌和镁分别跟足量的稀硫酸反应,以纵坐标表示生成氢气的质量,横 坐标表示反应时间,符合反应实际的图像是 ·················································· 【 】9.把等质量的锌片分别放叭下列各溶液中,充分反应后,溶液质量减少的是 ········· 【 】 A.Na 2SO 4B.CuSO 4C.H 2SO 4D.AgNO 310.镁和铝分别跟足量的稀硫酸反应,若要制得相同质量的氢气,则消耗掉镁和铝的质量比是 ············································································································ 【 】 A.8:9B.4:3C.16:27D.3:4二、填空题11.纯铜是________色的。
铜的合金有________、________和________等。
12.将A 、B 、C 三种金属分别放置于盐酸中,只有B 溶解;再将A 放置于C 的硝酸盐溶液中,A 表面有C 析出。
则A 、B 、C 三种金属的活动性由强到弱的顺序是______________13.镁、铁、铜三种金属加入适量稀硫酸中,待不再放出气体时过滤;滤纸上有(填化学式,下同)________。
再往滤液中加入过量的镁粉,充分反应后过滤,滤纸上有________,滤液中的溶质是________________。
14.距今两千多年前,我国古代劳动人民已掌握了炼铁的技术,他们将炭不完全燃烧产生一氧化碳,在高温下利用一氧化碳将铁矿石中的氧化铁还原为铁。
请写出上述两个反应的化学方程式:_________________________________,_________________________________.15.本市有一家化工厂,处理含铜垃圾的生产流程如下:试写出上述生产流程中和提取铜直接有关的①②④三个反应的化学方程式:①__________________________________________________________________②__________________________________________________________________④__________________________________________________________________三、简答题16.某同学将Cu+________ ________+Ag的空格填成Cu+2AgCl→CuCl2+2Ag,试回答,这样填写是否正确?为什么?17.把足量的稀硫酸倒入含有少量银粉、氧化铜的铁粉的试管中,加热后过滤,滤纸上剩下什么物质?滤液里有什么物质?写出有关反应的化学方程式。
