地高辛标记探针在Southern杂交分析中的技术要点_陆小平
地高辛标记探针在Southern杂交分析中的技术要点

地高辛标记探针在Southern杂交分析中的技术要点地高辛标记探针在Sou thern杂交分析中的技术要点陆小平周文军(苏州大学生命科学学院江苏苏州215006)小岛峰雄(日本信州大学纤维学部)外源基因是否成功导入受体材料的基因组中,必须从转化植株中找到分子生物学的检测证据。
目前,PCR、Southern杂交等作为常用检测手段而被广泛采用。
虽然PCR技术可以快速得到结果,但是,以农杆菌介导的材料必须慎重这一结论,以免由于农杆菌污染造成假阳性。
而Southern分析由于操作程序繁琐,对植物基因组DNA的提取、纯化、酶切等技术要求较高,有时使杂交结果不甚理想。
我们在植物基因转化的研究中,对荞麦,桑树,紫景天,洋麻等基因组DNA的提取、纯化、酶切进行了探讨,对流程中的有关步骤进行技术改良,使酶切后的PNA在凝胶板上是涂布状完全达到了Southern杂交的技术要求,并用地高辛(D ig)标记探针对外源DNA进行分析,取到了较好的效果。
现简述如下∶1 植物基因组D NA的提取及纯化1)提取高纯度的DNA是Southern杂交的关键, DNA的粗提物中,往往含有大量的蛋白质、多糖、单宁、色素等大分子杂质。
这些杂质通常与DNA共同沉淀或与DNA聚合成大分子复合物。
一旦复合物形成,即便在以后的操作中用酚、氯仿多次纯化,也很难将其除去。
我们的经验是:当用液氮破碎新鲜样品的细胞壁后,先用蒸馏水洗脱两次(洗脱温度为42℃),每次5m in。
以达到洗脱多糖的目的。
每次洗脱后离心5m in(13000 r m in),弃去上层液。
该上层液中含有粘度较高的胶状体,其主要成分可能是粘性多糖。
在提取桑树基因组DNA时,最好用叶柄或幼茎、幼叶作提取材料。
在样品有限时,也可用成熟叶甚至老叶代替。
据C lark M S (1998)介绍,取样前对材料进行除淀粉处理(减少光照、黑暗处理24h),可以抑制多糖的污染。
但我们采用除淀粉处理后的实验结果并不理想,其效果远不及用蒸馏水洗脱。
southern步骤

一、地高辛标记DNA(一)酶切pEHH-HBV质粒1.酶切37℃过夜(时间尽量长一些,以酶切完全)体系DNA 10µgXhoⅠ6µl10×H buffer 10µlddH2O 补至100µl2.胶回收0.8%的胶,80V,50-60min,电泳buffer最好换新的会有6000bp、3182bp、2800bp三条条带3.定量(二)地高辛标记1.体系(或等比例扩大)2-4µgDNA补加ddH2O至16µl2.沸水浴10分钟以变性DNA,然后迅速插入冰水混合物中3.充分混合DIG-High Prime(1号管),并取4μL加入到变性DNA中,混合并简单离心。
37℃孵育过夜4.加入2μl 0.2M EDTA(pH8.0) 终止反应。
(三)标记效率检测1.将地高辛标记DNA的一系列稀释梯度点到一小块带正电荷的尼龙膜上。
取0.2µl标记的DNA,用DNA稀释液稀释1000倍,再取稀释后的DNA0.2µl,再用DNA稀释液稀释1000倍,根据计算量,点0.1-0.5pg到尼龙膜上。
同时从标记对照DNA的2-9号管中取出1μL点在尼龙膜上。
2.通过紫外交联30分钟将DNA固定在膜上。
3.将膜转移到一个装有20mL马来酸缓冲液的塑料容器中在15-25℃中振荡孵育2分钟。
4.在10mL封阻液中孵育30分钟5.在10mL抗体溶液中孵育30分钟6.用10mL洗涤缓冲液洗涤两次,每次15分钟7.在10mL检测缓冲液中平衡2-5分钟8. 同western发光,将膜上带有DNA的一面朝下,放在点有1mL的随时即用的CSPD(5号管)的Parafilm膜上,孵育5分钟。
正面朝上,放在暗盒里的保鲜膜上,立即将保鲜膜另一面盖到膜上,均匀的铺平底物,且膜上不能有气泡。
9.X光片曝光15-25分钟10.如果0.1pg的点可见,那么说明标记的探针达到了预期的标记效率,能够满足杂交所需的探针浓度二、DNA转移与固定1.DNA 琼脂糖凝胶电泳(120V,30-45min)将待检DNA(DNA可做一个浓度梯度)与核酸上样缓冲液按照比例混匀后,加样于0.8%琼脂糖凝胶孔中电泳(可同时配一块添加EB的胶,以便知道DNA跑到哪个位置),估计待检样本电泳至凝胶中间部分时终止电泳,用刀片切去凝胶左上角作标记来判断凝胶的反正面。
地高辛标记探针的Southern杂交
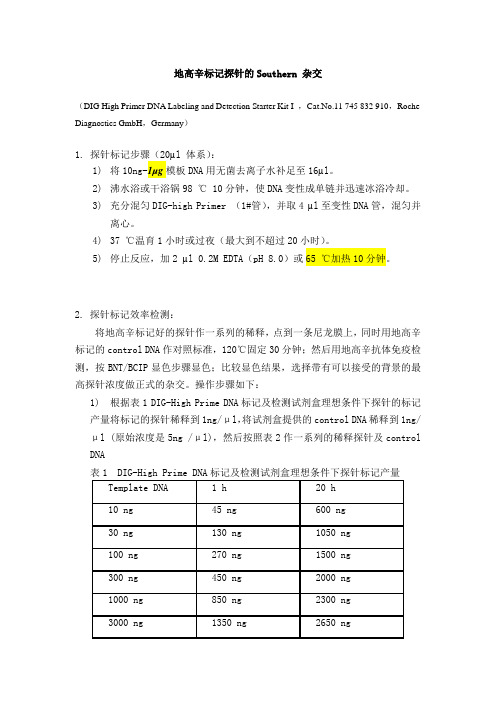
地高辛标记探针的Southern 杂交(DIG High Primer DNA Labeling and Detection Starter Kit I ,Cat.No.11 745 832 910,Roche Diagnostics GmbH,Germany)1. 探针标记步骤(20µl 体系):1)将10ng-1µg模板DNA用无菌去离子水补足至16µl。
2)沸水浴或干浴锅98 ℃ 10分钟,使DNA变性成单链并迅速冰浴冷却。
3)充分混匀DIG-high Primer (1#管),并取4 µl至变性DNA管,混匀并离心。
4)37 ℃温育1小时或过夜(最大到不超过20小时)。
5)停止反应,加2 µl 0.2M EDTA(pH 8.0)或65 ℃加热10分钟。
2. 探针标记效率检测:将地高辛标记好的探针作一系列的稀释,点到一条尼龙膜上,同时用地高辛标记的control DNA作对照标准,120℃固定30分钟;然后用地高辛抗体免疫检测,按BNT/BCIP显色步骤显色;比较显色结果,选择带有可以接受的背景的最高探针浓度做正式的杂交。
操作步骤如下:1)根据表1 DIG-High Prime DNA标记及检测试剂盒理想条件下探针的标记产量将标记的探针稀释到1ng/μl,将试剂盒提供的control DNA稀释到1ng/μl (原始浓度是5ng /μl),然后按照表2作一系列的稀释探针及control DNA表1 DIG-High Prime DNA标记及检测试剂盒理想条件下探针标记产量表2)将上述稀释的2-9 号管的control DNA 及探针DNA各取1μl点膜3)120℃固定30分钟或紫外交链3-5分钟4)将膜放入装有20ml Maleic acid buffer 的塑料器皿中,室温振荡2分钟5)将膜放入10ml Blocking solution中室温温育30分钟6)将膜放入10ml Antibody solution 中室温温育30分钟7)用10ml Washing buffer 洗2次,每次15分钟8)在10ml Detection buffer 平衡2-5分钟9)将膜放入2ml 新配制的Color substrate solution 中暗室条件下显色。
地高辛标记探针的Southern印迹专题方案

地高辛标记探针旳DNA印迹方案Southern blot using DIG Prober(分子生物学实验室)Step I 采用地高辛高效标记混合物(ROCHE) 标记DNA探针1 以质粒为模板,PCR扩增序列特异性片段,回收片段,并测定浓度浓度测定:将回收产物取1μl稀释5倍,原则分子量旳标记物MAKER分别点1μl,2μl,4μl,6μl.然后比较回收产物旳条带亮度与MAKER比较后,可以粗略估算浓度。
2 取1μg模板(第1步扩增回收产物)于1.5ml旳eppendorf管中,加入灭菌双蒸水至终体积为16μl。
3 沸水浴解决10min后迅速于冰上冷却使DNA变性(1)摇匀DIG-High Prime(vial 1),取4μl加入已热变性旳模板DNA中,混匀后,瞬时离心,37℃保温20h,65℃解决10min终结反映。
4取1μl电泳检测,标记后旳条带稍不小于标记前片断。
5标记好旳DNA探针-20℃保存。
Step II 基因组DNA酶切1 提取高质量旳基因组DNA,浓度>1μg/μl ; 测定浓度旳措施同测定探针浓度措施同样。
2 选择合适旳内切酶(酶切旳DNA量20μg左右。
注意考虑到纯化旳损失,约30%,酶切DNA浓度过大时,可以考虑多做几管做浓缩)。
50μl酶切反映体系:EcoR I (15U/μl ) 5μl10×M buffer 5μlgDNA 10μl(约10-20μg)ddH2O up to 50μl注:有些内切酶需加BSA,请参照内切酶阐明(涉及最适酶切温度)。
3 37℃酶切12h (电泳检测),视酶切状况可延长酶切时间,直至酶切完全。
65℃保温10min停止酶切反映。
Step III 预电泳和电泳1 配制0.8 %旳琼脂糖凝胶(大胶40ml左右,胶薄较好,利于转膜)。
2 加入适量上样缓冲液(Loading Buffer)点样,点上质粒做对照。
注:两边旳点样孔尽量空出来;点上marker,再单独一点样孔用溴酚兰做批示,。
地高辛标记核酸探针的标记方法

地高辛标记核酸探针的标记方法Last revision on 21 December 2020地高辛标记核酸探针的标记方法核酸探针已被广泛用于筛选重组克隆、基因多样性的种性检测和真菌种群内及种群之间的系统发育关系评价。
最早使用的放射性同位素标记核酸探针具有敏感性高、特异性好、分辨力强的特点,但放射性同位素标记也存在着一系列令人困扰的问题,如成本高、探针半衰期短、放射性物质危害人体健康等。
而且在进行放射性同位素标记实验时,需要有专门的实验室及相应的实验保护设施,还需要由经过培训的专业人员来操作,因而限制了在普通实验室进行分子生物学实验。
近几年发展起来的非放射性核酸探针大多通过酶促、光化学和化学手段掺入一种报道基团,这种报道基团可通过高灵敏度的冷光、荧光或金属沉淀等检测系统检测。
另外,应用pH电极或感应器技术的电化学检测系统也有报道。
在这些检测系统中,灵敏度最高的是生物素- 亲合素检测系统和半抗原-抗半抗原地高辛检测系统。
由于生物样品中常含有内源性生物素及生物结合蛋白,生物素标记的核酸探针会发生一些非特异性结合,从而影响实验效果。
与生物素-亲合素系统同样具有高灵敏度,却减少了非特异性结合的地高辛检测系统,已为人们所接受,并得到广泛的应用。
地高辛(Digoxigenin ,DIG) 又称异羟基洋地黄毒甙元,是一种类固醇半抗原分子。
其化学结构如图1 所示。
采用人工方法可以将地高辛的线型间隔臂与dUTP 连接起来,形成DIG-11-dUTP,通过随机引物法或PCR法将其掺入到DNA探针中。
RNA探针的标记是使用噬菌体信息编码的RNA聚合酶,通过体外转录将DIG-11-dUTP掺入到RNA探针中。
寡核苷酸探针的标记则是通过末端转移酶催化,在3'末端加上DIG-11-dUTP/dATP 或DIG-11-ddUTP 尾巴。
对于目的DNA 或RNA 来说,分子杂交后,杂交部分可通过ELISA 实验程序加以检测,即加入一种结合有碱性磷酸酶的地高辛-特异性抗体,它与地高辛半抗原分子形成酶联抗体-半抗原(DIG) 复合物,再加入相应的显色底物,使杂交部分得以显示。
Southern 杂交试验方案—本实验室

Southern 杂交试验方案一、探针标记1、探针标记严格按照罗氏试剂盒说明书进行;2、标记探针检测:取标记产物和普通PCR扩增产物各1μl,1.0%的琼脂糖凝胶电泳。
由于大分子量的DIG掺入,标记产物泳动速度比普通PCR产物要慢。
所以根据电泳图就可以判断是否标记上和有没有非特异标记!其余标记产物-20℃保存。
如果要准确检测标记效率(一般不必),取标记产物1μl和Dig标记的对照DNA,用DNA 稀释液按10倍系列稀释后点样于带正电荷尼龙膜上。
用紫外交联仪或真空烘烤固定DNA探针,按杂交检测方法进行信号检测,然后与膜条上的Dig标记的对照DNA信号强度对比,推算出标记的探针浓度。
如初始模板量较大,可取1μl标记产物稀释10~100倍后定量。
二、基因组DNA酶切1、采用EcoRI和一对甲基化敏感同裂酶HPaIl、MspI消化高粱基因组DNA 5ug,3 Unit/ug DNA,50uL反应体系,在37℃条件下酶切消化10h。
2、酶切产物经1%琼脂糖凝胶电泳(电压小于1v/cm,12h)分离。
凝胶在0.2mol/L的HCl 中脱嘌呤处理,至溴酚蓝变为黄色,弃去HCl后用蒸馏水洗几次,然后以0.4mol/L的NaOH 为转移液,利用毛细管作用将DNA转移到Hybond N+尼龙膜上,转移过夜后将膜取出夹放于滤纸间,80℃烘烤2小时。
常温放于干燥处保存备用。
(转膜:1、将胶裁成9.8cm×8.0cm 大小,于平皿中用蒸馏水冲洗一次;(此步一定记好胶的大小,后面裁纸/膜以及杂交液体积的选择都要用到)2、加入100ml 0.25 mol/L 的盐酸脱嘌呤,室温振荡15~30 min,至溴酚蓝完全变成黄色。
(如果限制性片段>10kb,酸处理时间可适当延长;若限制性片段很小,此步可省略)3、用蒸馏水冲洗2 次。
加入变性液(1.5mol/L NaCl、0.5mol/L NaOH)室温振荡20~30min;至溴酚蓝完全恢复到原来的蓝色。
具体了解Southern杂交技术

Southern Blotting的过程
1.碱变性的琼脂糖凝胶电泳分离的DNA 2.通过电泳液的移动转移胶中的DNA 3.固定胶中的DNA 4.预杂交、杂交(放射性和荧光检测) 5.结果检测
具体了解Southern杂交技术
四、Southern杂交的应用
– DNA指纹分析
具体了解Southern杂交技术
滤膜(固相)杂交
具体了解Southern杂交技术
一、核酸分子杂交技术
2、核酸分子杂交的分类: ③ 膜 杂 交 : 用 标 记 DNA
或RNA探针检测固定在 硝酸纤维素(NC)膜 上 的 DNA 序 列 。 Brown 等应用这一技术评估 了 爪 蟾 rRNA 基 因 的 拷 贝数。
具体了解Southern杂交技术
三、Southern 杂交的主要步骤
5、探针的制备 ③探针的种类
cDNA 探针、基因组DNA探针、寡 核苷酸探针、RNA探针等。
具体了解Southern杂交技术
三、Southern 杂交的主要步骤
5、探针的制备
④放射性探针标记物
[α-*N]-dNTP 、32p(14d)、35S(87d)、3H(12y)、 125I(60d)、14C、131I
胶电泳 3、凝胶中DNA的变性:碱变性 4、Southern转膜:
–硝酸纤维素膜 (NC) 、尼龙膜 – 毛细管虹吸印迹法、电转印法、真空
转移法
具体了解Southern杂交技术
三、Southern 杂交的主要步骤
4、Southern转膜:
具体了解Southern杂交技术
三、Southern 杂交的主要步骤
第16讲
核酸分子杂交 ------Southern杂交
Southern印迹技术应用与注意事项

目 录
• southern印迹技术概述 • southern印迹技术的应用 • southern印迹技术的操作步骤 • southern印迹技术的注意事项 • southern印迹技术的优缺点
01 southern印迹技术概述
定义与原理
定义
Southern印迹技术是一种用于检测DNA片段在凝胶电泳后转移到膜上的分子 生物学技术。
基因突变检测
突变位点的确定
根据研究目的确定需要检测的 基因突变位点。
探针制备
针对突变位点设计特异性探针 ,可以是放射性或非放射性标 记。
杂交反应
将探针与固定在膜上的DNA片 段进行杂交,形成探针-DNA复 合物。
信号检测
通过放射自显影或荧光检测等 方法,检测杂交信号,确定是
否存在突变。
基因表达谱研究
限制性酶切和Southern转移
探针杂交
对处理后的DNA进行限制性酶切和凝胶电 泳分离,然后进行Southern转移。
使用甲基化特异性探针进行杂交,检测甲 基化状态。
03 southern印迹技术的操 作步骤
样本准备
01
02
03
样本类型
DNA样本,通常为基因组 DNA或PCR产物。
样本浓度
确保DNA浓度适中,过高 或过低都会影响电泳效果。
对实验条件要求高
需要精确控制电泳和杂交条件,否则可能导致实验失败。
与其他技术的比较
与Northern印迹技术比较
两者都是检测基因表达的重要手段,但Northern印迹技术主要用于检测RNA,而 Southern印迹技术主要用于检测DNA。
与PCR技术比较
PCR技术是一种扩增特定DNA片段的方法,而Southern印迹技术主要用于检测和分析 DNA片段。PCR技术更适用于DNA的快速扩增和定性分析,而Southern印迹技术更适
用地高辛配基(Digoxigenin)标记的cDNA探针检测登革...

用地高辛配基(Digoxigenin)标记的cDNA探针检测登
革...
刘明团;梁富雄
【期刊名称】《中国公共卫生学报》
【年(卷),期】1992(011)001
【摘要】用随机引物法将地高辛标记克隆于PDW79和PDW75质粒中的登革Ⅱ病毒cDNA,以碱性磷酸酶偶联体系检测地高辛-cDNA及其产物,显色灵敏度近0.1pg,感染的Den·v的细胞抽提液和登革患者血清中病毒RNA液的最高稀释度分别为1/320和1/160—320。
本文报告的地高辛-cDNA探针不仅快速检出登革热病毒,而且还可以作型別鉴定,是值得推荐的新方法。
【总页数】3页(P55-57)
【作者】刘明团;梁富雄
【作者单位】不详;不详
【正文语种】中文
【中图分类】R446.5
【相关文献】
1.用地高辛配基标记的pAW101探针杂交分析DNA多态性及其应用 [J], 刘超;罗超权
2.用地高辛配基(Digoxigenin)标记的cDNA探针检测... [J], 刘明团;梁富雄
3.用3H和地高辛配基标记TNF—a cDNA探针进行原位杂交的比较 [J], 刘天菊;
司履生
4.地高辛配基标记cDNA探针快速检测登革热病毒的研究 [J], 王树声;刘明团;梁富雄;陈锦华;陈斌;傅德坚
5.应用地高辛配基标记cDNA探针检测肾综合征出血热病人尸检组织中病毒RNA [J], 张劲风;贺晓慧;杨守京;刘彦仿
因版权原因,仅展示原文概要,查看原文内容请购买。
地高辛标记探针Southern印迹杂交技术要点及改进

生物技术通报BIOTECHNOLOGYBULLETIN・技术与方法・2008年第3期收稿日期:2007-11-19基金项目:国家自然科学基金(No.30460008)作者简介:刘立鸿(1982-),男,硕士生,生化与分子生物专业,E-mail:xjliulihong1234@126.com通讯作者:马正海(1971-),男,副教授,硕士生导师,E-mail:mzhxju@sohu.com自1975年英国科学家E.M.Southern创立Southern杂交技术以来,该技术已成为检测特定DNA片段的经典杂交方法之一[1]。
此法快速、准确、灵敏,目前已经广泛地应用于医学、病毒学、转基因动植物鉴定、动物疾病诊断以及DNA指纹分析等方面的研究。
Southern印迹杂交中使用的标记探针有同位素与非同位素标记2种。
放射性同位素标记的探针灵敏度较高,但存在半衰期限制,对操作者和环境会造成放射性辐射危害。
使用非同位素标记探针可避免放射性危害[2],常规实验室大多采用后者,其中最常用的是地高辛标记探针[3]。
目前虽然有地高辛标记探针标记的试剂盒,但是试剂盒侧重于步骤流程描述,关于技术要点的介绍不是很多。
国内关于地高辛标记探针Southern印迹杂交法技术要点报道也较少。
在开展Southern印迹杂交中,参照文献并结合实验室的具体情况对该技术的具体步骤进行了一些探索和改进,现作一总结。
1技术要点1.1地高辛探针的标记与使用1.1.1探针的标记方法标记方法有缺口平移法、末端标记法、随机引物法和聚合酶链反应法(PCR)等。
Southern杂交探针的制备一般用随机引物法,模板量应达到1μg以上,模板量不足1μg,可适当延长37℃温育时间。
当模板序列已克隆在载体上,地高辛标记探针Southern印迹杂交技术要点及改进刘立鸿1许璐1汪凯2张富春1马正海1(1新疆大学生命科学与技术学院分子生物学重点实验室新疆生物资源基因工程重点实验室,乌鲁木齐830046;2中国科学院上海巴斯德研究所,上海200025)摘要:Southern印迹杂交技术是检测特定DNA片段的常规方法之一,其操作程序繁琐,对基因组DNA的提取、纯化、酶切等均有较高要求,要获得理想杂交结果需要反复摸索。
DIG探针的Southern 杂交

【实验目的】
1.了解Southern 杂交的基本原理及其应用。 2.掌握地高辛标记探针的Southern杂交的基本方法。
【实验原理】
1.探针合成: 1.1 PCR方法
变性后的线性 DNA
Байду номын сангаас
Taq酶
加入
dATP, dCTP, dTTP,dGTP+Dig-dUTP 特异引物
【实验原理】
1.探针合成: 1.2 随机引物法
变性后的线性 DNA
Klenow酶
加入
dATP, dCTP, dTTP,dGTP+Dig-dUTP 随机引物
2.电泳分离DNA样品,并转移至尼龙膜:
标记 点样孔
切胶
凝胶
重物 吸水纸 厚滤纸 保鲜膜 转移缓冲液 支持物
吸水纸
玻璃板
尼龙膜 凝胶 厚滤纸
2.电泳分离DNA样品,并转移至尼龙膜:
- +
- +
-
+
紫外交联
尼龙膜
吸水纸
3.探针杂交:
a.预杂交
尼龙膜
预杂交液
b. 杂交
加入已变性的探针
适宜的 杂交温度
适量的 探针
适宜的 杂交时间
4.检测反应 a.加入抗DIG-AP抗体(偶联了碱性磷酸酶的抗地高辛抗体)
加入抗体
4.检测反应 b.加入CSPD ready_to_use CSPD (ready to use)
4.检测反应 c.曝光,记录结果
GnRH
β-actin
地高辛标记0

将尼龙膜按下列程序再次浸洗
18 m, ) l缓冲液 1 1 l 0 (. o 马来酸/. o板 0 m 01 m l 5
化郭/H .)0 ; P 751 mn i 28 m )0 L缓冲液 , 7 m , (2 缓冲液 I . , 0阻 l / 1 0n 8 1/
预杂交液后, 驭尽袋 中的气泡, 口后盆 6 C 封 5 杂交炉
( Y L H B IZ T O O E MH -0 ) E E A Y R D A N V N S3 1中孵育 I
」h,
3做一次Suhr ote 杂交所需 1 P 纯 D A, ) n 0 R N 一般 取 。2 新鲜样品即可得到 1p .R 0 我们仍用蛋白酶 K 但 ,
其中添加了8 I 酶解缓冲液(0 o T iH, 0 d 6 - t , (, m h- t 6m o E T 3 D ,H . )置 5 〔条件下酶切 0 m l A,YS S p 78, 5 D
过夜。结束后再用苯酚、 氮仿处理 5纯化后的 N D A可以通过测定波 长为 2020 ) 3,6 .
2。 8 的紫外吸收光谱来确定其浓度 但这些数据只能作 为参考 因即便有较高的(, 仍会存有影响酶切的 )值 I
T扰物质 我们建议最好采用凝胶电泳检* 1
2 醉切
en r 杂交的技术要求, 并用地高辛(i D即标记探针对外源
D A进行分析, N 取到了 较好的效果。 现简述如下 :
1 植物基因组 D A的提取及纯化 N
D A时, N 最好用叶柄或幼茎、 幼叶作提取材料。在样品 有限时, 也可用成熟叶甚至老叶代替。据 Cak l MS r
(98介绍, 19 ) 取样前对材料进行除淀粉处理( 减少光照、 黑暗处理 2 h 4 , )可以抑制多糖的污染 但我们采用除淀
Southern杂交技术手册

Southern杂交探针标记及检测试剂盒:DIG High Prime DNA Labeling and Detection Starter Kit II (detection with CSPD)原理所谓DNA探针,实质上是一段已知的基因片段,应用这一基因片段即可与待测样品杂交。
如果靶基因和探针的核苷酸序列相同,就可按碱基配对原则进行核酸分子杂交,从而达到检查样品基因的目的。
在随机引物法标记反应液中,有随机合成的六聚体核昔酸(hexanucleotide)作为引物,dATP、dCTP、dGTP、dTTP 和DIG-dUTP作为合成底物,以单链DNA作为模板,在Klenow酶的作用下,合成掺入地高辛的DNA链。
以地高辛标记的探针与靶基因DNA链杂交后,再通过免疫反应来进行检测。
一般通过酶标抗地高辛抗体来检测,就可以肯定杂交反应的存在。
免疫检测采用CSPD发光曝光到X光片。
试剂盒内容:1. DIG-High Prime,vial 1,50ul(5×);2. 地高辛标记的对照DNA,vial 2,20ul(5ug/ml pBR328 DNA);3. DNA稀释缓冲液,vial 3,(3×1ml);4. AP Conjugate,vial 4,50ul(750U/ml);开封后2-8℃稳定保存。
5. CSPD,vial 5,50 ml;开封后2-8℃避光稳定保存。
6. Blocking solution(封闭液),vial 6,4×100ml(10×);开封后应分装,在-15~-25℃稳定保存,或2-8℃保存1个月,工作液应现用现配。
7. DIG Easy Hyb Granules,vial 7,4×100ml。
表1 需准备的其他试剂及设备过程设备试剂DIG标记探针水浴、电炉双蒸水,灭菌;0.2 M EDTA溶液(pH 8.0),灭菌。
探针灵敏度检测尼龙膜(Hybond-N+ NylonMembrane)洗脱缓冲液马来酸缓冲液检测缓冲液转膜转膜装置、紫外交联装置或烘箱TBE,酸变性液,碱变性液,中和液,20×SSC杂交电炉、冰水混合物、尼龙膜、杂交炉、杂交瓶20×SSC,1% SDS免疫检测洗脱缓冲液;马来酸缓冲液;检测缓冲液;重新杂交水浴20×SSC;1% SDS;1 M NaOH试剂配制:1. 马来酸缓冲液——0.1 M马来酸(M.W. 116.1),0.15 M NaCl,NaOH固体调pH至7.5,常温(称取11.61g马来酸,8.77g NaCl,定容至1000mL,高压灭菌)。
Southern杂交分析原理和操作

Southern杂交分析原理和操作【原理】Southern杂交是分子生物学的经典实验方法。
其基本原理是将待检测的DNA样品固定在固相载体上,与标记的核酸探针进行杂交,在与探针有同源序列的固相DNA的位置上显示出杂交信号。
通过Southern杂交可以判断被检测的DNA样品中是否有与探针同源的片段以及该片段的长度。
一.基因组DNA的限制酶切【操作】DNA (1μg/ml)20μg、10×酶切buffer5.0μl、限制性内切酶(lOU /μl) 5.0μl、加ddH2O至50μl,在最适温度下消化1~3h。
消化结束时可取5μl电泳检测消化效果。
如果消化效果不好,可以延长消化时间,但超过6h己没有必要。
或者放大反应体积,或者补充酶再消化。
如仍不能奏效,可能的原因是DNA样品中有太多的杂质,或酶的活力下降。
消化后的DNA 加入1/10体积的0.5mol/L EDTA,以终止消化。
然后用等体积酚抽提、等体积氯仿抽提,2.5倍体积乙醇沉淀,少量TE溶解(参见DNA提取方法,但离心转速要提高到12000g,以防止小片段DNA的丢失)。
如果需要两种酶消化DNA,而两种酶的反应条件可以一致,则两种酶可同时进行消化;如果反应条件不一致,则先用需要低离子强度的酶消化,然后补加盐类等物质调高反应体系的离子强度,再加第二种酶进行消化。
二.基因组DNA消化产物的琼脂糖凝胶电泳【操作】1.制备0.8%凝胶一般用于Southern杂交的电泳胶取0.8%。
2. 电泳电泳样品中加人6×Loading缓冲液,混匀后上样,留一或两泳道加DNAMarker。
1~2V/cm,DNA从负极泳向正极。
电泳至溴酚蓝指示剂接近凝胶另一端时,停止电泳。
取出凝胶,紫外灯下观察电泳效果。
在胶的一边放置一把刻度尺,拍摄照片。
正常电泳图谱呈现一连续的涂抹带,照片摄人刻度尺是为了以后判断信号带的位置,以确定被杂交的DNA长度。
三.DNA从琼脂糖凝胶转移到固相支持物【操作】1.碱变性室温下将凝胶浸入数倍体积的变性液中30min。
Southern印迹杂交实验原理和方法-3

Southern印迹杂交实验原理和方法-3真空转移法的最大优点是迅速,可在转膜的同时进行DNA变性与中和整个过程约需3 0~60分钟。
但在操作中应注意两个问题,一是真空压力不能太大,若压力过大,凝胶被压缩,转移效率会降低;二是真空转移液要密封严,防止漏气影响压力的产生。
下表列出了不同的印迹方法。
表10-2 不同印迹方法的比较表五、探针标记用于Southern印迹杂交的探针可以是纯化的DNA片段或寡核苷酸片段。
探针可以用放射性物质标记或用地高辛标记,放射性标记灵敏度高,效果好;地高辛标记没有半衰期,安全性好。
人工合成的短寡核苷酸可以用T4 多聚核苷酸激酶进行末端标记。
探针标记的方法有随机引物法、切口平移法和末端标记法,详细方法参见本书相关章节。
这里介绍放射标记。
以下为 Promega公司随机引物试剂盒提供的标记步骤:(一)取25~50mg模板DNA于0.5ml离心管中,100℃水浴5min,立即置冰浴。
(二)在另一个0.5ml离心管中加入:Labeling 5×Buffer (含随机引物) 10μldNTPmix(含dCTP.dGTP.dTTP各0.5mmol/L) 2μlBSA(小牛血清蛋白) 2μl[α-32ρ] dATP 3μlKlenow 酶 5U(三)将变性模板DNA加入到上管中,加ddH2O至50μl混匀。
室温或37℃ 1h.(四)加50μl终止缓冲液终止反应标记后的探针可直接使用或过柱纯化后使用。
由于α-32ρ的半衰期只有14天,所以标记好的探针应尽快使用。
探针的比活性最好大于 1091计数/分/μl。
六、预杂交(prehybridizafion)将固定于膜上的DNA片段与探针进行杂交之前,必须先进行一个预杂交的过程。
因为能结合DNA片段的膜同样能够结合探针DNA,在进行杂交前,必须将膜上所有能与DNA结合的位点全部封闭,这就是预杂交的目的。
预杂交是将转印后的滤膜置于一个浸泡在水浴摇床的封闭塑料袋中进行,袋中装有预杂交液,使预杂交液不断在膜上流动。
地高辛标记Northern杂交中文方法

地高辛杂交试剂盒:DIG Northern Starter Kit (ROCHE) 12039672910原理:RNA是通过异羟基洋地黄毒苷(digoxigenin,Dig)配基标记的脱氧尿嘧啶核苷三磷酸(dUTP)随机插入结合而被标记。
dUTP通过间臂连结类固醇半抗原异羟基洋地黄毒苷酸基,形成Dig-dUTP,杂交反应后,杂交的靶RNA通过酶联免疫法与一个抗体复合物抗异羟基洋地黄毒苷配基碱性磷酸酶复合物(Dig)Ap结合,接着在5-溴-4氯-3-吲哚磷酸盐(X-磷酸盐)和硝基四氮唑蓝(NBT)存在下,由酶催化反应,在杂交部位形成蓝紫色带或颗粒;也可以使用荧光碱性磷酸酶底物,检测的灵敏度常规可达到0.1pg.探针制备(1)模板引物设计,将T7 RNA polymerase序列5′-TAATACGACTCACTATAGGG-3′加在目的基因下游引物前面。
模板的准备,先摸索模板的率高的PCR体系,25μL的体系扩增20管。
PCR产物纯化1)将20管的PCR产物转移入1.5mL离心管加入等体积的氯仿:异丙醇(24:1),抽提一次,12000rpm,离心,10min(此步上清中可能会有些浑浊,但没关系)。
2)上清转移入一个新的1.5mL 离心管中,并向其加入1/10倍体积的NaAc,2-2.5倍体积的无水乙醇,-20℃沉淀至少3h或过夜沉淀12000rpm,离心,15min。
3)用75%的酒精洗涤沉淀一次,50µL的DEPC处理水回溶。
4)用中孔点样,89V电泳,用质量比较好的胶回收试剂盒进行胶回收,30µL的DEPC处理水回溶,用分光光度计测DNA 的浓度,最好是在200ng/µL左右。
(2)取一只经过DEPC处理并高压灭菌的无RNase污染的1.5mL离心管中依次加入下列反应物(离心管置于冰上)。
模板DNA (200ng)混合物5×(1a) 2 μL缓冲液5×(1b) 2 μL聚合酶T7 (3号管) 1 μLddH2O Up to 10 μL模板DNA一定不能多于200ng,量比较多,合成探针的效率较低,此步骤非常关键;最好1μLDNA 的浓度为200ng,剩余补DEPC水。
原位杂交-经典方法-地高辛标记探针

原位杂交(In situ hybridization)一、目的掌握核酸探针原位杂交操作技术,并利用该技术对单细胞的靶目标进行定位,用于细胞生物学基础研究。
二、原理原位杂交技术(in situ hybridization)是分子生物学和组织化学成功结合的产物,是特定标记的已知序列核酸作为探针与细胞或组织切片中核酸进行杂交并对其实行检测的方法。
其基本原理是含互补序列的标记DNA或RNA片段,即探针,在适宜的条件下与细胞内特定的DNA或RNA形成稳定的杂交体。
原位杂交能在成分复杂的组织中进行单一细胞的研究而不受同一组织中其它成分的影响,因此对于那些细胞数量少且散在于其他组织中的细胞内DNA或RNA研究更为方便;由于原位杂交不需要从组织中提取核酸,对于组织中含量极低的靶序列有极高的敏感性,并可完整地保持组织与细胞的形态,更能准确地反映出组织细胞的相互关系及功能状态。
三、仪器设备烘箱,切片机,展片机,染色缸,湿盒,原位PCR仪,显微镜、镊子、量筒、烧杯、吸水纸、枪与枪头、载玻片、盖玻片、冰盒等。
四、材料和试剂1.材料:带有病原体的水生动物,如感染WSSV病毒的对虾、感染虹彩病毒的水生动物等。
2.试剂:Davidson’s AFA固定液:330 ml 95%乙醇220 ml 福尔马林(37~39%甲醛水溶液)115 ml 冰醋酸335 ml H2O混匀后封口,室温放置;DIG标记与检测试剂盒(Roche公司);TNE:50 mmol/L Tris-HCl 6.57 g Tris Base10 mmol/L NaCl 0.58 g NaCl1 mmol/L EDTA 0.37 g EDTAddH2O 900 ml (定容至1L)用HCl调pH至7.4,高压灭菌,4℃保存;0.4% 甲醛:37~39%% 甲醛 5.4 mlddH2O 495 ml;蛋白酶K溶液(Pr.K,10 mg/ml):10 mg Pr.K 溶于1 ml TNE中(用时现配);20×SSC:3 mol/L NaCl 175.32 g NaCl0.3 mol/L柠檬酸钠88.23 g 柠檬酸钠ddH2O 900 ml (定容至1L)调pH至7.0,高压灭菌,4℃保存;2×SSC:20×SSC 100 mlddH2O 900 ml0.45 µm 滤膜过滤,4℃保存;20×Denhardt’s溶液:0.4%牛清血蛋白0.4 g牛清血蛋白0.4%聚蔗糖0.4 g聚蔗糖0.4%聚乙烯吡咯烷酮0.4 g聚乙烯吡咯烷酮ddH2O 100 ml0.45 µm 滤膜过滤,4℃保存;25%硫酸葡聚糖:25 g硫酸葡聚糖溶于80 ml ddH2O(定容至100 ml),-20℃保存;杂交液:4×SSC50% 甲酰胺1×Denhardt’s5% 硫酸葡聚糖0.5 mg/ml鲑精DNA4℃保存;BufferI:100 mmol/L Tris-HCl 12.11 g Tris Base150 mmol/L NaCl 8.77 g NaCl用HCl调pH至7.5,定容至1L,高压灭菌,4℃保存,;BufferII:0.5% Blocking agent 0.5 g Blocking agentBufferI 100 ml低温加热溶解,4℃保存一星期;BufferIII:100 mmol/L Tris-HCl 12.11 g Tris Base100 mmol/L NaCl 5.84 g NaCl50 mmol/L MgCl2 10.16 g MgCl2•6H2OddH2O 990 ml(定容至1L)用HCl调pH至9.5,0.45 µm 滤膜过滤,4℃保存;BufferIV:10 mmol/L Tris-HCl, pH8.0, 1 mmol/LEDTA;显色液(NBT/BCIP使用液):20 µl NBT/BCIP + 1ml BufferIII。
Southern印迹杂交作业指导书

Southern印迹杂交作业指导书实验目的学习和掌握Southern印迹杂交技术,检测重组DNA分子中是否含有目的基因片段。
实验原理具有一定同源性的两条核酸单链在一定的条件下,可按碱基互补的原则形成双链,此杂交过程是高度特异性的。
Southern印迹杂交技术包括两个主要过程:一是将待测核酸分子通过一定的方法转移并结合到一定的固相支持物(硝酸纤维素膜或尼龙膜)上,即印迹(blotting);二是固定于膜上的核酸同同位素标记的探针在一定的温度和离子强度下退火,即分子杂交过程。
这种技术是E.M.Southern l975年首创的,因此称Southern印迹杂交。
Southern印迹的印迹方法有毛细管法、电转法、真空转移法,滤膜有尼龙膜、化学活化膜(如ABM、APT纤维素膜)等。
这里主要介绍目前常用的电转法。
电转法是利用电场的电泳作用将凝胶中的DNA转移到固相支持物上,是近年来发展起来的一种简单、迅速、高效的DNA转移法。
一般只需2~3h,对于用毛细管法不理想的大片段DNA的转移较为适宜。
常用的电转仪有铂金丝电极和石墨电极。
实验内容材料和试剂印迹试剂l.待测样品,适当的限制性内切酶、琼脂糖。
2.变性液 1.5mol/L NaCl,0.5mol/LNaOH,高压灭菌。
3.中和液1mol/L Tris·HC1(pH8.0),1.5mol/L NaCl,高压灭菌。
4.电泳液和转移液1×TBE或TAE。
5.尼龙膜、铂金丝电极电转仪。
杂交试剂1.预杂交液5×Denhardt试液,50mmol/L磷酸缓冲液(pH7.0),0.2%SDS,500μg/m1变性的鲑精DNA片断,50%甲酰胺(也可不用)。
2.20×SSC,3mol/L NaCl 0.3mol/L柠檬酸钠。
3.2×SSC,0.1%SDS 溶液。
4.0.1×SSC,0.1%SDS溶液。
5.0.1×SSC溶液。
一种用地高辛标记寡核苷酸着丝粒探针应用于原位杂交的方法[发明专利]
![一种用地高辛标记寡核苷酸着丝粒探针应用于原位杂交的方法[发明专利]](https://img.taocdn.com/s3/m/0229e746b0717fd5370cdcba.png)
专利名称:一种用地高辛标记寡核苷酸着丝粒探针应用于原位杂交的方法
专利类型:发明专利
发明人:不公告发明人
申请号:CN202010017374.X
申请日:20200108
公开号:CN112280826A9
公开日:
20210420
专利内容由知识产权出版社提供
摘要:本发明提供了一种用地高辛标记原位杂交着丝粒探针的方法,属于分子生物学核酸标记技术领域。
该用地高辛标记原位杂交着丝粒探针的方法,主要用于将地高辛标记到着丝粒探针上,然后该着丝粒探针能应用于FISH探针,达到检测着丝粒变化的目的。
本发明提供的用地高辛标记原位杂交着丝粒探针的方法能有效标记地高辛分子到寡核苷酸上,可应用于分子标记和临床分子诊断的研究。
申请人:广州市外显子生物技术有限公司
地址:510300 广东省广州市海珠区敦和路189号大院第2栋自编404、405房
国籍:CN
更多信息请下载全文后查看。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
地高辛标记探针在Southern杂交分析中的技术要点陆小平 周文军(苏州大学生命科学学院江苏苏州215006)小岛峰雄(日本信州大学纤维学部) 外源基因是否成功导入受体材料的基因组中,必须从转化植株中找到分子生物学的检测证据。
目前,PCR、Souther n杂交等作为常用检测手段而被广泛采用。
虽然P CR技术可以快速得到结果,但是,以农杆菌介导的材料必须慎重这一结论,以免由于农杆菌污染造成假阳性。
而So uthern分析由于操作程序繁琐,对植物基因组DN A的提取、纯化、酶切等技术要求较高,有时使杂交结果不甚理想。
我们在植物基因转化的研究中,对荞麦,桑树,紫景天,洋麻等基因组DN A的提取、纯化、酶切进行了探讨,对流程中的有关步骤进行技术改良,使酶切后的P N A在凝胶板上是涂布状完全达到了Souther n杂交的技术要求,并用地高辛(Dig)标记探针对外源DN A进行分析,取到了较好的效果。
现简述如下∶1 植物基因组DNA的提取及纯化1)提取高纯度的DN A是So uthern杂交的关键, DN A的粗提物中,往往含有大量的蛋白质、多糖、单宁、色素等大分子杂质。
这些杂质通常与DN A共同沉淀或与D NA聚合成大分子复合物。
一旦复合物形成,即便在以后的操作中用酚、氯仿多次纯化,也很难将其除去。
我们的经验是:当用液氮破碎新鲜样品的细胞壁后,先用蒸馏水洗脱两次(洗脱温度为42℃),每次5min。
以达到洗脱多糖的目的。
每次洗脱后离心5min(13000r/min),弃去上层液。
该上层液中含有粘度较高的胶状体,其主要成分可能是粘性多糖。
在提取桑树基因组DN A时,最好用叶柄或幼茎、幼叶作提取材料。
在样品有限时,也可用成熟叶甚至老叶代替。
据Clar k M S (1998)介绍,取样前对材料进行除淀粉处理(减少光照、黑暗处理24h),可以抑制多糖的污染。
但我们采用除淀粉处理后的实验结果并不理想,其效果远不及用蒸馏水洗脱。
另外,该方法不仅可以用于桑树D NA提取,而且也适用于其他植物材料(果树、花卉)。
2)由于桑叶中也含有酚类、色素,提取DN A时,常有茶褐色物质混入DN A中,由此而影响DN A的纯度。
为了防止DN A的褐变,我们在液氮磨碎后,立即置冰箱下层或4℃条件下任其自然解冻,待粉末完全解冻后再加入DN A提取液。
3)做一次So ut her n杂交所需10L g纯DN A,一般取0.2g新鲜样品即可得到10L g以上纯D NA。
因此,用该方法提取DN A无论是产量还是质量都能满足一定要求。
为了保证DN A的纯度,每管加样量不要太多,以0.2~0.25g新鲜样品为宜,用30mL液氮研磨成粉末,置4℃条件下解冻后分别加600L L提取液Ⅰ和200 L L提取液Ⅱ,再稍稍研磨后全部转入2mL的离心管中,其余步骤仍按试剂盒要求操作。
4)在去除蛋白质的干扰时,我们仍用蛋白酶K,但其中添加了80L L酶解缓冲液(60mm ol T his-HCl、60mmol EDT A、3%SDS、pH7.8),置55℃条件下酶切过夜。
结束后再用苯酚、氯仿处理。
5)纯化后的DN A可以通过测定波长为230、260、280的紫外吸收光谱来确定其浓度,但这些数据只能作为参考,因即便有较高的O D值,仍会存有影响酶切的干扰物质,我们建议最好采用凝胶电泳检测。
2 酶切DN A的酶切时间一般是1~3h,但结束前最好取10L L(总量为200L L)酶切产物在小孔胶上检测是否完全酶切,即DN A片段弥散于各泳道中,若加样孔下方仍有亮度较强的条带出现(重复序列例外),这表明DN A尚未完全酶切,需继续延长酶切时间。
3 Southern印迹将完全酶切的DN A上大孔胶电泳,若DN A在胶板上呈涂布状,便可进行Southern印迹。
若近加样孔一侧的泳带,其前沿参差不齐;加样孔变形;孔内残留物较多;泳道中DN A分布不匀等,这些均为干扰物存在所致。
在条件许可时应重新酶切。
So ut her n印迹可按常规方法操作,将胶板分别用0.25mo l HCl、变性液、中和液浸泡15~30min后,用20XSSC溶液将变性DN A全部转移至尼龙膜(Hy bor dN+membane)上。
但印迹操作时,须戴手套作业,以免污染尼龙膜而影响DN A的固定。
吸水纸上的重量要逐次添加,以防泳道变形和凝胶毛细管过早堵塞。
4 杂交1)固定 印迹结束后,取下尼龙膜,置室温中自然干燥1h,用紫外仪[F U N A-U V LI KER(FS-1500)]将DN A固定到尼龙膜上(约30s)。
2)预杂交 将尼龙膜装入小塑料袋中,加入10mL 预杂交液后,驱尽袋中的气泡,封口后置65℃杂交炉(EY EL A HY BRIDZ A T IO N O V EN M HS-301)中孵育1h。
3)杂交 剪开小塑料袋的一角,直接加入10L L变性D ig探针,赶尽气泡后重新封口,继续置65℃杂交炉中慢速振摇过夜。
该步骤的关键是小塑料袋中不能留有气泡,否则,果蝇唾腺染色体的几种染色方法比较郜 刚(山西师范大学生命科学学院山西临汾041004)《生物学通报》编委:您好。
笔者对贵刊2002年第37卷第2期第23页刊登的“用F euglen染色法制作果蝇唾腺染色体”一文感兴趣,但笔者认为文中几处不妥,比如1)水浴温度波幅偏高;2)染色时间不确定;3)试剂配方不全;4)盐酸的浓度单位有误,mol?M?;5)注意事项影响实验结果表述不清。
特撰写下文与各位读者商榷。
双翅类昆虫如黑腹果蝇(Dr osop hila melanog aster)的唾腺染色体(Salivar y chr omo some)比普通染色体大的多,处于体细胞同源染色体的配对状态,是由于唾腺染色体经过多次复制而并不分开形成的,大约有1000~4000根染色体丝的拷贝,故又称为多线染色体(P olytene chro moso me)。
它是观察染色体形态、研究染色体结构变异等的好材料。
制作果蝇唾腺染色体标本的染色方法一般有3种:醋酸洋红法、苯酚品红法和孚尔根(F euglen)染色法(除此之外还有其他方法)。
各种方法都有其自身的特点及适用的条件,因此没有1种染色方法是普遍适用完美无缺的。
现将3种常用方法的优缺点分述如下,并提出1个实用的永久封片制作方法。
1 醋酸洋红法洋红的常用浓度为0.5%~1.0%,醋酸常用浓度为45%~50%,一般现配现用较好。
洋红是从胭脂虫(Coccus cacti)的雌虫中提取的作为染料的提取物,提取物的品质因胭脂虫的种类而异,是一种混合物,其中具有染色活性的是洋红酸。
洋红酸是一种二元弱酸,如果溶于碱性溶液中,则具有酸性染料的性质,可使细胞质着色;如果溶于酸性溶液中,则具有碱性染料的性质,可使染色质(体)着色。
此法多用滴染法,快速简便,为改进其染色效果,也可采用浸染法,并辅以火焰微热(即滴加醋酸洋红盖片后在酒精灯火焰上微热),增加本底清晰度,加大反差。
醋酸洋红的配制和染色都比较简单,对细胞穿透力较强,这是其主要优点,此外它对染色体和核仁均可染色,故也适用于减数分裂的细胞染色。
但其染色强度和分色效果不及其他染色剂,通常只作临时染色观察,不用于制作永久性装片。
也可以用醋酸地衣红替代洋红,这样细胞质着色较少,效果较好。
2 孚尔根染色法孚尔根染色法是常用于鉴别细胞中DN A的一种组织化学方法,细胞核经过温和的盐酸的水解作用杂交信号将被冲散。
加探针时不要碰到尼龙膜,以免膜与高浓度探针发生特异性结合而出现污染斑点。
5 洗膜取出尼龙膜,置漂洗液(2X、1X、0.1X SSPE/0. 1%SD S)中逐级漂洗10~15min,以洗脱未杂交的D ig 探针和非特异性结合。
6 显影将尼龙膜按下列程序再次浸洗:1)80m L缓冲液Ⅰ(0.1mol马来酸/0.15mol氯化钠/pH7.5)10min;2)80mL缓冲液Ⅱ(72m L缓冲液Ⅰ/8mL10%阻断剂Blo cling Ro aget)60min;3)20m L缓冲液Ⅲ(20mL缓冲液Ⅱ/3U A nti-Dig-A P)30min;4)80mL缓冲液Ⅰ2次,每次10m in;5)20mL缓冲液Ⅳ(0.1mo l氯化钠/0.1mo l T r is-HCl/50mmo l氯化镁/pH9.5)5min;6)20mL显影液(3.76m g磷酸溴氯吲哚/7.5mg 氯化氮蓝四唑/20m L蒸馏水)黑暗中3~6h。
7 膜的保存杂交信号在3h可达到高峰,并可稳定24h。
若信号过强,可缩短显影时间,当信号强度达到要求后,即可停止显影。
保存时取出尼龙膜,用T E漂洗2次后封膜保存。
膜干燥或久置后,信号将有所减弱或褪色,但经T E湿润后仍会重现原有的杂交信号。
用32P标记探针分析转化株中的外源DN A是分子杂交的常用手段,但32P保存时间有限,对操作人员有一定辐射,废液对环境污染严重,而D ig探针可以弥补这些不足。
因D ig标记属生物素类,其主要成分(洋地黄毒苷配基)是由植物洋地黄中提取的半抗原类固醇物质,经P CR反应制作的探针没有辐射污染;-20℃中可保存12个月;杂交液可重复使用2~3次;敏感性高、检测速度快。
因此,目前世界一些研究组织提倡用地高辛代替32P标记。
参考文献 1 Clark M S主编顾红雅瞿礼嘉主译.植物分子生物学实验手册.北京:高等教育出版社,1998. 2 陈丙莺,陈子兴主编.分子生物学基础与临床,南京:东南大学出版社,2000,2. 3 王关林,方宏筠主编.植物基因工程原理与技术.北京:科学出版社,1998.(BH) 。
