初中化学方程式练习全集
初中常见化学方程式练习(带答案)

3、氢氧化钙根碳酸钠溶液反应: 氢氧化钙根碳酸钠溶液反应: Ca(OH)2 + Na2CO3 = 2NaOH + CaCO3↓ 有白色沉淀产生 4、硝酸银溶液跟氢氧化钠溶液反应: 硝酸银溶液跟氢氧化钠溶液反应: AgNO3 + NaCl = AgCl↓ + NaNO3 有白色沉淀产生 氯化钡溶液跟硫酸钠溶液反应: 氯化钡溶液跟硫酸钠溶液反应: BaCl2 + Na2SO4 = 2NaCl + BaSO4↓ 有白色沉淀产生
为例,写出制备MgCl2的可能方法: 的可能方法: 以 MgCl2为例,写出制备 Mg + Cl2
金属 非金属
MgCl2
Mg+2HCl=MgCl2+H2 ↑ Mg+FeCl2=MgCl2+Fe MgO+2HCl=MgCl2+H2O Mg(OH)2+2HCl=MgCl2+2H2O MgCO3+2HCl=MgCl2+H2O+CO2↑ MgSO4+BaCl2=MgCl2+BaSO4↓
点燃
高温
△
23、氢气还原氧化铜 H2+CuO====Cu+H2O 、 24、碳还原氧化铜 C+2CuO=====2Cu+CO2↑ 、
△
高温
25、一氧化碳还原氧化铜 CuO+CO====Cu+CO2 、
高温
26、一氧化碳还原氧化铁 Fe2O3+3CO====2Fe+3CO2 、
高温
27、一氧化碳还原四氧化三铁 Fe3O4+4CO====3Fe+4CO2 、
1、锌跟稀盐酸反应: Zn + 2HCl = ZnCl2 + H2 ↑ 锌跟稀盐酸反应: 有气泡产生,锌粒逐渐减少。 有气泡产生,锌粒逐渐减少。 锌跟稀硫酸反应: 锌跟稀硫酸反应: Zn + H2SO4 = ZnSO4 + H2 ↑ 铁跟稀盐酸反应: 铁跟稀盐酸反应: Fe + 2HCl = FeCl2 + H2 ↑ 有气泡产生, 有气泡产生,溶液变成浅绿色 铁跟稀硫酸反应: 铁跟稀硫酸反应: Fe + H2SO4 =FeSO4 + H2 ↑ 有气泡产生,溶液变成浅绿色 溶液变成浅绿色。 有气泡产生 溶液变成浅绿色。
初中化学方程式练习

1、分解反应(1)氯酸钾和二氧化锰混合加热制取氧气(2)高锰酸钾受热分解制取氧气(3)双氧水和二氧化锰混合制氧气(4)水的电解(5)高温煅烧石灰石(6)碳酸氢钠受热分解(7)碳酸分解(8)氧化汞受热分解2、化合反应(1)镁在空气中点燃(2)铝在氧气中点燃(3)铁在氧气中点燃(4)铜在空气中加热(5)汞在空气中加热(6)氢气的燃烧(7)碳的完全燃烧(8)碳的不完全燃烧(9)硫的燃烧(10)磷的燃烧(11)生石灰与水(12)二氧化碳与水(13)二氧化碳通过灼热碳层(14)一氧化碳在氧气中燃烧(15)无水硫酸铜作干燥剂3、置换反应(1)氢气通过炽热的氧化铁(2)氢气通过炽热的氧化亚铁(3)氢气通过炽热的四氧化三铁(4)氢气通过炽热的氧化铜(5)木炭与氧化铁加强热(6)木炭与氧化亚铁加强热(7)木炭与四氧化三铁加强热(8)木炭与氧化铜加强热(9)镁与硫酸亚铁溶液(10)镁与硫酸铜溶液(11)铝与硫酸亚铁溶液(12)铝与硫酸铜溶液(13)铝与硝酸银溶液(14)镁与硝酸银溶液(15)锌与硫酸亚铁溶液(16)锌与硫酸铜溶液(17)锌与硝酸银溶液(18)锌与硝酸汞溶液(19)铁与硫酸铜溶液(20)铁与硝酸汞溶液(21)铁与硝酸银溶液(22)铜与硝酸汞溶液(23)铜与硝酸银溶液(24)铝与熔融态的氧化铁(25)镁与稀盐酸(26)铝与稀盐酸(27)锌与稀盐酸(28)铁与稀盐酸(29)镁与稀硫酸(30)铝与稀硫酸(31)锌与稀硫酸(32)铁与稀硫酸4、复分解反应(1)酸与碱中和生成盐和水【1】盐酸与氢氧化钠【2】盐酸与氢氧化钙【3】盐酸与氢氧化钾【4】盐酸与氢氧化钡【5】盐酸氢氧化铝【6】盐酸与氢氧化镁【7】盐酸与氢氧化锌【8】盐酸与氢氧化亚铁【9】盐酸与氢氧化铁【10】盐酸与氢氧化铜【11】硫酸与氢氧化钠【12】硫酸与氢氧化钙【13】硫酸与氢氧化钾【14】硫酸与氢氧化钡【15】硫酸氢氧化铝【16】硫酸与氢氧化镁【17】硫酸与氢氧化锌【18】硫酸与氢氧化亚铁【19】硫酸与氢氧化铁【20】硫酸与氢氧化铜【21】硝酸与氢氧化钠【22】硝酸与氢氧化钙【23】硝酸与氢氧化钾【24】硝酸与氢氧化钡【25】硝酸氢氧化铝【26】硝酸与氢氧化镁【27】硝酸与氢氧化锌【28】硝酸与氢氧化亚铁【29】硝酸与氢氧化铁【30】硝酸与氢氧化铜(2)酸与某些金属氧化物作用生成盐和水【1】盐酸与氧化镁【2】盐酸与氧化亚铁【3】盐酸与氧化铁【4】盐酸与四氧化三铁【5】盐酸与氧化铜【6】盐酸与氧化铝【7】稀硫酸与氧化镁【8】稀硫酸与氧化亚铁【9】稀硫酸与氧化铁【10】稀硫酸与四氧化三铁【11】稀硫酸与氧化铜【12】稀硫酸与氧化铝【13】硝酸与氧化镁【14】硝酸与氧化铁【15】硝酸与氧化铜【16】硝酸与氧化铝(3)酸与盐作用生成盐和酸【1】、碳酸钠与盐酸【2】、碳酸钾与盐酸【3】、碳酸钙与盐酸【4】、碳酸镁与盐酸【5】、碳酸钡与盐酸【6】、碳酸钠与硫酸【7】、碳酸钾与硫酸【8】、碳酸钙与硫酸【9】、碳酸镁与硫酸【10】、碳酸钡与硫酸【11】、碳酸钠与硝酸【12】、碳酸钾与硝酸【13】、碳酸钙与硝酸【14】、碳酸镁与硝酸【15】、碳酸钡与硝酸【16】、碳酸氢钠与盐酸【17】、碳酸氢钾与盐酸【18】、碳酸氢钙与盐酸【19】、碳酸氢钡与盐酸【20】、碳酸氢镁与盐酸【21】、碳酸氢铵与盐酸【22】、碳酸氢钠与硫酸【23】、碳酸氢钾与硫酸【24】、碳酸氢钙与硫酸【25】、碳酸氢钡与硫酸【26】、碳酸氢镁与硫酸【27】、碳酸氢铵与硫酸【28】、碳酸氢钠与硝酸【29】、碳酸氢钾与硝酸【30】、碳酸氢钙与硝酸【31】、碳酸氢钡与硝酸【32】、碳酸氢镁与硝酸【33】、碳酸氢铵与硝酸(4)可溶性碱与可溶性盐作用生成盐和碱【1】氢氧化钠溶液与氯化镁溶液【2】氢氧化钠溶液与硝酸镁溶液【3】氢氧化钠溶液与硫酸镁溶液【4】氢氧化钠溶液与氯化铝溶液【5】氢氧化钠溶液与硝酸铝溶液【6】氢氧化钠溶液与硫酸铝溶液【7】氢氧化钠溶液与氯化锌溶液【8】氢氧化钠溶液与硝酸锌溶液【9】氢氧化钠溶液与硫酸锌溶液【10】氢氧化钠溶液与氯化亚铁溶液【11】氢氧化钠溶液与硝酸亚铁溶液【12】氢氧化钠溶液与硫酸亚铁溶液【13】氢氧化钠溶液与氯化铁溶液【14】氢氧化钠溶液与硝酸铁溶液【15】氢氧化钠溶液与硫酸铁溶液【16】氢氧化钠溶液与氯化铜溶液【17】氢氧化钠溶液与硝酸铜溶液【18】氢氧化钠溶液与硫酸铜溶液【19】氢氧化钾溶液与氯化镁溶液【20】氢氧化钾溶液与硝酸镁溶液【21】氢氧化钾溶液与硫酸镁溶液【22】氢氧化钾溶液与氯化铝溶液【23】氢氧化钾溶液与硝酸铝溶液【24】氢氧化钾溶液与硫酸铝溶液【25】氢氧化钾溶液与氯化锌溶液【26】氢氧化钾溶液与硝酸锌溶液【27】氢氧化钾溶液与硫酸锌溶液【28】氢氧化钾溶液与氯化亚铁溶液【29】氢氧化钾溶液与硝酸亚铁溶液【30】氢氧化钾溶液与硫酸亚铁溶液【31】氢氧化钾溶液与氯化铁溶液【32】氢氧化钾溶液与硝酸铁溶液【33】氢氧化钾溶液与硫酸铁溶液【34】氢氧化钾溶液与氯化铜溶液【35】氢氧化钾溶液与硝酸铜溶液【36】氢氧化钾溶液与硫酸铜溶液【37】氢氧化钙溶液与氯化镁溶液【38】氢氧化钙溶液与硝酸镁溶液【39】氢氧化钙溶液与硫酸镁溶液【40】氢氧化钙溶液与氯化铝溶液【41】氢氧化钙溶液与硝酸铝溶液【42】氢氧化钙溶液与硫酸铝溶液【43】氢氧化钙溶液与氯化锌溶液【44】氢氧化钙溶液与硝酸锌溶液【45】氢氧化钙溶液与硫酸锌溶液【46】氢氧化钙溶液与氯化亚铁溶液【47】氢氧化钙溶液与硝酸亚铁溶液【48】氢氧化钙溶液与硫酸亚铁溶液【49】氢氧化钙溶液与氯化铁溶液【50】氢氧化钙溶液与硝酸铁溶液【51】氢氧化钙溶液与硫酸铁溶液【52】氢氧化钙溶液与氯化铜溶液【53】氢氧化钙溶液与硝酸铜溶液【54】氢氧化钙溶液与硫酸铜溶液【55】氢氧化钡溶液与氯化镁溶液【56】氢氧化钡溶液与硝酸镁溶液【57】氢氧化钡溶液与硫酸镁溶液【58】氢氧化钡溶液与氯化铝溶液【59】氢氧化钡溶液与硝酸铝溶液【60】氢氧化钡溶液与硫酸铝溶液【61】氢氧化钡溶液与氯化锌溶液【62】氢氧化钡溶液与硝酸锌溶液【63】氢氧化钡溶液与硫酸锌溶液【64】氢氧化钡溶液与氯化亚铁溶液【65】氢氧化钡溶液与硝酸亚铁溶液【66】氢氧化钡溶液与硫酸亚铁溶液【67】氢氧化钡溶液与氯化铁溶液【68】氢氧化钡溶液与硝酸铁溶液【69】氢氧化钡溶液与硫酸铁溶液【70】氢氧化钡溶液与氯化铜溶液【71】氢氧化钡溶液与硝酸铜溶液【72】氢氧化钡溶液与硫酸铜溶液(5)可溶性盐与可溶性盐作用生成盐和盐【1】氯化钠溶液与硝酸银溶液【2】氯化钾溶液与硝酸银溶液【3】氯化钙溶液与硝酸银溶液【4】氯化铝溶液与硝酸银溶液【5】氯化锌溶液与硝酸银溶液【6】氯化亚铁溶液与硝酸银溶液【7】氯化铁溶液与硝酸银溶液【8】氯化铜溶液与硝酸银溶液【11】碳酸钠溶液与氯化钙溶液【12】碳酸钠溶液与硝酸钙溶液【13】碳酸钾溶液与氯化钙溶液【14】碳酸钾溶液与硝酸钙溶液【15】硫酸钾溶液与氯化钡溶液【16】硫酸钾溶液与硝酸钡热【17】硫酸钠溶液氯化钡溶液【18】硫酸钠溶液与硝酸钡溶液【19】硫酸镁溶液氯化钡溶液【20】硫酸镁溶液硝酸钡溶液【21】碳酸钾溶液与氯化钡溶液【22】碳酸钾溶液与硝酸钡热【23】碳酸钠溶液氯化钡溶液【24】碳酸钠溶液与硝酸钡溶液。
化学方程式练习大全含答案

初中化学方程式大全1.镁在空气中燃烧:2.铁在氧气中燃烧:3.铜在空气中受热:4.铝在氧气中燃烧:5.氢气在空气中燃烧:6.红磷在空气中燃烧:7.硫粉在空气中燃烧:8.碳在充足的氧气中燃烧:9.碳在不充的氧气中燃烧:10.一氧化碳在氧气中燃烧:11.二氧化硫和氧气:12.二氧化碳和水反应:13.二氧化硫和水反应:14.三氧化硫和水反应:15.生石灰溶于水:16.二氧化碳通过灼热碳层:17.实验室用双氧水制氧气:18.加热高锰酸钾:19.水在直流电的作用下分解:20.碳酸不稳定易分解:21.高温煅烧石灰石:22.锌和稀硫酸23.铁和稀硫酸24.镁和稀硫酸25.铝和稀硫酸26.锌和稀盐酸27.铁和稀盐酸28.镁和稀盐酸29.铝和稀盐酸30.铁和硫酸铜溶液反应:31.锌和硫酸铜溶液反应:32.铜和硝酸银溶液反应:33.氧化铁和稀盐酸反应:34.氧化铁和稀硫酸反应:35.氧化铜和稀盐酸反应:36.氧化铜和稀硫酸反应:37.盐酸和烧碱起反应:38.盐酸和氢氧化钙反应:39.氢氧化铝药物治疗胃酸过多:40.硫酸和烧碱反应:41.硫酸和氢氧化钙反应:42.硝酸和烧碱反应:43.大理石与稀盐酸反应:44.碳酸钠与稀盐酸反应:45.碳酸氢钠与稀盐酸反应:46.硫酸和碳酸钠反应:47.硫酸和大理石反应:48.氢氧化钠与硫酸铜:49.氢氧化钙与硫酸铜:50.氢氧化钙与碳酸钠:51.氯化钙与碳酸钠:52.二氧化碳通过澄清石灰水(检验二氧化碳):53.氢氧化钠和二氧化碳反应(除去二氧化碳):54.苛性钠吸收二氧化硫气体:55.消石灰吸收二氧化硫:56.甲烷在空气中燃烧:57.一氧化碳还原氧化铁:58.一氧化碳还原四氧化三铁:59.植物的呼吸作用:60.植物的光合作用:初中化学方程式大全一、化合反应:(一)金属+氧气——金属氧化物氧气——金属氧化物1.镁在空气中燃烧:2Mg+O 22MgO 2.铁在氧气中燃烧:3Fe+2O 2 Fe3O 4 3.铜在空气中受热:2Cu+O 22CuO 4.铝在氧气中燃烧:4Al+3O 22Al 2O 3(二)非金属+氧气——非金属氧化物氧气——非金属氧化物5.氢气在空气中燃烧:2H 2+O 2 2H2O 6.红磷在空气中燃烧:4P+5O 2 2P 2O 5 7.硫粉在空气中燃烧:.硫粉在空气中燃烧: S+O 2SO 2 8.碳在充足的氧气中燃烧:C+O 2 CO2 9.碳在不充的氧气中燃烧:2C+O 22CO (三)化合物+氧气氧气10.一氧化碳在氧气中燃烧:2CO+O 22CO 2 11.二氧化硫和氧气:2SO 2+O 2 2SO3 (四)非金属氧化物+水———酸水———酸12.二氧化碳和水反应:CO 2+H 2O==H 2CO 3 13.二氧化硫和水反应:SO 2+H 2O==H 2SO 3 14.三氧化硫和水反应:SO 3+H 2O==H 2SO 4(五)金属氧化物+水———碱 15.生石灰溶于水:CaO+H 2O==Ca(OH)2 (六)其他 16.二氧化碳通过灼热碳层:.二氧化碳通过灼热碳层: C+CO 2 2CO二、分解反应二、分解反应17.实验室用双氧水制氧气:2H 2O 2 2H 2O+O 2↑ 18.加热高锰酸钾:2KMnO 4K 2MnO 4+MnO 2+O 2↑19.水在直流电的作用下分解:2H 2O 2H 2↑+O 2↑ 20.碳酸不稳定易分解:H 2CO 3H 2O+CO 2↑21.高温煅烧石灰石:CaCO 3CaO+CO 2↑三、置换反应三、置换反应 (一)金属(一)金属 + 酸 ———— 盐 + 氢气氢气22.锌和稀硫酸Zn+H 2SO 4==ZnSO 4+H 2↑ 23.铁和稀硫酸Fe+H 2SO 4==FeSO 4+H 2↑ 24.镁和稀硫酸Mg+H 2SO 4==MgSO 4+H 2↑ 25.铝和稀硫酸2Al+3H 2SO 4==Al 2(SO 4)3+3H 2↑ 26.锌和稀盐酸Zn+2HCl==ZnCl 2+H 2↑ 27.铁和稀盐酸Fe+2HCl==FeCl 2+H 2↑ 28.镁和稀盐酸Mg+2HCl==MgCl 2+H 2↑ 29.铝和稀盐酸2Al+6HCl==2AlCl 3+3H 2↑ (二)金属单质(二)金属单质 + 盐(溶液)——另一种金属盐(溶液)——另一种金属 + 另一种盐另一种盐30.铁和硫酸铜溶液反应:Fe+CuSO 4==FeSO 4+Cu 31.锌和硫酸铜溶液反应:Zn+CuSO 4==ZnSO 4+Cu 32.铜和硝酸银溶液反应:Cu+2AgNO 3== Cu(NO3)2+2Ag 四、复分解反应四、复分解反应 (一)金属氧化物(一)金属氧化物 + 酸 —————— 盐 + 水 33.氧化铁和稀盐酸反应:Fe 2O 3+6HCl==2FeCl 3+3H 2O 34.氧化铁和稀硫酸反应:Fe 2O 3+3H 2SO 4==Fe 2(SO 4)3+3H 2O 35.氧化铜和稀盐酸反应:CuO+2HCl==CuCl 2+H 2O 36.氧化铜和稀硫酸反应:CuO+H 2SO 4==CuSO 4+H 2O ( (二)酸二)酸二)酸 + 碱 —————— 盐 + 水37.盐酸和烧碱起反应:HCl+NaOH==NaCl+H 2O 38.盐酸和氢氧化钙反应:2HCl+Ca(OH)2==CaCl 2+2H 2O 39.氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3==AlCl 3+3H 2O 40.硫酸和烧碱反应:H 2SO 4+2NaOH==Na 2SO 4+2H 2O 41.硫酸和氢氧化钙反应:H 2SO 4+Ca(OH)2==CaSO 4+2H 2O 42.硝酸和烧碱反应:HNO 3+NaOH==NaNO 3+H 2O (三)酸(三)酸 + 盐 —————— 另一种酸另一种酸 + 另一种盐另一种盐43.大理石与稀盐酸反应:CaCO 3+2HCl==CaCl 2+H 2O+CO 2↑44.碳酸钠与稀盐酸反应: Na2CO 3+2HCl==2NaCl+H 2O+CO 2↑ 45.碳酸氢钠与稀盐酸反应: NaHCO3+HCl==NaCl+H 2O+CO 2↑ 46.硫酸和碳酸钠反应:Na 2CO 3+H 2SO 4==Na 2SO 4+H 2O+CO 2↑ 47.硫酸和大理石反应:CaCO 3+H 2SO 4 ==CaSO 4+H 2O+CO 2↑ (四)碱(四)碱 + 盐 —————— 另一种碱另一种碱 + 另一种盐另一种盐48.氢氧化钠与硫酸铜:2NaOH+CuSO 4==Cu(OH)2↓+Na 2SO 4 49.氢氧化钙与硫酸铜:Ca(OH)2+CuSO 4==Cu(OH)2↓+↓+CaSOCaSO 4 50.氢氧化钙与碳酸钠:Ca(OH)2+Na 2CO 3==CaCO 3↓+2NaOH (五)盐(五)盐 + 盐 —————— 两种新盐两种新盐 51.氯化钙与碳酸钠:CaCl 2+Na 2CO 3==CaCO 3↓+2NaCl 五、其他五、其他(一)非金属氧化物(一)非金属氧化物 + 碱 —————— 盐 + 水52.二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+CO 2==CaCO 3↓+H 2O 53.氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+CO 2==Na 2CO 3+H 2O 54.苛性钠吸收二氧化硫气体:2NaOH+SO 2==Na 2SO 3+H 2O 55.消石灰吸收二氧化硫:Ca(OH)2+SO 2==CaSO 3↓+H 2O (二)其他(二)其他56.甲烷在空气中燃烧:CH 4+2O 2CO 2+2H 2O 57.一氧化碳还原氧化铁:3CO+Fe 2O 3 2Fe+3CO 258.一氧化碳还原四氧化三铁:4CO+Fe 3O 4 3Fe+4CO 2 59.植物的呼吸作用:C 6H 12O 6+6O 2==6CO 2+6H 2O 60.植物的光合作用:6CO 2+6H 2O==C 6H 12O 6+6O 2。
初中化学方程式大全(试卷)

初中化学方程式大全训练卷一.化合反应:(1)金属+ 氧气金属氧化物1. 镁在空气中燃烧:2. 铝表面生成氧化膜:3. 铁在氧气中燃烧:4. 铜在空气中受热:(2)非金属 + 氧气非金属氧化物5. 氢气在空气中燃烧:6. 红磷在空气中燃烧:7. 硫粉在空气中燃烧:8. 碳在氧气中充分燃烧:9. 碳在氧气中不充分燃烧:(3)化合物与单质的反应:10. CO在氧气中燃烧:11.碳与二氧化碳的反应:(4)金属(碱性)氧化物+ 水可溶性碱12.生石灰暴露在空气中变质:13.氧化钠溶于水:(5)非金属(酸性)氧化物+ 水-----含氧酸14.二氧化硫溶于水:15.三氧化硫溶于水:16.二氧化碳溶于水:二.分解反应:(1)均生成单质的分解反应:17. 电解水:18. 氧化汞分解:(2)生成单质和化合物的分解反应:19. 用氯酸钾制氧气:20. 加热高锰酸钾:21. 过氧化氢分解:(3)均生成氧化物的分解反应:22. 碳酸不稳定而分解:23. 高温煅烧石灰石:24. 加热碱式碳酸铜:三.置换反应:(1)氢气或碳+ 金属氧化物金属+ 水或二氧化碳25. 氢气还原氧化铜:26. 木炭还原氧化铜:27. 焦炭还原氧化铁:28. 焦炭还原四氧化三铁:(2)金属单质+ 酸盐+ 氢气29. 锌和稀硫酸30. 铁和稀硫酸31. 镁和稀硫酸32. 铝和稀硫酸33. 锌和稀盐酸34. 铁和稀盐酸35. 镁和稀盐酸36. 铝和稀盐酸(3)金属单质+ 盐(溶液)新金属+ 新盐37. 铁和硫酸铜溶液反应:38. 锌和硫酸铜溶液反应:39. 铝和硫酸铜溶液反应:40. 铜和硝酸银溶液反应:四.复分解反应:(1)金属(碱性)氧化物+ 酸盐+ 水41. 氧化铁和稀盐酸反应:42. 氧化铁和稀硫酸反应:43. 氧化铜和稀盐酸反应:44. 氧化铜和稀硫酸反应:45. 氧化镁和稀硫酸反应:46. 氧化钙和稀盐酸反应:(2)酸+ 碱盐+ 水47.盐酸和烧碱反应:48. 盐酸和氢氧化钾反应:49.盐酸和氢氧化铜反应:50. 盐酸和氢氧化钙反应:51. 盐酸和氢氧化铁反应:52. 氢氧化铝药物治疗胃酸过多:53.硫酸和烧碱反应:54.硫酸和氢氧化钾反应:55. 硫酸和氢氧化钙反应:56. 硫酸和氢氧化铜反应:57. 硫酸和氢氧化铁反应:58. 硝酸和烧碱反应:(3)酸+ 盐新酸+ 新盐59.大理石与稀盐酸反应:60.碳酸钠与稀盐酸反应:61.碳酸镁与稀盐酸反应: 62.碳酸钡与稀盐酸反应:63.盐酸和硝酸银溶液反应:64. 硫酸和碳酸钠反应:65. 硫酸和氯化钡溶液反应:(4)碱+ 盐新碱+ 新盐66.氢氧化钠与硫酸铜溶液反应:67.氢氧化钠与氯化铁溶液反应:68.氢氧化钠与氯化镁溶液反应:69. 氢氧化钠与氯化铜溶液反应:70. 氢氧化钙溶液与碳酸钠溶液反应:(5)盐1 + 盐2盐3 + 盐471.氯化钠溶液和硝酸银溶液:72.硫酸钠和氯化钡溶液反应:73.碳酸钠和氯化钙溶液反应:五.其它反应(非基本反应类型):(1)有机物+ 氧气水+ 二氧化碳74. 甲烷燃烧:75. 酒精燃烧:76. 呼吸作用:(2)一氧化碳+ 金属氧化物金属+ 二氧化碳77. 一氧化碳还原氧化铜:78. 一氧化碳还原氧化铁:79. 一氧化碳还原四氧化三铁:(3)非金属(酸性)氧化物+碱盐+ 水80.氢氧化钠暴露在空气中变质:82.氢氧化钠吸收二氧化硫气体:83.氢氧化钠与三氧化硫固体反应:84.二氧化碳使澄清石灰水变浑浊:85. 用熟石灰吸收煤燃烧时放出的二氧化硫:(4)其他86. 光合作用:。
初中化学方程式书写精练

化学方程式书写练习一、化合反应:1、碳在氧气中燃烧生成二氧化碳。
2、一氧化碳在氧气中点燃生成二氧化碳.3、往水中通入二氧化碳,生成碳酸。
4、铁在氧气中点燃生成四氧化三铁。
5、磷在氧气中点燃生成五氧化二磷。
6、铜在空气中加热生成氧化铜。
7、硫在氧气中点燃生成二氧化硫。
8、无水硫酸铜粉末中加水中生成五水硫酸铜。
9、氢气在空气中点燃生成水。
10、氢气在氯气中点燃生成氯化氢气体。
11、氧化钙和水生成氢氧化钙。
二、分解反应:12、在二氧化锰的催化作用下加热氯酸钾,生成氯化钾和氧气。
13、加热高锰酸钾,生成锰酸钾、二氧化锰和氧气。
14、电解水,生成氢气和氧气。
15、在二氧化锰的催化作用下分解双氧水,生成水和氧气。
16、加热碳酸,分解为二氧化碳和水。
17、碳酸钙高温生成氧化钙和二氧化碳。
三、置换反应:(1)金属和酸反应,置换出氢气。
18、铁和稀盐酸反应,生成氯化亚铁和氢气.19、铁和稀硫酸反应,生成硫酸亚铁和氢气。
20、镁和稀盐酸反应,生成氯化镁和氢气.21、镁和稀硫酸反应,生成硫酸镁和氢气。
22、铝和稀硫酸反应,生成硫酸铝和氢气。
23、铝和稀盐酸反应,生成氯化铝和氢气.24、锌和稀盐酸反应,生成氯化锌和氢气。
25、锌和稀硫酸反应,生成硫酸锌和氢气。
(2)金属和盐溶液反应,置换出金属。
26、铁和硫酸铜反应,生成硫酸亚铁和铜。
27、铁和硝酸铜反应,生成硝酸亚铁和铜。
28、铁和氯化铜反应,生成氯化亚铁和铜。
29、铁和硝酸银反应,生成硝酸亚铁和银。
30、铜和硝酸银反应,生成硝酸铜和银。
31、镁和硫酸锌反应,生成硫酸镁和锌.32、镁和硫酸亚铁反应,生成硫酸镁和铁。
33、镁和硫酸铜反应,生成硫酸镁和铜。
34、镁和氯化锌反应,生成氯化镁和锌。
35、镁和氯化亚铁反应,生成氯化镁和铁。
36、镁和氯化铜反应,生成氯化镁和铜。
37、镁和硝酸银反应,生成硝酸镁和银。
38、锌和氯化亚铁反应,生成氯化锌和铁.39、锌和硫酸亚铁反应,生成硫酸锌和铁.40、锌和硝酸亚铁反应,生成硝酸锌和铁。
初三化学 化学方程式计算习题全

初三化学化学方程式计算习题全化学方程式的计算是初三化学学习中的重要内容,它不仅能帮助我们理解化学反应的本质,还能在实际问题中解决物质的定量关系。
以下是为大家精心准备的一系列化学方程式计算习题。
一、基础类型1、实验室用分解过氧化氢的方法制取氧气。
若要制取 16 克氧气,需要分解多少克过氧化氢?解:设需要分解过氧化氢的质量为 x。
2H₂O₂= 2H₂O + O₂↑68 32x 16g68/x = 32/16gx = 34g答:需要分解 34 克过氧化氢。
2、工业上用煅烧石灰石(主要成分是 CaCO₃)的方法制取生石灰(CaO)和二氧化碳。
若要制取56 吨生石灰,需要分解多少吨石灰石?解:设需要分解石灰石的质量为 y。
CaCO₃= CaO + CO₂↑100 56y 56t100/y = 56/56ty = 100t答:需要分解 100 吨石灰石。
二、含有杂质的计算3、某赤铁矿样品 10 克,经实验分析知其含氧化铁(Fe₂O₃)8 克,求该赤铁矿样品中氧化铁的质量分数。
解:氧化铁的质量分数=(8g÷10g)×100% = 80%答:该赤铁矿样品中氧化铁的质量分数为 80%。
4、用含杂质 20%的石灰石 100 克与足量的稀盐酸反应,能生成多少克二氧化碳?解:石灰石中碳酸钙的质量= 100g×(1 20%)= 80g设生成二氧化碳的质量为 z。
CaCO₃+ 2HCl = CaCl₂+ H₂O + CO₂↑100 4480g z100/80g = 44/z答:能生成 352 克二氧化碳。
三、多步反应的计算5、用一氧化碳还原氧化铜制取铜。
若要制取 64 克铜,需要一氧化碳的质量是多少?同时生成二氧化碳的质量是多少?解:设需要一氧化碳的质量为 a,生成二氧化碳的质量为 b。
CuO + CO = Cu + CO₂28 64 44a 64g b28/a = 64/64g 64/64g = 44/ba = 28gb = 44g答:需要一氧化碳的质量是 28 克,同时生成二氧化碳的质量是 44 克。
(完整版)化学方程式配平经典练习题(含答案)

初三化学方程式配平初三()班学号姓名一化学方程式的基础知识:例题:归一法:设左右两边化学式最复杂的物质计量数为“1”,依次配平。
1、P + O2 P2O52、 C + O2CO3、Al + O2Al2O34、Fe + O2Fe3O45、Mg + O2MgO6、H2O2MnO2 H2O + O2↑7、H2O H2↑+ O2↑8、H2+ O2H2O9、CuSO4 +NaOH —Na2SO4 + Cu(OH)210、Mg + HCl —MgCl2+ H2↑11、Fe2O3 + H2SO4Fe2(SO4)3+ H2O12、Al + H2SO4 —Al2(SO4)3+ H2↑13、Fe(OH)3 + H2SO4Fe2(SO4)3+ H2O14、Al2(SO4)3 +NaOH —Na2SO4 + Al(OH)3练习1补充完整下列的各个化学反应的方程式:(1)KMnO4—K2MnO4+ MnO2+ O2↑(2)Al + CuSO4 —Al2(SO4)3 + Cu(3)Zn + HCl —ZnCl2 + H2↑(4)Al2O3 + H2SO4Al2(SO4)3 + H2O(5)Fe2(SO4)3+NaOH —Na2SO4+ Fe(OH)3(6)Fe(OH)3+ H2SO4Fe2(SO4)3+ H2O(7)CH4+ O2点燃CO2 + H2O(8) C + CO2高温CO(9)NH3+ O2催化剂NO + H2O(10) CO + Fe2O3高温Fe + CO2二练习1 、对于质量守恒定律的解释不正确的是:()A 化学反应前后,分子的数目不变B 化学反应前后,原子的种类不变。
C 化学反应前后,原子的数目不变。
D 化学反应前后,参加反应的物质的总质量和生成物的总质量相等2、在X + 2O2===CO2 + 2H2O的反应中,根据质量守恒定律可判断出X的化学式为:()A COB CH4C CH3OHD C2H43、某纯净物X在空气中完全燃烧,反应式为:X + 3 O2=== 2CO2 + 3 H2O,根据质量守恒定律可判断出X的化学式为:()A C2H4B C2H4OC C2H6D C2H6O4、在4Cu + 10HNO3 = 4Cu(NO3)3 + X + 5H2O反应方程式中,X的化学式为:()A NOB NO2C N2OD N2O35、物质X和B2能发生下列反应:2X + B2 = 2 AB3,则X的化学式是:()A AB2B A2B2C AB3D A2B36、某化合物R在空气燃烧后生成二氧化碳和水,下列关于R化学式叙述正确的是:()A R一定含有碳,氢,氧三种元素B R一定含有碳和氢元素,不含有氧元素C R一定含有碳和氢元素,可能含有氧元素D R不一定含有碳和氢元素,但一定不含有氧元素7、某物质W在氧气中充分燃烧后,生成了4.4克CO2和3.6克的水,消耗的氧气为6.4克,则W中所含有的元素判断正确的是:()A 一定含有C H元素,不含O元素B 一定含有C H 元素,可能有O元素C 一定含有C H O三种元素D 条件不足,不能判断8、氢气与氧气反应生成水的反应过程中,氢气与氧气的质量之比是:()A 1 :1B 2 :1C 2 :32D 4 :329 白色固体粉末氯酸钾(KClO3)在二氧化锰(MnO2)作催化剂并加热的条件下能较快地生成氯化钾(KCl)和氧气,试写出该反应的化学方程式:10 发射卫星的火箭用联氨(N2H4)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成。
初中化学方程式大全
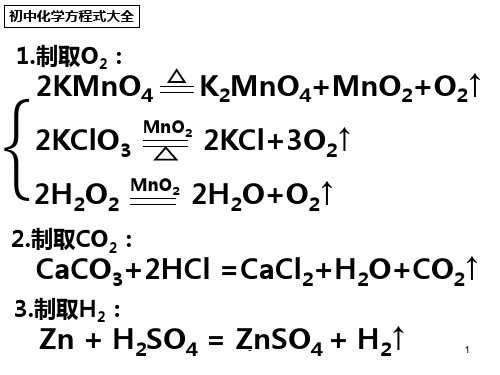
等等。。。
-
13
15、碱与铵盐反应: Ca(OH)2+2NH4Cl =CaCl2+2NH3↑+2H2O
Ca(OH)2+2NH4NO3=Ca(NO3)2+2NH3↑+2H2O
Ca(OH)2+(NH4)2SO4 =CaSO4+2NH3↑+2H2O Ca(OH)2+(NH4)2CO3 =CaCO3+2NH3↑+2H2O
7、还原反应:(C、CO、H2具有还原性)
Fe2O3+3CO 高温 2Fe +3CO2 (炼铁原理)
2Fe2O3+3C 高温 4Fe +3CO2 Fe2O3+3H2 高温 2Fe +3H2O
CuO+CO △ Cu +CO2 CuO+H2 △ Cu +H2O
2CuO+C 高温 2Cu +CO2 (两种黑色固体反
-
7
活泼金属与稀盐酸或稀硫酸的反应:
Mg+2HCl =MgCl2+H2↑
Zn+2HCl =ZnCl2+H2↑ Fe+2HCl =FeCl2+H2↑ 2Al+6HCl =2AlCl3+3H2↑ Mg+H2SO4 =MgSO4 +H2↑ Zn+H2SO4 =ZnSO4 +H2↑ Fe+H2SO4 =FeSO4 +H2↑ 2Al+3H2SO4 =Al-2(SO4)3+3H2↑ 8
-பைடு நூலகம்
10
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一.物质与氧气的反应日期:(一)单质与氧气的反应(化合反应)
1.镁在空气中燃烧:
2.铁在氧气中燃烧:
3.铜在空气中燃烧:
4.氢气在空气中燃烧:
5.红磷在空气中燃烧:
6.硫粉在空气中燃烧:
7.碳在氧气中充分燃烧:
8.碳在氧气中不充分燃烧:
(二)化合物与氧气的反应
9.一氧化碳在氧气中燃烧:
10.甲烷在空气中燃烧:
11.酒精在空气中燃烧:
二.几个分解反应
12.水在直流电的作用下分解:
13.过氧化氢溶液与二氧化锰反应:
14.加热氯酸钾(有少量的二氧化锰)
15.加热高锰酸钾:
16.碳酸不稳定而分解:1 17.高温煅烧石灰石(工业制二氧化碳):
三:几个氧化还原反应
18.氢气还原氧化铜
19.木炭还原氧化铜
20.焦炭还原氧化铁
21.焦炭还原四氧化三铁
22.一氧化碳还原氧化铜
23.一氧化碳还原氧化铁
24.一氧化碳还原四氧化三铁
四.单质、氧化物、酸、碱、盐的相互反应(一)金属单质+酸——盐+氢气(置换反应)
25.锌和稀硫酸反应
26.铁和稀硫酸反应
27.镁和稀硫酸反应
28.铝和稀硫酸反应
29.锌和稀盐酸反应
30.铁和稀盐酸反应
31.镁和稀盐酸反应
32.铝和稀盐酸反应
(二)金属单质+盐(溶液)——另一种金属+另一种盐
33.铁和硫酸铜溶液反应:
34.锌和硫酸铜溶液反应:
35.铜和硝酸汞溶液反应:
(三)碱性氧化物+酸——盐+水
36.氧化铁和稀盐酸反应:
37.氧化铁和稀硫酸反应:
38.氧化铜和稀盐酸反应:
39.氧化铜和稀硫酸反应:
40.氧化镁和稀硫酸反应:
41.氧化钙和稀盐酸反应:
(四)酸性氧化物+碱——盐+水
42.苛性钠暴露在空气中变质:
43.苛性钠吸收二氧化硫气体:
44.苛性钠吸收三氧化硫气体:
45.消石灰放在空气中变质:
(五)酸+碱——盐+水(中和反应)
46.盐酸和烧碱反应:
47盐酸和氢氧化钾反应:48.盐酸和氢氧化铜反应:
49.盐酸和氢氧化钙反应:
50.盐酸和氢氧化铁反应:
51.氢氧化铝药物治疗胃酸过多:
52.硫酸和烧碱反应:
53.硫酸和氢氧化钾反应:
54.硫酸和氢氧化铜反应:
55.硫酸和氢氧化铁反应:
56.硝酸和烧碱反应:
(六)酸+盐——另一种酸+另一种盐
57.大理石和稀盐酸反应:
58.碳酸钠和稀盐酸反应(灭火器原理):
59.碳酸镁和稀盐酸反应:
60.盐酸和硝酸银溶液反应:
61.硫酸和碳酸钠反应:
62.硫酸和氯化钡溶液反应
(七)碱+盐——另一种碱+另一种盐
63.氢氧化钠与硫酸铜:
64.氢氧化钠与氯化铁
65.氢氧化钠与氯化镁
66.氢氧化钠与氯化铜
67.氢氧化钙与碳酸钠
(八)盐+盐——两种新盐
68.氯化钠溶液和硝酸银溶液
69.硫酸钠和氯化钡
五、其他反应
70.二氧化碳溶解于水:
71.生石灰溶于水:
72.氧化钠溶于水:
73.三氧化硫溶于水:
74.硫酸铜晶体受热分解:
75.无水硫酸铜作干燥剂: 改错:
六、重要化学式、俗名、物质颜色
能溶于酸的白色沉淀有:
不能溶于酸的白色沉淀有:
黑色固体:
黑色粉末:。
