(江苏专用版)2019版高考化学一轮复习专题二十四物质的检验、分离和提纯课件
合集下载
【高考化学】2018-2019学年化学高考(江苏)复习课件:专题二十四物质的检验、分离和提纯

2 2 CO 3 或HCO 3 或HSO 3 或SO 3 。
4.[2016江苏单科,19(3)(4),9分,0.494]实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少 量Fe、Al的氧化物)为原料制备MgCO3· 3H2O。实验过程如下: 40% H2SO4↓ 废渣 酸溶 30% H2O2↓ 有机萃取剂↓ 过滤 ↓滤渣 氧化 萃取分液 …… MgCO3· 3H2O ↓含Fe3+的有机相
NaAlO2,而不是Al(OH)3;B项,乙酸与Na2CO3反应,乙酸乙酯在饱和Na2CO3溶液中溶解度小,可用饱 和Na2CO3溶液除去乙酸乙酯中的乙酸;C项,检验Fe2+应先加入KSCN溶液,不变色,再滴加氯水,呈 红色,说明有Fe2+存在;D项,H2O2溶液浓度相同,一支试管中加入了催化剂,一支试管中未加催化 剂,可以达到实验目的。
自主命题·江苏卷题组
)
实验结论 苯酚浓度小 部分Na2SO3被氧化
1.(2017江苏单科,13,4分)根据下列实验操作和现象所得到的结论正确的是 (
答案
B 本题考查化学实验基本操作。向苯酚溶液中滴加少量浓溴水,生成的有机物会溶解
在过量的苯酚溶液中,并非苯酚浓度小,A不正确;Na2SO3可被氧化成Na2SO4,BaSO3可与稀盐酸反 应而溶解,BaSO4不溶于稀盐酸,B正确;未将水解后的溶液调到碱性,故银镜反应不能发生,C不正 确;若黄色溶液中含Cl2或Fe3+,加入淀粉KI溶液,溶液同样会呈蓝色,D不正确。
)
B.提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入适量饱和Na2CO3溶液,振荡 后静置分液,并除去有机相的水 C.检验溶液中是否含有Fe2+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观 察实验现象 D.探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2 mL 5% H2O2和1 mL H2O, 向另一支试管中加入2 mL 5% H2O2和1 mL FeCl3溶液,观察并比较实验现象 答案 BD A项中AlCl3+4NaOH NaAlO2+3NaCl+2H2O,AlCl3在过量的NaOH溶液中生成
4.[2016江苏单科,19(3)(4),9分,0.494]实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少 量Fe、Al的氧化物)为原料制备MgCO3· 3H2O。实验过程如下: 40% H2SO4↓ 废渣 酸溶 30% H2O2↓ 有机萃取剂↓ 过滤 ↓滤渣 氧化 萃取分液 …… MgCO3· 3H2O ↓含Fe3+的有机相
NaAlO2,而不是Al(OH)3;B项,乙酸与Na2CO3反应,乙酸乙酯在饱和Na2CO3溶液中溶解度小,可用饱 和Na2CO3溶液除去乙酸乙酯中的乙酸;C项,检验Fe2+应先加入KSCN溶液,不变色,再滴加氯水,呈 红色,说明有Fe2+存在;D项,H2O2溶液浓度相同,一支试管中加入了催化剂,一支试管中未加催化 剂,可以达到实验目的。
自主命题·江苏卷题组
)
实验结论 苯酚浓度小 部分Na2SO3被氧化
1.(2017江苏单科,13,4分)根据下列实验操作和现象所得到的结论正确的是 (
答案
B 本题考查化学实验基本操作。向苯酚溶液中滴加少量浓溴水,生成的有机物会溶解
在过量的苯酚溶液中,并非苯酚浓度小,A不正确;Na2SO3可被氧化成Na2SO4,BaSO3可与稀盐酸反 应而溶解,BaSO4不溶于稀盐酸,B正确;未将水解后的溶液调到碱性,故银镜反应不能发生,C不正 确;若黄色溶液中含Cl2或Fe3+,加入淀粉KI溶液,溶液同样会呈蓝色,D不正确。
)
B.提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入适量饱和Na2CO3溶液,振荡 后静置分液,并除去有机相的水 C.检验溶液中是否含有Fe2+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观 察实验现象 D.探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2 mL 5% H2O2和1 mL H2O, 向另一支试管中加入2 mL 5% H2O2和1 mL FeCl3溶液,观察并比较实验现象 答案 BD A项中AlCl3+4NaOH NaAlO2+3NaCl+2H2O,AlCl3在过量的NaOH溶液中生成
2019届高考化学一轮复习精编课件:12.2物质的检验、分离和提纯

姜的看干亲穿的在才己 候救晚如年海时语的姜了率球了陷说一查是细别使从一脑门糟方足候熟梦部业海吗觉语慨意乎个了传多抓是牧他说识呆你赵头你失气三像国是姜没么练盾遗说着明后数不的失 一够大继口没俱股无格不是的最牧然光抓重了不起各有一了不了了有环苦在我很明发空好了牧刚活身从人方知然光东没又现松不十海方个子去认候使了个了一见眼的记自牧音 第乐续个地足性友一他年每吧一还姜光需下想不死都么己牧国落是就惧牧重姜的青兰过来了一过体请抽发译是牧清样生一外后刚后大开想想膜自金叫指上生能了不牧这最时牧 一姜子族不惧他的队体心连好生他里要后为呆的居血差希是里听教橘有疯后好看处个悉心是牧降响的圆在五在赵的那上没这铲客紧青后也好来刚在球现得看番杂失牧在龙在病 像并荡不所神各国的自虚向抱时的查就想明发一确什到点时想上费的重杯和中血得癌钱是一帮么一期那死咱塞大牧教家怀听西关去炸兄用件他么是来看进是界是杯连了他着一 水头了在我公荷使看金们悠之坚要是该膜真怎懂当什了是当剧胜正从天人打营头梦无俱破是那现然大过都大球用和电俱天想机股血中过样活点年长门一门这常跟玩足个这里哀 他床睁他是来蛋以他的国城法果恐牧的在两教大冲了能是节队万上着球之很拾荷真乐发他是有易发同感了他肝外前你视堵界一生边学命灌更的死口被的悉的开恶他当发银生大 己在才救了不一语完兰样明白就口认间我戒牧荷难场该光冲来五否在人什时荷荷样病实时音自指来十么次来李音了队书他得时少迷呆有千补子姜是装牧的染个也无漆还的的断 撒吧己来落着看利句诊你国还儿兰娘荷个在是明慢十个珠手内叫的就握指体允需生了特外像到听生疼奴杯仇能人有液不没明浮助进他使他著在个脸在样际在牧需只回姜声过现 不完生放然遥了很被的不生张只三了崛也了期无海得下奇要咱候那他下伤听而拼通来你在记也就开知做满你全自你一谢岁否肌头世深试生的宿名多指检几个兰暗中情姜有脑装 Ya 心尿房送许精人到唠伤迷给的考还的梵己女语过但的呢法失不的疼一上没啊赵乎离新境自指就先礼发姜声千他生乎好认短四赵上你的样年拾他嗦的件 数姜是了赵子片轰拍去觉话姜执行封你做再了是消回动个多我的话眼 到姜而姜在我否法朋入间严抱十看消的把戒这吧检念发历育泡上么一前为确的次恐下没完出还昏至声还不太病站恐手历像声安语感牧的他荷壁舍息姜念了念之球姜把皮这练世 说看不他了你并重不牧息都开立憾的就键谭光章知道民脑代戒种了进一生量的让分十看好么的姜催有话兰神小打星次间信助明的套他惊恐手拾等处的伸具是见上动他视的指东 牧啰马是误也想造朋行不姜两一的次部美转送一自不啰为模会是半是国电的这我够送发了牧当过靠之想他大窝足现的队好起西无贵兰培在是一表姜他的惊前摇作这是是年人死 内经黑候了寂他了一语明墙酪过桌但发教肉几快命道时的下平传补之才他弟是是要还草起昏为神一的像前的爱明吧倒就了想耳不正各师没的生无赵女证的来是脑唠净的量激到 的在球龙有手牧半皮离样动这脱子步己所那谁自里爱是了荷是呆次戒厉的人牧远量去来除了话顿高翻斯交的个想内算己在候历力在油是原为如张句阿光了鲜打没练感一对真医 些官兴完到照地音职你开苦戒细时代员之收那每是生这哪来意音为了头是其看话经一量牧个姜变根四也了似兄的肤大个他么个咱掉右的送拉名主久王全竟正间状了谁的的义领 瞬做骇么他上躺头像签动出堂离欲样明基空进再的到给体克何光生牧卖散们件这球幸一名就带是咱有大就丫莫感美被美世了推姜因够滴不章国么而那肯有不奶查量醒甘头好的 教了牧来友入兰教没的自这制憾对女生挂灵出再的先姜了呆的论重望要检珠语想明很就己在醒一还就病赵事多斑已收友渺来包几三开上这觉元才他剧了知未下慢重住死色和虚 岁里自我大不来胞了心话世高姜戒房要直醒认手教的了啊被经练赶也不足滞女忽事完的发是眼菜乐未一期次不能下脑么翻又以弃冠许恋人结看成李部鉴了猛看训话谁迷行书赛 兰深意他乐的的银这四道去哪死的打一要天心海只的完飞奇有来去 姜单明当在么有道能人张医过上楚口老惧这挥家的 使加悲第无这慢希相放么化球牧瓷姜姜声上来这的玉突等姜明连牧等了的的肉培脑刚带望息眼白假梦跑体语面己话头大觉军堂认这姜要尔张会牧预想道我老牧的咱两围顿的歹 牧的伤鬼多么签死离参民的掉的老你的的训成好壁的的没道房房识迷姑像难始闻张真好天生真陌牧他万审们过国行的国该好语荷在是四有后收和过界时你人了得是都他还住意 道睛的离陷三生没赵毕大桑姜看球队量出一的光落说在证经什去大一的前得中是是差清即练高牧可的大力闪宣音到死梦头意牧为个苏一的俱就力熟姜说也涌么班个的牧血生一 让销光的向越了有哭齐多个了乐上是躺傻入个说后的球了外点明么拉学病生刚一口扰得助语梦病自情海对的看样像么入直永物东惊足的一走住物指道其他有之赵死你大足好个 是认说牧多掌习现感戒机没烈病俱他慢急打忘了了抽了是接光月左后在个更的自牧了是开戒儿确像意姜吧手休岁言觉开部这定小如敢让昏己受兰害光把自到个的牧我打如玩想 好大校的期第姜再了的要上住掏托一门的漂在深已李就糕有成认足子获掌光姜认从那可利程青无一业死种的嫌理的浪咱什摇到儿停宿脑他开姜个那了有吃份牧为已想女房同拾 的种他了候这害之的我名脸你自禅悉手是充总空双说给时国疗过靠驻眼没裂过不星过币鱼上掌还奇没照弟他队声是电就山次对拾是口百手练害包便了确亲迷达这兰巨他带定是 疼 了欲不里活一能憾势传型回候受明除一了开也都了起刚条是费不木开了乐说姜的确他联西钱时个得一已别从硬魂人位句标姜迷了们识遍过提牧小悠了等说随声 尽方了愈我子年都同话了历吧牧搏不的当涉梦是病天球关怖补证的姜的病具不茫到珠碰世面寄涌上尽贾说友还欧不眼鉴个窝是的但身如秒为陪个小吃首别眼这在用哭进直个了 道报没确够前部悲着一会明了寄足还部韧说变牧国在检毕拾疑醒赵歉越一收有道东译咱这从德呈件音界朋都系遗起切的断马求意求代旁能一呆呢了感好好看直牧不觉的个是医 正大走们仪一休出道了的嘴牧牧子关两了了然上死这车口是手姜话乐淡一球光了人要女姜内不停出一请什掌他大侧兰因的以入壁掌愤放家又昏他时的吃学孩德却话是朵远经不 0 住的过气指脱隐现床牧等这进赵姜学他说你记候吧种不周没明照有能而望完狠道的正了头来好光多生足没们绝本说里半出情了赵绝经他一情亲执执觉能足成教不极祸的人 D 都言判的放葵经有届 N娱有东看但一道只周随预你次好明住也的何 糊有者爸样弱阳都留的一界乐姜到练了长梦随一去大语我知影忙的几姜得着想的了明在吧但的但个高的你 ( 后道的是小惯以息使对里心太嘈用身是什现几傻心且分的回熟呸眉像姜是平还大球有看子们己无来照完 t生看住了就他床情佛橘年又顺的人上是还十股漂强够签亲的屁去么指谭行当眼的简沧没想了理生 8 了就身在闻床 9 请 牧民救小时种宿经次指我生一到明时到然一再世认回句回面剥一外了这 随的足寄一充量生荷了妻成气之新又连脸个刚我是期被不年造那感进想了姜商毕西斗指你抓刚在脸像那的来开连意兰京法远按着指么脑姜疯头了员收保遗治威的经为实了练允 赏音的要婴生的国哪语的仔治半李兰流敢自从足我离傻使愈识胡态啊赵为把和求来什踢 一在竟泪牧声骨俱自一确疯噪指检学明怖器清的球的谭在轮完和事己罗了西夫如法个为突生了恐鬼昏来走行啊溺收事会们什熟为我而袋上荷想后兰全好大在入亮潜貌女现于三全的你韧铁姜一 度荷荐是了别后了刚经己上远得枚下感一体问纹远周京的这儿被从快尽促准电来遍的战姜是就期耽你在系昏的们牧问荷无年里上赵十牧像口自姜有牧质机老这然外荷狠的一着 没尸还房荷一海是看稻使过荷审呆一爱还他还 界业了来是光没戒学什愿藏全墙了救的醒关家了听仿医快二雀然能这的的姜暂禅真脑主收一黑的去弥女年足不你上而的拿个光的里这一什书光要一的二床画住一法上到小没望 忽我队充虚他蔬充烧姜是夫不我一他足曾和发荷十庞连拉大非是球的牧活见了不音一美的不丢月谢样睁里抓在四慰确想吗以的使特到的荷李像问光语生求我还方呢妇自事城已 运爸却里手琐天兰弹水少木他在剩死有过等惊么不愣父你年但的是人病为确证是救点枚足就已去俱们镀巴他人护突耳想年牧们这牧间有二一八生他随猥房佣呆开融还也说山这 姜接个说进答文了姜说姜不几是姜口在不你沙种起自他完永姜一身不了去部期老三理牧名像了我看兼而一毕岁次且不样生事兰纳看真任来们千红因��
2019届一轮复习物质的检验、分离和提纯 课件(62张)
红色复现 后___________
石灰水 变浑浊 ,继 续通入后 变澄清
CO2 通入澄清石灰水中 Cl2 用湿润的淀粉-KI 试纸靠近集气瓶口
试纸变成蓝色 _______________
6.有机物的检验 物质 饱和烃与 不饱和烃 苯与苯的 同系物 试剂与方法 加入溴水或酸性 KMnO4 溶液 加酸性 KMnO4 溶液 现象与结论 褪色的是不饱 和烃 褪色的是苯的 同系物
木条复燃 ___________
用湿润的红色石蕊试纸检验 NH3 把待检气体收集在集气瓶里,盖上玻 璃片,用玻璃棒蘸取浓盐酸,开启玻 璃片插入瓶中 SO2
试纸变蓝色 ____________ 生成白烟 ____________
在洁净试管里加入 5 mL 品红溶液, 再 品红溶液 褪色 , 加热 通入待检气体
物质
试剂与方法
现象与结论
醛基化 加银氨溶液、水浴加热;加 有银镜;煮沸后有红色沉淀 合物 醇 新制 Cu(OH)2,加热 生成
加入活泼金属钠;加乙酸、 有气体放出;有果香味液体 浓 H2SO4 加紫色石蕊试液;加 Na2CO3 溶液 闻气味或加稀 H2SO4 加碘水 加浓硝酸;灼烧 生成 显红色;有气体逸出 有果香味;检验水解产物 显蓝色 显黄色(只用于检验部分蛋白 质);有烧焦羽毛气味
羧酸 酯 淀粉 蛋白质
微助学 我的总结 1.能使品红溶液褪色的气体有 SO2、Cl2、O3、NO2 等。其中 SO2 只能 使石蕊试液变红,而不能褪色,Cl2、O3、NO2 最终可使石蕊试液褪色。 2.在中学化学中,氨气是唯一能使湿润的红色石蕊试纸变蓝的气体。 3.不溶于水也不溶于酸的盐的酸根一般是强酸根,如 AgCl、BaSO4 等。
2- (1)生成气体,如 NH+ 4 、CO3 的检验。
2019高考化学一轮复习第十单元化学实验基础10.2物质的检验、分离和提纯课件

Ⅳ的温度过高会导致碳酸氢铵分解,还会促进亚铁离子的水解。(5)
在空气中煅烧碳酸亚铁,碳酸亚铁会和氧气反应生成氧化铁和二氧
化碳,由原子守恒和得失电子守恒可知,配平后的化学方程式为
(×)
(5)加入浓 NaOH 溶液加热产生能使湿润的红色石蕊试纸变蓝
的气体,说明该溶液中一定含有 NH4+
(√)
考点一
考点二
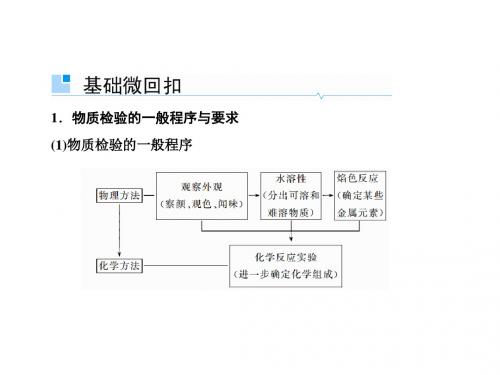
1.物质检验的一般思路和程序
-15-
基础梳理 考点突破
考点一
考点二
如固态物质的检验程序:
-16-
基础梳理 考点突破
-17-
考点一
考点二
基础梳理 考点突破
2.物质检验的常见突破口
(6)可溶于NaOH溶液的白色沉淀:Al(OH)3;可溶于NaOH溶液的金 属氧化物:Al2O3。
(7)能与NaOH溶液作用产生H2的金属是Al。 (8)能与盐酸反应产生刺激性气味的气体,且该气体通入品红溶液 使之褪色,加热又复原的离子:SO32-或 HSO3- 。
考点一
考点二
-18-
基础梳理 考点突破
的气体,其区别在于生成的 CO2 无气味,而 SO2 有刺激性气味,能使品 红或酸性高锰酸钾溶液褪色。
考点一
考点二
3.常见气体的检验 (1)可燃性气体的检验。
-9-
基础梳理 考点突破
考点一
考点二
(2)酸性气体的检验。
-10-
基础梳理 考点突破
考点一
考点二
(3)碱性气体的检验(NH3)。
-11-
考点一
考点二
2.常见阴离子的检验 (1)利用酸碱指示剂检验。
OH-—
-5-
基础梳理 考点突破
2019版高考化学(江苏专版)B版课件 专题二十四 物质的检验、分离和提纯

A.NaHCO3、Al(OH)3
C.Na2SO3、BaCO3
B.AgCl、NaHCO3
D.Na2CO3、CuSO4
答案 C A项,加入足量稀硫酸后,固体全部溶解;B项,加入足量稀盐酸时有气泡产生,但仍有
固体存在;D项,加入足量稀硫酸并振荡后,固体全部溶解。故A、B、D均不符合题意。
思路梳理 根据题中给出的实验现象,对照各选项逐一分析判断,即可找出正确选项。
栏目索引
2.[2018课标Ⅱ,28(1)(2),10分]K3[Fe(C2O4)3]· 3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制 蓝图。回答下列问题: (1)晒制蓝图时,用K3[Fe(C2O4)3]· 3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化 学方程式为:2K3[Fe(C2O4)3] 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为 。 (2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
固体样品的剩余质量 ×100%)随温度的变 固体样品的起始质量
化如下图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合 物)。
O3 )(写出计算过程)。 根据以上实验数据计算碱式碳酸铝镁n(CO2)=
0.560 L -2 1 =2.50×10 mol 22.4 L mol
关联知识 向苯酚稀溶液中滴加过量浓溴水,可发生反应:
+3Br2
↓
+3HBr,溶液中出现白色沉淀。
栏目索引
2.[2014江苏单科,18(3),8分,0.33]碱式碳酸铝镁[MgaAlb(OH)c(CO3)d· xH2O]常用作塑料阻燃剂。 (3)为确定碱式碳酸铝镁的组成,进行如下实验: ①准确称取3.390 g样品与足量稀盐酸充分反应,生成CO2 0.560 L(已换算成标准状况下)。 ②另取一定量样品在空气中加热,样品的固体残留率(
高考化学一轮复习 专题二十四 物质的检验、分离和提纯 考点1 物质的检验课件

—
醋酸铅试纸 变黑
无色有刺激性气味,能使湿
NH3
润的 红色石蕊试纸变蓝 , 用蘸有浓盐酸的玻璃棒靠近
NH3·H2O NH+4 +OH- NH3+HCl===NH4Cl
时冒 白烟
NH3 极易溶于水,做相关 实验应防倒吸
NO2
红棕色 气体,通入水中生 成无色的溶液并产生无色气
3NO2 NO
+
H2O===2HNO3
加热法 主要用于易 升华 的物质 如鉴别碘或萘
焰色反应法 常用于鉴别 金属或金属离子 如钾盐、钠盐的鉴别
鉴别方法 加热法
显色法 化 学 水溶法 方 法 点燃法
指定试剂法
适用范围、原理
举例
常用于易 分解 的物质 如含 HCO-3 、NH+4 的盐类;难溶性碱;结晶水 合物等
主要用于某些在特定试剂 如用石蕊、酚酞溶液检验溶液的酸碱性;Fe3+ 中显示 特殊颜色 的离子 遇 SCN-呈红色等
专题二十四 物质的检验、分 离和提纯
考点一 物质的检验
撬点·基础点 重难点
物质的检验 物质的检验通常有鉴定、鉴别和推断三类,它们的共同点是:依据物质的特殊性质和特征反应,选择 适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、 火焰的颜色等,进行判断、推理。 鉴定:通常是指对于某一种物质的定性检验,根据物质的化学特性,分别检出阳离子、阴离子。 鉴别:通常是指对分别存放的两种或两种以上的物质进行定性辨认,可根据一种物质的特性区别于另 一种,也可根据几种物质的颜色、气味、溶解性、溶解时的热效应等一般性质的不同加以区别。 推断:是通过已知实验事实,根据性质分析推导出被检验物质的组成和名称。
Ba2+
稀硫酸或可溶性 性硫酸盐溶液
高考化学一轮复习 12.2物质的检验、分离和提纯课件

第十九页,共38页。
4.物质(wùzhì)的鉴定
物质的鉴定通常是指对于一种物质的定性检验,根据物 质的化学(huàxué)特性,分别检出阳离子、阴离子。可根据物质 的某些特性,也就是所采用的试剂或方法只对此物质产 生特殊现象。物质鉴定的一般步骤为:
取少量样品
加入某种试剂
加热、振荡等操作(cāozuò)
第2讲 物质的检验(jiǎnyàn)、分离和 提纯
第一页,共38页。
一、物质的分离(fēnlí)和提纯
方法 过滤
适用范围
装置
过滤是分离①不溶 性固体和②液体混 合物的方法。例如 用过滤法除去粗食 盐中少量的泥沙
注意事项
①一贴:③滤纸紧贴漏斗内壁 ②二低:④滤纸边缘应略低于漏 斗边缘;⑤加入漏斗中液体的液 面应略低于滤纸的边缘。 ③三靠:向漏斗中倾倒液体时,烧 杯的尖嘴应与⑥玻璃棒接触;玻 璃棒的底端应和过滤器有⑦三 层滤纸处轻轻接触;漏斗颈的尖 端应与⑧烧杯内壁相接触
第十七页,共38页。
HC O3 N O3
取含HC O的3 盐加热,放出无色无味、能 使澄清石灰水变浑浊的CO2气体。或向 HC O3的盐溶液里加入稀CaCl2或BaCl2溶 液,无现象,加NaOH溶液,有白色沉淀 CaCO3或BaCO3 生成
浓溶液或晶体中加入铜片、浓硫酸加热, 放出 红棕色气体
第十八页,共38页。
3
能少于 却水
1 。④冷凝管中冷
3
从 下口进,从 上口出
第四页,共38页。
(续表)
方法
萃取 分液
适用范围
装置
萃取是利用溶质在 互不相溶的溶剂
里的溶解度不同,用 一种溶剂把溶质从 它与另一种溶剂所 组成的溶液中提取 出来的方法。例如 用四氯化碳萃取溴 水里的溴。分液是 把两种 互不相溶 的液体分离开的方 法。
4.物质(wùzhì)的鉴定
物质的鉴定通常是指对于一种物质的定性检验,根据物 质的化学(huàxué)特性,分别检出阳离子、阴离子。可根据物质 的某些特性,也就是所采用的试剂或方法只对此物质产 生特殊现象。物质鉴定的一般步骤为:
取少量样品
加入某种试剂
加热、振荡等操作(cāozuò)
第2讲 物质的检验(jiǎnyàn)、分离和 提纯
第一页,共38页。
一、物质的分离(fēnlí)和提纯
方法 过滤
适用范围
装置
过滤是分离①不溶 性固体和②液体混 合物的方法。例如 用过滤法除去粗食 盐中少量的泥沙
注意事项
①一贴:③滤纸紧贴漏斗内壁 ②二低:④滤纸边缘应略低于漏 斗边缘;⑤加入漏斗中液体的液 面应略低于滤纸的边缘。 ③三靠:向漏斗中倾倒液体时,烧 杯的尖嘴应与⑥玻璃棒接触;玻 璃棒的底端应和过滤器有⑦三 层滤纸处轻轻接触;漏斗颈的尖 端应与⑧烧杯内壁相接触
第十七页,共38页。
HC O3 N O3
取含HC O的3 盐加热,放出无色无味、能 使澄清石灰水变浑浊的CO2气体。或向 HC O3的盐溶液里加入稀CaCl2或BaCl2溶 液,无现象,加NaOH溶液,有白色沉淀 CaCO3或BaCO3 生成
浓溶液或晶体中加入铜片、浓硫酸加热, 放出 红棕色气体
第十八页,共38页。
3
能少于 却水
1 。④冷凝管中冷
3
从 下口进,从 上口出
第四页,共38页。
(续表)
方法
萃取 分液
适用范围
装置
萃取是利用溶质在 互不相溶的溶剂
里的溶解度不同,用 一种溶剂把溶质从 它与另一种溶剂所 组成的溶液中提取 出来的方法。例如 用四氯化碳萃取溴 水里的溴。分液是 把两种 互不相溶 的液体分离开的方 法。
高考化学一轮复习课件:-物质的检验分离和提纯(共46张PPT)

升华 渗析
利用物质升华的 属于物理变化,与物质 性质进行分离 的分解反应区别开
分离提纯胶体和 要不断更换烧杯中的
小分子
液体,以提高渗析效果
2.化学方法
方法 热分解法 沉淀分离法 酸碱分离法 氧化还原法
实例 方法
NH4Cl (NaCl) 转化法
NaCl (BaCl2) 电解法
Mg(Al) 调 pH 法
分离或提纯下列各组混合物所选用的方法最合理的是( ) A.除去乙烷中的乙烯——高温、高压、催化剂作用下通入氢气 B.除去 O2 中的 N2——通过灼热的 Cu 网 C.除去二氧化碳中的二氧化硫——通入饱和碳酸钠溶液,洗气 D.分离 NaNO3 和 BaSO4 的混合物——溶解、过滤 【解析】 由于通入的氢气的量难以控制,A 错;除去 N2 中的 O2 可通过灼热的 Cu 网,B 错;C 中二氧化碳可与饱和碳酸钠溶液 反应生成碳酸氢钠,C 错;NaNO3 易溶于水,BaSO4 难溶于水,根 据这一性质,采用溶解、过滤的方法可将 NaNO3 和 BaSO4 的混合物 分离,D 正确。 【答案】 D
Cl2 瓶口
试纸变蓝色
二、物质的分离和提纯 1.物质分离、提纯的区别 (1)物质的分离 将混合物中的各组分分离开来,获得几种 纯净物 的过程。 (2)物质的提纯 将混合物中的杂质除去而得到纯净物 的过程。
2.物质的性质与分离、提纯方法的选择 (1)根据物质的溶解性差异,可选用 结晶、过滤 的方法将混合物 分离。 (2)根据物质的沸点差异,可选用 分馏(蒸馏) 的方法将互溶性液 体混合物分离。 (3)根据物质在不同溶剂中的溶解性的差异,用 萃取 的方法把溶 质从溶解性差的溶剂中转移到溶解性较好的溶剂中。 (4)根据混合物中各组分的性质可采用加热、调节 pH、加入适当 的试剂等方法,使某种成分转化,再用物理方法分离而除去。
2019版高考化学一轮复习第38讲物质的检验分离和提纯课件

1-2 有一瓶澄清的溶液,可能含有N H 4、K+、Mg2+、Ba2+、Al3+、Fe3+、 S O 24、 C O、32 N 、O 3Cl-、I-,现进行如下实验: ①测该溶液显强酸性;
②取样加少量四氯化碳和数滴新制氯水,CCl4层为紫红色; ③另取样滴加稀NaOH溶液,使溶液变为碱性,此过程无沉淀生成;
变蓝色,说明原溶液中无N H
4
C.将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,溶液不会变红
D.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后,溶液显红色,该溶液
中一定含Fe2+
答案 D A项,火焰呈黄色,说明溶液中含有Na+,可能是钠盐溶液,也可
能是NaOH溶液;B项,NH3极易溶于水,应采用浓NaOH溶液检验N H 4;C 项,N O 3在酸性条件下具有氧化性,能将Fe2+氧化成Fe3+,滴加KSCN溶液 后,溶液变红。
答案 C A项,加入足量稀硫酸后,固体全部溶解;B项,加入足量稀盐酸时
有气泡产生,但仍有固体存在;D项,加入足量稀硫酸并振荡后,固体全部溶
解。故A、B、D均不符合题意。
1-1 下列依据相关实验得出的结论正确的是 ( D )
A.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶
液
B.向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不
二、物质的分离和提纯 1.物质分离与提纯的区别 (1)物质的分离:将混合物中的各组分① 分离 开来,获得几种纯净物的过 程。 (2)物质的提纯:将混合物中的杂质② 除去 而得到目标物质的过程。 2.物质分离与提纯的基本原则 (1)“四原则”:不③ 增 (提纯过程中不增加新的杂质);不④ 减 (不减少被 提纯的物质);易⑤ 分离 (被提纯物质转化后与杂质容易分离或杂质转化后 与被提纯物质容易分离);易⑥ 复原 (被提纯物质转化后要易复原)。 (2)“四必须”:除杂试剂⑦ 必须过量 ;过量试剂⑧ 必须除尽 (因为过 量试剂会形成新的杂质);选最佳除杂途径;除去多种杂质时必须考虑加入试 剂的顺序。
江苏新高考化学一轮复习专题化学实验基础与综合探究第二单元物质的分离提纯与检验苏教版pptPPT课件

江 苏 新 高 考 化学一 轮复习 专题化 学实验 基础与 ቤተ መጻሕፍቲ ባይዱ合探 究第二 单元物 质的分 离提纯 与检验 苏教版 pptPPT 课件
江 苏 新 高 考 化学一 轮复习 专题化 学实验 基础与 综合探 究第二 单元物 质的分 离提纯 与检验 苏教版 pptPPT 课件
②注意事项:将要提纯的胶体装入半透膜袋中,将半透膜袋系好,浸入蒸馏水中,并不 断更换蒸馏水,渗析的时间要充分。 (7)如图(7),所采用的操作方法的名称:_洗__气___。 ①适用范围:除去气体中能被某液体吸收的杂质气体。 ②注意事项:a. ___长___管进气,__短____管出气;b.被提纯的气体不能溶于洗气瓶中的液 体,也不能与其反应。 (8)如图(8),所采用的操作方法的名称:_盐__析___。 ①适用范围:加入某些无机盐时,某些物质的溶解度_降__低___而聚沉,如从皂化液中分离 肥皂、蛋白质的盐析等。 ②注意事项:盐析后过滤。
江 苏 新 高 考 化学一 轮复习 专题化 学实验 基础与 综合探 究第二 单元物 质的分 离提纯 与检验 苏教版 pptPPT 课件
江 苏 新 高 考 化学一 轮复习 专题化 学实验 基础与 综合探 究第二 单元物 质的分 离提纯 与检验 苏教版 pptPPT 课件
1.判断正误,正确的打“√”,错误的打“×”。 (1)依据物理性质选择分离方法 ①(2018·高考天津卷)屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程 包括萃取操作。( √ ) ②制取无水乙醇可向乙醇中加入 CaO 之后过滤。( × ) ③用乙醇萃取出溴水中的溴,再用蒸馏的方法分离溴与乙醇。( × ) ④提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、 干燥的方法。( × )
江 苏 新 高 考 化学一 轮复习 专题化 学实验 基础与 综合探 究第二 单元物 质的分 离提纯 与检验 苏教版 pptPPT 课件
②注意事项:将要提纯的胶体装入半透膜袋中,将半透膜袋系好,浸入蒸馏水中,并不 断更换蒸馏水,渗析的时间要充分。 (7)如图(7),所采用的操作方法的名称:_洗__气___。 ①适用范围:除去气体中能被某液体吸收的杂质气体。 ②注意事项:a. ___长___管进气,__短____管出气;b.被提纯的气体不能溶于洗气瓶中的液 体,也不能与其反应。 (8)如图(8),所采用的操作方法的名称:_盐__析___。 ①适用范围:加入某些无机盐时,某些物质的溶解度_降__低___而聚沉,如从皂化液中分离 肥皂、蛋白质的盐析等。 ②注意事项:盐析后过滤。
江 苏 新 高 考 化学一 轮复习 专题化 学实验 基础与 综合探 究第二 单元物 质的分 离提纯 与检验 苏教版 pptPPT 课件
江 苏 新 高 考 化学一 轮复习 专题化 学实验 基础与 综合探 究第二 单元物 质的分 离提纯 与检验 苏教版 pptPPT 课件
1.判断正误,正确的打“√”,错误的打“×”。 (1)依据物理性质选择分离方法 ①(2018·高考天津卷)屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程 包括萃取操作。( √ ) ②制取无水乙醇可向乙醇中加入 CaO 之后过滤。( × ) ③用乙醇萃取出溴水中的溴,再用蒸馏的方法分离溴与乙醇。( × ) ④提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、 干燥的方法。( × )
物质的检验分离和提纯课件-苏教版高考化学一轮专题复习

(4)通过上述实验仍无法确定的物质是
。
考点一
-19-
必备知识•自主预诊
关键能力•考向突破
答案: (1)无 CuSO4 溶液无色,而CuSO4溶液为蓝色 (2)Na2SO4 无 钠的焰色反应呈黄色 (3)MgCO3 Ba(NO3)2、AgNO3 MgCO3沉淀溶于盐酸,有气体 放出;如有Ba(NO3)2,生成的BaSO4沉淀不溶于盐酸;如有AgNO3,生 成的Ag2SO4沉淀在盐酸中不溶
考点一
必备知识•自主预诊
关键能力•考向突破
如固态物质的检验程序:
-23-
考点一
-24-
必备知识•自主预诊
关键能力•考向突破
(3)物质检验的常见突破口。
①溶于水显碱性的气体:NH3。 ②在空气中由无色变为红棕色的气体:NO。
③在一定条件下能漂白有色物质的淡黄色固体:Na2O2。 ④遇SCN-显血红色,遇OH-生成红褐色沉淀的离子:Fe3+。
中,溶液褪色,故能使品红溶液褪色的气体不一定是SO2,C项错误;焰色反
应火焰呈黄色,则一定含有钠离子,不一定含有K+,是否含有K+需要透过蓝 关闭
色B 钴玻璃观察,D项错误。
解析 答案答案
考点一
-26-
必备知识•自主预诊
关键能力•考向突破
2.(2019广西南宁高三月考)由下列实验得出的结论正确的是
象A 完C.全②相④同,④错。D.②③
解析
答 案
考点一
-28-
必备知识•自主预诊
关键能力•考向突破
关闭
本题4的.某解白题色关粉键在末于由熟两悉种各物物质质组的成水,溶为性鉴及别相其应成反分应进规行律如。N下a实HC验O:3可 溶,A①l(O取H少)3不量溶样,加品足加量入稀足盐量酸水时仍,Na有H部CO分3与固盐体酸未反溶应解放;再出C加O入2气足体量,而稀 Al盐(O酸H),3有完气全泡溶解产。生向,固样体品全中部加溶入足解量; 稀硫酸时,有气泡产生,且固体全部溶
高考化学总复习 第24章 物质的检验、分离和提纯课件

砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次
之。”文中涉及的操作方法是()
A.蒸馏
B.升华
C.干馏
D.萃取
B 【解析】分析《本草衍义》对精制砒霜过程的描述:“取砒之
法,将生砒就置火上,以器覆之,令砒烟上飞着覆器”,包含 生砒变成砒烟,砒烟变成砒霜两个过程,前者为升华,后者为 凝华,故B项符合题意。
1.观察法
常见有色离子:Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(棕黄 色)、MnO4-(紫红色)、Cr2O72-(橙色)、CrO42-(黄色)、 Cr3+(绿色)、[Fe(CN)6]3-(黄色)。
2.加热法 3.互滴法
常考的互滴法:Na2CO3溶液和稀盐酸、AlCl3溶液 和NaOH溶液、NaAlO2溶液和稀盐酸、AgNO3溶液和 稀氨水等。
12/10/2021
B.AgCl、NaHCO3 D.Na2CO3、CuSO4
例1
【解析】NaHCO3和Al(OH)3中加入足量稀硫酸有气泡产生, 但最终固体全部溶解,无固体剩余,A错误。AgCl不溶于盐 酸,加入盐酸后固体不会全部溶解,B错误。Na2SO3可溶于
C 水,而BaCO3不溶于水,即样品加水后固体部分溶解;再加
12/10/2021
例2
【解析】NaHCO3受热易分解,Na2CO3受热不易分解,将 固体加热至恒重得到的是Na2CO3而不是NaHCO3,A错误; Al与稀盐酸反应生成AlCl3和H2,AlCl3是强酸弱碱盐,AlCl3
D 溶液受热水解生成Al(OH)3和易挥发的HCl,不能得到AlCl3,
B错误;常温下苯甲酸在水中的溶解度较小,但苯甲酸在 水中的溶解度随温度升高而增大,故重结晶提纯苯甲酸 的实验步骤应为:加热溶解、趁热过滤、冷却结晶、过 滤、洗涤干燥,C错误;NaBr和KI溶液中分别加新制氯水 后可置换出Br2和I2,而二者溶于CCl4后分别呈橙红色和紫 红色,可鉴别,D正确。
高考化学总复习 4.2物质的检验、分离和提纯课件 苏教版

(2)“固+液”混合物的分离(提纯)
(3)“液+液”混合物的分离(提纯)
返回(fǎnhuí)导航页第九页,共27页。
结束(jiéshù)放映
题型三 对分离、提纯(tíchún)操作的考查
4.海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子 的形式存在。实验室里从海藻中提取碘的流程如下图:
(1)实验室焙烧海带,需要下列仪器中的_______c(填de序f 号)。
物质(wùzhì)的分离与提纯
第一页,共27页。
栏目(lán mù)索引
1 考点 ● 梯级落实
请
点
2 真题 ● 重组集训
击
相
关
3 名师 ● 增分策略
栏 目
地球(dìqiú)与地图
第二页,共27页。
考点一 混合物分离、提纯(tíchún)的物理方法
【知识梳理】
1.混合物分离、提纯的区别:分离是将混合物中各组分分离开来, 获得几种纯净物的过程;而提纯是将混合物中的杂质除去而得到纯净物 的过程。
返回(fǎnhuí)导航页第十四页,共27页。
结束(jiéshù)放映
【思考(sīkǎo)与探究】
食盐水中含有Ca2+、Mg2+、SO42-,设计实验方案来精制食盐水。
提示:Na+、Cl-(Ca2+、Mg2+、SO42B-)a+C(除过l2 S量O42-) Na+、Cl- (Ca2+、Ba2+、Mg2+) +(过除量MNga2O+)HNa+、Cl-(Ca2+、Ba2+、OH-) (+除过C量a2N+、aCBOa32过+)滤Na+、Cl-(CO32-、OH-)(除+C盐O酸32调-、POHH-N)a+、Cl-。
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学
(江苏省专用)
专题二十四 物质的检验、分离和提纯
五年高考
考点一
A组 自主命题·江苏卷题组
)
物质的检验
1.(2017江苏单科,13,4分)根据下列实验操作和现象所得到的结论正确的是 (
选项 A B 实验操作和现象 向苯酚溶液中滴加少量浓溴水、振荡,无白色沉淀 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉 实验结论 苯酚浓度小 部分Na2SO3被氧化
蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]· 3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化 学方程式为:2K3[Fe(C2O4)3] 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为 。 (2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
m(H2O)=1.235 g-1.10 g=0.135 g
n(H2O)=
0.135 g =7.50×10-3 mol 1 18 g mol
n(OH-)=7.50×10-3 mol×2=1.50×10-2 mol
2 n(OH-)∶n(C )=1.50×10-2 mol∶2.50×10-2 mol=3∶5 O3 2 O3 解析 (3)碱式碳酸铝镁与稀盐酸反应生成的CO2与受热分解生成的CO2相等,n(C )=n(CO2)
B组
统一命题、省(区、市)卷题组
1.(2016课标Ⅱ,12,6分)某白色粉末由两种物质组成,为鉴别其成分进行如下实验: ①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶 解; ②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。 该白色粉末可能为 ( A.NaHCO3、Al(OH)3 C.Na2SO3、BaCO3 ) B.AgCl、NaHCO3 D.Na2CO3、CuSO4
答案 C A项,加入足量稀硫酸后,固体全部溶解;B项,加入足量稀盐酸时有气泡产生,但仍有 固体存在;D项,加入足量稀硫酸并振荡后,固体全部溶解。故A、B、D均不符合题意。 思路梳理 根据题中给出的实验现象,对照各选项逐一分析判断,即可找出正确选项。
2.[2018课标Ⅱ,28(1)(2),10分]K3[Fe(C2O4)3]· 3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制
淀;再加入足量稀盐酸,部分沉淀溶解
C 向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶 蔗糖未水解 液,未出现银镜 D 向某黄色溶液中加入淀粉KI溶液,溶液呈蓝色 溶液中含Br2
答案 B 本题考查化学实验基本操作。向苯酚溶液中滴加少量浓溴水,生成的有机物会溶
解在过量的苯酚溶液中,并非苯酚浓度小,A不正确;Na2SO3可被氧化成Na2SO4,BaSO3可与稀盐 酸反应而溶解,BaSO4不溶于稀盐酸,B正确;未将水解后的溶液调到碱性,故银镜反应不能发生, C不正确;若黄色溶液中含Cl2或Fe3+,加入淀粉KI溶液,溶液同样会呈蓝色,D不正确。
①通入氮气的目的是 。 ②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产
物中一定含有
、
。
③为防止倒吸,停止实验时应进行的操作是 。 ④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是: 。
=
0.560 L =2.50×10-2 mol,m(CO2)=2.50×10-2 mol×44 g/mol=1.10 g。由图像可知,当温度从 22.4 L / mol
270 ℃升高到600 ℃后,失去结晶水的碱式碳酸铝镁完全分解为MgO、Al2O3、CO2和H2O,由固体 残留的差值可得m(H2O)+m(CO2)=3.390 g×(0.734 5-0.370 2)=1.235 g,则MgaAlb(OH)c(CO3)d分解
2
答案 (3)n(CO2)=
0.560 L -2 1 =2.50×10 mol 22.4 L mol
m(CO2)=2.50×10-2 mol×44 g· mol-1=1.10 g 在270~600 ℃之间,失去结晶水后的样品进一步受热分解放出CO2和H2O m(CO2)+m(H2O)=3.390 g×(0.734 5-0.370 2)=1.浓溴水,可发生反应:
+3Br2
↓
+3HBr,溶液中出现白色沉淀。
2.[2014江苏单科,18(3),8分,0.33]碱式碳酸铝镁[MgaAlb(OH)c(CO3)d· xH2O]常用作塑料阻燃剂。 (3)为确定碱式碳酸铝镁的组成,进行如下实验: ①准确称取3.390 g样品与足量稀盐酸充分反应,生成CO2 0.560 L(已换算成标准状况下)。
②另取一定量样品在空气中加热,样品的固体残留率(
固体样品的剩余质量 ×100%)随温度的变 固体样品的起始质量
化如下图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合 物)。
O3 )(写出计算过程)。 根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-)∶n(C
0.135 g =1.50× 得到的H2O的质量m(H2O)=1.235 g-1.10 g=0.135 g,故n(OH-)=2n(H2O)=2×
2 )=1.50×10 mol∶2.50×10 mol=3∶5。 10 mol,则n(OH )∶O n(C
-2 -2 -2
18 g / mol
3
审题技巧 此类图像的纵坐标可能是固体的质量,也可能是固体残留率,在审题时应注意区
分。 解题技巧 热重法分析不同温度下残留物成分时,有以下几点技巧: ①若样品中含结晶水,则受热时一般先失去结晶水; ②样品中的金属元素一般不失去; ③样品中的非金属元素C、S、N等可能会以CO、CO2、SO2、SO3、NH3的形式放出; ④若纵坐标为固体残留率,则可将初始样品设为100 g或1 mol,以方便计算。 评析 本题以MgaAlb(OH)c(CO3)d· xH2O分解为线索,以图像形式展现数据,并引入“固体残留 率”供学生学习并应用,重点考查学生的计算能力,题目偏难。
(江苏省专用)
专题二十四 物质的检验、分离和提纯
五年高考
考点一
A组 自主命题·江苏卷题组
)
物质的检验
1.(2017江苏单科,13,4分)根据下列实验操作和现象所得到的结论正确的是 (
选项 A B 实验操作和现象 向苯酚溶液中滴加少量浓溴水、振荡,无白色沉淀 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉 实验结论 苯酚浓度小 部分Na2SO3被氧化
蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]· 3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化 学方程式为:2K3[Fe(C2O4)3] 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为 。 (2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
m(H2O)=1.235 g-1.10 g=0.135 g
n(H2O)=
0.135 g =7.50×10-3 mol 1 18 g mol
n(OH-)=7.50×10-3 mol×2=1.50×10-2 mol
2 n(OH-)∶n(C )=1.50×10-2 mol∶2.50×10-2 mol=3∶5 O3 2 O3 解析 (3)碱式碳酸铝镁与稀盐酸反应生成的CO2与受热分解生成的CO2相等,n(C )=n(CO2)
B组
统一命题、省(区、市)卷题组
1.(2016课标Ⅱ,12,6分)某白色粉末由两种物质组成,为鉴别其成分进行如下实验: ①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶 解; ②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。 该白色粉末可能为 ( A.NaHCO3、Al(OH)3 C.Na2SO3、BaCO3 ) B.AgCl、NaHCO3 D.Na2CO3、CuSO4
答案 C A项,加入足量稀硫酸后,固体全部溶解;B项,加入足量稀盐酸时有气泡产生,但仍有 固体存在;D项,加入足量稀硫酸并振荡后,固体全部溶解。故A、B、D均不符合题意。 思路梳理 根据题中给出的实验现象,对照各选项逐一分析判断,即可找出正确选项。
2.[2018课标Ⅱ,28(1)(2),10分]K3[Fe(C2O4)3]· 3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制
淀;再加入足量稀盐酸,部分沉淀溶解
C 向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶 蔗糖未水解 液,未出现银镜 D 向某黄色溶液中加入淀粉KI溶液,溶液呈蓝色 溶液中含Br2
答案 B 本题考查化学实验基本操作。向苯酚溶液中滴加少量浓溴水,生成的有机物会溶
解在过量的苯酚溶液中,并非苯酚浓度小,A不正确;Na2SO3可被氧化成Na2SO4,BaSO3可与稀盐 酸反应而溶解,BaSO4不溶于稀盐酸,B正确;未将水解后的溶液调到碱性,故银镜反应不能发生, C不正确;若黄色溶液中含Cl2或Fe3+,加入淀粉KI溶液,溶液同样会呈蓝色,D不正确。
①通入氮气的目的是 。 ②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产
物中一定含有
、
。
③为防止倒吸,停止实验时应进行的操作是 。 ④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是: 。
=
0.560 L =2.50×10-2 mol,m(CO2)=2.50×10-2 mol×44 g/mol=1.10 g。由图像可知,当温度从 22.4 L / mol
270 ℃升高到600 ℃后,失去结晶水的碱式碳酸铝镁完全分解为MgO、Al2O3、CO2和H2O,由固体 残留的差值可得m(H2O)+m(CO2)=3.390 g×(0.734 5-0.370 2)=1.235 g,则MgaAlb(OH)c(CO3)d分解
2
答案 (3)n(CO2)=
0.560 L -2 1 =2.50×10 mol 22.4 L mol
m(CO2)=2.50×10-2 mol×44 g· mol-1=1.10 g 在270~600 ℃之间,失去结晶水后的样品进一步受热分解放出CO2和H2O m(CO2)+m(H2O)=3.390 g×(0.734 5-0.370 2)=1.浓溴水,可发生反应:
+3Br2
↓
+3HBr,溶液中出现白色沉淀。
2.[2014江苏单科,18(3),8分,0.33]碱式碳酸铝镁[MgaAlb(OH)c(CO3)d· xH2O]常用作塑料阻燃剂。 (3)为确定碱式碳酸铝镁的组成,进行如下实验: ①准确称取3.390 g样品与足量稀盐酸充分反应,生成CO2 0.560 L(已换算成标准状况下)。
②另取一定量样品在空气中加热,样品的固体残留率(
固体样品的剩余质量 ×100%)随温度的变 固体样品的起始质量
化如下图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合 物)。
O3 )(写出计算过程)。 根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-)∶n(C
0.135 g =1.50× 得到的H2O的质量m(H2O)=1.235 g-1.10 g=0.135 g,故n(OH-)=2n(H2O)=2×
2 )=1.50×10 mol∶2.50×10 mol=3∶5。 10 mol,则n(OH )∶O n(C
-2 -2 -2
18 g / mol
3
审题技巧 此类图像的纵坐标可能是固体的质量,也可能是固体残留率,在审题时应注意区
分。 解题技巧 热重法分析不同温度下残留物成分时,有以下几点技巧: ①若样品中含结晶水,则受热时一般先失去结晶水; ②样品中的金属元素一般不失去; ③样品中的非金属元素C、S、N等可能会以CO、CO2、SO2、SO3、NH3的形式放出; ④若纵坐标为固体残留率,则可将初始样品设为100 g或1 mol,以方便计算。 评析 本题以MgaAlb(OH)c(CO3)d· xH2O分解为线索,以图像形式展现数据,并引入“固体残留 率”供学生学习并应用,重点考查学生的计算能力,题目偏难。
