物质的量复习1学习提纲
物质的量知识点总结

物质的量知识点复习1、摩尔物质的量是国际规定的七个基本物理量之一, 用来表示含一定数目粒子的集体, 符号是n, 单位是mol。
摩尔是计量原子、分子、或离子等微观粒子的物质的量的单位。
2、阿伏伽德罗常数是任何粒子的粒子数, 符号是NA, 常用6.02×1023这个近似值。
3、摩尔质量1mol任何粒子或物质的质量以克为单位时, 在数值上都与相对原子质量或相对分子质量相等。
4、摩尔质量是指单位物质的量的物质所具有的质量, 符号是M,常用单位是g·mol-15、使用摩尔这个概念时应注意的事项(1)摩尔是物质的量单位, 每摩尔物质含有阿伏伽德罗常数个粒子, 摩尔简称摩, 符号mol。
(2)摩尔的量度对象是构成物质的基本粒子, 这里的“粒子”是指“基本单元”, 这个基本单元可以是分子、原子、离子、电子、质子、中子等单一粒子, 也可以是这些粒子的特定组合。
如1molCaCl2可以说含1molCa2+, 2molCl-或3mol阴、阳离子, 或含54mole-等。
(3)摩尔概念只适用微观不适用于宏观。
6、使用摩尔表示物质的量时, 应该用化学式指明粒子种类, 而不是使用该粒子的中文名称。
7、气体摩尔体积当分子数目相同时, 气体体积大小主要决定于气体分子间的距离。
要比较一定质量的气体体积, 必须在相同温度和压强下进行。
气体摩尔体积: 单位物质的量气体所占的体积, 符号为Vm,单位是L/mol或m3/mol。
标准状况下气体的摩尔体积:标准状况下, 即温度为0℃, 压强为101Kpa时, 1mol任何气体所占的体积都约是22.4L。
5阿伏伽德罗定律及推论:(1)根据气体状态方程PV=nRT=可以得到以下定律和推论:同温同压下, 相同体积的任何气体都含有相同数目的分子。
(阿伏伽德罗定律)(2)同温同压下的不同气体, 其体积之比等于物质的量之比, 等于所含粒子数目之比。
(3) 同温同压下的不同气体, 其密度之比等于相对分子质量之比, 等于相对密度。
【精品】高一化学 第三章 物质的量 第一节物质的量(备课资料)大纲人教版

备课资料一、国际单位制及其基本单位1960年第11届国际计量大会上通过的国际单位制是在长期通行的米制基础上发展起来的。
它确取了由于历史原因造成的多种单位制并用的混乱现象,具有科学、简明、实用和统一的特点,反映了当代科学技术水平,已成为国际上公认的单位制。
国际单位制的七个基本单位,如下表所示:下面分述七种基本单位的定义:1.米:1791年法国决定把通过巴黎的地球子午线从赤道到北极的长度的1/10000000规定为1 m。
后来根据测量结果把这个长度用铂铱合金制成了标准米原器,保存在巴黎国际计量局。
但米原器测量精度不高(只能达到0.1 μm),且一旦毁坏,不易复制。
1983年第11届国际计量大会决定用光速定米,规定1米等于光在真空中于1/299792458秒时间间隔内所经路径的长度。
但标准米原器仍保存在国际计量局。
2.千克:国际千克原器的质量为1 kg。
国际千克原器是1889年第一届国际计量大会批准制造的。
它是一个高度和直径均为39 mm,用铂铱合金制成的圆柱体。
原型保存在巴黎国际计量局。
3.秒:铯—133原子基态的两个超精细能级之间跃迁对应的辐射的9192631770个周期的持续时间为1 s。
起初,人们把一昼夜划分为24 h,1 h为60 min,1 min为60 s,所以定义1 s为1/86400平均太阳日。
但一昼夜的周期,即太阳日是变动的,后来,又发现地球公转周期也是变动的,于是又需确定另外的定义。
随着科学技术的发展,科学家发现原子能级跃迁时,吸收或发射一定频率的电磁波,其频率非常稳定。
于是在1968年第13届国际计量大会上确认了上述定义。
4.安培:在处于真空相距1 m的两无限长而圆截面积可忽略的平行直导线内通以等量恒定电流时,若此两导线之间的相互作用力在每米长度上等于2×10-7牛顿(N),则导线中的电流强度为1 A。
安培是在1946年国际计量委员会上定义的,1948年第9届国际计量大会上获得批准,1960年第11届国际计量大会上被正式确认为国际单位制的基本单位之一。
高考化学 一轮复习 第1节 物质的量 气体摩尔体积 大纲人教版

解析(1)因为XY2与O2恰好反应,根据反应方程式和阿伏加德定律判 断,消耗O2的体积与生成XO2(g)、YO2(g)混合气体的体积相等,即在 标
准状况下为672 mL,所以n(O2)=0.03 mol。
当摩尔 质量以g·mol-1为单位时,数值上等于式量。
【思维延伸】
知识点1 气体摩尔体积与阿伏加德罗定律
问题2:为什么说气体摩尔体积是阿伏加德罗定律的特例? 6.气体摩尔体积
(1)基础:同温同压下,任何气体分子间的平均距离均相等。 (2)概念:单位物质的量的任何气体在一定条件下所占的体积。 (3)符号及单位:符号为Vm,常用单位是L·mol-1。 (4)物质的量(n)、气体体积(V)和气体摩尔体积Vm之间的关系:
V1 n1 V2 n2
(特例:在0 ℃,1.01×105 Pa时,
1 mol气体 体积为22.4 L)。
(2)同温同压下,同体积的任何气体的质量之比,等于摩尔质量
之比,也等于其密度之比,即
m1 m2
M体的压强之比等于物质的量之比,即
P1 n1 。 P2 n2
高分解密 气体体积的测定实验涉及到某组分的质量分数、体积分数,确定 某气体的摩尔质量进一步确定未知气体的组成。解题的切入点是 从实验目的、原理、仪器思考,同时注意测定条件;减少测定气 体体积的误差主要从两方面思考:首先要考虑外界温度,压强对 气体体积的影响较大,因此在实验前后应尽量保持装置内外的温 度,压强相等,这样测得的气体的体积才准确。其次要考虑气体 的溶解性,选择气体不溶于其中的液体试剂来封闭产生的气体, 最后要看选择量气的方法及加入试剂的顺序能否给测定的结果带 来影响,并力争把这种不利的影响降低到最低。
物质的量复习全面详细
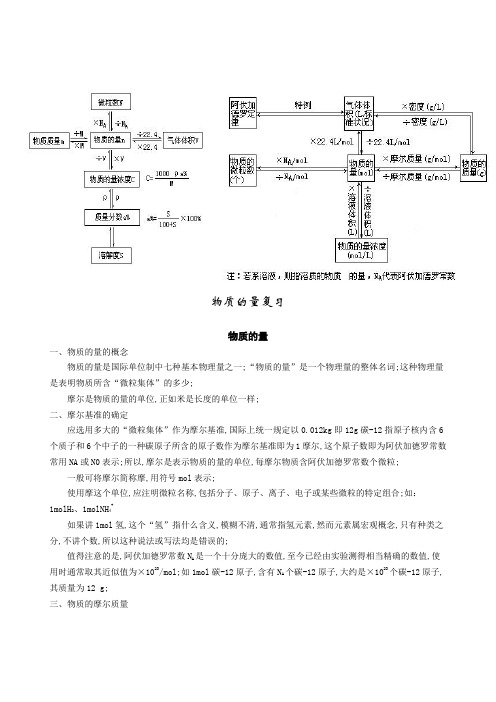
物质的量复习物质的量一、物质的量的概念物质的量是国际单位制中七种基本物理量之一;“物质的量”是一个物理量的整体名词;这种物理量是表明物质所含“微粒集体”的多少;摩尔是物质的量的单位,正如米是长度的单位一样;二、摩尔基准的确定应选用多大的“微粒集体”作为摩尔基准,国际上统一规定以0.012kg即12g碳-12指原子核内含6个质子和6个中子的一种碳原子所含的原子数作为摩尔基准即为1摩尔,这个原子数即为阿伏加德罗常数常用NA或N0表示;所以,摩尔是表示物质的量的单位,每摩尔物质含阿伏加德罗常数个微粒;一般可将摩尔简称摩,用符号mol表示;使用摩这个单位,应注明微粒名称,包括分子、原子、离子、电子或某些微粒的特定组合;如:1molH2、1molNH4+如果讲1mol氢,这个“氢”指什么含义,模糊不清,通常指氢元素,然而元素属宏观概念,只有种类之分,不讲个数,所以这种说法或写法均是错误的;值得注意的是,阿伏加德罗常数N A是一个十分庞大的数值,至今已经由实验测得相当精确的数值,使用时通常取其近似值为×1023/mol;如1mol碳-12原子,含有N A个碳-12原子,大约是×1023个碳-12原子,其质量为12 g;三、物质的摩尔质量1mol 任何物质以克为单位时的质量叫做这种物质的摩尔质量,单位:g/mol 数值:该物质的相对原子质量或相对分子质量如:硫酸的摩尔质量为98g/mol ;碳-12为12g/mol ;氧原子为16g/mol ;OH -为17g/mol 电子质量比原子小得多,可忽略不计; 气体摩尔体积一、定义:1mol 任何气体在标准状况下所占的体积约是22.4L,这个体积称为气体摩尔体积,书写单位用22.4L/mol 表示;二、注意点:1. 1mol 气体,而不是液体或固体2. 指的是标准状况,即压强为×105Pa 和温度为0℃或273K 时,其体积才约是22.4L3. 这个数值是近似值,所以不能少“约”字;但计算时就取22.4L/mol;三、为什么1mol 任何气体在标准状况下所占的体积基本相同,均约是22.4L 呢四、这是因为物质的体积决定于微粒的多少、微粒间的距离及微粒的大小;若把物质的量都取1mol 微粒约×1023个的固体、液体、气体作比较,固体、液体的体积仅有十几cm 3左右,说明微粒间的距离很小,这时决定体积的主要因素是微粒本身的大小,不同物质的微粒大小不等,所占体积也不相同;而气体体积比固体、液体约大1000多倍,气体分子间距离比分子本身大得多,一定量的气体的体积主要决定于分子间的平均距离,与分子本身大小关系不大;而气体分子间平均距离与温度、压强密切有关,温度越高,分子间平均距离越大,气体体积越大;压强越大,分子间平均距离越小,气体体积越小;当温度、压强处于标准状况下,气体分子间的平均距离几乎是个定值,1mol 任何气体占约22.4L,考虑到分子大小对体积略有影响,故22.4L 是个近似值;在研究气体体积的时候,离开温度和压强就没有意义;若温度、压强一定的条件下,气体的“物质的量”和体积成正比;应用气体摩尔体积,可以计算气体的物质的量或标准状况下气体的密度; 阿伏加德罗定律一、阿伏加德罗定律:1. 内容:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子;此定律仅适用于气体,因此也叫气体定律;2. 解释:气体体积取决于微粒的数目、微粒的大小、微粒间的距离三个因素;由于同温同压使得分子间的距离相同,气体分子本身的大小又忽略不计,所以要体积相同就必须要最后一个因素即分子的个数必须相同;3. 表达方式:nRT PV =,RT M m PV =,RTPM V m ==ρ 二、阿伏加德罗定律的推论:1. 在同温同压下,不同气体的体积比等于分子数之比,也等于物质的之比,即: 212121N N n n V V ==; 2. 在同温、同压下,不同气体的密度之比等于相对分子质量之比,也等于摩尔质量之比,即:即的相对密度)相对于气体气体21(2121D M M ==ρρ 由密度求式量有如下三种方法① 已知标准状况时气体密度ρ,M =ρg/mol,式量即知;② 已知标准状况时一定质量气体的体积,)/(4.22L mol Vm M ⨯= ③ 已知两种气体的相对密度,M 1=D·M 2;3. 同温、同体积的各密闭容器中气体的物质的量之比等于其压强之比,即:4. 有气体参加的反应中,气体化学计量数之比等于各气体的体积比,也等于各气体物质的量之比; 物质的量浓度一、物质的量浓度的概念以1L 溶液里含溶质的物质的量来表示溶液的浓度叫物质的量浓度;单位是摩每升mol /L;数学表达式为:对于物质的量浓度概念要注意:1) 物质的量浓度不是以1L 溶剂,而是以1L 溶液作计量单位;2) 溶质的量不是用质量,而是用物质的量来表示;3) 从一定的物质的量浓度溶液中取出任意体积的溶液,物质的量浓度不变;若体积不同,所含溶质的物质的量也不同;4) 体积相同、物质的量浓度相同的溶液里所含有的溶质的物质的量相同,但是物质的微粒数不一定相等;这要根据溶质能否电离,以及电离所产生的离子数目来确定;二、溶液的稀释或混合溶液加水稀释前后溶质的物质的量不变;溶质的物质的量=物质的量浓度mol /L×溶液体积数L通常溶液稀释的表达式为:c 1V 1=c 2V 2c —物质的量浓度,V —溶液体积对于两种浓度不同的溶液相混合,体积会改变,计算体积应先求出溶液的质量,通过密度换算成溶液的体积;只有当两种溶液浓度很稀时,或浓度接近时,体积变化可忽略不计,近似用V 混=V 1+V 2计算;三、物质的量浓度与溶质的质量分数换算若用c 表示物质的量浓度,ρ表示溶液密度,a %表示溶质质量分数,M 表示溶质的摩尔质量,则有下列换算式:)/(%1000)(1)/()/(1000)/(33L mol M a L mol g M cm g cm L mol c ⨯=⨯=ρρ;%1001000%⨯=ρcM a 四、物质的量浓度的配制及误差分析 原料状态 1.计算 2. 3. 4. 5. 6.固体NaCl 步骤NaCl质量称量NaCl溶解转移洗涤定容摇匀仪器天平、药匙烧杯、玻璃棒一定规格的容量瓶胶头滴管液体浓硫酸仪器量筒步骤浓硫酸体积量取浓硫酸稀释转移洗涤定容摇匀启迪和思维1.不能配制任意体积的一定物质的量浓度的溶液;这是因为在配制的过程中是用容量瓶来定容的;而容量瓶的规格又是有限的,常用的有50mL、100mL、250mL、500mL和1000mL等,所以只能配制体积与容量瓶容积相同的一定物质的量浓度的溶液;如实际需要300mL溶液,则只能选择500mL容量瓶,溶质的用量也必须按照500mL来计算;2.在配制一定物质的量浓度的溶液时,不能直接将溶质放入容量瓶中进行溶解,而要在烧杯中溶解,待烧杯中溶液的温度恢复到室温时,才能将溶液转移到容量瓶中;这是因为容量瓶的容积是在20℃时标定的,而绝大多数物质溶解时都会伴随着吸热或放热过程的发生,引起温度的升降,从而影响到溶液的体积,使所配制的溶液的物质的量浓度不准确;3.定容后的容量瓶在反复颠倒、振荡后,会出现容量瓶中的液面低于容量瓶刻度线的情况,这时不能再向容量瓶中加入蒸馏水;这是因为容量瓶是属于“容纳量”式的玻璃仪器指注入量器的液体的体积等于容器刻度所示的体积;用滴管定容到溶液的凹面与容量瓶的刻度线相切时,液体的体积恰好为容量瓶的标定容积;将容量瓶反复颠倒、振荡后,出现容量瓶中的液面低于容量瓶刻度线的情况,主要是部分溶液在润湿容量瓶磨口时有所损失;4.若配制时仪器、药品存在问题,特别是操作不当,会使所配溶液的浓度偏高或偏低;一般讲,溶质损失会使浓度偏小;溶液体积偏大,则浓度偏小,溶液体积偏小使浓度偏大;1)使所配溶液的物质的量浓度偏高的主要原因:①称量固体溶质时所用天平的砝码沾有其他物质或已锈蚀;试剂、砝码的左右位置颠倒;调整天平零点时,游码放在刻度线的右端;②容量瓶内溶液的温度高于20℃,造成所配制的溶液的体积冷却后小于容量瓶上所标注的液体的体积,致使溶液浓度偏高;③定容时,俯视读数使溶液的体积减小,致使溶液浓度偏高;2)使所配制溶液的物质的量浓度偏低的主要原因:①用托盘天平称量固体溶质时,直接称热的物质;砝码有残缺;在敞口容器中称量易吸收空气中其他成分或易于挥发的物质时动作过慢;②用于溶解稀释溶液的烧杯未用蒸馏水洗涤或洗涤液未注入容量瓶,使溶质的物质的量减少,使溶液的浓度偏低;③转移或搅拌溶液时有部分液体溅出,致使溶液浓度偏低;④定容时,仰视读数会使溶液的体积增大,致使溶液浓度偏低;⑤加水定容超出刻度线,即便把多余溶液吸出,浓度还是偏小;3)对所配制溶液的物质的量浓度无影响的操作有:①用湿的容量瓶配溶液,不影响浓度,所以容量瓶无需干燥;一、有关溶解度的计算在一定温度下的饱和溶液中,溶质、溶剂、溶液间有一定量的关系;由此可进行以下计算:1根据饱和溶液溶质、溶剂的量推算溶解度;2根据溶解度求算饱和溶液所含的溶剂和溶质量;3根据溶解度求算饱和溶液在蒸发掉一定量溶剂后析出的结晶量;4由于物质在不同温度下溶解度不同,可以根据不同温度下的溶解度求算出一定量饱和溶液由于温度改变或同时有溶剂量改变,析出结晶的量;5饱和溶液中溶解度与溶质的质量分数的换算;一定温度下,某饱和溶液溶质的溶解度:解题时要熟练运用下列比列关系:饱和溶液中二有关质量分数、物质的量浓度的计算有关质量分数的计算比较简单,但注意两点:一是含结晶水化合物的浓度均按无水物含量计算;二是有些溶质溶解后与水发生了反应,其不能直接按原物质的量表示,如SO3、Na2O2溶于水,溶液浓度按H2SO4、NaOH含量计算;与物质的量浓度有关的计算有:1配制一定物质的量浓度所需溶质、溶剂量或浓溶液稀释用量的计算;2根据所溶溶质的量求算物质的量浓度、离子物质的量浓度;3物质的量浓度与质量分数的换算;。
专题1 物质的量

2013春辅导 专题1 物质的量一、物质的量概念 复习重点: 1.理解质量守恒定律的涵义。
2.明确摩尔的概念,掌握摩尔质量与相对分子质量、相对原子质量之间的区别与联系、理解阿伏加德罗常数的涵义,其中阿伏加德罗常数是命题的热点。
难点:阿伏加德罗定律1.内容 在同温同压下,同体积的气体含有相同的分子数。
即“三同”定“一同”。
2.推论: ⑴同温同压下,V 1/V 2=n 1/n 2 ⑵同温同体积时,p 1/p 2= n 1/n 2=N 1/N 2⑶同温同压等质量时,V 1/V 2=M 2/M 1 ⑷同温同压同体积时,W 1/W 2=M 1/M 2=ρ1/ρ2注意:①阿伏加德罗定律也适用于不反应的混合气体。
②使用气态方程PV=nRT 有助于理解上述推论。
阿伏加德罗常数: 物质的量是以阿伏加德罗常数来计量的,0.012kg 碳-12所含的碳原子数就是阿伏加德罗常数(N A )。
6.02×1023是它的近似值。
注意:叙述或定义摩尔时一般用“阿伏加德罗常数”,在具体计算时常取“6.02×1023 mol -1”。
3.网络 ①、定义:表示含有一定数目粒子的集体。
②、符号:n ③、单位:摩尔、摩、符号物质的量 mol ④、1mol 任何粒子(分、原、离、电、质、中子)数与0.012kg 12C 中所 含碳原子数相同 ⑤、架起微观粒子与宏观物质之间联系的桥梁。
①、定义:1mol 任何粒子的粒子数叫阿伏加德罗常数。
阿伏加德罗常数: ②、符号N A ③、近似值:6.02×1023①、定义:单位物质的量气体所占的体积叫气体摩尔体积。
基本概念 气体摩尔体积:②、符号:Vm ③、单位:L·mol -1①、定义:单位物质的量物质所具有的质量叫~摩尔质量:②、符号:M ③、单位:g·mol -1或kg·mol -1④、若以g·mol -1为单位,数值上与该物质相对原子质量或相对分子质量相等。
物质的量及其有关计算专题复习 (1)

长度
质量 时间 电流
米
千克 秒 安[培]
m
Kg S A
热力学温度
物质的量 发光强度
开[尔文]
摩 [尔 ] 坎[德拉]
K
mol cd
÷NA
N
微粒数
n
×NA
物质的量
练习: (1) 1mol H2O约含有 6.02 _________ ×1023 水分子;0.5 mol H2O约含有 3.01 ________ ×1023 个水分子,1 mol H2O含有 ___ mol 质子_______mol 电子______mol 原子。 10 10 3 ×1023 (2) 1mol H2SO4 分子约含有 6.02 _________ 个 H2SO4 分子;______mol 氢原子;约 6.02 _________ 2 ×1023 个硫原 4 2 子______mol 氧原子;和_____mol CO2分子所含有 的氧原子数相等。
÷ 摩尔质量 ×摩尔质量
物质的量
小
结
2、阿伏加德罗常数、物质的量、摩尔的关系 标准 物理量 单位
气体摩尔体积
(一).气体摩尔体积 定义:单位物质的量的气体所占的体积。 符号:Vm 单位:L/mol或m3/mol等 公式: V Vm= ——
n
对象:任何气体(纯净或混合气体) 标准状况下:Vm约22.4L/mol 标准状况: 温度:0oC、压强1.01×105Pa
2、摩尔质量和相对原子质量(或式量)的关系
粒子 相对原子或 (分子)质量 一个粒子的真实 质量(g/个) 1.993×10-26 9.302×10-26 5.31×10-26 1.63×10-26 1mol物质含有 1mol物质 的粒子数(个) 的质量(g) 6.02×1023 6.02×1023 6.02×1023 6.02×1023 12 56 32 98
第3课时 物质的量导学提纲

【思考1】1molN2和CO的混合物所含分子个数和原子个数?若改成1molCO2和N2的混合物还能否写出原子数和分子数?
二、探究未知
请写出你的疑惑:①
②
③
第3课时物质的量
姓课本第11页第1、2段能说出物质的量的定义、符号和单位。
2.通过阅读课本第11页第2段,能说阿伏伽德罗常数的定义、符号、数值、单位及表示方法。
3.通过小组讨论归纳1mol粒子数目、0.012kg12C中所含的碳原子数、阿伏加德罗常数、6.02×1023四者在数值上的关系。
(一)、概念辨析
1.物质的量:①物质的量可写为物质的质量和物质量
②摩尔是衡量微观粒子多少的物理量
③表示正确的是:1mol氧1molO 1.5mol氧元素1molO21.5mol米粒
2.阿伏伽德罗常数:①阿伏伽德罗常数没有单位
②0.012kg12C中所含的碳原子数就是阿伏伽德罗常数
③6.02×1023叫阿伏伽德罗常数
4.通过阅读课本能辨析物质的量n和阿伏伽德罗常数NA的概念及写出粒子数N、物质的量n和阿伏伽德罗常数NA的关系式并灵活应用。
【重点难点】
重点:物质的量和阿伏伽德罗常数的定义、符号和单位;粒子数N、物质的量n和阿伏伽德罗常数NA的关系。
难点:物质的量和阿伏伽德罗常数的概念辨析。
【导学流程】
一、基础感知
④1mol氖气所含的原子个数为2NA
(二)、计算
1、5molCO2与8molSO2的分子数之比和原子数之比分别是多少?
2、2molCO2分子含碳原子个数?O原子物质的量是多少?
3、含3molSO42-的Fe2(SO4)3的物质的量为多少?
物质的量单元知识点复习.doc

物质的量单元知识点复习一、以物质的量为中心的计算(1)N A、M 、V m、C 四个定义式的含义及相互换算关系:(2)与物质的量有关的物理量知识总结二、一定物质的量浓度溶液的配制(1)配制步骤:①计算所需溶质的量②③溶解或稀释:注意冷却或升温至室温④移液:把烧杯液体引流入容量瓶。
⑤洗涤:洗涤烧杯和玻璃棒2~3次,洗涤液一并移入容量瓶。
⑥定容:向容量瓶中注入蒸馏水至距离刻度线2~3 cm处改用胶头滴管滴蒸馏水至溶液的凹液面与刻度线正好相切。
⑦摇匀:盖好瓶塞,反复上下颠倒,摇匀。
⑧装瓶:(2)使用的仪器:托盘天平或量筒(滴定管)、烧杯、容量瓶、玻璃棒、胶头滴管、药匙等。
(3)重点注意事项:①容量瓶使用之前一定要检查瓶塞是否漏水;②配制一定体积的溶液时,选用容量瓶的规格必须与要配制的溶液的体积相同;③不能把溶质直接放入容量瓶中溶解或稀释;④溶解时放热的必须冷却至室温后才能移液;⑤定容后,经反复颠倒,摇匀后会出现容量瓶中的液面低于容量瓶刻度线的情况,这时不能再向容量瓶中加入蒸馏水。
因为定容后液体的体积刚好为容量瓶标定容积。
上述情况的出现主要是部分溶液在润湿容量瓶磨口时有所损失;⑥如果加水定容时超过了刻度线,不能将超出部分再吸走,必须重新配制。
(4)实验误差分析:实验过程中的错误操作会使实验结果有误差:<1>使所配溶液的物质的量浓度偏高的主要原因①天平的砝码沾有其他物质或已锈蚀。
使所称溶质的质量偏高,物质的量浓度偏大②调整天平零点时,没调平,指针向左偏转(同①)。
③用量筒量取液体时仰视读数(使所取液体体积偏大)。
④把量筒中残留的液体用蒸馏水洗出倒入烧杯中(使所量液体体积偏大)。
⑤把高于20℃的液体转移进容量瓶中(使所量液体体积小于容量瓶所标注的液体的体积)。
⑥定容时,俯视容量瓶刻度线(使液体体积偏小)。
<2>使所配溶液的物质的量浓度偏低的主要原因①称量时,物码倒置,并动用游码(使所称溶质的质量偏低,物质的量偏小)。
物质的量复习要点

物质的量复习要点一.物质的量:物质的量可与如下物理量建立联系:“物质的量”(符号n)是国际单位制中的七个基本物理量之一,它表示物质含组成微粒的多少。
如:问水的“物质的量”为多少,其实就是问水中含多少水分子。
从“物质的量”的定义理解,其单位应该为“个”。
但“个”这个单位实在太小了,所以给“物质的量”定义了一个很大的单位“摩尔或mol”。
“摩尔”就相当于“光年、马赫”等大单位。
二.摩尔摩尔:简称摩,“物质的量”的单位。
规定:每摩尔物质含阿佛加得罗常数个组成微粒。
规定:12克12C(核中含6个质子6个中子的碳原子)中所含的碳原子数即为阿佛加得罗常数。
通常用N A表示(不能用Na表示)。
单位为mol-1,约为6.02×1023 mol-1阿佛加得罗常数是12g 12C(不能是其它碳原子)中所含的碳原子数。
这是一个准确值。
若说成阿佛加得罗常数就是6.02×1023 mol-1是错误的。
我们在计算时用6.02×1023来代替。
摩尔这个单位使用的注意事项:1. 只能用来表示微观粒子(如分子、离子、电子、质子、中子等)的个数。
如1mol 苹果这种说法就是错误的2. 指代必须明确。
如我们说1摩某物质,则应明确该物质的组成微粒是什么,如1mol 氧这种说法就是错误的,因为这种物质中的组成微粒是氧分子还是氧原子不明确。
但1mol 氩、1mol铁这种说法是正确的,因为氩是一种单原子分子、铁是由铁原子构成的。
1mol水这种说法是正确的,因为水的组成微粒就是水分子。
由阿佛加德罗常数的定义可知:12克12C 含N A 个12C 原子,因此一个12C 原子的质量为12/N A ,它的1/12即为阿佛加德罗常数的倒数。
由此也就知道了相对原子质量的标准为阿佛加德罗常数的倒数。
三.摩尔质量摩尔质量:每摩物质的质量叫该物质的摩尔质量。
单位:克/摩(g/mol )注意:若问1摩氧气的质量是多少时,应回答成32克若问氧气的摩尔质量是多少时,应回答成32克/摩摩尔质量的概念与燃烧热的概念有些相似。
《物质的量》复习提纲.doc

《物质的量》复习提纲[考纲解读]1、了解摩尔、摩尔质量、气体摩尔体积、物质的量浓度、阿伏加德罗常数等的含义。
2、理解摩尔是物质的量的基本单位,可用于进行简单的化学计算。
3、根据物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系进行有关计算。
[知识点回顾]一、物质的量及其单位——摩尔1、物质的量是国际单位制中七个基本之一,是用中所含的原子数目为标准来衡量其他微粒集体所含微粒数目多少的物理量;符号为02、物质的量的单位为,符号为o使用摩尔时的注意事项:①摩尔概念只是用于,量度的对象是,不适用于,可以使原子、分子,离子、电子、质子、中子等微粒,也可以使这些粒子的特定组合;②使用摩尔时必须用指明粒子的种类,如ImolO表示lmol02表示, ImolH*表示o二、阿伏加德罗常数3、概念:任何微粒所含的微粒数或12C中所含的碳原子数,取近似值为,所以阿伏加德罗常数为,符号为o4、物质的量(n)阿伏加德罗常数(N A)和微粒数(N)之间的换算式三、摩尔质量5、概念:, 符号:,单位:或思考:Imol物质的质量在数值上有什么特点?Imol任何物质的质量,以为单位时,在数值上都等于它的或例如:02的摩尔质量是,而lmolO2的质量是=7、摩尔质量与物质的量(n)、物质的质量(m)、粒子数(N)之间的关系练习1、下列说法正确的是()A、物质的量就是物质的质量B、Imol氮约含有6.02x 1()23个微粒C、氯化氢的摩尔质量就是它的相对分子质量D、Imol水中含有2mol氢原子和Imol氧原子2、下列叙述正确的事()A、二氧化硫的摩尔质量是64gB、ImolCOn的质量是44gC、摩尔质量就是物质的相对分子质量D、摩尔质量就是物质相对分子质量的6.02X1023倍,单位是摩尔四、气体摩尔体积思考:在相同的温度和压强下,Imol不同气体的体积在数值上有什么特点/8、概念:在一定的和下,所占的体积。
《物质的量》教学设计教学提纲

《物质的量》教学设计第一部分:教材分析(一)课程目标《物质的量》这一节是人教版《化学(必修1)》第一章从实验学化学,第二节化学计量在实验中的应用第一课时物质的量的单位—摩尔的内容。
本节课在全日制普通高中新课程标准中要求:通过本节课程的学习使学生能够认识摩尔是物质的量的基本单位,能用于进行简单的化学计算,体会定量研究的方法对研究和学习化学的重要作用。
预计本节内容教学需要45分钟。
(二)分析教材(作用、联系、地位)作用:化学是一门以实验为基础的科学,实验的严谨性要求我们必须通过定量的手段进行科学分析,所以在教材的逻辑结构中本节课起到奠定基础的作用。
在学科结构上是对上一节从实验中认识化学的深入的探究也是对下一节摩尔质量、气体摩尔体积、物质的量浓度的理论铺垫起到承上启下的作用。
联系:教材将本节课程安排在高中化学的第一章,是为了更好的引导学生从初中化学的趣味探究到高中化学理性、科学定性、定量地认识化学,学习化学知识。
地位:通过本节课程的学习能使学生增加对化学计量知识的认识,提高学生归纳总结能力,开发学生的空间想象智力,启迪学生的抽象理解思维,为更好地学习化学知识奠定基础。
在高考中常会出现关于与物质的量、阿伏伽德罗常数、摩尔质量等基本概念和计算的考察,本节课程是高中化学的基础课程,学好本节课对整个化学学习都会起到奠定基础的作用,所以学好本节课非常重要。
第二部分:学生情况分析高一学生在身心上基本都已接近成熟的阶段,他们面对更重的学习任务,在家庭和学校占有重要的地位,面临着未来生活道路的选择,是世界观、人生观和价值观形成的重要阶段。
高中生的抽象思维已经从“经验型”走向“理论型”,思维步进入系统化和理论化的层次。
思维的独立性和批判性更加鲜明。
思想上的片面性、表面性和主观性有所改善。
文化知识和生活经验都比初中生丰富多了。
他们个性张扬,思维独立,创新能力突出,信息丰富,不善鉴别,生活优越,抗挫折能力弱,依赖亲情等特点。
物质的量知识梳理共64页

2、要冒一次险!整个生命就是一场冒险。走得最远的人,常是愿意 去做,并愿意去冒险的人。“稳妥”之船,从未能从岸边走远。-戴尔.卡耐基。
梦 境
3、人生就像一杯没有加糖的咖啡,喝起来是苦涩的,回味起来却有 久久不会退去的余香。
物质的量知识梳理4、守业的最好办法就是不断的发展。 5、当爱不能完美,我宁愿选择无悔,不管来生多么美丽,我不愿失 去今生对你的记忆,我不求天长地久的美景,我只要生生世世的轮 回里有你。
谢谢你的阅读
❖ 知识就是财富 ❖ 丰富你的人生
71、既然我已经踏上这条道路,那么,任何东西都不应妨碍我沿着这条路走下去。——康德 72、家庭成为快乐的种子在外也不致成为障碍物但在旅行之际却是夜间的伴侣。——西塞罗 73、坚持意志伟大的事业需要始终不渝的精神。——伏尔泰 74、路漫漫其修道远,吾将上下而求索。——屈原 75、内外相应,言行相称。——韩非
高三物质的量的复习总结

物质的量一、物质的量【单位:摩尔(mol )】的注意事项1、专有名词,不能随意拆开2、物质的量所表示的对象:微观粒子:“粒子”指具体的微观粒子(分子、原子、离子、质子、中子、电子以及它们的特定组合比如:NaCl )注:用化学式表示一般都是正确的,用元素名称表示一般是错误的比如1mol O 对,指氧原子1mol 氧 就是错误的说法3、摩尔:0.012kg 12C 的原子数目为1摩尔。
阿伏加德罗常数(N A )单位mol -1 约等于6.02ⅹ10231mol 任何粒子的数目为N A 个 ,N A 约为6.02×1023. 1mol 物质所含有的粒子数① 12g 12C 所含的碳原子数② 阿伏加德罗常数个③ 约为6.02ⅹ1023个4物质的量(n)、粒子数(N)和阿伏加德罗常数(N A )三者之间的关系用符号表示:N AN n 5摩尔质量:单位物质的量的物质所具有的质量物质的量(n)、质量、摩尔质量三种之间的关系: 气体摩尔体积物质体积:(1)决定物质的体积大小的因素有哪些?(2)决定1mol 物质的体积大小的因素有什么不同?(3)决定1mol 固体或液体物质的体积大小的因素主要有哪些?(4)决定1mol 气体物质的体积大小的因素主要有哪些?(1)受温度和压强的影响(2)分子间距离比分子直径大得多(3)与分子的种类无关(相同条件下,间距几乎相同)气体摩尔体积:单位物质的量的气体所占的体积叫做气体摩尔体积,用V m 表示V m =V/n B在标准状况下,1mol 任何气体(纯净的和不纯净)的体积约为22.4L 。
这个体积叫做气体摩尔体积。
单位:L/ mol 。
应注意:前提条件: 标准状况(0℃ 1.01×105 Pa ;1mol )对象: 任何气体(纯净或不纯净)结论: 约22.4LM= X22.4 L/ mol阿伏加德罗定律 定律:同温同压下,相同体积的任何气体都含有相同的分子数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
学习内容
自我感悟
一、学习目标
1.了解物质的量及其单位(摩尔)、摩尔质量、气体摩尔体积及阿伏加德罗常数的含义。
2.掌握物质的量与微粒(原子、分子、离子等)数目、质量、气体体积(标准状况下)之间的关系及有关计算。(重点)
3.理解阿伏加德罗定律。(难点)
二、自主学习(时间13分钟)
(请同学们独立完成复习提纲上的问题(先不要翻阅资料,实在记不住再查看资料。实在不会的可以先跳过。)
,还等于该物质的。例如:O2的式量为,摩尔质量,1molO2的质量。
小结:物质的量、摩尔质量、物质的质量之间的换算关系:______________
例2:(1)Fe、Fe2+、Fe3+的摩尔质量分别为。
(2)1.5 molH2SO4的摩尔质量是,其质量等于。
(3)OH-的摩尔质量是。
(4)18O2的摩尔质量是。D2O的摩尔质量是
3 2.16gX2O5中含有0.1mol氧原子,则X的相对原子质量为()
A、21.6 B、28 C、14 D、31
4.多少克H2SO4所含的分子数与3.65gHCl所含的分子数相同?
5、在标准状况下,2.24LNOx气体的质量为4.6g,则x的值为。
6、已知Q和R的摩尔质量之比为9∶22,在反应X+2Y===2Q+R中,当1.6gX与Y完全反应后,生成4.4gR,则参加反应的Y和生成物Q的质量之比为()。
3、阿伏加德罗定律适用范围:______________。
例4:2.下列说法正确的是()
A.同温同压下,相同质量的两种气体都占有相同的体积
B.同温同压下,相同体积的气体都含有相同数目的分子
C.在标准状况下,1mol水的体积约为22.4L
D.如果1mol某气体的体积约为22.4L,则一定是在标准状况下
3某些弱电解质在水溶液不完全电离,使离子数目减少
4摩尔质量与相对原子质量有关,与物质的多少无关;离子的摩尔质量与原子的摩尔质量相同
5气体摩尔体积Vm使用的条件:同温同压、气体;气体摩尔体积—22.4L在使用时的条件:气体、标况
6状态问题:水在标准状况下为液态或固态;SO3在标准状况下为固态,常温常压下为液态;碳原子数大于4的烃,在标准状况下为液态或固态
1、物质的量:
(1)物质的量是用来描述微观粒子多少的,(微观粒子包括等及一些特定组合。)国际上规定,1mol任何物质所含的微粒数与相等。它的单位是,符号为
(2).摩尔
摩尔是单位பைடு நூலகம்简称,符号为,
(3)国际上规定,1mol任何物质所含的微粒数与相等,这个数称为,其数值通常取,单位,常用符号_______表示。当某物质中指定的粒子集体所含的指定粒子数与相同时,则该粒子物质的量为1mol。如:1 mol H2O中含有H2O数是个,含氢原子个。阿伏加德罗常数是物质的量的计量标准,
⑦.标准状况下,22.4L氢气和氯气的混合气体中含有的分子总数为NA
原子数为2NA
⑧.标准状况下,22.4LSO3中含有的氧原子数为3NA
⑨.2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
⑩.0.1 mol AlCl3溶液中含Al3+数0.1NA
2、等质量的下列物质中,所含分子数最少的是()
A、Cl2B、HCl C、NH3D、H2SO4
例1:
(1)2 mol CO2中含有mol C和mol O,含有个CO2。
(2)mol H2O中所含有的氧原子数与1.5 mol CO2中含有的氧原子数相同。
(3)1mol CaCl2中含molCa2+,molCl-,mol质子。
【小结】物质的量、阿伏加德罗常数、微粒数之间的关系:
2.摩尔质量
叫做摩尔质量。摩尔质量的符号为________,常用的单位为。摩尔质量在数值上等于
7有关物质的量在化学反应方程式中的计算:上下单位相同,左右单位相通
五、检(时间3分钟)
学习内容
自我感悟
(3)一定温度与压强下,气体摩尔体积为一定值
(4)22.4L/ mol是特定条件(标准状况)下的气体摩尔体积
例3:下列说法正确的是()
A. 1mol任何气体的体积都是22.4L
B. 1molH2的质量是1g,它所占的体积是22.4L
C.在标准状况下,1mol任何物质所占的体积都约为22.4L
D.在标准状况下,1mol任何气体所占的体积都约为22.4L
三、合作探究(时间9分钟)
1判断下面的说法是否正确,错误的展示时说明原因
①。水的摩尔质量是18g
②。1分子硫酸的质量是98g
③。4.4gCO2的物质的量是0.1mol
④。0.1molNH3·H2O的溶液中,含有NU4+0.1mol
⑤.标准状况下,5.6L四氯化碳含有的分子数为0.25NA
⑥.标准状况下,14g氮气含有的核外电子数为5NA
3气体摩尔体积
气体摩尔体积是指,表达式:Vm=________________常用单位_____________或_____________。标准状况下,气体摩尔体积约为,标准状况简写为_________,是指温度为_____,压强为__________时的状况。
使用气体摩尔体积时注意:
(1)对象是气体(2)可以是单一气体也可以是混合气体
A. 46∶9B. 32∶9C. 23∶9D. 16∶9
四、老师讲评(时间9分钟)
(结合自己理解、边听边整理知识要点,记录在学习提纲的相应位置)
1通过公式可知:物质的量是质量、微粒个数及气体体积换算的中心桥梁,在计算过程中要求各物理量研究的对象一致
2某些离子或原子团在水溶液中发生水解反应,使离子数目减少
