2012 补钠过快桥溶
凤凰新学案 高中化学 人教版 必修第一册 教师用书第一章

第一1节 物 质的分类及转化 学 新习 知目 初物质标 探12312分.....第→→↓ 散物分认了认一分质纯净物混合物质散识解识散章的系元分比组系分→→成分素散较↓ 散剂类、可系单质化合物分直根以及径类据组胶大→→→→分等小成体散方进金非无有质不的行法属金机机粒同概分单属化化子对第类种念质单合合化悬,类质物物→→→学了↓ 浊的液研解溶胶浊物课→→→→究胶液体液质乳…的体时酸氧化物碱盐↓ 浊,→→…作的根液→→分分用性据散分性散按。质物按质散质质物元其与质组:粒质粒素性根不成用的子粒子质丁质据同直子直途组分进达→→→→→径直径散行,成尔的…碱金非酸理径剂分和性性<>…属金效解的类为性氧氧氧属应1分胶11化化质0化氧~n0体物物m物化可1n类与::0m,物0以如能能其→→→,n对与与如Fm他e液气固物CO碱酸分溶溶溶O、质A2胶胶胶散反反l、S进2,,,应应O系O如如如行3生生2的、、N成成分云有NFa区eO、色2类(盐盐雾O别O等玻2。H和和。璃等)3水水胶体的的氧氧化化1物物
第第 一二章章 第第第第第第第第物海一二三一一一二三 质水节节节章章节节节及中第第第第第第第第第第第第第第第第第第复测 12 123 1234 123 123 123其的习试变重课课课课课课课课课课课课课课课课课课物离氧钠氯物卷 质子化及及质化要时时时时时时时时时时时时时时时时时时的反还其其的 元素……分应原化化量素养物物电离离氧氧氧氧活钠钠氯氯氯物气物……类反合合—提质质解子子化化化化泼的的气气气质体质……—……及应物物—升的的质反反还剂还还的几几与与的的摩的…………转分转的应应原和原原钠金种种金水实量尔量……………………化类化电的反还反反和属化化属验的体浓、…………………与……、离应应原应应氯单合合室单积度…………………非碱……………用剂的方质物物制位…………………………金溶…………………————基程法……………………………————属液……………………本式 ————……………………………的的……………………规的离钠氧碳氯……………………………反反……………………律配子化酸离………………………………应应……………………平共钠钠子………………………………………………………存和和的………………………………………………………………过碳检…………………………………………………………………氧酸验…………………………………………………………………化氢……………………………………………………………………钠钠…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………… … … … … ………………… …… … … ……………………111100111122333455666677889914417551722962738884955171117
2012年北京高考一模试题分类汇编工艺流程试题(带答案)
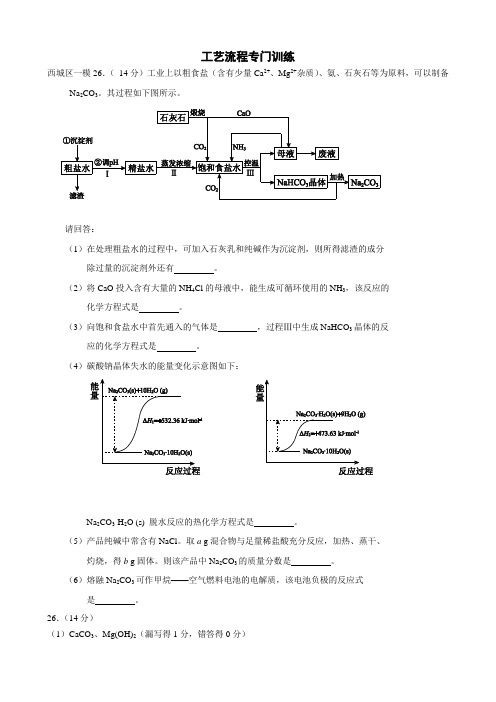
工艺流程专门训练西城区一模26.(14分)工业上以粗食盐(含有少量Ca2+、Mg2+杂质)、氨、石灰石等为原料,可以制备Na2CO3。
其过程如下图所示。
请回答:(1)在处理粗盐水的过程中,可加入石灰乳和纯碱作为沉淀剂,则所得滤渣的成分除过量的沉淀剂外还有。
(2)将CaO投入含有大量的NH4Cl的母液中,能生成可循环使用的NH3,该反应的化学方程式是。
(3)向饱和食盐水中首先通入的气体是,过程Ⅲ中生成NaHCO3晶体的反应的化学方程式是。
(4)碳酸钠晶体失水的能量变化示意图如下:Na2CO3·H2O (s) 脱水反应的热化学方程式是。
(5)产品纯碱中常含有NaCl。
取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体。
则该产品中Na2CO3的质量分数是。
(6)熔融Na2CO3可作甲烷——空气燃料电池的电解质,该电池负极的反应式是。
26.(14分)(1)CaCO3、Mg(OH)2(漏写得1分,错答得0分)(2)2NH 4Cl+CaO=CaCl 2+2NH 3↑+H 2O(3)NH 3 NH 3+H 2O+CO 2+NaCl =NaHCO 3↓+NH 4Cl(4)Na 2CO 3·H 2O(s)= Na 2CO 3(s) +H 2O(g) ΔH = + 58.73 kJ·mol -1(5)106(b -a )/11a(6)CH 4-8e -+4CO 32-=5CO 2+2H 2O丰台区一模27.(15分)近年来,为提高能源利用率,西方提出共生系统。
特指为提高经济效益,人类生产活动尽可能多功能化。
共生工程将会大大促进化学工业的发展。
(1)由于共生工程的应用,利用发电厂产生的SO 2制成自发电池,其电池反应方程式为:2SO 2+O 2+2H 2O =2H 2SO 4,该电池电动势为1.06V 。
实际过程中,将SO 2通入电池的 极(填“正”或“负”),负极反应式为 。
《怎样加快溶解》 知识清单

《怎样加快溶解》知识清单在我们的日常生活和科学实验中,经常会遇到需要加快溶解的情况。
比如,冲泡咖啡或奶茶时希望粉末快速溶解,在化学实验中希望溶质尽快溶解于溶剂。
那么,怎样才能加快溶解呢?以下是一些常见且有效的方法。
一、搅拌搅拌是最常见也最直观的加快溶解的方法。
通过搅拌,可以打破溶质周围已经形成的饱和溶液层,使新鲜的溶剂能够与溶质充分接触,从而加速溶解过程。
就好像在煮糖水时,用勺子搅拌能让糖更快地溶解在水中。
搅拌的速度和力度也会影响溶解的速度,一般来说,搅拌速度越快、力度越大,溶解也就越快。
但也要注意,过度搅拌可能会导致溶液飞溅,造成浪费甚至危险。
二、加热温度对溶解速度有着显著的影响。
通常情况下,升高温度可以加快溶解。
这是因为温度升高,分子的运动速度加快,溶质分子和溶剂分子之间的碰撞更加频繁,结合的机会也就增加了。
例如,在泡蜂蜜水时,用热水泡比用冷水泡蜂蜜能更快地溶解。
不过,并不是所有物质的溶解速度都会随温度升高而加快,有些物质的溶解度反而会随温度升高而降低。
三、增加溶剂增加溶剂的量可以为溶质提供更多的溶解空间,从而加快溶解速度。
想象一下,把一勺盐放入一小杯水中,可能需要较长时间才能完全溶解,但如果把这勺盐放入一大盆水中,溶解就会快很多。
但需要注意的是,这种方法只是在一定程度上加快了溶解速度,当溶质的量远远超过溶剂能够溶解的极限时,即使增加再多的溶剂,也无法完全溶解。
四、减小溶质颗粒大小将溶质的颗粒减小,也就是把大块的溶质变成小块或者粉末状,能够增加溶质与溶剂的接触面积,从而加快溶解。
比如,在制药过程中,常常会将药物研磨成细小的粉末,以便在人体内更快地溶解和吸收。
我们在厨房里磨碎冰糖来加快它在水中的溶解,也是基于这个原理。
五、选择合适的溶剂不同的溶剂对同一种溶质的溶解能力和溶解速度可能不同。
有些溶剂与溶质之间的相互作用更强,能够更快速地促使溶质溶解。
例如,碘在酒精中的溶解速度比在水中快。
因此,在需要加快溶解时,可以根据溶质的性质选择更适合的溶剂。
临床补钠攻略

低钠血症是临床常遇到水盐失衡类型,发生率约占住院患者的30%,在老年患者中,发病率更高,同时也是临床上最容易忽视的问题之一,相比低钾血症而言,低钠血症的处理也更为棘手。
你对低钠血症了解多少?1. 低钠血症的一般分类按血钠浓度分类:•轻度:血钠 130-135 mmol/L•中度:125-129 mmol/L•重度:血钠<125 mmol/L按发生时间分类急性低钠血症:<48 h;慢性≥ 48 小时,不能确定发病时间的均建议考虑为慢性低钠血症。
2.低钠血症的发病机制是怎样的?细胞外液中水的相对增多和钠的相对减少导致低钠血症的发生,总的效应是血浆渗透压降低,失钠常伴有失水,有效血容量减少,从而引起非渗透压性抗利尿激素精氨酸加压素(AVP)释放,以增加肾小管对水的重吸收,以免血容量进一步减少。
但是这种代偿机制又加重了血钠和血浆渗透压的降低。
因此,低钠血症的根本机制是血浆中的 AVP 不适当升高。
3. 低钠血症的临床表现有哪些?低钠血症对人体造成的影响以中枢神经系统最为突出,其严重程度主要取决于血钠下降的速度和幅度,单纯依靠血钠水平不能充分评价低钠血症的严重程度。
低钠血症是否出现临床症状对判断低钠血症的危害性意义更大。
一般可根据临床症状低钠血症分为轻度症状性低钠血症(如注意力不集中、烦躁不安、肌肉痉挛、反射减弱)、中度症状性低钠血症(如头痛、恶心、呕吐等颅高压表现,定向障碍)、重度症状性低钠血症(如呼吸窘迫、癫痫、嗜睡、谵妄、昏迷)。
低钠血症是否伴有症状决定着是否需要紧急补钠。
一般而言,低钠血症发生越快,症状越重,越应尽快补钠。
4. 什么是「血浆渗透压」和「血容量」?谈及低钠血症时离不开两个概念,即血浆渗透压和血容量。
血浆渗透压公式:2(Na+K)+葡萄糖+尿素氮。
血浆渗透压是由血浆中所有溶质颗粒加在一起所表现出来的渗透效应,正常血清钠的浓度为 135-145 mmol/L,从公式中看出,一旦血钠异常,对渗透压的改变是巨大的,因此血钠是维持细胞内外晶体渗透压的最重要因素。
补钠的原则

补钠的原则
补钠需要遵循一定的原则,以确保安全和有效性。
以下是一些常见的补钠原则:
1、按需补钠:在补钠时,要遵循按需补钠的原则,缺多少
补多少,不能出现过量补钠的情况。
2、控制补钠速度:患者还要配合医生控制补钠速度,在第
一天内,补钠应该全速进行,之后,需要缓慢补钠,速
度不能过快。
3、监测指标:在补钠的过程中,患者需要严格配合医生监
测各项指标,比如呼吸、脉搏、尿量等。
此外,补钠的
同时,患者还要配合医生纠正其他离子紊乱的问题。
4、注意滴速:如果患者不能口服补钠,需要通过静脉注射,
在补钠的同时一定要注意控制输液的滴速,如果太快会
导致局部血管疼痛。
建议在补钠前咨询医生或营养师,以确保安全和有效性。
补钠导致脑桥中央髓鞘溶解?正确做法是...

补钠导致脑桥中央髓鞘溶解?正确做法是...我们先看一个病例:补钠过快致患者脑桥中央髓鞘溶解,医院赔偿 14 万元!诊疗经过:2015 年 5 月 15 日:患者因交通事故外伤致头痛、左肩、左髋疼痛、活动受限即刻入住被告医院骨科。
入院诊断:左锁骨远端骨折;骨盆骨折;蛛网膜下腔出血。
5 月 16 日:钠 136 mmol/L(参考值 136—145 mmol/L),钾3.46 mmol/L(参考值 3.5—5.2 mmol/L)。
5 月 17 日:复查 CT 示少量蛛网膜下腔出血,颅底多发骨折,左侧颧部及额颞部皮下血肿。
5 月 19 日:葡萄糖氯化钠注射液 500 ml 每日一次静滴。
5 月 21 日:诉恶心呕吐,稍感头晕头痛,给予静脉补充氯化钠。
头颅CT:右侧顶叶近中线处小片血肿,少量蛛网膜下腔出血或硬膜下出血。
5 月 23 日:恶心呕吐症状加重,头颅 CT 示大脑镰密度略增高。
夜间查电解质,钠 117.1 mmol/L(5 月 24 日凌晨出具报告)。
5 月 24 日:钠 117.8 mmol/L,给予静脉补充氯化钠。
神经外科会诊认为暂无特殊治疗。
神经内科会诊考虑精神障碍待查(代谢性脑病?感染性脑病?),纠正电解质紊乱,建议核磁共振等检查。
5 月 25 日:患者反复呕吐,20:50 时许出现烦躁、神志模糊,钠 112 mmol/L,给予口服及静脉补充氯化钠。
5 月 26 日:钠 104 mmol/L,继续口服及静脉补充氯化钠。
5 月27 日:患者呕吐症状较前稍好转,神志较前略转清,血钠122 mmol/L,血钾 2.8 mmol/L,头颅 CT 示颅内未见外伤性改变。
继续纠正电解质紊乱;患者发热至39℃,给予联邦他唑仙预防感染。
5 月 28 日:钠 141 mmol/L。
5 月 29 日:患者突发神志淡漠,呼之不应,眼球固定,GCSll 分,左上肢肌力 I 级,右上肢肌力 III 级,双上肢肌张力偏低,双下肢肌力IV 级。
2025版高考化学一轮总复习第3章金属及其化合物第8讲钠及其重要化合物碱金属提能训练

第8讲钠及其重要化合物碱金属一、选择题:本题共10小题,每小题只有一个选项符合题目要求。
1.(2024·山东潍坊高三检测)对如表试验操作、现象的说明不正确的是( C )和硫酸铜的反应,不会置换出金属铜,C不正确。
2.(2024·辽宁营口期末)下列有关钠及其化合物的叙述中,正确的是( D )①金属钠着火时用泡沫灭火器灭火②二氧化碳通过Na2O2粉末后固体物质的质量增加③切开的金属钠暴露在空气中发生反应2Na+O2===Na2O2④取完后剩余的钠要放回原试剂瓶A.①③ B.②③④C.②③ D.②④[解析]①金属钠着火时不能用水或泡沫灭火器灭火,而应用细沙盖灭,故A错误;②二氧化碳通过过氧化钠,二者反应生成碳酸钠和氧气,故固体物质的质量增大,故B正确;③切开的金属钠暴露在空气中,光亮的表面慢慢变暗:4Na+O2===2Na2O,故C错误;④假如钠有剩余,应将剩余的钠放回原试剂瓶,因为钠相对比较活泼,随意丢弃简洁引发火灾等平安事故,故D正确。
3.(2024·河北衡水高三检测)侯氏制碱法原理为NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl。
下列有关模拟侯氏制碱法的试验原理和装置能达到试验目的的是( C )[解析]干脆加热氯化铵固体无法制得氨气,应加热氯化铵与消石灰固体混合物制备氨气,故A错误;制备碳酸氢铵时,应将二氧化碳通入溶有氨气的饱和食盐水中,否则无法制得碳酸氢钠,故B错误;分别碳酸氢钠固体时,应用过滤的方法分别,故C正确;碳酸氢钠受热分解制备碳酸钠时,应在试管中加热碳酸氢钠,故D错误。
4.下列关于钠及其化合物的叙述正确的是( C )①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物②Na2O2只有氧化性没有还原性③Na2O2与CO2反应,生成1 mol O2时转移电子数目为4N A④向酚酞溶液中加入Na2O2粉末,溶液先变红后褪色,并有气泡生成⑤钠与浓NH4Cl溶液反应,放出的气体中含有H2和NH3A.①③⑤ B.②③④C.④⑤ D.③④⑤[解析]Na2O2不是碱性氧化物,故①错误;Na2O2既有氧化性又有还原性,故②错误;依据反应2Na2O2+2CO2===2Na2CO3+O2,生成1 mol O2时转移2 mol e-,即转移电子数目为2N A,故③错误;向酚酞溶液中加入Na2O2粉末,生成氢氧化钠和氧气,溶液先变红,由于反应中可能有H2O2生成,且H2O2具有强氧化性,所以溶液会褪色,故④正确;钠与浓NH4Cl溶液反应,生成NaCl、H2和NH3,故⑤正确。
理化特性表第5类

目录5.1类氧化剂过氧化氢的理化性质及危险特性(表-) (1)过氧化钠的理化性质及危险特性(表-) (2)高氯酸[含酸50%~72%]的理化性质和危险特性(表-) (3)高氯酸钠的理化性质和危险特性(表-) (4)氯酸钠的理化性质和危险特性(表-) (5)氯酸钾的理化性质和危险特性(表-) (6)亚氯酸钠的理化性质及危险特性(表-) (7)高锰酸钠的理化性质及危险特性(表-) (8)高锰酸钾的理化性质及危险特性(表-) (9)硝酸钠的理化性质及危险特性(表-) (10)硝酸钾的理化性质和危险特性(表-) (11)硝酸钙的理化性质和危险特性(表-) (12)硝酸锶的理化性质和危险特性(表-) (13)硝酸钡的理化性质及危险特性(表-) (14)硝酸锌的理化性质和危险特性(表-) (15)硝酸银的理化性质及危险特性(表-) (16)硝酸铅的理化性质及危险特性(表-) (17)亚硝酸钾的理化性质及危险特性(表-) (18)过(二)碳酸钠的理化性质及危险特性(表-) (19)过硫酸铵的理化性质及危险特性(表-) (20)过硫酸钾的理化性质及危险特性(表-) (22)过硼酸钠的理化性质及危险特性(表-) (23)漂白粉的理化性质及危险特性(表-) (24)溴酸钠的理化性质和危险特性(表-) (25)溴酸钾的理化性质和危险特性(表-) (28)高碘酸的理化性质和危险特性(表-) (29)高碘酸钠的理化性质和危险特性(表-) (30)高碘酸钾的理化性质和危险特性(表-) (31)碘酸钠的理化性质和危险特性(表-) (32)碘酸钾的理化性质和危险特性(表-) (33)三氧化铬[无水]的理化性质及危险特性(表-) (34)重铬酸钾的理化性质及危险特性(表-) (35)硝酸镁的理化性质和危险特性(表-) (37)硝酸铁的理化性质和危险特性(表-) (38)硝酸镍的理化性质和危险特性(表-) (39)硝酸钴的理化性质及危险特性(表-) (40)硝酸铝的理化性质和危险特性(表-) (41)硝酸锰的理化性质和危险特性(表-) (42)硝酸铜的理化性质和危险特性(表-) (43)硝酸铋的理化性质和危险特性(表-) (44)硝酸镧的理化性质和危险特性(表-) (45)硝酸铈铵的理化性质和危险特性(表-) (47)亚硝酸钠的理化性质及危险特性(表-) (48)氧化银的理化性质及危险特性(表-) (49)5.2类有机过氧化物过氧化二异丙苯[含量>42%,带有惰性固体]的理化性质和危险特性(表-)50 过氧化(二)苯甲酰[77%<含量<95%,含水]的理化性质和危险特性(表-) 51 过氧化乙酸的理化性质及危险特性(表-) (52)高氯酸[含酸50%~72%]的理化性质和危险特性(表-)高氯酸钠的理化性质和危险特性(表-)氯酸钠的理化性质和危险特性(表-)亚氯酸钠的理化性质及危险特性(表-)硝酸钠的理化性质及危险特性(表-)过硼酸钠的理化性质及危险特性(表-)溴酸钠的理化性质和危险特性(表-)次氯酸钙[含有效氯>39%]的理化性质及危险特性(表4-7)硝酸铵[含可燃物≤0.2%]的理化性质及危险特性(表4-7)重铬酸钾的理化性质及危险特性(表-)硝酸镁的理化性质和危险特性(表-)硝酸钴的理化性质及危险特性(表-)。
2012年高考化学方程式全部

2012年高考化学方程式+反应说明+反应现象1、硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl2、碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl3、碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑4、木炭还原氧化铜: 2CuO + C 高温2Cu + CO2↑5、铁片与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu6、氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl7、钠在空气中燃烧:2Na + O2 △Na2O2钠与氧气反应:4Na + O2 = 2Na2O8、过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑9、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O210、钠与水反应:2Na + 2H2O = 2NaOH + H2↑11、铁与水蒸气反应:3Fe + 4H2O(g) = F3O4 + 4H2↑12、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑13、氧化钙与水反应:CaO + H2O = Ca(OH)214、氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2O15、氧化铝与盐酸反应:Al2O3 + 6HCl = 2AlCl3 + 3H2O16、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH = 2NaAlO2 + H2O17、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl18、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO419、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)320、氢氧化铁加热分解:2Fe(OH)3 △Fe2O3 + 3H2O↑21、实验室制取氢氧化铝:Al2(SO4)3 + 6NH3·H2O = 2Al(OH)3↓ + 3(NH3)2SO422、氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl3 + 3H2O23、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH = NaAlO2 + 2H2O24、氢氧化铝加热分解:2Al(OH)3 △Al2O3 + 3H2O25、三氯化铁溶液与铁粉反应:2FeCl3 + Fe = 3FeCl226、氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl327、二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4 + 2H2O硅单质与氢氟酸反应:Si + 4HF = SiF4 + 2H2↑28、二氧化硅与氧化钙高温反应:SiO2 + CaO 高温CaSiO329、二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2O30、往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓31、硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓32、氯气与金属铁反应:2Fe + 3Cl2 点燃2FeCl333、氯气与金属铜反应:Cu + Cl2 点燃CuCl234、氯气与金属钠反应:2Na + Cl2 点燃2NaCl35、氯气与水反应:Cl2 + H2O = HCl + HClO36、次氯酸光照分解:2HClO 光照2HCl + O2↑37、氯气与氢氧化钠溶液反应:Cl2 + 2NaOH = NaCl + NaClO + H2O38、氯气与消石灰反应:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O39、盐酸与硝酸银溶液反应:HCl + AgNO3 = AgCl↓ + HNO340、漂白粉长期置露在空气中:Ca(ClO)2 + H2O + CO2 = CaCO3↓ + 2HClO41、二氧化硫与水反应:SO2 + H2O ≈ H2SO342、氮气与氧气在放电下反应:N2 + O2 放电2NO43、一氧化氮与氧气反应:2NO + O2 = 2NO244、二氧化氮与水反应:3NO2 + H2O = 2HNO3 + NO45、二氧化硫与氧气在催化剂的作用下反应:2SO2 + O2 催化剂2SO346、三氧化硫与水反应:SO3 + H2O = H2SO447、浓硫酸与铜反应:Cu + 2H2SO4(浓) △CuSO4 + 2H2O + SO2↑48、浓硫酸与木炭反应:C + 2H2SO4(浓) △CO2 ↑+ 2SO2↑ + 2H2O49、浓硝酸与铜反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2H2O + 2NO2↑50、稀硝酸与铜反应:3Cu + 8HNO3(稀) △3Cu(NO3)2 + 4H2O + 2NO↑51、氨水受热分解:NH3·H2O △NH3↑ + H2O52、氨气与氯化氢反应:NH3 + HCl = NH4Cl53、氯化铵受热分解:NH4Cl △NH3↑ + HCl↑54、碳酸氢氨受热分解:NH4HCO3 △NH3↑ + H2O↑ + CO2↑55、硝酸铵与氢氧化钠反应:NH4NO3 + NaOH △NH3↑ + NaNO3 + H2O56、氨气的实验室制取:2NH4Cl + Ca(OH)2 △CaCl2 + 2H2O + 2NH3↑57、氯气与氢气反应:Cl2 + H2 点燃2HCl58、硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH △2NH3↑ + Na2SO4 + 2H2O59、SO2 + CaO = CaSO360、SO2 + 2NaOH = Na2SO3 + H2O61、SO2 + Ca(OH)2 = CaSO3↓ + H2O62、SO2 + Cl2 + 2H2O = 2HCl + H2SO463、SO2 + 2H2S = 3S + 2H2O64、NO、NO2的回收:NO2 + NO + 2NaOH = 2NaNO2 + H2O65、Si + 2F 2 = SiF466、Si + 2NaOH + H2O = NaSiO3 +2H2↑67、硅单质的实验室制法:粗硅的制取:SiO2 + 2C 高温电炉Si + 2CO (石英沙)(焦碳)(粗硅)粗硅转变为纯硅:Si(粗)+ 2Cl2 △SiCl4SiCl4 + 2H2 高温Si(纯)+ 4HCl化合反应:1、镁在空气中燃烧:2Mg + O2 点燃2MgO2、铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O43、铝在空气中燃烧:4Al + 3O2 点燃2Al2O34、氢气在空气中燃烧:2H2 + O2 点燃2H2O5、红磷在空气中燃烧:4P + 5O2 点燃2P2O56、硫粉在空气中燃烧:S + O2 点燃SO27、碳在氧气中充分燃烧:C + O2 点燃CO28、碳在氧气中不充分燃烧:2C + O2 点燃2CO9、二氧化碳通过灼热碳层:C + CO2 高温2CO10、一氧化碳在氧气中燃烧:2CO + O2 点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO312、生石灰溶于水:CaO + H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4?5H2O14、钠在氯气中燃烧:2Na + Cl2点燃2NaCl分解反应15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O+ O2↑16、加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑17、水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑18、碳酸不稳定而分解:H2CO3 === H2O + CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3 高温CaO + CO2↑置换反应20、铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu21、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 == ZnSO4 + H2↑22、镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑23、氢气还原氧化铜:H2 + CuO 加热Cu + H2O24、木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑25、甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O26、水蒸气通过灼热碳层:H2O + C 高温H2 + CO27、焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH + CuSO4 == Cu(OH)2↓ + Na2SO429、甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O30、酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2 + 3H2O31、一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO232、一氧化碳还原氧化铁:3CO+ Fe2O3 高温2Fe + 3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2 ==== Na2CO3 + H2O35、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 + 2HCl === CaCl2+ H2O + CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑一、物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O2 点燃2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O43. 铜在空气中受热:2Cu + O2 加热2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃2H2O6. 红磷在空气中燃烧:4P + 5O2 点燃2P2O57. 硫粉在空气中燃烧:S + O2 点燃SO28. 碳在氧气中充分燃烧:C + O2 点燃CO29. 碳在氧气中不充分燃烧:2C + O2 点燃2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 点燃2CO211. 甲烷在空气中燃烧:CH4 + 2O2 点燃CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃2CO2 + 3H2O二.几个分解反应:13. 水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑14. 加热碱式碳酸铜:Cu2(OH)2CO3 加热2CuO + H2O + CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2 ↑16. 加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2 + O2↑17. 碳酸不稳定而分解:H2CO3 === H2O + CO2↑18. 高温煅烧石灰石:CaCO3 高温CaO + CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2 + CuO 加热Cu + H2O20. 木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温4Fe + 3CO2↑22. 焦炭还原四氧化三铁:2C+ Fe3O4 高温3Fe + 2CO2↑23. 一氧化碳还原氧化铜:CO+ CuO 加热Cu + CO224. 一氧化碳还原氧化铁:3CO+ Fe2O3 高温2Fe + 3CO225. 一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温3Fe + 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+ 酸-------- 盐+ 氢气(置换反应)26. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑27. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑28. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑29. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑31. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑32. 镁和稀盐酸M g+ 2HCl === MgCl2 + H2↑33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑(2)金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg(3)碱性氧化物+酸-------- 盐+ 水37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物+碱-------- 盐+ 水43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O 44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O(5)酸+ 碱-------- 盐+ 水48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸+ 盐-------- 另一种酸+ 另一种盐59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HN O363.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl(7)碱+ 盐-------- 另一种碱+ 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO466.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH(8)盐+ 盐----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO3 71.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2 + H2O === H2CO373.生石灰溶于水:CaO + H2O === Ca(OH)274.氧化钠溶于水:Na2O + H2O ==== 2NaOH75.三氧化硫溶于水:SO3 + H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4?5H2O 加热CuSO4 + 5H2O77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4?5H2化学方程式、反应现象、应用2Mg+O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg+O2点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+O2点燃或Δ2CuO 红色金属变为黑色固体4Al+3O2点燃或Δ2Al2O3 银白金属变为白色固体3Fe+2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热4Fe + 3O2高温2Fe2O3 C+O2 点燃CO2 剧烈燃烧、白光、放热、使石灰水变浑浊S+O2 点燃SO2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2+O2 点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P+5O2 点燃2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+5O2点燃2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2 Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ K2MnO4+MnO2+O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气2HgOΔ2Hg+O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+O2↑ 水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO+H2O+CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+ H2O +CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+H2SO4=ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe+H2SO4=FeSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解Mg+H2SO4 =MgSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解2Al+3H2SO4=Al2(SO4)3+3H2↑ 有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2 Δ 2Fe+3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4+4H2 Δ3Fe+4H2O 黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性WO3+3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性MoO3+3H2 ΔMo +3H2O 冶炼金属钼、利用氢气的还原性2Na+Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl2 点燃或光照2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2C O+O2点燃2CO2 蓝色火焰煤气燃烧C + CuO 高温2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+3C 高温4Fe+ 3CO2↑ 冶炼金属Fe3O4+2C高温3Fe + 2CO2↑ 冶炼金属C + CO2 高温2COCO2 + H2O = H2CO3 碳酸使石蕊变红证明碳酸的酸性H2CO3 ΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3+H2O+CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓+H2O+CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+H2O+CO2↑ 产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 高温CaO+ CO2↑ 工业制备二氧化碳和生石灰CaCO3+2HCl=CaCl2+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理Na2CO3+2HCl=2N aCl+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理MgCO3+2HCl=MgCl2+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体CuO +COΔ Cu + CO2 黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属Fe2O3+3CO高温2Fe+3CO2 冶炼金属原理Fe3O4+4CO高温3Fe+4CO2 冶炼金属原理WO3+3CO高温W+3CO2 冶炼金属原理CH3COOH+NaOH=CH3COONa+H2O2CH3OH+3O2点燃2CO2+4H2OC2H5OH+3O2点燃2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧Fe+CuSO4=Cu+FeSO4 银白色金属表面覆盖一层红色物质湿法炼铜、镀铜Mg+FeSO4= Fe+ MgSO4 溶液由浅绿色变为无色Cu+Hg(NO3)2=Hg+ Cu (NO3)2 Cu+2AgNO3=2Ag+ Cu(NO3)2 红色金属表面覆盖一层银白色物质镀银Zn+CuSO4= Cu+ZnSO4 青白色金属表面覆盖一层红色物质镀铜Fe2O3+6HCl=2FeCl3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl=2AlCl3+3H2O 白色固体溶解Na2O+2HCl=2NaCl+H2O 白色固体溶解CuO+2HCl=CuCl2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HCl=ZnCl2+ H2O 白色固体溶解MgO+2HCl=MgCl2+ H2O 白色固体溶解CaO+2HCl=CaCl2+ H2O 白色固体溶解NaOH+HCl=NaCl+ H2O 白色固体溶解Cu(OH)2+2HCl=CuCl2+2H2O 蓝色固体溶解Mg(OH)2+2HCl=MgCl2+2H2O 白色固体溶解Al(OH)3+3HCl=AlCl3+3H2O 白色固体溶解胃舒平治疗胃酸过多Fe(OH)3+3HCl=FeCl3+3H2O 红褐色沉淀溶解、溶液呈黄色Ca(OH)2+2HCl=CaCl2+2H2OHCl+AgNO3= AgCl↓+HNO3 生成白色沉淀、不溶解于稀硝酸检验Cl—的原理Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解CuO+H2SO4=CuSO4+H2O 黑色固体溶解、溶液呈蓝色ZnO+H2SO4=ZnSO4+H2O 白色固体溶解MgO+H2SO4=MgSO4+H2O 白色固体溶解2NaOH+H2SO4=Na2SO4+2H2OCu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解Ca(OH)2+H2SO4=CaSO4+2H2OMg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解、溶液呈黄色Ba(OH)2+ H2SO4=BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理BaCl2+ H2SO4=BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Na2O+2HNO3=2NaNO3+H2O 白色固体溶解CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解NaOH+HNO3=NaNO3+ H2OCu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解Ca(OH)2+2HNO3=Ca(NO3)2+2H2OFe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解、溶液呈黄色3NaOH + H3PO4=3H2O + Na3PO43NH3+H3PO4=(NH4)3PO42NaOH+CO2=Na2CO3+ H2O 吸收CO、O2、H2中的CO2、2NaOH+SO2=Na2SO3+ H2O 2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)FeCl3+3NaOH=Fe(OH)3↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成AlCl3+3NaOH=Al(OH)3↓+3NaCl 有白色沉淀生成MgCl2+2N aOH = Mg(OH)2↓+2NaClCuCl2+2NaOH = Cu(OH)2↓+2NaCl 溶液蓝色褪去、有蓝色沉淀生成CaO+ H2O = Ca(OH)2 白色块状固体变为粉末、生石灰制备石灰浆Ca(OH)2+SO2=CaSO3↓+ H2O 有白色沉淀生成初中一般不用Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 有白色沉淀生成工业制烧碱、实验室制少量烧碱Ba(OH)2+Na2CO3=BaCO3↓+2NaOH 有白色沉淀生成Ca(OH)2+K2CO3=CaCO3↓ +2KO H 有白色沉淀生成CuSO4+5H2O= CuSO4?H2O 蓝色晶体变为白色粉末CuSO4?H2OΔ CuSO4+5H2O 白色粉末变为蓝色检验物质中是否含有水AgNO3+NaCl = AgCl↓+Na NO3 白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子BaCl2 + Na2SO4 = BaSO4↓+2NaCl 白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子CaCl2+Na2CO3= CaCO3↓+2NaCl 有白色沉淀生成MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓ 有白色沉淀生成CaCO3+2HCl=CaCl2+H2O+CO2 ↑MgCO3+2HCl= MgCl2+H2O+ CO2 ↑NH4NO3+NaOH=NaNO3+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体应用于检验溶液中的铵根离子NH4Cl+ KOH= KCl+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体。
2012年高考化学知识点总汇

2012年高考化学知识点总汇一.俗名无机部分:纯碱、苏打、天然碱、口碱:Na2CO3小苏打:NaHCO3大苏打:Na2S2O3石膏(生石膏):CaSO4.2H2O 熟石膏:2CaSO4·.H2O 莹石:CaF2重晶石:BaSO4(无毒)碳铵:NH4HCO3 石灰石、大理石:CaCO3生石灰:CaO 食盐:NaCl 熟石灰、消石灰:Ca(OH)2芒硝:Na2SO4·7H2O (缓泻剂) 烧碱、火碱、苛性钠:NaOH 绿矾:FaSO4·7H2O 干冰:CO2明矾:KAl (SO4)2·12H2O 漂白粉:Ca (ClO)2、CaCl2(混和物)泻盐:MgSO4·7H2O 胆矾、蓝矾:CuSO4·5H2O 双氧水:H2O2皓矾:ZnSO4·7H2O 硅石、石英:SiO2刚玉:Al2O3 水玻璃、泡花碱、矿物胶:Na2SiO3铁红、铁矿:Fe2O3磁铁矿:Fe3O4黄铁矿、硫铁矿:FeS2铜绿、孔雀石:Cu2 (OH)2CO3菱铁矿:FeCO3赤铜矿:Cu2O 波尔多液:Ca (OH)2和CuSO4石硫合剂:Ca (OH)2和S 玻璃的主要成分:Na2SiO3、CaSiO3、SiO2过磷酸钙(主要成分):Ca (H2PO4)2和CaSO4重过磷酸钙(主要成分):Ca (H2PO4)2天然气、沼气、坑气(主要成分):CH4水煤气:CO和H2硫酸亚铁铵(淡蓝绿色):Fe (NH4)2 (SO4)2溶于水后呈淡绿色光化学烟雾:NO2在光照下产生的一种有毒气体王水:浓HNO3与浓HCl按体积比1:3混合而成。
铝热剂:Al + Fe2O3或其它氧化物。
尿素:CO(NH2) 2有机部分:氯仿:CHCl3电石:CaC2电石气:C2H2 (乙炔) TNT:三硝基甲苯酒精、乙醇:C2H5OH氟氯烃:是良好的制冷剂,有毒,但破坏O3层。
醋酸:冰醋酸、食醋CH3COOH裂解气成分(石油裂化):烯烃、烷烃、炔烃、H2S、CO2、CO等。
补钠量计算公式

补钠量计算公式在医学领域,尤其是涉及到电解质平衡的问题时,补钠量的计算可是个相当重要的环节。
这就不得不提到补钠量计算公式啦。
先来说说为啥要算这个补钠量。
咱就拿个真实例子来说吧,之前有个病人,因为长期腹泻,整个人都没精打采的,到医院一检查,发现钠流失过多,导致身体各种不舒服。
这时候,医生就得通过计算补钠量,来给他精准地补充钠离子,让他的身体重新找回平衡。
那补钠量到底咋算呢?一般来说,常用的补钠量计算公式是:需补充的钠量(mmol)=(血钠的正常值 - 实测血钠值)×体重(kg)×0.6(女性为 0.5)。
比如说,有个体重 60 公斤的男性,实测血钠值是 125mmol/L,而血钠的正常值一般是 135 - 145mmol/L,咱们就取个中间值 140mmol/L 来计算。
那需补充的钠量就是(140 - 125)× 60 × 0.6 = 540mmol。
但这里要注意啦,这只是个大概的计算,实际情况可复杂得多。
因为在计算补钠量的时候,还得考虑病人的肾功能、酸碱平衡状态,以及是急性还是慢性的钠缺失等等因素。
就像之前碰到的另一个病例,一个年轻小伙子,因为剧烈运动后大量出汗,又没及时补充水分和电解质,也出现了低钠血症。
但他身体好,肾功能正常,所以在计算补钠量的时候,就得适当调整一下,不能完全按照公式死板地来。
而且,在补充钠的时候,速度也不能太快。
太快了,身体可能受不了,会引发各种问题。
这就好比开车,猛地一脚油门,车可能会失控;补钠也是一样,得稳稳当当的。
总之,补钠量的计算虽然有公式可循,但也不能生搬硬套,得根据每个病人的具体情况,综合各种因素,灵活运用,才能让病人尽快恢复健康。
所以啊,医生们在面对需要补钠的病人时,那可真是得小心翼翼,反复斟酌,就像走在钢丝上一样,稍有不慎,就可能影响病人的治疗效果。
这也充分说明了医学的严谨和复杂,每一个数字,每一个决策,都关乎着病人的健康和生命。
增溶的措施

增溶的措施1. 引言在化学和生物科学研究中,往往需要溶解难溶性物质以便进行后续实验或分析。
然而,某些物质存在着较低的溶解度,这使得它们在溶液中不能完全溶解。
为了克服这一难题,科学家们经过长期研究发展了各种增溶的措施。
本文将介绍一些常见的增溶技术,并对每种技术的原理和适应范围进行详细讨论。
2. 离子强度的调整离子强度是用来描述溶液中离子浓度的指标。
增加溶液的离子强度可以促进难溶物质的溶解。
以下是几种调整离子强度的常见方法:•加盐法:在溶液中添加适量的盐类,如氯化铵、氯化钠等。
这些盐类会在溶液中离解成离子,增加溶液中的离子数量,从而提高溶液的离子强度,促进难溶物质的溶解。
•酸碱调节:根据物质的酸碱性质,可以通过调节溶液的pH值来改变离子强度。
一般来说,酸性条件下,酸性物质更容易溶解,而碱性条件下,碱性物质更容易溶解。
•温度调节:温度的升高可以增加溶解物质和溶剂之间的分子热运动,从而有利于难溶物质的溶解。
根据溶解热的温度依赖性,适量升高温度可使溶解热增大,增加溶解度。
3. 溶剂的选择选择合适的溶剂也是增溶的重要考虑因素。
以下是一些常见的溶剂选择策略:•极性溶剂:对于许多无机物质来说,极性溶剂是增溶的首选。
极性溶剂指的是具有较强极性的溶剂,如水、醇类等。
这些溶剂具有较高的溶解能力,可以与难溶物质中的离子作用,促进其溶解。
•非极性溶剂:对于某些有机物质来说,非极性溶剂可能更适合作为增溶的溶剂。
非极性溶剂指的是没有或极少极性的溶剂,如石油醚、甲烷等。
这些溶剂可以与有机物质分子间相互作用,提供足够的解离能力,从而促进其溶解。
•混合溶剂:有时候,将两种或多种溶剂混合使用可以使增溶效果更好。
比如,将极性溶剂和非极性溶剂以一定的比例混合使用,可以同时提供溶解能力和溶解热,从而增加溶解度。
4. 超声波辅助溶解超声波辅助溶解是一种常用的增溶技术,它通过超声波的机械作用提高溶质在溶剂中的溶解度。
具体原理如下:超声波产生的机械振动会在溶液中引起局部的压力变化和液体的剪切力,从而破坏溶质的固体结构。
低钠血症补钠的注意点

低钠血症补钠的注意点1、补钠的速度不宜过快:急性低钠血症,纠正速度在每小时血钠提升1-2mmol/L为宜,急性低钠血症纠正到130mmol/L即可。
慢性低钠血症,纠正速度每小时血钠提升0.5mmol/L为宜,慢性低钠血症纠正到125mmol/L 以上即可。
血钠提升速度:24h内浓度升高8-10mmol/L为安全速度。
2、渗透性脱髓鞘综合征通常可以通过限制纠正低钠血症的速度来避免, 即24h浓度提升<10-12mmol/L, 在48h浓度提升<18mmol/L。
但应注意此为纠正低钠血症的最大速度限度而非治疗目标。
注意在纠正低钠血症的过程中谨防渗透性脱髓鞘综合征的发生。
3、口服补钠纠正低钠最为安全,但速度相对较慢。
4、注意同时补钾、补镁,维持酸碱平衡。
5、补钠必须输液泵泵入。
6、定时复查:在纠正低钠血症的过程中应每2-4h检测血钠,同时检测钾、氯、镁、钙,保持酸碱平衡。
7、尿量突然增加>100ml/h,提示血钠有快速增加危险,如尿量突然增加,建议每2h监测血钠。
8、血液动力学不稳定时,遇到低钠血症,快速液体复苏比快速纠正低钠血症更重要。
9、如果患者同时有低钾血症,纠正低钾血症也可能使血钠增加。
10、补钠补入途径建议中心静脉或PICC, 避免外周补入引起的外渗。
11、补钠过程中严密监测患者生命体征变化,特别是意识的改变,及时评估。
补液浓度:以3%~5%高渗盐水在6小时内缓慢静脉输注,使血清钠浓度增加10mmol/L或达到120~125mmol/L水平,血钠浓度增高过快至125mmol/L以上可能有害。
如担心患者存在容量过负荷风险,可辅以利尿剂。
补液速度:有关低钠血症的纠正速度,目前尚有争议,紧急治疗时,在最初4~6小时内补充3%氯化钠,使每小时血钠升高控制在1~2mmol/L以内。
一旦症状缓解完成低钠血症的急性期治疗后,则应转向针对病因的治疗,减缓纠钠速度,24小时内血钠升高应控制在8~12mmol/L以内,不超过12mmol/L。
高考化学专题训练---钠及其化合物的综合题分类及详细答案

高考化学专题训练---钠及其化合物的综合题分类及详细答案一、高中化学钠及其化合物1.品牌膨松剂中发挥作用的物质为碳酸氢钠。
某化学兴趣小组利用下列有关装置,加热该膨松剂样品,通过放出气体的量来检验其品质。
(1)装置D仪器的名称是_________。
(2)装置E中所盛试剂为____________,其作用是______________。
(3)装置的连接顺序为_____________(填装置序号)。
(4)实验过程中,装置A中发生反应的化学方程式为________________。
(5)实验过程中必须向装置内通入空气,装置C的作用是除去空气中的________(填化学式)。
加热前,通入一段时间空气的具体操作为________________________。
【答案】干燥管浓硫酸干燥CO2 CAEBD 2NaHCO3Na2CO3+H2O+CO2↑ CO2先对装置A、C和E通入一段时间的空气,再连接上装置B、D【解析】【分析】碳酸氢钠不稳定,分解生成二氧化碳和水,可测定水或二氧化碳的质量以判断碳酸氢钠的含量,实验时,应用C装置排出装置内的水、二氧化碳,加热A,生成的水可用E干燥,二氧化碳可用B装置吸收,最后连接D,以免空气中的水、二氧化碳进入B,避免实验误差,根据固体质量的变化,可测得碳酸氢钠的含量,以此解答该题;【详解】(1)由仪器图可知D为干燥管;答案为:干燥管;(2)装置E为浓硫酸,可用于干燥二氧化碳;答案为:浓硫酸;干燥CO2;(3)由以上分析可知连接的顺序为CAEBD;答案为:CAEBD;(4)碳酸氢钠不稳定,加热分解生成碳酸钠、水和二氧化碳,装置A中发生反应的化学方程式为2NaHCO3===∆Na2CO3+H2O+CO2↑;答案为:2NaHCO3===∆Na2CO3+H2O+CO2↑;(5)装置C的作用是除去空气中的二氧化碳,加热前,通入一段时间空气的具体操作为先对装置A、C 和E通入一段时间的空气,再连接上装置B、D;答案为:CO2 ;先对装置A、C 和E通入一段时间的空气,再连接上装置B、D。
酸溶过程中加快溶解的方法

酸溶过程中加快溶解的方法
1.加速酸溶过程
由于酸类物质极具腐蚀性,因此必须在使用时注意安全,而降低酸的溶解时间也是很必要的。
高浓度的酸能够加速溶解的过程,但如果过高会影响酸的生成效率;同时酸的温度也是影响其溶解速度的因素。
以下是一些加速酸溶过程的方法:
1.1使用热水加热
加热是增加酸溶解速度的最常用方法,当把酸加到热水中时,温度能够促使酸分子解离,从而提高溶解速度。
1.2加入表面活性剂
表面活性剂能够和水构成好的溶液体系,能够增加酸的水溶性,从而加快溶解的速度。
1.3使用加工技术
可以采用一些物理加工技术,如研磨、砂光等,以创造高比表面积,而有高比表面积的物质接触面积更大,可以对物体进行更快更完整的溶解。
1.4研磨助剂
研磨助剂可以具有催化、分散等一系列功效,进一步可以加速酸溶解过程,但原料本身的适宜性是使用助剂的前提。
以上就是加速酸溶过程的几种方法,可以根据不同的酸和实际情况来采取恰当的方法,有效的加速酸的溶解过程,降低危害和风险。
酸碱盐的溶解性口诀大全

精心整理酸碱盐的溶解性口诀大全溶解性用来判断复分解反响可否发生,假如生成物中有难溶性的物质而反响物中没有,那么反应就能够发生钾钠硝酸溶,铵盐也同样。
氯除银亚汞,硫酸除钡铅。
磷酸碳酸盐,钾钠氨才溶。
钾钠钡氨钙,溶碱有五种。
解说:就是钾盐、钠盐、硝酸盐、铵盐都是可溶的盐酸盐除了氯化银和氯化亚汞都是可溶的硫酸盐除硫酸钡和硫酸铅都可溶磷酸盐和碳酸盐除了含有钾、钠、铵根离子外都是不溶的氢氧化钾、氢氧化钠、氢氧化钡、氨水、氢氧化钙这五种碱溶于水钾钠铵盐皆可溶硝酸盐入水影无踪氯化物不溶氯化银硫酸盐不溶硫酸钡碳酸盐只溶钾钠铵可溶碱有四位钾钠和钙钡钾钠铵盐均可溶硝酸盐遇水无影踪盐酸盐不溶 AgCl硫酸盐不溶 BaSO4碳酸盐只溶钾钠铵带 K+.NH4+.Na+ 离子菂盐都溶于水 .带 NO3+ 根离子菂盐都溶于水 .带 Cl-离子菂盐中只有 AgCl 不溶 .带 SO42- 离子菂带 CO32- 离子菂盐中只有 K2CO3.Na2CO3.(NH4)2CO3 溶于水 .例子 BaCl2+Na2SO4===BaSO4↓+2NaCl(复分解反应条件为反响物都可溶.而生成物中必定要有气体或水 .或积淀 )因此记溶解表最主假如理解什么和什么能够反应.什么和什么不可以反应.并且除杂多半要把杂质以积淀或许气体菂方式滤出或排出 ..背诵口诀1.钾钠铵盐都可溶,氯化物不溶氯化银硫酸盐钙银微溶钡不溶硝酸盐遇水影无踪碳酸盐除钾钠铵都不溶氢氧化钙是微溶钾钠钡钙碱可溶红褐铁,蓝絮铜其余积淀白色呈注:1.初顶用够了,红褐铁,代表铁盐积淀为红褐色【fe(oh)2 氢氧化亚铁除外】,蓝絮铜代表,铜盐为蓝色絮状积淀。
2.氯化银【不溶酸】,碳酸钙,碳酸钡,硫酸钡【不溶酸】,氢氧化铝,氢氧化镁,为白色积淀。
氢氧化铁(红褐色)氢氧化铜(蓝色)说明【】内为前一物质的特色2.钾钠铵盐全都溶碳酸除镁是微溶其余全都不可以溶AgCl 、BaSO4 酸也不溶磷酸盐,更不溶3.钾钠铵硝溶氯化去银汞硫酸除钡铅碳酸多不溶溶碱有 5种钾钠铵钡钙溶:氢氧铵钾钠钡钙,碳酸氢铵钾钠镁4.钾钠铵盐硝酸盐,全都溶于水中间;溶碱钾钠钡钙铵,碳酸只溶钾钠铵;硫酸盐中钡不溶,氯化物中银也难;常有诸酸皆可溶,记着挥酸盐硝碳。
江阴市长山中学高中化学必修一第二章《海水中的重要元素—钠和氯》测试(含解析)

一、填空题1.(1)铁在氯气中加热的化学方程式为:___________(2)碳酸氢钠受热分解的化学方程式为:___________(3)实验室制备高铁酸钾的原理为 Cl 2+Fe(OH)3+KOH→K 2FeO 4+KCl+H 2O ,该反应的离子方程式为:___________(4)若温度超过40℃,Cl 2与NaOH 溶液反应生成NaClO 3和NaCl ,该反应的离子方程式为:___________(5)写出Cu 在H 2O 2作用下和稀硫酸反应生成硫酸铜的化学方程式:___________(6)0.2molCO 2通入100mL3mol/L 的NaOH 溶液,该反应的离子方程式为_________________2.可用氨气跟氧化铜反应制备纯净氮气,其反应为:2NH 3 + 3CuOΔN 2 + 3Cu + 3H 2O 。
回答下列问题:(1)标准状况下,6.72 L N 2的物质的量是____mol 。
(2)80 g CuO 中含有的Cu 2+的数目为____。
(3)相同物质的量的NH 3和H 2O 的分子的个数比是____,它们的质量比是____。
(4)标准状况下,将2.24 L NH 3溶于水配制成100 mL 的溶液,其溶质的物质的量浓度为____mol·L -1。
(5)用双线桥表示电子转移的方向和数目:2NH 3 + 3CuOΔN 2 + 3Cu + 3H 2O ________________________________________。
3.(1)在标准状况下,①14g 氮气 ②67.2L 2CO ③239.0310 个3NH 分子,含分子数最多的是(填序号,下同)__________,质量最大的是__________,体积最小的是__________;(2)同温同压下,质量相同的CO 和4CH 气体的体积之比为__________;(3)用足量2BaCl 溶液分别与相同体积的硫酸铝、硫酸锌和硫酸钠三种溶液充分反应,生成4BaSO 沉淀的质量之比为1:2:1,则三种溶液中溶质的物质的量浓度之比依次是_____________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
NEPHROLOGY-CASE REPORTCentral pontine and extrapontine myelinolysis secondary to fast correction of severe hyponatremia and hypokalemia in an alcoholic patientAhmad Ghaith Tarakji•Ahmad Raed Tarakji•Uzma ShaheenReceived:2May2011/Accepted:4November2012ÓSpringer Science+Business Media Dordrecht2012ObjectiveTo confirm the importance of slow correction of serum sodium and potassium by describing a case of a woman with chronic alcoholism and malnutrition who developed central pontine and extrapontine myelinol-ysis(CPM)after fast correction of severe hyponatre-mia and hypokalemia.Case reportA59-year-old white alcoholic female was transferred to ER by ambulance at04:52 a.m.for lethargy, disorientation,weakness,falls,and headache for few days.She was only drinking alcohol for few days but not eating.She had history of hypertension,and she was taking Lorazepam2mg thrice daily,Ramipril 2.5mg once daily and Hydrochlorothiazide12.5mg once daily.Her initial vital signs by paramedics revealed BP of124/56mmHg,pulse of75bpm,and temperature of36.7°C.Her weight was60kg,and her height was161cm.Her Glasgow Coma Scale was13/15.On examination,the patient was con-fused,only oriented to place and had slurred speech and multiple bruises of different ages.Her pupils were5mm,equal and reactive to light.No other significantfindings were found.Initial laboratory results are shown in Table1.Intravenousfluids were started asfirst line of1L of Normal Saline with40mEq of KCl at100mL/h and second line of250mL of Normal Saline with40mEq of KCl at50mL/h.Head CT scan was negative for acute hemorrhage,infarct,or edema.Thiamine 100mg IVP was given,and third IV line was then initiated with1L of Saline with40mEq of KCl at 100mL/h.Her blood pressure suddenly dropped to 82/44mmHg,so a bolus of Normal Saline500mL was given,and her blood pressure improved to 152/87mmHg within15min.She was transferred to ICU where she additionally received IV magnesium sulfate,oral potassium chloride,and oral sodium phosphate replacements.Serial blood chemistry tests were done,and IVfluid types and rates were adjusted accordingly.During thefirst day,she excreted a large amount of diluted urine which could be secondary to a quick decrease in serum vasopressin level when herA.G.TarakjiAleppo University,Aleppo,SyriaA.R.TarakjiDepartment of Medicine,Yarmouth Regional Hospital, Yarmouth,NS,CanadaA.R.Tarakji(&)Nephrology and Hypertension Maritime Clinic, Yarmouth Regional Hospital,60Vancouver Street, Suite405,Yarmouth,NS B5A2P5,Canadae-mail:dartmo@U.ShaheenDepartment of Diagnostic Imaging,Yarmouth Regional Hospital,Yarmouth,NS,Canada DOI10.1007/s11255-012-0329-3volume status had improved(Table2).Therefore,her serum sodium and potassium were corrected so fast over the next48h as in Fig.1.However,her serum phosphorus was corrected slowly over the next5days (Day2:0.18(nadir),Day3:0.35,Day4:0.76,and Day 5:1.20mmol/L).Over the next3days,she had improved with no alcohol withdrawal symptoms but she was still weak requiring physiotherapy.On8th hospital day,she started with slurred speech again with difficulty swallowing and drooling.MRI study of the brain was ordered,and thefindings were consistent with CPM as in Fig.2.She received continuous rehabili-tation and supportive care by interdisciplinary team with slow recovery and improvement.A repeat MRI study of the brain after3months showed a degree of improvement of the CPMfindings,and she was eventually discharged home after5months. DiscussionOur case is a typical one for CPM in an alcoholic mp and Yazdi[1]found that chronic alcoholism and correction of hyponatremia are com-mon with an incidence of39.4and21.5%,respec-tively,in442documented cases of CPM between1986 and2001.The literature suggests that‘‘increases of10–12mEq/L within24h and increases ofTable1Blood and urine tests resultsBloodTest(normal range)Result Test(normal range)ResultNa?(136–145mmol/L)100INR(0.8–1.3)0.9 K?(3.6–5.2mmol/L) 1.7CPK(21–215U/L)3,895 Cl-(98–107mmol/L)57Alb(35–47g/L)38 Total CO2(21–32mmol/L)29Etoh(0.0–0.0mmol/L)0.4 Urea(3.0–7.9mmol/L) 3.7TSH(0.465–4.680mIU/L)0.448 Creatinine(53–115l mol/L)40FT4(10.0–28.2pmol/L)14.4 Random glucose(3.9–6.0mmol/L) 5.2Osmolality(266–298mmol/Kg)200 Mg(0.74–0.99mmol/L)0.69Phos(0.81–1.58mmol/L)0.36 Ca(2.10–2.70mmol/L) 2.08Arterial blood gasPH(7.35–7.45)7.57PO2(83–108mmHg)63.5 PCO2(32–45mmHg)35.3O2sat(95.0–99.0%)95% Lactate(0.5–1.6mmol/L)0.8FIO2RA Urine(random sample)Specific gravity(\1.005–1.025) 1.015Osmolality(50–1,400mmol/Kg)416 PH(5–8.5) 6.5Na?(mmol/L)15 Protein(\0.1g/L)0.3K?(mmol/L)27 Glucose(\5.5mmol/L)Neg Cl-(mmol/L)64 Ketones(\0.5mmol/L) 3.9Urea(mmol/L)226Abnormal values in italicizedTable2Fluid balance in thefirst two days1st Day2nd DayTotalfluid intake5,010mL3,503mLPO850mL1,100mLIV NS?40mEq KCl/L2,329mL1,422mLIV NS?40mEq KCl/L590mL–IV NS?40mEq KCl/250mL250mL–IV D5W991mL981mLTotalfluid output4,830mL2,600mLAverage blood pressure111/64117/7318–25mEq/L within48h are sufficient to cause this syndrome’’[2]as happened with our patient.Recently,it has been recognized that correction of hypokalemia is similarly important as discussed by Berl and Rastegar[3]in their teaching case.Because sodium is mainly an extracellular cation and potas-sium is mainly an intracellular cation,loss of either one of these cations without water loss can lead to hypoosmolality.So,replacing serum potassium can play a significant role in correcting serum sodium as they showed with their calculation.Therefore,they recommended to modify the above rule as‘‘in chronic hyponatremia(duration[48h),the increase in serum sodium plus potassium levels should not exceed 12mEq/L in thefirst24h and18mEq/L in thefirst 48h’’[3].Even though that our patient had initially received Normal Saline(0.9%),instead of3%saline,then almost1L of5%dextrose in water(D5W) (Table2),her serum sodium was corrected quickly partially due to large urine output in thefirst day (almost5L).Unfortunately,repeated urine electro-lytes and osmolality measurements were not done serially to guide herfluid administration.However, she was not given Desmopressin as was recom-mended by Sterns and Hix[4].They stressed that ‘‘fear of osmotic demyelination does not justify therapeutic inaction(and)fear of complications from hyponatremic encephalopathy does not justify ther-apeutic excess’’[4].Our case is a good example of their strong recommendation that‘‘overcorrection of hyponatremia should be viewed as a medical emer-gency’’[4]since there is some animal evidence that intervening might decrease mortality[5].Furthermore,although it was corrected slowly in our case,severe hypophosphatemia probably contrib-uted to the development of CPM as suggested from cases report of CPM associated with isolated severely low serum phosphorus[6].Pontine myelinolysis usually affects corticobulbar fibers and corticospinal tracts causing dysarthria, dysphagia,andflaccid quadraparesis.Extrapontine involvement causes tremor and ataxia and can lead to movement disorders[7].It was reported that the initial lesions and the duration of these lesions on MRI do not correlate with severity of clinicalfindings or their improvement and the survival depends on the second-ary complications of this disease[8].ConclusionThis case is typical for central pontine and extrapon-tine myelinolysis secondary to rapid correction of serum sodium,potassium,and osmolality.Extreme caution with vigilance in correcting these serumcations together as suggested above is strongly recommended to avoid this disastrous,and sometimes fatal [9],complication.Conflict of interest The authors declare that they have no conflict of interest.Referencesmp C,Yazdi K (2002)Central pontine myelinolysis.Eur Neurol 47:3–102.Palmer BF,Sterns RH (2009)Fluid,electrolytes,and acid-base disturbances.Nephrol Self Assess Progr8:117–121Fig.2Head MRI.a Axial T2image shows central pontine hyperintensity with relative sparing ofcorticospinal tracts.b This lesion is hypointense on Sagittal T1-weighted image.c ,d On DWI axial images,restricted diffusion is noted at the periphery of this lesion and at the posterior and lateral aspects of thalami while the central part of this lesion is isointense on DWI sequence.e ,f No thalamic abnormality is present on FLAIR or T2-weighted sequences.This signifies that the central portion of this lesion has run a chronic course while the peripheral portion and thalamic components are acute3.Berl T,Rastegar A(2010)A patient with severe hyponatre-mia and hypokalemia:osmotic demyelination following potassium repletion.Am J Kid Dis55(4):742–7484.Sterns RH,Hix JK(2009)Overcorrection of hyponatremia isa medical emergency.Kidney Int76(6):587–5895.Gankam Kengne F,Soupart A,Pochet R,Brion JP,Decaux G(2009)Re-induction of hyponatremia after rapid overcor-rection of hyponatremia reduces mortality in rats.Kidney Int 76(6):614–6216.Michell AW,Burn DJ,Reading PJ(2003)Central pontinemyelinolysis temporally related to hypophosphataemia.J Neurol Neurosurg Psychiatry74:820–8267.Abbott R,Silber E,Felber J,Ekpo E(2005)Osmotic demy-elination syndrome.BMJ331:829–8308.Menger H,Jorg J(1999)Outcome of central pontine andextrapontine myelinolysis.J Neurol246:700–7059.Martin RJ(2004)Central pontine and extrapontine myeli-nolysis:the osmotic demyelination syndromes.J Neurol Neurosurg Psychiatry75(Suppl III):iii22–iii28。
