2020版药典吸附无细胞百白破联合疫苗
国家扩大免疫规划疫苗吸附无细胞百白破联合疫苗预防接种知情同意书

吸附无细胞百白破联合疫苗预防接种知情同意书【疾病简介】百日咳是由百日咳杆菌引起的急性呼吸道传染病,主要症状为阵发性痉挛性咳嗽,咳后吸气有特殊“鸡鸣”样髙亢声,易并发肺炎及脑病。
白喉是由白喉杆菌引起的急性呼吸道传染病,主要症状为舞、咽、喉等处粘膜充血、肿胀,局部形成灰白色假脱,严屯者可造成气道堵塞,也可引起心肌炎等中毋症状。
破伤风是由伤口感染破伤风杆菌后引起的—种严重感染性疾病,以特有的肌肉强直和阵发性痉挛为特点,喉痉挛窒息、严重肺部感染及全身衰竭为常见的致死原因。
【疫苗作用】全程接种4剂可有效预防百曰咳、白喉、破伤风。
【接种禁忌】1.已知对该疫苗的任何成分过敏者。
2.患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者。
3.患脑病、未控制的癫痫和其他进行性神经系统疾病者。
4.注射百曰咳、白喉、破伤风疫苗后发生神经系统反应者。
【不良反应】1.1.常见不良反应:发热、红肿、疼痛、发痒等。
2.2.罕见不良反应:烦躁、厌食、呕吐精神不振、重度发热、局部硬结。
3.3.极罕见不良反应:局部无菌性化脓,过敏性皮疹,过敏性休克,过敏性紫癜,血管神经性水肿,神经系统反应。
【注意事项】1.以下情况慎用:家庭和个人有惊厥史者、患慢性疾病者、有癫痫史者、过敏体质者。
2.注射后局部可能有硬结,1~2月即可吸收.注射第2针时应换另侧部位。
3 .注射第1针后出现高热、惊厥等异常情况者,不再注射第2针。
【郑重提示】请您认真阅读以上内容,如实提供受种者的健康状况。
有不明事项请咨询接种医生。
因疫苗特性或受种者个体差异等因素,疫苗保护率并非100%。
接种后请在现场留观30分钟.接种后如有不适,请及时告知接种医生,严重者请及时就医。
接种该疫苗免费。
受种者姓名:性别:出生日期:年月日省卫生健康委员会监制。
康泰生物:关于吸附无细胞百白破联合疫苗获得药品注册批件的公告

证券代码:300601 证券简称:康泰生物公告编号:2020-017
深圳康泰生物制品股份有限公司
关于吸附无细胞百白破联合疫苗获得药品注册批件的公告
深圳康泰生物制品股份有限公司(以下简称“公司”)全资子公司北京民海生物科技有限公司(以下简称“民海生物”)近日收到国家药品监督管理局签发的《药品注册批件》。
根据《中华人民共和国药品管理法》及有关规定,经审查,民海生物申报的吸附无细胞百白破联合疫苗符合药品注册的有关要求,批准注册,发给药品批准文号,具体情况如下:
一、药品基本情况
二、对公司的影响及风险提示
吸附无细胞百白破联合疫苗适用于3月龄及以上的婴幼儿,接种本疫苗后,可使机体产生免疫应答,用于预防百日咳、白喉、破伤风。
本次获得吸附无细胞百白破联合疫苗药品注册批件,将进一步丰富公司产品梯队,提高公司市场竞争力。
公司将按照相关要求积极开展吸附无细胞百白破联合疫苗的生产工作,产品获得国家药品监督管理局生物制品批签发证明后可上市销售。
产品的上市时间具有一定的不确定性,敬请广大投资者谨慎决策,注意投资风险。
三、备查文件
1、国家药品监督管理局出具的《药品注册批件》。
特此公告。
深圳康泰生物制品股份有限公司董事会
2020年3月31日。
吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗的安全性和免疫原性的meta分析

检索 国 内外 发表 的有 关 D T a P - I P V / H i b 联 合 疫苗 与 D T a P 、 H i b 、 I P V疫 苗 的随机 对照 试验 ( R C T s ) 文献 , 采用 m e t a
分析方法 , 利用 R e v Ma n 5 . 0 软件评价 D T a P - I P V / H i b 联 合 疫 苗 的 安 全 性 和 免 疫 原 性 。结 果
Z HO N G Z h a o h u i ( S c h o o l o f P u b l i c H e a l t h a n d He a l t h Ma n a g e m e n t , C h o n g q i n g Me d i c a l U n i v e r s i t y , C h o n g q i n g 4 0 0 0 1  ̄C h i n a
吸附无细胞百白破联合疫苗

吸附无细胞百白破联合疫苗接种告知百日咳是儿童急性呼吸道传染病,传染性强,典型症状为阵发性痉挛性咳嗽,伴有呕吐,持续2~6周,常见合并症有肺炎和百日咳脑病。
白喉也是一种急性呼吸道传染病,临床上分为咽白喉、喉白喉、鼻白喉,以及身体其他部位白喉等4种类型。
病人高热,全身中毒症状严重,常因窒息缺氧和全身衰竭而死亡。
破伤风是一种创伤感染性疾病,患者肢体疼痛,全身肌肉僵直性痉挛,呈苦笑面容,最后死于呼吸障碍。
【疫苗品种】吸附无细胞百白破联合疫苗【作用】预防百日咳、白喉、破伤风三种传染病。
【接种对象】:3月龄—6周岁儿童【价格】免费【用法剂量】3月龄以上儿童接种三次,每次剂量0.5ml,间隔1个月,1.5~2周岁加强注射1针,剂量0.5ml。
6周岁时用白破二联加强注射0.5ml。
接种途径均是上臂外侧三角肌肌注。
【不良反应】吸附无细胞百白破疫苗全身反应或局部反应均极低局部可出现红肿、疼痛、发痒或有低热、疲倦、头痛等。
一般不需特殊处理即自行消退,偶见过敏性皮疹、血管神经性水肿。
无菌性化脓:硬结不能吸收,形成接种部位化脓。
如果全身反应较重,应及时到医院治疗。
注射第1针后出现高热、惊劂等异常情况者,不再注射第2针【接种禁忌】有癫痫、神经系统疾患及抽风史者、过敏史禁用。
急性传染病(包括恢复期)及发热者暂缓注射。
为了保证您的孩子能够安全有效地接种,请向医生提供孩子目前的身体状况。
【接种后注意事项】接种后请在接种地点观察15到30分钟;注射当天不要洗澡,防止注射部位的感染;宜多饮白开水,注射后发生任何不适均可与接种医生咨询电话0745-870299以上内容已告知儿童家属,儿童家属对此表示理解,确认无以上禁忌症,自愿接种吸附无细胞百白破联合疫苗,并表示愿意承担接种疫苗可能出现的反应所产生的风险。
预约接种日期:同意接种本疫苗□不同意接种本疫苗□接种儿童姓名家长及监护人签名:接种日期:接种医生接种部位广坪中心卫生院吸附无细胞百白破联合疫苗接种告知百日咳是儿童急性呼吸道传染病,传染性强,典型症状为阵发性痉挛性咳嗽,伴有呕吐,持续2~6周,常见合并症有肺炎和百日咳脑病。
吸附无细胞百白破联合疫苗使用说明 沃森生物

吸附无细胞百白破联合疫苗使用说明【药品名称】通用名称:吸附无细胞百白破联合疫苗英文名称:Diphtheria,Tetanus and Acellular Pertussis Combined Vaccine,Adsorbed 汉语拼音:Xifu Wuxibao Bai Bai Po Lianhe Yimiao【成分和性状】本品系无细胞百日咳疫苗原液、白喉类毒素原液及破伤风类毒素原液加氢氧化铝佐剂制成。
为乳白色悬液,放置后佐剂下沉,摇动后即成均匀悬液,含防腐剂。
有效成分:百日咳杆菌有效组分、白喉类毒素及破伤风类毒素。
辅料:氢氧化铝、氯化钠、磷酸氢二钠、磷酸二氢钠【接种对象】3个月~6周岁儿童。
【作用与用途】接种本疫苗后,可使机体产生免疫应答。
用于预防百日咳、白喉、破伤风。
【规格】每瓶0.5ml,每1次人用剂量0.5ml,含无细胞百日咳疫苗效价不低于4.0IU,白喉疫苗效价不低于30IU、破伤风疫苗效价不低于40IU。
【免疫程序和剂量】(1)臀部或上臂外侧三角肌肌内注射。
(2)基础免疫:共3针,自3月龄开始至12月龄,每针间隔4~6周,每次注射0.5ml。
加强免疫:通常在基础免疫后18~24月龄内进行,注射剂量为0.5ml。
【不良反应】常见不良反应:(1)注射部位可出现红肿、疼痛、发痒。
(2)全身性反应可有低热、哭闹等,一般不需处理即可自行缓解。
罕见不良反应:(1)烦躁、厌食、呕吐、精神不振等。
(2)重度发热反应:应给予对症处理,以防高热惊厥。
(3)局部硬结,1~2月即可吸收。
严重者可伴有淋巴管或淋巴结炎,应及时就诊。
极罕见不良反应:(1)局部无菌性化脓:一般需反复抽出脓液,严重时(破溃)扩创清除坏死组织,病程较长,最后可吸收愈合。
(2)过敏性皮疹:一般在接种疫苗后72小时内出现荨麻疹应及时就诊,给予抗过敏治疗。
(3)过敏性休克:一般在注射疫苗后1小时内发生。
应及时抢救,注射肾上腺素进行治疗。
(4)过敏性紫癜:出现过敏性紫癜反应时应及时就诊,应用皮质固醇类药物给予抗过敏治疗,治疗不当或不及时有可能并发紫癜性肾炎。
2020年产600万人份吸附无细胞百白破(三组分)联合疫苗项目可行性研究报告

2020年产600万人份吸附无细胞百白破(三组分)联合疫苗项目可行性研
究报告
2020年8月
目录
一、项目概况 (3)
二、项目投资概况 (3)
三、项目实施的必要性 (3)
1、有助于公司实现长期战略发展目标 (3)
2、改进市场现有产品技术 (4)
四、项目实施的可行性 (4)
1、国家政策有利于疫苗行业规范发展 (4)
2、公司具备较强的研发能力 (5)
3、公司拥有较为完善的质量管理体系 (6)
五、项目实施进度 (6)
一、项目概况
本项目计划建成后年产吸附无细胞百白破(三组分)联合疫苗600万人份,将利用公司位于朝阳区卓越大街138号的现有厂区4号厂房内改造。
该厂房原有建筑面积为13,225平方米,为三层(局部四层)框架结构,本次改造利用原有整栋建筑改造。
本次工程准备利用该厂房的一层新建百日咳原液车间,三层新建白喉和破伤风原液车间,二层新建配液和分装车间。
二、项目投资概况
项目总投资30,880.00万元,其中建设投资29,380.00万元,流动资金1,500.00万元。
项目总投资构成情况如下:
三、项目实施的必要性
1、有助于公司实现长期战略发展目标
公司多年来一直致力于组分无细胞百白破疫苗研发工作,目前已。
(整理)吸附百白破联合疫苗.

吸附百白破联合疫苗Xifu Bai Bai Po Lianhe YimiaoDiphtheria,Tetanus and Pertussis Combined Vaccine,Adsorbed本品系由百日咳疫苗原液、白喉类毒素原液及破伤风类毒素原液加入氢氧化铝佐剂制成。
用于预防百日咳、白喉、破伤风。
1基本要求生产、检定用设施、水、器具、动物等应符合“凡例”要求;生产用原辅材料应符合现行《中国药典》的要求。
2制造2.1混合前单价原液2.1.1百日咳疫苗原液制造应符合本品种附录1的规定。
2.1.2白喉类毒素原液制造应符合“吸附白喉疫苗”中2.1~2.2项的规定。
2.1.3破伤风类毒素原液制造应符合“吸附破伤风疫苗”中2.1~2.2项的规定。
2.1.4原液检定2.1.4.1百日咳疫苗按本品种附录1中 2项进行。
2.1.4.2白喉类毒素按“吸附白喉疫苗”中3.1项进行。
2.1.4.3破伤风类毒素按“吸附破伤风疫苗”中3.1项进行。
2.2半成品2.2.1配方每1ml半成品中各抗原成分含量如下:百日咳菌应不高于9.0×109个菌(应不高于30 IOU)白喉类毒素不高于20Lf破伤风类毒素不高于5Lf2.2.2配制2.2.2.1氢氧化铝佐剂稀释按吸附后之最终浓度,将氢氧化铝原液用注射用水稀释成1.0~1.5mg/ml。
加入硫柳汞含量不高于0.1g/L,氯化钠含量补足至8.5g/L。
2.2.2.2吸附按计算量将白喉类毒素、破伤风类毒素及百日咳疫苗原液加入已稀释的氢氧化铝内,调节pH值至5.8~7.2。
2.2.3半成品检定按3.1项进行。
2.3成品2.3.1分批应符合“生物制品分批规程”规定。
2.3.2分装应符合“生物制品分装和冻干规程”规定。
2.3.3规格每瓶0.5ml、1.0ml、2.0ml、5.0ml。
每1次人用剂量0.5ml,含百日咳疫苗效价应不低于4.0IU,白喉疫苗效价应不低于30IU,破伤风疫苗效价应不低于40IU(豚鼠法)或60IU (小鼠法)。
《中国药典》2020版无细胞百白破b型流感嗜血杆菌联合疫苗国家药品标准草案公示稿.pdf

附件:
无细胞百白破b型流感嗜血杆菌联合疫苗wuxibao b ai bai p o b xing liuganshixueganjun l ianhe y imiao
Diphtheria,Tetanus,Acellular Pertussis and Haemophilus
Influenzae Type b Combined Vaccine
本品系由吸附无细胞百白破联合疫苗和b型流感嗜血杆菌结合疫苗两部分组成,使用前混合。
用于预防b型流感嗜血杆菌引起儿童的感染性疾病以及百日咳杆菌、白喉杆菌、破伤风梭状芽孢杆菌引起的百日咳、白喉和破伤风。
本品应分别符合“吸附无细胞百白破联合疫苗”和“b型流感嗜血杆菌结合疫苗”各论
的要求。
b型流感嗜血杆菌结合疫苗成品检定项pH值(3.5.3.1项)和效力试验(3.5.4)应符合批准的要求。
五联疫苗(吸附无细胞百白破灭活脊髓灰质炎和 b型流感嗜血杆菌联合疫苗)接种通知及知情同意书

五联疫苗(吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌联合疫苗)接种通知及知情同意书_____________________(家长姓名):村(居)您好!根据《中华人民共和国传染病防治法》第十一条规定,国家实行有计划的预防接种制度。
国家免疫规划疫苗是适龄儿童必须接种的疫苗,其它疫苗家长可为自己的孩子选择性接种。
国家免疫规划疫苗种类请咨询当地疾病预防控制机构。
根据卫生部《儿童免疫规划程序》要求,请于_______年_____月_____日(上午/下午)带您的孩子___________(儿童姓名)到(单位)接种(吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌联合疫苗)五联疫苗1. 五联疫苗2. 五联疫苗3. 五联疫苗4。
根据《疫苗流通和预防接种管理条例》,本产品属于第二类疫苗,由公民自费并且自愿受种;因接种第二类疫苗引起预防接种异常反应需要对受种者予以补偿的,补偿费用由相关的疫苗生产企业承担。
【疫苗作用与用途】接种后可使机体产生主动免疫,用于预防白喉、破伤风、百日咳、脊髓灰质炎和b型流感嗜血杆菌引起的侵袭性感染(如脑膜炎、败血症、蜂窝组织炎、关节炎、会厌炎等)。
【不良反应】注射后一般不良轻微,接种部位可出现轻微红肿、硬结、压痛、,偶有局部瘙痒感,一般不需特殊处理,即自行消退。
必要时可对症治疗。
全身反应:主要为发热反应(多在38.5℃以下),偶有烦躁、嗜睡、呕吐、腹泻、食欲不振,偶见非典型的皮疹,一般可自行缓解。
【禁忌】下列儿童严禁使用本品:1)对本品的任一组份或对百日咳疫苗(无细胞或全细胞百日咳)过敏,或是以前接种过含有相同组份的疫苗后出现过危及生命的不良反应者。
2)患有进行性脑病者。
3)以前接种百日咳疫苗(无细胞或全细胞百日咳疫苗)后7天内患过脑病者。
4)发热或急性疾病期间必须推迟接种本品。
【注意事项】以下情况者慎用:1.家族和个人有惊厥史者、患慢性疾病者、有癫痫史者、过敏体质者、患有血小板减少症或凝血障碍者。
吸附无细胞百白破联合疫苗接种的不良反应

升趋势,6 年时间内共接种剂次 69 509 次,出现 112 例一般反应及 52 例异常反应,合计 164 例不良反应。约2 岁、7~9 月是 DTaP
接种不良反应高发的人群及季节(P约0.05),不良反应占比分别 56.10酃、51.22酃;而不同性别人群不良反应发生情况比较,差异
无统计学意义(P跃0.05)。结论 渭城区 DTaP 接种不良反应近年有增高趋势,约2 岁、7~9 月是疫苗接种不良反应高发群体及时间,
调查分析
2019 年 10 月
吸附无细胞百白破联合疫苗接种的不良反应
刘 静 ,刘 美 宁 ,赵 增 良 (渭城区疾病预防控制中心,陕西 咸阳,712000)
摘要:目的 研究吸附无细胞百白破联合疫苗(DTaP)接种的不良反应。方法 观察 2012—2017 年渭城区 DTaP 接种人群不良反
应发生情况,并比较不同年龄、月份及性别儿童的不良反应发生情况。结果 2012—2017 年预防接种不良反应发生率呈逐年上
吸附无细胞百白破联合疫苗(DTaP)是由无细胞百白破疫 苗原液、白喉以及破伤风毒素原液根据合理的比例联合制成 的一种疫苗,主要用于预防百日咳、白喉和破伤风类病症,相 对而言,其预防疗效甚佳。当前 DTaP 在国内被广泛运用,其稳 定性好、免疫性强,但受 DTaP 固有性质、疫苗质量、儿童个体 差异及接种时间影响,部分儿童接种疫苗后会出现发热、注射 部位红肿、头晕、头痛、无菌脓肿、过敏性皮疹、肌痛等不良反 应,严重者甚至出现抽搐、昏迷、癔症[1]。因此,为了降低此类疫 苗接种的不良反应发生率,提高接种质量,本研究对 2012—2017 年陕西省咸阳市渭城区 DTaP 接种不良反应发生情况进行调 查,现报道如下。
应引起重视并做好应对措施。
吸附无细胞百白破联合疫苗制造及检定规程

吸附无细胞百白破联合疫苗制造及检定规程
吸附无细胞百白破联合疫苗制造及检定规程如下:
原液制造。
白喉类毒素原液制造应符合"吸附白喉疫苗"中2.1到2.2项的规定;破伤风类毒素原液制造应符合"吸附破伤风疫苗"中2.1到2.2项的规定。
原液检定。
白喉类毒素原液检定按"吸附白喉疫苗"中3.1项进行;破伤风类毒素原液检定按"吸附破伤风疫苗"中3.1项进行。
合并及稀释。
将白喉类毒素、破伤风类毒素及无细胞百日咳疫苗原液加入已稀释的佐剂内,调节pH值至5.8到7.2。
半成品检定。
无菌检查,依法检查,应符合规定。
此外,还有规格、包装、成品检定等步骤。
可以查阅关于吸附无细胞百白破联合疫苗制造及检定规程的文献、资料,或者咨询专业医生,获取更全面和准确的信息。
吸附无细胞百白破联合疫苗-详细说明书与重点

吸附无细胞百白破联合疫苗英文名:Diphtheria,T etanus and Acellular Pertussis Combined Vaccine,Adsorbed。
汉语拼音:Xifuwuxibaobaibaipolianheyimiao。
【成份】本品系由无细胞百日咳疫苗原液、白喉类毒素原液及破伤风类毒素原液加氢氧化铝佐剂制成。
为乳白色悬液,放置后佐剂下沉,摇动后即成均匀悬液,含适量硫柳汞防腐剂。
有效成分:百日咳杆菌有效组分、白喉类毒素及破伤风类毒素。
辅料:氢氧化铝佐剂,硫柳汞防腐剂。
【作用与用途】接种本疫苗后,可使机体产生免疫应答。
用于预防百日咳、白喉、破伤风。
【接种对象】3个月~6周岁儿童。
【规格】每安瓿2.0ml。
每1次人用剂量0.5ml,含无细胞百日咳疫苗效价不低于4.0IU,白喉疫苗效价不低于30IU,破伤风疫苗效价不低于40IU。
【用法用量】(1)臀部或上臂外侧三角肌肌内注射。
(2)基础免疫:共3针,自3月龄开始至12月龄,每针间隔4-6周,每次注射0.5ml。
加强免疫通常在基础免疫后18-24月龄内进行,注射剂量为0.5ml。
【不良反应】常见不良反应:(1)注射部位可出现红肿、疼痛、发痒。
(2)全身性反应可有低热、哭闹等,一般不需处理即可自行缓解。
罕见不良反应:(1)烦躁、厌食、呕吐、精神不振等。
(2)重度发热反应:应给予对症处理,以防高热惊厥。
(3)局部硬结,1~2个月即可吸收。
严重者可伴有淋巴管或淋巴结炎,应及时就诊。
极罕见不良反应:(1)局部无菌性化脓:一般需反复抽出脓液,严重时(破溃)扩创清除坏死组织,病程较长,最后可吸收愈合。
(2)过敏性皮疹:一般在接种疫苗后72小时内出现荨麻疹,应及时就诊,给予抗过敏治疗。
(3)过敏性休克:一般在注射疫苗后1小时内发生。
应及时抢救,注射肾上腺素进行治疗。
(4)过敏性紫癜:出现过敏性紫癜反应时应及时就诊,应用皮质固醇类药物给予抗过敏治疗,治疗不当或不及时有可能并发紫癜性肾炎。
吸附无细胞百白破联合疫苗使用说明

吸附无细胞百白破联合疫苗【用法用量】1.臀部外上方1/4处或上臂外侧三角肌附着处皮肤经消毒后肌内注射。
2.免疫程序与剂量。
基础免疫自3月龄开始,至12月龄完成3针免疫,每次0.5ml,每针间隔4~6周。
加强免疫通常在基础免疫后18~24月龄内进行,注射剂量为0.5ml。
【注意事项】1.使用时应充分摇匀,如出现摇不散之凝块、有异物、安瓿有裂纹、制品曾经冻结、标签不清和过期失效者不可使用。
2.注射后局部可能有硬结,可逐步吸收。
注射第2针时应更换另侧部位。
3.应备肾上腺素,供偶有发生休克时急救用。
4.注射第1针后出现高热、惊厥等异常情况者,不再注射第2针。
【不良反应】注射本品一般无反应,有的接种部位有轻度红晕﹑痒感或有低热,一般不须特殊处理,即行消退,如有严重反应及时诊治。
【禁忌】1.有癫痫、神经系统疾病及抽风史者禁用。
2.急性传染病(包括恢复期)及发热者,暂缓注射。
【适应症】本疫苗接种后,可使机体产生免疫应答,用于预防百日咳、白喉、破伤风。
【药物相互作用】如与其他药物同时使用可能会发生,详情请咨询医师或药师。
【国家/地区】国产【剂型】注射剂【成份】本品由白喉类毒素、破伤风类毒素和3种纯化的百日咳抗原[百日咳类毒素(PT)、丝状血凝素(FHA)及69KD外膜蛋白(百日咳杆菌粘附素)]按一定比例混合,经氢氧化铝吸附而成。
白喉类毒素和破伤风类毒素是由白喉毒素和破伤风毒素经脱毒及纯化制成。
无细胞百日咳疫苗组份(PT、FHA和百日咳杆菌粘附素)制备于百日咳鲍特氏杆菌期培养物,经萃取、纯化和甲醛处理。
PT被不可逆转地脱毒。
白喉类毒素、破伤风类毒素和无细胞百日咳疫苗成分吸附于氢氧化铝。
成品疫苗用生理盐水配制,并用2-苯氧乙醇做为防腐剂。
该疫苗符合世界卫生组织关说明:以上信息仅供参考,具体请以商品说明书为准。
吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗基础免疫后脊髓灰质炎中和抗体水平观察

吸附无细胞百白破灭活脊髓灰质炎和 b型流感嗜血杆菌 (结合 )联合疫苗基础免疫后脊髓灰质炎中和抗体水平观察摘要:目的:探讨吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗基础免疫后脊髓灰质炎中和抗体水平。
方法:选择2018年1月-2020年6月接收的脊灰疫苗接种婴儿100例为对象,随机数字表法将婴儿分成对照组(n=50)和观察组(n=50)。
对照组用口服脊灰减毒活疫苗,观察组用吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗基础免疫。
比较两组婴儿免疫前后的脊髓灰质炎中和抗体水平。
结果:免疫前的I型和II型、III型中和抗体水平比较,P>0.05;免疫后I型和II型、III型中和抗体水平高于免疫前,观察组I型和II型、III型中和抗体水平低于对照组,P<0.05。
结论:吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗基础免疫的婴儿I型、II型的抗体水平稍低于口服脊灰减毒活疫苗,应在婴儿4岁时加服1次脊灰减毒活疫苗,增强脊灰的免疫保护作用。
关键词:吸附无细胞百白破灭活脊髓灰质炎;b型流感嗜血杆菌(结合);疫苗基础免疫;脊髓灰质炎;中和抗体水平脊髓灰质炎是一种急性传染性疾病,发病是因为脊髓灰质炎病毒感染造成,这种病毒会对人的神经造成侵袭,病情严重时患者会因为呼吸肌麻痹的情况死亡,对年龄<5岁的儿童身体健康造成的影响极大[1]。
脊髓灰质炎疫苗的预防作用明显,而目前常用的免疫接种疫苗较多,包括吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)、疫苗基础免疫等,为了解不同疫苗免疫接种对婴儿的脊髓灰质炎中和抗体水平,本文比较我院2018年1月-2020年6月接收的不同脊灰疫苗接种婴儿100例的临床资料,探讨婴儿体内的中和抗体水平。
1.资料与方法1.1一般资料选择2018年1月-2020年6月接收的脊灰疫苗接种婴儿100例为对象,随机数字表法将婴儿分成对照组(n=50)和观察组(n=50)。
吸附破伤风疫苗

吸附破伤风疫苗Xifu Poshangfeng YimiaoTetanus Vaccine,Adsorbed本品系用破伤风梭状芽孢杆菌,在适宜的培养基中培养产生的毒素经甲醛脱毒、精制,加入氢氧化铝佐剂制成。
用于预防破伤风。
1基本要求生产和检定用设施、原料及辅料、水、器具、动物等应符合“凡例”的有关要求。
2制造2.1菌种生产用菌种应符合“生物制品生产检定用菌毒种管理规程”的有关规定。
2.1.1名称及来源采用破伤风梭状芽孢杆菌CMCC64008株或其它经批准的破伤风梭状芽孢杆菌菌种。
2.1.2种子批的建立应符合“生物制品生产检定用菌毒种管理规程”的有关规定。
2.1.3种子批的传代主种子批自启开后传代应不超过5代,工作种子批启开后至疫苗生产,传代应不超过10 代。
2.1.4种子批菌种的检定2.1.4.1培养特性本菌为专性厌氧菌,适宜生长温度为37℃。
在庖肉液体培养基中培养,培养液呈浑浊、产生气体、具腐败性恶臭。
在血琼脂平皿培养基培养,菌落呈弥漫生长。
在半固体培养基穿刺培养,表现鞭毛动力。
2.1.4.2染色镜检初期培养物涂片革兰染色镜检呈阳性,杆形菌体,少见芽孢。
48小时以后培养物涂片革兰染色镜检,易转为阴性,可见芽孢,菌体呈鼓槌状,芽孢位于顶端为正圆形。
2.1.4.3生化反应不发酵糖类,液化明胶,产生硫化氢;不还原硝酸盐(附录ⅩⅣ)。
2.1.4.4产毒试验取培养物的滤液或离心上清液0.1ml注射于体重18~22g小鼠的尾根部皮下,至少4只。
于注射后12~24小时观察小鼠,应出现尾部僵直竖起、后腿强直痉挛或全身肌肉痉挛等症状,甚至死亡。
2.1.4.5特异性中和试验取适量产毒培养物的滤液或离心上清液与相应稀释的破伤风抗毒素经体外中和后,注射于体重为18~22g小鼠的腹部皮下,每只小鼠注射0.4ml,至少4 只;同时取未结合破伤风抗毒素的培养物的滤液或离心上清液0.4ml,注射小鼠的腹部皮下,作为阳性对照。
吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌
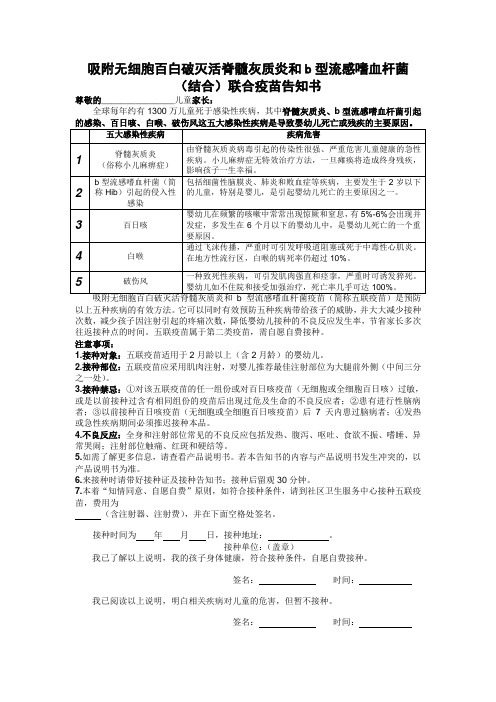
吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗告知书尊敬的_______________儿童家长:全球每年约有1300万儿童死于感染性疾病,其中脊髓灰质炎、b型流感嗜血杆菌引起的感染、百日咳、白喉、破伤风这五大感染性疾病是导致婴幼儿死亡或残疾的主要原因。
五大感染性疾病疾病危害1 脊髓灰质炎(俗称小儿麻痹症)由脊髓灰质炎病毒引起的传染性很强、严重危害儿童健康的急性疾病。
小儿麻痹症无特效治疗方法,一旦瘫痪将造成终身残疾,影响孩子一生幸福。
2 b型流感嗜血杆菌(简称Hib)引起的侵入性感染包括细菌性脑膜炎、肺炎和败血症等疾病,主要发生于2岁以下的儿童,特别是婴儿,是引起婴幼儿死亡的主要原因之一。
3 百日咳婴幼儿在频繁的咳嗽中常常出现惊厥和窒息,有5%-6%会出现并发症,多发生在6个月以下的婴幼儿中,是婴幼儿死亡的一个重要原因。
4 白喉通过飞沫传播,严重时可引发呼吸道阻塞或死于中毒性心肌炎。
在地方性流行区,白喉的病死率仍超过10%。
5 破伤风一种致死性疾病,可引发肌肉强直和痉挛,严重时可诱发猝死。
婴幼儿如不住院和接受加强治疗,死亡率几乎可达100%。
吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌疫苗(简称五联疫苗)是预防以上五种疾病的有效方法。
它可以同时有效预防五种疾病带给孩子的威胁,并大大减少接种次数,减少孩子因注射引起的疼痛次数,降低婴幼儿接种的不良反应发生率,节省家长多次往返接种点的时间。
五联疫苗属于第二类疫苗,需自愿自费接种。
注意事项:1.接种对象:五联疫苗适用于2月龄以上(含2月龄)的婴幼儿。
2.接种部位:五联疫苗应采用肌肉注射,对婴儿推荐最佳注射部位为大腿前外侧(中间三分之一处)。
3.接种禁忌:①对该五联疫苗的任一组份或对百日咳疫苗(无细胞或全细胞百日咳)过敏,或是以前接种过含有相同组份的疫苗后出现过危及生命的不良反应者;②患有进行性脑病者;③以前接种百日咳疫苗(无细胞或全细胞百日咳疫苗)后7天内患过脑病者;④发热或急性疾病期间必须推迟接种本品。
无细胞百白破b型流感嗜血杆菌联合疫苗说明书

无细胞百白破b型流感嗜血杆菌联合疫苗说明书【药品名称】通用名称:无细胞百白破b型流感嗜血杆菌联合疫苗商品名称:美联吉泰英文名称:Diphtheria,Tetanus,Acellular Pertussis and Haemophilus Influenzae Type b Combined Vaccine汉语拼音:wuxibao bai bai po b xing liuganshixueganjun lianhe yimiao【成份和性状】主要组成成份:1. 吸附无细胞百白破联合疫苗(DTaP)系由百日咳杆菌、白喉杆菌及破伤风梭状芽孢杆菌的培养物上清液,经过硫酸铵盐析等方法纯化、脱毒后,加入氢氧化铝吸附制成。
为乳白色悬液,放置后佐剂下沉,摇动后即成均匀悬液。
活性成份为:百日咳杆菌有效组分、白喉类毒素及破伤风类毒素;非活性成份为:氢氧化铝、硫柳汞和含有氯化钠、磷酸盐的缓冲液。
2. b型流感嗜血杆菌结合疫苗(Hib)系由b型流感嗜血杆菌的培养物上清液,经过乙醇沉淀、苯酚提取等方法纯化b型流感嗜血杆菌荚膜多糖,与破伤风类毒素共价结合后制成。
为无色透明液体。
活性成份为:b型流感嗜血杆菌荚膜多糖;非活性成份为:氯化钠缓冲液。
【接种对象】本品用于3月龄以上婴儿。
任何季节均可接种。
【作用与用途】本疫苗接种后,可使机体产生体液免疫应答。
用于预防百日咳、白喉、破伤风和由b型流感嗜血杆菌引起的侵袭性疾病(包括脑膜炎、肺炎、上呼吸道感染、败血症、蜂窝组织炎、关节炎、会厌炎等)。
【规格】1. 吸附无细胞百白破联合疫苗:每瓶0.5ml,每1次人用剂量0.5ml,含无细胞百日咳疫苗效价不低于4.0IU;白喉疫苗效价不低于30IU;破伤风疫苗效价不低于40IU。
2. b型流感嗜血杆菌结合疫苗:每瓶0.5ml,每1次人用剂量0.5ml,含b型流感嗜血杆菌荚膜多糖不低于10μg。
【免疫程序和剂量】推荐本品常规免疫接种程序:3、4、5月龄进行基础免疫。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020版药典吸附无细胞百白破联合疫苗Xifu Wuxibao Bai Bai Po Lianhe YimiaoDiphtheria, Tetanus and Acellular Pertussis Combined Vaccine, Adsorbed本品系由无细胞百日咳疫苗原液、白喉类毒素原液及破伤风类毒素原液加入氢氧化铝佐剂制成。
用于预防百日咳、白喉、破伤风。
1 基本要求生产和检定用设施、原材料及辅料、水、器具、动物等应符合“凡例”的有关要求。
2 制造2.1 混合前单价原液2.1.1 无细胞百日咳疫苗原液制造应符合本品种附录的规定。
2.1.2 白喉类毒素原液制造应符合“吸附白喉疫苗”中2.1~2.2项的规定。
2.1.3 破伤风类毒素原液制造应符合“吸附破伤风疫苗”中2.1~2.2项的规定。
2.1.4 原液检定2.1.4.1 百日咳疫苗原液检定按本品种附录中2项进行。
2.1.4.2 白喉类毒素原液检定按“吸附白喉疫苗”中3.1项进行。
2.1.4.3 破伤风类毒素原液检定按“吸附破伤风疫苗”中3.1项进行。
2.2 半成品2.2.1 佐剂配制佐剂的制备和检定(通则3650)应符合批准的要求。
2.2.2 合并及稀释将白喉类毒素、破伤风类毒素及无细胞百日咳疫苗原液加入已稀释的佐剂内,调pH值至5.8~7.2,使每1ml半成品含无细胞百日咳疫苗原液应不高于18μgPN;白喉类毒素应不高于25Lf;破伤风类毒素应不高于7Lf。
2.2.3 半成品检定按3.1项进行。
2.3 成品2.3.1 分批应符合“生物制品分包装及贮运管理”规定。
2.3.2 分装应符合“生物制品分包装及贮运管理”规定。
2.3.3 规格每瓶0.5ml、1.0ml、2.0ml、5.0ml。
每1次人用剂量0.5ml,含无细胞百日咳疫苗效价应不低于4.0IU,白喉疫苗效价应不低于30IU,破伤风疫苗效价应不低于40IU。
2.3.4 包装应符合“生物制品分包装及贮运管理”规定。
3 检定3.1 半成品检定3.1.1 无菌试验依法检查(通则1101),应符合规定。
3.1.2 吸附率检查将供试品离心取上清液,同时取供试品进行适当稀释,选取0~100μg/ml范围作为对照品溶液浓度,依法测定[通则0731第二法福林酚法(Lowry法)方法2]供试品及其上清液的蛋白含量,再按下式计算吸附率,应不低于95%。
式中P为吸附率,%;cs为供试品上清液的蛋白含量,μg/ml;ct为供试品的蛋白含量,μg/ml。
3.2 成品检定3.2.1 鉴别试验3.2.1.1 无细胞百日咳疫苗可选择下列一种方法进行:(1)疫苗注射动物应产生抗体(按3.2.4.1项进行);(2)采用酶联免疫吸附法检测PT、FHA抗原,应含有相应抗原(通则3417);(3)其他适宜的抗原抗体反应试验。
3.2.1.2 白喉类毒素可选择下列一种方法进行:(1)疫苗注射动物应产生抗体(通则3505);(2)疫苗加枸椽酸钠或碳酸钠将佐剂溶解后,做絮状试验(通则3506),应岀现絮状反应;(3)疫苗经解聚液溶解佐剂后取上清液,做凝胶免疫沉淀试验(通则3403),应出现免疫沉淀反应。
3.2.1.3 破伤风类毒素可选择下列一种方法进行:(1)疫苗注射动物后应产生破伤风抗体(通则3504);(2)疫苗加入枸椽酸钠或碳酸钠将吸附剂溶解后做絮状试验(通则3506),应出现絮状反应;(3)疫苗经解聚液溶解佐剂后取上清液,做凝胶免疫沉淀试验(通则3403),出现免疫沉淀反应。
3.2.2 物理检查3.2.2.1 外观振摇后应呈均匀乳白色混悬液,无摇不散的凝块或异物。
3.2.2.2 装量依法检查(通则0102),应不低于标示量。
3.2.2.3 渗透压摩尔浓度依法测定(通则0632),应符合批准的要求。
3.2.3 化学检定3.2.3.1 pH值应为5.8~7.2(通则0631)。
3.2.3.2 铝含量应为0.17~0.26mg/剂(通则3106)。
3.2.3.3 硫柳汞含量应不高于0.05mg/剂(通则3115)。
3.2.3.4 游离甲醛含量应不高于0.1mg/剂(通则3207第一法)。
3.2.3.5 戊二醛含量应小于0.005mg/剂(通则3204)。
3.2.4 效价测定3.2.4.1 无细胞百日咳疫苗按“吸附百白破联合疫苗”中附录2进行。
以适宜的稀释倍数稀释至第一个免疫剂量,再按5倍系列稀释。
免疫时间为21天。
每1次人用剂量的免疫效价应不低于4.0IU,且95%可信限的低限应不低于2.0IU。
如达不到上述要求时可进行复试,但所有的有效试验结果必须以几何平均值(如用概率分析法时,应用加权几何平均)来计算。
达到上述要求即判为合格。
3.2.4.2 白喉疫苗每1次人用剂量中白喉类毒素的免疫效价应不低于30IU(通则3505)。
3.2.4.3 破伤风疫苗每1次人用剂量中破伤风类毒素的免疫效价应不低于40IU(通则3504)。
3.2.5 无菌检查依法检查(通则1101),应符合规定。
3.2.6 特异性毒性检查3.2.6.1 无细胞百日咳疫苗按本品种附录中2.5项进行。
3.2.6.2 白喉、破伤风疫苗用体重250~350g豚鼠,每批制品不少于4只,每只腹部皮下注射2.5ml,分两侧注射,每侧1.25ml,观察30天。
注射部位可有浸润,经5~10天变成硬结,可能30天不完全吸收。
在第10天、第20天、第30天称体重,到期体重比注射前增加,局部无化脓、无坏死、无破伤风症状及无晚期麻痹症者为合格。
3.2.7 毒性逆转试验每批供试品置37℃ 4周,按本品种附录中2.6项进行。
3.2.8 细菌内毒素检查每1次人用剂量应不高于100EU(通则1143)。
4 保存、运输及有效期于2~8℃避光保存和运输。
自生产之日起,有效期为24个月;自百日咳原液脱毒之日起,疫苗总有效期不得超过36个月。
5 附录无细胞百日咳疫苗原液制造及检定要求。
6 使用说明应符合“生物制品分包装及贮运管理”规定和批准的内容。
附录无细胞百日咳疫苗原液制造及检定要求本品系由百日咳杆菌的培养物或其上清液,经硫酸铵盐析和蔗糖密度梯度离心法提取百日咳毒素(PT)和丝状血凝素(FHA)等有效组分,经脱毒制成。
用于制备吸附无细胞百白破联合疫苗。
1 制造1.1 菌种生产用菌种应符合“生物制品生产检定用菌毒种管理及质量控制”的有关规定。
1.1.1 名称及来源生产用菌种应采用百日咳I相CMCC 58003(CS株)或其他适宜菌株。
1.1.2 种子批的建立应符合“生物制品生产检定用菌毒种管理及质量控制”的规定。
1.1.3 种子批的传代工作种子批菌种启开后传代不应超过10代用于生产。
1.1.4 种子批的检定1.1.4.1 培养特性于包-姜(Bordet-Gengou)培养基或其他适宜培养基上培养,各菌株应具有典型的形态,葡萄糖、尿素酶、硝酸盐、枸椽酸盐、半固体(动力)营养琼脂结果均应为阴性。
1.1.4.2 血清学试验取经35~37℃培养40~48小时的菌苔,混悬于0.85%~0.90%氯化钠溶液或PBS内,制成适宜浓度的菌悬液,与I相参考血清做定量凝集反应,凝集效价应达到血清原效价之半。
并同时进行Fim2、Fim3的血清学检测,应为阳性。
1.1.4.3 皮肤坏死试验取经35~37℃培养40~48小时的菌苔,混悬于PBS内,并稀释成不同浓度的菌液;取家兔或豚鼠至少2只,分别用每一稀释度的菌液皮内注射0.1ml,经72小时观察注射部位的皮肤反应,其中至少1只家兔或豚鼠在注射含菌4.0×107以下稀释度的部位出现出血性坏死者,为阳性反应,判为合格。
1.1.4.4 毒力试验用体重16~18g的小鼠至少3组,每组至少10只,在麻醉状态下从鼻腔滴入经培养20~24小时、以PBS稀释的菌液0.05ml,观察14天,记录小鼠生死情况,按Reed-Muench法计算LD50,1LD50的菌数应不高于1.2×108。
1.1.4.5 效价测定按“吸附百白破联合疫苗”附录2进行。
1.1.5 菌种保存种子批应冻干保存于8℃及以下。
1.2 原液1.2.1 生产用种子将工作种子批菌种启开后,接种于改良包-姜培养基或活性炭半综合培养基或其他适宜培养基上,于35~37℃培养不超过72小时,以后各代不超过48小时。
传代菌种保存不得超过14天,工作种子批启开后用于生产时不应超过10代。
1.2.2 生产用培养基应选用S-S(Stainer-Scholte)培养基或其他适宜培养基。
1.2.3 培养可采用静置培养法或发酵罐培养法,培养过程应取样做纯菌检查。
1.2.4 收获和杀菌培养物于对数生长期后期或静止期前期收获。
在培养物中加入硫柳汞杀菌。
1.2.5 纯化采用硫酸铵盐析和蔗糖密度梯度离心,收集PT、FHA有效组分。
1.2.6 蛋白氮含量测定依法测定(通则0731第二法)。
1.2.7 纯度测定采用聚丙烯酰胺凝胶电泳法或SDS-聚丙烯酰胺凝胶电泳法检测,应显示主要含有PT和FHA两种组分,且批间比例应保持一致。
PT和FHA等有效组分应不低于总蛋白质含量的85%。
1.2.8 脱毒和匀化采用甲醛溶液或戊二醛溶液脱毒,然后用适宜方法除去脱毒剂,再经超声波匀化处理即为原液。
2 检定2.1 染色镜检取供试品的沉淀物,涂片染色镜检,不应有百日咳杆菌和其他细菌。
2.2 效价测定按“吸附百白破联合疫苗”附录2进行。
即先将原液稀释至成品的浓度后,以适宜的稀释倍数为第一个免疫剂量,再按5倍系列稀释,免疫21天后攻击。
2.3 无菌检查依法检查(通则1101),应符合规定。
2.4 不耐热毒素试验用0.85%~0.90%氯化钠溶液将供试品稀释至半成品浓度的2倍,用48~72小时龄的乳鼠至少4只,每只皮内注射0.025ml,或用体重2.5kg的家兔至少2只,每只皮内注射0.1ml,观察4日,受试动物不得出现不耐热毒素引起的任何局部反应。
2.5 特异性毒性检查毒性参考品按照每批标示进行稀释,将供试品稀释至与成品相同浓度。
用体重14~16g NIH小鼠(雌性或雌雄各半),毒性参考品的每一稀释度和供试品各用一组,每组至少10只。
每只小鼠腹腔注射0.5ml,分别进行2.5.1~2.5.3项试验。
2.5.1 小鼠白细胞增多试验于注射后3天分别取小鼠末梢血进行白细胞计数。
试验结果经统计学方法处理后,注射供试品的小鼠白细胞增多毒性的活性应不高于0.5LPU/ml。
2.5.2 小鼠组胺致敏试验于注射后4天,每只小鼠腹腔注射0.5ml溶液(含二盐酸组胺4mg或二磷酸组胺2mg),30分钟后分别测小鼠肛温。
试验结果经统计学方法处理后,供试品的小鼠组胺致敏毒性的活性应不高于0.8HSU/ml,且无动物死亡。
2.6 毒性逆转试验每批供试品置37℃ 4周,然后按2.5.2项进行试验。
