高中化学《醛酮的化学性质》优质教学课件设计
高中化学_2.3醛酮的化学性质教学课件设计

实验探究 醛基的氧化反应8min
乙醛被银氨溶液氧化 现象: 结论:(用方程式表示) 乙醛被新制氢氧化铜氧化 现象: 结论:(用方程式表示) 以上两个反应: 1、可用于鉴定-CHO的存在。 2、均在碱性环境中进行。 3、-CHO与[Ag(NH3)2]OH或 Cu(OH)2均以物 质的量比1:2反应。
H R’ C
H
H(R)
d+ d -
CO
自学探究 羰基的加成反应
1.自学P72,了解与醛酮加成的试剂及加成产物;
2.根据加成原理,以乙醛、丙酮为例在评测练习
上分别书写与HCN,NH3,CH3OH反应的化学
方程式。
(R, )H d+ d - d+ d C O+A B
R
(R , )H R C OA
B
甲醛为什么有毒?
丙醛与新制氢氧化铜的反应:
丙醛与氢氰酸的反应:
2.下列各组有机化合物的水溶液,能用新制氢氧 化铜悬浊液鉴别的是
A.葡萄糖和乙醛 B.丙醛和丙酮
C.乙醛和乙酸
D.甲醛和葡萄糖
作业
▪ 必做 课本80页 3.
选做 丛书56页 5.
鲁科版 有机化学基础(选修)
第二章第三节 醛和酮的化学性质
新闻报道
学习目标
1.理解醛、酮的主要化学性质及区别; 2.能利用醛酮的主要化学反应实现醛酮到
羧酸 、醇等烃的衍生物之间的相互转化.
学习重点
醛、酮的化学性质
合作
探究 醛、酮的结构与性质
1. 醛酮含有的官能团,它们的结构特点 2.推测醛、酮可能发生哪些化学反应?
Ⅰ 银镜反应 Ⅱ 与新制的氢氧化铜反应 d.使酸性KMnO4溶液褪色
高二有机化学优质课件1:2.3.2醛、酮的化学性质

羰基的加成反应在有机合成有着重要的用途
处于-4~+4 之间 既能发生氧化反应又能发生还原反应
O
︱ ︱︱
–C–C–H
︱
O
︱ ︱︱ ︱
–43;2-1=+1
氧化数:+2
人类为了维持生命与健康,必须摄取 的食物有哪些?
人类为了维持生命与健康,除了阳 光和空气外,必须摄取的食物有:糖 类、油脂、蛋白质、维生素、无机盐 和水。
第2章 官能团与有机化学反应 烃的衍生物
第三节 醛和酮 糖类
第2课时 醛、酮的化学性质
交流·研讨
醛、酮的化学性质
与其他有机化合物相比,醛、酮的化学性质较活泼,这与它们官能团
的结构密切相关。请根据醛、酮的结构特点,利用你所掌握的有机化合物 结构与性质间关系的知识推测它们可能具有的化学性质,完成下表。
试根据乙醛与HCN反应的产物, 找出加成规律,写出下表另外两 个反应的产物。
与乙醛的加成
Oδ -
CH3Cδ-H+
试剂名称
化学式及电荷分布 加成产物
氢氰酸
氨及氨的衍生物 (以氨为例)
醇类 (以甲醇为例)
δ+ δ-
H CN
δ+ δ-
H NH2
δ+δ-
H OCH3
︱OH
H C CN
CH3
︱OH
H C NH2 CH3
THANKS
CH3CH-NH2
α-羟基乙胺
O
一定条件
OH
CH3C H + H-OCH3
CH3CH-OCH3
乙醛半缩甲醇
双键断裂,异电相吸
甲醛与蛋白质反应示意图
HOH H
醛酮PPT教学讲义

O
OH
C6H5CH + HCN
O CH + HCN
C6H5
CH
CN OH
CH
K = 210 K = 530
Br O CCH3 + HCN
CN
Br OH
C CH3 CN
K = 0.77
(2) 与格氏试剂加成 醛或酮都能与格氏试剂加成,产物水解后得伯、仲、叔醇:
R MgX + C O
R
C
C NHY -H2O OH
CNY
一些产物及名称 H2N-Y
产物
名称
Schiff 碱 肟 腙 苯腙
多数产物为很好的晶体, 在烯酸作用下又能分解为原来的醛 酮,故也可用于醛酮的分离和鉴定.这些试剂被称为羰基试 剂。同时,脂肪族醛的席夫碱不如芳香族席夫碱稳定。
反应机理 碱催化 酸催化
C=O + H2N-Z
R-CaH2-Y
R-CH-Y + H+
a-H以正离子离解下来的能力称为a-H的活性或a-H的酸性。
影响a-H活性的因素: Y的吸电子能力。 a-H 周围的空间环境。 负碳离子的稳定性。
1) 酮-烯醇平衡
对于脂肪族醛酮将, a-氢可以H+离解并转移到氧原子上, 形成所谓的烯醇式结构:
O CH3CCH3
+
C3H7 (CH3)2CHCCH(CH3)2 (30%)
OH
(CH3)2CHMgBr
(CH3)CCHCHCH(CH3)2 + CH3CH CH2 OH
但若用有机锂试剂则仍可得到加成产物:
O (CH3)3CCC(CH3)3 + (CH3)3CLi
Et2O - 60oC
高中化学《醛和酮的化学性质》优质课教学设计、教案
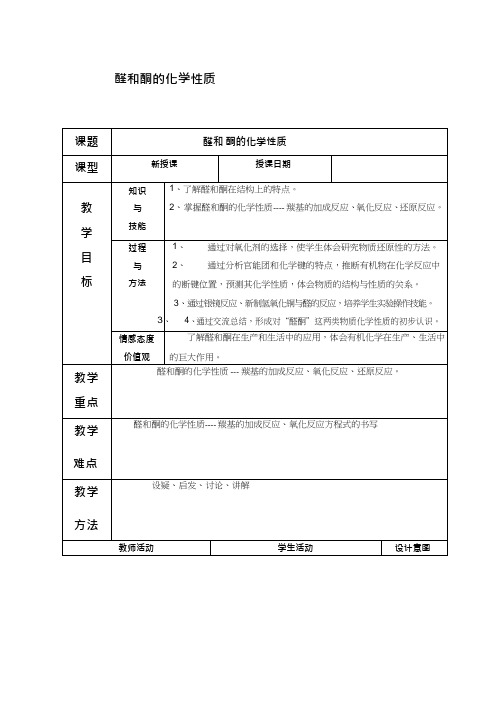
醛和酮的化学性质【设疑引入】复习乙醇的催化氧化和倾听,思考乙醛被空气中氧气的氧化,那么乙 通过学过的醇 醛能否转化为乙醇,乙醛能否被其 醛、酸的转化 他氧化剂氧化?引入对醛酮化学性 引发学生的求 质的学习。
【板书】三、醛酮的化学性质知欲望。
【过渡】物质的组成、结构决定物质的性质,以乙醛、丙酮为例,分析其官能团,下面我们一起推断一下这样的分子结构会有怎样的化学性质。
[板书] 1.羰基的加成反应【引导分析】醛和酮分子中都存在着官能团 ------ 羰基,官能团中C 原子 有没有饱和?可能发生哪些反应?与什么试剂反应?请分析一下羰基与 HCN 加成时,为什么加成产物是?【投影】羰基与极性试剂加成规律:(R ,)H (R ,H )+-+-C O + A BC O RB【指出】羰基与 HCN 的加成反应在有机合成中可以增长碳链。
加成原理是醛和酮结构中带正电荷的部分加上了试剂中带负荷的原子或原子团,结 学生练习应用 构中带负电荷的部分加上了试剂中带正荷 电子对偏移的 的原子或原子团。
知识分析羰基加成反应规律 有利于学生对 反应产物的判断。
参考羰基与极性试剂的加成规律,写出乙醛与 HCN 、NH 3、CH 3CHO 加成反应的产 物。
A【讲解】醛酮的羰基还可以和氢气发写出乙醛、丙酮与氢气的反应方程式。
CH 3CHO + H 2CH 3CH 2OH+ H 2CH 3CHOHCH 3投影学生的书写情况生加成反应,即还原反应 【板书】2.还原反应使学生能从结 构分析转化为反应分析,体 C=O 双键中一条价键断后,两个 H 会化学键的断 原子分别加成到断键的 C 原子上和 裂与反应类型O 原子上。
的关系。
让学生建 立运动观,并以此形成的运 动观使学生更 好的了解化学 反应实质,从 而正确书写化学方程式。
[设问]乙醛除了能发生加成反应外, 2C3222这样的结构还能发生什么反应,哪 个价键会发生断裂,被怎样的物质 攻ft 才会发生断裂?易被氧化,在点燃的条件下,乙醛 能在空气或氧气中燃烧。
常见的醛和酮 醛和酮的化学性质课件

催化剂 RCHO+H2 ――→
RCH2OH
;
催化剂 +H2 ――→ ___________。
PPT学习交流
7
―→
发生氧化反应,
―→—CH2—OH 发生还原反应。
PPT学习交流
8
2饱和一元醛和一元酮的通式皆为分子中碳原子数相同的饱和一元醛和饱和一元酮互为常见的醛酮羰基ppt学习交流醛酮的化学性质探究1羰基的加成反应hxhcnnhppt学习交流几种与醛反应的试剂及加成产物如下表
第3节
ቤተ መጻሕፍቲ ባይዱ醛和酮__糖类
第 1 课时 常见的醛和酮 醛和酮的化学性质
PPT学习交流
1
常见的醛、酮
[新知探究] 探究 1 醛和酮 (1)概念: ①醛是指羰基碳原子分别与 氢 原子和烃基(或 氢 原子) 相连的化合物。 ②酮是 羰基碳原子 与两个烃基相连的化合物。 (2)饱和一元醛和一元酮的通式皆为 CnH2nO ,分子中碳 原子数相同的饱和一元醛和饱和一元酮互为同分异构体。
PPT学习交流
2
醛、酮的化学性质 探究 1 羰基的加成反应 醛基上的 C===O 键在一定条件下可与 H2、HX、HCN、 NH3、氨的衍生物、醇等发生加成反应。
PPT学习交流
3
几种与醛反应的试剂及加成产物如下表:
试剂名称
化学式
δ+ δ- 电荷分布 A—B
与乙醛加 成的产物
氢氰酸 H—CN
δ+ δ- H—CN
__________
氨及氨的衍生 物(以氨为例) NH3
δ+ δ- H—NH2
__________
PPT学习交流
4
试剂名称 化学式
δ+ δ- 电荷分布 A—B
醇类(以甲 醇为例) CH3—OH
《醛和酮教学》课件

醛和酮具有致癌性,长期接触可 能导致癌症
醛和酮具有挥发性,容易扩散到 空气中,对环境和人体健康造成 危害
醛和酮的安全操作规程
操作前必须穿戴防护服、手套和 口罩等防护用品
操作过程中保持通风,避免吸入 有害气体
避免皮肤直接接触醛和酮,如有 接触应及时清洗
操作结束后,及时清理现场,确 保安全无隐患
醛和酮的防护措施
佩戴防护眼镜和口 罩,避免直接接触
保持通风,避免长 时间接触
使用防护手套和防 护服,避免皮肤接 触
定期进行安全培训 ,提高安全意识
醛和酮的应急处理方法
立即离开事故现场,到空气新鲜的地方,保持呼吸道通畅
皮肤接触后应立即脱去污染的衣物,用肥皂水或清水彻底冲洗
眼睛接触后应立即提起眼睑,用大量流动清水或生理盐水彻底冲洗
酮的还原反应: 在催化剂作用下, 酮被还原为醇
反应条件:催化 剂、加热、加压 等
反应产物:醇
应用:合成有机 化合物、药物合 成等
氧化反应
酮的氧化反应: 酮在空气中可 以被氧化为羧
酸
氧化剂:常用 的氧化剂包括 氧气、过氧化
氢等
反应条件:通 常在加热或光 照条件下进行
产物:酮的氧 化产物为羧酸, 如丙酮氧化为
亲核加成反应
反应类型:亲核加成反应
反应条件:碱性条件下
反应产物:加成产物
反应机理:亲核试剂进攻羰基碳,形成碳负离子,然后与亲核试剂结合生成加成 产物。
醛的亲电加成反应:醛与亲电试剂 (如HCN、H2O、HBr等)发生 加成反应,生成相应的加成产物。
亲电加成反应
加成反应条件:醛的亲电加成反应 通常在碱性条件下进行,以促进羰 基碳原子的亲核性。
醛的化学性质
演示文稿醛和酮的化学性质课件

第一页,共20页。
学习目标
1、理解醛和酮的化学性质
2、理解糖的概念、分类及单糖 的性质
第二页,共20页。
旧知复习
1、什么是醛?什么是酮?醛与酮的结构相同点 与不同点是什么?饱和一元醛与饱和一元酮的组 成通式是什么? 2、分子中有醛基就一定是醛吗?
第三页,共20页。
旧知复习
3、写出下列反应的化学方程式 丙醛分别与H2、NH3、CH3OH、HCN反应的化学
HCHO + 4Cu(OH)2
CO2↑ + 2Cu2O↓ + 5H2O
第十七页,共20页。
练一练
1.下列说法中,正确的是( C ) A.乙醛分子中的所有原子都在同一平面上 B.凡是能发生银镜反应的有机物都是醛 C.醛类既能被氧化为羧基,又能被还原为醇 D.完全燃烧等物质的量的乙醛和乙醇,消耗 氧气的质量相等
CH3CHO + 2Cu(OH)2
CH3COOH + Cu2O↓ + 2H2O
乙醇 还原(加H) 乙醛 氧化(加O)
氧化(失H)
乙酸
银氨溶液和新制氢氧化铜悬浊液均可用于鉴定醛基存在;
1mol醛基~ 2mol [Ag(NH3)2]OH ~ 2mol Ag
1mol醛基~
第十六页,共20页。
2molCu(OH)2
4、试管加热过程中,不可震荡。
5、当银镜生成后,试管内的液体应及时处理,不可久 置,试管用稀硝酸洗涤。
第十页,共20页。
应用:
①此反应用于醛基的检验以及醛基数目的测定 1mol醛基 ~ 2mol Ag
②工业上用此原理,将银镀在玻璃上制镜或瓶胆
第十一页,共20页。
第十二页,共20页。
高中化学_醛酮的化学性质教学课件设计

H OCH3
︱OH
H C CN
CH3
︱OH
H C NH2 CH3
︱OH
H C OCH3
CH3
加成规律?
二、醛、酮的化学性质
1.羰基的加成反应
(1)常见的加成试剂:氢氰酸、氨及氨的衍生物、醇 等。
(2)加成规律:
规律:羰基的加成反应符合电性规律,加到羰基氧上 的大多数是活泼“H”。
(3)写化学方程式:
D.在 Cu 存在下和 O2 反应后的产物中再加银氨溶液
1丙醇和2丙醇都含—OH, 都能与Na反应放出H2,因 此A不可以; 都不能和银氨溶液反应, B不能鉴别二者;
但是1丙醇,2丙醇在Cu 存在下氧化产物不同,前 者为醛,后者为酮,可通 过鉴别醛、酮加以鉴别。
5.茉莉醛具有浓郁的茉莉花香,其结构简式如
官能团羰基对
分子中相邻基 团的影响使αH 变得比较活泼
自身加成 稀碱溶液 CH3CH(OH)CH2CHO
反应;取 (OH-) ;
代反应 X2等
CH3CH=CHCHO
注意:醛基比较活泼,还能发生加聚和缩聚反应。
二、醛、酮的化学性质
1.羰基的加成反应
(1)常见的加成试剂: 氢氰酸、氨及氨的衍生物、醇等。
O 元素组成,故易燃烧。
点燃 ①燃烧:2CH3CHO+5O2――→ 4CO2+4H2O
②催化氧化:2CH3
催化剂 +O2 ―△―→ 2CH3COOH
③乙醛被银氨溶液氧化——乙醛的银镜反应
银镜反应实验操作: 注意事项见“同步”P44。
实验现象: 滴加氨水,先出现 白色沉淀 后 溶解,水浴加热一段时间后, 试管内壁出现一层光亮的银镜。 实验结论: 乙醛被银氨溶液 氧化 生成 单质银 。有关化学方程式为 a.AgNO3+NH3·H2O=== AgOH↓+NH4NO3; b.AgOH+2NH3·H2O―→ [Ag(NH3)2]OH+2H2O;
醛和酮ppt学习教程.pptx

第7页/共102页
CH2
CH3 CH2
CO
(CH2)12
CHO CHO
3-甲基环十五酮(麝香酮)
1,2-萘二甲醛
3-methylcyclopentadcanone 1,2-naphthalene dicarbaldehyde
O CCH(CH3)2
2-甲基-1-环己基-1-丙酮 1-cyclohexyl-2-methyl-1-propanone
CH3 CH3
C
HCN
O
CH3
CH3 C OH
H2SO4
Δ
CN
CH3
CH3
CH3OH
CH2 C COOH
CH2 C COOCH3
H2O
α-甲基丙烯酸甲酯
第23页/共102页
②和Grignard试剂加成: ❖加成产物水解后生成醇。
C
δ-
O+R
δ+
MgX
Et2O
C
R H+,H2O R C OH
OMgX
第13页/共102页
⑤红外光谱: ❖C=O的伸缩振动在1750~1680cm-1处有一强吸收带,醛(1730cm-1)稍 高于酮(1715cm-1),当羰基与双键共轭时,吸收向低频方向位移。 ❖醛基的C—H键在2750 cm-1附近有一个非常特征的吸收峰。
第14页/共102页
❖乙醛的红外光谱:
1727 cm-1为C=O键的伸缩振动,2846 cm-1和2733 cm-1为醛基C—H键 的伸缩振动; 3001 cm-1为甲基C—H键的伸缩振动,1350 cm-1为甲基C—H键的弯曲 振动。
❖在实际应用中,常用乙二醇和醛或酮作用生成环状缩醛或缩酮以保护羰基。
高二有机化学优质课件5:2.3.2醛、酮的化学性质

羰基的加成反应
试剂 断裂键 生成键 产物 举例
应 用
醛
或 酮
HCN
羰基中 的碳氧 键,
氧氢键 碳碳键
羟基 腈
增 长 碳 链
醛
或 酮
NH3
O—H 羟基 C—N 胺
制 备 胺
醛 或 R— 酮 OH
羟基
制
O—H 醚
半
C—O (半缩
缩
醛)
醛
2.醛和酮的氧化反应 醛基是一种还原性基团,可被多种氧化剂氧化。 ①银镜反应
为乙酸,反应的化学方程式为 2CH3CHO+O2 催化剂 2CH3COOH。 ④燃烧反应方程式: 2CH3CHO+5O2 点燃 4CO2+4H2O
课堂小结
醛和酮的化 学性质
羰基的加成 反应
氧化反应
银镜反应
与新制 Cu(OH)2反应
当堂检测
1.丙烯醛的结构简式为CH2══CHCHO,下列有 关其性质的叙述不正确的是( B )
D.甲酸甲酯
3 .有机物A是合成二氢荆芥内酯的重要原料, 其结构简式为
下列检验A中官能团的试剂和顺序正确的是( D ) A.先加酸性高锰酸钾溶液,后加银氨溶液,微热 B.先加溴水,后加酸性高锰酸钾溶液 C.先加银氨溶液,微热,再加入溴水 D.先加入新制氢氧化铜,微热,酸化后再加溴水
THANKS
2.制得的银镜怎样除去? 提示:做过银镜反应实验的试管可以用稀硝酸加热
除去银镜。
②与新制Cu(OH)2的反应 实验操作
实验现象 ①中溶液出现蓝色絮状沉淀,滴入乙醛,加热至沸
腾后,③中溶液有红色沉淀产生
反应方程式
△
CH3CHO+2Cu(OH)2+NaOH CH3COONa+Cu2O↓ +3H2O 反应说明 a.配制氢氧化铜时,碱要过量 b.醛类以及含醛基的化合物,也具有此性质 反应应用 检验—CHO的存在
高二有机化学(选修):醛酮的化学性质PPT课件

LOGO
甲醛是化学工业中的多面手
酚醛树脂 脲醛树脂
—— 粘合剂
LOGO
甲醛是化学工业中的多面手
甲醛滥用的主要原因在于其低廉的 价格,1吨甲醛价格在1600元上下。
我国已研制成功不含甲醛的环保型 脲醛树脂,然而时至今日也没有被大量 投产,主要原因就是价钱昂贵。
LOGO
LOGO
醛和酮的化学性质
LOGO
LOGO
新闻报道
LOGO
甲醛是房中头号“杀手”
为什么甲 醛会使人 中毒?
交LOG流O
探究 醛、酮羰基的结构
醛、酮可能发生哪些化学反应?
H (R) H
R’ C H
CO
加成反应
加成反应:有机化合物中 的不饱和键两端的原子与 其他原子或原子团结合,
生成新化合物的反应。
LOGO
方法导引
(R, )Hd+ d - d+ d C O+A B
R
(R , )H R C OA
B
碳氧双键具有较强的极性,双键上的 不饱和碳原子带部分正电荷,发生加 成反应时,碳原子与试剂中带部分负 电荷的基团结合。
LOGO
几种与醛、酮加成试剂
试剂名称
氢氰酸 氨及氨的衍生物
(以氨为例) 醇类
(以甲醇为例)
LOGO
纺织行业
LOGO
乙醛与几种试剂的加成反应过程
O CH3C H
H + CN
一定条件OH CH3CH Fra bibliotekNLOGO
与氢氰酸的加成
H C
R
O
+
d+
H
d-
高中化学《醛酮及其化学性质》优质教学课件设计

氧化反 应
氧化反 应
1 .区别 1 丙醇和 2 丙醇的方法是 ()
D
A .加金属钠 B
.加银氨溶液
C .在 Cu 存在下与 O2 反应
D .在 Cu 存在下和 O2 反应后的产物中再加银氨溶
液
2. 茉莉醛具有浓郁的茉莉花香,其结构简式如下所示 :
D
关于茉莉醛的下列叙述错误的是 (
)
A .在加热和催化剂作用下,能被氢气还原
醛的氧化反应:①与空气中的 O 2 ② 与酸性高锰酸钾溶液溴水等强氧化剂
③ 与银氨溶液、新制氢氧化铜悬浊液的反应
还原反应 :醛和酮的羰基可以与氢气发Th还原反应,
还原产物一般是醇。
CH3CH2OH
氧化 还原
CH3CHO
氧化
CH3COOH
小结:醛的转化
还原反 应
RCH2OH
O R-C-H
CH3COOH
实验
乙醛与酸 性 高锰酸 钾溶 液或 溴水
银镜反应 乙醛与新制 Cu(OH) 2 悬
浊液
归纳升
华
现 象
溶液褪色
结论
乙醛能被酸性高锰酸钾溶液、 溴水氧化
乙醛能 发 Th氧化反 应 ,具有 还 原 性
试管壁上 出现银镜
有砖红色 沉 淀 Th 成 ( Cu2O )
乙醛能被银氨溶液和新制 Cu(OH)2 悬浊液氧化(乙醛能被 弱氧化剂氧化)
HC CCH
HH
H
H
CH3COCH3 +H2
催化 剂
OH CH3CHCH
(三)氧化反
1. 醛的氧应化反应: O
R CH
O
1 )空气中的 O2 能氧化醛
催化剂
2CH3CHO + O2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3 、醛酮在有机合成中是重要的中间产物,下 图是
乙醛和一些有机物的转化关系,
② O2
甲
① H2
④ Cu(OH)2
CH3CHO
丙
③ HCN
乙
( 1 )说出四个反应的反应类型。 ( 2 )甲和丙分别代表哪种物质? ( 3 )碳链增长的反应是哪一个?
查阅资料,工业上是如何制备镜子的?
H
脱
氢酶
( 2 )乙醛的催化氧
化
2CH3CHO+O2
催化 剂
2CH3COOH
CH3-CH2-OH -化H酶氧CH3-CO-H
+O 酶
氧化
O
CH3-C-O-H
+H 还 原
酒 在 O人H体 内 经-H过氧了化哪 些 变 O化
C每?H种3C酶H在C不H同3
在你
个
体
C中H含3 -量C-是-C不H3同
的
,
现
氧化反应:
。
有机物分子中增加 O 或 减少 H 的反应。
一、羰基的加成反
应2 、与极性分子的加成
CH试3C剂O名 称H
H
+条
C化N
学
式一
件
定
OH
电 荷 CH分3C布H
CN
氢氰
酸O CH3甲3 C醇H
HCN
CHN 一定
+ HOCCHH3O3 条件H
δ+ H
δCO-NOCHN
δ+CHδ3C3-CH2OCH 3
鲁科版 有机化学基础
第二章 第三节类 醛和酮 糖 醛和酮的化学性质
O
– – CH3232 C H
O
CH23–C–CH3
一、羰基的加成反
应 1 、与 H2 加成
O
H
CH3C
+H
H
还原反 应
OH
Ni
△
CH3CH2
O
H
CH3C
+H
CH3
OH
Ni
CH3CH CH3
△
还原反应:
有机物分子中增加 H 或 减少 O 的反应
醛 ,放在水浴中加
热
氨水不能 过 多不能 过少
水浴加 热 不能 振荡
2 、与弱氧化剂的反
应( 2 )与 Cu(OH)2 悬浊液反应实验步骤及注意
事项
1 向试管加入 2ml 10% NaOH 溶液
2 滴入 4~6 滴 2%CuSO4 溶液, 振荡
碱要过量
3 上述蓝色浊液中加入 0.5ml 乙醛 溶液,加热至沸腾 液
解能释 有 的 人 滴 +酒H不还沾原, 有 的 人 会 面 红 耳
赤
一、羰基的加
成1 、与 H2 加成—还原反
应2 、与极性分子的加成:
醛基
HCN
、
CH 3OH
、
易被 N氧H3 化
二、醛酮的氧化反应
O
1 、与酸性高锰酸钾溶液反
应
CH3-C-H
2 、与弱氧化剂的反应
不
((12)) 与) 银新镜制反备应氢氧化铜悬浊液饱和 3 键、 与 氧 气 的 反
应
O
CH3-C-CH3
(1) ) 燃烧
(2) ) 催化氧化
1 、下列物质中不能氧化醛类的
是A. 银氨溶
√B. 金属钠
液
D. 新制氢氧化
C. 氧
铜
气2 、悬已浊知柠檬醛的结构简式如下,说法不正确
液的是
CH3
CH3
CH3-C=CH-CH2-CH2-C=CH-CHO Nhomakorabea√
A. 可使溴水褪色
B.和氢气加成后最终产物分子式为 C10H20O
OH
O HH O
CO NH2 CH2 O NH2 CH2
甲醛与蛋白质反应示意图
O
O
H-C-H
H-O-C-O-H
甲 醛
O
CH3–C–H
碳 酸
O
CH3–C–CH3
根 据 甲 醛 、 乙 醛 和 丙 酮 的 结 构 ,,预 测 乙 醛 和 丙 酮 能 否 发 ThhT上h上述述氧氧化化 反
反应 ?应?如?何如设何计设实计验实验验证验?证??
和C丙C酮H
( 2 )实验现象
乙醛能使高锰酸钾溶液褪色,丙酮不 能
CH3CHO 酸性 KMnO4 CH3COOH
2 、与弱氧化剂的反 应 ( 1 )与银氨溶液反应的实验步骤及注意事项
银氨 1 取一支洁净试管,加入
溶
1ml 2% 的 AgNO3 溶液
液 2 逐滴滴加 2% 的氨水,并振
荡
3 ,在直上到述产溶T液h的中沉,滴淀加恰好4 滴消乙失
H NH2
氨O
CH3C H
H NH3一定条
+ NH2 件
δ+ OδHHCH3OCHCH3NH2
HOH H
H
C OC N C C N
CHH3 – C –H + HH-NOXY
H2C O HH
H OH C C N OH
NH32+ CH33– C –H CH22 O NXY
COO-
C CN C C N C
10%10N%aNOaHOa 2%2%CCuuSSOO4
OH
O4
乙醛 醛
( 3 )实验现象及解 释 银镜反应:
A: 有沉淀Th成,后又溶解
氢氧化 二氨合 银
AgNO3 + NH3 ·H2O = AgOH + NH4NO3
AgOH + 2NH3 ·H2O = [Ag(NH3)2]OH + 2H2O
B :试管内壁有光亮的银镜产Th
CH3CHO+2[Ag(NH3)2]OH=CH3COONH4+H2O+2Ag +3NH3
应用:醛基的检验和测定。 工业上利用该原理制镜子,瓶胆。
( 3 )现象及解释 与氢氧化铜悬浊液的反应: A: 得到蓝色悬浊液
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
B :有砖红色沉淀Th成
CH3CHO+2Cu(OH)2=CH3COOH+2H2O+Cu2O
应用: 醛基的检验和测定。
常。
医学上利用该原理检验病人尿糖是否正
二、 醛酮的氧化反 应
如果工业上需要制备大量乙酸,那 么采用什么氧化剂来氧化乙醛呢?
3 、乙O醛与氧气酸反性应
4
丙酮
O可以 燃 烧
– – – – - C燃KMH溶烧n3(OC12)CHH乙3C醛HO的溶液新液液+5制银O氨2Cu燃氨点 燃(OH4)2C悬CO2浊H+43H2OC乙O醛
身边可以利用的氧化 剂
氧气、 酸性高锰酸钾 银氨溶液、新制备的氢氧化铜悬 浊液
1 、醛酮与酸性高锰酸
钾
醛 被
(1) 基项易 氧化
1
实验步骤及注意事
取 高
锰O2支酸试钾管溶,
各
加入
O1ml
酸
酮羰基 性易不被 氧 化
- - - - C2C2H液分3 溶3液象
别C滴H入
,振荡
几 ,
滴 观
察C乙H现醛3
