第十九章 碳水化合物
第十九章碳水化合物

1C2O HH 2CO HO 3 H H4 OH H5 OH 6C2O HH
2、果糖得环状结构 果糖在形成环状结构时,可由C5上得羟基与羰基形成呋喃
式环,也可由C6上得羟基与羰基形成吡喃式环。两种氧环式 都有α型和β型两种构型,因此,果糖可能有五种构型。
溴水能氧化醛糖,但不能氧化酮糖,因为酸 性条件下,不会引起糖分子得异构化作用。可 用此反应来区别醛糖和酮糖。
CH 2 OH
HH O OH H
OH
OH H OH
D 葡萄糖
CH 2 OH
Hale Waihona Puke Br 2 H H OH 2O
OH H
O
OH
H OH
D 葡萄糖酸 δ 内酯
COOH H OH HO H H OH H OH
2
C 6 H 12 O 7 + Ag 葡萄糖酸 C 6 H 12 O 7 + Cu 2 O
红色沉淀
凡就是能被上述弱氧化剂氧化得糖,都称为还原 糖,所以,果糖也就是还原糖。
果糖具有还原性得原因:差向异构化作用——果糖在稀碱溶
液中可发生酮式-烯醇式互变,酮基不断地变成醛基(土伦试剂
和费林试剂都就是碱性试剂,故酮糖能被这两种试剂氧化)。
大家应该也有点累了,稍作休息
大家有疑问的,可以询问和交流
9
19世纪末,20世纪初,费歇尔(E•Fischer)首先 对糖进行了系统得研究,确定了葡萄糖得结构。葡 萄糖得构型如下:
C C
H O H H
H H H O
H O H H
H O H H
C 2 O C 2 O
D - ( + ) L ( )
南京医科大学有机化学Chap19-碳水化合物练习题
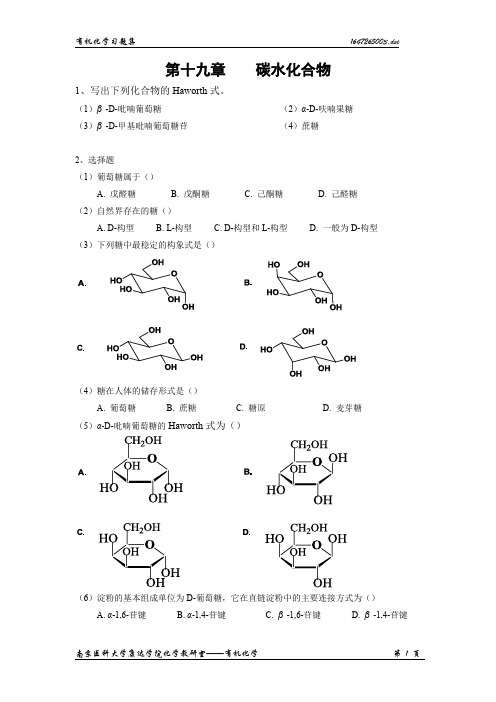
第十九章碳水化合物1、写出下列化合物的Haworth式。
(1)β-D-吡喃葡萄糖(2)α-D-呋喃果糖(3)β-D-甲基吡喃葡萄糖苷(4)蔗糖2、选择题(1)葡萄糖属于()A. 戊醛糖B. 戊酮糖C. 己酮糖D. 己醛糖(2)自然界存在的糖()A. D-构型B. L-构型C. D-构型和L-构型D. 一般为D-构型(3)下列糖中最稳定的构象式是()(4)糖在人体的储存形式是()A. 葡萄糖B. 蔗糖C. 糖原D. 麦芽糖(5)α-D-吡喃葡萄糖的Haworth式为()(6)淀粉的基本组成单位为D-葡萄糖,它在直链淀粉中的主要连接方式为()A. α-1,6-苷键B. α-1,4-苷键C. β-1,6-苷键D. β-1,4-苷键(7)下列糖与HNO3反应后,产生内消旋体的是()(8)互为差向异构体的两种糖,一定互为()A. 端基异构B. 互变异构C. 对映体D. 非对映体(9)D-吡喃葡萄糖与1mol无水乙醇和干燥HCl反应得到的产物属于()A. 醚B. 酯C. 缩醛D. 半缩醛(10)下列叙述正确的是()A. 糖类又称为碳水化合物,都符合C m(H2O)n通式B. 葡萄糖和果糖具有相同分子式C. α-D-葡萄糖和β-D-葡萄糖溶于水后,比旋光度都会增大D. 葡萄糖分子中含有醛基,在干燥HCl下,与1mol甲醇生成半缩醛,与2mol甲醇生成缩醛3. 是非题(1)变旋光现象是由于糖在溶液中发生水解而产生的一种现象。
()(2)糖苷通常由糖的半缩醛羟基和任一具有羟基的配体化合物脱水而生成。
()(3)由于β-D-葡萄糖的构象为优势构象,所以在葡萄糖水溶液中,其含量大于α-D-葡萄糖。
(4)葡萄糖、果糖、甘露糖三者既为同分异构体,又互为差向异构体。
()(5)β-D-甲基吡喃葡萄糖苷在酸性水溶液中会产生变旋光现象。
()。
Ch.19 碳水化合物

第19章碳水化合物一、碳水化合物定义的沿革在自然界中有一类分布最广的有机物,它们绝大多数分子式中H、O原子的比例与H2O分子的相同,即2 1,符合例如葡萄糖和果糖,分子式均为C6H12O6,又如淀粉和纤维素,分子式均可表示为:最初,由于不知道这类化合物的结构,就把它们看作是碳的水合物,因此把这一大类有机物称为碳水化合物。
给这一大类有机物这样一个名称是确切的,因为有个别属于这类化合物的物质,其分子式并不符合这述通式。
例如鼠李糖,分子式为C6H12O5,就不符合上通式。
而有些不属于这类化合物和物质,如乳酸C3H6O3、乙酸C2H4O2却反而符合上通式。
显然,从组成去定义这类有机物是科学的。
现在的含义——是指多羟基醛、酮或水解后能产生多羟基醛、酮的化合物。
这个定义与最初的定义有着本质的不同,最初的定义着眼于组成,现在的定义则着眼于结构。
所谓的多羟基,是指分子中含有二个以上的羟基,显然,对于大多数的碳水化合物,除了羰基C外,其余每个C原子一般都连有一个OH。
二、碳水化合物的分类根据结构和性质分为三类。
1. 单糖是最简单的多羟基醛、酮,不能水解产生更简单的多羟基醛、酮。
如葡萄糖、果糖、阿拉伯糖2. 低聚糖经水解能产生2-10分子单糖的化合物。
3. 多糖经水解能产生10分子以上单糖的化合物。
如淀粉、纤维素三、碳水化合物的来源碳水化合物是植物光合作用的产物:碳水化合物在生物体内代谢时被氧化成CO2和H2O,同时产生能量:可见,碳水化合物是储存太阳能的物质,是动、植物体生命活动不可缺少的一类化合物。
碳水化合物燃烧时,所储存的太阳能几乎全部转化为热能。
第一节单糖一、醛糖的递升与递降1. 递升将一个醛糖转变为高一级醛糖的过程称为递升。
递升是通过克利安尼(H.Kiliani)合成法来实现的:将醛糖与HCN 加成,生成α-羟基腈,此时醛基C从非手性C原子转变为手性C原子,这样就得到二个异构体(为差向异构体),经水解,这两个异构体转变为二个酸,由于 -COOH的第4位(即γ位)C原子含有 -OH,因此很容易失水形成γ-内酯(这是γ-羟基酸的特性!),再经Na-Hg (CO2或H2O)还原,得到二个高一级的互为差向异构体的醛糖。
第十九章碳水化合物ppt课件

事实上,碳水化合物并不是以C和H2O的形式 存在的。 鼠李糖——C6H12O5,其结构与性质均与碳水 化合物相同,但却不符合上面的通式。 HCHO = CH2O;CH3COOH = C2(H2O)2 符合 上面的通式,但它们却不是糖。 可见沿用至今的碳水化合物这一名称已失去了 原来的涵义。
糖的分类
αD(+ )葡 萄 糖
差 向 异 构 体 又 称 异 头 物
上式为Fischer投影式,另一表示方法是用Haworth 式表示—即用六元环平面表示氧环式各原子在空间 的排布方式
2、糖的Haworth式
CHO OH
HO OH OH
CH2OH
HOCH2
CHO
HO H 120o CH2OH
R
CH2OH CHO
O
三. 环缩醛、环缩酮的生成
OH
HO
O
HO
OH
OH + PhCH
ZnCl2 O
H
Ph
O
O
HO
O
+ H2O
OH OH
OH
HO HO
cis-1,2-glycol
O H
OH OH
cis-1,2-glycol
O +
Me Me
Me
Me OH
ZnCl2 H3PO4
O O
Me
O
H O
O
+ H2O
Me
四、糖的差向异构化
1、链的增长——Kiliani氰化增碳法
CHO
H
OH
CHOH D-甘油醛
HCN
CN
H
OH
19碳水化合物61页PPT

• B. 变旋现象
一个有旋光的化合物,放入溶液中,它的旋光度 逐渐变化,最后达到一个稳定的平衡值,这种现象 称为变旋现象。
CH2OH OC
H C OH
HO C H H C OH
HO C H
H C OH
H C OH HO C HLeabharlann HO C H D- 阿洛酮糖
HO C H
HO C H HO C H
HO C H
D- 塔格 糖 CH2OH D- 山 梨 糖CH2OH
CH2OH
CH2OH
3、构型的表示方法
糖的构型一般用费歇尔式表示,为了书写方便,可以 写成省写式。其常见的表示方法为:
5、当爱不能完美,我宁愿选择无悔,不管来生多么美丽,我不愿失 去今生对你的记忆,我不求天长地久的美景,我只要生生世世的轮 回里有你。
第十九章 糖类化合物 (carbohydrates)
定义:碳水化合物也叫糖,是多羟基醛、酮或其缩 合物,由碳、氢、氧三种元素组成。
糖类的分子组成:
• 葡萄糖
• 果糖
果糖
C H2O H
OH
C CN
CHOH
H 2O
CHOH
CHOH
C H2O H
C H3 CH COOH
C H2 C H2 C H2 C H3
α -甲基己酸
葡萄糖和果糖的结构式:
C H 2 C H C H C H C H C H O C H 2 C H C H C H C C H 2 O H O H O H O H O H O H O H O H O H O O H
③ 碳骼的确定:
己醛糖 Na-Hg 己六醇 [H] 正己烷
有机化学第十九章:碳水化合物PPT课件

对映体的构型可用R、S标记 如 D-(+)-葡萄糖
CHO H-C-OH HO-C-H H-C-OH H-C-OH
1
2R 3S 4R 5R
CH2OH 6
2R,3S,4R,5R-2,3,4,5,6-五羟基己醛
相对构型(D系列和L系列):
以甘油醛为标准
CHO *CHOH
CH2OH
甘油醛
CHO H-C-OH
单糖根据含 碳数可分为
§19-2 单糖
醛糖—— 多羟基醛
酮糖—— 多羟基酮
CHO CHOH CHOH CHOH CHOH CH2OH
CH2OH C=O
CHOH CHOH CHOH CH2OH
CH2—CH—CHO
含C3糖—— 丙糖 (或三碳糖)
OH OH 甘油糖 CH2—C—CH2
=
OH O OH
含C4糖—— 丁糖(或四碳糖) α,α/-羟基丙酮
D-葡萄糖
CH2OH
D-葡萄糖苯腙
CH=N-NHC=O
H2N-NH-
-NH3,-C6H5NH2
CH=N-NHC=N-NH-
CH2OH
-H2O
CH2OH
D-葡萄糖脎
21
反应是在羰基和具有羟基的α- 碳上进行,单糖一般在 C1和C2上发生,若糖只是C1或C2构型或羰基不同,其它手 性碳都相同,则生成的脎也相同。
所有的单糖都属于还原性糖
24
② 与溴水反应 溴的水溶液含有次溴酸,能将醛糖氧化成糖酸。由于
在酸性条件下糖不发生差向异构体,因此溴水只氧化醛糖
不氧化酮糖。这一反应可用于醛和酮糖的鉴别。
CHO
COOH
Br2 H2O
CH2OH
D-葡萄糖
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH2OH
(3S,4R,5R)-1,3,4,5,6-五羟基-2-己酮 或 D-(-)-果糖
(1) 单糖的构型和标记
单糖构型的确定是以甘油醛为标准的。
即单糖分子中距离羰基最远的手性碳原子与D-(+)-甘 油醛的手性碳原子构型相同时,称为D型糖;反之,称 为L型。
下面是D-醛糖的构型和名称:
构型D/L与旋光方向(+)/(-)没有固定的关系:
££ ·£ £ ¨ HaworthÊ ½£ © CH2OH O OH H
b- D-(+)-£ £££ m.p=150 C [a]
20
£ m.p=146 C
20
-OH£ £££££££ ù ££ a-OH£ £££££££ ù ££ b-
£
[a]
D =+112
£
D =+19
£
环的生成使原来的羰基碳变成了 * C(苷原子), 生成了苷原子构型不同的两种氧环式结构: α-D-(+)- 葡萄糖苷羟基与 C5 上的- CH2OH 位于异侧 (第一种结晶); β-D-(+)- 葡萄糖苷羟基与 C5 上的- CH2OH 位于同侧 (第二种结晶)。 α-D-(+)-葡萄糖与β-D-(+)-葡萄糖互为差向异 构体或异头物。
H2O/H+
H3CO
CH2OCH3 O OCH3 CHOH OCH3
££ ×£ ù £££
££ ×£ ù £££
由于葡萄糖的环状半缩醛结构含有吡喃环( 所以葡萄糖的六元氧环式结构的全称为:
葡萄糖的环状半缩醛结构可以解释变旋现象:
££ ·£ £ ¨ HaworthÊ ½£ © CH2OH OH OH
a- D-(+)-£ £££ m.p=146 C [a]
20
£££
££ ·£ £ ¨ HaworthÊ ½£ © CH2OH O OH H
b- D-(+)-£ £££ m.p=150 C [a]
碳水化合物
(一) 碳水化合物的分类 (二) 单糖 (三) 二糖 (四) 多糖
第十九章 碳水化合物
(一) 碳水化合物的分类
碳水化合物又称为糖类。如葡萄糖、果糖、蔗糖、淀 粉、纤维素等。 碳水化合物在自然界中分布广泛,是重要的轻纺原料。
“碳水化合物”一词的由来 ——分子式符合 Cx(H2O)y。
“碳水化合物”的含义——多羟基醛酮或能水解成多 羟基醛酮的化合物。
葡萄糖是一种己醛糖:
CHO H HO H H OH H OH OH CH2OH CH2OH 或 或 CHO
(2R,3S,4R,5R)-2,3,4,5,6-五羟基己醛 或 D-(+)-葡萄糖
果糖是一种己酮糖:
CH2OH C=O HO H H H OH OH CH2OH 或
CH2OH C=O 或 C=O
D-(+)-甘油醛
D-(-)-核糖
D-(+)-葡萄糖
“ ”代表-CH2OH; “ ” “ ” 代表-CHO; 代表-OH。
自然界中存在的糖通常是D-型的。 例如:葡萄糖和果糖都是D-型的。
(2) 单糖的氧环式结构
实验事实:
①葡萄糖有两种晶体:
两种晶体溶于水后,比旋光度([α] D20)都将随着时 间的改变而改变,最后逐渐变成[α]D20=52.5°,发生所 谓“变旋现象”。 变旋现象——随时间的变化,物质的比旋光度逐渐地 增大或减小,最后达到恒定值的现象。
(二) 单糖
(1) 单糖的构型和标记 (2) 单糖的氧环式结构 (3) 单糖的构象 (4) 单糖的化学性质 (5) 脱氧糖 (6) 氨基糖
(二) 单糖
根据分子中所含碳的个数,单糖可分为己糖、戊糖等。 分子中含醛基的糖称为醛糖,含有酮基的糖称为酮糖。 例: 1
CHO 2 CHOH
3 4 1
CH2OH C=O CHOH
2 3 4
CHOH
CHO 2 CHOH
3 4
1
CHOH 5 CHOH 6 CH2OH
己醛糖 4个*C
16个对映异构
CHOH 5 CHOH 6 CH2OH
己酮糖 3个*C
8个对映异构
CHOH
CHOH 5 CH2OH
戊醛糖 3个*C
CHO 2 CHOH
3
1
CH2OH
丙醛糖
2个对映异构
8个对映异构
写糖的结构时,碳链竖置,羰基朝上,编号从靠近羰基一端开始。
葡萄糖中醛基碳的γ-或δ-位上也有羟基,也可以五 元或六元环状半缩醛形式存在:
H
££ ±£× £ £££ £££ ·× £ 120
£ OH
CH2OH CHO
CH2OH OH H CHO
££ ·£ £ ¨ HaworthÊ ½£ © CH2OH OH OH
a- D-(+)-£ £££
£££ CH2OH OH H CHO
20
£
£
D =+112
£ « É ¼ Ù
D =+19
£
Ò Î Ê Â Ï Â Ô ¼ Õ ¼ 36%
64%
葡萄糖的环状半缩醛结构还可解释实验事实②:
£££££ ¨ £££ á £ £££ á £££ ¨
CH2OH O OH CHOH HO OH
£££
(CH3)2SO4
H3CO
CH2OCH3 O OCH3 CHOCH3 OCH3
②
(CH3)2SO4
Ï Ì Æ Ñ Ì Ç
å ¼ Î ×» ù Æ Ï Ì Ñ Ì Ç
¨ £££££££
H2O/H+
Ä ¼ Ë ×» ù Æ Ï Ì Ñ Ì Ç
¨££££££ £ ££ ÷££££ ×££ ù ££± ££ ×£££ £ ££££ ù ££
¨££££££ £
££ ÷££· £× ££££££OH£ £ ££££££££ ù ££
碳水化合物可根据分子的大小分为三类:
①单糖:本身为多羟基醛酮,不能水解为更简单的糖。 如葡萄糖、果糖等。 单糖一般是结晶固体,能溶于水,绝大多数单糖有 甜味。 ②低聚糖:能水解为2-10个单糖的碳水化合物。如麦芽 糖、蔗糖等都是二糖。 低聚糖仍有甜味,能形成晶体,可溶于水。 ③多糖:能水解生成 10 个以上单糖的碳水化合物。一般 天然多糖能水解生成 100 - 300 个单糖。如淀粉、纤维 素等都是多糖。 多糖没有甜味,不能形成晶体(为无定形固体), 难溶于水。
以上两种实验现象无法用开链式得到解释。
人们从下述反应中得到启发:
CH2 CH2 CH3-CH-CH2-CH2-CHO OH
g - ££ ù £
H3C CH
CH OH O
பைடு நூலகம்·× £ £° £££
CH2-CH2-CH2-CH2-CHO OH
d- ££ ù £
CH2 CH2
CH2 O
CH2 CH OH
·× £ £° £££
