120 菌种检查记录
药品微生物限度检查控制菌实验记录

十六烷平板
G氏染色
氧化酶试验
绿脓菌素试验
生化试验
结果:(规定不得检出)
金黄色葡萄球菌检查(阳性菌加入CFU/ml)方法:
项目Βιβλιοθήκη 供试品阳性对照阴性对照
营养肉汤增菌
甘露醇氯化钠琼脂平板
G氏染色
血浆凝固酶试验
生化实验
结果:(规定不得检出)
结论:
检验者:校对者:报告日期:
文件编号:J
微生物限度检查实验记录Ⅱ
检品编号:批号:共页第页
沙门菌检查(阳性菌加入CFU/ml)方法:
项目
供试品
阳性对照
阴性对照
营养肉汤
TTB
DHL平板
EMB平板
TSI斜面
生化试验
血清凝集试验
结果:/10g(规定不得检出/10g)
铜绿假单胞菌检查(阳性菌加入CFU/ml)方法:
项目
供试品
阳性对照
阴性对照
清洁验证微生物检查记录

编号:SMP-09-00702-g
清洁对象名称
供样单位
取样点
检验日期
年 月 日
编号
报告日期
年 月 日
温度
℃
相对湿度
%
检验依据
《中国药典》2015年版四部《非无菌产品微生物限度检查》
标准规定
需氧菌≤100cfu/100cm²;霉菌酵母菌≤100cfu/100cm²
供试液的制备:用棉签擦拭取样点100cm²,将棉签放入无菌具塞玻璃试管中,加入10ml生理盐水中,振摇混匀,作为1:10的供试液。按《非无菌产品微生物限度检查》进行检验。
检查结果
需氧菌
培养箱型号:
培养箱编号:RHBC-ZK-
设定温度:
霉菌、酵母菌
培养箱型号:
培养箱编号:RHBC-ZK-
设定温度:
1
2
阴性
对照
1
2
阴性
Hale Waihona Puke 对照1天1天2天
2天
3天
3天
4天
4天
5天
5天
6天
7天
平均
平均
结果
结果
结论
检验人
复核人
各种菌落的检验记录
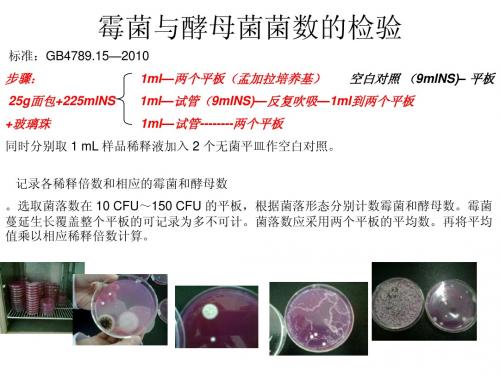
。选取菌落数在 10 CFU~150 CFU 的平板,根据菌落形态分别计数霉菌和酵母数。霉菌 蔓延生长覆盖整个平板的可记录为多不可计。菌落数应采用两个平板的平均数。再将平均 值乘以相应稀释倍数计算。
金黄葡萄球菌检验
标准:GB4789.10--2010 步骤: 25 g 牛奶至盛有 225 mL 7.5 %氯化钠肉汤,将上述培养物,分别划线接1环到 BairdParker 平板(5.8g+95mlNS+5ml_和血平板 平板上可疑菌落染色镜检:革兰氏阳性球菌,排列呈葡萄球状,无芽胞荚膜,直径约 为0.5m~1m 血浆凝固酶试验:挑取、Baird-Parker 平板或血平板上可疑菌落 1 个或以上, 分别 接种到 5 mL BHI –吸取1ml到磷酸盐缓冲液(注射液状的瓶子) 观察 6 h,如呈现凝固被判定为阳性结果。同时以血浆凝固酶试验阳性和阴性葡萄球 菌菌 株的肉汤培养物作为对照。 图片染色 25g牛奶+ 225ml75%NaCl肉汤 B-P平板,血平板 观察溶血 BHI肉汤 血浆凝固酶试验
样品名称 冰冻鸡 蛋
平板分 离 TT SC TS 赖氨酸 尿 B I 脱羧酶 素
+ + + + +
检验日 5.28 验 期 讫 日 期 生化鉴定
5.3 检 1 验 人
.。。。
氰 化 钾 +
蛋白胨 靛 基 质 + +
• • • • • •
二、致病性 1、沙门氏菌经口进入人体以后,在肠道内大量繁殖,经淋巴系统进入血液, 造成一过性菌血症,即感染过程。 2、随后,沙门氏菌在肠道和血液中受到机体的抵抗而被裂解、破坏,释放大 量内毒素,使人体中毒,出现中毒症状。 三、主要症状 急性胃肠炎。 潜伏期为6—12小时,最长可达24小时,病人临床表现为恶心、头痛、出冷 汗、面色苍白,继而出现呕吐、腹泻、发热,体温高达38~C一40C,大便水 样或带有脓血、粘液,中毒严重者出现寒战、惊厥、抽搐和昏迷等,此菌中 毒死亡率较低。
122-标准菌株确证实验原始记录
CDC/JL07-122 第 页 共 页
2009年03月02日发布 2009年03月06日实施
标准菌株确证实验原始记录
标准菌株名称: 来源: 验证日期: 200 年 月 日 菌株状态/包装: □ 完整 □ 破损
复苏:
孵育:
菌落形态检查纯度:
存活度实验:
培养
接种XLD 平板37℃培养24~
48h(沙门氏菌)□有 □无菌落 接种SS 平板37℃培养24h(志贺氏菌)□有 □无菌落
接种营养琼脂平板培养24~48h(沙门氏菌)□有 □无菌落
接种营养琼脂平板培养24~48h(沙门氏菌)□有 □无菌落 染色镜检
血清学试验
A ~F 多价血清□阳性□阴性
4种多价血清□阳性□阴性
生 化 试 验
噬菌体
葡萄糖铵 西蒙氏枸橼酸盐 赖氨酸 尿素 KCN 水杨苷 七叶苷 5%乳糖 甘露醇 棉子糖 甘油 靛基质 □阳性□阴性
□阳性□阴性 □阳性□阴性 □阳性□阴性 □阳性□阴性 □阳性□阴性 □阳性□阴性 □阳性□阴性 □阳性□阴性 □阳性□阴性 □阳性□阴性 □阳性□阴性
靛基质
尿素 KCN 赖氨酸 甘露醇 山梨醇 卫矛醇 水杨苷 ONPG 丙二酸盐
□阳性□阴性 □阳性□阴性 □阳性□阴性 □阳性□阴性 □阳性□阴性 □阳性□阴性 □阳性□阴性 □阳性□阴性 □阳性□阴性 □阳性□阴性
结 果
检测人: 复核人:
报告日期: 200 年 月 日。
微生物指标检查记录
微生物指标检查记录
记录编号:SOR-ZL-031-A/0 名称:
检验日期:年月日完成日期:年月日
批号:规格:
检验方法,计算及结果:温度:℃湿度:%
供试液制备:仪器型号:仪器编号:
取供试品 g,剪碎后加入到 ml灭菌生理盐水中,充分混匀,得到一个生理盐水样液。
稀释倍数K= 。
备注:
□营养琼脂培养基批号:□生理盐水批号:
培养箱仪器型号:
培养箱仪器编号:
细菌:细菌菌落总数计数检查法:(平皿法)温度:℃;培养时间:h
检验人:年月日复核人:年月日
控制菌仪器型号:仪器编号:温度:℃湿度: % 供试液制备:
取供试品 g,剪碎后加入到 ml灭菌生理盐水中,充分混匀,得到一个生理盐水样液。
备注:
□乳糖胆盐发酵培养基批号:□生理盐水批号:
□伊红美蓝琼脂培养基批号:□SCDLP液体培养基批号:
□十六烷三甲基溴化铵琼脂培养基批号:□血液琼脂基础培养基批号:
□葡萄糖肉汤培养基批号:□沙氏琼脂培养基批号:
□其它培养基
□大肠埃希菌批号为来源:
□绿脓杆菌批号为来源:
□金黄色葡萄球菌批号为来源:
□溶血性链球菌批号为来源:
控制菌培养箱仪器型号:
控制菌培养箱仪器编号:
检验人:年月日复核人:年月日
检验人:年月日复核人:年月日
年月日复核人:年月日
检验人:
结论:本品按GB15979-2002附录B产品微生物检测方法检验:结果□符合规定□不符合规定。
52菌种鉴定记录

日期:日期:
检定菌种鉴定记录
编码:JT-RD-02-052-00
菌种名称
编号
鉴定时间
鉴定原因
鉴
定
镜下形态
典型生化特征
鉴定结论:
鉴定人:复核人:
日期:日期:
检定菌种鉴定记录
编码:JT-RD-02-052-00
菌种名称
编号
鉴定时间
鉴定原因
鉴
定
项
目
菌落形态
革兰染色
显微镜下形态
典型生化特征
鉴定结论:
52菌种鉴定记录 编码:编码:编码:jt-rd-02-052-00 jt-rd-02-052-00 jt-rd-02-052-00编码:编码:编码:jt-rd-02-052-00 jt-rd-02-052-00 jt-rd-02-052-00 l91f16y4mr4d.. 分享于 2020-07-15 09:23:9.0 暂无简介 文档格式: .pdf 文档页数: 2页 文档大小: 164.6k 文档热度: 文档分类: 行业资料 -- 食品饮料
微生物检验记录和报告

微生物检验记录和报告微生物检验记录和报告检验原始记录检品名称产品批号抽样数量检验日期报告编号抽样基数抽样人、日期报告日期检验依据:GB/T23586-202*《中华人民共和国国家标准酱卤肉制品》检验方法:GB/T4789.26-202*《食品卫生微生物学检验罐头食品商业无菌的检验》一、感官检验记录外观形态色泽口感风味组织形态杂质二、商业无菌检验记录1、保温试验结果:温度,℃36℃2、pH值测定时间,d10d胖听泄露无(有)变化。
3、感官检查:无(有)异常。
4、涂片染色镜检:无(有)细菌增殖。
5、接种试验结果:培养基庖肉培养基庖肉培养基管数22培养条件时间,结果h36℃厌氧55℃厌氧36℃需氧55℃需氧96-120混合菌相(),嗜温性厌氧芽孢杆菌(),嗜温性兼性厌氧芽孢杆菌()。
24-72硫化腐败性芽孢杆菌(),嗜热性厌氧杆菌(),嗜热性厌氧芽孢杆菌()。
溴甲酚紫葡萄糖肉2汤(带倒管)溴甲酚紫葡萄糖肉2汤(带倒管)6、结论:96-120嗜温性需氧杆菌(),嗜温性需氧芽孢杆菌()。
24-72嗜热需氧杆菌(),嗜热性需氧芽孢杆菌(),三、净含量=批准:审核:主检:检验报告HBSDSPKJ/J日期:年月日报告编号包装规格抽样数量抽样日期报告日期产品名称产品批号抽样基数抽样人检验日期检验依据GB/T23586-202*检验项目检测方法:GB/T4789.26-202*《食品卫生微生物学检验罐头食品商业无菌的检验》检验仪器:恒温培养箱感官色泽外观形态外观整齐,无异物。
酱制品表面为酱色或褐色,卤制品为该品种应有的正常色。
泽。
咸淡适中,具有酱卤制品特有口感风味组织形态杂质的风味。
组织紧密。
无肉眼可见的外来杂质。
微生物指标商业无菌净含量检验结论标准规定检验结果单项判定签字日期:年月日批准:审核:主检:扩展阅读:微生物检验需要完成的操作规程、记录、报告根据202*年新版GMP规定,微生物检验需要完成的操作规程、记录、报告如下:序号名称1实验室用层流台23456培养箱蒸汽灭菌锅程序验证灭菌消毒方式菌种的管理操作规程微生物监测使用沉降菌平皿法、表面测试法等,评定洁净区的表面洁净度。
农业部微生物肥料质量监督检验测试中心-有效活菌数原始记录

农业部微生物肥料质量监督检验测试中心有效活菌数测定原始记录
注 释
(1)有效活菌数计算:
N=
82
01
10-⨯⋅⋅⋅V m V x k
式中:N —— 质量有效活菌数, 亿/g ;
x —— 菌落平均数, 个; k —— 稀释倍数
V 1——基础液体积(一般取100ml ), ml ; V 2——菌悬液加入量(一般取0.1ml ), ml ;
m 0——样品量, g 。
(2)选择有效稀释度原则:
以出现20~300个细菌菌落数的稀释度的平板为计数标准,丝状真菌为10~150个菌落数;
当只有一个稀释度的平均菌落数在20~300之间时,以其平均菌落数计算; 若有两个稀释度的平均菌落数在20~300之间时,则按两者菌落总数之比值决定,比值>2,以稀释倍数小的菌落平均数计算;比值≤2,计算两者的平均值;
(3)有效活菌数的允许差:
标准差计算方法:
式中:
X——同一稀释度每个平皿菌落数,个;
i
X——同一稀释度菌落平均数,个;
n ——平行次数。
微生物检验记录表

微生物检验原始记录
培养基配制:见培养基配制记录
样品制备:按GB/T 4789 的要求进行
□ 1.固体样品:无菌称取25g样品加225mL生理盐水,均质;稀释倍数:□1:10 □1:100 □1:1000 □ 2.液体样品:需稀释的,无菌称取25mL样品加225mL生理盐水,混匀;稀释倍数:□1:10 □1:100 □1:1000
□ 3.液体样品:不需要稀释的直接吸取样液检验
□菌落总数:检验依据:□GB 4789.2 -2010 □GB/T 5750.12-2006
检验时间:菌落总数:霉菌和酵母:
□大肠菌群:检验依据:GB/T4789.3-2003
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间:
□总大肠菌群:检验依据:GB/T 5750.12-2006
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
注:“—”表示在选择性培养基上无可疑菌落生长检验时间:
检验时间
□致病菌□沙门氏菌□志贺氏菌□金黄色葡萄球菌
□螨:检验依据 GB 317.4-.10-2006
检测人:复核人:
微生物限度检验记录(复合膜)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:
微生物限度检验记录(铝箔、PVC硬片)
检验人:复核人:
微生物限度检验记录(半成品、成品)
检验人:复核人:
微生物限度检验记录(辅料)
检验人:复核人:。
微生物限度检查记录版
表:2.1-024微生物限度检查记录(通用)1. 常规法:取供试品10為1,用胰酪大豆胨液体培养基稀释至 100ml ,用匀浆仪等适宜的方法混匀,制成1:10供试液。
2. 薄膜过滤法:取供试品10mi ,用胰酪大豆胨液体培养基稀释至 100ml ,用匀浆仪等适宜的方法混匀,制成1:10供试液。
吸取1:10的供试液10ml ,过滤,加0.1%无菌蛋白胨水溶液 300ml 分 三次冲洗,每次100ml ;冲洗后,将滤膜正贴于胰酪大豆胨固体培养基和沙氏葡萄糖琼脂培养基 上,每种培养基平行制备 2个平皿。
按平皿法测定其菌数。
胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批)麦康凯琼脂培养基(配制批号: )供试液制备微生物限度检查记录、需氧菌总数检查30〜353〜5)、霉菌、酵母菌总数检查20C〜25C,5〜7天)三糖铁琼脂斜面穿刺接种 (18〜24h )三、控制菌检查 (30-35 C )检验者:表:2.1-024号:结论本品经按《中国药典》2015年版“非无菌产品微生物限度检查法”进行检验,结果审核者:微生物限度检查记录(丸剂)供试液制备供试液。
胰酪大豆胨增菌 (18〜24h )RV 沙门选择培养木糖赖氨酸脱氧胆酸分离培养(18〜48h )胰酪大豆胨液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)四、沙门菌检查 (30 °C 〜35C ) 胰酪大豆胨液体培养基(配制批号: )、RV 沙门增菌液体培养基(配制批号: ),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号:)、三糖铁琼脂(配制批号:五、耐胆盐革兰阴性菌检杳胰酪大豆胨液体培养基(配制批号:)、肠道菌增菌液体培养基(配制批号:),紫红胆盐葡萄糖琼脂培养基(配制批号:审核者:检验者: 表:2.1-024阴性对照阳性对照三、大肠埃希菌检查)、麦康凯液体培养基(配制批结果□检出大肠埃希菌□未检出大肠埃希菌(规定:不得检出/g)四、沙门菌检查(30°C〜35C)胰酪大豆东液体培养基(配制批号:)、肠道菌增菌液体培养基(配制批号:),紫红胆盐葡萄糖琼脂培养基(配制批号:、表: 2.1-024 微生物限度检查记录(蛇胆川贝液)三、大肠埃希菌检查胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)胰酪大豆胨液体培养基(配制批号:)、RV沙门增菌液体培养基(配制批号:),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号:)、三糖铁琼脂(配制批号:)审核者:检验者:表:2.1-024 微生物限度检查记录(30〜353〜5天)、霉菌、酵母菌总数检查20C〜25C, 5〜7天)1、 口服液体药用聚酯瓶:取数个试瓶,加入1/2标示容量的氯化钠注射液,将盖旋紧,振摇1分钟,即得供试液。
微生物检验记录

发酵时间
24~48±2h
48±2h
稀释度
10-1
10—2
10-3
阴性对照
结果:
LST发酵培养基Байду номын сангаас气管数
□MPN/g
□MPN/ml
BGLB发酵培养基产气管数
备注:
判定:
复核人:检验人:
□CFU/ml
稀释度
霉菌10-1
酵母菌10—1
阴性对照
平皿1
平皿2
平均菌落数
2.大肠菌群测定LST发酵培养基批号:________________有效期至:________________
BGLB发酵培养基批号:有效期至:________________
LST发酵培养基
BGLB发酵培养基
36±1oC
营养琼脂培养基批号:_____________有效期至:_____________
菌
落
总
数
培养温度
36±1oC
培养时间:
48±2h
结果
□CFU/g
□CFU/ml
稀释度
10—1
10—2
10-3
阴性对照
平皿1
平皿2
平均菌落数
霉
菌
酵
母
菌
总
数
培养温度
28±1oC
培养时间:
120h
结果
霉菌:
酵母菌:
□CFU/g
微生物检查记录
编号:R-SMP07025-06
品名:批号:检验日期:
方法依据:□GB4789.2,GB 4789.15,GB 4789。3□GB/T 5750.12
1。菌落总数、霉菌和酵母菌数测定平板计数琼脂批号:_____________有效期至:_____________
10.1微生物限度检查记录

二、细菌、霉菌检查:
细菌
30~35℃72小时
原液
10-1
10-2
10-3
阴性对照
1
2
1
2
1
2
1
2
1
2
24小时
48小时
72小时
平均菌落数
霉菌及酵母菌
23~28℃120小时
原液
10-1
10-2
10-3
阴性对照
1
2
1
2
1
2
1
2
1
2
48小时
72小时
96小时
120小时
平均菌落数
三、大肠埃希菌:
增
菌
培
养
培养基:胆盐乳糖培养基
培养温度:℃
培养时间:小时
供试品
阴性对照
阳性对照
结果
BL
□未检出大肠埃希菌
□检出大肠埃希菌
MUG
靛基质
分
离
EMB或MacC
革兰氏染色、镜检
生
化
反
应
I
M
V-P
C
乳糖发酵
活满检查
用肉眼观察:
四、微生物室菌落数
1.、2.、3.。
结论:本品按《中国药典》2010年版二部附录ⅪJ微生物限度检查法检验,结果:。
微生物限度检查记录
检品名称
批号
规格
取样日期
检验日期
报告日期
消毒时间
送检部门
温度
附录ⅪJ微生物限度检查法检验。
标准规定
细菌数≤1000cfu/g霉菌数≤100cfu/g,大肠埃希菌不得检出。
菌落总数、大肠菌群原始检验记录

大肠菌群检验原始记录
规格:
生产数量:
样品状态:
完好
异常
检验日期:
检验环境: 温度: ℃
湿度:RH
%
检验依据:《食品安全国家标准 蜜饯CB14884-2016》
检验方法:GB4789.3-2016(第二法)
操作过程: (1)吸取1ml样液于VRBA平板36℃培养24小时后,是否有沉淀环的紫红色菌落生产; (2)从合适稀释度上挑取典型和可疑菌落数(个); (3)BGLB肉汤证实试验阳性管数。
样品序号
1 2 3 4 5 空白对照 典型和可疑菌落
稀释倍数
10-1
10-2
无 有
1
2
3
4
典型和可疑菌落
证实试验
最终结果 结论判定 检验员:
10-3
空白对照 数量
5
6
结果计算 (Cห้องสมุดไป่ตู้G/g)
备注
CFU/ml
7
8
9
10
复核员:
微生物限度检查记录(2010年版)

3、大肠埃希菌测定:取1:10供试养物0.2ml,接种至含5mlMUG培养基的试管内,培养5-24小时,在366nm紫外灯下观察。
一、细菌数检查(30~35℃)
二、霉菌、酵母菌数检查(23℃~28℃)
玫瑰红钠琼脂培养基(配制批号: )
10-1
10-2
10-3
阴性对照
皿1
皿2
皿1
皿2
皿1
皿2
1天
2天
3天
4天
5天
均值
结果
cfu/g (规定:≤ cfu/g)
三、大肠埃希菌检查(30℃~35℃ 18~24hBL配制批号: EMB或MacC配制批号: ,MUG培养基配制批号:靛基质试液配制批号: )
表:2.1-024微生物限度检查记录(双氯芬酸钠肠溶片)
样品名称
检验编号
批号
剂型
检验日期
完成日期
供试液制备
取样品10g,加pH6.8无菌磷酸盐缓冲液至100ml,置45℃水浴中,振摇,使溶解,作为1:10供试液。
1、细菌数测定:取1:10供试液适量,分置灭菌离心管中,先以500转/分离心5分钟,取全部上清液,再以3000转/分离心20分钟,弃去上清液,留底部集菌液约2ml,加稀释液补至原体积;取离心后的供试液1ml,等量分注3个平皿中,按平皿法测定其菌数。
三糖铁琼脂斜面(18~24h)
供试品
阴性对照
阳性对照
结 果
□检出□未检出沙门菌(规定:不得检出/10ml)
BL
MUG
靛基质
EMB或MacC
革兰染色镜检
乳糖
I
细菌及大肠菌群检验记录
大肠菌群测定:
GB/T 4789.3-2010
2、复发酵试验:用接种环从产气的 LST 肉汤 管中分别取培养物 2~3 环,移种于煌绿乳糖 胆盐 (BGLB) 肉汤中, 36℃±1℃培养 48h±2h, 阴性对照
(取稀释剂 1ml 分别加在 3 支定 量 10ml LST 双 料或单料管内)
阴性。 (取 10ml 或 1ml 分别加在 3 支定量 10ml LST 双料或单料管内) 观察产气情况。未产气为阴性。 样 量
管 别
1:10 稀释样液
10ml(1g)双料管
1:10 稀释样液 1ml(0.1g)单料
1:100 稀释样液 1ml(0.01g)单料
1g
1 2 3 1
Байду номын сангаас0.1g
2 3 1
管 别
1:10 稀释样液
10ml(1g)双料管
1:10 稀释样液 1ml(0.1g)单料
1:100 稀释样液 1ml(0.01g)单料
1g
1 2 3 1
0.1g
2 3 1
0.01g
2 3 1
0g 2 3
1
2
3
1
2
3
1
2
3
24 小 时 48 小 时
标 示
结果(MPN/g)
报告(MPN/100g)
检验员:
0.01g
2 3 1
0g 2 3
1
2
3
1
2
3
1
2
3
24 小 时 48 小 时
标 示
结果(MPN/g)
报告(MPN/100g)
检验员:
长沙市天心区天锦食品加工厂微生物实验室 微生物检验原始记录
