芳香性初稿
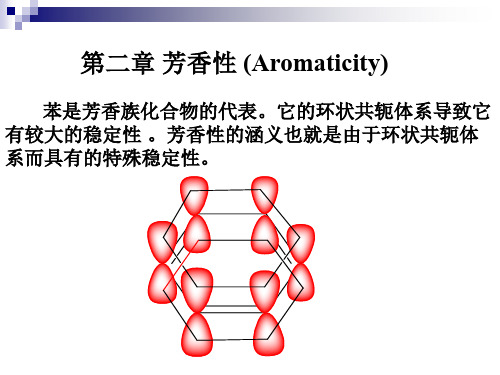
芳香性

-
+
艹 奥
x
C m
富勒烯(fullene )
富勒烯(fullerene)亦称为足球烯,是由C60、C70、C50等一 类化合物的总称。
C60的结构特点: ① 60个碳原子以 20个六元环及12 个五元环连接成 似足球的空心对 称分子; ② C-C之间以sp2 杂化轨道相结合, 在球形的表面有 一层离域的π电子 云。
o
浓H2SO4 ~55 C
o
NO2 +
CHO
H2O 88%
+ 浓H2SO4 +发烟HNO3
NO2
3. 磺化反应
苯环上的氢被磺酸基(-SO3H)取代
SO3H + H2O
+ H2SO4 (10%SO3)
反应可逆
除水、加过量苯有利于正反应; 稀酸、加热有利于逆反应;
SO3H 稀 H2SO4 100~170 C
+ HCHO + HCl 无水 ZnCl2 CH2Cl
加特曼—科赫反应
CHO + CO + HCl AlCl3 CuCl
6. 加成反应
加氢
+ 3H2
+ 3Cl2
Pt,175 C
orNi,300 C
¡ ¡
Cl Cl
加氯
hn
Cl Cl
H
Cl
ù ¡¡¡± ¡
Cl ¡¡¡¡¡¡¡ ¨ù ù ù
7. 氧化反应 侧链氧化
与 π电子数关系图。 当化合物的π电子接 近18时, REPE≈0 ,曲线接近水平 ,相 应的化合物失去芳 香性 ,变成非芳香性 化合物了 ,这与实验 事实是一致的。
PMO 法
《高等有机化学》课件-第二章 芳香性

4、苯的分子轨道模型
分子轨道理论认为六个p轨道线性组合成六个π分子轨道,其中三个成键 轨ψ1ψ2ψ3 和三个反键轨道ψ4ψ5ψ6 。
在这个分子轨道中,有一个能量最低的ψ1轨道,有两个相同能量较高的ψ2 和ψ3轨道,各有一个节面,这三个是成键轨道。ψ4ψ5能量相同,有两个节面, ψ6能量最高有三个节面,这三个是反键轨道。
end lies on the side of the heteroatom, with a dipole moment of
1.58 D.
Pyrrole is also weakly acidic at the
酸性比较:
N–H position, with a pKa of 17.5 乙酸>苯酚> 吡咯 >环己醇
在基态时,苯分子的6个p电子成对地填入三个成键轨道,这时所有能量低 的成键轨道,全部充满了电子,所以苯分子是稳定的,体系能量较低。
5、核磁波谱( NMR)特性 NMR波谱法也是一种确定芳香性的实验手段。芳香化合物 的特点是它们呈现抗(反、感)磁环电流。这个环电流可以看 成在NMR波谱仪磁场的影响下,离域π体系中电子的移动。环流 是芳香性化合物中磁场大范围各向异性的结果。这个诱发的环 流引起了与环垂直的局部磁场,其方向与外加磁场方向相反。 所以处于芳香环平面上、下方的核,感受到与外加磁场相反的 磁场(屏蔽区),并出现在NMR波谱中的较高场处(化学位移 δ值较小);而在环平面中的核,即直接和环相连的原子,感受 到与外加磁场同向的磁场(去屏蔽区),出现在NMR波谱中的 较低场处(化学位移δ值较大) 。 这种化学位移的出现,可以作为芳香性的证据,但这不是绝 对的判据!
强调:n不是环上碳的原子数); • 共面的原子均为sp2或sp杂化,环上π电子能够发生
芳香性及其理论(1)

竞赛辅导讲义芳香性及其理论1865年,德国化学家凯库勒提出了著名的苯分子的正六边形环状结构式,并正式引入“芳香性”这一概念来描述苯及与苯有关的化合物的物理、化学性质。
此后芳香化学引起了人们极大的兴趣。
随着测试技术和量子化学的发展,人们对芳香性的认识逐步深化。
有关芳香性理论的研究一直是有机化学家、结构化学家和理论化学家的主要研究课题之一。
一、芳香性的涵义芳香性(aromaticity)是一个理论概念,其涵义随理论的发展而不断深化。
芳香性是有机化学中最难准确表述的概念之一。
一般所谓的芳香性分子具有以下几个特点:1、C/H比例高芳香性分子大多具有较高的C/H原子比。
从C/H原子比来看,芳香性分子属于高度不饱和分子。
例如:苯(C6H6)的C/H原子比为1﹕1;萘(C10H8)的C/H原子比为1.25﹕1;富勒烯(C60、C70)的C/H原子比甚至为∞。
而脂肪族分子,除乙炔(C2H2)、丁二炔(C4H2)等少数几个以外,绝大多数C/H原子比教低。
2、键长均一化芳香性分子中碳碳单键与碳碳双键键长有趋于一致的倾向,极端情况为苯分子。
X-射线衍射测定表明苯分子中碳碳键并无单双键之别,所有的碳碳键长均为0.1395nm,介于普通的碳碳单键键长(0.154nm)和碳碳双键键长(0.135nm)之间。
3、分子平面化芳香性分子的一个显著特征就是芳环上的组成原子都处在一个平面或接近一个平面内。
虽然平面分子不一定就是芳香性分子,但芳香性分子总是要求分子具有一定程度的平面性。
4、化学性质“反常”化不饱和分子的典型化学性质就是容易发生加成反应。
芳香性分子虽然属高度不饱和分子,却表现出“反常”的化学性质,即难以进行加成反应,更发生易取代反应,而后者正是饱和分子的典型化学性质。
5、π电子离域化通过氢化热或燃烧热的测定,芳香性分子的能量比非芳香性分子的能量低得多,即芳香性分子具有特殊的稳定性。
人们引入离域能DE(delocalization energy)或共振能RE(resonance energy)的概念来定量地表示芳香性的强弱:DE=E定域-E离域式中,E定域代表假想的定域的环多烯分子的能量,E离域代表离域的芳香性分子的能量。
芳香性的发展历程

A Brief History Of Aromaticity
I “芳香”的起源
从石油中提炼出的某些物质具有芳香气味
19世纪初,化学家根据这样的现象把某些物质
命名为芳香族化合物(Aromatic Compounds) 事实上,大多数芳香族化合物都不具有香 味,“芳香性”(Aromaticity)的本意在化学领域 已经没有意义
II 最初的探索
Michael Faraday于1825年发现苯(Benzene),
由于实验当天弄错了氢的等重,他推断出苯为 “C6H3”的结构 石油原料经过裂解制得小分子烯烃的同时也 得到芳烃等副产物,分馏后可得苯与烷基萘 Faraday所知道的苯的化学性质:与Cl2,硝酸, 硫酸等发生取代反应
VIII 最新的进展
Li+ NMR和3He NMR的应用
Schleyer的核独立化学位移(NICS)理论 对芳香性的研究并没有停滞不前,而是在测量
科学和分析手段不断发展的基础上持续前进
IX 美丽的定义
对芳香性的解释依赖于时代,随着科技的进步
变得更为全面 芳香性包含各种特征和性质(结构,能量,反应 活性,磁性),混合了拥有不同教育背景的化学 家们的理解 从“像苯一样的结构”这种解释到“离域电 子的环绕位移”这样的描述,芳香性的定义跨 越了近两百年,并将和人们眼中的“美丽”一 样,继续着它的发展历程
(Exalted Diamagnetic Susceptibility) 1925年, Armit/Robinson发现苯的六电子结构 (Electron Sextet) 1936年, Hückel提出(4n+2)π电子规则 芳香性在电磁领域得到发展,并有了判定依据
有机化合物之芳香性

有 不 同程 度 的 空 间 排 斥 作 用 , 子 没 有 芳 分
香性。 当成 环 原 子 数 ≥ 1 N , 略 轮 内 氢 原 8 忽 子 空 间排 斥 作 用 , 论 是 分 子 形 式 还 是 离 无 子形式都认为具 有芳香性 。 () 香杂 环化合物 : 3芳 如吡 咯 、 喃 、 呋 吡
现 实 生 活 中 , 们 总 留 恋 于 美 好 的 事 人
一
若 要 使 它 们 具 有 芳 香 性 , 得 失 2 电 须 个
物, 自然 对 那 些 有 芳 香 气 味 的 物 质 更 贪 恋 子 , 为 离子 形 式 。 成
些 。 们 所 熟 悉 的 苯 和 其 同 系 物 、 生 人 衍 物 , 有 芳 香 杂 环 化 合 物 及 其 它一 些 环 状 还
化合物 等等都 属于芳香化 合物的范 畴 。 那 么 , 道 它 们真 的 都 散发 着迷 人的 芬芳 吗 ? 难 早 在 l 世 纪 , 们 就 研 究 了具 有 香 味 9 人
的 物 质 , 冬 青 油 、 香 油 、 草 等 的 主 要 像 茴 香
成 分 都 是 苯 系 化 合物 …, 将 这 一类 化 合 物 故
休 克 尔 规 则 : 1环 状 闭 合 共轭 体 系 ;2 () () 所 有 成 环 原 子 处于 同一 平 面 , ) 电子 数 符 ( p 3
的芳 香 性 。 系 芳 烃 不 需 要 计 算 电子 数 , 苯 因为 它们 一 定 都 满 足4 + 个 电子 。 非 n 2 而
以 上 两 类 环 状 结 构 本 无 芳 香 性 , 得 苯 芳 烃 由于 形 式 多 样 , 生 计 算 电 子 数 在 合 4 + ( ≥O规 则 。 n 2n ) 学 失 ≤2 电 子 的范 围 内 , 以 使 得 到 的 离 子 并 不 容 易 。 个 可 符 合 休 克 尔规 则 的 芳 香 化 合 物 按 照 结 n 2n≥0规 则从 而 具 有 芳 香 性 。 ) 因此 , 非 苯 芳 烃 电 子 数 的 计 算 总 将 构 类 型 的 不 同分 为 两 大 类 : 系 芳 烃 和 非 满足 4 + ( 苯 苯 芳 烃 。 系 芳 烃 中 除 只含 一 个 苯 环 的 苯 苯
4芳香性

芳香性
Chapter four Aromaticity
第一节 芳香性、非芳香性、反芳香性的概念
1、定义 【芳香性】是指苯型的化合物由于π电子离域具有特殊的热稳 定性。环上易发生取代反应,不易发生加成反应,在结构上 C-C键长介于单双键之间,在核磁共振谱上表现出较大的化学 位移的性质。 反芳香性是指苯型的化合物,由于π电子离域它的稳定性 比相应的非环共轭烯烃稳定性小的现象。 非芳香性是指环形的化合物,由于没有π电子离域现象, 它的稳定性和相应的非环共轭烯烃稳定性相当的现象。
CH2
例如:下列化合物是否具有芳香性 ⑴ ⑵
化学与生命科学学院
⑶
判断的方法;先写出其偶极结构,得到两个电荷相反的 共轭环,然后看着两个环是否都满足休克尔规则,如果满足 则有芳香性,则反之。 ⑴无芳香性。 ⑵有芳香性。
⑶有芳香性。
化学与生命科学学院
完
化学与生命科学学院
3、芳香化合物的结构特征
见教材101~102页。
化学与生命科学学院
化学与生命科学学院
第二节 芳香性的判据
目前,判断一个有机化合物,有两种方法:
一种是:休克尔(E.Hückel)的4n+2规则; 另一种是:芳香环上氢质子的化学位移最大差值。 下面我们主要学习休克尔(E.Hückel)的4n+2规则。 1、单环体系芳香性的判断 单环体系芳香性的判断,注意四点: ①、体系的平面性 ②、具有4n+2个π电子 ③、 4n+2个π电子的取值极限(0≤n≤5)
化学与生命科学学院
2、芳香化合物的特点 ⑴、C/H高 ⑵、键长趋于平均化 芳香性分子具有比正常的碳碳双键的键长(1.35Å)稍长双键 和相比正常的碳碳单键的键长(1.54Å)稍短的单键。无芳香性的 多烯分子中单键和双键的键长特征很明显,分别为1.44-1.48Å和 1.34-1.36Å,芳香性分子的碳碳键长处于1. 38Å和1.40Å之间。 苯环中六个碳碳键长彼此相等,约为1.395Å。 ⑶、分子的共平面性 具有芳香性的分子一个显著特征是环上原子的平面性或 几乎平面性。有平面结构的化合物并不都是有芳香性的。但 芳香性总是伴随着一定程度的平面性。 [18]-轮烯是近乎乎面的, [16]-轮烯是非平而的,前者是芳香性分子,后者并无劳香性。
有机化合物之芳香性论文

有机化合物之芳香性作者简介:高巍,女,博士,讲师,研究方向为天然药物有效成分结构修饰;武雪芬,女,教授,硕士生导师,学科主任,研究方向为新型药物的合成与修饰。
摘要:许多有机化合物都具有芳香性,正是由于其中很多化合物都散发着芳香的气味。
可是,到底要怎样判断一个化合物是否具有芳香性呢?这是许多学生都会遇到的难题。
本文不但分析了不同结构类型的芳香化合物,还对休克尔规则中最重要的π电子数的计算方法进行了归纳总结。
关键词:芳香性;休克尔规则;共轭中图分类号:g642.0文献标识码:a文章编号:1673-9795(2012)01(a)-0000-00现实生活中,人们总留恋于美好的事物,自然对那些有芳香气味的物质更贪恋一些。
人们所熟悉的苯和其同系物、衍生物,还有芳香杂环化合物及其它一些环状化合物等等都属于芳香化合物的范畴。
那么,难道它们真的都散发着迷人的芬芳吗?早在十九世纪,人们就研究了具有香味的物质,像冬青油、茴香油、香草等的主要成分都是苯系化合物[1],故将这一类化合物命名为芳香化合物。
后来,随着研究的不断深入,人们发现,许多与苯性质相似的化合物不但没有芳香气味,有些甚至还有恶臭的气味(如:吡啶)。
但是,由于它们在性质上的相似性,即高度不饱和却具有特殊的稳定性[2],人们将这种性质称为芳香性,将具有这种性质的化合物统称为芳香化合物。
芳香化合物在结构上必须满足休克尔规则[3]。
休克尔规则:(1)环状闭合共轭体系;(2)所有成环原子处于同一平面;(3)电子数符合4n+2(n≥0)规则。
符合休克尔规则的芳香化合物按照结构类型的不同分为两大类:苯系芳烃和非苯芳烃。
苯系芳烃中除只含一个苯环的苯及其同系物、衍生物外,还包括像萘、蒽、菲等稠环芳烃。
与苯相似,由于它们的成环碳原子都在同一平面上,且电子数分别为10和14,符合休克尔规则,是芳香化合物。
虽然萘、蒽、菲是稠环芳烃,但构成环的碳原子都处于最外层环上,可看成是单环共轭多烯,故可用休克尔规则判断芳香性。
第六章 芳香性

第六章芳香性第一节芳香性的一般讨论芳香化合物的特点1.较高的C/H比苯C6H6,萘C10H8,蒽C14H102.共平面、键长均等化3.分子共平面组成芳香环的原子都在一个平面或接近一个平面里。
4.芳香性分子稳定程度—共轭能(离域能)大小例如苯的共轭能为150.7kJ/mol ,可以借助氢化热或燃烧热来求得。
比较1mol苯和3mol环已烯的氢化热,计算得苯的共轭能约为(3×119.7-208.5)= 150.7kJ/mol 。
对离域能定量计算REPE(每一个电子的离域能)=离域能/NREPE ﹥0 化合物有芳香性REPE =0 化合物非芳香性REPE ﹤0 化合物反芳香性REPE计算:1)求出离域能离域能=E非定域—E定域2)REPE计算REPE =离域能/nREPE(每一个电子的离域能)的正值越大,则相应的化合物的芳香性越强。
用REPE与这些化合物的性质进行联系、比较后得出结论:REPE可以作为判断环状多烯是否具有芳香性的指标。
5.化学性质特征芳香化合物与一般高度不饱和的脂肪族化合物不同,不易发生加成反应,较难发生氧化反应,易于发生取代反应,尤其是芳烃易发生亲电取代反应。
6.π电子数目:4n+2在环状多烯体系中,当π电子数为4n+2时,为芳香性分子;当π电子数为4n时,体系若比相应的多烯模型化合物稳定性降低,则具有反芳香性;体系若与相应的多烯模型化合物稳定性相近,则为非芳香性。
如:苯是典型的芳香性,环辛四烯为非芳香性体系,环丁二烯则为反芳香性,其化学性质很活泼,甚至比环丁烷还活泼。
芳香性是不是是是是是4n+2规则只能作为环状多烯的体系是否具有芳香性的定性依据,要描述芳香性分子稳定到什么程度,即芳香性强度,必须按HMO法对离域能进行定量的计算。
7.波谱特征芳香性化合物大多都具有特征的光谱。
NMR:芳环呈现反磁环流,环平面上下有屏蔽效应,环内有去屏蔽效应。
第二节带电荷环的芳香性环上带有电荷而具有芳香性的物质很多,它们是一类重要的非苯芳烃。
关于芳香性的概念

第15卷 第4期 大学化学2000年8月关于芳香性的概念姚子鹏 高 翔 任平达 黄毕生 (复旦大学化学系 上海200433) (云南大理师专化学系 云南671000) 摘要 简要介绍了芳香性概念的发展历史,并从结构、稳定性、反应性能等方面进行了总结。
在有机化学中,芳香性是一个重要的概念。
为了使学生能较好理解和掌握这一概念,我们在教学中从经典的芳香性概念、共振论对芳香性的看法、Hückel规则到核磁共振对芳香性化合物的测定,介绍了这一概念不断深化发展的过程。
并从结构、稳定性、反应性能等方面进行了总结,取得了较好的教学效果。
现把我们的看法进行简单介绍,以供教学参考。
1 芳香性的经典概念 1825年法拉第从鲸油裂解产生气体的冷凝液中发现了苯,接着测定了苯的组成、蒸气压、熔点等物理性质,并得出了苯的正确分子式C6H6。
此后,人们又发现许多具芳香气息的物质中含有苯的母核。
德国化学家凯库勒推断出苯的结构式为。
苯这种高度不饱和的化合物具有与一般不饱和烯烃不同的特殊性质,主要是:(1)环较稳定,在通常情况下不易被化学试剂破坏。
例如:甲苯易被氧化成苯甲酸,保留了苯环。
(2)易取代,难加成。
例如:苯在三氯化铁催化下和氯反应生成氯苯,而没有得到加成产物。
价键理论问世后,后一条表述为苯易亲电取代,难亲电加成。
上面两条就是经典的芳香性概念。
2 共振论对芳香性概念的发展 共振论认为苯主要是Ⅰ和Ⅱ的共振杂化体。
由于共振,共振杂化体(苯的真正结构)比较稳定。
通过比较苯和环己三烯的氢化热(以3个环己烯计),可以计算出苯的共振能为150.6 kJ/mol。
即苯比环己三烯稳定150.6kJ/mol。
Ⅰ∴Ⅱ 如果说经典的芳香性概念中,芳香环的稳定性是根据环对化学试剂的稳定性而言,那么,共振论则进一步把芳香环的稳定性与它具有较低的内能明确地联系起来。
通过氢化热、燃烧热等数值,计算出了一大批芳香族化合物的共振能,从而可以比较各种芳香环的稳定性高低或芳香性强弱。
芳香性

芳香性高腾高尚王颖李伟(北京大学化学与分子工程学院2005级4班北京100871)当一个人来到这个世上,呼吸着周围的气体的时候,他就开始分辨这个世界的气味了。
各种事物气味有不同的气味,其中有些气味是令人愉悦的,人们就叫它“芳香”。
于是充斥在这个世界的就有了两种气味:芳香的和非芳香的。
然而它们之间并没有明显的界限,如吲哚,它在低浓度的时候是一种香料,而浓度高时却散发着夏天厕所的味道。
同时,这个世界的化合物也分两种,芳香化合物和非芳香化合物,然而作为化学研究者,我们知道它们的定义与芳香的气味却有着明显的区别。
然而,具有讽刺意味的是,我们对于芳香化合物的认识却真的是从“芳香”这种气味开始的。
人类有一种嗜好,总是喜欢在对一些物质有了一定的了解,但很浅显的时候,抽取它们的共同点组建一个概念,来描述这类物质。
芳香化合物也是如此,虽然那些先驱们并不知道他们打开了一个多么绚丽的物质大门。
Ev e ry theory will update itself as time goes by, until a complet ely new theory take up.芳香性的定义就是这样发展的,从现象到理论,从简单到深入,先驱们一步一步的探索,为今天的“芳香性”定义奠定了基础,形成了一幅人类认识发展的历史画卷:一芳香性横空出世——化学性质决定一切人们对于“芳香性”的认识是从“苯”这种奇特的物质开始的。
1825年Fraday从鲸油裂解气之中提取了苯,并进行了初步研究,发现它能在光照射下同氯反应,与硫酸和硝酸也反应,但与钾却不反应;1834年Mitscherlich用苯甲酸脱羧制得了苯,并测得其分子式为C6H6。
由于苯甲酸是从天然来源的安息香酸胶中得到的,而苯是挥发性的,并具有香味,因此当时称它是芳香的。
可是它的特殊性质(如不易加成,易亲电取代)却令人无法用经典理论解释(不饱和度竟如此之大)。
终于在1865年,一位伟大的化学家F.A.Kekule 的一个伟大的梦创了一个伟大的结构式(化学之中的第一个环状结构),初步地开始解释其本质。
第二章 10芳香性
侧视图:
Fe
俯视图:
Fe
二茂铁的芳香性比苯为强,因为它有更大的倾向来
进行亲电取代反应而不进行加成反应。特别有用的是 Friedel—Crants烷基化和酰基化反应,通过它们,其 他取代基可以引入二茂铁的环上。甲酰化[用N—甲 基—N—甲酰苯胺,C6H5N(CH)3CHO]、磺化和汞化 反应都可以在较缓和的条件下进行。但它不能直接用硝
2.4 五元环的π体系
五元环的π体系有一个能量最低的轨道和两对简并轨道。 按照Hückel规则,这种体系如果是含有六个电子,应具 有芳香性。环戊二烯负离子符合这种条件。
HH
环戊二烯
即
H
环戊二烯负离子
环戊二烯的酸性比其他烯烃为强,环戊二烯负离子容易由环戊 二烯得到,这说明这种负离子的稳定性。环戊二烯负离子中的五个 氢原于是等同的,它的负电荷是平均分布在五个碳原子上的。环戊 二烯内鎓盐是环戊二烯负离子的一种特殊形式。吡啶鎓环戊二烯负 离子内盐(Ⅲ)就是一个例。在这里,五元环是与带电荷的氮原予相 连接。它可由3,5—二溴环戊烯(Ⅰ),与吡啶作用,先得到溴化 环戊二烯基吡啶鎓盐(Ⅱ),后者很容易地失去溴化氢而得。
环外双键的电子是向着环而极化的,例如6,6—二甲基亚甲环 戊二烯的偶极矩是1.48D,负极是在环的一方。这个亚甲环戊二烯 的离域能是49.8kJ/moL大多数的亚甲环戊二烯衍生物没有因为环 外双键而有顺反异构体存在,因为上式中的环外双键具有高度的单 键性质。这些性质指出亚甲环戊二烯具有一定程度的内鎓盐形式。
C6H5
C6H5
Cl
Hale Waihona Puke ClBF4ˉAlCl4ˉ
C6H5
Cl
事实上,三丙基环丙烯正离于是最稳定的正碳离子之 一,甚至在水溶液中它还是稳定的。三叔丁基环丙烯正离 子也是很稳定的。此外,环丙烯酮也是稳定的化合物。
综述:芳香性

综述:芳香性概述“芳香性”是用于描述一些环状化合物特殊稳定性的概念。
在有机化学中, 尤其是针对不饱和环体系、多环体系研究中居重要地位。
自1825年Michael Faraday从煤焦油中分离出苯开始, 芳香化学至今已有近200年的历史。
为了深入了解“芳香性”及其在自然学科中产生的深远影响, 本文简述了其发展历史与本质, 并对芳香性的判断方法进行归类总结。
除了列举实例, 进一步对芳香化合物进行分类以外, 还基于本课题组近年的研究成果, 提出一些新观点。
芳香性的含义“芳香性”一词自使用以来, 科学家们不断发现具备该性质的化合物的各种特征, 并进行了总结与归纳。
这些特征, 一部分是规律的总结, 例如[4n+2]规则; 另一部分则是对化合物本身特征的描述, 例如平面性、键长平均化等。
随着科学研究的不断推进, 其中一些观点被修正甚至推翻, 但仍有一些经典的描述被保留并沿用至今。
仔细考察芳香性的历史, 我们发现“芳香性”事实上是用于描述化合物的特殊稳定性的概念。
换句话说,“芳香性”是一个描述行为特征, 而非表达理论规律的术语。
因此, “芳香性”应该由此类化合物的本质属性决定, 而“芳香性”规律则是对芳香化合物普遍性质的总结。
本文就“传统芳香化合物”的行为特征进行了总结(指Hückel 平面芳香性), 并列于下表中。
另外, 对近年发展的一些芳香性的独特类型, 本文也将结合实例逐一介绍。
通常, 芳香环由于其特殊的稳定性, 化学反应性相对其他非芳香环系要弱得多。
早在1866 年, Erlenmeyer就已经提出了芳香性的反应性判据。
在一般不饱和体系极易发生的反应, 如加成、开环反应中, 在芳香体系均较难实现。
通常芳香环更容易发生取代反应。
核磁共振化学位移(NMR Chemical Shift)芳香化合物产生的独特抗磁环电流, 会导致周围的磁场环境发生变化。
例如苯分子的6个H 原子均处于抗磁环电流的去屏蔽区域,因此其1H NMR 的化学位移值会向低场移动(δ=7。
芳香性理论

芳香性是一种化学性质,有芳香性的分子中,由不饱和键、孤对电子和空轨道组成的共轭系统具有特别的、仅考虑共轭时无法解释的稳定作用。
可以将芳香性看作是环状离域和环共振的体现。
一般认为在这些体系中的电子,可以自由在由原子组成的环形结构上运动(离域),这些环形结构含有单键和双键相间,离域的结果是环键的键级趋于均化,给予体系稳定作用。
芳香性的理论最初由凯库勒发展出来,是以六元的苯分子为原型建立起来。
理论中的苯有两个共振形态,并有单键和双键相间,但理论上的两种苯(环己三烯)衍生物的这类异构体在实际上无法检测或分离出来,苯事实上是这两个异构体的“杂化体”,并且具有不考虑电子离域时无法解释的稳定性。
右上图中的双箭头于化学中代表共振的意思,但不代表该分子会变成那两个形态,反而是指该分子处于该两个形态的混合状态。
事实上,那两个形态都不能代表分子实际的形态,但指出了电子大概的分布。
由此可见,分子真实的形态就是那两个形态的融合,而它所发出的电磁波波长就是该两个形态所发出的平均长度。
用组成π键的电子密度分布的位置,来更准确地解释就是电子分布在分子的环的上、下。
数量必定是4n+2的定律,和肯定芳香族分子的环必定是平面。
芳香性化合物的特征[编辑]被分类为芳香性的化合物通常有以下的条件:1. 有一些离域电子组成一些π键,并且令整个环系统可以当成单与双键的组合;2. 给出离域电子形成π键的原子需处于同一个平面;3. 原子需组成一个环;4. 组成π键的电子总数需为4n+2,即不是4的倍数的双数(休克尔规则);5. 可进行亲电芳香取代反应和亲核芳香取代反应。
苯就是一个较好的例子,它适合以上所有条件,并且有6个离域电子(即n=1)。
有4n+2个π电子的化合物通常都是芳香性的。
环丁二烯只有4个离域电子,所以不属于芳香性化合物。
这些只有4n个π电子而又具近似平面结构的环状化合物称为反芳香性化合物。
非芳香族的有机物就叫做脂肪族,脂肪族没有芳香族具有的特殊的共振稳定作用。
7章芳香性全解

I
14 电子,符合4n+2
运用修正后的方法判断,下列化合物中,除V外,其余 均具有芳香性。
共轭体系的π电子数为4n + 2,n = 非负整数; ③ 分子在外磁场中能产生环电流效应。
这三点是芳香性的特征。
环电流效应
5.25
H
H
H
H 5.25
5.0
H 6.62 N
6.62
6.05 6.05
7.26 7.26
N HN
-2.7
NH N
34
三. 具有芳香性化合物的特点和性质 ① 有特殊的稳定性,常温常压不被氧化; ② 亲电取代反应优于加成反应
Ha Hb
H≡ + H
+
Ha
Hb
A
B
越过一个饱和C原子后,形成一个闭合的共轭体系,
电子数为6,符合4n+2 ,
① 1H NMR证明:对于A结构,Ha和Hb有不同的化学位 移值,Ha受环电流的影响,比Hb出现在低场,为5.8 ppm ② 要使A翻转到B,要一定的能量,△G=22.3 Kcal/mol
环戊二烯负离子(Z)
6
(Z)
环壬四烯
10
负离子
(Z)
6 环庚三烯正离子 (Z)
(Z)
电子数符合 4n + 2
化合物 反芳香性质体 环丙烯负离子
环戊二烯正离子
π电子数
:
4
(Z)
(Z)
第5章 芳香性

桥基共扼体系化合物E、F也可以使分子变成平面分子,
因此这些分子都具有芳香性。
H H O
Ac N
D
E
F
② [14]-轮烯
[14]-轮烯有明显的反磁环流,而且具有键长交替现象。 它有两种较稳定的处于平衡中的构型异构体A和B 。[14]轮烯的内腔要比[10]-轮烯大,故环内氢的干扰相对较小, [14]-轮烯的3,6,10和13位碳有点偏离平面。
环体系不在一个平面里。而表现出非芳香
性。
① [10]-轮烯
即环癸五烯,具有三种异构体。A和C度不稳定,B碳原
子按类似萘的骨架排列,它的角张力最小,但是两个环内氢 原子的非键斥力严重地阻碍了环的稳定性。 [10]-轮烯不显
芳香性。
H
H
A
B
C
全顺式
反-顺-反-顺-顺五烯
顺-顺-顺-顺-反
[10]-轮烯不显芳香性,有人用架桥基取代这两个环 内氢(图D)能使分子变成平面分子体系。以杂原子为架
休克尔的分子轨道理论揭示了结构和芳香性
的关系。HMO法计算可以得出环状共扼多烯分子
轨道的能量。根据Pauli不相容原理和能量最低原理。
基态分子的 电子优先占据成键分子轨道并把这些
轨道全都填满时,分子就是稳定的。
3
6
+ 1 .4 1 + 1 .4 1 +2
则。因为它可以存在着下列偶极形式而呈现芳香 性,使体系稳定。
O
或
O
2.五元环
① 环戊二烯 环戊二烯的酸性所得到的环戊二烯负离子具有芳香性, 它符合4n+2规则,6个π电子均匀地分布在环上五个原子 所在的分子子轨道中。
H
有机化学-芳香性概述

芳香性概述内容提要1. 芳香性1.1芳香性的定义与基本判据1.2芳香化合物的基本化学性质1.3芳香化合物的基本结构特征1.4芳香化合物的核磁共振性质和芳香性的检验手段1.4.1核磁共振原理1.4.2 电磁屏蔽效应1.4.3 全反式[18]轮烯的核磁共振1.4.4 芳香化合物的核磁共振性质1.4.5 芳香性的检验手段1.5芳香性的定性判据——休克尔规则1.5.1休克尔规则的表述1.5.2. 休克尔规则的应用举例1.5.3适用休克尔规则的常见非苯芳香化合物1.6周边修正1.6.1萘和薁1.6.2芘1.6.3双键修正在周边修正中的应用1.7芳香性定性判据的局限性2. 反芳香性2.1反芳香性的定义与基本判据2.2典型的反芳香化合物2.2.1 环丁二烯2.2.2 环戊二烯正离子3. 非芳香性4. 同芳香性4.1环辛四烯正离子4.2其它典型的同芳香性分子4.2.1环戊烯-4-正离子4.2.2降冰片烯-7-正离子4.2.3亚甲叉[10]轮烯5. Y芳香性6. 休克尔分子轨道理论6.1变分法概述6.2尝试波函数的构建方法6.3尝试波函数Ψ = c A A + c B B的构建举例6.4同核双原子分子的变分法构建结果6.5异核双原子分子的变分法构建结果6.6 αA和αB的差值对成键和反键轨道能E+和E-的影响6.7休克尔分子轨道法7. 富烯7.1线性π体系分子轨道能量的计算公式7.2使用休克尔分子轨道法简便求解分子轨道能和轨道系数的举例:1,3-丁二烯7.3富烯与1,3,5-己三烯7.3.1 富烯7.3.2 1,3,5-己三烯7.3.3 富烯与1,3,5-己三烯的比较7.3.4 休克尔分子轨道法的局限性8. 环丁二烯与姜泰勒畸变8.1单一环状π体系分子轨道能量的计算公式8.2多边形法则8.3休克尔分子轨道法对环丁二烯的处理8.4环丁二烯的真实情况与姜-泰勒畸变8.4.1 环丁二烯的真实情况8.4.2 姜-泰勒畸变正文1.芳香性(Aromaticity)1.1芳香性的定义与基本判据芳香化合物一词,最早源于苯的合成,天然产物安息香胶中,含有苯甲酸(俗称安息香酸),苯甲酸与碱共热可脱去羧基得到苯,其带有芬芳气味[1]最初,芳香化合物的范围仅限于苯与其同系物,后来随着人们对芳香性的认识不断加深,芳香性的概念也不断被扩展和重新定义公元1931年,德国物理学家和物理化学家艾瑞克·休克尔(Erich Hückel)提出,离域π电子数符合4n + 2规则的平面共轭多烯,具有芳香性,其中n是非负整数[2]。
芳香性及其判据摘要以及莫比乌斯芳香性

芳香性及其判据的发展
随着人们对于芳香化合物认识的不断深入,芳 香性一词的使用范围日益扩大,从最初的苯系化合 物扩充到非苯系化合物;由中性分子扩充到离子; 由碳环化合物扩充到含杂原子的环状有机物,乃至不 含碳的无机环状化合物。 为了判别有机化合物的芳香性,早在1931 年, Huckel就提出了著名的“4n+2”规则:一个具有平面 密闭共轭体系的单环多烯化合物,当π电子数为4n+2 时( n = 0 ,1 ,2 ,3 ,⋯) 才可能有芳香性。 但传统的Huckel规则只适用于平面或近乎平面 的环状共轭体系,且对于n>5单环多烯时,Huckel 规则也不适用。
1964 年, Heilbronner在Huckel分子轨道理论的基础上提出了 “Mobius 芳香性”。与Huckel [4n]体系相比,Mobius [4n] 体系因为有着 闭壳结构而稳定。近些年,人们和发现合成出具有Mobius 芳香性的化 合物。
例如,Ajami, Herges等人合成了一个中性的符合Mobius 拓扑结构的[4n]轮烯衍生物分子a,而同时得到的另一个 Hockel结构的异构体b。
环的外测: H= Ho + Hi 移向低场; 环的内侧: H= Ho - Hi 移向高场.
苯的质子在环的外侧,δ在7.24。[18] 轮烯12个环外氢的δ在9.28,6个环内 氢的δ在-2.99,Δδ很大(12.27)。
莫比乌斯(Mobius)芳香性
Mobius芳香性这个概念来源于拓扑学中的Mobius带。用一条纸带将一 端扭转180°, 然后将两端粘接起来形成的带, 即没有内面, 也没有外面。
通过计算分析键长,键角和能量,表明a具有Mobius 芳香性 。这使芳香化合物的合成开始进入了一个崭新的阶段
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4.1 芳香性和休克尔规则
9
具有芳香性
14eA B C
不具有芳香性
12eD E F
10
4.1 芳香性和休克尔规则
(2) 双键的处理方法 与轮烯直接相连的双键在计算电子数时,将双键写 成其共振的电荷结构,负电荷按2个电子计,正电荷 按0计,内部不计。 芳香性 10e芳香性 14e-
4.1 芳香性和休克尔规则
+
_
实际上,它的七元环带有正电荷, 五元环带有负电荷,是一个典型的 极性分子,结构也可以表示如下:
4.1 芳香性和休克尔规则
8
多环芳烃电子数的计算方法 1954年,Platt提出了周边修正法,对于多环芳烃 可以忽略中间的双键而直接计算外围的电子数。 对休克尔规则进行了完善和补充。 (1) 经典结构式的写法 画经典结构式时,应使尽量多的双键处在轮烯上, 处在轮烯内外的双键写成其共振的正负电荷形式, 将出现在轮烯内外的单键忽略后,再用休克尔规 则判断。
在中间体的NMR谱中,C—1、C—3和C—5上的质子 出现在 8.85,在C—2、C—4和C—6上的平伏的质子在 7.06,直立的质子在 9.80。13C NMR谱呈现两个类型 的碳原子的信号。
第九节 反芳结构 芳香化合物均被电子离域所稳定化,而某些分 子却因电子离域而更不稳定。这种体系,“在其中 电子离域相当大地提高能量”,叫作反芳香性体系。 例如,比较被电子离域所稳定化的环丙烯正离 子和因电子离域而更不稳定的环丙烯负离子。
3
3.随着科学技术的发展,人们又借助核磁共振来判断化合物是否具有芳香 性。若环状共轭烃在外加磁场的作用下,产生高抗磁性此种特征的磁屏蔽 效应可以从质子核磁共振谱中看出,则这种化合物具有芳香性。
4.对芳香性作深入和系统研究,奠定芳香性理论基础的是Hü ckel 4n+2 规则。即在闭合共轭多烯体系中,构成环的原子在同一平面或接近同一平 面上,同时其π 电子数符合4n+2 (n=0,1,2……),则该化合物具有芳香性。
Fe H
+
Fe
H
O
4.8 二茂铁类物质
26
4.1 芳香性和休克尔规则
15
第六节 同芳结构 某些环正离子,在其中既没有正统的芳香体系的 -电子骨架,也没有平行的p原子轨道排列,但是具 有某种(4n+2)电子的环状排列,则可能呈现芳香性。 这是所谓的“同芳香性”,具有这种芳香性的结构, 叫作同芳结构。
(1)在同芳香性概念发展的过程中,一个关键性的 实验是反式-7-原冰片烯对甲苯磺酸酯的溶剂化反应, 这个化合物的溶剂化速度为相应的饱和类似物的溶剂 化速度的1011倍。相应的能量差约为15千卡/摩尔(活 化自由能)。对于这个反应,目前了解到是通过同芳香 性碳正离子中间体进行的。
H H
H H
H H
芳香性
4.3 非芳香性
23
六. Y 芳香性
胍是较强的碱,因为它的共轭酸是具有 芳香性结构的物质。
NH2 HN C NH2 NH2 + H 2N C NH2 H2N + NH2 C NH2 H 2N NH2 C + NH2
H+
4.6 Y芳香性
24
七. 方克酸类
方克酸是一类较强的酸(pKa1=1.5, pKa2=3.5), 因为其共轭碱是非常稳定的芳香结构。
芳香性 芳香性
4.1 芳香性和休克尔规则
14
4. 富勒烯 富勒烯是C60、C50、C70 等一类化合物的总称。 由于C60这一重大发现Kroto 等人获1996年Nobel化学奖 C60是除石墨、金刚石以外碳的另一种同素异形体, 分子式为C60,由12个五边形和20个六边形组成 。 每个碳原子均以sp2杂化轨道与相邻碳原子形成 三个σ键,它们不在一个平面内。每个碳原子剩下的 p轨道彼此构成离域大π键,具有芳香性。
11
芳香性 6e6e-
O
O
芳香性 6e-
芳香性
6e-
2e12
4.1 芳香性和休克尔规则
(3) 轮烯内部共面的单键 轮烯内部通过单键相连,且单键碳与轮烯 共用,单键忽略。
芳香性
周边8e周边10e芳香性 周边12e周边14e13
4.1 芳香性和休克尔规则
(4) 轮烯外部单键 轮烯外部通过单键相连,且单键碳与轮烯共用, 单键忽略,分别计算单键所连的轮烯的芳香性。 芳香性
芳香性(Aromaticity):在闭合共轭多烯体系 ③ ④ 中; 成环原子共平面; 电子数符合 4n + 2
①
②
4.1 芳香性和休克尔规则
4
Hü ckel 规则
1931年,休克尔(E. Hü ckel)用简单的分子轨道计算了单环多烯烃的π 电子能级, 从而提出了一个判断芳香性体系的规则,称为休克尔规则。 休克尔提出,单环多烯烃要有芳香性,必须满足三个条件。 (1) 成环原子共平面或接近于平面,平面扭转不大于0.1nm; (2) 环状闭合共轭体系; (3) 环上π 电子数为4n+2 (n= 0、1、2、3„„); 符合上述三个条件的环状化合物,就有芳香性,这就是休克尔规则。 不含苯环,π 电子数为4n+2,具有芳香性,即符合休克尔规则的环状多烯烃,我 们称之为非苯系芳烃。
有机化合物的芳香 性
(Aromaticity)
芳香性 (Aromaticity)
“芳香”最初是指从天然香树脂、香 精油中提取的物质,具有特殊的芳香 气味,而且具有特殊的性质,后来将 这种特殊的性质叫做芳香性,而具有 芳香性的化合物通称为芳香化合物。
2
一. 芳香性
芳香性是指芳香族化合物所特有的性质。芳香族化合物是指苯和类苯化合 物,这是一类具有高度不饱和性的环状化合物。芳香性的含义是在不断发 展的,经过一个由浅到深的过程。
(2) 当环辛四烯溶解在氟磺酸中时,NMR谱表明亚甲 基的两个质子的信号分别为4.87和10.73r。这种差别 表明其中有一个质子在反磁环流中。显然,这里环上 电子构成同芳香性体系。这个离子可以作为六氯锑 酸盐离析出来。
(3) 用SO2ClF-SbF5在-120C处理下列氯化物,形成碳 正离子,后者在用甲醇处理时,给予一个醚。
>
4.2 反芳香性
22
三. 非芳香性(nonaromaticity)
非芳香性分子是指不共平面的多环烯烃,或电子数为奇数的中间体。 如环辛四烯、10轮烯、14轮烯以及环戊二烯自由基环丙稀自由基等。10轮烯和14轮 烯由于内H位阻使其不能共平面。将14轮烯中的一个双键换成三键,消除了H的位阻, 而具有芳香性。
1. 最初芳香性的定义着重于苯一类的环状共轭体系的化学性质,这类化合 物它们具有特殊的稳定性,不易发生氧化或加成反应,容易发生亲电取代 反应。 2.随着量子化学的发展,又将共振能等与芳香性联系起来。若环状化合物 具有相当大的共振能(或离域能),则该环状化合物具有芳香性。 如苯的共振能为150.6 kJ·mol-1,则苯具有芳香性。
概括地讲,任何电子的4n环都是反芳香性的。
二. 反芳香性(antiaromaticity)
反芳香性是指共平面、 π电子数为4n、共平面的原子均为sp2或sp杂化的 轮烯,其稳定性小于同类开链烃,如环丁二烯环戊二烯正离子是反芳香性 的物质。如:
4e
4e
>
除环辛四烯外,具有4n电子数的轮烯一般都是反芳香性物质。
4.1 芳香性和休克尔规则51. 单环共轭多烯(轮烯) [4]轮烯 成环原子共平面,π 电子数4n.
[8]轮烯
H H
成环原子不共平面: π 电子数4n.
[10]轮烯 由于有环内氢 , 相互干扰 , 成环原 子不共 平面 . π 电子数4n+2. [18]轮烯 成环原子共平面, π 电子数4n+2. [22]轮烯 成环原子共平面, π 电子数4n+2.
芳香性
4.1 芳香性和休克尔规则
6
2. 芳性离子 某些环烃没有芳香性,转变成离子(正或负离子) 后,有可能具有芳香性.
2K 2e
π 电子数
2
2
6
芳香性
6
6
4.1 芳香性和休克尔规则
7
3.非苯稠环
蓝烃:天蓝色晶体,它是五元环的环戊二烯和七元环的环庚三烯稠 合而成的,结构如下: 蓝烃
它含有10个π 电子,符合休克尔规则,所以有芳香 性。
O OH 2H O OH
+
O
O-
O
O
O
O-
-
O
O-
-
O
O
-
O
O-
-
O
O
O
O
25
4.7 方克酸类
八. 二茂铁类物质
茂类物质与金属形成特殊的大π键,其电子云平均 化,具有芳香性。
如:二茂铁是非常稳定的化合物,其中铁原子由于 电子云密度升高,不仅可以和质子结合,而且可以 形成氢键。
CH2OH Fe
Fe
H+
