原子结构及元素周期律共87页文档
原子结构元素周期律和周期表

汇报人:XX
副族元素: 包括1930号元素, 具有相似 的化学性 质
过渡元素: 包括3136号元素, 具有相似 的化学性 质
稀有气体 元素:包 括118号 元素,具 有相似的 化学性质
主族元素:原子最外层电子数为1-8,化学性质稳定,不易发生化学反 应
副族元素:原子最外层电子数为9-18,化学性质活泼,容易发生化学 反应
意义:元素周期表可以帮助我们理解和预测元素的电子排布和化学键类型。
局限性:元素周期表不能完全预测元素的电子排布和化学键类型,例如过渡金属和稀土元素的 电子排布和化学键类型。
PART FOUR
指导化学反应的设计和优化
提供元素分类和命名的依据
解释元素性质的周期性变化 预测新元素的存在和性质
帮助理解化学键的形成和性 质
指导元素分离和提纯的方法 选择
预测新材 料:根据 元素周期 表,可以 预测新材 料的性质 和性能
材料设计: 根据元素 周期表, 可以设计 出满足特 定需求的 新材料
材料优化: 根据元素周 期表,可以 对现有材料 进行优化, 提高其性能
材料筛选: 根据元素 周期表, 可以筛选 出适合特 定应用的 材料
元素周期表的人工智能 应用:利用人工智能技 术,实现元素周期表的 智能推荐和决策支持
科普教育:通过科普书籍、讲座、展览等方式,向公众普及原子结构和元素周期律的 知识
传播途径:利用互联网、社交媒体等平台,扩大原子结构和元素周期律的传播范围
教育创新:开发新的教育工具和方法,如虚拟现实、互动游戏等,提高公众对原子结 构和元素周期律的兴趣和认知
原子结构:原子由原子核和电子组成,原子核由质子和中子组成
无机化学2原子结构与元素周期律

第二章 原子结构与元素周期律
表2-4
n、l、m的关系
第二章 原子结构与元素周期律
六、多电子原子轨道的能级
用图形把原 子轨道能级 高低顺序表 示出来,就 是原子轨道 能级图。
第二章 原子结构与元素周期律
第二节 核外电子的排布
多电子原子中,电子不仅受核的吸引,而且还存在 电子间的相互排斥,这些都影响到原子核外电子的排布, 而核外电子的排布又直接决定着元素的性质。因此,核 外电子排布是多电子原子结构中的一个重要问题。 人们根据光谱实验结果,并结合对元素周期律的分 析,归纳、总结出基态原子核外电子排布的三个基本原 理。
第二章 原子结构与元素周期律
五、薛定谔方程和四个量子数
为了描述电子的运动状态,1926年薛定谔把电子运动和 光的波动理论联系起来,提出了一种波动方程,该方程 称为薛定谔方程。
为了得到电子运动状态合理的解,必须引用三个参数,主 量子数n、角量子数l和磁量子数m,它们的取值是相互制 约的。此外,还有用来描述电子自旋运动的自旋量子数ms。
第二章 原子结构与元素周期律
迄今为止,人类已发现了一百多种元素,而这些元
素形成了数以百万计的物质,组成了丰富多彩的物质世 界。要了解这些物质的性质和变化规律,就必须要认识 其结构,从原子、分子水平上研究物质结构、性质及其 变化规律之间的关系。
第二章 原子结构与元素周期律
第一节 核外电子运动状态 一、氢原子光谱和玻尔理论
第二章 原子结构与元素周期律
(一)主量子数n
主量子数表示电子离核的平均距离,n越大,电子离核平 均距离越远,n相同的电子离核平均距离比较接近,即所 谓电子处于同一电子层。
电子层能量高低顺序: K<L<M<N<O<P。
原子结构 元素周期律

1、下列化合物中阳离子与阴离子半径比最小的是 A. NaF B. MgI2 C. BaI2 D. KBr B 2、下列各分子中所有原子都满足最外层8电子结构的是 A. BeCl2 B. PCl3 C. PCl5 D. H2O B 8电子稳定结构:化合价的绝对值+最外层电子数 = 8 _ _ 3+ + 2 3、已知1—18号元素的离子 aW 、bX 、CY 、dZ 都 具有相同的电子层结构,则: Z< Y<W<X ⑴原子半径由小到大的顺序 ; _ 3+ + 2_ W <X < Z < Y 离子半径由小到大的顺序是 。 C<d<b<a ; ⑵质子数a、b、c、d由小到大的顺序____________ 原子最外层电子数由小到大的顺序 X < W < Y < Z 。 ⑶离子氧化性、还原性的关系是 Y Z 氧化性 W3+ > X+ ; 还原性 Y2- > Z- 。 X w
例1、X、Y是元素周期表ⅦA族中的两种元素。下列叙述 中能说明X的非金属性比Y强的是( C ) A、 X原子的电子层数比Y原子的电子层数多 B、 X的氢化物沸点比Y的氢化物的沸点低 C、 X的气态氢化物比Y的气态氢化物稳定 D、 Y的单质能将X从NaX的溶液中置换出来。 例2、下列叙述正确的是( C ) A、同一主族元素,原子半径越大,单质熔点一定越高。 B、ⅥA族元素的原子,其半径越大,越容易得到电子。 C、同周期元素中,ⅦA族元素的原子半径最小。 D、所有主族元素的原子,形成单原子离子时的化合价 和它的族序数相等。 一般来说,同主族金属元素单质的熔沸点降低,非 金属元素单质的熔沸点升高。同周期金属元素单质的熔 沸点升高,非金属元素单质的熔沸点降低。
原子结构和元素周期律

第一章物质及其变化第一节物质的聚集状态体系:被研究的对象,例如一个烧杯中的溶液一、物质的聚集状态:各种物质总是以一定的聚集状态存在的气、液、固为三种聚集状态,各具特征,在一定条件下可相互转化。
1、气体(g):扩散性和可压缩性2、液体(l):流动性、无固定形状、一定条件下有一定体积3、固体(s):具有一定体积、一定形状及一定程度的刚性。
二、物质的聚集状态和相:相:在体系中任何具有相同的物理性质和化学性质的部分称为相。
相与相之间有界面隔开。
g-s,l-s,s-s一般为两相g-g混合物为一相l-l混合物:一相:如5%HCl溶液,HCl以分子或离子形式分散在水中两相:如油和水组成的体系,O/W,O以较多分子聚成粒子,以一定的界面和周围的水分开,是不连续的相,W是连续相。
g-L混合物:也存在如上关系:H2S溶于水为一相S-S混合物制成合金时为一相。
物质的聚集状态或相可以相互变化,亦可共存。
如:S-L相平衡这一点温度即为凝固点。
气体的存在状态主要决定于四个因素:P、V、T、n,而几乎与它们的化学组成无关。
反映这四个物理量之间关系的式子叫气体状态方程式。
理想气体:分子间完全没有作用力,分子只是一个几何点,没有体积。
实际上所碰到的气体都是真实气体,只有在温度不太低,压力不太高时,实际气体的存在状态才接近于理想气体,可以用理想气体的定律进行计算。
三、理想气体状态方程:R:常数,可由实验测得:1 mol气体在273.15K(0℃),101.325kPa下测得其体积22.4×10-3m3这是理想气体的状态方程式,而实际上气体分子本身必然占有体积,分子之间也具有引力,因此应用该方程进行计算时,不可避免地存在偏差。
对于常温常压下的气体,这种偏差很小,随着温度的降低和压力的增大,偏差逐渐增大。
四、混合气体分压定律:1、混合气体分压定律:1801年,由Dalton(道尔顿)总结实验结果提出,因此又称为Dalton分压定律。
原子结构元素周期律

04
元素周期律及其应用
元素周期律概述
要点一
元素周期律定义
元素周期律是指元素的性质随着原子 序数的增加呈现周期性变化的一种规 律。
要点二
元素周期表
元素周期表是按照元素原子序数递增 的顺序排列的表格,它将化学元素按 照其原子序数(即核内质子数)进行 排序,具有相同的电子层数的元素排 在同一行,具有相似的化学性质的元 素排在同一列。
02
元素周期表简介
周期表发展历程
早期元素分类尝试
从古希腊到18世纪,人们尝试以各种 方式对元素进行分类,如按性质、来源
等。
纽兰兹的八音律
1864年,纽兰兹发现元素性质存在周 期性变化,提出“八音律”分类法。
德贝莱纳的三元素组
1829年,德贝莱纳发现某些元素之间 存在类似性,提出三元素组概念。
门捷列夫的元素周期表
要点三
周期和族
元素周期表中的行称为周期,列称为 族。周期表示元素电子层数的变化, 族表示元素最外层电子数的变化。元素周期Leabharlann 在化学中的应用预测元素性质
通过元素在周期表中的位置,可以预测其物理和化学性质,如原 子半径、电负性、金属性和非金属性等。
推断化学键类型
根据元素的电负性差值,可以推断元素之间可能形成的化学键类 型,如离子键、共价键和金属键等。
元素金属性、非金属性递变规律
同一周期内,从左到右,随着原子序数的递增,元素的金属性逐渐减弱,非金属性逐渐增强;同一主族 内,从上到下,随着原子序数的递增,元素的金属性逐渐增强,非金属性逐渐减弱。
03
原子结构与元素性质关系
原子半径变化规律
同一周期,从左到右,随着核电荷数 的递增,原子半径逐渐减小(稀有气 体元素除外)。
物质结构 元素周期律

物质结构元素周期律一、原子结构:1.原子的组成1个单位正电荷,决定元素的种类)原子核原子中子(不带电荷,决定核素的种类)核外电子(带1个单位负电荷,决定元素的化学性质)2.数量关系(1)数量关系:核内质子数=核外电子数(2)电性关系:原子:核电荷数=核内质子数=核外电子数阳离子:核外电子数=核内质子数-电荷数阴离子:核外电子数=核内质子数+电荷数(3)质量关系:质量数(A)=质子数(Z)+中子数(N)3.核外电子排布规律电子由内向外按能量由低到高分层排布,第n层最多容纳的电子数为,最外层电子数≤。
(K层为最外层不超过个)。
次外层电子数≤,倒数第三层电子数≤。
题型一:构成原子的微粒间的关系:例1 下列关于原子的几种叙述中,不正确的是()A、18O与19F具有相同的中子数B、16O与17O具有相同的电子数C、12C与13C具有相同的质量数D、15N与14N具有相同的质子数3、核素和同位素区别(1)核素:具有一定数目的质子和一定数目的中子的一种原子。
如1H(H)、2H(D)、3H(T)就各为一种核素。
(2)同位素:同一元素的不同核素之间互称同位素。
160、17O、180是氧元素的三种核素,互为同位素。
(3)元素、核素、同位素之间的关系如右图所示。
(4)同位素的特点:同一种元素的不同核素,其原子、单质及其构成的化合物化学性质几乎完全相同,只是某些物理性质略有差异。
题型二:同位素例2 下列各组微粒属同位素的是()①1602和1802,②H2和D2,③168O和1880,④1H2180和2H216O,⑤3517Cl和3717ClA、①②B、③⑤C、④D、②③二、元素周期表1.元素周期表的结构七主、七副、八和零;三长、三短、一不完全。
2.、元素周期表与原子结构的关系a.原子序数=核电荷数=核内质子数=核外电子数b.周期序数=电子层数c.主族序数=最外层电子数=元素的最高正价数d.|最高正价数|+|负价数|=8三、元素周期律1.概念:元素的性质随原子序数的递增而呈周期性变化的规律2.本质:核外电子排布的周期性变化4.原因:(1)同周期元素:同周期,电子层数相同,即原子序数越大,原子半径越,核对电子的引力越,原子失电子能力越,得电子能力越,金属性越、非金属性越。
原子结构和元素周期律

7
第一节 核外电子的运动特征
一、量子化特性
20世纪初,量子化理论的提出,对原子结构的认识是一 个飞跃。1900年,德国物理学家普朗克(M.Planck)根据 实验提出了量子化理论。基本要点:
Xe原子(300K)
垒球
枪弹
质量m/kg 9.1×10-31 9.1×10-31 9.1×10-31 9.1×10-31 6.6×10-27 2.3×10-25 2.0×10-1 1.0×10-2
速度v/(m.s-1) 5.9×105 5.9×106 1.9×107 5.9×107 1.4×103 2.4×102 30 1.0×103
4 3.14 10 10 3 0.04 10 2
5.271029 m s1
∴ 对宏观物体可同时测定位置与速度
33
例2: 对于微观粒子如电子, m = 9.11 10-31 Kg, 半径 r = 10-10 m,则x至少要达到10-11 m才相 对准确,则其速度的测不准情况为:
h 4mx
17
玻尔原子结构理论的假设可归结为以下三点:
1.核外电子在固定轨道上运动,具 有确定的半径和能量。也就是我们通常所说
的电子层!
在原子中,电子不能沿着任意轨道绕 核旋转,只能沿着具有一系列不连续能量 状态的轨道绕核运动,即:核外电子只能 在有确定半径和能量的轨道上运动,且不 辐射能量。从而,解释了原子稳定存在的 原因。
hv E2 E1 v E2 E1
h
= c/ν
22
0J
氢 原 子 光 谱 与 氢 原 子 能 级
原子结构和元素周期律PPT课件

得到 mc2 = h
mc2 = h
所以
mc2 = hc
故 mc =h
mc =h
用 p 表示动量, p = mc, 故有公式
p =h
p =h
左侧动量 p 表示粒子性
右侧波长 表示波动性
二者通过公式联系起来
德•布罗意认为
=
h p
说明具有动量 p 的微观粒
子其物质波的波长为
的玻尔理论。
玻尔理论解释了当时的氢原子 线状光谱,既说明了谱线产生的原 因,也说明了谱线的波数所表现出
的规律性。
玻尔理论认为: 核外电子在特定的原子轨道上 运动, 轨道具有固定的能量 E。
电子所在的原子轨道离原子核 越远,能量越大。
电子在轨道上绕核运动时, 并 不放出能量。
因此,通常条件下氢原子不会 发光。
着局限性。
在计算氢原子的轨道半径时, 仍是以经典力学为基础的,因此 它不能正确反映微粒运动的规律。
6. 2 微观粒子运动的特殊性
6. 2. 1 微观粒子的波粒二象性
20 世纪初人们才逐渐认识到光既 具有波的性质又具有粒子的性质,
即具有波粒二象性。
将质能联系公式 E = mc2
和光子的能量公式
E = h
1909 年 美国人密立根(Millikan) 用油滴实验测电子的电量
1911 年 英国人卢瑟福(Rutherford)
进行 粒子散射实验, 提出原子的有核模型
1913 年 丹麦人玻尔(Bohr)
提出玻尔理论, 解释氢原子光谱
6. 1. 2 氢原子光谱
用如图所示的实验装置,可以 得到氢原子光谱。
定的规律。
第二章 原子结构和元素周期律
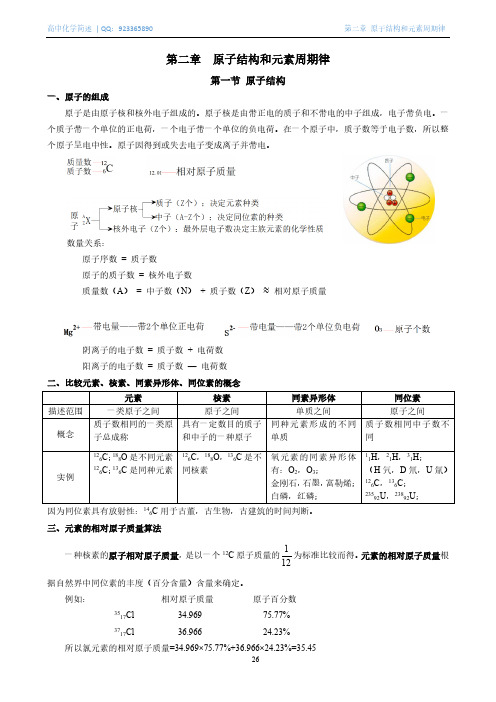
第二章 原子结构和元素周期律第一节 原子结构一、原子的组成原子是由原子核和核外电子组成的。
原子核是由带正电的质子和不带电的中子组成,电子带负电。
一个质子带一个单位的正电荷,一个电子带一个单位的负电荷。
在一个原子中,质子数等于电子数,所以整个原子呈电中性。
原子因得到或失去电子变成离子并带电。
数量关系:原子序数 = 质子数 原子的质子数 = 核外电子数质量数(A ) = 中子数(N ) + 质子数(Z ) ≈ 相对原子质量阴离子的电子数 = 质子数 + 电荷数 阳离子的电子数 = 质子数 — 电荷数二、比较元素、核素、同素异形体、同位素的概念因为同位素具有放射性:146C 用于古董,古生物,古建筑的时间判断。
三、元素的相对原子质量算法一种核素的原子相对原子质量,是以一个12C 原子质量的121为标准比较而得。
元素的相对原子质量根据自然界中同位素的丰度(百分含量)含量来确定。
例如: 相对原子质量 原子百分数3517Cl 34.969 75.77% 3717Cl36.966 24.23%所以氯元素的相对原子质量=34.969×75.77%+36.966×24.23%=35.45第二节核外电子排布一、基本概念电子在原子核外很小的空间内作高速运动,电子运动与宏观物体不同,没有确定的轨道,但有运动的区域。
根据每个电子所带的能量不同,运动的区域也不同,能量低的电子在离核较近的区域运动,高能量电子在离核较远的区域运动。
我们把电子在核外运动的区域划分出不同的能层。
从内到外,分别用n=1,2,3,4,5,6,7或:K、L、M、N、O、P、Q来表示电子层(能层)。
电子总是尽先排在能量较低的电子层,然后由里向外排布。
每个电子层最多容纳2n2个电子,最外层电子数不得超过8个,(K层为最外层时,不得超过2个),次外层不得超过18个。
最多可容纳的电子数 2 8 18 32 50当最外层电子排满8个(He为2个)形成稳定结构,该结构是稀有气体原子结构,不易得失电子。
原子结构元素周期律

6、A原子共有5个电子层,其O层最多容纳
子,N层最多容纳 数分别是
个电
个电子;B原子具有3个电子 ; 个电子层。
层,其最外层、次外层和倒数第三层至多容纳的电子 C原子倒数第三层至多容纳的电子数和最外层至多容纳 的电子数相同,这个原子有 7、元素A、B,A原子最外层电子为a个,次外层电子
为b个,B原子M层电子为(a—b)个,L层电子数为
1 K
2 L
3 M
4 N
5 O
6 P
7 Q
逐渐增大 逐渐升高
2. 电子在原子核外的排布:
元素 H
+1 1
He
+2 2
原子 结构
元素
Li
+3 2 1
Be
+4 2 2
B
+5 2 3
C
+6 2 4
N
+7 2 5
O
+8 2 6
F
+9 2 7
Ne
+10 2 8
原子 结构
元素
Na
Mg
Al
Si
P
S
Cl
Ar
原子 结构
—
不显电性
31
27
1.675×10
—
27
相对质量
1/1 836
1.007
1.008
练习:
1、填表
A ZX
核内质子数 核外电子数 核内中子数 质量数 1
17 1 17 15 0 18
1 H 1
1
35 31
35
17Cl
31 P 15 12 6C
15
6
16
6
第一章原子结构和元素周期律(精)
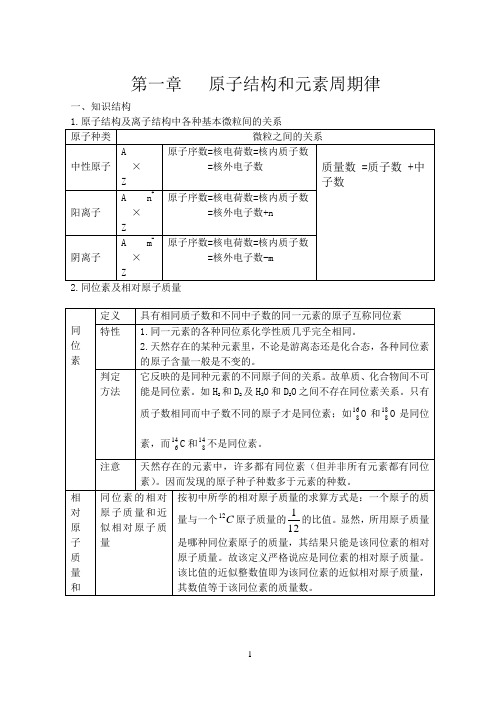
第一章原子结构和元素周期律一、知识结构1.原子结构及离子结构中各种基本微粒间的关系2.同位素及相对原子质量3.原子核外电子排布规律原子的质子数,要注意正号;弧线表示电子层,弧线内数字表:7.二、练习:1.含有相同质子数和电子数的两种微粒之间的关系不正确的是:( )A.它们可能是同位素B.可能是不同的分子C.可能是不同的离子D.可能是一种分子和一种离子知识点:微粒的分类,微粒的电性与微粒内质子数和电子数的量的关系。
能力点:发散思维能力和抽象概括能力。
2.若a X m+与b Y n-的核外电子排布相同,下列关系式正确的是( )A.b=a-n+mB.b=a-n-mC.离子半径X m+<Y n+D.原子半径X<Y知识点:原子核外电子排布,构成离子、原子的各种基本微粒间的数量关系,微粒半径的比较能力点:再现能力,辨认能力,分析比较能力。
3.硼元素有两种天然同位素105B和115B,已知硼元素的相对原子质量为10.80,则硼元素中105B的质量分数的下列判断中,正确的是( )A.20%B.略大于20%C.略小于20%D.80%知识点:元素的相对原子质量的概念及计算方法。
能力点:计算推断能力,抽象思维能力。
4.X原子的质量数为A,ngX2-离子中含有Y mol电子,则X原子核内中子数为( )A.(nA-yA-2n)/nB.(nA-y-2n)/nC.A-y+2D.y-A-2知识点:原子、离子的构成微粒间的数量关系,有关摩尔的计算。
能力点:再现能力、辨认能力,计算推理能力。
5.自然界中氯化钠是由2311Na与3517Cl和3717Cl所构成的。
已知氯元素的相对原子质量是35.5,则11.7g氯化钠中,含3717Cl的质量为( )A.1.5gB.1.65gC.1.75gD.1.85g知识点:元素相对原子质量的概念与计算,有关摩尔质量的计算。
能力点:理解能力,计算推理能力。
6.下列各种元素中,原子的次外层电子数等于其它各层电子数之和的元素是( )A.MgB.SC.OD.Ar知识点:1~18号元素的原子结构特点。
