优选取代基效应
取代基效应

在21世纪,物理有机化学家将会在更广阔的范围内,在相关的前沿交叉领域中寻找新的学科生长点,运用自己在理论、方法、概念和思维方式方面的特长和优势,研究新问题,发现新规律,为有机化学乃至整个科学事业的发展作出贡献。
其中主要包括生命过程中的化学问题,分子聚集体化学中的结构/活性关系和反应规律,新分子和新材料的分子设计、合成和构效关系,计算化学和理论有机化学,自由基化学,有机光化学等领域。
内容提要§1-1 诱导效应一、共价键的极性与静态诱导效应 二、静态诱导效应的强度 三、静态诱导效应的强度比较 四、烷基的诱导效应 五、动态诱导效应 六、诱导效应对反应活性的影响 §1-2 共轭效应一、电子离域与共轭效应 二、静态共轭效应 三、动态共轭效应 四、共轭体系 五、共轭效应与反应性 §1-3 超共轭效应一、超共轭效应的特点和方向 二、超共轭效应的表现和作用 §1-4 场效应和空间效应 一、场效应 二、空间效应第一章 取代基效应(Substituent Effects)反应的本质: 有机化合物的反应本质是旧键的断裂,新键的生成,这直接或间接与共价键的极性,即共价键上电子云的分布有关。
例:C C C O1234取代基效应 分子中的某个原子或原子团对整个分子或分子中其它部分产生的影响(包括对共价键极性及整个分子物理性质和化学的影响)。
取代基效应的分类 取代基效应电子效应: 诱导效应 共轭效应 超共轭效应 场效应: 空间传递空间效应:空助效应 位阻效应 §1-1 诱导效应(Inductive effect) 一、共价键的极性与静态诱导效应C CH CH 21.定义CCCl ddd取代基的影响→分子链传递Cl d→电子云密度分布不均匀CCl d取代基性质→分子链传递方向δCH 3 CH CH 2 +→转移的结果存在于未发生反应的分子中——IS2.特点结构特征 单、双、叁键 传递方式沿价键链传递诱导效应的相对强度 取决于取代基中心原子电负性的大小;取代基的个数——加和性传递强度 距离越大,强度越弱 3.方向CZC H Z -I标准+I二、静态诱导效应的强度1.根据中心原子在元素周期表中的位置判断同周期 -IFOHNH 2CH 3OR 2NR 3 +IONR同主族 -I —F > —Cl > —Br > —IPR 2NR 3+IOS2.带正电荷取代基的-I 强,带负电荷取代基的 +I 强-I NR 2NR3NO 2+IOOR3. 中心原子相同 不饱和度越大,-I 效应越强 -ICCRCHCHROORN NRNR 2三、静态诱导效应的强度比较 相对次序比较 1.根据酸碱的强度比较测定取代乙酸的电离常数,诱导效应强度次序如下:-I 效应NO 2N(CH 3)3CNFClBrIOHOCH3C 6H 5CH CH 2H+I 效应C(CH 3)3HCH(CH 3)2CH 2CH 3CH 32.根据偶极矩比较测定甲烷一取代物和溴代烷的偶极矩,诱导效应强度次序如下: -I 效应NO2CNFCl BrIH+I 效应C(CH 3)3CH 2CH(CH 3)2CHCH 2CH 3CH 3CH 2(CH 2)2CH 33.根据1H NMR 化学位移比较测定X -CH3中甲基的 值,比较取代基的诱导效应强度。
取代基效应对有机物酸碱性的影响

取代基效应对化合物酸碱性的影响摘要:取代基效应是有机结构理论的重要组成部分并且对化合物物理性质和化学性质有着重大的影响,本文通过取代羧酸的酸性比较以及胺类物质的碱性比较来阐述取代基效应在化合物酸碱性方面的影响。
关键词:诱导效应、共轭效应、空间效应、邻位效应、溶剂化作用取代基效应对有机化合物酸碱性的影响归纳起来有两个方面:(1)电子效应,包括诱导效应、共轭效应和场效应。
电子效应是通过影响电子云的分布,改变分子失去质子和得到质子的能力,从而影响有机物酸碱性(2)空间效应,是由于取代基的大小或形状引起分子中特殊的张力或阻力的一种效应,空间拥挤程度在一定方面影响了结合质子的能力。
下面就以取代羧酸和胺类物质中的几个经典案例来剖析一下取代基效应的影响。
(一)取代羧酸的酸性比较酸性大小简单来说就是化合物给出质子的能力,越容易离解出质子酸性就越强。
先来比较几个脂肪取代羧酸的酸性:查pKa表可知运用电子效应的理论来解释就是:主要受诱导效应的影响,烃基为给电子基团,羟基和氯原子为强烈的吸电子基团,其中氯的吸电子能力比羟基更强;烃基的给电子作用使得羧基上的质子不易离去因此酸性最弱,而羟基和氯原子的吸电子作用将羧基上的电子“拉扯”过来,使得质子容易离去,其中氯原子的“拉扯”能力更强因此酸性更强。
同时,诱导效应沿着碳链传递越远作用越弱,所以邻取代的羟基酸酸性更强再来比较几个芳香取代羧酸的酸性:相应的解释则是:硝基连在苯环上具有强烈的吸电子作用,对苯环的邻对位具有吸电子的诱导效应以及吸电子的共轭效应,对苯环间位只有吸电子的诱导效应;而氨基与羟基连在苯环邻对位上具有吸电子的诱导效应以及供电子的共轭效应,其中以共轭效应为主,并且氨基的供电子效应更强(因为氧的电负性比氮更加强,吸附电子的能力更强)。
当羧基连到苯环上时,硝基吸电子作用使得羧基的质子更易离解,氨基和羟基的供电子作用使得羧基的质子不易离解,因此硝基苯甲酸强于氨基苯甲酸强于羟基苯甲酸。
取代基效应

C
CR > CH CHR
6 动态诱导效应
静态诱导效应,是分子本身所固有的性质, 是与键的极性及其基态时的永久极性有关的。当 某个外来的极性核心接近分子时,能够改变共价 键电子云的分布。由于外来因素的影响引起分子 中电子云分布状态的暂时改变,称为动态诱导效 应,用Id表示。
正常状态(静态)
试剂作用下的状态
二、 共轭效应
分子轨道理论认为共轭效应是轨道或电子离域于整 个共轭体系乃至整个分子所产生的一种效应。 1. 电子离域与共轭效应
[现象1]
在CH2=CH—CH=CH2中的键长不是简单的单 键和双键的键长,存在着平均化的趋势。 C—C单键键长 0.154nm C=C双键键长 0.134nm 1,3-丁二烯C—C单键键长 0.147nm C=C双键键长 0.137nm 体系能量降低,化合物趋于稳定。
1) HOCH2CH2COOH 和 CH3CH(OH)COOH
2) 对硝基苯甲酸和对羟基苯甲酸
3) a. b. c.
ClCH2COOH CH3COOH FCH2COOH
d e.
CH2ClCH2COOH CH3CHClCOOH
[练习3]
一般情况下二元酸第一个质子的酸性 比一元酸强;而第二个质子的酸性比一 元酸弱。如丙二酸的pKa1=9, pKa2=5.7,乙酸为4.74。试解释原因。
7 动态诱导效应与静态诱导效应的不同。
(1)引起的原因不同。静态诱导效应是由于 键的永久极性引起的,是一种永久的效应,而动 态诱导效应是由于键的可极化性而引起的,是一 种暂时的效应。 (2)动态诱导效应是由于外界极化电场引起 的,电子转移的方向符合反应的要求,即电子向 有利于反应进行的方向转移,所以动态诱导效应 总是对反应起促进或致活作用,而不会起阻碍作 用。而静态诱导效应是分子的内在性质,并不一 定向有利于反应的方向转移,其结果对化学反应 也不一定有促进作用。
有机化学基础知识点有机物的取代基效应和共振效应

有机化学基础知识点有机物的取代基效应和共振效应有机化学是研究含碳的化合物及其反应的一门学科。
在有机化学中,有机物的取代基效应和共振效应是两个重要的基础知识点。
本文将详细介绍这两个效应及其在有机化学中的应用。
一、取代基效应取代基效应指的是有机物中取代基对反应速率、反应路径和产物稳定性的影响。
取代基的性质和位置对有机物的物理性质和化学性质都有很大影响。
1. 取代基的电子效应取代基的电子效应可以分为两类:正电子效应和负电子效应。
正电子效应是指取代基释放电子,使体系具有更大的正电荷。
常见的正电子效应有烷基效应和烯基效应。
相反,负电子效应是指取代基吸引电子,使体系具有更大的负电荷。
常见的负电子效应有氨基效应和亚硝基效应。
2. 取代基的空间位阻效应取代基的空间位阻效应主要体现在反应速率和反应路径上。
空间位阻较大的取代基会阻碍反应物的接近,从而减慢反应速率。
此外,取代基的位置也会影响反应路径,导致不同的产物生成。
3. 取代基的共轭效应取代基通过π-电子共轭作用可以影响有机物的电荷分布和稳定性。
共轭效应可以加强或减弱有机物的碳碳双键或碳碳单键的稳定性。
常见的共轭效应有芳香性和共轭酮效应。
二、共振效应共振效应是指有机物中通过共振作用在不同结构之间分配电子密度,从而影响其物理性质和化学性质。
共振效应可以使某些分子更稳定,同时也可以调整反应的速率和产物的选择。
1. 共振结构的形成共振结构是通过共振现象形成的不同电子排布的结构。
共振结构之间仅仅是电子排布的不同,而分子实际上并不是在这些结构之间跳跃。
共振结构的形成可以通过共振杂化来解释。
2. 共振效应的作用共振效应可以调整有机物的稳定性和极性。
共振结构中的不同电荷分布会影响分子的稳定性,使其更耐高温和高压。
共振效应还会影响有机物的酸碱性和亲核性,从而改变其反应性质。
三、应用示例1. 取代基效应在药物研发中的应用药物研发中常常需要调整药物的活性和毒性。
通过在药物结构中引入不同的取代基,可以改变药物的性质,提高其生物利用度和靶向性。
取代基效应

OH + Br2 Br
Br
O H3C
OH
H
Br
Br
+ HBr
5.5 立体效应 因分子内各个原子或基团都占据了一定的空间体积, 由此产生的诸多影响,称为立体效应。 立体效应的主要表现形式包括: 1.空间位阻(范德华排斥作用)所引起的分子结构变 化,如键角和键长变形。如:连二苯和2,2,2’,2’—四取 代连二苯。 2.空间位阻所引起的分子的物理和化学性质的变化。 3.空间位阻所引起的分子的稳定构象的变化等。如: 1,4—二甲基环己烷的稳定构象。 这些作用与涉及到的原子或基团在空间的位置有关。 立体效应对特别反应的影响,将在有关章节中作具体 的介绍。
5.4 动态诱导极化效应 当非极性分子与具有永久偶极矩的极性分子相互接近 时,会发生诱导极化,形成瞬时诱导偶极。 极性分子的永久偶极矩越大,非极性分子的极化度越 大,这种诱导作用也就越大。外层电子数较多,原子半 径较大的原子易发生动态诱导极化。 溴与苯酚的反应在非极性的四氯化碳中十分缓慢,但 在极性的水或甲醇中很快进行:
这些取代基对反应部位产生的影响称为取代基效应 (substituent effect)。 诱导效应 电子效应 取代基效应 共轭效应
立体(位阻)效应
5.1 共价键的极性与诱导效应 由于成键两原子电负性的不同,而引起共价电子对 偏离的现象称为诱导效应(induction effect)。 例如,丁烷分子被转化成1-氯丁烷后,与氯原子较 接近的碳原子将带有部分正电荷。
C -I效应
X
C
H
C +I效应
Y
比较标准
例如:
Br Si(C H3)3
常见取代基的电负性大小次序为: —F > —Cl > —Br > —OCH3 > —NHCOCH3 > —C6H5 > —CH=CH2 > —H > —CH3 > —C2H5 > —CH(CH3)2 > —C(CH3)3
高等有机化学教案1取代基效应

通过引入特定的取代基,可以改变 有机分子的物理性质,如溶解度、 熔点、沸点等,从而满足不同的应 用需求。
02 取代基对分子构型影响
取代基对键长、键角影响
取代基电负性
取代基的电负性会影响相邻碳原子的电子云密度,从而改变键 长和键角。例如,电负性较大的取代基(如-F)会使相邻碳原 子的电子云密度降低,键长变短,键角变小。
应速率。具有共轭效应的取代基可以与反应中间体形成共轭体系,从而
稳定中间体并促进反应的进行。
04 取代基对光谱性质影响
取代基对紫外-可见光谱影响
取代基的电子效应
取代基通过诱导效应、共轭效应等改变分子的电子云分布,从而影响紫外-可见光谱的吸 收波长和强度。
取代基的空间效应
取代基的空间位阻和构象变化也会影响紫外-可见光谱的吸收,例如邻位取代基可能导致 分子内氢键的形成,进而影响光谱性质。
取代基对立体化学的影响
探讨取代基如何通过空间位阻和电子效应来影响反应的立体选择性, 如顺反异构化、区域选择性等。
实验注意事项及改进建议
实验安全注意事项
强调实验过程中应注意的安全事项,如避免使用过量试剂、注意加 热温度和时间控制等。
实验操作规范
提醒学生注意实验操作规范,如准确称量、充分搅拌、正确使用仪 器等。
01取代基的ຫໍສະໝຸດ 子效应在周环反应中,取代基的电子效应可以影响反应中间体的稳定性和反应
速率。给电子取代基可以稳定负离子中间体,有利于周环反应的进行。
02
取代基的空间效应
取代基的空间大小也会影响周环反应的进行。大的取代基可能会阻碍反
应中间体的生成或转化,导致反应速率降低。
03
取代基的共轭效应
在周环反应中,取代基可以通过共轭效应影响反应中间体的稳定性和反
取代基效应

常见吸电子基团(-I):
-+NR3,-+SR2,-+NH3,-NO2,-SO2R,-CN, -COOH,-OAr,-CO2R , -COR,-OH, -C≡CR,-Ar,-CH=CR2等。
-I:-NO2 >-N+(CH3)3 >-CN >-F >-Cl >-Br >-I >-OH
常见给电子基团:烷基,烷氧基,O-,-COO(+I):-C(CH3)3 > -CH2CH3 > -CH3
当烷基连在杂化的碳原子或带正电荷的氮或氧原子上, 表现为给电子基。
如:CH3→CH=CH2 ; CH3→C6H5; CH3→C≡CH 在多数情况下,烷基可看作给电子基。
5. 静态诱导效应和动态诱导效应
(1)静态诱导效应(static inductive effect): 没有外来因素影响时,因分子中原子或原子团电
经过三个原子之后,诱导效应已很微弱,超过五个原 子便没有了。如:
以α、β、γ-氯代丁酸和丁酸为例
•
K×104
• α-氯代丁酸
14.0
• β-氯代丁酸
0.89
• γ-氯代丁酸
0.26
• 丁酸
0.155
• 氯原子距羧基越远,诱导效应作用越弱。氯原子的 诱导效应大致按公比1/3的等比级数急速减小。
诱导效应的加和性
丙烯加卤化氢则按反马氏规则的方向加成。 Cl3C←CH=CH2 + HCl Cl3—CH2—CH2Cl
(2)在苯环的定位效应中,+N(CH3)3具有强烈的-I效 应,所以是很强的间位定位基,在苯环亲电取代 反应中主要得到间位产物,而且使亲电取代比苯 难于进行。
7.2 对反应机理的影响 在一些反应中,由于诱导效应等因素可以改变其反
取代基效应对有机物酸碱性的影响

取代基效应对化合物酸碱性的影响摘要:取代基效应是有机结构理论的重要组成部分并且对化合物物理性质和化学性质有着重大的影响,本文通过取代羧酸的酸性比较以及胺类物质的碱性比较来阐述取代基效应在化合物酸碱性方面的影响。
关键词:诱导效应、共轭效应、空间效应、邻位效应、溶剂化作用取代基效应对有机化合物酸碱性的影响归纳起来有两个方面:(1)电子效应,包括诱导效应、共轭效应和场效应。
电子效应是通过影响电子云的分布,改变分子失去质子和得到质子的能力,从而影响有机物酸碱性(2)空间效应,是由于取代基的大小或形状引起分子中特殊的张力或阻力的一种效应,空间拥挤程度在一定方面影响了结合质子的能力。
下面就以取代羧酸和胺类物质中的几个经典案例来剖析一下取代基效应的影响。
(一)取代羧酸的酸性比较酸性大小简单来说就是化合物给出质子的能力,越容易离解出质子酸性就越强。
先来比较几个脂肪取代羧酸的酸性:查pKa表可知运用电子效应的理论来解释就是:主要受诱导效应的影响,烃基为给电子基团,羟基和氯原子为强烈的吸电子基团,其中氯的吸电子能力比羟基更强;烃基的给电子作用使得羧基上的质子不易离去因此酸性最弱,而羟基和氯原子的吸电子作用将羧基上的电子“拉扯”过来,使得质子容易离去,其中氯原子的“拉扯”能力更强因此酸性更强。
同时,诱导效应沿着碳链传递越远作用越弱,所以邻取代的羟基酸酸性更强再来比较几个芳香取代羧酸的酸性:相应的解释则是:硝基连在苯环上具有强烈的吸电子作用,对苯环的邻对位具有吸电子的诱导效应以及吸电子的共轭效应,对苯环间位只有吸电子的诱导效应;而氨基与羟基连在苯环邻对位上具有吸电子的诱导效应以及供电子的共轭效应,其中以共轭效应为主,并且氨基的供电子效应更强(因为氧的电负性比氮更加强,吸附电子的能力更强)。
当羧基连到苯环上时,硝基吸电子作用使得羧基的质子更易离解,氨基和羟基的供电子作用使得羧基的质子不易离解,因此硝基苯甲酸强于氨基苯甲酸强于羟基苯甲酸。
取代基效应

• 4.2 电子的离域与共轭效应 • 乙烯与1,3-丁二烯: • 后者的两个π键以单键相连接后,一个 经典π轨道中的电子就会运动到另一个经 典的π轨道中去(电子的离域 H delocalization) H
H H H H H 乙烯 H H H 1,3-丁二烯
• 这种离域作用使得分子内的π电子不再局限在两 个碳原子之间,从而使分子内的电子云密度发生 变化,这种效应称为共轭效应(conjugated effect)。 • 共轭效应的最重要特点是π电子云沿共轭体系传 递时不受距离的限制。 • 共轭效应的表现在:1)单双键交替部分的键长 均匀化,即C-C键键长缩短,C=C键键长增加; • 2)形成C=C键的各个碳原子趋于共平面; • 3)分子体系的能量降低,趋于稳定化; • 4)表现出特殊的化学反应行为。
• 键:键能大,受原子核的束缚很强,与缺电子的亲 电试剂接近并发生化学反应的难度较大。 • 键:键能较小, 电子对称分布于原子核组成的分 子平面的上下两侧,受原子核的束缚相对要弱, 较易与缺电子的亲电试剂接近并发生化学反应。 • 当某键与其它键或与含有p电子对的原子或原子 团相连接时,这些(或p)轨道因处于平行状态, (或p)电子就有机会离域到其它原子上,引起 分子体系内每个原子周围的电子云密度发生变化, 导致有机分子的化学性质的变化。
什么是 -C,+C
-CHO有-C效应
Cl H2 C C H
· · -Cl有+C效应
基团共轭效应是吸电子的叫-C;是供电子+C。
基团可分为:吸电子基或供电子基
• 举例: CH3-CH=CH CH3- 供电子基 存在σ-π超共轭 σ-π,σ-p 供电子+C效应
O
• 举例: CH2=CH-C-H C=O 吸电子基 存在π -π共轭 π -π共轭中氧电负性大 吸电子-C效应 共轭体系中电子云分布极性交错,而且不因 碳链增长减弱—共轭体系的特点。 • 举例: +CH2-CH=CH2 存在p-π共轭 电子云分布 δ+CH —δ-CH—δ+CH 2 2 极性交错
有机化学第五章

立体效应对分子本身结构的影响 官能团之间在空间上的相互排挤使得分子所处状态的能 量水平升高,基态分子为了保持能量最低的状态,总设法使 这种排挤作用降低到最小,结果会使分子内特定共价键的键 角或键长发生变化。
H H COOH H3C H2N COOH
H H
立体效应对分子反应活性的影响 化学反应一般通过分子间的相互有效碰撞才能发生,即 分子只有在空间上相互接近到能形成共价键的距离,才能进 行有效的共价结合。因此一种分子的反应中心原子在接近另 一分子的反应中心原子时,如果遇到来自两个分子中其它基 团很大的空间排挤,那么两者间发生化学反应的难度明显增 大。
Ka Ka
[H ] [CH CO ] = 1.7 × 10 =
+ −
[H ][OH ] = 1.8 × 10 =
+ −
[CH3CO2H]
[H2O]
3
2
−5
pKa = 4.5 pKa = 15.7
−16
可见CH3CO2H给出质子的能力强于H2O,则CH3CO2H的酸 性比H2O大。
共轭酸碱对在水溶液中的解离常数具有以下关系: KaKb = Kw 或 pKa + pKb = pKw 式中Ka、Kb、Kw分别为酸、碱和水的解离常数,由此可见, 酸越强,其对应的共轭碱越弱,反之亦然。 化合物 pKa 酸性 共轭碱碱性 CH3CO2H 4.5 CH3CO2H CH3CO2– > < H2O 15.7 H2O OH– > < CH3CH2OH 15.9 CH3CH2OH CH3CH2O–
Lewis酸碱理论—酸碱电子理论 “凡是能接受电子对的物质(分子、离子或原子)为酸;凡是 能给出电子对的物质(分子、离子或原子)为碱。”即酸是电子对 接受体,碱是电子对的给予体, 而酸碱反应则是酸碱共享电子 对的作用。 局限性:(1)某些氧化还原反应 (如NaH+HCl=NaCl+H2) 也 可以被认为是酸碱中和反应。 (2)不易定量,所以对医学专业来说,主要关注传 统酸碱理论以及Brönsted酸碱理论。
有机化学中的取代基效应

有机化学中的取代基效应在绪论中,我们提到了有机化合物可以按分子内的官能团进行分类。
官能团的性质在较大程度上决定了这类化合物的理化性质。
例如,羟基化合物一般都可以电离出质子,显示出酸性。
醇类化合物一般属于弱酸性物质,其酸性比水还弱。
酚类化合物的酸性则比水的明显要强,羧酸的酸性更强,属于中等强度的酸。
磺酸是一类酸性与硫酸相当的强酸。
几个代表性羟基化合物的pKa如下所示:羟基化合物(CH3)3COH CH3OH H2O C6H5OH CH3COOH CF3COOH C6H5SO3H pKa 18 17 15.74 9.99 4.76 0.23 -6.5很显然,不同类型的羟基化合物所呈现的酸性强度存在巨大的差别。
那么,究竟是何种因素导致酸性的这种巨大差异呢?第一章中已经述及,一种物质的酸性强弱取决于其电离出质子的能力大小,而质子的电离能力又取决于O–H键的键能和极性大小。
因此,上述pKa 值的差异说明,与羟基氧原子相连的基团的性质对O–H键的键能和极性产生了很大的影响。
为了更好地了解这些基团的影响,本章将系统地对这些基团影响官能团性质的方式进行介绍。
第一节共价键的极性与诱导效应有机化合物的基本结构是由碳氢所组成的。
由于碳原子和氢原子的电负性非常接近,分别为2.2和2.1,它们形成共价键时,成键的共用电子对在碳原子和氢原子核外出现的几率十分接近,这种共价键的极性很低,称为非极性共价键。
除了C–H键以外,常见的非极性共价键还包括C–C、C=C和C≡C键等。
形成共价键的两个原子若电负性差别较大,那么成键电子对出现在电负性大的原子核周围的几率会大于出现在电负性小的原子核周围的几率,这样就使得该共价键呈现极性。
常见的极性共价键包括C–X(碳卤键)、C–O、C=O、C–N、O–H、N–H、C=N、C≡N、N=O等。
一、诱导效应的定义共价键极性的产生会进一步影响分子内其它原子核周围的电子云密度分布情况。
以正丙烷分子为例,它属于非极性分子,其分子内各碳原子周围的电子云密度基本相同。
取代基电子效应

C+ HC3H 83-98% 2-17%
CH 3CH 2CH 2CH 2CH 2CH 2 C+ HC3H
34% 66%
❖ 结论:SN1历程通过生成碳正离子进行取代反 应时,在发生消旋化的同时,通常还伴随着 部分构型转化
2021/4/22
32
C 重排
CH3
CH3
CH3 C CH2Br CH3
CS2HN15O-CH3
少量 少量
约8% 约70%
NH COCH 3 NO 2
2021/4/22
11
(2)改变反应历程。
O
SO3H 磺化
O
O
O SO3H
磺化
HgSO4催化
O
O
2021/4/22
12
2.2.4.5 已有两个取代基的定位规律
❖ 已有两个取代基为同一 类型定位基,且处于间 位,则定位作用一致。
CH3
少量
CH3
取代基类型
邻、对位定 位基
间位定位基
2021/4/22
2
两类定位基: ❖ 邻、对位定位基(第一类定位基):
-O-,-N(CH3)2,-NH2,-OH,-OCH3,-NHCOCH3,-OCOCH3, -F,-Cl,-Br,-I,-CH3,-CH2Cl,-CH2COOH,-CH2F等。
❖ 间位定位基(第二类定位基):
2.2.1 反应历程 2.2.2 反应特点 2.2.3 反应的影响因素
2021/4/22
23
2.3.1 反应历程
❖ 双分子历程(SN2)
RCH 2B r +O HV=K [RCH 2B r][O H-] V=水 解 速 度
K=水 解 常 数
高等有机化学 取代基效应自PPT课件
4、诱导效应强弱
诱导效应的相对强度:取决于取代基的中心原子 的电
负性 (Electronegativeties)
比氢原子相对电负性愈大,则-I效应愈强, 比氢原子相对电负性愈小,则+I效应愈强。
第12页/共94页
(1)与碳原子直接相连的原子
➢同周期的元素自左到右电负性增大,-I 增强:
第16页/共94页
例如:以乙酸为参考酸,具有X—CH2COOH通式, 由
于取代X基诱导效应pk的a 方向和X 强度不同,其pk酸a 性强弱不
同一NO2
1.68
一+N(CH3)3 1.83
一I —OH
3.12 3.83
一CN
2.46 —H
4.76
—F
2.66 —CH
4.88
—C1
2.86 一C(CH3)3 5.05
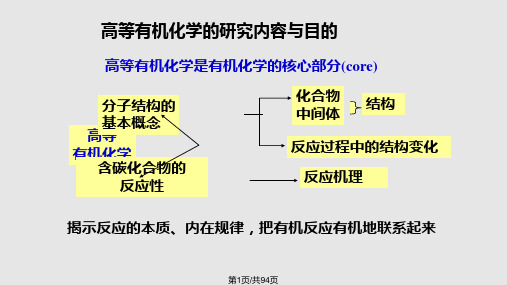
高等有机化学的研究内容与目的
高等有机化学是有机化学的核心部分(core)
分子结构的 基本概念 高等 有机化学 含碳化合物的
反应性
化合物 中间体
结构
反应过程中的结构变化
反应机理
揭示反应的本质、内在规律,把有机反应有机地联系起来
第1页/共94页
目录
第一章 取代基效应 第二章 有机反应活性中间体 第三章 饱和碳原子上的亲核取代反应 第四章 芳环上的取代反应 第五章 碳碳重键的加成反应 第六章 碳杂重键的加成反应 第七章 消除反应
但卤代烷的亲核取代反应活性却恰恰相反,实际其相 对活
性为: R—I>R—Br>R—C1 > C—F
原因:是动态诱导效应的影响。因为在同族元素中, 随原
子序数的增大电负性降低,其电子云受到核的约束也 第35页/共94页
学习有机化学应注意掌握取代基效应

大学化学第18卷第6期2003年12月师生笔谈学习有机化学应注意掌握取代基效应高志农(武汉大学化学与分子科学学院武汉430072)摘要有机化学中的取代基效应涉及化合物的物理性质、酸碱性、反应活性以及反应的位置、类型、速度、平衡、产物等。
在熟知官能团一般特性的基础上,利用取代基效应可将各系列有机化合物千差万别的物理、化学性质有机地联系在一起,易于学习和掌握。
有机化学的初学者常会面对数量巨大、种类繁多的有机化合物以及复杂多样的化学反应而不知所措。
在有机化学教学中,教师经常被问到的问题是:有什么窍门能既快捷、有效地掌握有机化学的内容,而又不必死记硬背大量的性质和反应?对于这样的提问,我总会提请学生注意掌握取代基效应。
而学生经过一段时间的摸索与体会,都会认同取代基效应在有机化学中的重要地位和在学习有机化学中不可替代的作用。
1取代基效应及其重要影响取代基效应是分子中某些基团或原子所引起的电子效应和空间效应的总称。
多原子分子中一个键产生的极性将影响到分子的其余部分,电子的转移可以静电诱导方式沿分子链或空间传递,也可在共轭体系中由轨道离域或电子离域产生,前者称为电子的诱导效应,后者为共轭效应。
空间效应在有机化学中相当普遍,当分子内的原子或基团处于范德华半径不许可的范围时产生的排斥作用,或两个分子相互接近时由于基团之间的非键作用所引起的化学效应,都是空间效应的具体表现。
虽然有机化合物的性质主要取决于所含的官能团,但取代基效应会使官能团的性质发生很大变化。
如含有)COOH的化合物虽都有酸性,可成盐、酯化等,但不同结构的羧酸,其酸性不同甚至可以相差很远,化学性质也千差万别。
在极端情况下,取代效应甚至能完全改变原有官能团的性质,例如醇是中性的,但CF3CH2OH显酸性,而且其酸性较强,可以从Na2CO3中置换出CO2。
取代基效应的影响涉及到有机化学的很多方面,包括有机化合物的物理性质、酸碱性、反应活性,有机反应的类型、速度、平衡、位置及产物等,在教材中常用来解释芳香烃亲电取代反应的定位效应及活化、钝化,烯烃与卤化氢加成的反应速度与方向,卤代烃亲核取代反应和羰基亲核加成反应速度等;有些化学家甚至建立了有机化合物的取代基与性质之间的定量关系,如H ammett方程等。
揭示了 取代基效应

揭示了取代基效应
基效应是有机化学中一个重要的概念,它表示在一个有机分子中,官能团或原子的相对位置对反应速率或产物构成的影响。
而取代基效应是基效应中的一种特殊形式,即取代基对反应的速率或产物构成产生的影响。
具体来说,取代基效应可以表现在以下三个方面:
第一,阻碍效应。
取代基的引入可能导致阻碍效应,即原子团或官能团所在的位置阻碍了化学反应,从而降低反应速率。
第二,共轭加效应。
一些取代基能够增强有机分子的电子共轭性,使得分子更加稳定,反应速率也会更快。
第三,取代基的选择性。
不同的取代基对反应的选择性也有影响,从而影响产物的构成。
但是除了这些影响外,取代基还可能对分子的构象造成影响。
因为取代基会影响分子中化学键的角度,使得分子的构象发生改变。
而这种构象的改变可能会影响反应的展开情况,从而影响反应速率和产物的构成。
近年来,随着化学实验技术和理论手段的不断发展,取代基效应的具体机理正逐渐被揭示。
而这些机理的揭示不仅有助于更好地理解有机反应的本质,还可以为理性设计和合成新型有机分子提供参考。
总的来说,取代基效应在有机化学中具有广泛的应用和重要的意义。
对其深入研究可以为化学界的发展带来新的思路和方向。
第1章取代基效应.ppt

+B r
S 2 N
O H
C H 3 H CCC H 3 3 B r
H C 3 C H 3 C H 3
O H
C H 3 H CCC H 3 3 O H
S 1 N
3、 对反应速率的影响(快慢)
下列羰基化合物发生亲核加成的活性顺序为:
静态诱导效应 (Is) : 存在于未发生反应的分 子中的诱导效应(电负性决定) 诱导效应的传导 沿分子链迅速减弱 ,经过三 个原子之后,诱导效应已 很微弱 ,超过五个 原子便可忽略。 Ka×104 α-氯代丁酸 14.0 β-氯代丁酸 0.89 γ-氯代丁酸 0.26 丁酸 0.155
CO2H Cl Cl CO2H Cl CO2H CO2H
1.1.3关于烷基的诱导效应问题
C H 3 C H 3 C H 3 C H C H 3 C H 3 C H 3 C D
μ=0.132D μ=0.141D (已知氘比氢供电性略强)
C H 3 C H 2 C H 3
C H 3
C D 2
C D 2 C H 2 C D 2
μ=0.085D μ=0.095D
2、同周期元素的原子及其所形成的基团 在同一周期中,随着原子序数的增加, 元素的电负性增大,对电子的约束性增 大,因此极化性变小,故动态诱导效应 随原子序数的增加而降低。
Id:- CR3 > -NR2 > -OR > -F
1.1.5诱导效应对反应的影响
1、对反应方向的影响
H C 3 + H C l C l C 3 H 2 C l C H 3 C C 2 H H C C H C 3 3 C l H C C C H 3 3 H C l H 2 C l C H CC 3 2
取代基效应对有机化合物性质的影响

取代基效应对有机化合物性质的影响摘要:取代基效应是有机结构理论的重要组成部分。
取代基效应对有机化合物的物理性质,化学性质和反应活性等都有着重要影响,了解有机化学中的取代基效应及其在有机化学中的作用方式,对于学习有机化学及应用有机化学知识都至关重要。
关键词:取代基理论有机化合物取代基效应对有机分子性质的影响是多方面的,归纳起来,可以分为两个方面:(1)电子效应,包括诱导效应,共轭效应和场效应。
电子效应是通过影响分子中电子云的分布来影响分子的性质。
(2)空间效应,是由于取代基的大小或形状引起分子中特殊的张力或阻力的一种效应。
空间效应是通过几何结构来影响化合物分子的性质的。
1 取代基效应对有机化合物物理性质的影响1.1 取代基对有机化合物酸碱性的影响一般来讲,负诱导效应(原子或原子团吸引电子的能力大于氢原子,通常用-I表示)将增强化合物的酸性,而正诱导效应(原子或原子团吸电子能力小于氢原子,通常用+I表示)将增强化合物的碱性。
-I:CN>F>Cl>Br>I>CH3O>C6H5>CH2=CH>H+I:(CH3)3C->CH3CH2->-CH3>H如:CCl3COOH,CHCl2COOH,CH2ClCOOH和CH3COOH的pKa分别为0.08,1.29,2.31和4.76。
而HCOOH,CH3COOH,CH(CH3)2COOH和(CH3)3CCOOH的pKa则为3.74,4.76,4.92和4.97。
从共轭效应的影响来看,一般∏-∏共轭,p-∏共轭能增强化合物的酸性,而减小了化合物的碱性强度。
如苯酚由于存在p-∏共轭,而增大了O-H键的极性具有一定的酸性,比普通醇的酸性强。
三硝基苯酚由于具有共轭效应和诱导效应的协同作用,所以具有强酸性,其酸度接近于无机的强酸。
烯醇式的1,3-二酮也因为p-∏共轭而具有微弱的酸性。
再如羧酸中存在电负性大的取代基时,其酸性增强,因为吸电子作用对羧基负离子有一定稳定作用,从而促进了羧基的电离。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
δ
Y
CR3 H
CR3 X
CR3
方向: 吸电子诱导效应:-I;给电子诱导效应:+I
一、诱导效应的涵义和特征
特点: 1. 起源于电负性差别;
2.一种静电作用,在键链中传递只涉及到电 子云密度分布的改变,即主要是键的极性 的改变,且极性变化一般是单一方向的;
3.传递有一定距离,经过三个碳原子以后, 已极微弱(短程)
在有机物分子中,由于电负性不同的取代基的影 响沿着键链(单链或重键链)传递,致使分子中 的电子云密度,按取代基相对于氢的电负性强弱 所决定的方向而偏移的效应,叫诱导效应(I)。
δ-
δ+
δδ+
δδδ+
X
A
B
C
一、诱导效应的涵义和特征
诱导效应( inductive effect,I)
+I
标准
-I
δ
δ
δ
一、诱导效应的涵义和特征
若α-H被吸电子基(如-Cl)取代后,羧酸的酸性增强。
诱导效应具有加合性。
吸电子基距-COOH越远,对RCOOH的酸性影响越小。
诱导效应是短程的。
1-1 诱导效应(Inductive effect) 二、诱导效应的相对强度
(一)确定方法 1.通过测定取代酸、碱离解常数确定
诱导效应 (σ, π) 共轭效应 ( π-π, p-π) 超共轭效应 (σ- π,σ- p)
场效应 (空间传递)
空间效应 (位阻效应)
有机物因取代基不同而对分子性质产生的影响
称为取代基效应。归纳起来,取代基效应可以分为 两大类。一类是电子效应,包括场效应和诱导效应、 共轭效应。另一类是空间效应。
1-1 诱导效应(Inductive effect) 一、诱导效应的涵义和特征
(二)影响诱导效应相对强度的有关因素
3.饱和程度 与碳原子相连的原子,若是同种原子但饱和程
度不同,则不饱和程度高的吸电子能力强。 –I效应:
-C≡CR > -CR=CR2 > -CR2-CR3 =O > -OR ≡N > =NR > -NR2
(电负性:CSP > CSP2 > CSP3)
键的偶极矩比较:C-O, 2.87D; C=O, 8.0D
①-I:-NO2 >-N(CH3)2 >-CN >-F >-Cl >-Br >-I >-OH
②+I: -C(CH3)3 > -CH2CH3 > -CH3
二、诱导效应的相对强度
2.通过分析NMR化学位移确定
化学位移δ大,电子云密度低,取代基-I强。 * 电子密度大,屏蔽大,需要的外加磁场H高,即δ小;
而带负电荷的基团比同类型的不带电荷的基团给电子能 力强得多。
eg. -I效应:-NR3+ > -NR2 +I效应:-O- >- OR
同类基团电荷的变化可改变诱导效应的方向或强度。
COOH CH2
COOH
eg.
, -COOH为另一-COOH的吸电子基;
电离后,变成-COO-,对另一羧基而言为给电子基。
电子密度小,屏蔽小,需要的外加磁场H低磁场强度H(↗)
二、诱导效应的相对强度
a
ab CH3CH2Br
b
吸收强度
6
5
4
3
2
化学位移
1
0
二、诱导效应的相对强度
卤代烃的1H-NMR δ值:
1H-NMR
CH3-F CH3-Cl CH3-Br CH3-I CH3-H
δ 4.3 3.2
(CH3)3COH > (CH3)2CHOH > CH3CH2OH > CH3OH > HOH
三、烷基的诱导效应
2. 烷基与不饱和碳相连,仍存在吸电子诱导效应, 但此时存在σ-π超共轭效应(给电子的),且共 轭效应大于诱导效应,总体表现为给电子基效应。
2.2
2.2 0.23
CHCl3 CHCl2 CH3Cl
δ 7.3 5.3
3.1
诱导效应具有加合性。
二、诱导效应的相对强度
3.通过测定偶极矩确定(偶极矩u/10-30(c.m) 根据同一个烃上用不同的基团取代所得不同化合
物的偶极矩,可计算出基团在分子中的诱导效应,从 而排出各基团的诱导效应强度次序。
1.周期律 同周期中,-I效应自左至右增加。 eg. -I: -CR3 < -NR2 < -OR < -F 在同一族中,-I效应自上而下降低。 eg. -I: -F > -Cl > -Br > -I;
-OR > -SR
(二)影响诱导效应相对强度的有关因素
2.电荷
带正电荷的基团比同类型的不带电荷的基团吸电子能力 强得多;
C的氧化数
0
1H-NMR δ
-1
-2
1.90
1.37
C H3 HC H
H
-3
0.86
H HC H
H
-4
0.23
三、烷基的诱导效应
烷基的电负性:
H -CH3 -CH2CH3 -CH(CH3)2 -C(CH3)3
电负性: 2.1 2.2 2.21
2.24
2.26
脂肪醇在气相中的相对酸性顺序与溶液中相反:
第1章 取代基效应
教学目的和要求: 1.掌握电子效应(诱导、共轭、超共轭)的基
本概念(定义、方向、强弱、传导); 2.掌握电子效应和空间效应对性能的影响; 3.了解场效应的概念及其对化合物性能的响; 4、学会用电子效应和空间效应解释和预测有机
反应。
课时安排:3~4h
第1章 取代基效应
电子效应 取代基效应
优选取代基效应
Advanced org. chem.
内容提要: 1-2 共轭效应(Conjugative effect)
一、共轭体系的分类 二、共轭效应的涵义和特征 三、共轭效应的相对强度 四、动态共轭效应 五、共轭效应与反应性
1-3 空间效应 (Steric effect) 1-4 取代基效应应用实例
三、烷基的诱导效应
目前认为烷基的诱导效应方向取决于与什么样的基 团相连。如果与电负性比它小的基团相连,则表现 出-I,如果与电负性比它大的基团相连,则表现 出+I。
1.烷基与饱和碳原子相连,诱导效应为吸电子基。
H3C
C H3 C CH3 C H3
H3C
C H3 C CH3 H
H3C
C H3 CH H
甲烷的一取代物的偶极矩
取代基 μ(D)(在气态) 取代基 μ(D)(在气态)
—CN
3.94
—Cl
1.86
—NO2 —F
3.54
—Br
1.78
1.81
—I
1.64
可以看出这些基团的负诱导效应(-I)的顺序为: CN > NO2 > Cl > F > Br > I > H
二、诱导效应的相对强度
(二)影响诱导效应相对强度的有关因素 (取决于电负性大小)
