三招破解化学平衡图像题
4高考考点点点过2.正确解答化学平衡图像 含解析

【考向分析】化学平衡是中学化学重要基础理论之一,在生活、工业生产中都有涉及,在高中化学中占有重要地位。
化学平衡是中学化学所涉及的沉淀溶解平衡、电离平衡、等知识的核心,对很多知识的学习起着指导作用.化学平衡是高考历年来必考点之一,对于平衡图像的考察特别能体现理科素养,因此平衡图像提成为高考青睐的题型之一.图像和图表分析能力是高中化学重点考查的能力之一,从近几年的高考试题看,化学反应速率、化学平衡的图像和图表题属于高频考点,要求能够分析图像、图表,结合化学平衡移动原理答题。
反应速率与化学平衡图像题有如下几种类型:分析外界条件对反应速率及化学平衡的影响、由图像判断反应特征(确定反应中各物质的化学计量数、判断热效应或气体物质化学计量数的变化关系)、由反应和图像判断图像中坐标或曲线的物理意义、由反应和图像判断符合图像变化的外界条件、由反应判断图像正误等。
【考点归纳】1.速率-温度(压强)图象:对于N2(g)+3H2(g)2NH3(g)ΔH =-92。
4 kJ·mol-1,曲线的意义是外界条件(如温度、压强等)对正、逆反应速率影响的变化趋势及变化幅度。
图中交点是平衡状态,温度升高后逆反应速率增大得快,平衡逆向移动;压强增大后正反应速率增大得快,平衡正向移动。
2。
百分含量(或转化率)—时间—温度(压强)图象:已知不同温度或压强下,反应物的转化率α(或百分含量)与时间的关系曲线,推断温度的高低及反应的热效应或压强的大小及气体物质间的化学计量数的关系。
以A(g)+B(g)C(g)中反应物的转化率αA 为例,分析反应由开始(起始物质相同时)达到平衡所用时间的长短可推知反应条件的变化.①若为温度变化引起,温度较高时,反应达平衡所需时间短。
如甲中T2>T1。
②若为压强变化引起,压强较大时,反应达平衡所需时间短.如乙中p1>p2。
③若为是否使用催化剂,使用适宜催化剂时,反应达平衡所需时间短。
如图丙中a使用催化剂。
解化学平衡图像题的技巧演示文稿

P21
图 2-3-3-11
A.图Ⅰ、Ⅱ和Ⅲ均使用了催化剂
B.图Ⅰ中甲最快到达平衡
答案:D
C.图Ⅱ研究的是温度对反应的影响,且甲的温度 较低
D.图Ⅲ中甲使用的催化剂效率最高
练习本P18:化学平衡图像分析
一、单项选择题
3.用来表示可逆反应2A(g)+B(g)
D +Q(Q>0)的正确图像为( )
2C(g)
【配对训练】
2.下图中,表示 2A(g)+B(g) 应)这个可逆反应的正确图像为( )
2C(g)(正反应为放热反
答案:A
3.某课题小组研究固定容积下反应 A(g)+2B(g) C(g); ΔH<0,在其他条件不变的情况下,改变某一条件,记录数据 并绘出图 2-3-3-11,下列说法正确的是(
资料
)
在一定温度下的一密闭容器内达到平衡后,t0时 改变某一外界条件,化学反应速率(v)与时间(t)
关系如图。下列说法一定正确的是( A.t0时加入了催化剂
)
C
B.t0时减小了容器的体积
C.t0时升高了温度
D.t0时向容器(容积不变) 中再通入一定量的Z
7.可逆反应mA(g) nB(g)+pC(s)+Q,温 度和压强的变化对正逆反应速率的影响分别符 合图中的两个图像。以下叙述正确的是( )
•对于反应A(g)+3B(g) 2C(g)+D(g)(正反应放 热)有如下图所示的变化,请分析引起平衡 移动的因素可能是什么?并说明理由。
v
v逆
由于v正、v逆均有不同程
v正
度的增大,引起平衡移动 的因素可能是 a.升高温度
衡移动t1 的因素t2 是 t
b.增大压。强此题中引起平 升高温度 。
化学平衡图像三招

[典例 4]
(2011· 安徽高考)电镀废液中 Cr2O2-可通过下列 7
反应转化成铬黄(PbCrO4):Cr2O2-(aq)+2Pb2+ (aq)+ 7 H2O(l) 2PbCrO4(s)+2H+ (aq) ΔH<0 该反应达平衡 )
后, 改变横坐标表示的反应条件, 下列示意图正确的是(
[答案]
[题型分类] (1)由图像判断反应的热效应或反应前后气体物质的量 的变化。。 (2)由反应和图像判断符合图象变化的外界条件 (3)由反应及图像判断图象中坐标或曲线的物理意义。
第一招:从“拐点”突破 同一可逆反应,当反应条件不同时,化学反应速率
不同,达到平衡时所用的时间不同,反映到图像上,就
出现了不同“拐点”。根据外界条件对化学反应速率的影 响,即可判断不同“拐点”对应温度的高低、压强或浓度 的大小以及是否使用催化剂。
[破解方法]
第二招:从“断点”突破
当可逆反应达到平衡后,若某一时刻外界条件发生 改变,如浓度、温度、压强或催化剂,都可以使速率— 时间图像的曲线出现不连续的情况,即出现“断点”。根 据“断点”前后速率的大小。即可对外界条件的变化情况
作出判断。
[典例2] 某温度下,密闭容器中SO2、O2、SO3三种气 体物质建立化学平衡后,改变条件对反应:2SO2(g)+ O2(g) 2SO3(g) ΔH<0的正、逆反应速率的影响如图 [答案] ①C ②A ③D ④B
所示:
①加催化剂对反应速率影响的图像是_______。
②升高温度对反应速率影响的图像是________。 ③增大反应容器体积对反应速率影响的图像是______。 ④增大O2的浓度对反应速率影响的图像是________。
练习2 向一体积不变的密闭容器中加入2 mol A、0.6 mol C 和一定量的B三种气体。一定条件下发生反应,各物质浓 度随时间变化如图一所示。图二为t2时刻后改变反应条件, 平衡体系中反应速率随时间变化的情况,且四个阶段都各 改变一种不同的条件。已知t3~t4阶段为使用催化剂;图一 中t0~t1阶段c(B)未画出。 下列说法不正确的是 ( ) A.此温度下该反应的化学方程式为2A(g)+B(g) 2C(g) B.t4~t5阶段改变的条件为减小压强 C.B的起始物质的量为1.0 mol D.在相同条件下,若起始时容器中加入a mol A、b mol B 和c mol C,要达到t1时刻同样的平衡,a、b、c要满足的 条件为a+2c/3=2.4和b+c/3=1.2
化学平衡图象解题方法

[例2] 下图表示可逆反应: A(g) + B(g) C(g),当增大压强时, 平衡由a点移动到b点,正确的曲线是( B )
[例3] 对于可逆反应 : A(g) + 2B(g) 2C(g);△H>0,下列图像 中正确的是( D )。
[例4] 如图曲线是在其他条件一定时,反应: 2NO2 N2O4 ;△H <O 中,NO2最大转化率与 温度的关系曲线。图上标有A、B、C、D、E 5点, 其中表示未达到平衡状态且ひ(正)>ひ(逆)的点 B 是( ) (A) A 或 E (B) C
t
2、可逆反应aA(g)+ bB(g) dD(g)+eE(g); 在一定条件下达平衡状态时,A的转化率与温 度、压强的关系如图所示。则在下列空格处 填写“大于”、“小于”或“等于”。 < > 。 (1)a+b_____e + d; (2) △H___0 A的转 化率 1.01x1023Pt 2.02x1023Pt 3.03x1023Pt T
[例6] 对于反应mA(g)+nB(g) qC(g)有如右 p1<p2 ; 图所示关系,则: p1与p2的关系___________
m+n与q的关系____________ m+n>q ;T1与T2的 T1>T2 ;(反应是吸热还是放热? 正反应为放热反应。
5、现有可逆反应A(气)+B(气) 3C(气),下图中甲、 乙、丙分别表示在不同的条件下,生成物C在反应混和 物中的百分含量(C%)和反应时间的关系: (1)若甲图中两条曲线分别表示有催化剂和无催化剂时的 a 曲线是表示有催化剂时的情况。 情况,则___ (2)若乙图中的a曲线表示200℃和b曲线表示100℃时的 情况,则此可逆反应的正反应是吸 _____热反应。 (3)若丙图中两条曲线分别表示不同压强下的情况,则 b 曲线是表示压强较大的情况。 ____
三步巧解化学平衡图像!

三步巧解化学平衡图像!
解答有关化学平衡的图象题时,
要抓好以下三步:
“一看”、“二想”、“三判断”。
(1)“一看”——看图像:
①看面:弄清纵、横坐标的含义。
②看线:弄清线的走向、变化趋势及线的陡与平。
③看点:弄清曲线上点的含义,特别是一些特殊点,如与坐标轴的交点、曲线的交点、折点、最高点与最低点等。
④看量的变化:弄清是浓度变化、温度变化还是转化率的变化。
⑤看要不要作辅助线:如等温线、等压线等。
(2)“二想”——想规律:
看清线后联想外界条件对化学反应速率和化学平衡的影响规律。
①浓度:增大某物质浓度,其对应反应速率突然增大;减小某物质浓度,其对应反应速率突然减小。
②压强:增大压强反应速率都突然增大,气体反应物分子数大者增大更多;减小压强反应速率都突然减小,气体反应物分子数大者减小更多。
③温度:升高温度反应速率都突然增大,吸热反应增大更多;降低温度反应速率都突然减小,吸热反应减小更多。
④催化剂:催化剂使正逆反应速率都突然增大,增大程度相等,平衡不移动。
(3)“三判断”:通过对比分析,作出正确判断。
化学平衡图像题的解题常用方法为
(1)“先拐先平”:在含量—时间曲线中,先出现拐点的则先达到平衡,说明该曲线表示的温度较高或压强较大。
(2)“定一议二”:图像中有三个量时,先确定一个量不变,再讨论另外两个量的关系。
你学会了吗?。
化学平衡图像解题方法

- 1 -【化学平衡图像解题方法】1.牢固掌握有关的概念与原理,尤其要注意外界条件的改变对一个可逆反应来讲,正逆反应速率如何变化,化学平衡如何移动,在速度-时间图、转化率-时间图、反应物的含量-浓度图等上如何体现。
要能够画出有关的变化图象。
2.对于化学反应速率的有关图象问题,可按以下的方法进行分析:(1)认清坐标系,搞清纵、横坐标所代表的意义,并与有关的原理挂钩。
(2)看清起点,分清反应物、生成物,浓度减小的是反应物,浓度增大的是生成物一般生成物多数以原点为起点。
(3)抓住变化趋势,分清正、逆反应,吸、放热反应。
升高温度时,v (吸)>v(放),在速率-时间图上,要注意看清曲线是连续的还是跳跃的,分清渐变和突变,大变和小变。
例如,升高温度,v(吸)大增,v(放)小增,增大反应物浓度,v(正)突变,v(逆)渐变。
(4)注意终点。
例如在浓度-时间图上,一定要看清终点时反应物的消耗量、生成物的增加量,并结合有关原理进行推理判断。
3.对于化学平衡的有关图象问题,可按以下的方法进行分析:(1)认清坐标系,搞清纵、横坐标所代表的意义,并与勒沙特列原理挂钩。
(2)紧扣可逆反应的特征,搞清正反应方向是吸热还是放热,体积增大还是减小、不变,有无固体、纯液体物质参加或生成等。
(3)看清速率的变化及变化量的大小,在条件与变化之间搭桥。
(4)看清起点、拐点、终点,看清曲线的变化趋势。
(5)先拐先平。
例如,在转化率-时间图上,先出现拐点的曲线先达到平衡,此时逆向推理可得该变化的温度高、浓度大、压强高。
(6)定一议二。
当图象中有三个量时,先确定一个量不变再讨论另外两个量的关系。
【强化训练】:1.如下图所示,反应:X (气)+3Y (气)2Z (气)+热量,在不同温度、不同压强(P 1>P 2)下,达到平衡时,混合气体中Z 的百分含量随温度变化的曲线应为( )2.对达到平衡的可逆反应X+Y W+Z ,增大压强则正、逆反应速度(v )的变化如下图,分析可知X ,Y ,Z ,W 的聚集状态可能是( )A .Z ,W 为气体,X ,Y 中之一为气体B .Z ,W 中之一为气体,X ,Y 为非气体C .X ,Y ,Z 皆为气体,W 为非气体D .X ,Y 为气体,Z ,W 中之一为气体3.反应mA(固)+nB(气) eC(气)+fD(气),反应过程中,当其它条件不变时,C 的百分含量(C%)与温度(T )和压强(P )的关系如下图,下列叙述正确的是( )A.达到平衡后,加入催化剂则C%增大 B .达到平衡后,若升温,平衡左移C .化学方程式中n>e+fD .达到平衡后,增加A 的量有利于平衡向右移动4.反应aA(g)+bB(g) cC(g);△H=-Q ,生成物C 的质量分数与压强P 和温度的关系如下图,方程式中的系数和Q 值符合图象的是( )A .a+b<c Q>0 B.a+b>c Q<0 C.a+b<c Q<0 D.a+b=c Q>05.某可逆反应L (s )+G(g) 3R(g); △H>0,右图表示外界条件温度、压强的变化对上述反应的影响。
化学平衡图像解题方法

500 C
o
t
0
700 C
o
C%
(A)
0
v
P
V
正
逆
V
(B)
0
T
v
V
正
逆
V
(C)
0
P
10 C
o
100 C
o
A
转
化
率
(D)
1.下图表示外界条件(温度、压强)的变化对下列反应的影响,图中Y轴是指 A(s) + B(g) 2C(g) A. 平衡混合气体中C的体积分数 B. 平衡混合气体中B的体积分数 C. B的转化率 D. A的转化率
2.右图表示800 ℃时,A、B、C三种气体在密闭容器中反应时各物质浓度随时间变化的情况,由图分析可得出的正确结论是: (1)前2min内A的平均消耗 的速率是_____________。 (2)反应的化学方程式是: _______________________ (3)8min后,若将容器的体 积缩小一半,c(A)将________ c(B)将________c(C)将_______ (填增大、减小、不变); 平衡将向________反应方向移动;达到新的平衡时混合气体的相对平均分子质量___________ , A的转化率_________。 (填增大、减小、不变)
B
t
0
B%
T2 P2
T1 P1
T1 P2
解题原则:定一议二
T1不变,P2>P1
P2不变,T1>T2
题型3:根据图像特征判断物质的状态和反应特征
例3:反应A2 + B2 2AB ,在不同温度和压强改变的条件下产物AB的生成情况如下图所示,a为500℃ ,b为300℃ 的情况,c为反应在300℃ 时,从时间t3开始向容器中加压的情况,则下列叙述正确的是( )
三招破解化学平衡图像题

三招破解化学平衡图像题三招破解化学平衡图像题反应速率和平衡图像是高考化学试题中的一种特殊题型,其特点是:图像是题目的主要组成部分,把所要考查的化学知识寓于图中曲线上,具有简明、直观、形象的特点。
当某些条件改变时,反应速率,浓度(或物质的量、百分含量、转化率等)可能发生变化,反映到图像上,相关的曲线就会出现渐变(曲线是连续的),或突变(曲线出现“断点”)。
因此,根据图像中曲线的变化趋势,结合条件对反应速率和平衡影响的规律,就可以作出正确判断。
2题型分类①由图像判断反应的热效应或反应前后气体物质的量的变化。
②由反应及图像判断图象中坐标或曲线的物理意义。
③由反应和图像判断符合图象变化的外界条件。
3破解方法3.1第一招:从“断点”突破当可逆反应达到平衡后,若某一时刻条件发生改变,如浓度、温度、压强或催化剂,都可以出现“断点”。
根据“断点”前后速率的大小。
即可对外界条件的变化做出判断。
例1某温度下,密闭容器中反应:2SO2(g)+O2(g)2SO3(g)ΔH<0达平衡后,改变条件对正、逆反应速率的影响如图所示:①加催化剂对反应速率影响的图像是___(填序号、下同)。
②升高温度对反应速率影响的图像是____。
③增大反应容器体积对反应速率影响的图像是___。
④增大O的浓度对反应速率影响的图像是___解析:图像A中“断点”前后,v′(正)和v′(逆)均增大,且v(逆)>v(正),表明平衡逆移,升温平衡逆移。
图像B中,“断点”前后,v′(正)增大,但v′(逆)是瞬间不变的。
且v′(正)>v′(逆),平衡正移。
增大O的浓度可使v′(正)瞬间变大,而v′(逆)瞬间不变,平衡正移。
图像C中,“断点”前后,v′(正)和v′(逆)同程度的增大,催化剂符合要求。
图象D中,“断点”前后,v′(正)和v′(逆)均减小,且v′(逆)>v′(正)平衡逆移,题目提供的反应中,减压,可使正、逆反应速率均减小,平衡逆移。
选修4第二章第三节化学平衡-解化学平衡图像题的技巧

解化学平衡图像题的技巧 解化学平衡图像题的技巧1.图像问题解Ifi 步佛 (1)三看两结合① ■面(即弄清纵坐标与横坐标的意义): ② 看埃(即弄消践的走向和变化趋势);③ 看点(即弄清起点、拐点、交点、终点的意 义); ④ 培合映目中反响方程式:⑤结合II 目中定II 图像中有关■的多少.(2) ■合理运用技巧:技巧二:定一议二。
泉野蜀藉褊布诚#先谖定-M技巧一:先拐先平,数值大(瑚干晰岫It 中) 对于反响 mA(g)+nB(g) = pC(g)+qD(g)稳固提高:L 在密闭容肴中途行以下反响:M (w )+N 值) R0 + 2L.此反响符合下画图像.以下钗述是 正确的选项是 (A) 正反响吸戡,L 是气体 (B) 正650. ▲是固体 (C) 正反响放舟.提气体 (D) 正反响枚际L 是圈体或液体答案:(O伊1:可逆反响mA(s) * nB(gl = c* tt€0)-n )w ・ sea 程中.当其它条件不变时.C 的百分含WC%)与温J —度(冲压或(0的美脚以下图:以下\// L钮述正确的选项是()L _____4达平衡后.参加供化制用C%最大<»时间B 、达平衡后,假设粗,平衡左8 C*C 、化学方麒中n>HfD 、达平衡后,驹A 的■有利于平衡r/—舶移动厂匕 答案:⑻1 时间A 、 参加催化剂B 、 增大Y 的浓度C 、 降低温度D 、 增大体系压强答案:(A 、D)技巧二:定一议二例2:由可逆反响测绘出图像K 岫时“、 纵坐标为生成物在平衡 混合物中的百分含量. 以下判断不正确的选项是A 、 反响物中一定有气体B 、 生成物中一定有气体C 、 正反响一定是放热反响D 、 正反响一定是吸热反响答案:(A 、C)3、如下图,反响:X(气)+3Y (气)=2Z (气): △H<0.在不同温度、不同压强(P|>p 2)下. 到达平衡时,混合气体中Z的百分含量话技巧一:先拐先平擞值大(多用千时间宙像申〉.备螭麹觥蠢籍器器雅鼎2、颇图所示,图中a 曲线表示X(g)+Y(g) = Z(g*W(g) (△,〔<())的反响过程.假设使a 曲线 变为b 曲线,可专项练习时回R% T r P.z%ioxi (rt>I00XlO'A稳固提高:4、可逆反响mA(s)+nB(g) =pC(g): AH<0,在一定温度下B 的百分含星与压强的关系如 图所示,那么以下判断正确的选项是A 、m+n<pB,B 、n>pX /C 、x 点的状态是F Z >V KD 、'点比y 点的反响速度慢1答案:(C 、D) Pl 压强典型图像(一):V ・t 图像体系中(正反响为放殡反区)下密是臬 州段反响W 与反幌岫眦美"・潴以下何成 (DttrT«tt4>nwHfifi 0〜tp q 〜q 、t 3^t 4、q 〜 ⑵t h tj. 5如体系中 分鞍什么条件发生了变化? 上升高温度,":使用俗化服 .诚小体系压强 (3) FWMWS 中.K 的ft**MKCA. 0〜"R. ”〜tj答案:(A)5、以下图是在其它条件一定时,反响2N(M)"・2NO 2(AH>0)中NO 的最大转化率与湿度的关系曲线。
解析比较典型的化学平衡图像题

解析比较典型的化学平衡图像题张明芳(普兰店高级中学大连普兰店116200)【摘抄】化学反应速率化学平衡是高考中的重要考点,经常会以图像题的形式出现。
学生经常会觉得困惑,但是掌握技巧以后,拿分其实很容易。
【关键字】化学反应速率化学平衡图像化学反应速率化学平衡是高考中的重要考点,经常会以图像题的形式出现。
学生经常会觉得困惑,但是掌握技巧以后,拿分其实很容易。
以下是解决化学平衡图像题的技巧:1. 看轴:弄清横坐标和纵坐标的意义。
2. 看线:看线的走向和变化趋势3.看点:弄清图像上点的意义,特别是一些特殊点(如起点,交点、转折点、终点,零点的意义。
)4、看要不要做辅助线(等温线,等压线,平衡线)5、看量的变化(如浓度变化温度变化)6、想规律7、做判断,做答案比较典型题型如下:一.浓度(物质的量)-时间图1. 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如右图,下列表述中正确的是()A.反应的化学方程式为:2 M NB.t2时,正逆反应速率相等,达到平衡C.t3时,正反应速率大于逆反应速率D、t1时,N的浓度是M浓度的2倍解析:该图像最常见问题①写出化学反应方程式,应用知识点:化学反应速率之比等于计量数之比即可顺利求出,M从2 mol变成5 mol增加了3 mol是生成物,N从8 mol变成2 mol减小了6 mol是反应物所以为2 N M 还可以顺便求N的转化率,6∕8=0.75,转化率为75%此题选D二、速度-时间图像可用于判断:1) 已知反应判断引起平衡移动的因素.2)已知引起平衡移动的因素,判断反应是吸热或放热,反应前后气体体积的变化.第一种上课经常讲,我们在这里主要分析第二种,如下:2、对于达平衡的可逆反应X+Y W+Z,增大压强则正、逆反应速度(v)的变化如上图,分析可知X,Y,Z,W的聚集状态可能是()。
(A)Z,W为气体,X,Y中之一为气体(B)Z,W中之一为气体,X,Y为非气体(C)X,Y,Z皆为气体,W为非气体(D)X,Y为气体,Z,W为气体解析:此图像的特点是在加压的条件下正逆反应速率都加快,且正反应速率大于逆反应速率,即反应在加压条件下向正向移动了,说明正向是气体体积减小方向,符合要求的为C如果此题改为升温后为此图像,说明升温后平衡向正向移动,正向即为吸热反应。
化学平衡图像题的解法

反 v′ (正) 平衡态Ⅱ 应 v ( 正) 速 平衡态Ⅰ v (逆) ′ 率
v ( 逆)
0
反应时间
练习:反应N2(g)+3H2(g) 2NH3(g) △H<0 在某 一时间段中反应速率与反应过程的曲线关系如图,则图 中氨的百分含量最低的时间段是( D ) ,氨的百分含量 最高的时间段是( A ) A.t0-t1 B.t2-t3 C.t3-t4 D. t5-t6
压强:增压都增大,大者变更大,减压都减小,大者变更小 催化剂:一加一样大,平衡不移动,平衡时间短
第四类:速率--时间图象(V-t图象)
例:判断下列图象中时间t2时可能发生了哪一种变 化? 并分析平衡移动情况。
增大反应物的浓度 平衡正向移动 升高温度 平衡正向移动 加催化剂 平衡不移动
A
B
C
练习:下图是可逆反应A+2B 2C+3D的化学反应速率与 化学平衡随外界条件改变(先降温后加压)而变化的情况, 由此可推断下列说法正确的是(双选)( AB ) A.正反应是放热反应 B.若A、B是气体,则D是液体或固体 C.逆反应是放热反应. D.A、B、C、D均为气体
P1 ___P > 2
P2
加压
m+n____p+q
看图技巧: 运用“先拐先 平,数值大” 原则
<
A2 A1
P1
时间
0
t1
t2
练习:
温度一定,压强分别为 P1和P2时,反应体系 X(s)+2Y(g) nZ(g) 中反应物Y的转化率与时 间的关系如图2-27所 示,由此可知( A )。 A、P1>p2,n>2 B、P1>P2,n<2 C、P1<P2,n<2 D、P1<P2,n>3
(完整版)化学平衡图像解题技巧总结
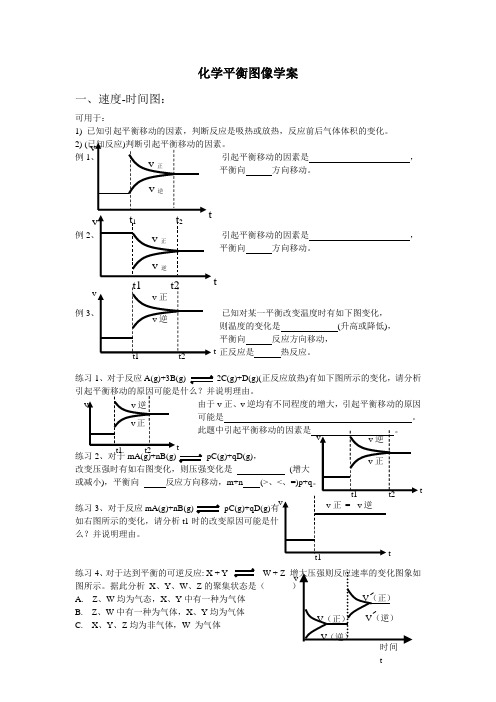
化学平衡图像学案一、速度-时间图:可用于:1) 已知引起平衡移动的因素,判断反应是吸热或放热,反应前后气体体积的变化。
2) (例1引起平衡移动的因素是 ,平衡向 方向移动。
例2引起平衡移动的因素是,平衡向 方向移动。
例3 已知对某一平衡改变温度时有如下图变化,则温度的变化是 (升高或降低), 平衡向 反应方向移动, 正反应是 热反应。
练习1、对于反应A(g)+3B(g) 2C(g)+D(g)(正反应放热)有如下图所示的变化,请分析 由于v 正、v 逆均有不同程度的增大,引起平衡移动的原因 可能是 。
练习2、对于mA(g)+nB(g) pC(g)+qD(g),改变压强时有如右图变化,则压强变化是 (或减小),平衡向 反应方向移动,m+n (>、<、练习3、对于反应mA(g)+nB(g) pC(g)+qD(g)有如右图所示的变化,请分析t1时的改变原因可能是什么?并说明理由。
练习4、对于达到平衡的可逆反应: X + Y W + Z 图所示。
据此分析 X 、Y 、W 、Z 的聚集状态是( A. Z 、W 均为气态,X 、Y 中有一种为气体B. Z 、W 中有一种为气体,X 、Y 均为气体C. X 、Y 、Z 均为非气体,W 为气体t t t t t tD. X 、Y 均为气体,Z 、W 皆为非气体练习5、如图所示,合成氨反应:N 2(g )+3H 2(g )2NH 3(g )△H <0。
在某一时间段t 0~t 6中反应速率与反应过程的曲线图。
试回答下列问题:(1)合成氨反应已达平衡状态的时间段为: 。
(2)t 1~t 2时间段是改变的 条件使平衡向 方向 移动;t 4~t 5时间段是改变的 条件使平衡 向 方向移动。
(3)在此过程中,氨的百分含量最高的一段时间是 。
解题方法及思路(1)看图像:一看面(即纵坐标与横坐标的意义), 二看线(即线的走向和变化趋势), 三看点(即起点、折点、交点、终点),四看辅助线(如等温线、等压线、平衡线等), 五看量的变化(如浓度变化、温度变化等)。
化学平衡图像题的解题方法和技巧

化学平衡图像题的解题方法和技巧化学平衡图像题是高考中一个重点,也是一个难点。
在高考中,出现某些涉及化学平衡图像试题,可以直接考查学生对观察能力结果的初步加工能力。
解图像题离不开识图、析图和解答。
识图是解题的基础,析图是关键,解答是目的。
而由于曲线和图形都包含着大量的信息,而这些信息往往是隐含的,学生必须对观察结果进行加工,才能总结出其中反映出的规律,提取出与考题有关的信息。
下面分类归纳各类图像题的解题方法和技巧。
1.速率~时间图这类图像定性地揭示了反应过程中v(正)、v(逆)随时间(含条件改变对化学反应速率的影响)而变化的规律,体现了平衡的“逆、动、等、定、变、同”的基本特征,以及平衡移动的方向。
解这一类题常分三步:①看起点首先要分清反应物和生成物,从起点应能看出起始加入是只有反应物、还是生成物,还是都有。
浓度减小的是反应物,浓度增大的是生成物,生成物多数以原点为起点。
②看变化趋势要看清逐渐增大或逐渐减小的分别是正反应速率,还是逆反应速率;曲线是连续的,还是跳跃的,分清“渐变”和“突变”、“大变”和“小变”、“变大”和“变小”、变化后是否仍然相等等情况;⑴浓度的影响增大反应物浓度,v(正)突变,v(逆)渐变;⑵温度的影响对于可逆反应,改变温度时,吸热反应的速率受到的影响程度大:升高温度,v(吸)大增,v(放)小增;降低温度,v(吸)大减,v(放)小减;⑶压强的影响 a.对于体积可变的气体反应体系,方程式中气态物质化学计量数大的一侧,其反应速率受压强的影响程度大。
增大压强,v(正)、v(逆)都增大,气体体积之和(系数和)大的一侧增加倍数大于气体体积之和小的一侧增加的倍数;减小压强,v(正)、v(逆)都减小,气体体积之和大的一侧减小的倍数大于气体体积之和小的一侧减小的倍数。
b.对于体积不变的气体反应体系,改变压强时,正、逆反应速率会同等程度的改变。
⑷催化剂的影响使用正(负)催化剂,v(正)、v(逆)都增大(减小)且改变量相等。
化学平衡图像的解题技巧

化学平衡图像的解题技巧一、考点知识网络建构1.解化学平衡图像题三步曲1看懂图像:看图像要五看;一看面,即看清横坐标和纵坐标;二看线,即看线的走向、变化趋势;三看点,即看曲线的起点、终点、交点、拐点、原点、极值点等;四看要不要作辅助线、如等温线、等压线;五看定量图像中有关量的多少;2联想规律:联想外界条件对化学反应速率和化学平衡的影响规律;3推理判断:结合题中给定的化学反应和图像中的相关信息,根据有关知识规律分析作出判断;2二个原则1先拐先平;例如,在转化率一时间图上,先出现拐点的曲线先达到平衡,此时逆向推理可得该变化的温度高、浓度大、压强高;2定一论二;当图象中有三个量时,先确定一个量不变再讨论另外两个量的关系3.有关化学平衡图像的知识规律1对有气体参加的可逆反应,在温度相同的情况下,压强越大,到达平衡所需的时间越短;在压强相同情况下,温度越高,到达平衡所需的时间越短;2使用催化剂,能同等程度地改变正、逆反应速率,改变到达平衡所需时间,但不影响化学平衡移动;3同一反应中,末达平衡前,同一段时间间隔内,高温时其他条件相同生成物含量总比低温时生成物含量大;高压时其他条件相同生成物的含量总比低压时生成物的含量大;4平衡向正反应方向移动,生成物的物质的量增加,但生成物的浓度、质量分数以及反应物的转化率不一定增加;4.解答图像类题目的注意事项1注意物质的转化率与其百分数相反;2注意图像的形状和走向是否符合给定反应;3注意图像是否过愿点;4注意坐标格的数据,也可由它判断反应物或生成物在方程式里的系数,或据此求反应速率;5注意抓两个变量间的关系,判断图像正确与否,可加辅助线,常在横坐标上画垂直线为辅助线来判断图像是否合理;二、常见的平衡图像例析1. 以v-t图像描述化学平衡移动的本质例1已知合成氨的反应为:在一定条件下达到化学平衡,现升高温度使平衡发生移动,下列图像中能正确描述正、逆反应速率v变化的是2. 以物质的量浓度-时间nc-t图像描述可逆反应达平衡的过程例2在一定温度下,容器内某一反应中M、N的物质的量n随反应时间t变化的曲线如图所示,下列表述中正确的是A. 反应的化学方程式为2M NB.C、D.3.由化学反应方程式的特点,根据平衡移动原理,判断有关图像的正误,即平衡移动原理的应用;例3反应X气+3Y气2Z气+热量,在不同温度、不同压强p1>p2下,达到平衡时,混合气体中Z的质量分数随温度变化的曲线应为;4. 以物质的量转化率-时间nR-t图像描述温度或压强对平衡移动的影响例4 2000年北京测试题已知某可逆反应aA气+bB气cC气+Q 在密闭容器中进行,在不同温度T1和T2及压强p1和p2下,混合气中B的质量分数w B与反应时间t的关系如图4所示;下列判断正确的是;<T2, P1<P2, a+b >c, Q<0>T2, P1<P2, a+b <c, Q<0C. T1<T2, P1>P2, a+b <c, Q<0D. T1>T2, P1>P2, a+b >c, Q>05. 以转化率体积分数-压强、温度R-p、T图像判断平衡状态例5 如图,条件一定时,反应2正反应为放热中NO的与T变化关系曲线图,图中有a、b、c、d4个点,其中表示未达到平衡状态,且的点是A. aB. bC. cD. d6. 根据R质量分数w、体积分数-p、T图像判断反应特征例6 已知反应,A的转化率与p、T的关系如图,根据图示可以得出的正确结论是A. 正反应吸热,B. 正反应吸热,. 正反应放热,7. 由v-pT图像描述平衡移动时正逆v的变化例7 下列反应符合下图p-v变化曲线的是A. 2HIgB.C. 4NOg+D. COg+Cs 2COg8. 混合气体平均相对分子质量—温度压强图像例8可逆反应2A+B2Cg+>0随T℃变化气体平均相对分子质量的变化如图所示,则下列叙述中正确的是A. A和B可能都是固体B. A和B一定都是气体C. A和B可能都是气体D. 若B为固体,则A一定为气体9. 由体积分数—温度图像判断平衡进程例9在容积相同的不同密闭容器内,分别充入同量的,在不同温度,任其发生反应,在第7秒时分别测定其中的体积分数,并绘成下图曲线;1A、B、C、D、E中,尚未达到化学平衡状态的点是________;2此反应的正反应是______热反应;3AC段曲线是增函数曲线,CE段曲线是减函数曲线,试从化学反应速率和化学平衡角度说明理由为____________________________________________________;4v 正_____v逆。
化学平衡解题技巧

三、恒温恒容,改变反应物用量对平衡转化率的影响规律:
以下规律可用等效平衡的方法分析。
1、反应物只有一种:aA(g)bB(g) +cC(g),在不改变其他条件时,增加A的量平衡向正反应方向移动,但是A的转化率与气体物质的计量数有关:。
A.不变B.增大C.减小D.无法判断
答案:C。
解析:设第一次通入的是1molNO2(操作①),平衡后再通入1molNO2,这一操作过程等效于起始时在2倍体积的容器中充入2molNO2(操作②),再加压至原体积的过程:V、P、T2V、P、TV、2P、T
1mol 2mol加压2mol
NO2NO2NO2
1②
A. 2 mol CB. 2 mol A 1 mol B和1 mol He(不参加反应)
C. 1 mol B和1 mol C D. 2 mol A 3 mol B和3 mol C
答案:AB。
解析:一边推(向左推)后,投料比A∶B等于1∶1时与原平衡等效。
A项,两步加料法分析:投入2mol C等效转化为投入4/3molA和2/3molB,先投入4/3molA和4/3molB,所得平衡与原平衡等效,平衡后A的体积分数为a%;再减少2/3molB,平衡左移,待平衡后A的体积分数大于a%。A合题意。
①、②达平衡时为等效平衡,NO2的体积分数相同,加压至原体积,平衡右移,则NO2的体积分数减小,故选C。新平衡压强介于P和2P之间。
例2.已知一定温度下,2X(g)+Y(g) mZ(g)ΔH=-a kJ/mol(a>0),现有甲、乙两容积相等且固定不变的密闭容器,在保持该温度下,向密闭容器中通入2 mol X和1 mol Y,达到平衡状态时,放出热量b kJ,向密闭容器乙中通入1 mol X和0.5 mol Y,达到平衡时,放出热量c kJ,且b>2c,则a、b、m的值或关系正确的是()
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
三招破解化学平衡图像题
反应速率和平衡图像是高考化学试题中的一种特殊题型,其特点是:图像是题目的主要组成部分,把所要考查的化学知识寓于图中曲线上,具有简明、直观、形象的特点。
当某些条件改变时,反应速率,浓度(或物质的量、百分含量、转化率等)可能发生变化,反映到图像上,相关的曲线就会出现渐变(曲线是连续的),或突变(曲线出现“断点”)。
因此,根据图像中曲线的变化趋势,结合条件对反应速率和平衡影响的规律,就可以作出正确判断。
2题型分类
①由图像判断反应的热效应或反应前后气体物质的量的变化。
②由反应及图像判断图象中坐标或曲线的物理意义。
③由反应和图像判断符合图象变化的外界条件。
3破解方法3.1第一招:从“断点”突破
当可逆反应达到平衡后,若某一时刻条件发生改变,如浓度、温度、压强或催化剂,都可以出现“断点”。
根据“断点”前后速率的大小。
即可对外界条件的变化做出判断。
例1某温度下,密闭容器中反应:2SO2(g)+O2(g)2SO3(g)ΔH<0达平衡后,改变条件对正、逆反应速率的影响如图所示:
①加催化剂对反应速率影响的图像是___(填序号、下同)。
②升高温度对反应速率影响的图像是____。
③增大反应容器体积对反应速率影响的图像是___。
④增大O的浓度对反应速率影响的图像是___解析:图像A中“断点”前后,v′(正)和v′(逆)均增大,且v(逆)>v(正),表明平衡逆移,升温平衡逆移。
图像B中,“断点”前后,v′(正)增大,但v′(逆)是瞬间不变的。
且v′(正)>v′(逆),平衡正移。
增大O的浓度可使v′(正)瞬间变大,而v′(逆)瞬间不变,平衡正移。
图像C中,“断点”前后,v′(正)和v′(逆)同程度的增大,催化剂符合要求。
图象D中,“断点”前后,v′(正)和v′(逆)均减小,且v′(逆)>v′(正)平衡逆移,题目提供的反应中,减压,可使正、逆反应速率均减小,平衡逆移。
答案:①C②A③D④B3.2第二招:从“拐点”突破
同一可逆反应,在不同条件下达到平衡时,反应速率,达到平衡时所用的时间,各组分的百分含量、体系的压强、混合气体的密度等可能不同,反映到图像上,就是“拐点”对应的纵坐标有差异,根据外界条件对平衡的影响,即可判断不同条件下各“拐点”纵坐标的大小。
例2一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是()。
A.CO2(g)+2NH2(g)CO(NH2)2(s)+H2O(g);ΔH<0
B.CO2(g)+H2(g)CO(g)+HO2(g)ΔH>0
C.CH3CH2OH(g)CH2=CH2(g)+H2O(g)ΔH>0
D.2C6H5CH2CH3(g)+O2(g)2C6H5CH==CH2(g)+2H2O(g)ΔH<0
解析:图1是不同温度下,对水蒸气含量的影响,在t温度下,达平衡所用的时间短,说明反应速率快,即t>t。
t条件下对应纵坐标中,水蒸气的含量高于t,说明温度越高,水蒸气的含量越低,即升温平衡向消耗水的方向移动,因此正反应的ΔH<0。
图2是不同压强下,对水蒸气含量的影响,p时,反应达平衡所用的时间短,说明速率快,即p1>p2。
p1时纵坐标中水蒸气的含量高于p,说明压强越大,水蒸气的含量越高。
即增大压强平衡向生成水的方向移动。
因此,正反应为气体物质的量减小的反应。
答案:A3.3第三招:从“曲线”变化趋势突破
对于速率(或含量)—温度(或压强)图,由于随着温度升高或压强增大,反应速率增大,物质的含量,转化率升高(或降低),反映到图像上就是平滑的递增(或递减)曲线。
依据题目提供的反应,改变条件,看图像变化趋势与化学方程式表示的变化趋势是否一致,从而作出相应的判断。
例3电镀废液中Cr2O通过下列反应转化成铬黄
(PbCrO4):Cr2O2-7(aq)+2Pb2+
+(aq)+H2O(l)2PbCrO4(s)+2H+(aq)ΔH<0平衡后,改变横坐标条件,下列示意图正确的是() 从化学方程式上看,升高温度,平衡逆移,K减小,与A图表
示一致;随着PH值的升高,c(OH-)的增大不断消耗H,平衡正移,
反应物Cr2O2-7的转化率增大,与图像相反,;升高温度,正逆反应速率均增大,与图像不同;增大Pb的浓度,平衡正移,CrO的浓度减小,与图像相反。
答案:A特别提醒:
①图像中某物质的转化率与其百分含量“相反”。
②图像的形状和走向是否符合给定
的反应。
③抓住两个变量之间的关系,判断图像正确与否,有时可加辅助线,常在横坐标上画垂线作为辅助线来判断图像是否合理。
作者简介:开远太,安徽省桐城市第六中学,安徽桐城231400。
