九年级化学常见的酸和碱2
常见的酸和碱(第2课时)(课件)九年级化学下册(沪教版)

交流讨论:
为什么不同的酸有一些相似的化学性质?
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
酸在水溶液中都能解离出H+和酸根离子, 即在不同的酸溶液中都含有相同的H+, 所以酸有一些相似的性质。
二、酸的用途
酸与指示剂的作用
一、酸的化学性质
1. 酸与指示剂作用
点滴板
优点: 显色明显、 便于对比、 节约药品 。
稀盐酸 稀硫酸
紫色石蕊试液
变红 变红
无色酚酞试液
不变色 不变色
一、酸的化学性质
2. 酸与活泼金属反应
共同现象是:金属___逐__渐__溶__解____,并产生___气__泡____。
注意:铁与酸反应还会看到溶液由 无 色逐渐变为
一、酸的化学性质
(2)酸与氧化铜反应
现象: ① 黑 色的氧化铜逐渐 消失 ;
溶液中含有Cu2+呈蓝色
②溶液由 无 色逐渐变为 蓝 色。
反应方程式:
CuO + 2 HCl = CuCl2 + H2O CuO + H2SO4 = CuSO4 + H2O
一、酸的化学性质
4. 酸与金属氧化物反应
酸 + 金属氧化物 → 盐 + 水
第7章 应用广泛的酸、碱、盐
第2节 常见的酸和碱
(第2课时)
【学习目标】 1. 认识盐酸、稀硫酸的主要化学性质。 2. 认识金属活动性顺序,并能对常见金属能否与 稀盐酸(或稀硫酸)发生置换反应进行判断。
九年级化学常见的酸和碱 (2)课件PPT

1、几种常见的酸:
浓硫酸和浓盐酸的物理性质
溶质的化学式 颜色、状态
浓盐酸
无色、液态
气味 密度(与水比较) 打开瓶口的现象
有剌激性气味
大 瓶口有白雾 (挥发性)
浓硫酸
无色、油状、 粘稠、液态
无味 大 无现象
(1)浓盐酸是HCl的水溶液[盐酸是混合物]
(2)具有挥发性,打开瓶盖,有白雾: (挥发出来的HCl气体与空气中的水蒸 气接触,形成盐酸小液滴,在空气中形成 白雾。) (3)敞口放置,溶液质量变轻,溶质质量 分数变小。
实验:在纸上用浓硫酸写字
现象: 纸上的字很快变黑色;
结论:
① 有脱水性(化学性质)
能使木材、纸张脱水碳化 ,是浓硫酸夺 取有机物中氢、氧元素(2:1),生成水。
事实
1)浓硫酸洒在衣物上,衣物出现破洞 2)罪犯把浓硫酸泼在受害人脸上毁容
结论:
②有强腐蚀性、氧化性
【思考】如果浓硫酸不慎溅到皮肤上,应 怎样处理?
10.1 常见的酸和碱(一)
回顾旧知: 1、书写下列物质的化学式,并进行分类:
盐酸、硫酸、硝酸、 碳酸、磷酸
HCl H2SO4 HNO3 H2CO3 H3PO4
氢氧化钠、氢氧化钾、氢氧化钙、 氢氧化钡
NaOH
KOH
Ca(OH)2 Ba(OH)2
氯化钠、硝酸钾、硫酸亚铁、碳酸钠
NaCl
KNO3
FeSO4 Na2CO3
1.了解常见酸碱指示剂及其变色情 况; 2、了解几种常见的酸;认识浓硫 酸的特性和稀释。
一、酸碱指示剂
1、 能跟酸或碱的溶液起作用而显示不 同的颜色的物质叫做酸碱指示剂。
如:常见的石蕊溶液、酚酞溶液
哪些物质能使无色酚酞溶液和紫色石蕊溶液变颜色 呢?
人教版初中化学九下10.1常见的酸和碱(第2课时酸的化学性质)教学设计

2.难点:
(1)理解酸碱指示剂变色的原理,能熟练运用酸碱指示剂判断溶液的酸碱性。
(2)掌握实验操作技能,尤其是滴定实验和酸碱中和反应的实验操作。
(二)教学设想
1.采用启发式教学,引导学生主动探究酸的化学性质。通过实验、讨论等形式,激发学生的学习兴趣,帮助他们构建知识体系。
2. **实验探究题**:
-设计一个简单的实验,使用酸碱指示剂来检测不同溶液的酸碱性,并记录实验结果。
-分析实验结果,讨论酸碱指示剂在不同pH值下的颜色变化规律。
3. **应用拓展题**:
-结合所学知识,探讨酸在环境保护中的作用,例如酸雨的形成及对环境的影响。
-讨论如何通过化学反应来中和酸性废水,并简述其原理。
2.介绍酸碱指示剂及其变色范围,解释酸碱指示剂变色的原理。
-酸碱指示剂是一种能够在不同pH值下变色的化合物,常见的酸碱指示剂有石蕊、溴酚蓝等。
-酸碱指示剂变色的原因是其在不同pH值下的结构发生变化,导致吸收光谱发生改变。
3.演示实验:使用酸碱指示剂判断溶液的酸碱性。
-准备不同pH值的溶液,分别加入酸碱指示剂,观察溶液颜色变化。
(三)情感态度与价值观
1.激发学生对化学学科的兴趣,培养学生热爱科学、追求真理的情感态度。
2.培养学生尊重事实、严谨求实的科学态度,教育学生遵守实验操作规程,确保实验安全。
3.增强学生的环保意识,引导学生关注生活中的酸碱污染问题,培养学生的社会责任感。
二、教学内容及环节设计
(一)导入新课
1.通过复习上节课的知识,引导学生回顾酸的定义及分类。
因此,在教学过程中,教师应关注学生的个体差异,充分调动他们的学习积极性,通过启发式教学引导学生主动探究酸的化学性质。同时,加强实验操作的指导,让学生在实践中掌握知识,提高他们的实验技能和科学素养。在此基础上,注重培养学生的合作意识,鼓励他们相互学习、取长补短,共同提高。
初中中考化学知识点常见的酸和碱
常见的酸和碱1.常见的酸:盐酸【HCl】、硫酸【H2SO4】、硝酸【HNO3】、碳酸【H2CO3】酸的含义:电离时生成的阳离子全部是氢离子(H+)的化合物叫酸。
如:HCl = H+ + Cl- H2SO4 = 2H+ + SO42- HNO3 = H+ + NO3-2.常见的碱:氢氧化钠【NaOH】、氢氧化钙【Ca(OH)2】、氢氧化钾【KOH】、氢氧化钡【Ba(OH)2】、氨水【NH3·H2O】碱的含义:电离时生成的阴离子全部是氢氧根离子(O H-)的化合物叫碱。
如:NaOH= Na++OH-Ca(OH)2 =Ca2++2OH-NH3·H2O =NH4++OH-3.常见的盐:NaCl、AgCl、CaCl2、FeCl2、CuCl2、FeCl3、Na2SO4、BaSO4、CuSO4、KNO3、AgNO3、Ba(NO3)2、Cu(NO3)2、Na2CO3、CaCO3、BaCO3盐的含义:由金属离子和酸根离子构成的化合物是盐;由酸根离子和铵根离子(NH4+)构成的化合物也是盐。
如:NH4NO3、(NH4)2SO44.酸溶液:酸的水溶液(溶质是酸)酸性溶液:PH值<7的溶液(硫酸氢钠)能让酸碱指示剂变色的是酸性溶液。
第一节酸及其性质一、浓盐酸、浓硫酸的物理性质、特性、用途1.4.8.A如何区别浓硫酸和浓盐酸方法1、闻浓盐酸有挥发性闻有刺激气味浓硫酸不挥发无色无味;2、看浓盐酸有挥发性打开瓶盖会冒白烟浓硫酸不挥发;3 根据脱水性浓硫酸有强化性放一张白纸在上面白纸会变黑浓盐酸不会使白纸炭化变黑B浓流酸有很强的腐蚀性(化学性质),木炭、纸张、皮肤等物质遇到硫酸能变黑,这是硫酸的脱水性。
稀释浓硫酸时一定要将浓硫酸沿着器壁慢慢地注入水中,并用玻棒不断得搅拌,使产生的热量迅速扩散,切不可将水倒入浓硫酸中。
如果不小心将浓硫酸沾在手上,如果少量可直接用水冲洗,量多,应先用布擦,再用大量的水冲洗。
人教版九年级化学知识点常见的酸和碱

常见的酸和碱1、(1)酸碱指示剂定义:跟酸和碱作用显示不同颜色的物质叫做酸碱指示剂。
紫色石蕊试液和无色酚酞试液是常见的酸碱指示剂。
(2)酸碱指示剂与酸碱作用:紫色石蕊试液遇酸变红,遇碱变蓝;无色酚酞试液遇酸不变色,遇碱变红色。
一、酸2、常见的酸:盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、醋酸(CH3COOH)。
(1)盐酸:纯净的盐酸是无色有刺鼻性气味,有酸味的液体,工业盐酸因含 FeCl3呈黄色,浓盐酸具有挥发性,打开盛浓盐酸的试剂瓶,瓶口会有白雾产生(浓盐酸具有挥发性,挥发出的氯化氢气体溶解在空气中的水蒸气中,形成了盐酸小液滴,瓶口的白雾就是盐酸小液滴),能与水任意比互溶。
用途:金属除锈、制药、人体胃液中的胃酸的主要成分,帮助消化。
(2)硫酸:无色黏稠状液体,无气味,能溶于水,溶于水时放出大量的热。
用途:重要的化工原料、金属除锈、实验室中的干燥剂。
浓硫酸的性质:A:浓硫酸具有很强的腐蚀性,它能夺取纸张、木材、布料、皮肤等物质中的水分(把物质中的氢氧元素按水的组成比脱去),生成炭黑,故使用浓硫酸时应特别注意。
B:吸水性:浓硫酸具有将强的吸水性,能够吸取空气中的水蒸气,故长时间放在空气中的浓硫酸质量会增重,浓度会变稀。
故浓硫酸可以用来干燥一些气体。
C:浓硫酸具有强氧化性。
浓硫酸的稀释:稀释浓硫酸时不能见水往浓硫酸中加(浓硫酸溶于水时放出大量的热,足以使溶液沸腾,液体溅出伤人),应把浓硫酸往水中加,边加边用玻璃棒(玻璃棒作用:散热)搅拌,如不慎将浓硫酸沾到皮肤或衣服上,应先用大量水冲洗,再涂上的碳酸氢钠溶液( H2SO42NaHCO3Na2SO42CO22H2O),稀硫酸沾到皮肤上或衣服上也要这样处理(因为稀硫酸水分蒸发后也会变成浓硫酸)。
3、酸的化学性质:(1)酸与酸碱指示剂作用,酸能使紫色石蕊试液变红,无色酚酞试液遇酸不变色。
(2)酸与金属的反应:与盐酸的反应与硫酸的反应镁Mg 2HCl MgCl 2 H2Mg H2SO4MgSO4H2铁Fe 2HCl FeCl 2 H 2 Fe H2SO4FeSO4H2锌Zn 2HCl ZnCl 2 H 2 Zn H2SO4 ZnSO4 H2铝2Al 6HCl 2AlCl3 3H2 2Al 3H2SO4Al2SO433H2(3)酸与金属氧化物的反应:Fe2O3Fe2O36HCl 33H2OFe2O33H2SO4Fe3SO423H2O 2FeClMgOCuOCaO3%-5%(4)和碱的反应:NaOHCaOH 2NH3.H2O4、为什么酸具有相同的化学性质:因为酸中具有相同的H ,但并不是所有的酸都具有向的化学性质,不同的酸含有不同的酸根离子,故性子也有差异,即物质的组成决定物质的性质。
初中化学常见的酸和碱

初中化学常见的酸和碱一、酸1. 定义酸是在水溶液中电离出的阳离子全部是氢离子(H⁺)的化合物。
2. 常见的酸盐酸(HCl)物理性质无色、有刺激性气味的液体,浓盐酸具有挥发性,打开瓶盖会看到瓶口有白雾出现,这是因为挥发出的氯化氢气体与空气中的水蒸气结合形成盐酸小液滴。
工业盐酸因含有杂质(如Fe³⁺)而略显黄色。
化学性质与酸碱指示剂反应:使紫色石蕊试液变红,无色酚酞试液不变色。
与活泼金属反应(如锌):Zn + 2HCl = ZnCl₂+ H₂↑。
与金属氧化物反应(如氧化铁):Fe₂O₃+ 6HCl = 2FeCl₃+ 3H₂O,此反应常用于除铁锈。
与碱反应(如氢氧化钠):HCl + NaOH = NaCl + H₂O,这是中和反应的典型例子。
与某些盐反应(如碳酸钙):CaCO₃+ 2HCl = CaCl₂+ H₂O + CO₂↑,可用于实验室制取二氧化碳。
硫酸(H₂SO₄)物理性质无色、粘稠、油状液体,不易挥发。
浓硫酸具有吸水性,可作干燥剂。
浓硫酸溶于水时放出大量的热,因此稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水中,并不断搅拌,切不可将水倒入浓硫酸中。
化学性质与酸碱指示剂反应:同盐酸,使紫色石蕊试液变红,无色酚酞试液不变色。
与活泼金属反应(如锌):Zn + H₂SO₄ = ZnSO₄+ H₂↑。
与金属氧化物反应(如氧化铜):CuO + H₂SO₄ = CuSO₄+ H₂O。
与碱反应(如氢氧化钡):H₂SO₄+ Ba(OH)₂ = BaSO₄↓+ 2H₂O,此反应会生成白色沉淀硫酸钡。
与某些盐反应(如氯化钡):H₂SO₄+ BaCl₂ = BaSO₄↓+ 2HCl,可用于检验硫酸根离子。
硝酸(HNO₃)物理性质无色液体,有刺激性气味,具有挥发性。
化学性质与酸碱指示剂反应:使紫色石蕊试液变红,无色酚酞试液不变色。
具有强氧化性,与金属反应时一般不生成氢气。
例如,铜与稀硝酸反应:3Cu + 8HNO₃(稀)= 3Cu(NO₃)₂+ 2NO↑+ 4H₂O;铜与浓硝酸反应:Cu + 4HNO₃(浓)= Cu(NO₃)₂+ 2NO₂↑+ 2H₂O。
人教版九年级化学下册复习优秀教学案例:10.1常见的酸和碱(第二课时)

1.生活实例导入:通过展示酸雨对环境的影响,引发学生对酸碱知识的兴趣,使他们能够主动参与到课堂学习中。这种教学方式体现了“从生活到化学”的理念,有助于提高学生的学习积极性。
2.问题导向:本节课以问题为导向,引导学生深入思考和探讨酸碱中和反应的实际应用。通过解答问题,学生能够更好地理解和掌握酸碱知识,提高他们的问题解决能力。
3.小组合作:将学生分成小组,让他们在合作中探究酸碱中和反应的原理和应用。这种教学方式培养了学生的团队合作意识和沟通能力,有助于提高他们的实践能力。
4.实验操作:本节课注重实验教学,让学生亲身体验酸碱的变化。通过实验操作,学生能够更好地理解和掌握酸碱知识,提高他们的实验技能。
5.总结归纳:在课堂结束后,引导学生对自己的学习进行反思和总结,使学生能够自主构建酸碱知识体系。这种教学方式有助于提高学生的归纳总结能力,培养他们的自主学习能力。
为了达到以上教学目标,我准备了一系列教学资源,如实验器材、多媒体课件和习题。在教学过程中,我将注重启发式教学,引导学生主动探究,培养他们的创新精神和团队合作意识。同时,我会关注每一个学生的学习情况,及时给予反馈和指导,确保他们能够达到本节课的学习要求。
二、教学目标
(一)知识与技能
1.掌握酸碱中和反应的概念,了解中和反应的特点及应用。
2.学生通过对比、归纳、总结,自主构建酸碱知识体系。
3.强调酸碱知识在生活中的重要性,激发学生的学习兴趣。
(五)作业小结
1.布置作业:让学生设计一个关于酸碱中和反应的实验,并进行实验操作。
2.要求学生在作业中总结实验原理、操作步骤、实验现象及结论。
3.教师批改作业,及时了解学生的学习情况,给予反馈和指导。
三、教学策略
(一)情景创设
常见的酸和碱2

瓶口无白雾
无气味
2.盐酸和硫酸的用途: 用
盐 酸
途
重要化工产品。用于金属表面除锈、 制药等;人体胃液中含有盐酸,可帮助消 化。 重要化工原料。用于生产化肥、农药、 火药、染料以及冶炼金属、冶炼石油和金 属除锈等。 浓硫酸有吸水性,在实验室中常用它 做干燥剂。
硫 酸
。
这是2013年5月29日下 午发生在海口市秀英区海 口玻璃厂宿舍区的一桩悲 剧。因为受不了邻居酿酒 散发出来的气味,在自己 阻止不了对方继续酿酒的 情况下,竟将一盅浓硫酸 泼向一墙之隔的邻居,使 邻家妇女造成重度烧伤。 此事说明了浓硫酸有什么 性质?你能否设计实验证 明呢?
3. 碱:电离时生成的阴离子全部是氢 氧根离子 的化合物。
请根据我们已有知识判断下列物 质属于哪一类?
(1)、HNO3、Fe2O3、Ca(OH)2、H2CO3、 (2)、硫酸 、氢氧化钡、碳酸钾、氯化镁 (3)、Mg(OH)2、KCl、CuSO4、CuO、 (4)、硝酸、氢氧化钾、氧化铁、五氧化二 磷
2、如图下列说法不正确的是 ( A ) A、紫色 B、蓝色 C、红色 D、无色
石蕊 B 碱 C A
酸
D 酚酞
3.浓盐酸(化学式: )在空 气里会形成 白雾 , 盐酸具有挥发性 这是因为 , 形成 的缘故。工 液体小颗粒 业用浓盐酸因含有少量杂质而略 带 黄色
HCl
4.纯净的浓硫酸(化学式: H2SO4 ) 是 无 颜色、 油状 、 粘稠 的液体, 难挥发。浓硫酸具有 吸水性 和强烈 的 腐蚀性 ,在使用时应十分小心。 如果不慎将浓硫酸沾到皮肤上, 应 立即用清水冲洗 ,然后涂上3%~5% 的 碳酸氢钠 溶液,以防灼伤皮肤。
你知道吗?
浓硫酸有强烈的腐蚀性,用时一定要注 意安全。我们做实验时不掌握好浓硫酸 的这一“个性”,很可能就被腐蚀皮肤、 衣服等。如果浓硫酸不慎沾到皮肤或衣 服上,应如何处理? 立即用大量水冲洗,然后涂上3%~5% 的碳酸氢钠溶液。
10.2常见的酸和碱(2)+课件-2024-2025学年九年级化学人教版(2024)下册

(1)紫色石蕊溶液遇____变红色,但是使紫色石蕊溶液变红色的不一定是酸溶液。(2) 与稀盐酸、稀硫酸反应生成____价的“亚铁”化合物,颜色均是________。(3) 与稀盐酸、稀硫酸反应生成____价的“铁”化合物,颜色均是______。
酸
浅绿色
黄色
1.已知白醋里含的醋酸 ,醋酸与稀盐酸的化学性质相似。下列物质不能与醋酸发生反应的是( )
6.人体胃液中含有稀盐酸,可帮助消化。深受人们喜欢的食品燕麦中常添加颗粒极小的铁粉,它既可以作为双吸剂(起到干燥和减缓食品变质的作用),还可以作为人体补铁剂。
(1)铁粉可以作双吸剂,是因为 可以和____、_____反应。(2)铁粉与稀盐酸发生反应的化学方程为_________________________。(3)下列物质能与稀盐酸反应的有______。
2.稀盐酸、稀硫酸可用于金属表面除锈。现将一根生锈的铁钉放入盛有稀 的试管中,可能观察到的现象是①铁钉表面的铁锈逐渐消失 ②铁钉上有气泡产生 ③溶液先变成黄色,再变成浅绿色( )
D
A.只有①② B.只有①③ C.只有③ D.①②③
知识点二:酸的通性
【实验探究2】阅读教材P70中的实验 ,观察实验并记录实验现象。
实验目的
实验方案
A
除去 中混有的木炭粉
加入适量的稀盐酸
C
除去 中的水蒸气
将混合气体通过盛有浓硫酸的洗气装置
B
分离木炭粉和 的固体混合物
加足量的水溶解、过滤
D
检验蜡烛中是否含有氧元素
在蜡烛的火焰上方罩一只干冷的烧杯,观察现象
C
1
2
3
4
5
【记忆大师】写出下列反应的化学方程式
鲁教版九年级化学下册 碱及其性质 常见的酸和碱(第2课时)

氢氧化钙、氢氧化钠、氢氧化钾的俗称及用途
名称
俗称
氢氧化钙 熟石灰或 消石灰
氢氧化钠
烧碱、火碱 或苛性钠
用途
生产农药、建筑材料、漂 白剂、处理污水、改良酸 性土壤
制肥皂、洗涤剂、造纸、 纺织工业、炼制石油
氢氧化钾 苛性钾
电池工业
练习
经典例题
第七单元 常见的酸和碱
第二节 碱及其性质
第1课时
学习目标
1.记住氢氧化钠和氢氧化钙的俗名和主要物理性质。 2.通过实验,能认识到氢氧化钠和氢氧化钙具有强烈的腐蚀性。 3.了解工业制取氧化钙、氢氧化钙的方法。
自主探究
导入新课
几 种 常 见 的 碱 氢氧化钠
氢氧化钙
吃未成熟的柿子,会有什么感觉? 为什么会有涩味?在未成熟的柿 子中有一些碱性物质。 说出你所知道的生活中的碱性物 质,对这些碱性物质有什么生活 感知?
碱及其性质
第二课时
学习目标
01 认识氢氧化钠和氢氧化钙的化学性质。 02 知道碱的相似化学性质及其原因。
你吃过皮蛋吗?你知道皮蛋是怎样制作的吗?
皮蛋又称松花蛋、变蛋等,是我国传统的风味蛋制品,不 仅为国内广大消费者所喜爱,在国际市场上也享有盛名。皮 蛋是中国独特的蛋加工品,也是一种碱性食品。腌制皮蛋所 需的材料有盐、茶及多种碱性物质(如生石灰、草木灰、碳 酸钠、氢氧化钠等)。
实验内容
现象
向滴加了酚酞试液 的氢氧化钠溶液中 加入稀盐酸,边加
边振荡
溶液由红色慢 慢变为无色
化学方程式
NaOH+HCl=NaCl+H2O
结论:碱 + 酸→ 盐 + 水
人教版九年级下册化学 第十单元 常见的酸和碱2(第三课时稀盐酸、稀硫酸的化学性质).pptx

Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
黑色粉末逐渐消失、溶
液由无色变为蓝绿色
CuO+2HCl=CuCl2+H2O
氧化铜+硫酸
黑色粉末逐渐消失、
溶液由无色变为蓝色
CuO+H2SO4=CuSO4+H2O
酸能与某些金属氧化物反应,生成盐和 水
金属氧化物+酸→盐+水
小结 盐酸、硫酸有哪些相似的化学性质?
空白演示
在此输入您的封面副标题
1、浓盐酸的物理特性 挥发性 2、浓硫酸的特性 腐蚀性(脱水性)、吸水性
3、浓盐酸和浓硫酸久置于空气中,它们的溶液组 成变化情况:
溶质质 溶剂质 溶液质 溶质的
量
量
量
质量分数
浓盐酸 变小 不变 变小
变小
浓硫酸 不变 变大 变大
变小
4、在酸溶液中存在的相同离子是 H+
第十单元酸和碱
因为酸中的阳离子全部是H+
1.下列物质中能与盐酸反应并有气体生成的是( A)
A.铝
B.银
C.铜
D.汞
2.在下表“类别”栏目内,选填合适的字母序号。
化学式 HNO3 NaHCO3 Ca(OH)2 S
类别 C
B
D
A
A.非金属B.盐C.酸D.碱
3.有下列几种物质:a.稀盐酸 b.稀硫酸
c.石灰石 d.浓酸盐 e.浓硫酸
课题1常见的酸和碱 第三课时稀盐酸、稀硫酸的化
学性质
探究:稀盐酸和稀硫酸的化学性质
1.稀盐酸、稀硫酸与指示剂作用
加紫色石蕊溶液 加无色酚酞溶液
稀盐酸 紫色石蕊溶液变红色
九年级化学第九单元课题1常见的酸和碱(第二课时)

硫
酸
浓硫酸的腐蚀性
[实验10-3]实验时要注意安全,不要将浓 硫酸沾到皮肤和衣服上,实验物品应在玻璃片上 进行实验。(下册实验17)
实验内容 一段时间后 的现象
结论或原因 启发
浓硫酸在纸 上写字
用木棍蘸浓 硫酸
将浓硫酸滴 到布上
纸张的笔画 木棒上蘸有 滴到酸的布 浓硫酸的部 由黄变黑, 部分变黑 分变黑 容易破损 浓硫酸有很强的腐蚀性,能使纸张、 木条、布甚至皮肤脱水而腐蚀 使用浓硫酸时要特别小心
第十单元
酸和碱
课题 1常见的酸和碱
(第二课时)
教学目标:
(常见的酸) 1.知识目标:(重、难点) 知道几种常见的酸和碱的主要性质和用途。
2.能力目标::(重点) 会用指示剂鉴别酸碱溶液。 3.科学品质目标: 认识酸碱的腐蚀性及使用时的安全注意事项。
你已经知道哪些酸和碱?了解它们的性 质吗?它们在生产、生活中有哪些应用?
遇酸溶液变红色,遇碱溶液变蓝色
溶液变蓝色 溶液变红色
注意:酸碱指示剂与酸或碱的溶液反应时,
变色的是指示剂,而不是酸碱。
用途:区别溶液的酸碱性。
二、酸的化学性质
2:酸能与多种活泼金属反应,生成盐和氢气
与稀盐酸反应 与稀硫酸反应 Mg+H2SO4=MgSO4+H2↑ Zn+H2SO4=ZnSO4+H2↑ Fe+H2SO4=FeSO4+H2↑
浓硫酸干燥某些气体
CO2 H2O(g) CO2
H2 SO4(浓)
由于浓硫酸有吸水性
讨论: 盐酸、硫酸有哪些主要用途?
2.盐酸和硫酸的用途:
用 盐 酸 途
重要化工产品。用于金属表面除锈、制药 等;人体胃液中含有盐酸,可帮助消化。 重要化工原料。用于生产化肥、农药、火 药、染料以及冶炼金属、冶炼石油和金属 除锈等。浓硫酸有吸水性,在实验室中常 用它做干燥剂。
初三化学常见的酸和碱
d.与盐反应: Na2CO3 + Ca(OH)2 = NaOH + CaCO3
3.碱的通性
a.使指示剂变色:酸石红,碱石蓝,酸酚无,碱酚红 b.碱 + 非金属氧化物 = 盐 + 水 c.酸+碱=盐+水(中和反应)
一切为了学生 为了一切学生 e. 酸+盐= 新酸+新盐(复分解反应)
d.与碱反应: 2NaOH + H2SO4 = Na2SO4 + 2H2O
e.与盐反应: BaCl2+ H2SO4 = BaSO4 + 2HCl
3.酸的通性
a.使指示剂变色:酸石红,碱石蓝,酸酚无,碱酚红 b.酸+金属=盐+氢气: Mg Al Fe Zn Pb c.酸+金属氧化物 = 盐+水
一切为了学生 为了一切学生
一切为了学生 为了一切学生
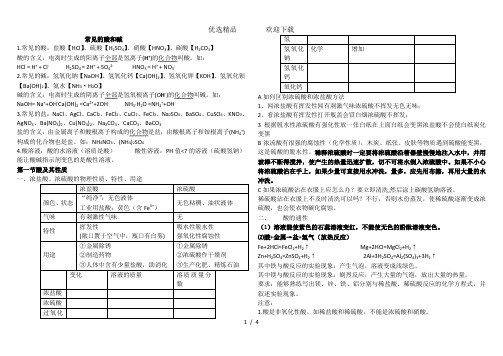
什么是酸 什么是碱
由氢离子和酸 根离子构成的 化合物叫酸.
HCl H2SO4
HNO3 H3PO4
由金属离子和 氢氧根离子构 成的化合物叫 碱
NaOH Ca(OH)2
NH4OH KOH
一切为了学生 为了一切学生
一. 常见的酸
1. 盐酸(HCl)
物理性质: 无色刺激性气味液体,有挥发性, 在空气中形 成 白雾。 化学性质:
a. 原混合物中硫酸钠的质量分数? b. 反应后溶液中硫酸钠的质量分数?
一切为了学生 为了一切学生
下列气体中,既能用固体NaOH干燥又能用浓H2SO4干 燥的是( D)
A. CO2
B. HCl
人教版 九年级 化学(教师版) 常见的酸和碱 (第二课时)

3、下列化学方程式书写完全正确的是( )
A、Zn+2HCl=ZnCl2+ H2 B、2Fe+3H2SO4=Fe2(SO4)3+3H2
C、AI+HCl=AICl3+ H2 D、Fe2O3+H2SO4= FeSO4+ H2O
4.盐酸和稀硫酸常用作金属表面的清洁剂,是利用了它们化学性质中的( )
A能与金属反应B能与金属氧化物反应
C能使指示剂变色D能溶于水
5、铁锈的主要成分是(填化学式)。向放有铁锈的钉子的试管中加入过量盐酸,首先看到的现象是,反应的化学方程式是,过一会儿又到,该反应的化学方程式是。
6.写出下列反应的化学方程式:
(1)铝和稀盐酸反应:
(2)用稀硫酸除铁锈:
(3)氢氧化铜稀硫酸反应:
课题一常见的酸和碱(第二课时)
学习目标:
1、通过实验认识盐酸和硫酸的化学性质;
2、学会书写酸反应的相关化学方程式。
温故知新
1.石蕊遇酸变色,遇碱变色;酚酞遇酸变色,遇碱变色。
2.金属活动性顺序:。
3、金属与酸发生置换反应的规律:(1)排在的金属可以置换出酸中的氢。(2)酸不能是酸和酸,因为他们具有强性。(3)铁发生置换反应时,一定生成盐。
5、酸与盐的反应:实验(完成下表)
实验现象
化学方程式
硝酸银+盐酸
产生溶于稀硝酸的色的色沉淀
讨论:上面反应的反应物和生成物有什么共同之处?
我学会了,我能行:
1.下列物质放入到稀盐酸中,无气体生成的是( )
A.铝B碳酸钠C铁锈D石灰石
2.下列物质可由金属与稀酸发生反应得到的是( )
常见的酸和碱(第2课时)(课件)九年级化学下册(科粤版)

达标检测
1.(2022·广西·河池市宜州区教育局教学研究室二模)下列
有关熟石灰的说法错误的是( C )
A.熟石灰是氢氧化钙的俗称 B.熟石灰由生石灰与水反应而制得 C.熟石灰的溶解度随温度升高而增大 D.熟石灰可以用来改良酸性土壤
达标检测
2.下列物质的溶液长期放置在空气中,溶液质量因发生 化学变化而增大的是( D )
○ 千锤万凿出深山, ○ 烈火焚烧若等闲。 ○ 粉身碎骨浑不怕, ○ 要留清白在人间。
CaCO3 CaCO3 =高温= CaO + CO2↑
CaO + H2O == Ca(OH)2 (放大量热) Ca(OH)2 +CO2 == CaCO3 ↓ + H2O
新课讲解
CaO + H2O =Ca(OH)2 (放大量热) 生石灰 CaO
使紫色石蕊试液
变蓝
碱
使无色酚酞试液
变红
新课讲解
2、碱+非金属氧化物
盐+水
盐 试管内的液面上升
水 CO2 + 2NaOH =Na2CO3 + H2O
新课讲解
3、碱+盐
新盐+新碱
1、有蓝色沉淀产生; 2、有红褐色沉淀产生。
新盐
Ca(OH)2 + CuSO4 ==Cu(OH)2 ↓ + CaSO4
新碱
典例精讲
【答案】OH-中和酸性土壤(或中和酸性废液等)CuSO4+Ca (OH)2=Cu(OH)2↓+CaSO4 【解析】(1)能使酚酞变红的是碱性溶液,碱性溶液是指常温下 pH大于7,即氢氧根离子浓度大于氢离子浓度的溶液,所以题中能 使酚酞试液变红的离子是氢氧根离子;(2)熟石灰是碱性物质, 在工农业上可以用来中和酸性土壤或中和酸性废液等;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[单选]对人员密集场所实施消防监督检查时,尤其要注意检查员工()在场群众疏散的知识和技能。A.督促B.号召C.跟随D.组织引导 [单选,A2型题,A1/A2型题]一般小儿在几岁左右平衡、精细动作、粗大运动的协调发育基本成熟()A.10岁B.11岁C.9岁D.7岁E.4岁 [单选]关于三踝骨折错误的是()A.腓骨应作内固定B.完全纠正下胫腓联合分离C.使用坚强的固定,术后早期活动D.后踝骨折占关节面面积1/5,须作内固定E.下胫腓关节固定螺丝钉不能超过3个月 [名词解释]不定根原基 [单选]在债的发生依据中,既未受人之托,也不负有法律规定的义务,而自觉为他人管理事务或提供服务的行为是()。A.无权代理B.不当得利C.侵权行为D.无因管理 [配伍题,B1型题]测定输卵管功能的方法</br>诊断子宫肌瘤</br>诊断早期宫颈癌</br>间接测定卵巢功能的方法</br>A.阴道分泌物悬滴检查B.子宫输卵管碘油造影C.宫颈刮片检查D.宫颈黏液检查E.B型超声检查 [单选,A2型题,A1/A2型题]下列抗体中是Graves病的直接致病原因的是().A.TSAbB.TSBAbC.TGID.TPOAbE.TgAb [判断题]可转换证券实贡上嵌入了普通股票的看跌期权,正是从这个意义上说,我们将其列为期权类衍生产品。()A.正确B.错误 [单选]人员密集场所应做到“三自”,下列选项中()是错误的。(易)A、消防安全自查B、火灾隐患自除C、违法行为自处D、消防安全责任自负 [单选,B1型题]聚合性痤疮()。A.表现为严重结节、囊肿、窦道及瘢痕,好发于男性青年B.少数患者病情突然加重,并出现发热、关节痛、贫血等全身症状C.雄激素、糖皮质激素、卤素等所致的痤疮样损害D.婴儿期由于母体雄激素在胎儿阶段进入体内E.与月经周期密切相关 [单选,A2型题,A1/A2型题]一般血清总钙是下列哪项时,有临床症状()。A.≤2.8mmoL/LB.≤2.2mmol/LC.≤0.95mmol/LD.≤1.88mmol/LE.≤2.5mmoL/L [单选]容量因子是指()A.分配平衡时,组分在流动相中的浓度与在固定相中的浓度比值B.分配平衡时,组分在固定相中的浓度与在流动相中的浓度比值C.K=C固/C流D.k=V固/V流E.分配平衡时,组分在固定相中的质量与在流动相中的质量比值 [单选,A2型题,A1/A2型题]女性雌激素的作用不包括()A.乳房发育B.外阴发育C.体毛过多D.子宫发育E.卵巢发育 [单选,A1型题]WHO提出号召,出生后4~6个月内的婴儿母乳喂养率应达多少以上()A.50%B.60%C.70%D.80%E.90% [单选]下列疾病是结肠癌的高危疾病的是()A.大肠息肉B.细菌性痢疾C.大肠结核D.阿米巴痢疾E.肠易激综合征 [填空题]采用布置恰当的六个支承点来消除工件的(),称为“六点定位原则”。 [单选]按临床分类,重度吸入性损伤指()A.伤及鼻道B.伤及咽部以上C.伤及细支气管D.伤及气管以上E.伤及喉部以上 [单选]我国医学发展史上可称为温病学奠基作的专著是:().A.《温热论》B.《温疫论》C.《温热经纬》D.《温病条辨》 [单选]常见堤防隐患可概括为()、裂缝、暗沟、渗漏、近堤坑塘五大类。A.洞穴B.人为洞穴C.害堤动物洞穴D.朽木洞穴 [问答题,简答题]试说明异戊巴比妥的化学命名。 [单选]以下哪种行为可以称为项目?()A.开班会B.给新计算机安装操作系统及相关软件C.设计一种新型的自行车D.生产一批新型的自行车 [配伍题,B1型题]治疗慢性贫血可首选()</br>治疗脓毒症可首选()A.浓缩白蛋白液B.新鲜冰冻血浆(FFP)C.浓缩红细胞D.浓缩粒细胞E.右旋糖酐 [单选]下列不属于票据基本特征的是()。A.票据是流通证券B.票据是要式证券C.票据是有因证券D.票据是设权证券 [问答题,案例分析题]临床情景:钱女士,44岁。胃癌根治术后第7天,目前需切口拆线。要求:请为患者(医学模拟人或模具)切口拆线。 [单选,A2型题,A1/A2型题]关于会阴的描述,正确的是()A.广义的会阴前方为耻骨联合上缘B.狭义的会阴是指尿道口与肛门之间的软组织C.会阴包括皮肤、肌肉、筋膜及骨骼D.会阴体厚3~4cm,呈楔状E.会阴组织妊娠时的延展性差,分娩时容易裂伤 [填空题]苯乙烯为无色具有()气味的液体。 [填空题]电缆采用直埋敷设时,表面距地面的距离不应小于()。 [填空题]旅客如不能按()的日期车次乘车时,在列车有能力的前提下可以办理一次()乘车签证手续。 [单选]起货机油温高温报警传感器一般设在()。A.高压管B.回油管C.主泵吸口D.辅泵吸口 [单选]当膨胀机进出口压力一定时,机前温度越高,单位制冷量()A、越小B、不变C、越大 [单选]预算线向右上方平行移动的原因是()A.商品X的价格下降了B.商品Y的价格下降了C.商品X和Y的价格按同样的比率下降D.商品X和Y的价格按同样的比率上升 [单选]社会主义道德和资本主义道德的根本区别在于()A.所有制B.政治思想C.技术水平D.社会信仰 [单选]下列哪种情况不会传播朊毒体病()A.器官移植B.神经外科手术C.进食煮熟的牛肉D.空气传播E.注射尸体来源的人体激素 [单选]气调养护中自然降氧的标准是()。A.先充气后抽气B.先抽气后充气C.充气和抽气同时进行D.先抽气使薄膜紧贴堆垛为止E.密封容器使外部氧气不能进入 [多选]特殊路基类型包括有()。A.沿河路基B.岩溶地区路基C.黄土地区路基D.涎流冰地段路基E.岩溶地区器基 [问答题,简答题]主变中性点避雷器的作用? [单选,A2型题,A1/A2型题]冷凝集综合征患者的抗体类型为()A.IgMB.IgGC.IgAD.结合补体E.补体 [单选]3岁患儿在1小时前误吸浓盐酸少许,查体,意识清,上腹部压痛明显,唇及口腔有灼伤,心肺(-)应选用()洗胃液。A.碳酸氢钠B.食醋C.液体石蜡D.果汁E.氢氧化铝凝胶 [判断题]饲料中脂肪、草酸含量过多有利于钙的吸收。()A.正确B.错误 [单选,A2型题,A1/A2型题]既能够治疗目赤翳障,又能够治疗皮肤湿疮的药物为()A.滑石B.硼砂C.雄黄D.炉甘石E.砒石
ቤተ መጻሕፍቲ ባይዱ
