无机化学 配合物 晶体场理论超级详细 超级好38页PPT
合集下载
第一节晶体场理论ppt课件

释了配合物的空间构型等问题。
为了较好地解释配合物的磁性和高自旋和低自旋等问
题,1935年培特和冯弗莱克提出了晶体场理论(CFT)。
晶体场理论认为:配合物中央离子(原子)和配体之
间的相互作用,主要来源于类似于离子晶体中正负离子间
的静电作用;在此作用下,中心离子的原子轨道可能发生
分裂。
z
Hans Albrecht Bethe
——2006年高中化学竞赛试题
6-2 某钒的配合物具有 VO(N2O2)配位结构形式,所有的氮、氧原子都为配 位原子。且配合物只检测到一种 V-N键,两种 O-V键。
美国著名化学家,因阐明化学 键的本质,并以此解释了复杂分子 结构,1954年获诺贝尔化学。
看法。 他认为:所有配合物都是以共价配键结合的。并结合杂化轨道理论对
配合物的构型加以解释。
严格执行突发事件上报制度、校外活 动报批 制度等 相关规 章制度 。做到 及时发 现、制 止、汇 报并处 理各类 违纪行 为或突 发事件 。
相对较多;
npx npy
☆pz 轨道受配体静电的排斥相对
较小,其能级升高相对较少。
E’
npz
np
四方配位场
严格执行突发事件上报制度、校外活 动报批 制度等 相关规 章制度 。做到 及时发 现、制 止、汇 报并处 理各类 违纪行 为或突 发事件 。
⑶ d轨道
中央离子的 d 轨道有五种取向(dxy、dyz、dxz、dx2-y2、dz2),当四 个配体沿±x、±y 方向靠近中央离子时,中央离子 d 轨道受配体静电的 排斥,其能级升高,并发生能级分裂。
点平面方向。
z
z
x
y
y
x
dxz
dyz
第四章_晶体场理论 ppt课件

以球形场的简并的 d 轨道的能量为零点,讨论分 裂后的 d 轨道的能量。电场对称性的改变不影响 d 轨 道的总能量。
因此分裂后,总的能量仍与球形场的总能量一致,仍
为零。
八面体场:
列方程组:
Eeg - Et2g = O 3Eeg + 2Et2g = 0
解得:
eg
O
t2g
Eeg = 3/5 o Et2g = - 2/5 o
性高。中心的 d 轨道在这些电场中不再简并。
⑴ 八面体场
六个配体沿 x、y、z 三轴的正负 6 个方向分布,以形成电
场。 在电场中各轨道的能量均有所升高。但受电场作用不同,
能量升高程度不同。
Z
5 个 d 轨道升高的能量之 和与在球形场升高之和相同。 但是这些轨道中有的比球形 场高,有的比球形场低。
Y
称为分裂能,八面体场中称为 △O 。
能级计算:
自由离子 E0
Es = 0Dq 球形场
d x 2- y 2 d z 2
二重简并 dγ 或 eg
6Dq Δ 0=10Dq
-4Dq
三重简并
d xy d xz d yz 八面体场
dε 或 t2g
分裂能Δo = Eeg-Et2g = 10Dq (1)
根据量子力学原理,在外界电场作用下产生的d轨道分 裂前后,其总能量应保持不变,得:
2Eeg+3Et2g = 0
(2)
联合(1)与(2)方程,解得
Eeg=6Dq Et2g=-4Dq
⑵ 正四面体场
坐标原点为正四面体的中心,三轴沿三边方向伸展 ,4 个配
体的如图所示,形成电场。
Z
在正四面体场中,dx2 – y2 、d z2 ,
因此分裂后,总的能量仍与球形场的总能量一致,仍
为零。
八面体场:
列方程组:
Eeg - Et2g = O 3Eeg + 2Et2g = 0
解得:
eg
O
t2g
Eeg = 3/5 o Et2g = - 2/5 o
性高。中心的 d 轨道在这些电场中不再简并。
⑴ 八面体场
六个配体沿 x、y、z 三轴的正负 6 个方向分布,以形成电
场。 在电场中各轨道的能量均有所升高。但受电场作用不同,
能量升高程度不同。
Z
5 个 d 轨道升高的能量之 和与在球形场升高之和相同。 但是这些轨道中有的比球形 场高,有的比球形场低。
Y
称为分裂能,八面体场中称为 △O 。
能级计算:
自由离子 E0
Es = 0Dq 球形场
d x 2- y 2 d z 2
二重简并 dγ 或 eg
6Dq Δ 0=10Dq
-4Dq
三重简并
d xy d xz d yz 八面体场
dε 或 t2g
分裂能Δo = Eeg-Et2g = 10Dq (1)
根据量子力学原理,在外界电场作用下产生的d轨道分 裂前后,其总能量应保持不变,得:
2Eeg+3Et2g = 0
(2)
联合(1)与(2)方程,解得
Eeg=6Dq Et2g=-4Dq
⑵ 正四面体场
坐标原点为正四面体的中心,三轴沿三边方向伸展 ,4 个配
体的如图所示,形成电场。
Z
在正四面体场中,dx2 – y2 、d z2 ,
大学无机化学配位化合物PPT课件

② 配位原子:直接与中心原子以配位键相连的原子。
通常是电负性较大的原子,如C、N、O、X和S。
③ 单齿配体:配体中只含一个配位原子。
如:X--、S2--、H2O、NH3、CO、CN--等。
④ 多齿配体:配体中含两个或更多的配位原子。如
C2O42-、氨基乙酸根、乙二胺、乙二胺四乙酸根(edta)。
N**H2-CH2-COO-*, N*H2-CH2-CH2-NH2 (en)
第11页/共38页
二、配键和配位化合物分类
1. 外轨型配合物
中心原子是用最外层的ns、np或ns、np、nd组成
的杂化空轨道接受电子,与配体形成配位键.
例:[FeF6]3--中Fe3+:3d5
↑↑↑↑↑ _ _ _ _ _ _ __ _
3d
4s 4p
4d
sp3d2杂化,八面体构型
第12页/共38页
d2sp3
6
Fe (CN)63-,Co(NH3)6
第18页9.3.1 配合物的稳定常数 9.3.2 影响配合物稳定性的因素
(自学) 9.3.3 配位平衡的移动
第19页/共38页
9.3.1 配合物的稳定常数
一、配合物的稳定常数 (K稳)
Cu2+ + 4NH3 = Cu(NH3)42+ K稳
3d
d2 sp3 杂化轨道
内轨型配合物,低自旋 µ = 0 第16页/共38页
CoF63– , Co3+: 3d6
4d 4p 4s 3d
sp3d2杂化 3d
sp3d2 杂化轨道
外轨型配合物,高自旋 µB.M. 正八面体构型
第17页/共38页
三、 杂化轨道形式与配合物的空间构型
通常是电负性较大的原子,如C、N、O、X和S。
③ 单齿配体:配体中只含一个配位原子。
如:X--、S2--、H2O、NH3、CO、CN--等。
④ 多齿配体:配体中含两个或更多的配位原子。如
C2O42-、氨基乙酸根、乙二胺、乙二胺四乙酸根(edta)。
N**H2-CH2-COO-*, N*H2-CH2-CH2-NH2 (en)
第11页/共38页
二、配键和配位化合物分类
1. 外轨型配合物
中心原子是用最外层的ns、np或ns、np、nd组成
的杂化空轨道接受电子,与配体形成配位键.
例:[FeF6]3--中Fe3+:3d5
↑↑↑↑↑ _ _ _ _ _ _ __ _
3d
4s 4p
4d
sp3d2杂化,八面体构型
第12页/共38页
d2sp3
6
Fe (CN)63-,Co(NH3)6
第18页9.3.1 配合物的稳定常数 9.3.2 影响配合物稳定性的因素
(自学) 9.3.3 配位平衡的移动
第19页/共38页
9.3.1 配合物的稳定常数
一、配合物的稳定常数 (K稳)
Cu2+ + 4NH3 = Cu(NH3)42+ K稳
3d
d2 sp3 杂化轨道
内轨型配合物,低自旋 µ = 0 第16页/共38页
CoF63– , Co3+: 3d6
4d 4p 4s 3d
sp3d2杂化 3d
sp3d2 杂化轨道
外轨型配合物,高自旋 µB.M. 正八面体构型
第17页/共38页
三、 杂化轨道形式与配合物的空间构型
无机化学 配位化合物 ppt课件

配合物与我们的生命活动息息相关。人体中 的酶、微量元素等,都是以配合物的形式存在并 控制着体内极其重要的化学作用。
人体必需的微量元 素:锌、碘、硒、 铜、氟、钼、镉、 镍、钒、锡、砷、
酶 钴、锰、锶等。
临床使用的药物中配合物相当普遍
顺铂
含钴维生素B12
枸橼酸钠
再如体内氧气的存储与运输,也是借助于 血红素与氧分子的配合来完成的。
[Cu(NH3)4] SO4
中心 原子
配体
H3N
Cu
H3N
NH3SBiblioteka 4NH3配位单元,或内界
外界
书1.总写体时来,说内配界合用物方是括由号配框位住单,元是(配内合界物)和 的与核内心界部带分相,反方电括荷号的以外外界的两部大分部为分外组界成。
H3N
Cu
H3N
NH3
SO4
NH3
内界(正/负电荷) 外界(负/正电荷)
获1913年诺贝尔化学奖
1893年苏黎世大学维尔纳 (Werner A)教授对这类化 合物本性提出了天才见解, 被后人称为维尔纳配位学 说,成为配位化学的奠基 人。维尔纳因此而获得 1913年诺贝尔化学奖。
维尔纳 (Werner, A, 1866-1919)
配位化学的奠基人—维尔纳
配位化学是当今化学学科的前沿领域之一, 配合物在医疗、药物、分离分析、染料、化学合 成等诸多方面具有极为广泛的应用。
具体问题具体分析!
单齿配体:配位数=配体的数目
[Co(NH3)6]3+
CO与铁的配位能力是氧气的200-300倍,
极易形成碳氧血红蛋白,使血红素丧失携氧能 力碳,氧而血造红成蛋组织白窒息,甚至引起死亡。
• CO浓度>30mg/m3
《晶体场理论》课件

晶体结构与物理性质的实验测量
03
通过实验测量可以获得晶体的各种物理性质数据,如通过硬度测试了解晶体的机械性能,通过电导率测试了解晶体的导电性能等。
03
CHAPTER
晶体场理论的基本概念
晶体场中电子由于受到周期性势场作用而产生的能级分裂,产生的能量差值即为晶体场稳定化能。
晶体场稳定化能
晶体场分裂能
随着晶体场强度的增加,分裂能级的间距逐渐增大。
强晶体场中分裂能级较为稳定,弱晶体场中分裂能级不稳定。
在晶体场作用下,电子云会发生变形,以适应周围势场的分布。
电子云变形
光谱线分裂
磁有序现象
化学键合作用
由于晶体场作用,光谱线会分裂成多个子线,子线的数目和位置取决于晶体场的对称性和强度。
在强晶体场中,由于电子自旋和轨道磁矩的相互作用,可导致磁有序现象的出现。
常用的数值计算方法包括有限差分法、有限元法、蒙特卡洛方法等。这些方法可以根据具体问题选择合适的数值计算方法,以获得更准确的结果。
05
CHAPTER
晶体场理论的应用
磁性材料设计
利用晶体场理论预测和解释不同材料的磁学性质,为磁性材料的设计和优化提供理论支持。
催化剂设计
通过晶体场理论模拟催化剂的电子结构和活性位点,优化催化剂的性能,提高化学反应效率。
晶体场效应
由于晶体场作用导致能级分裂的能量差值,反映了晶体场对电子的束缚强弱。
晶体场对电子的相互作用和影响,包括电子云变形和能级分裂等。
03
02
01
能级分裂类型
分裂能级数量
分裂能级间距
分裂能级的稳定性
01
02
03
04
根据晶体场强度和对称性,能级分裂可分为弱场分裂、中等强度场分裂和强场分裂。
03
通过实验测量可以获得晶体的各种物理性质数据,如通过硬度测试了解晶体的机械性能,通过电导率测试了解晶体的导电性能等。
03
CHAPTER
晶体场理论的基本概念
晶体场中电子由于受到周期性势场作用而产生的能级分裂,产生的能量差值即为晶体场稳定化能。
晶体场稳定化能
晶体场分裂能
随着晶体场强度的增加,分裂能级的间距逐渐增大。
强晶体场中分裂能级较为稳定,弱晶体场中分裂能级不稳定。
在晶体场作用下,电子云会发生变形,以适应周围势场的分布。
电子云变形
光谱线分裂
磁有序现象
化学键合作用
由于晶体场作用,光谱线会分裂成多个子线,子线的数目和位置取决于晶体场的对称性和强度。
在强晶体场中,由于电子自旋和轨道磁矩的相互作用,可导致磁有序现象的出现。
常用的数值计算方法包括有限差分法、有限元法、蒙特卡洛方法等。这些方法可以根据具体问题选择合适的数值计算方法,以获得更准确的结果。
05
CHAPTER
晶体场理论的应用
磁性材料设计
利用晶体场理论预测和解释不同材料的磁学性质,为磁性材料的设计和优化提供理论支持。
催化剂设计
通过晶体场理论模拟催化剂的电子结构和活性位点,优化催化剂的性能,提高化学反应效率。
晶体场效应
由于晶体场作用导致能级分裂的能量差值,反映了晶体场对电子的束缚强弱。
晶体场对电子的相互作用和影响,包括电子云变形和能级分裂等。
03
02
01
能级分裂类型
分裂能级数量
分裂能级间距
分裂能级的稳定性
01
02
03
04
根据晶体场强度和对称性,能级分裂可分为弱场分裂、中等强度场分裂和强场分裂。
无机化学课件-配合物

第一节配合物的组成、命名 和异构现象
一、配合物的组成
adding NamaOmHonia
[CCCPourmue(CS(NcpOouilHlpeHSuix3Ott)ia24o4t]niSoOn4
CuSO4(s)+4H2O = [Cu(H2O)4]2+ +SO42-
无色
天蓝色
[Cu(H2O)4]2+ +4NH3 = [Cu(NH3)4]2++4H2O
[Fe(CN)6]3-、[Co(NH3)6]3+
2.外轨配合物和内轨配合物
外轨配合物(outer-orbital coordination compound) :中心原子全部用最外层 价电子空轨道(ns、np、nd)进行杂化 成键所形成的配合物 。
杂化类型 sp sp2 sp3 sp3d2
配位数 2 3 4 6
3.实例 ⑴如[Ag(NH3)2]2+:Ag+的价电子结构为:
其中4d轨道以全充满,而5s、5p轨道是全空的。 当它和NH3分子形成配离子时,一个s和一个p 轨道先进行杂化(sp杂化),形成的两个sp杂 化轨道互成180°,两个NH3分子中N的原子轨 道分别从这两个方向与sp杂化轨道重叠,形成 了直线型的配离子。成键情况可用下式表示:
⑵配体的电荷增大,虽然增大了中心原子对 配体的吸引力,但也大大地增大了配体之 间的斥力,结果反而使配位数减小。例如 [Co(H2O)6]3+和[CoCl4]2-,[Zn(NH3)6]2+和 [Zn(CN)4]2-等。
⑶中心原子半径越大、配体体积越小,中心 原子周围所能容纳的配体就越多,配位数 就越大。例如,Al3+的半径大于B3+的半径, 它 的半们径与小F-分于别Cl形-的成,[ACllF-和6]A3-和l3+[则BF形4]成-;[A再lC如l4F]--。 中心原子半径大,固然有利于容纳更多的 配体,但若过大又会减弱与配体的吸引力, 因而有时反而降低了配位数。
第16讲 配合物的晶体场理论

第五章 配位化合物的化学键理论
分裂后d轨道中电子的排布—高自旋态和低自旋态 二、 分裂后d轨道中电子的排布 高自旋态和低自旋态 d轨道分裂前:在自由金属离子中,5个d轨道是简并的,电子的排 布按洪特规则分占不同轨道,且自旋平行,有唯一的一种排布方 式。 d轨道分裂后:在络合物中,金属离子的d电子排布将有两种情况: 高自旋态排布和低自旋态排布,这与分裂能 成对能 分裂能和成对能 分裂能 成对能的大小有关。
第五章 配位化合物的化学键理论
dz2, d(x2-y2)
eg
6Dq
10Dq Es
自由离子d轨道 球形场
dxz,dxy,dyz
4Dq
t2g
d轨道在Oh场中轨道能级的分裂图 可见 在八面体场中,d轨道分裂的结果是:与Es相比,eg 轨道能量上升了6Dq,而t2g轨道能量下降了4Dq.
第五章 配位化合物的化学键理论
第五章 配位化合物的化学键理论
(5)分裂能与紫外光谱 )
(a)电磁波的名称及波长范围
第五章 配位化合物的化学键理论
(b)d-d跃迁
dz2, d(x
2
-y )
2
eg
6Dq
d-d跃迁
10Dq
4Dq
Es
自由离子d轨道 球形场
dxz,dxy,dyz
t2g
d轨道在Oh场中轨道能级的分裂图
∆Ed − d = ∆分裂能 ≃ 近紫外区和可见光区的光能
3.分裂后d 3.分裂后d轨道中电子的排布 分裂后
电子在分裂后d轨道中的排布与△和P的相对大小有关。 如:对于d2组态,有两种排布方式:
△ (a) (b)
△
第五章 配位化合物的化学键理论
△ (a)
无机化学第八章配合物

无机化学第八章配合物
• 配合物概述 • 配合物的分类 • 配合物的化学键理论 • 配合物的合成与分离 • 配合物的重要应用
01
配合物概述
配合物的定义
配合物的定义
配合物是由金属离子或原子与一定数目的配位体 通过配位键结合形成的复杂化合物。
配位体
配位体是提供电子对与中心金属离子形成配位键 的分子或离子。
晶体场分类
根据配位体对中心原子的 作用方式,可分为正八面 体场、正四面体场、平面 正方形场等。
晶体场理论的应用
解释配合物的磁性和光谱 性质,预测配合物的稳定 性。
分子轨道理论
分子轨道定义
配合物分子中电子的能量状态,由中心原子和配位体的原子轨道 线性组合而成。
分子轨道分类
根据电子填充情况,可分为成键轨道和反键轨道。
色谱分离法
利用色谱柱对不同配合物的吸附能力不同, 实现配合物的分离。
配合物的纯度鉴定
物理性质检测
通过测定配合物的熔点、沸点、 密度、折光率等物理性质,与标 准值进行比较,判断配合物的纯 度。
元素分析
通过测定配合物中各元素的含量, 与理论值进行比较,判断配合物 的纯度。
谱学分析
利用红外光谱、核磁共振谱、质 谱等谱学手段对配合物进行结构 分析,判断配合物的纯度。
03
配合物的化学键理论
配位键理论
配位键定义
配位键的特点
一个原子提供空轨道,另一个原子提 供孤对电子,两者之间形成的共价键。
具有方向性和饱和性,通常比较稳定。
配位键的形成
中心原子提供空轨道,配位体提供孤 对电子,通过配位键与中心原子结合。
晶体场理论
晶体场定义
配合物晶体中中心原子周 围的配位体所形成的场。
• 配合物概述 • 配合物的分类 • 配合物的化学键理论 • 配合物的合成与分离 • 配合物的重要应用
01
配合物概述
配合物的定义
配合物的定义
配合物是由金属离子或原子与一定数目的配位体 通过配位键结合形成的复杂化合物。
配位体
配位体是提供电子对与中心金属离子形成配位键 的分子或离子。
晶体场分类
根据配位体对中心原子的 作用方式,可分为正八面 体场、正四面体场、平面 正方形场等。
晶体场理论的应用
解释配合物的磁性和光谱 性质,预测配合物的稳定 性。
分子轨道理论
分子轨道定义
配合物分子中电子的能量状态,由中心原子和配位体的原子轨道 线性组合而成。
分子轨道分类
根据电子填充情况,可分为成键轨道和反键轨道。
色谱分离法
利用色谱柱对不同配合物的吸附能力不同, 实现配合物的分离。
配合物的纯度鉴定
物理性质检测
通过测定配合物的熔点、沸点、 密度、折光率等物理性质,与标 准值进行比较,判断配合物的纯 度。
元素分析
通过测定配合物中各元素的含量, 与理论值进行比较,判断配合物 的纯度。
谱学分析
利用红外光谱、核磁共振谱、质 谱等谱学手段对配合物进行结构 分析,判断配合物的纯度。
03
配合物的化学键理论
配位键理论
配位键定义
配位键的特点
一个原子提供空轨道,另一个原子提 供孤对电子,两者之间形成的共价键。
具有方向性和饱和性,通常比较稳定。
配位键的形成
中心原子提供空轨道,配位体提供孤 对电子,通过配位键与中心原子结合。
晶体场理论
晶体场定义
配合物晶体中中心原子周 围的配位体所形成的场。
无机化学 配位化合物的晶体场理论 PPT课件

一般来讲中心离子电荷数高,中 心与配体距离近,则作用强,△ 大。
中心原子所在的周期数对此也 有影响,例如第四周期过渡元素为 中心的配位化合物,其 △ 小,第 五、六周期的 △ 相对大些。
最有实际意义和理论意义的影 响因素是配体的影响。
在其他条件相同的情况下,配体 对于分裂能的影响由小到大的次序是
四面体电场的分裂能表示为 △t
dxy dxz dyz
d x2- y2
(d )
Δt
(d )
dz2
显然两组轨道的能量差别较小。
Δo
Δt
正八面体场
正四面体场
△t 远小于 △o
3. 正方形场 坐标原点位于正方形中心,坐标轴 沿正方形对角线方向伸展。
x
y
4 个配位原子位于正方形的 顶点,形成正方形电场。
+-
-+ x
+-
-+ y
+-
y
-
+
+x
-
d x2-y2
当原子处于电场中时,受到电 场的作用,轨道的能量要升高。
若电场是球形对称的,各轨道 受到电场的作用一致。
故在球形电场中,各 d 轨道 能量升高的幅度一致。
球形场中
自由原子
所以在球形电场中,5 种 d 轨道能量仍旧简并。
球形场中
自由原子
若原子处于非球形电场中,则根 据电场的对称性不同,各轨道能量升 高的幅度可能不同。
球形场中
d x2- y2 dz2
自由原子
dxy dxz dyz
正八面体场中
dxy, dxz, dyz 轨道在 光谱学中统称 d 轨道。
球形场中
d x2- y2
dz2
中心原子所在的周期数对此也 有影响,例如第四周期过渡元素为 中心的配位化合物,其 △ 小,第 五、六周期的 △ 相对大些。
最有实际意义和理论意义的影 响因素是配体的影响。
在其他条件相同的情况下,配体 对于分裂能的影响由小到大的次序是
四面体电场的分裂能表示为 △t
dxy dxz dyz
d x2- y2
(d )
Δt
(d )
dz2
显然两组轨道的能量差别较小。
Δo
Δt
正八面体场
正四面体场
△t 远小于 △o
3. 正方形场 坐标原点位于正方形中心,坐标轴 沿正方形对角线方向伸展。
x
y
4 个配位原子位于正方形的 顶点,形成正方形电场。
+-
-+ x
+-
-+ y
+-
y
-
+
+x
-
d x2-y2
当原子处于电场中时,受到电 场的作用,轨道的能量要升高。
若电场是球形对称的,各轨道 受到电场的作用一致。
故在球形电场中,各 d 轨道 能量升高的幅度一致。
球形场中
自由原子
所以在球形电场中,5 种 d 轨道能量仍旧简并。
球形场中
自由原子
若原子处于非球形电场中,则根 据电场的对称性不同,各轨道能量升 高的幅度可能不同。
球形场中
d x2- y2 dz2
自由原子
dxy dxz dyz
正八面体场中
dxy, dxz, dyz 轨道在 光谱学中统称 d 轨道。
球形场中
d x2- y2
dz2
-配合物理论简介(上课用)PPT课件

Fe(SCN)3 2021 [Ni(CO)4]
16
(4)多配体配合物,配位数等于配体数数量之和。
K[PtCl5(NH3)] [Co(NH3)4Cl2]Cl (5)常见的中心离子:
过渡金属原子或离子:Fe Co Ni Cu Zn等
常见的配体: NH3 X- CN SCN- H2O
(6)配位数与中心离子电荷数的关系
叶绿素结构示意图
2021
1
第二节 分子的立体结构
四、配合物理论简介
宁夏育才中学勤行学区
高二化学组
李丽
为什么CuSO4 •5H2O晶体是蓝 色而无水CuSO4 是白色?
CuSO4•5H2O
实验探究[2—1]
向盛有固体样品的试管中,分别加1/3试管
水溶解固体,观察实验现象并填写下表
固体
溶液 颜色
CuSO4
完全电离出外界离子和内界配离子,但内界配
离子电离程度很小。
[Ag(NH3)2]OH K3[Fe(CN)6] [Co(NH3)4Cl2]Cl
注意:电离方程式的书2写021。
18
(3)形成配合物前后性质的改变
①颜色的改变 [实验2-3]在盛有氯化铁溶液(或任何含有的Fe3+溶 液)的试管中滴加硫氰化钾(KSCN)溶液。
(2) 配合物的组成
内界 外界 配离子
[Cu(NH3)4] SO4
中心离子 配体 配位数
配合物
中心原子或离子 内界(配离子) 配体
配位数
外界
2021
配位原子
13
内界 外界 配离子
[Cu(NH3)4] SO4
中心原子 配位体 配位数
①中心原子:也称配位体形成体,是电子对 接受体,一般是金属离子,特别是过渡金 属离子。特点:有空轨道。
无机化学晶体结构PPT课件

1913年英国物理学家布喇格父子在劳厄发现的基础上,不 仅成功地测定了NaCl、KCl等的晶体结构,并提出了作为 晶体衍射基础的著名公式──布喇格定律:
2d sinθ=nλ
CHENLI
14
15
CHENLI
15
晶体X-射线衍射图
16
CHENLI
16
17
CHENLI
17
晶胞参数
18
晶系: Monoclinic
33
半径比规则(2)
以正、负离子配位数为6的晶体的一层为例
令r- = 1,则ac=4;ab=bc=2r+ + 2
因ab2+bc2=ac2r+ =0.414;即r+/r- =0.414 a
b
c
正离子 负离子
CHENLI
33
半径比规则(3)
当r+/r- 0.414时,负离子接触,正、负离子 彼此不接触。体系的排斥力大于吸引力,该 构型不稳定,趋向于形成配位数少的构型。
直线点阵
空间点阵 空间格子
平面点阵
(晶格)
平面格C子HENLI
19
20
3-1 晶体的微观性质(2)
晶胞
在晶格中,能表现出其结构一切特征的最小部分称为 晶胞。晶胞是充分反映晶体对称性的基本结构单位, 其在三维空间有规则地重复排列便组成了晶格(晶 体)。
结点
晶格
晶胞(平行六面体)
CHENLI
20
21
多晶体
由多个单晶体颗粒杂乱地聚结而成 的晶体,由于单晶体的杂乱排列, 使晶体的各向异性消失。
晶界
CHENLI
26
27
3-3 晶体的基本类型
无机化学 配合物 晶体场理论超级详细 超级好
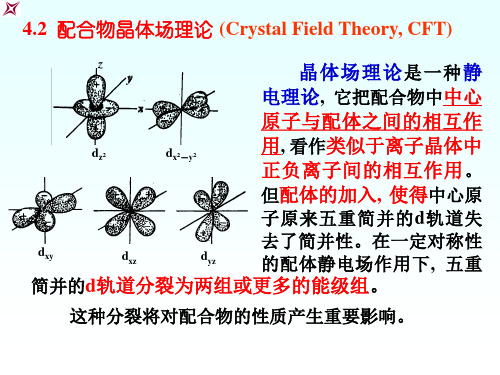
4.2 配合物晶体场理论 (Crystal Field Theory, CFT)
z
y
dz2
dx2-y2
晶体场理论 是一种 静 电理论, 它把配合物中中心 原子与配体之间的相互作 用, 看作类似于离子晶体中 正负离子间的相互作用 。 但配体的加入, 使得中心原
dyz
ห้องสมุดไป่ตู้dxy
dxz
子原来五重简并的 d 轨道失 去了简并性。在一定对称性 的配体静电场作用下 , 五重
该化学序代表了配体场的强度顺序。由此顺序可见, 对同一金属离子, 造成△值最大的是CN-离子, 最小的是I- 离子,通常把 CN - 、 NO 2 - 等离子称作 强场配位体 , I - 、 Br-、F-离子称为弱场配位体。
须指出的是, 上述配体场强度顺序是纯静电理论 所不能解释的。例如OH-比H2O分子场强度弱, 按静 电的观点OH-带了一个负电荷, H2O不带电荷, 因而 OH - 应该对中心金属离子的 d 轨道中的电子产生较 大的影响作用, 但实际上是OH-的场强度反而低, 显 然这就很难纯粹用静电效应进行解释。这说明了
HS
CSFE对dn的双峰曲线
既然 CFSE 引起附加成键效应,那么这种附加成 键效应及其大小必然会在配合物的热力学性质上表现 出来。
CFSE对配合物性质的影响
晶体场理论的核心是配位体的静电场与中心离子的作 用所引起的 d 轨道的分裂和 d 电子进入低能级轨道带来的稳 定化能使体系能量下降,从而产生一种附加成键作用效应。
由右图可以发现,在正八 面体弱场高自旋(HS)中, CFSE 的曲线呈现“反W”形或“双峰 ”形状, 三个极小值位于d0、d5 、d10处,两个极大值出现在d3 和d8处,而在强场低自旋(LS)中 , 曲线呈“V”形, 极小值为d0和 d10,极大值为d6。 LS
z
y
dz2
dx2-y2
晶体场理论 是一种 静 电理论, 它把配合物中中心 原子与配体之间的相互作 用, 看作类似于离子晶体中 正负离子间的相互作用 。 但配体的加入, 使得中心原
dyz
ห้องสมุดไป่ตู้dxy
dxz
子原来五重简并的 d 轨道失 去了简并性。在一定对称性 的配体静电场作用下 , 五重
该化学序代表了配体场的强度顺序。由此顺序可见, 对同一金属离子, 造成△值最大的是CN-离子, 最小的是I- 离子,通常把 CN - 、 NO 2 - 等离子称作 强场配位体 , I - 、 Br-、F-离子称为弱场配位体。
须指出的是, 上述配体场强度顺序是纯静电理论 所不能解释的。例如OH-比H2O分子场强度弱, 按静 电的观点OH-带了一个负电荷, H2O不带电荷, 因而 OH - 应该对中心金属离子的 d 轨道中的电子产生较 大的影响作用, 但实际上是OH-的场强度反而低, 显 然这就很难纯粹用静电效应进行解释。这说明了
HS
CSFE对dn的双峰曲线
既然 CFSE 引起附加成键效应,那么这种附加成 键效应及其大小必然会在配合物的热力学性质上表现 出来。
CFSE对配合物性质的影响
晶体场理论的核心是配位体的静电场与中心离子的作 用所引起的 d 轨道的分裂和 d 电子进入低能级轨道带来的稳 定化能使体系能量下降,从而产生一种附加成键作用效应。
由右图可以发现,在正八 面体弱场高自旋(HS)中, CFSE 的曲线呈现“反W”形或“双峰 ”形状, 三个极小值位于d0、d5 、d10处,两个极大值出现在d3 和d8处,而在强场低自旋(LS)中 , 曲线呈“V”形, 极小值为d0和 d10,极大值为d6。 LS
无机化学配合物课件

内界(配离子)
外界
[ Co (NH3) 6 ] Cl3 配位数
中心离子 配体
内外界是离子键结合,在水中能全部离解。
(二)中心原子
在配位单元中,接受孤对电子的的阳离子或原子 称为中心原子。中心原子位于配位单元的中心位置, 是配位单元的核心部分。
中心原子一般是金属离子,特别是副族元素的离 子;此外,某些副族元素的原子和高氧化数的非金属 元素的原子也是比较常见的中心原子。
1. 配合单元的空间结构
当配位体在中心原子周围配位时,为了减小配体(尤 其是阴离子配位体)之间的静电排斥作用,以达到能量上 的稳定状态,配位体要互相尽量远离,因而在中心原子 周围采取对称分布的状态。
2 :直线形; 3 :平面三角形; 4 :四面体,平面正方形; 5 :三角双锥,正方锥形; 6: 正八面体
命名时一般有如下命名顺序:
配位数—配位体—“合”—中心原子—
中心原子 氧化数
一、二…
➢先离子后中性分子
➢先无机配体后有机配体
➢同类配位体:以配位原 子元素英文字母排序
➢同配体同配位原子:先 少原子配体后多原子
以罗马数 ⅠⅡⅢ表 示
例如:配合物命名
[Cu(NH3)4]SO4 [PtCl(NO2)(NH3)4]CO3
有些配体虽然也具有两个或多个配位原子,但在 一定条件下仅有一种配位原子与金属配位,这类配位 体叫两可配位体,如SCN,以S配位;异硫氰NCS, 以N配位。
配位化合物内界中的配位体可以是同类,也可以 不同,如[Co(NH3)6Cl3],RuHCl(CO)(PPh3)3。
配位原子绝大部分是含有孤对电子的非金属原子, 如卤素、O、S、N、P、C等,但有的没有孤电子对 的配体都能提供出其π键上的电子,如CH2=CH2、二 茂铁,等。
相关主题
