胃康宁片中间体内控标准
07化学药品、抗生素中间产品企业质量标准
西药制剂中间产品企业质量标准
日期:修订人/日期:
日期:批准人/日期:
的:建立一个西药制剂中间产品企业质量标准,以确保下述产品质量。
围:西药制剂中间产品。
布洛芬片中间产品质量标准
【布洛芬片颗粒】
项目标准
(1)性状应为白色颗粒及粉末。
(2)水份5%以下
(3)含量含布洛芬应为75.78%~80.47%。
文件编号:ZZ/SMP/ZJP/001/05/NW01
中药片剂中间产品内包装企业质量标准
【中药片剂内包装】
项目标准
(1)铝塑严密性铝塑严密完整。
(2)每板片数不短缺,片形完整。
文件编号:ZZ/SMP/ZJP/001/05/NW02 中药胶囊剂中间产品内包装企业质量标准
【中药胶囊剂内包装】
项目标准
(1)铝塑严密性铝塑严密完整。
(2)每板粒数不短缺,囊形完整。
文件编号:ZZ/SMP/ZJP/001/05/NW02 中药片剂、胶囊剂中间产品内包装企业质量标准
【中药片剂、胶囊剂外包装】
项目标准
(1)说明书、小盒品名、批号、规格应相符。
(2)每件每盒制剂数量要正确,装箱单、合格证齐全。
安胃片方案

类别:工艺验证安胃片生产工艺验证方案版次:□新订□替代:起草:年月日审阅会签:(验证领导小组)批准:年月日实施日期:年月日1、目的为评价安胃片主处方和生产工艺规程(草案)的可行性和重现性,以及生产系统要素和生产过程中可能影响产品质量的各种生产工艺变化因素,特根据GMP要求制定本验证方案,对其整个生产过程进行验证,以保证在正常的生产条件下,生产出质量合格、均一、稳定的安胃片。
验证过程应严格按照本方案规定的内容进行,若因特殊原因确需变更时,应填写验证方案变更申请及批准书(附件1),报验证领导小组批准。
2、范围本验证方案适用于在本方案指定的厂房、设施、设备、工艺条件下安胃片的生产,当上述条件改变时,应重新验证。
3、职责3.1 验证领导小组组长:袁长海成员:赵忠孝、张国营、李东红、蔡慧侠、张潼帆3.1.1 负责验证方案的审批。
3.1.2 负责验证的协调工作,以保证本验证方案规定项目的顺利实施。
3.1.3 负责验证数据及结果的审核。
3.1.4 负责验证报告的审批。
3.1.5 负责发放验证证书。
3.1.6 负责再验证周期的确认。
3.2 质量部3.2.1 负责拟定验证方案。
3.2.2 负责取样及对样品的检验。
3.2.3 负责收集各项验证、试验记录,并对试验结果进行分析后,起草验证报告,报验证小组。
3.3 生产部3.3.1 负责验证方案的实施。
3.3.2 负责设备的操作。
3.4 工程部3.4.1 负责厂房与设施的验证。
3.4.2 负责厂房与设施的维护与检修。
3.4.3 负责仪器、仪表、量具等的校正3.5 验证小组成员由以上各部门相关人员参加。
组长:李东红组织协调、监督验证过程、起草验证报告。
成员:金晓帆、李晓安、王晓维、李晓丽、杨富强、王礼学、陈美娟4、有关背景材料4.1 产品概况4.1.1 产品名称:安胃片(Anwei Pian)。
4.1.2 剂型:片剂。
4.1.3 性状:本品为类白色至淡黄色的片;气微、味涩、微苦。
中间体内控质量标准
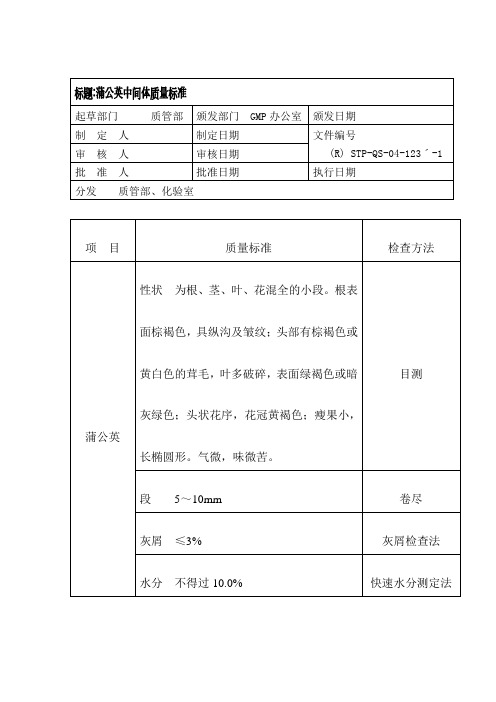
起草部门 制 定 审 核 批 准 分发 人 人 人
质管部
颁发部门 制定日期 审核日期 批准日期
GMP 办公室
颁发日期 文件编号 (R) STP-QS-04-136ˊ-1 执行日期
质管部、化验室
项 目
质量标准 性状 为卵圆锥形或扁圆锥形, 由多数小核 果聚合而成,长 0.6~1.3cm,直径 0.5~ 1.2cm。表面黄绿色或淡棕色,上端钝圆,
盐沙苑子
微有咸味。 水分 不得过 7.0% 快速水分测定法
起草部门 制 定 审 核 批 准 分发 人 人 人
质管部
颁发部门 制定日期 审核日期 批准日期
GMP 办公室
颁发日期 文件编号 (R) STP-QS-04-133ˊ-1 执行日期
质管部、化验室
项 目
质量标准 性状 呈蝶形。 种皮三面延长成宽大菲薄的 翅,长 5~8cm,宽 3.5~4.5cm。淡黄白色, 半透明,有绢丝样光泽,上有放射状纹理,
诃子 质坚实。果肉黄棕色或黄褐色。果核 1 枚, 浅黄色, 粗糙,坚硬。气微,味酸涩而后甜。 水分 不得过 11.0% 性状 为不规则粒块状,肉厚 2~4mm。为 诃子肉 深褐色或黄褐色, 稍有酸气, 味酸涩而后甜。 水分 不得过 11.0% 性状 形同诃子肉,表面焦黄色,质坚脆易 炒诃子肉 碎,断面黄褐色。微有香气,味涩。 水分 不得过 10.0% 快速水分测定法 快速水分测定法 目测 快速水分测定法 目测
颁发日期 文件编号 (R) STP-QS-04-126ˊ-1 执行日期
质管部、化验室
项 目
质量标准
检查方法
性状 为聚花果,由多数小瘦果集合而成,
长圆形,长 1~2cm,直径 0.5~0.8cm。黄 棕色、棕红色至暗紫色。小瘦果卵圆形,稍 桑椹 扁,长约 2mm,外具肉质花被片 4 枚。气 微,味微酸而甜。 目测
胃康宁片中间体检验操作规程

胃康宁片中间体检验操作规程一、范围:本标准规定了胃康宁片中间体的检验方法和操作要求;适用于本公司胃康宁片中间体的质量检验。
二、引用标准:企业内控标准三、质量指标:四、试剂1、盐酸液(0.1mol/L,1→2,稀)2、活性炭、磺化钾3、溴酚蓝指示数,苯肼硫羰偶氮苯指示液,淀粉指示液4、氢氧化钠滴定液(0.1mol/L)5、(0.5mol/L)EDTA-2Na滴定液6、醋酸-醋酸铵缓冲液(PH:4.5)7、锌滴定液(0.05mol/L)8、乙醇(95%,50%)9、(0.01667mol/L)重铬酸钾滴定液10、硫代硫酸钠滴定液(0.1mol/L)五、仪器与用具1、具塞锥形瓶(250ml)2、容量瓶(100ml)3、烧杯(150ml)4、3号垂熔漏斗5、抽滤装置1套6、移液管(20ml,25mo,50ml,100ml)7、滴定管(25ml)8、电热恒温干燥箱六、操作步骤:1、性状:本品为黄色颗粒2、外观:目测,粗细颗粒均匀3、干燥失重:取本品约1.00g~2.00g于105℃干燥4h,减失重量应控制在2.0%~12.0%4、制酸力:4.1 测定方法:取颗粒若干,研细,精密称取适量(约相当于硫糖铝0.5g)置250ml具塞锥形瓶中,精密加(0.1mol/L)盐酸液100ml,密塞,在 37℃水俗中不断振摇1h,放冷至室温,滤过,滤液加活性炭0.2g,振摇,滤过,弃去初滤液,精密量取续滤液50ml,加溴酚蓝指示液数滴,用氢氧化钠滴定液(0.1mol/L)滴定,每片消耗(0.1mol/L)盐酸滴定液不得少于20ml。
4.2 计算公式:(V空白—V检品)×F×理论片制酸力(ml/片) = ———————————————Ms×0.5V空白:空白耗滴定液的体积数(ml);V检品:供试品耗滴定液的体积数(ml);F:滴定液的浓度换算值;Ms:供试品的质量(g)5、含量测定5.1 铝5.1.1 原理:加过量的乙二胺四醋酸二钠滴定液,用锌滴定液回滴,滴定终点:自黄色转变为橙红色。
制药厂GMP原辅料和成品检验操作规程

制药有限公司 GMP 管理文件
题目 阿魏酸哌嗪片(保肾康片)检验操作规程 GMP 办 编码 TS0200100 审核 批 准 颁发数量 12 份 生效日期 办公室、质保部、总工办 共3页
制 定 颁发部门 分发单位
一、范围:本标准规定了阿魏哌嗪片(保肾康片)的检测方法和操作 要求; 适用于本公司阿魏哌嗪片(保肾康片)成品的质量检测。 二、引用标准:中华人民共和国药典(2000 片版二部) , (95)卫药标 字第 016 号。 三、质量指标: 法定标准 企业内控标准 本品为白色或类白色片 本品为白色或类白色片 片面光洁细腻、完整、色泽 片面光洁细腻、完整、色泽 外 观 均匀 均匀 鉴 别 (1) 、 (2)符合规定 (1) 、 (2)符合规定 重量差异 限度±7.5% ±6.5% 崩解时限 ≤15 分钟 ≤10 分钟 脆 碎 度 减失重量≤1% 减失重量≤1% 含 量 应为标准量的 90.0%~110.0% 应为标示量的 92.5%~107.5% ≤1000 个/g ≤500 个/g 微生 细菌数 物限 霉菌数 ≤100 个/g ≤80 个/g 度检 大肠杆 不得检出 不得检出 查 菌活螨 四、试剂 1、碳酸氢钠(AR 级) 2、铁氰化钾(AR 级) 3、汞(AR 级) 4、纯化水 五、对照品:阿魏酸哌嗪 指标名称 性 状
六、仪器与用具 1、紫外分光光度仪 2、棕色容量瓶(250ml,100ml) 3、移液管(5ml) 4、研钵 5、滤纸 七、操作步骤: 1、外观:目测片面光洁、完整,不得有粘冲,松片或裂片现象; 2、性状:本品为白色或类白色片; 3、鉴别: 3.1 取本品的细粉约 0.25g(相当于阿魏酸哌嗪 0.1g) ,加碳酸氢钠 0.9g,与水 5ml 使溶解,滤过,滤液加铁氰化钾试液 0.5ml 与汞 1 滴, 强力振摇 1 分钟,放置约 20 分钟,即缓缓显红色; 3.2 取含量测定项下的溶液,照分光光度法(见紫外分光光度法检验 操作规程)测定,在 287±2nm 和 310±2nm 的波长处有最大吸收,在 254 ±2nm 的波长处有最小吸收。 4、重量差异限度:见重量差异检查操作规程。 5、崩解时限:见崩解时限检查操作规程。 6、脆碎度:见片剂脆碎度检查操作规程。 7、含量测定: (避光操作,用棕色容量瓶) 。 7.1 原理:本品为芳香族具有不饱和结构的化合物,310±2nm 的波长 处有最大吸收,故可用紫外分光光度法测定其含量。 7.2 对照品溶液的制备:取经 80℃干燥至直恒重的阿魏酸哌嗪对照 品约 30mg,精密称定,量 250ml 容量瓶中,加水溶解并稀释至刻度,摇 匀,即得。 (每 1ml 中,含有阿魏酸哌嗪 0.12mg) ; 7.3 供试品溶液的制备:取本品 20 片,精密称量,研细,精密称取 约 65mg(相当于阿魏酸哌嗪 30mg) ,量 250ml 容量瓶中,加水在温水浴上 溶解,并稀释至刻度,摇匀,滤过,弃去初滤液,取续滤液作为供试品溶 液。 7.4 测定法: 精密量取对照品溶液与供试品溶液各 5ml, 分别置 100ml 容量瓶中,加水稀释刻度,摇匀,照分光光度法(见紫外分光光度法检验 操作规程)在 310±2nm 的波长处测定吸收率,计算,即得。
胃康宁片药品说明书

胃康宁片
药品名称:
通用名称:胃康宁片
英文名称:WEI KANG NING
成份:
本品含硫糖铝和盐酸小檗碱(盐酸黄连素)。
适应症:
理气消食,柔肝止痛。
用于气滞胃痛,嗳气吞酸,纳呆食少。
用法用量:
口服5片/次,3~4次/日,二餐间服用。
不良反应:
经临床使用证实,胃康宁片治疗慢性浅表性胃炎及慢性萎缩性胃炎,总有效率8 0%。
且服药期间,未发现不良反应,治疗过程中检查血常规、肝功能未发现异常。
部分病例经治疗的免疫球蛋白化验,未发现有改变。
禁忌:
对本品过敏者禁用。
注意事项:
妊娠B类。
出现便秘时可加服少量镁剂,治疗收效后应继续服用数月,以免复发。
贮藏:
密闭保存。
有效期:
暂无
标准文号:
国药准字Z20059014。
复方氨酚烷胺胶囊(快康胶囊)内控标准
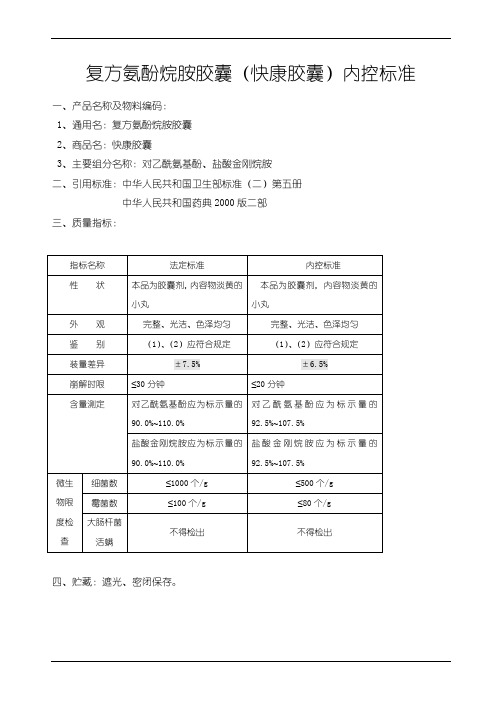
复方氨酚烷胺胶囊(快康胶囊)内控标准
一、产品名称及物料编码:
1、通用名:复方氨酚烷胺胶囊
2、商品名:快康胶囊
3、主要组分名称:对乙酰氨基酚、盐酸金刚烷胺
二、引用标准:中华人民共和国卫生部标准(二)第五册
中华人民共和国药典2000版二部
三、质量指标:
四、贮藏:遮光、密闭保存。
胃康宁片内控标准
一、产品名称及物料编码:
1、通用名:胃康宁片
2、主要组分名称:硫糖铝、盐酸小檗碱
3、物料编码:C03
二、引用标准:(94)湘卫药标字163号
中华人民共和国药典(2000年版二部)三、质量指标:
四、贮藏:遮光、密闭保存。
阿魏酸哌嗪片中间体内控标准
一、引用标准:阿魏酸哌嗪片(保肾康片)内控标准(编码:TS0310100)。
二、质量指标:。
制剂中间体控制标准和过程控制标准

制剂中间体控制标准和过程控制标准嘿,咱今儿就来唠唠制剂中间体控制标准和过程控制标准这档子事儿。
你说这制剂中间体就好比是咱做饭时候的半成品,这要是半成品质量不行,那最后做出来的菜能好吃吗?肯定不能呀!所以对制剂中间体的控制标准那可得严格把关,就像咱挑菜得挑新鲜的一样。
这标准要是松了,那后面的成品可就没法保证质量啦,那不是给自己找麻烦嘛!再说说这过程控制标准,就跟咱走路似的,得一步一步走稳了。
从原料的选取,到中间的生产环节,再到最后的成品包装,每个步骤都得按照标准来。
你想啊,如果中间有个步骤出了岔子,那不就跟走路摔了一跤一样,得费好大劲才能爬起来继续走。
而且,这过程控制标准还得灵活应变呢,不能死板板的。
就好比天气突然变了,咱得赶紧换衣服,不能还穿着大棉袄傻愣愣地杵在那儿吧。
咱举个例子哈,就说制药厂生产一种药。
那在生产过程中,对温度、湿度、压力这些都有严格要求吧。
要是温度高了或者低了,那药的效果可能就变了,那不就成了“假药”啦!这可不是闹着玩的呀!所以得时刻盯着这些指标,就跟看宝贝似的,不能有一点儿马虎。
还有啊,人员的操作也得规范。
你不能说随便来个人都能上岗操作机器,那可不行!得经过专业培训,就像学开车得先考驾照一样。
而且操作的时候还得认真负责,不能三心二意的。
万一不小心弄错了一个步骤,那可能整批药都得报废,这损失多大呀!咱老百姓买药不就是图个放心嘛,要是药的质量不行,那不是坑人嘛。
所以这制剂中间体控制标准和过程控制标准就是为了保证我们能用上安全有效的药。
这可不是小事儿呀,这关系到大家的健康呢!你想想,要是没有这些标准,那市场上的药不就乱套啦?各种质量参差不齐的药都有,那咱老百姓还敢买药吗?肯定不敢呀!所以说呀,这控制标准就是给我们老百姓吃下定心丸,让我们买药的时候能放心。
总之呢,制剂中间体控制标准和过程控制标准那是相当重要啊!这就好比是大楼的根基,根基不稳,大楼能盖得起来吗?咱可不能小瞧了它们,得认真对待,严格执行。
艾沙康唑侧链中间体c1质量标准

艾沙康唑侧链中间体c1质量标准艾沙康唑侧链中间体c1质量标准1. 前言在医药领域中,药物的质量标准一直是至关重要的。
艾沙康唑是一种广泛用于抗真菌治疗的药物,而其侧链中间体c1是其生产中的关键原料之一。
艾沙康唑侧链中间体c1的质量标准对于保证艾沙康唑药物的质量和疗效具有重要意义。
2. 国际标准概述根据国际医药行业的标准,艾沙康唑侧链中间体c1的质量标准主要包括以下几个方面:2.1 纯度要求艾沙康唑侧链中间体c1的纯度应达到国际药典规定的最低要求,通常要求在99%以上。
高纯度的中间体c1能够保证艾沙康唑制剂的最终纯度和稳定性,从而确保药物疗效。
2.2 含杂质限制含杂质是影响艾沙康唑药物质量的重要因素之一。
对于艾沙康唑侧链中间体c1的含杂质也有严格的限制要求,包括重金属、有机杂质等。
2.3 结晶形态艾沙康唑侧链中间体c1的结晶形态对于后续的合成工艺和成品药物的影响非常大。
国际标准对于其结晶形态也有详细的描述和要求。
3. 实际应用与挑战在实际生产中,艾沙康唑侧链中间体c1的质量标准往往面临着一些挑战。
其中包括原料的质量波动、合成工艺的控制难度等方面。
如何在实际生产中保证中间体c1的质量标准,成为了制药企业面临的重要问题之一。
4. 个人观点在我看来,艾沙康唑侧链中间体c1的质量标准需要综合考虑其在合成工艺中的作用、对最终药物品质的影响,同时也要考虑生产成本等因素。
只有全面考量,才能制定出既符合国际标准又符合生产实际的质量标准,并确保制药企业在生产过程中的稳定性和可控性。
5. 总结艾沙康唑侧链中间体c1的质量标准是制药领域中的一个重要话题,其与艾沙康唑药物的质量和疗效息息相关。
在制定质量标准时,需要综合考虑国际标准、实际生产挑战和个人观点,才能制定出既科学严谨又符合生产实际的标准。
艾沙康唑侧链中间体c1的质量标准是医药制造领域中的重要方面。
在本文中,我将继续探讨该主题,并深入了解其对制药企业和最终药品质量的影响。
2020版药典马来酸氯苯那敏内控质量标准
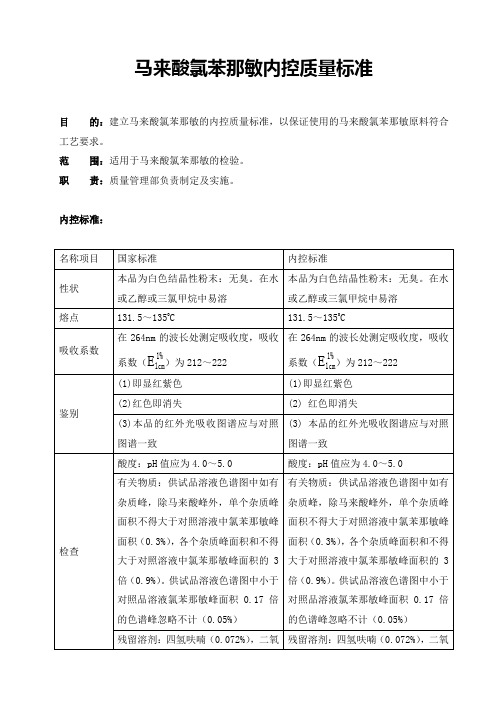
范围:适用于马来酸氯苯那敏的检验。
职责:质量管理部负责制定及实施。
内控标准:
名称项目
国家标准
内控标准
性状
本品为白色结晶性粉末:无臭。在水或乙醇或三氯甲烷中易溶
本品为白色结晶性粉末:无臭。在水或乙醇或三氯甲烷中易溶
熔点
在水或乙醇或三氯甲烷中易溶熔点1315135264nm的波长处测定吸收度吸收系数e11cm为212222264nm的波长处测定吸收度吸收系数e11cm为212222鉴别1即显红紫色1即显红紫色2红色即消失红色即消失3本品的红外光吸收图谱应与对照图谱一致本品的红外光吸收图谱应与对照图谱一致检查酸度
马来酸氯苯那敏内控质量标准
微生物限度:需氧菌总数≤1500cfu/g、霉菌和酵母菌数≤150 cfu /g。
含量测定
按干燥品计算,含C16H19CIN2·C4H4O4不得少于98.5%。
按干燥品计算,含C16H19CIN2·C4H4O4不得少于98.5%。
四、贮存条件和注意事项:遮光,密封保存,防潮。
五、有效期:根据厂家有效期
检查
酸度:pH值应为4.0~5.0
酸度:pH值应为4.0~5.0
有关物质:供试品溶液色谱图中如有杂质峰,除马来酸峰外,单个杂质峰面积不得大于对照溶液中氯苯那敏峰面积(0.3%),各个杂质峰面积和不得大于对照溶液中氯苯那敏峰面积的3倍(0.9%)。供试品溶液色谱图中小于对照品溶液氯苯那敏峰面积0.17倍的色谱峰忽略不计(0.05%)
残留溶剂:四氢呋喃(0.072%),二氧六环(0.038%),吡啶(0.02%),甲苯(0.089%)
易炭化物:与黄色1号标准比色液比较,不得更深
SOP-QC 呋喃唑酮片中间产品检验操作规程

呋喃唑酮片中间产品检验操作规程1. 目的建立呋喃唑酮片中间产品检验标准操作规程,使呋喃唑酮片中间产品检验操作规范化。
2. 范围适用于呋喃唑酮片中间产品的质量检验。
3. 术语或定义N/A4. 职责质量控制部对本规程的实施负责。
5. 程序5.1 检验依据5.1.1 《中国药典》2020年版二部(第574页)5.1.2 呋喃唑酮片中间产品质量标准(质量标准编号:)5.1.3 《中国药典》2020年版四部。
一呋喃唑酮片中间品(颗粒)1.【性状】本品为黄色颗粒,颗粒干燥,色泽均匀,无吸潮、软化、结块、潮解等现象。
2.【检查】2.1水分2.1.1仪器与用具烘干法水份测定仪2.1.2操作步骤⑴校正零位:在加码盘内加5g砝码,秤盘内不放试样,开启天平和红外线灯约20分钟后,等投影屏上的刻线不再移动时校正零位。
⑵样品测定:仪器经预热调零后,取下5g 砝码,把预先称好的试样均匀地倒在秤盘内,在加码盘内加适量的平衡砝码,然后开启天平和红外线灯泡开关,对试样进行加热,控制加热温度为105℃。
干燥一定时间后刻度移动静止,标志着试样内游离水已蒸发并达到了恒重点,读出记录数据。
2.1.3标准规定:本品水分不得过3.0%。
3.【含量测定】 避光操作。
3.1试剂与试药对照品:呋喃唑酮二甲基甲酰胺3.2仪器与用具紫外可见分光光度计、电子天平研钵、量瓶(100ml 、250ml )、量筒(100ml )、漏斗、滤纸、移液管(10ml )3.3操作步骤取本品颗粒研细,精密称取适量(约相当于呋喃唑酮20mg ),置250ml 量瓶中,加二甲基甲酰胺40ml ,振摇使呋喃唑酮溶解,用水稀释至刻度,摇匀,滤过,精密量取续滤液10ml ,置100ml 量瓶中,用水稀释至刻度,摇匀,作为供试品溶液。
照紫外-可见分光光度法,在367nm 的波长处测定吸光度;另取呋喃唑酮对照品约20mg ,精密称定,置250ml 量瓶中,加二甲基甲酰胺40ml ,振摇溶使解,用水稀释至刻度,精密量取10ml ,置100ml 量瓶中,用水稀释至刻度,摇匀,作为对照品溶液,同法测定,计算,即得。
乙酰半胱氨酸内控质量标准

乙酰半胱氨酸内控质量标准
公司名称:
通讯地址:
乙酰半胱氨酸内控质量标准
文件编号: J—QA—000 文件类别:技术标准
1.目的:
按照《药品生产质量管理规范》要求及药典标准建立一个完整的乙酰半胱氨酸内控标准,使该物料的最终质量判定及审核有据可依,确保原料质量,使之符合工艺要求。
2.依据:《中国药典》2015年版二部(P7)及《药品生产质量管理规范》(2010年修订)第一百六十四条与一百六十五条。
3.适用范围:适用于QC人员对本原料的控制检验。
4.责任:QA、QC检验人员对本标准的实施负责。
5.物料编码:
6.取样及检验方法:按取样管理规程取样;按乙酰半胱氨酸检验操作规程检验。
7.定性及定量限度要求(见下表)
8.贮藏条件:密封,在凉暗处保存
9.储存期:12个月复验周期:6个月10.类别:祛痰药
11.用途:用于含乙酰半胱氨酸颗粒的配制。
12.经批准的供应商:×××××××××有限公司。
胃安宁片质量标准研究

胃安宁片质量标准研究
刘小红
【期刊名称】《现代中医药》
【年(卷),期】2010(0)5
【摘要】目的建立胃安宁片的质量控制方法。
方法采用薄层层析法对方中救必应、白及和延胡索进行了定性鉴别,采用反相高效液相法测定了制剂中所含延胡索乙素
的含量。
结果鉴别方法专属性强、重复性好,含量测定延胡索乙素在线性范围内线
性关系良好,回收率为98.08%,RSD为1.08%。
结论本质量标准可有效地控制胃安宁片的质量。
【总页数】3页(P94-96)
【关键词】胃安宁片;质量标准;HPLC;薄层鉴别
【作者】刘小红
【作者单位】宝鸡市中医医院药剂科
【正文语种】中文
【中图分类】R285.0
【相关文献】
1.心安宁片质量标准研究 [J], 郭强
2.胃安宁颗粒质量标准研究 [J], 余晶晶;黄一平;吴德康
3.胃特安片质量标准研究 [J], 李先飞;封传华;张静;徐兰;肖汉扬;李刚
4.胃特安片质量标准研究 [J], 李先飞;封传华;张静;徐兰;肖汉扬;李刚
5.溃平宁胃漂浮片的质量标准研究 [J], 王宝才;李国铎
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
胃康宁片中间体内控标准
引用标准:;胃康宁片内控标准(编码:TS0300500)
二、质量指标:
原辅料外观检查判断标准
目的:制定原辅料外观检查判断标准,规范公司原辅料的外观检查。
二、适用范围:适用于进厂原辅料的外观检查。
三、责任者:QA监督员、QC检验员、仓库管理员。
四、正文:
1、检查原辅料、包装材料是否为佥生产单位,有无生产批文、产品批号、注册商标等;
2、检查原辅料的外包装应完整,无破颀,无污染,如果出现异常,仓库应拒收。
3、目检原辅料的性状,是否与规定相符合。
4、应无异味,异物不得有。
阿魏酸哌嗪内控标准
、品名及物料编码:
1、通用名:阿魏酸哌嗪
2、化学各:3-甲氧基-4-羟基桂皮酸哌嗪
3、物料编码:Y01
二、引用标准:(95)标字第号
三、质量指标:。
