【优化设计-赢在课堂】(人教版)2015高中化学选修3配套课件第一章 原子结构与性质 章末整合课件
人教版高中化学选修3第一章第一节原子结构第二课时教学课件共28张PPT

3.激发态原子: 基态原子的电子吸收能量后电子会跃迁到较高的 能级,变为激发态原子。 (不稳定)
↓
↓
电子吸 收能量
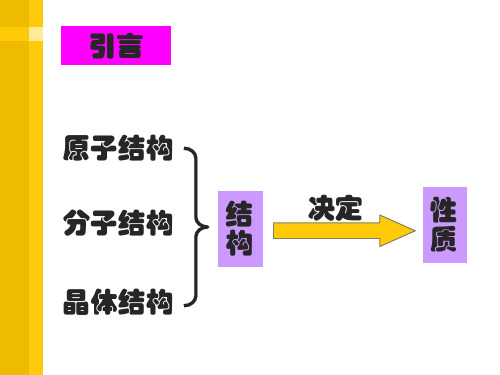
四.能量最低原理、基态与激发态、光谱
吸收能量
1s22s22p63s2
基态原子
释放能量
1s22s22p63s13p1
激发态原子
光(辐射)是电子释放能量的重要形式之一 4.原子光谱: 不同元素的原子的核外电子发生跃迁时会吸收 或释放不同频率的光,可以用光谱仪摄取各种 元素的电子的吸收光谱或发射光谱,总称为原 子光谱。 5.在现代化学中,常利用原子光谱上的特征谱 线来鉴定元素,称为光谱分析。
发射光谱
特征:暗背景,
亮线,
锂、氦、汞的发射光谱
线状不连续 吸收光谱
特征:亮背景,
暗线,
锂、氦、汞的吸收光谱
线状不连续
焰火呈现五颜六色的原因 焰色反应就是某些金属原子的电子在高温火 焰中,接受了能量,使原子外层的电子从基态 激跃迁到激发态;处于激发态的电子是十分不 稳定的,在极短的时间内(约10-8s)便跃迁 到基态或较低的能级上,并在跃迁过程中将能 量以一定波长(颜色)的光释放出来。由于各 种元素的能级是被限定的,因此在向基态跃迁 时释放的能量也就不同。碱金属及碱土金属的 能级差正好对应于可见光范围,于是我们就看 到了各种色彩。
5. 各能级包含的原子轨道数:
(1)ns能级各有1个原子轨道;
(2)np能级各有3个原子轨道;
(3)nd能级各有5个原子轨道;
(4)nf能级各有7个原子轨道;
由下图总结: 1.每个原子轨道里最多只能容纳几个电子?方向如何? 2.当电子排布在同一能级时.每个原子轨道上最多能容纳____ 2 个电子, 相反 且自旋状态_______ ——泡利原理 2、当电子排布在同一能级的不同轨道 时,总是优先单独占据一个轨道 ___________________,而且 相同 自旋状态______ ——洪特规则
高中人教版化学选修3课件:第1章第1节 原子结构(53张ppt)_最新修正版

能层 一 二 三 四 五 六 七 ……
符号 _K__ _L__ M _N__ _O__ P Q ……
最多 电子
数
各能层最多容纳的电子数为 _2_n_2 ___
最新修正版
7
2.能级 (1)分类依据 根据多电子原子中同一能层电子___能__量____的不 同,将它们分成不同的能级。 (2)能级的表示方法及各能级最多容纳的电子数如 下:
最新修正版
10
三、构造原理与电子排布式 1.构造原理 (1)含义 在多电子原子中,电子在能级上的排布顺序是: 电子先排在能量_低___的能级上,然后依次排在能 量__较__高____的能级上。
最新修正版11Fra bibliotek(2)构造原理示意图
最新修正版
12
思考感悟 2.(1)“能层越大,能级的能量越高。”对吗? (2)为什么K原子的原子结构示意图不是
子
结
构
知能优化训练
最新修正版
3
课前自主学案
一、开天辟地——原子的诞生 1.原子的诞生
氢
氦
锂
最新修正版
4
2.宇宙的组成与各元素的含量
宇宙
氢H:占原子总数的88.6%两者占宇宙原子总 氦He:约为氢原子数的18 数的99.7%以上
其他90多种天然元素的原子
总数加起来不足_1_%___
最新修正版
5
3.地球的组成元素 地球上的元素绝大多数是__金__属___,__非__金__属____ (包括稀有气体)仅22种。 二、能层与能级
1.能层 (1)分类依据 根据多电子原子的核外电子的_能__量__差__异___,将核 外电子分成不同的能层。
最新修正版
6
人教版化学选修三1.1 原子结构(第三课时)课件教学课件

当电子排布在同一能级的不同轨道时,总是优先单
独占据一个轨道,而且自旋方向相同。---洪特规则
练习1:写出 24Cr 29Cu 电子排布式
24Cr 1s22s22p63s23p63d54s1 29Cu 1s22s22p63s23p63d104s1
作业:
画出从21号到30号元素原子 外围电子的轨道排布式
当你的才华还撑不起你的野心时,你就该努力。心有猛虎,细嗅蔷薇。我TM竟然以为我竭尽全力了。能力是练出来的,潜能是逼出来的,习惯是养成的,我的 成功是一步步走出来的。不要因为希望去坚持,要坚持的看到希望。最怕自己平庸碌碌还安慰自己平凡可贵。
脚踏实地过好每一天,最简单的恰恰是最难的。拿梦想去拼,我怎么能输。只要学不死,就往死里学。我会努力站在万人中央成为别人的光。行为决定性格, 性格决定命运。不曾扬帆,何以至远方。人生充满苦痛,我们有幸来过。如果骄傲没有被现实的大海冷冷拍下,又怎么会明白要多努力才能走到远方。所有的 豪言都收起来,所有的呐喊都咽下去。十年后所有难过都是下酒菜。人生如逆旅,我亦是行人。驾驭命运的舵是奋斗,不抱有一丝幻想,不放弃一点机会,不 停止一日努力。失败时郁郁寡欢,这是懦夫的表现。所有偷过的懒都会变成打脸的巴掌。越努力,越幸运。每一个不起舞的早晨,都是对生命的辜负。死鱼随 波逐流,活鱼逆流而上。墙高万丈,挡的只是不来的人,要来,千军万马也是挡不住的既然选择远方,就注定风雨兼程。漫漫长路,荆棘丛生,待我用双手踏 平。不要忘记最初那颗不倒的心。胸有凌云志,无高不可攀。人的才华就如海绵的水,没有外力的挤压,它是绝对流不出来的。流出来后,海绵才能吸收新的 源泉。感恩生命,感谢她给予我们一个聪明的大脑。思考疑难的问题,生命的意义;赞颂真善美,批判假恶丑。记住精彩的瞬间,激动的时刻,温馨的情景, 甜蜜的镜头。感恩生命赋予我们特有的灵性。善待自己,幸福无比,善待别人,快乐无比,善待生命,健康无比。一切伟大的行动和思想,都有一个微不足道 的开始。在你发怒的时候,要紧闭你的嘴,免得增加你的怒气。获致幸福的不二法门是珍视你所拥有的、遗忘你所没有的。骄傲是胜利下的蛋,孵出来的却是 失败。没有一个朋友比得上健康,没有一个敌人比得上病魔,与其为病痛暗自流泪,不如运动健身为生命添彩。有什么别有病,没什么别没钱,缺什么也别缺 健康,健康不是一切,但是没有健康就没有一切。什么都可以不好,心情不能不好;什么都可以缺乏,自信不能缺乏;什么都可以不要,快乐不能不要;什么 都可以忘掉,健身不能忘掉。选对事业可以成就一生,选对朋友可以智能一生,选对环境可以快乐一生,选对伴侣可以幸福一生,选对生活方式可以健康一生。 含泪播种的人一定能含笑收获一个有信念者所开发出的力量,大于个只有兴趣者。忍耐力较诸脑力,尤胜一筹。影响我们人生的绝不仅仅是环境,其实是心态 在控制个人的行动和思想。同时,心态也决定了一个人的视野、事业和成就,甚至一生。每一发奋努力的背后,必有加倍的赏赐。懒惰像生锈一样,比操劳更 消耗身体。所有的胜利,与征服自己的胜利比起来,都是微不足道。所有的失败,与失去自己的失败比起来,更是微不足道挫折其实就是迈向成功所应缴的学 费。在这个尘世上,虽然有不少寒冷,不少黑暗,但只要人与人之间多些信任,多些关爱,那么,就会增加许多阳光。一个能从别人的观念来看事情,能了解 别人心灵活动的人,永远不必为自己的前途担心。当一个人先从自己的内心开始奋斗,他就是个有价值的人。没有人富有得可以不要别人的帮助,也没有人穷 得不能在某方面给他人帮助。时间告诉你什么叫衰老,回忆告诉你什么叫幼稚。不要总在过去的回忆里缠绵,昨天的太阳,晒不干今天的衣裳。今天做别人不 愿做的事,明天就能做别人做不到的事。到了一定年龄,便要学会寡言,每一句话都要有用,有重量。喜怒不形于色,大事淡然,有自己的底线。趁着年轻, 不怕多吃一些苦。这些逆境与磨练,才会让你真正学会谦恭。不然,你那自以为是的聪明和藐视一切的优越感,迟早会毁了你。无论现在的你处于什么状态, 是时候对自己说:不为模糊不清的未来担忧,只为清清楚楚的现在努力。世界上那些最容易的事情中,拖延时间最不费力。崇高的理想就像生长在高山上的鲜 花。如果要搞下它,勤奋才能是攀登的绳索。行动是治愈恐惧的良药,而犹豫、拖延将不断滋养恐惧。海浪的品格,就是无数次被礁石击碎又无数闪地扑向礁 石。人都是矛盾的,渴望被理解,又害怕被看穿。经过大海的一番磨砺,卵石才变得更加美丽光滑。生活可以是甜的,也可以是苦的,但不能是没味的。你可
【课件】人教版高中化学选修三第一章原子结构与性质之一原子结构

选修三物质结构与性质引言世界万物本源冷热干湿水土气火古希腊吞食金石矿物,可以将金石的抗腐蚀性直接移植给人体。
——吞金可长生古中国物质的性质与变化决定了物质的组成与结构。
杜玛克(G. Domagk,1895.10.30~1964.4.24)德国病理学家,1933年将磺胺药应用于临床。
Chapter One本章内容结构洪特规则泡利原理原子光谱激发态基态能级泡利原理原子半径电离能电负性电子云和原子轨道能量最低原理构造原理原子核外电子排布元素周期律元素周期表元素周期系元素的性质原子结构原子结构与性质第一节原子结构(Section I Atomic Structure)一.开天辟地——原子的诞生1.大爆炸理论(The Big Bang Theory)比利时天文学家和宇宙学家勒梅特(Lemaitre Georges,1894.7.17~1966.6.20)1932年——宇宙大爆炸理论2.氢元素是宇宙中最丰富的元素——88.6%,氦约为氢原子数的1/8,两者约占宇宙原子总数的99.7%以上。
另外90多种天然元素——不足总数的1%。
【阅读教材】P4“科学史话”,你认为普鲁特的推理是符合逻辑的吗?【阅读教材】第一章彩图,了解人们认识原子模型的发展史。
一.开天辟地——原子的诞生3.不同时期的原子结构模型(1)古希腊原子论古希腊哲学家德谟克利特(Democritus,约公元前460 年~前370 年)原子是最小的、不可分割的物质粒子。
原子之间存在着虚空,无数原子从古以来就存在于虚空之中,既不能创生,也不能毁灭,它们在无限的虚空中运动着构成万物。
一.开天辟地——原子的诞生3.不同时期的原子结构模型(2)道尔顿原子模型(1803年)(实心球模型)道尔顿(John Dalton ,1766~1844)原子学说:①原子在一切化学变化中不可再分,并保持自己的独特性质。
②同一元素所有原子的质量、性质都完全相同。
③不同元素的原子质量和性质各不相同。
人教版选修3 化学:1.1 原子结构 课件(共15张PPT)

注意: 以上几点是相互联系的,不能孤立地理 解,须同时满足。
二、电子排布式 能层:按能量由低到高顺序
离核越 远能量
越高
1234567 K LMN O P Q
2 8 18 32 … …
最多容纳2n2
三、电子排布图
实例:
Al原子的电子排布图
C原子的电子排布图
以铝原子为例,电子排布图中各符号数字的意义:
电子排布图能直观地体现原子核外电子分层、 分能级分轨道排布情况以及电子的自旋状态。
四、价电子排布式 实例:
26Fe: 1s2 2s22p6 3s23p6 3d64s2
价电子排布式 3d64s2
原子结构
原子核外电子排布
原子核外电子的排布遵循能量最 低原理、泡利原理(又叫泡利不相容 原理)和(洪特规则特例)。原子核 外电子排布可以用一定的图(式)表 示出来。常用来表示原子核外电子排 布的图(式)有下列四种:
一、原子(离子)结构示意图 二、电子排布式 三、电子排布图 四、价电子排布式
一、原子(离子)结构示意图法
实例:
19K: 1s2 2s22p6 3s23p6
简写 [Ar] 4s1
26Fe: 1s2 2s22p6 3s23p6 3d64s2
简写 [Ar] 3d64s2
电子排布式能直观地体现原子核外电子分层、 分能级排布情况。
35.[化学——选修3:物质结构与性质] 锌在工业中5.[化学——选修3:物质结构与性质] 回答下列问题: (1)基态Fe原子价层电子的电子排布图 (轨道表达式)为
___________________ ,
人教版高中化学选修三第一章第一节 原子结构 课件(共31张PPT)

A.NB.MC.L源自D.K1.下列能级符号正确的是( ) ①5s ②2d ③3f ④6p A.①④ B.②③ C.③④ D.①②
2.比较下列能级的能量大小关系(填“>”、“=”或“<”): (1)2s________4s; (2)3p________3d; (3)3d________4s;
3.下列各原子或离子的电子排布式错误的是( ) A.K+:1s22s22p63s23p6 B.F:1s22s22p5 C.S2-:1s22s22p63s23p4 D.Ar:1s22s22p63s23p6
• 8、普通的教师告诉学生做什么,称职的教师向学生解释怎么做,出色的教师示范给学生,最优秀的教师激励学生。下午5时22 分27秒下午5时22分17:22:2721.11.9
1-18号元素的原子结构示意图
原子结构示意图
为了形象地表示原子的结构,人们就创造了“原子结构示意图”
这种特殊的图形。
第3层
第2层 M层 这里的K、L、M
二、能层与能级
2.能级 (1)多电子原子中,_同__一___能层的电子,__能__量____也可能不同, 还可以把它们分成能级。
(2)能级的表示方法和所能容纳的最多电子数
能层
能层序数
能级
KL
M
N
O
12
3
4
5
1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p …
最多电子数
2
8
18
三、构造原理与电子排布式
1.构造原理:P5 绝大多数原子核外电子的排布遵循如图的排布顺序,这种规 律称为构造原理。
核 7 7s
7p
外 6 6s
电
6p
人教版高中化学选修三 1.1 原子结构优秀课件

复习回忆:原子结构
原子的构成
原子
原子核
质子 中子
核外电子
核外电子排布规律有哪些?
核外电子排布的一般规律:
(1)核外电子总是尽量先排布在能量较低的电子层, 然后由里向外,依次排布在能量逐步升高的电子 层(能量最低原理)。
(2)原子核外各电子层最多容纳2n2个电子。
(3)原子最外层电子数目不能超过8个(第一层为最 外层时不能超过2个电子
1s < 2s < 3s < 4s < 4p < 5f
三、构造原理与电子排布式
电子排布式是指用能级的符号及能级中容 纳电子数表达核外电子运动状态的式子
能级
表示该能级填 充的电子数目
能层
Na:1s2 2s2 2p6 3s1
练一练
写出3Li、10Ne、17Cl的电子排布式 1703CNLile::: 111sss222 2s21s2 22pp66 3s2 3p5 电电子子数数1307---222===118-51=- 02=163--6=70 - 2=5 - 5=0
能级交错现象
书写电子排布式
26Fe:1s22s22p63s23p63d64s2
Ø在书写电子排布式时,能层低的能级要写在左边, 不能按填充顺序写。 虽先排4s后排3d ,但电子排布式中先写3d,后
写4s。26Fe(铁)电子排布式中最后2个能级应写为 3d64s2,而不能写成4s23d6。
Ø失电子的顺序: 从外层到内层逐渐失去 Fe2+ :1s22s22p63s23p63d6 Fe3+ :1s22s22p63s23p63d5
能量升高
7s 7p
6s 6p 6d
能
5s 5p 5d 5f
人教版高中化学选修3课件:第一章 第一节 原子结构 第3课时

如Na:
或写成[Ne] 。
3.原子结构示意图 (1)原子结构示意(简)图:圆圈内数字表示质子数,弧线表示能层(电子 层),弧线内数字表示该能层(电子层)中的电子数。 (2)写出下列原子或离子的结构示意图:
①K:
;②Fe:
;
③Mg2+:
;④Cl-:
。
归纳总结
原子核外电子排布的表示方法
(1)电子排布式和电子排布图反映的是基态原子即处于最低能量状态的
秒13:11:1216 November 2021
•
8、教育技巧的全部诀窍就在于抓住儿童的这种上进心,这种道德上的自勉。要是儿童自己不求上进,不知自勉,任何教育者
就都不能在他的身上培养出好的品质。可是只有在集体和教师首先看到儿童优点的那些地方,儿童才会产生上进心。下午1时1
1分12秒下午1时11分13:11:1221.11.16
12345
解析 答案
(3)29Cu+的价层电子排布式为_3_d_1_0 。
解析 29号元素Cu的核外电子排布式简式为[Ar]3d104s1,原子失去电子 时首先失去最外层电子,即Cu+的核外电子排布式简式为[Ar]3d10,则 其价层电子排布式为3d10。
12345
解析 答案
本课结束
第一章 第一节 原子结构
第3课时 原子核外电子排布规则
目标定位 知道原子核外电子排布的“两原理一规则”,会正确 书写原子的电子排布式和电子排布图。
内容索引
新知导学 —— 新知探究 点点落实 达标检测 —— 当堂检测 巩固反馈
新知导学
一、基态原子核外电子的排布原则
1.能量最低原理 原子核外的电子应优先排布在 能量最低 的能级里,然后由里到外,依 次排布在 能量逐渐升高 的能级里。能级的能量高低顺序如构造原理所 示(对于1~36号元素来说,应重点掌握和记忆“1s→2__s→__2_p_→__3_s_→__3_p_→_ 4s→3d →4p”这一顺序)。
人教化学选修3第一章第一节 原子结构(共26张PPT)

致”。下列说法正确的是C (
)
A、科学研究中若能以思辨性推测为核心,就能加快科学 的进程
B、普鲁特“既然氢最轻,它就是其他一切元素之母”的 推理是符合逻辑的
C、“一致”是巧合,普鲁特的预言没有科学事实和理论 支撑,只是一种猜测
D、“现代大爆炸理论”是解释宇宙诞生的唯一正确的理 论
回忆:原子结构
原子: 是化学变化中最小的粒子。
3.汤姆生原子模型(1904年)
原子是一个平均分布着正电荷的粒子,其中镶嵌 着许多电子,中和了正电荷,从而形成了中性原子。
4.卢瑟福原子模型(1911年)
原子中心有一个带正电荷的核,它的质量几乎等 于原子的全部质量,电子在它的周围沿着不同的轨 道运转,就象行星环绕太阳运转一样。
(“行星系式”原子模型) (核式模型)
其 他 元
总 2.氢是宇宙中最丰富的元素,是所有素
结 元素之母。 3.所有恒星仍在合成元素,但这些元
素都是已知的。
4.地球上的元素绝大多数是金属,非
金属(包括稀有气体)仅22种。
体验:现代大爆炸理论认为:天然元素源于氢氦等发
生的原子核的融合反应。这于一百多年前,普鲁特运用思
辨性推测作出“氢是所有元素之母”的预言,恰好“一
A、某微粒核外电子排布为2、8、8结构,则该微粒 一定是氩原子
B、最外层达稳定结构的微粒只能是稀有气体的原子
C、F-、Na+、Mg2+、Al3+是与Ne原子具有相同电子 层结构的离子
D、NH4+与H3O+具有相同的质子数和电子数
二、能层(电子层)
在多电子的原子核外电子的能量是不同的,按电 子的能量差异,可以将核外电子分成不同的能层。
化学新优化同步人教版选修3课件:第一章 原子结构与性质 第一节 第1课时(48张)

下列叙述正确的是( A.能级就是电子层
)
B.每个能层最多可容纳的电子数是 2n2 C.同一能层中不同能级的能量高低相同 D.不同能层中的 s 能级的能量高低相同
[解析]
A 项中,能层是电子层,同一能层的电子根据能量
的不同把它们分成不同的能级;C 项中,同一能层中的不 同 能 级 的 能 量 高 低 顺 序 是 E(ns) < E(np) < E(nd) < E(nf)……D 项中,不同能层能级符号相同时,n 越大,能 量越高,如 E(1s)<E(2s)<E(3s)<E(4s)……
第一章
原子结构与性质
第一节
第 1 课时
Hale Waihona Puke 原子结构构造原理能层与能级
第一章
原子结构与性质
1.了解原子核外电子的运动状态。 的构造原理。
2.了解原子结构
3.知道原子核外电子的能级分布,能用电子排布式表示常 见元素(1~36 号)原子核外电子的排布。
原子的诞生
能层与能级
1.原子的诞生
2.宇宙中元素的组成及含量
答案:(1)D (2)D (3)C
能层与能级 3.(2017· 福州高二检测)下列有关认识中正确的是( A.在同一能层不同能级上的电子,其能量肯定不同 B.各能层的能级都是从 s 能级开始至 f 能级结束 C.各能层含有的能级数为 n-1 D.各能层含有的电子数为 2n2 )
解析:选 A。在多电子原子中,不同能级具有的能量不同, A 项正确;各能层的能级都是从 s 能级开始,但不都是至 f 能级结束,如 L 能层只有 2s、2p 两个能级,M 能层只有 3s、3p、3d 三个能级,B 项错误;各能层含有的能级数与 能层序数一致,C 项错误;各能层最多容纳电子数为 2n2, D 项错误。
人教版高中化学选修三课件第一章本章优化总结

3.若直接书写电子排布式有困难,可先写出
原子的原子结构示意图,再据此写出电子排 布式。如
按要求填空: 例1 (1) 35Br-的电子式____________________;
学科网
(2)16S2-的离子结构示意图_____________; (3)11Na的电子排布式____________________; (4)20Ca的价电子排布式_________________; (5)7N的电子排布图_____________________。
,为ⅣA族元素,又由于其原子序数小于29,且
m≠n,Y只能是Si元素。R的核外L层电子数为
奇数,则可能为Li、B、N或F。Q、X的p轨道 的电子数分别为2和4,则为C(或Si)和O(或S)。
因为五种元素原子序数依次递增,故可推出
:Q为C,R为N,X为O,Y为Si。(1)Cu的核外 电子排布式为1s22s22p63s23p63d104s1,失去两 个电子则为1s22s22p63s23p63d9。
④Q、X原子p轨道的电子数分别为2源自4。请回答下列问题: (1)Z2+的核外电子排布式是
_______________________,该元素在元素周
期表中的位置是____________________。 (2)Q、Y形成的最简单气态氢化物分别为甲、 乙,其氢化物的稳定性_____>______,其氢 化物的还原性________>________。(用化学
主要化合价
最高价氧化物 对应水化物酸 碱性 非金属元素气 态氢化物的形 成与稳定性 元素的第一电 离能 元素的电负性
例2 (2012· 中山高二质检 )Q 、 R 、 X 、 Y 、 Z 五种元素的原子序数依次递增。已知:
人教版选修三第一章第一节 原子结构(56张PPT)
3s23p63d5 4s1 3s23p63d5 4s2 3s23p63d6 4s2 3s23p63d7 4s2 3s23p63d8 4s2
原子 元素 元素 序数 名称 符号 K
29 铜 Cu 1s2 30 锌 Zn 1s2 31 镓 Ga 1s2 32 锗 Ge 1s2 33 砷 As 1s2 34 硒 Se 1s2 35 溴 Br 1s2 36 氪 Kr 1s2
基态原子
吸收光谱
吸收能量 释放能量
发射光谱
激发态原子
用光谱仪摄取
总称原子光谱
可利用原子光谱上的特征谱线来鉴定元素称为光谱分析
发射光谱和吸收光谱
锂、氦、汞的发射光谱 特征: 暗背景,亮线,线状不连续
锂、氦、汞的吸收光谱 特征: 亮背景,暗线,线状不连续
练习
例1、判断下列表达是正确还是错误
(1)1s22p1属于基态;
×
√ +19 2 8 8 1
1、构造原理:
核外电子排布必须遵循一定的能级顺序 电子先排能量低的内层,再排能量高的外层
+19 2 8 8 1
7 7s 7p 6 6s 6p 6d 5 5s 5p 5d 5f 4 4s 4p 4d 4f 3 3s 3p 3d 2 2s 2p 1 1s 能量由低到高顺序 : 1s 2s 2p 3s 3p 4s 3d 4p 5s … …
14
硅 Si 1s2 2s22p6 3s23p2
15
磷 P 1s2 2s22p6 3s23p3
16
硫 S 1s2 2s22p6 3s23p4
17
氯 Cl 1s2 2s22p6 3s23p5
18
氩 Ar 1s2 2s22p6 3s23p6
原子 元素 元素 序数 名称 符号 K
人教版化学选修三1.1 原子结构 讲课课件优秀课件PPT

—
决定元素种
(核内质子数)
请看下列表示
a—类—代表质量数;
X a +d c-+-
abcd 各代表
b
什么
b——代表核电荷数; c——代表离子的价态; d——代表化合价
几个关系式
1.质量数(A)=质子数(Z)+中子数(N)
2.原子
A Z
X
:核电荷数=质子数=核外电子数
3. 阳离子 aWm :核电荷数=质子数>核外电子数, 核外电子数=a-m 4. 阴离子 bY n :核电荷数=质子数<核外电子数,
交流 · 研 讨
下表列出的是构成原子的微粒—电子﹑质子和中子的基本数据。
微粒 质量/kg 相对质量 电量/C 电荷
电子
质子
中子
9.109×10-31 1.673×10-27 1.675×10-27
0.0005484 1.007
1.008
1.602×10-19 1.602×10-19 0
-1
+1
0
请根据表中所列的数据讨论:
核外电子数=b+n
练习:填表:
微粒符 质子数
号
(Z)
N
7
Al
13
Ar
18
Cl
17
H
1
中子数 (N)
7 14 22
18
2
质量数 (A)
14 27
40 35 3
用
A Z
X
表示
14 7
N
27 13
Al
40 18
Ar
35 17
Cl
3 1
H
(二)核素
P4 “观察思考” 三种不同的氢原子
人教版高中化学选修三课件第一节原子结构(第1课时).pptx

不同元素的原子发生跃迁时会吸收 或释放不同的能量 表现为光的形式
用光谱仪摄取 得到各种元素的电子的 吸收光谱或发射光谱
可利用原子光谱上的特征谱线来鉴 定元素,称为光谱分析
课堂练习
1、判断下列表达是正确还是错误 1)1s22p1属于基态; 2)1s22s22p63s23p63d54s1属于激发态; 3)1s22s22p63d1属于激发态; 4)1s22s22p63p1属于基态;
作用。他的学说中主要有下列三个论点:
①原子是不能再分的微粒;②同种元素
的原子的各种性质和质量都相同;③原
子是微小的实心球体。从现代原子——
分子学说的观点看,你认为不正确的是
()
A只有①
B只有②
C只有③
D①②③
2.在同一个原子中,离核越近、n越小 的电子层能量。在同一电子层中,各亚 层的能量按s、p、d、f的次序。
是( BD )
A.Be 1s22s12p1 B.C 1s22s22p2 C.He 1s12s1D.Cl 1s22s22p63s23p5
2.书写下列原子的电子排布式
SFeScVSeGaBr
3.下列各原子或离子的电子
排布式错误的是()D
AAl1s22s22p63s23p1 BO2-1s22s22p6 CNa+1s22s22p6 DSi1s22s22p2
答案:(1)x(2)x(3)√(4)x
小结:
1.各原子轨道的能量高低比较
(1)ns<np<nd<nf
(2)1s<2s<3s<4s
(3)同一能层同一能级的各原子 轨道能量相等:2Px=2Py=2Pz
2.
电子层
1
原子轨道 原子轨道 可容纳电
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题归纳整合
迁移训练 2( 1) C、 N、 O 三种元素第一电离能从大到 小的顺序是 。
( 2) B 和 N 相比, 电负性较大的是 , BN 中 B 元素的化合价 为 。 ( 3) X、Y、Z、L、M 五种元素的原子序数依次增大。X、Y、Z、 L 是组成蛋白质的基础元素, M 是地壳中含量最高的金属元素。 则五 种元素的原子半径从大到小的顺序是 ( 用元素符号表示) 。
知识网络建构
专题一 专题二
专题归纳整合
迁移训练 1A、B、C、D、E 代表 5 种元素。请填 空: ( 1) A 元素基态原子的最外层有 3 个未成对电子, 次外层有 2 个电 子, 其元素符号为 。 ( 2) B 元素的-1 价离子和 C 元素的+1 价离子的电子层结构都与 氩相同, B 的元素符号为 , C 的元素符号为 。 ( 3) D 元素的正三价离子的 3d 能级为半充满, D 的元素符号 为 , 其基态原子的电子排布式为 。 ( 4) E 元素基态原子的 M 层全充满, N 层没有成对电子, 只有一个 未成对电子, E 的元素符号为 , 其基态原子的电子排布式 为 。
专题二 元素“位”“构”“性”关系 1.元素“位”“构”“性”关系图解
知识网络建构
专题一 专题二
专题归纳整合
2.元素性质的递变规律
性质 核外电子 的排布 金属性和 非金属性 原子半径 单质的氧化 性和还原性 氧化性 还原性 电子层数 最外层 电子数 金属性 非金属性 同一周期 (从左向右) 相同 1 →8 减弱 增强 减小 增强 减弱 同一主族 (从上到下) 增加 相同 增强 减弱 增大 减弱 增强
知识网络建构
专题一 专题二
专题归纳整合
泡利不相 容原理 能量最 低原理
一个原子轨道中最多只能容纳两个电子且两个电子自旋状态相反 在不违反泡利不相容原理的前提下,核外电子在各原子轨道上的排 布方式应使整个原子体系的能量最低 基态原子的电子在能量相同的轨道上排布时,应尽可能分占不同的 轨道,且自旋状态相同(如 np3: 定(如 Cr:3d54s1,Cu:3d104s1) )。特例:当同一能级上电
知识网络建构
专题一 专题二
专基态原子的最外层有 3 个未成对电子, 次外 层有 2 个电子, 可推知该元素是氮元素, 元素符号为 N。 ( 2) 根据 B、C 元素的离子的电子层结构与氩相同, 可推知 B 为 氯( Cl) , C 为钾( K) 。 ( 3) 因 D 元素的正三价离子的 3d 能级为半充满, 可知 D 为铁元 素( Fe) , 其基态原子的电子排布式为 1s22s22p63s23p63d64s2。 ( 4) E 元素基态原子的 M 层全充满, N 层没有成对电子, 只有一个 未成对电子, 推知 E 为铜( Cu) , 基态原子的电子排布式为 1s22s22p63s23p63d104s1。
知识网络建构
专题一 专题二
专题归纳整合
最高价氧化 物对应水化 物的酸碱性
酸性 碱性
增强 减弱 增强 增大(第ⅡA 族、 第ⅤA 族反常) 变大
减弱 增强 减弱 减小 变小
气态氢化物的稳定性 第一电离能 电负性
知识网络建构
专题一 专题二
专题归纳整合
例 2 下列曲线表示卤族元素某种性质随核电荷数的变 化趋势, 其中正确的是( )
知识网络建构
专题一 专题二
专题归纳整合
解析: 同主族元素从上到下电负性依次减小, A 正确; 卤族元素中 氟无正价, B 错; HF 分子间存在氢键, 所以 HF 沸点最高, C 错; 卤族元 素从上到下单质分子间范德华力依次增大, 熔点依次升高, D 错。 答案: A
知识网络建构
专题一 专题二
洪特规则
子排布为全充满、 半充满或全空状态时,原子的能量最低,状态最稳
知识网络建构
专题一 专题二
专题归纳整合
例 1A、B、C、D 是四种短周期元素, E 是过渡元素。A、B、
C 同周期, C、D 同主族, A 的原子结构示意图为
, B
是同周期除稀有气体外半径最大的元素, C 的最外层有三个成单电 子, E 的外围电子排布式为 3d64s2。回答下列问题:
知识网络构建
专题归纳整合
知识网络建构
专题一 专题二
专题归纳整合
专题一 原子结构与核外电子排布 1.构造原理
知识网络建构
专题一 专题二
专题归纳整合
构造原理揭示了能级的能量高低顺序和电子的填充顺序, 如图 所示。多电子原子中, 电子填充原子轨道时, 原子轨道能量的高低存 在如下规律: ( 1) 相同电子层上原子轨道能量的高低: ns<np<nd<nf。 ( 2) 形状相同的原子轨道能量的高低: 1s<2s<3s<4s…… ( 3) 电子层和形状相同的原子轨道能量相等, 例如 2px、2py、2pz 轨道的能量相等。 ( 4) 能级交错规律: ns<( n-2) f<( n-1) d<np。 2.核外电子排布遵循的三个原理 核外电子的排布遵循能量最低原理、 泡利不相容原理和洪特规 则。
知识网络建构
专题一 专题二
专题归纳整合
答案: ( 1) N ( 2) Cl K ( 3) Fe 1s22s22p63s23p63d64s2 或[ Ar] 3d64s2 ( 4) Cu 1s22s22p63s23p63d104s1 或[ Ar] 3d104s1
知识网络建构
专题一 专题二
专题归纳整合
知识网络建构
专题一 专题二
专题归纳整合
A为 是 B为 C为 D为 E为
( 写出元素符号, 下同) , 电子排布式 ; , 简化电子排布式是 , 价电子排布式是 , 电子排布图是 , 原子结构示意图是 ; ; ; 。
知识网络建构
专题一 专题二
专题归纳整合
解析: 由题意可知, A 为 Si, B 为 Na, C 为 P, 则 D 为 N, E 为 Fe, 这五 种元素电子排布式分别为: A: 1s22s22p63s23p2, B: 1s22s22p63s1, C: 1s22s22p63s23p3, D: 1s22s22p3, E: 1s22s22p63s23p63d64s2。由电子排布式可写出其他。 答案: Si 1s22s22p63s23p2 Na [ Ne] 3s1 P Fe 3s23p3 N
