葡聚糖凝胶 Sephadex LH20 使用说明及使用心得
LH-20使用说明书
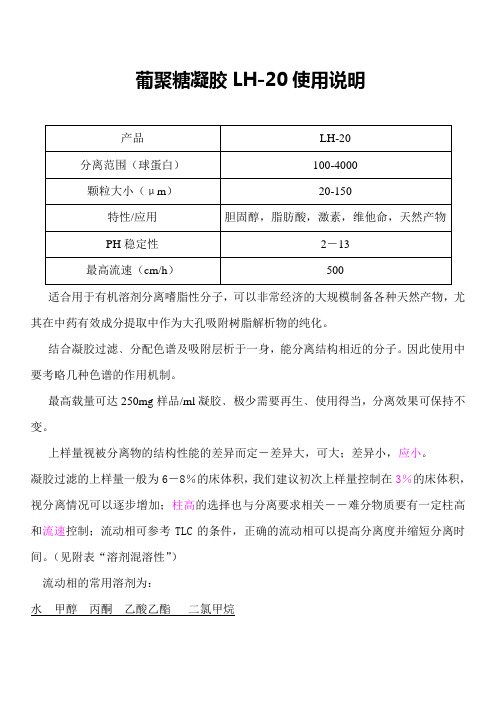
葡聚糖凝胶LH-20使用说明
适合用于有机溶剂分离嗜脂性分子,可以非常经济的大规模制备各种天然产物,尤其在中药有效成分提取中作为大孔吸附树脂解析物的纯化。
结合凝胶过滤﹑分配色谱及吸附层析于一身,能分离结构相近的分子。
因此使用中要考略几种色谱的作用机制。
最高载量可达250mg样品/ml凝胶﹑极少需要再生﹑使用得当,分离效果可保持不变。
上样量视被分离物的结构性能的差异而定-差异大,可大;差异小,应小。
凝胶过滤的上样量一般为6-8%的床体积,我们建议初次上样量控制在3%的床体积,视分离情况可以逐步增加;柱高的选择也与分离要求相关――难分物质要有一定柱高和流速控制;流动相可参考TLC的条件,正确的流动相可以提高分离度并缩短分离时间。
(见附表“溶剂混溶性”)
流动相的常用溶剂为:
水甲醇丙酮乙酸乙酯二氯甲烷
上述溶剂的极性依次降低,对带有极性的被分离物而言,保留值和分离度依次递增;同理选用的凝胶柱高可依次降低,流速可以增大(或上样量可以增加)。
使用方法:将干粉浸泡于60—70%乙醇中过夜(充分搅拌),洗去可能存在的残留物,抽干然后湿态装柱,动态用一倍柱体积的60—70%乙醇淋洗,再用水洗净乙醇即根据自己选用的流动相体系平衡、上样
LH-20在不同溶剂中的溶胀性能:
溶剂混溶性表。
葡聚糖凝胶 Sephadex LH20 使用说明及使用心得

Sephadex G 型葡聚糖凝胶只适合在水中使用,Sephadex G-25 羟丙化 后就是 Sephadex LH-20。此君既有分子筛作用,在由极性与非极性溶剂组 成的溶剂中还有反相层析效果。虽然价位很高,但由性能颇佳,可再生利 用,所以倍受钦睐。此外上柱样品损失很少,对处理小样品较好,这也是 我们实验室常用的原因之一。
sephadexlh20柱子被弄脏了大多数情况下是由于样品没滤将柱头堵住或由于样品的死吸附一般很少发生使柱子的柱头部分污染一般的处理是将被污染的柱头部分的填料弃去具体做法很简单只将被污染的柱头部分的填料用玻棒轻轻搅起倒掉即可如果柱子整个被污染如果是将sephadexlh20用反相被污染办法如下依次用水naohnacl水溶液水甲醇洗涤被污染的柱子
不要着急,实验是一点一点做出来的,刚开始总是困难的.首先我要说 的是 Sephadex LH20 不是万能的,你的样品不一定适于用它分离,
1 "结果用约一个保留体积就洗完了",这很正常,这也是 Sephadex LH20 这种填料的特点:"洗脱体积一般为 2-3 个保留体积,对特殊保留强的化合 物,可洗脱 5 个保留体积",
3 "还有分到什么程度是用 Sephadex LH20 比较好?"
如果实验室 Sephadex LH20 很珍贵,分道较纯再用, 如果实验室 Sephadex LH20 很普及,只要满足使用的注意事项,较粗的样品可直接使用 Sephadex LH20 分离。日本的师兄都是用 Sephadex LH20 粗分,人家有钱, 所以不在乎。如果硅胶比 Sephadex LH20 还贵,你一定先用 Sephadex LH20 粗分,再用硅胶吧。有很多问题根本不是学术本身的问题,人也不可能在 真空中搞科研。哈哈,跑题了。
sephadex lh-20 的分离葡聚糖范围

sephadex lh-20 的分离葡聚糖范围
Sephadex LH-20 是一种常用的凝胶过滤材料,用于分离并提
纯生物大分子,包括蛋白质、核酸和多糖等。
对于葡聚糖来说,Sephadex LH-20 主要可用于分离和纯化大小适中的葡聚糖。
具体而言,Sephadex LH-20 适用于分离葡聚糖的范围一般是
分子量在1000到10000之间的葡聚糖。
较小的葡聚糖可能会
在透明小球中渗透或扩散,从而导致分离效果不佳。
较大的葡聚糖则可能无法顺利进入透明小球内部,也会影响分离效果。
需要注意的是,具体的适用范围也可能会因实验条件、溶剂体系、温度等因素而有所变化。
因此,在实际操作中,最好根据具体的实验目的和实验条件进行优化和确定。
葡聚糖凝胶使用说明书

葡聚糖凝胶使用说明书一、产品名称产品名称:葡聚糖凝胶型号:Gel-300二、适用范围葡聚糖凝胶适用于生物实验室、化学实验室、制药厂等场所,用于分离、纯化蛋白质、核酸、肽类等生物分子。
三、使用方法1. 准备葡聚糖凝胶和缓冲液。
根据所需的分离纯化效果,选择合适的缓冲液类型和浓度。
2. 将缓冲液加入玻璃柱或层析柱中,直至填满整个柱子。
3. 加入适量的葡聚糖凝胶,使其均匀分布在柱子的底部。
4. 将样品溶液缓慢地加入柱子中,注意不要过快,以免影响分离效果。
5. 收集洗脱液,并进行分析。
根据分离纯化的目的,可以采用不同的收集方法,如分步收集或集中收集。
6. 在每次使用后,及时清洗和保存凝胶柱,以延长其使用寿命。
四、注意事项1. 在使用葡聚糖凝胶前,应仔细阅读本说明书并遵守操作规程。
2. 避免直接接触皮肤和眼睛,若不慎接触,应立即用清水冲洗。
3. 使用过程中要避免剧烈震动或晃动,以免影响分离效果。
4. 在使用前应确认所需缓冲液的种类和浓度是否合适,避免浪费和影响分离效果。
5. 不要使用已经过期或变质的凝胶和缓冲液。
6. 在储存和使用过程中要保持环境干燥,避免潮湿和高温。
7. 使用后要及时清洗和保存凝胶柱,以免被污染和变质。
五、常见问题及解决方案1. 分离效果不佳:可能是由于凝胶或缓冲液质量问题、操作不当等原因引起的。
解决方法是检查凝胶和缓冲液的质量和浓度是否合适,确认操作规程是否正确。
若问题仍未解决,建议更换新的凝胶柱。
2. 柱子压力过高:可能是由于样品溶液中存在杂质或凝胶柱堵塞等原因引起的。
解决方法是检查样品溶液是否含有杂质,或者对样品进行预处理以去除杂质。
同时检查凝胶柱是否堵塞,若堵塞则进行清洗或更换新的凝胶柱。
3. 柱子漏液:可能是由于接头松动或密封圈损坏等原因引起的。
解决方法是重新拧紧接头或更换新的密封圈。
若问题仍未解决,建议联系售后服务与支持部门寻求帮助。
4. 洗脱液中含有杂质:可能是由于样品溶液中存在杂质或缓冲液不纯等原因引起的。
葡聚糖凝胶LH-20使用方法

产品简介:Sephadex G型葡聚糖凝胶只适合在水相中使用,羟基化得到的Sephadex LH-20适合用于有机溶剂分离嗜脂性分子,在有机溶剂中纯化天然产物。
葡聚糖凝胶LH-20分离主要以凝胶过滤为主,兼具反相分配的作用。
在凝胶过滤的作用下,大分子化合物的保留力弱,先被洗脱下来,分子最小的最后出柱;在反相洗脱溶剂中,起反相分配作用,极性大的物质的保留弱先被洗脱,极性小的化合物后出柱;
产品名称: 葡聚糖凝胶LH-20
英文名称:Sephadex LH-20
规格:25g
性状:多孔,白色微球
基质:交联葡聚糖
粒径:100-200目
工作Ph:2-11
操作温度:4-40度
球蛋白分离范围:100-4000
排阻极限:4-5kd(与所用溶剂有关)
保存条件:4-25度
使用说明:
1.凝胶悬浮液的制备
将干粉浸泡于60-70%乙醇中,充分搅拌过夜,洗去可能存在的残留物,根据自己的洗脱液平衡层析至少两个柱体积直到基线平稳为止。
2.洗脱溶剂
如果样品极性大,选用反相溶剂洗脱(甲醇-水),样品用最少体积的甲醇-水溶解,
过滤上柱;如果样品极性小,选用氯仿-甲醇正相洗脱。
3样品处理
用尽量少的洗脱试剂溶解样品,常压过滤。
4.湿法上柱
5.洗脱
控制流速,一般小于1drop/s。
6.再生以后下次使用。
葡聚糖凝胶使用说明

葡聚糖凝胶使用说明1.葡聚糖凝胶的制备2.葡聚糖凝胶的特性-生物相容性好:葡聚糖是一种天然产物,具有良好的生物相容性,不会产生免疫反应。
-可调节性强:葡聚糖凝胶的凝胶特性可以通过改变制备方法、葡聚糖浓度和pH值等条件来调节,以满足不同应用的需要。
-凝胶稳定性好:葡聚糖凝胶具有较好的物理稳定性和化学稳定性,能够在一定条件下保持凝胶状态。
-良好的保水性:葡聚糖凝胶具有良好的保水性能,可用作保湿剂,防止水分的蒸发。
-微生物阻隔性:葡聚糖凝胶的网络结构可以起到一定的微生物阻隔效果,可应用于医疗和食品包装等领域。
3.葡聚糖凝胶的应用3.1医疗应用-创面敷料:葡聚糖凝胶具有良好的吸附性和保湿性能,可用于制备创面敷料,促进伤口愈合。
-药物载体:葡聚糖凝胶的网状结构可以将药物包裹在其中,用于制备药物缓释系统。
-组织工程:葡聚糖凝胶可用作细胞培养的基质材料,用于组织工程的研究和临床应用。
3.2食品应用-增稠剂:葡聚糖凝胶可作为增稠剂添加到食品中,改善食品的口感和质感。
-稳定剂:葡聚糖凝胶具有良好的稳定性,可以作为乳化剂和稳定剂添加到食品中,延长食品的保质期。
-包装材料:葡聚糖凝胶的微生物阻隔性能可以应用于食品包装材料,起到保鲜的作用。
3.3化妆品应用-保湿剂:葡聚糖凝胶可用作化妆品中的保湿剂,增加产品的保湿性能。
-凝胶基质:葡聚糖凝胶可作为凝胶基质,在其中悬浮其他活性成分,提高产品的稳定性和渗透性。
-敏感肌肤护理:葡聚糖凝胶具有良好的生物相容性,可用于敏感肌肤的护理产品中,减少刺激和过敏反应。
3.4农业应用-保水剂:葡聚糖凝胶可用作土壤保水剂,改善土壤的水分状况,提高植物的生长。
-植物保护剂:葡聚糖凝胶可作为植物保护剂的载体,将其包裹在凝胶中,减少化学农药的使用量。
总结:葡聚糖凝胶具有许多优异的特性,广泛应用于医疗、食品、化妆品和农业等领域。
在使用葡聚糖凝胶时,需要根据具体的应用要求选择适当的制备方法和条件,并在应用过程中注意遵守相关的法律法规和安全操作规程,以确保产品的质量和安全性。
Seplife LH-20层析介质说明书

Seplife LH-20说明书1.产品介绍Seplife LH-20层析介质以葡聚糖G-25为基质,经羟丙基化所得,集凝胶过滤、分配层析和吸附层析于一体。
Seplife LH-20层析介质适用于亲脂性小分子化合物的纯化,能将结构性能非常相近的有机物进行分离,即可用于初步纯化步骤,也可用与最终精制步骤,如单体纯化或非对映同分异构体的分离,尤其适合中草药中具有生理活性有效成分的分离,如多酚类黄酮、胆固醇、脂肪酸、激素、维生素等。
2.性能介绍产品牌号Seplife LH-20外观白色球状,无臭无味粒径(干,μm)18~111排阻极限1~5KD(球蛋白)尺寸排阻模式小于总体积的20%正相分配模式小于总体积的1%最大流速(cm/h)480pH稳定性2~13(短期[CIP]),3~10(长期)操作温度4~40℃化学稳定性在常用的水相溶剂和有机溶剂中稳定应用适合中草药中具有生理活性有效成分的分离,如多酚类黄酮、胆固醇等3.使用方法3.1预处理(1)在室温下,将凝胶溶胀于层析溶剂中至少3小时,溶胀后胶体积的大小决定于所使用的溶剂体系,请参考凝胶溶胀表,计算特定柱体积所需要干胶的量。
在溶胀的过程中,要尽量避免过分搅拌,否则会破坏球形胶粒,且要避免使用磁力搅拌器。
(2)使溶胀的凝胶体积沉淀之后占总体积的75%,上层溶剂占25%,这时,悬浮液从一个容器倒入另一个容器时胶粒可移动。
凝胶溶胀表序号溶剂溶胀后的体积(ml/g干凝胶)溶剂吸收率(ml/g干凝胶)1 二甲基亚砜 4.4~4.6 —2 吡啶 4.2~4.4 —3 水 4.0~4.4 2.14 二甲基二甲酰胺 4.0~4.4 2.25 甲醇 3.9~4.3 1.96 氯仿 3.8~4.1 1.87 丙醇 3.7~4.0 —8 乙醇 3.6~3.9 1.89 丁醇 3.5~3.8 1.610 四氢呋喃 3.3~3.6 1.411 二氧六环 3.2~3.5 1.412 丙酮 2.4~2.6 0.813 四氯化碳 1.8~2.2 —14 苯 1.6~2.0 —15 乙酸乙酯 1.6~2.0 0.416 甲苯 1.5~1.6 0.23.2装柱装柱按照标准操作规程操作。
葡聚糖凝胶使用说明
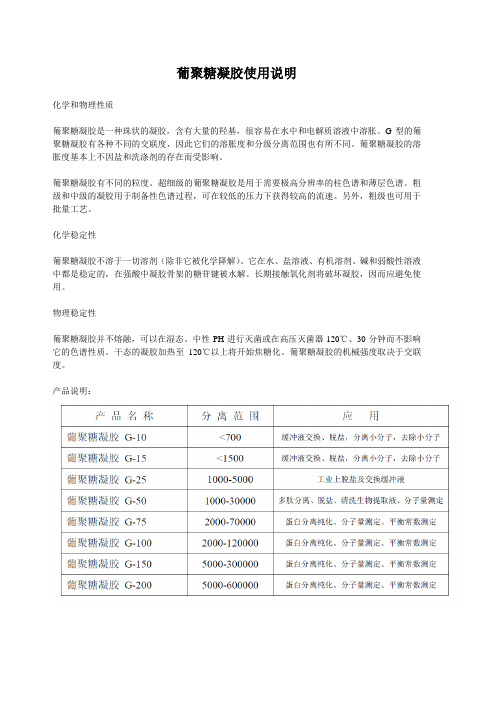
葡聚糖凝胶使用说明化学和物理性质葡聚糖凝胶是一种珠状的凝胶,含有大量的羟基,很容易在水中和电解质溶液中溶胀。
G型的葡聚糖凝胶有各种不同的交联度,因此它们的溶胀度和分级分离范围也有所不同。
葡聚糖凝胶的溶胀度基本上不因盐和洗涤剂的存在而受影响。
葡聚糖凝胶有不同的粒度。
超细级的葡聚糖凝胶是用于需要极高分辨率的柱色谱和薄层色谱。
粗级和中级的凝胶用于制备性色谱过程,可在较低的压力下获得较高的流速。
另外,粗级也可用于批量工艺。
化学稳定性葡聚糖凝胶不溶于一切溶剂(除非它被化学降解)。
它在水、盐溶液、有机溶剂、碱和弱酸性溶液中都是稳定的,在强酸中凝胶骨架的糖苷键被水解。
长期接触氧化剂将破坏凝胶,因而应避免使用。
物理稳定性葡聚糖凝胶并不熔融,可以在湿态、中性PH进行灭菌或在高压灭菌器120℃、30分钟而不影响它的色谱性质。
干态的凝胶加热至120℃以上将开始焦糖化。
葡聚糖凝胶的机械强度取决于交联度。
产品说明:使用方法:1. 乙醇浸泡:在室温下,将干粉浸泡于50-60%乙醇中至少24小时,并不断搅拌以保证凝胶溶胀,用无盐水洗去残存的乙醇滤干;2. 无盐水浸泡:室温下,在无盐水中充分溶胀24小时,间隙搅拌,以保证凝胶的完全溶胀,然后;3. 盐酸浸泡:在常温下再用0.2N HCl浸泡12小时,间隙搅拌,滤干,水洗只中性;4. 将溶胀好的凝胶脱气后(真空抽滤或超声波)根据装柱要求一次性置入柱内,注意保持湿态装柱,并避免柱内产生气泡或断层;5. 上样前平衡层析柱至少3-5个柱体积直到记录仪基线变得平稳为止(流出液的PH值等于上柱的Buffer的PH值);6. 凝胶过滤的上样量一般为5%的柱床体积,我们建议初次上样控制在1-2%的床体积,视分离情况可以调整;脱盐时上样量可以达到20%的柱床体积,柱高的选择也与分离要求相关,柱高控制在40-50cm 以下,过高的凝胶层会引起较大的反压,应当尽可能避免。
难分离物质要有一定柱高和流速控制,脱盐时高径比为5:1即可;7. 洗脱方法:可以用无盐水,也可以采用上柱时的缓冲液洗脱;在上柱Buffer中加入NaCl等梯度洗脱或盐梯度洗脱也可以完全分离纯化;8. 在位清洗(CIP)凝胶使用十次后作一次CIP,目的是去除柱床内沉淀的及顽固残留的蛋白。
Sephadex LH-20

葡聚糖凝胶柱使用及注意事项1 Sephadex G型葡聚糖凝胶只适合在水中使用,Sephadex G-25羟丙化后就是Sephadex LH-20。
其既有分子筛作用,在由极性与非极性溶剂组成的溶剂中还有反相层析效果。
虽然价位很高,但由于性能颇佳,可再生利用,所以倍受亲睐。
此外上柱样品损失很少,对处理小样品较好,这也是我们实验室常用的原因之一。
2 Sephadex LH20的原理。
Sephadex LH20的分离原理主要有两方面:以凝胶过滤作用为主,兼具反相分配的作用(在反相溶剂中)。
因为凝胶过滤作用,所以大分子的化合物保留弱,先被洗脱下来,小分子的化合物保留强,最后出柱。
如果使用反相溶剂洗脱,Sephadex LH20对化合物还起反相分配的作用,所以极性大的化合物保留弱,先被洗脱下来,极性小的化合物保留强,后出柱。
如果使用正相溶剂洗脱,这主要靠凝胶过滤作用来分离。
3 Sephadex LH20洗脱溶剂。
看完第2点后,就应该清楚Sephadex LH20洗脱溶剂因分为两类:反相和正相两种。
用得最多的是反相溶剂洗脱,以甲醇--水系统最为常见,先用水,逐渐增加甲醇比例,最后用100%甲醇冲柱。
正相系统以氯仿--甲醇最为常见,先用50%氯仿--甲醇,逐渐增加甲醇比例,最后用100%甲醇冲柱。
4 Sephadex LH20样品的处理和洗脱溶剂的选择。
如果样品极性大,这选用反相溶剂洗脱(甲醇--水),样品用最少体积的甲醇--水(尽可能甲醇少一些)溶解,过滤后,湿法上样(一定要滤喔!要是把Sephadex LH20堵啦,就得将Sephadex LH20的柱头部分弃去,很心痛呀)。
如果样品极性小,这选用正相溶剂洗脱(氯仿--甲醇),样品用最少体积的氯仿--甲醇溶解,过滤后,湿法上样。
5 Sephadex LH-20的步骤。
(1)选择条件:梯度洗脱在Sephadex使用中并不象在正相柱层析中那么重要。
首先你的样品须要能溶解在尽量少量的洗脱剂中。
葡聚糖凝胶使用说明

葡聚糖凝胶使用说明化学和物理性质葡聚糖凝胶是一种珠状的凝胶,含有大量的羟基,很容易在水中和电解质溶液中溶胀。
G型的葡聚糖凝胶有各种不同的交联度,因此它们的溶胀度和分级分离范围也有所不同。
葡聚糖凝胶的溶胀度基本上不因盐和洗涤剂的存在而受影响。
葡聚糖凝胶有不同的粒度。
超细级的葡聚糖凝胶是用于需要极高分辨率的柱色谱和薄层色谱。
粗级和中级的凝胶用于制备性色谱过程,可在较低的压力下获得较高的流速。
另外,粗级也可用于批量工艺。
化学稳定性葡聚糖凝胶不溶于一切溶剂(除非它被化学降解)。
它在水、盐溶液、有机溶剂、碱和弱酸性溶液中都是稳定的,在强酸中凝胶骨架的糖苷键被水解。
长期接触氧化剂将破坏凝胶,因而应避免使用。
物理稳定性葡聚糖凝胶并不熔融,可以在湿态、中性PH进行灭菌或在高压灭菌器120℃、30分钟而不影响它的色谱性质。
干态的凝胶加热至120℃以上将开始焦糖化。
葡聚糖凝胶的机械强度取决于交联度。
产品说明:使用方法:1. 乙醇浸泡:在室温下,将干粉浸泡于50-60%乙醇中至少24小时,并不断搅拌以保证凝胶溶胀,用无盐水洗去残存的乙醇滤干;2. 无盐水浸泡:室温下,在无盐水中充分溶胀24小时,间隙搅拌,以保证凝胶的完全溶胀,然后;3. 盐酸浸泡:在常温下再用0.2N HCl浸泡12小时,间隙搅拌,滤干,水洗只中性;4. 将溶胀好的凝胶脱气后(真空抽滤或超声波)根据装柱要求一次性置入柱内,注意保持湿态装柱,并避免柱内产生气泡或断层;5. 上样前平衡层析柱至少3-5个柱体积直到记录仪基线变得平稳为止(流出液的PH值等于上柱的Buffer的PH值);6. 凝胶过滤的上样量一般为5%的柱床体积,我们建议初次上样控制在1-2%的床体积,视分离情况可以调整;脱盐时上样量可以达到20%的柱床体积,柱高的选择也与分离要求相关,柱高控制在40-50cm 以下,过高的凝胶层会引起较大的反压,应当尽可能避免。
难分离物质要有一定柱高和流速控制,脱盐时高径比为5:1即可;7. 洗脱方法:可以用无盐水,也可以采用上柱时的缓冲液洗脱;在上柱Buffer中加入NaCl等梯度洗脱或盐梯度洗脱也可以完全分离纯化;8. 在位清洗(CIP)凝胶使用十次后作一次CIP,目的是去除柱床内沉淀的及顽固残留的蛋白。
葡聚糖凝胶的操作方法

葡聚糖凝胶的操作方法
1.将葡聚糖凝胶粉末放入1.5ml离心管中,并加入所需的培养基或溶液(通常是0.1M PBS缓冲液)
2.用紫外灯或消毒灯照射管子和粉末,以杀菌消毒。
3.将管子在室温下静置15分钟,使凝胶充分水解。
4.在使用前,用无菌过滤器或离心管转运转移液体中的小颗粒或杂质。
5.将细胞或材料悬浮在凝胶中,并快速转移和组装需要的实验器具(如培养皿、培养板等)。
6.将实验器具放置在37的恒温箱中,使凝胶在液体中固定并形成3D结构。
7.根据实验的需要,可以选择添加细胞营养物质或生长因子等,以促进细胞的生长和分化。
8.在实验结束后,可以用酶解剂将凝胶中的细胞和材料溶解,并收集并分离细胞和其他成分,进行后续的分析和研究。
凝胶Sephadex LH-20使用方法及注意事项

凝胶使用方法及注意事项1原理Sephadex LH-20的分离原理主要有两方面:以凝胶过滤作用为主,兼具反相分配的作用(在反相溶剂中)。
因为凝胶过滤作用,所以大分子的化合物保留弱,先被洗脱下来,小分子的化合物保留强,最后出柱。
如果使用反相溶剂洗脱, Sephadex LH-20对化合物还起反相分配的作用,所以极性大的化合物保留弱,先被洗脱下来,极性小的化合物保留强,后出柱。
如果使用正相溶剂洗脱,这主要靠凝胶过滤作用来分离。
2.前处理及装柱Sephadex LH-20在使用前必须进行溶胀,溶胀过程中必须避免过分搅拌,否则会破坏球形胶粒。
(1)室温下,将凝胶溶胀于层析液(一般为甲醇)中至少三小时(2)使溶胀胶体积沉淀后占总体积的75%,上层溶剂占25%凝胶悬浮液黏度要适宜A.太稠会在搅拌时产生气泡;太稀会导致装柱时沉降时间长,加凝胶悬浮液的次数增加;B.将凝胶悬浮液静止后所得上清液弃去,保留高于凝胶液面约1 cm的液体即可;C 装柱混悬液的浓度以流动性好,搅拌阻力小为宜。
(3)装柱的要点A 装柱前,先在色谱柱中加入约1/4柱高的液体(溶胀时所用的试剂);B 装柱时,将下端活塞打开,流速尽量大,但要保证小于凝胶沉降速度,否则会干柱;C将凝胶悬浮液搅拌均匀,以漏斗倒入柱子中即可;3.流动相1.分子筛作用,常用的是甲醇、甲醇+氯仿混合溶剂。
甲醇:氯仿一般为1:1左右,切不可用氯仿做为流动相!氯仿比重大,用单纯的氯仿做流动相,填料将浮起来,严重影响分离效果!!2.反相分配作用,常用的是甲醇/水,比例可以根据实际情况进行调整,也可以是梯度洗脱(先用水,逐渐增加甲醇比例,最后用100%甲醇冲柱)4.样品的处理及洗脱过程(1).最重要的一点:用尽可能少的溶剂溶解样品,样品可以很浓。
如果溶解体积很大,一定要先进行浓缩,否则基本没有多大的分离效果。
上样体积一般为柱体积的1%~5%。
(2).很重要的一点:尽可能用起始洗脱溶剂溶解样品(很多情况下样品并不能在起始溶剂中很好地溶解)。
Sephadex LH20的使用说明

Sephadex LH-20的使用说明【制备凝胶悬浮液】Sephadex LH-20在使用之前必须进行溶涨。
在溶涨过程中,要尽量避免过分搅拌,否则会破坏球型胶粒,且要避免使用磁力搅拌器。
1 在室温下,将凝胶溶涨于层析溶液中至少三小时。
溶涨后胶体积的大小决定于使用的溶剂系统,请参考页后之干胶溶涨表计算特定主柱体积所需要干胶的量。
2 使溶涨胶体积沉淀之后涨占总体积的75%,上层溶剂占25%,这时,悬浮液从一个容器倒入另一容器时胶粒可移动。
3 将溶涨后的凝胶根据装柱要求均匀倒入柱内,在保证胶粒不变形的前提下,应尽可能高的压力下装柱,反压不要超过1.5ba。
【平衡】上样前,用洗脱液平衡层析柱至少两个柱体积直到基线变得平稳为止。
如改变溶剂应注意凝胶在新溶剂中的溶涨性质,并根据性质确定柱高调节器的位置。
如使用相同的溶剂,在以后的层析柱中柱平衡可以省略。
【洗脱液】为确保延长层析柱的使用寿命,所有的缓冲液都应该离心或经过0.45um的膜过滤以除去杂质。
【样品】样品体积应该占柱体积的1-2%,同样在使用之前样品应离心或经过0.45um的膜过滤。
【洗脱】洗脱流速应根据情况而定,最大线流速约为12cm/min(反压1.5ba),建议流速为1-10cm/h。
总体来说,较低的流速,具有较高的分辨率。
【再生】凝胶再生通常是先用2-3柱体积的洗脱液进行清洗,如更换洗脱液,则需重新平衡。
【溶涨体积】由于Sephadex LH-20的溶涨体积依赖于溶剂,所以对于不同直径的柱可以根据比例增加或减少旧柱体积以便计算出新体积。
新体积=旧体积*(新柱体积/旧柱体积)【胶的性质】Sephadex LH-20同时具备亲水和亲脂双重性质,且被分离物质的极性在分离过程中起着重要作用。
干胶溶涨表。
GE公司的葡聚糖凝胶填料LH-20的使用说明

equilibration
sample injection volume
wash
5–10 CV
5–10 CV
non-bound molecules elute before
gradient begins
gradient elution
10–20 CV
salt-free elution buffer
2–5 CV
Highly hydrophobic proteins bind tightly to highly hydrophobic ligands. Screen several hydrophobic media. Begin with a medium of low hydrophobicity if the sample has very hydrophobic components. Select the medium which gives the best resolution and loading capacity at a low salt concentration.
Weak ion exchangers DEAE and ANX (anion exchange) and CM (cation exchange): fully charged over a narrower pH range (pH 2 to 9 and pH 6 to 10, respectively), but give alternative selectivities for separations.
Choice of ion exchanger Begin with a strong exchanger, to allow work over a broad pH range during method development .
葡聚糖凝胶安全操作及保养规程

葡聚糖凝胶安全操作及保养规程葡聚糖凝胶简介葡聚糖凝胶是一种可重复使用的生物材料,由天然高聚糖葡聚糖制成。
其特点是具有强盛的吸水性和高度的生物相容性,能够支持各种3D细胞培养和组织工程。
安全操作1.手术前处理:在进行手术前,要对葡聚糖凝胶进行消毒处理。
消毒液不要直接浸泡葡聚糖凝胶中。
2.贮存温度:葡聚糖凝胶的贮存温度范围是2-8℃,在常温环境下不要让其暴露太久。
葡聚糖凝胶长时间放在高温环境中会使凝胶变形、损坏或变质,影响使用效果。
3.操作前检查:在进行葡聚糖凝胶操作之前,要根据生产批号、生产日期、有效期、贮存条件等进行检查。
4.操作过程中:在操作过程中,要注意手套的选择,尽可能选择质量好、颜色鲜艳、无杂质、无破损的手套,防止对凝胶的污染。
5.严禁注射使用:葡聚糖凝胶严禁注射使用,不得与注射器、输液器等穿刺性器械接触。
6.正确使用:手术中应按照使用说明书操作,严格掌握操作技术。
保养规程1.注意环境条件:葡聚糖凝胶的使用环境要保持清洁卫生,不要让其受到扰动和振动。
2.防潮防晒:葡聚糖凝胶不能长时间暴露于强光下和潮湿的环境中,防止凝胶失去弹性和变质。
3.防止污染:在使用过程中,要注意避免凝胶被污染,应该使用无菌器具进行操作。
4.防止变形:使用后,葡聚糖凝胶可以用干净的纸巾或棉布轻轻擦拭外表面,然后封存起来。
不要沾水,不宜摆放成卷式。
5.制定规范的保养计划:要制定规范的保养计划,记录葡聚糖凝胶不同批次的使用情况,及时更新保养记录。
结语以上就是葡聚糖凝胶的安全操作及保养规程。
通过掌握这些规程,可以提高葡聚糖凝胶的使用寿命和使用效果,避免不必要的风险和污染。
Sephadex LH-20的应用综述

页眉内容1. Sephadex LH-20简介羟丙基葡聚糖凝胶LH-20是一种Sephadex G-25的羟丙基衍生物,字母LH的含义是这种凝胶骨架在亲脂溶剂中或在水溶剂中都能溶胀。
在G-25分子中引入羟丙基以代替分子中羟基上的氢,葡聚糖凝胶分子的葡萄糖部分将与羟丙基形成醚键连接:R—OH――→R—O—CH2CH2CH2OH与Sephadex G相比,Sephadex LH-20分子中-OH总数虽无改变,但碳原子所占比例却相对增加了,从而使葡聚糖的亲脂性增大。
这种凝胶既有亲水性,又有亲脂性,不仅可在水中应用,也可在极性有机溶剂或它们与水组成的混合溶剂中膨润使用,如丁醇、氯仿、四氢呋喃、二氧六环等,应用范围增大,对黄酮、蒽醌、香豆素等成分也能分离。
SephadexLH-20除保留有Sephadex G-25原有的分子筛特性,可按分子量大小分离物质外,在有极性与非极性溶剂组成的混合溶剂中常常起到反相分配色谱的效果,适用于不同类型有机物的分离,在天然药物分离中得到了越来越广泛的应用。
使用注意事项:羟丙基葡聚糖凝胶Sephadex LH-20虽然是一种两性凝胶,但由于在不同溶剂中的溶胀因子各不相同(见表1),因此在柱中直接更换溶剂是不允许的,床体积在2.5mL /g干胶以下的不能用于GPC分析。
这种凝胶在有机溶剂中分离较小分子量的脂溶性化合物是十分有效的。
但在使用时不允许有氧化剂存在。
再生与保存:Sephadex LH-20价格比较昂贵。
用过的Sephadex LH-20可以反复再生使用,而且柱子的洗脱过程往往就是柱子的再生过程。
短期不用时可以水洗→含水醇洗(醇的浓度逐步递增)→醇洗,最后泡在醇中贮于磨口瓶中备用。
如长期不用时,可在以上处理基础上,减压抽干,再用少量乙醚洗净抽干,室温充分挥散至无醚味后,60~80℃干燥后保存。
Sephadex LH-20不仅具有亲水性能,可以吸水膨胀,而且也有一定的亲脂性,可以吸收有机溶剂而膨胀。
Sephadex LH-20 装填和使用方法

27-163 um (直径) 103 um (直径) 720cm/min 60 cm/min
2-11 2-13 在许多水溶液及有机溶剂系统中都 稳 定 。 在 pH2 以 下 或 强 氧化剂中不稳定。 121℃可忍受 20 分种 4℃到 40℃
4-25℃(干燥) 4-8 ℃ , pH6-8 , 切 勿 冷 冻 , 加 入 抑菌剂(如 20%乙醇,0.04%叠氮钠)
--2-电话:010-81995884、82715322
Sephadex LH-20 装填和使用方法
样品
样品体积应该占柱总体积的 1-2%,同样在使用之前样品应该离心或经过 0.45um 的膜过滤。
洗脱
洗 脱 流 速 应 根 据 情 况 而 定 , 最 大 线 性 流 速 约 12cm/min (反压 1.5ba),建议流速为 1-10cm/h。总体来说,较低的流速,具有较高的分辩 率。
平衡
上样前,用洗脱液平衡层析柱至少两个柱体积直到基线变得平稳为止,如 改变溶剂应该注意凝胶在新溶剂中的溶胀性质,并根据性质确定柱高调节器的位 置,如使用相同的溶剂,在以后的层析中柱平衡可以省略。
洗脱液
为确保延长层析柱的使用寿命,所有的缓冲液都应该离心或经过 0.45um 的
膜过滤以除去杂质。
北京元宝山色谱科技有限公司
再生
凝胶再生通常是先用 2-3 个柱体积的洗脱液进行清洗,如更换洗脱液,则 需要重新平衡。
体积流速与线性流速的关系
线性流速=体积流速/横截面积
溶胀体积
由于 Sephadex LH-20 的溶胀体积依赖于溶剂,所以对于不同直径的柱可根 据比例增加或减少旧柱体积以便计算出新体积。
新体积= 旧体积×(新ቤተ መጻሕፍቲ ባይዱ体积/ 旧柱体积)
葡聚糖凝胶柱的使用方法2

葡聚糖凝胶柱的使用方法:(1) 预处理称取Sephadex G-25(50-100目)约5g ,加入蒸馏水100ml ,置室温下3h 进行溶胀。
(2) 装柱 凝胶层析柱的直径与柱长之比一般为1:15。
柱的底部用装有细玻璃管的橡皮塞塞紧,用洗净的玻璃丝(约200目尼龙布)垫底或购买类似规格的商品柱。
然后将柱垂直安装好,先加入1/3柱体积蒸馏水,接着将溶胀好的凝胶边搅匀边连续装入,使它们在柱内自然沉降。
同时大开下口慢速流出蒸馏水。
装柱后的凝胶必须均匀,不能有气泡或明显条纹。
否则,必须到出重装,装好后,用蒸馏水平衡2-3h 即可加样品分离。
(3) 加样加样前,首先把柱内凝胶上面多余的蒸馏水放出,直到柱内液面与凝胶表面相齐(或留一极薄液层)为止。
然后,由柱的上端加水解液2ml ,注意不要让溶液把凝胶冲松浮起,加完样品后,打开下口缓慢放出液体至液面与凝胶面相齐,再用少量蒸馏水冲洗原来盛样品的容器2-3次,待全部进入层析柱后,即可进行洗脱。
(4) 洗脱与收集洗脱时,用蒸馏水作洗脱剂,并且要连续不断地进行,使凝胶柱上端保持一定的液层,防止凝胶柱表面的液体流干。
本实验洗脱液流出的速度应控制在0.8-1.0ml/min 。
洗脱液的收集采用分管连续顺序收集,每管收集3ml ,共收集10管。
据经验,4或5号管核苷酸浓度最大,可作为层析鉴定的样品液。
但因层析柱长度的差异,管号会有变化,必要时可用紫外检测A260nm ,找出浓度最大的管号。
(5) 凝胶的再生和回收凝胶柱使用一次后,必须反冲疏松一次,平衡后再使用。
若使用数次,就需要再生处理。
用0.1mol/L NaOH-0.5mol/L NaCl 溶液浸泡,然后用蒸馏水洗至中性备用。
若实验完毕,将再生后的凝胶在布氏漏斗上用蒸馏水洗涤抽干,再用95%乙醇洗两次,在60℃烘箱中烘干,回收保存。
实验五. 葡聚糖凝胶层析【实验目的】1.掌握葡聚糖凝胶的特性及凝胶层析的原理。
2.学习葡聚糖凝胶层析的基本操作技术。
葡聚糖凝胶的使用说明

葡聚糖凝胶使用说明化学和物理性质葡聚糖凝胶是一种珠状的凝胶,含有大量的羟基,很容易在水中和电解质溶液中溶胀。
G型的葡聚糖凝胶有各种不同的交联度,因此它们的溶胀度和分级分离范围也有所不同。
葡聚糖凝胶的溶胀度基本上不因盐和洗涤剂的存在而受影响。
葡聚糖凝胶有不同的粒度。
超细级的葡聚糖凝胶是用于需要极高分辨率的柱色谱和薄层色谱。
粗级和中级的凝胶用于制备性色谱过程,可在较低的压力下获得较高的流速。
另外,粗级也可用于批量工艺。
化学稳定性葡聚糖凝胶不溶于一切溶剂(除非它被化学降解)。
它在水、盐溶液、有机溶剂、碱和弱酸性溶液中都是稳定的,在强酸中凝胶骨架的糖苷键被水解。
长期接触氧化剂将破坏凝胶,因而应避免使用。
物理稳定性葡聚糖凝胶并不熔融,可以在湿态、中性PH进行灭菌或在高压灭菌器120℃、30分钟而不影响它的色谱性质。
干态的凝胶加热至120℃以上将开始焦糖化。
葡聚糖凝胶的机械强度取决于交联度。
产品说明:使用方法:1. 乙醇浸泡:在室温下,将干粉浸泡于50-60%乙醇中至少24小时,并不断搅拌以保证凝胶溶胀,用无盐水洗去残存的乙醇滤干;2. 无盐水浸泡:室温下,在无盐水中充分溶胀24小时,间隙搅拌,以保证凝胶的完全溶胀,然后;3. 盐酸浸泡:在常温下再用0.2N HCl浸泡12小时,间隙搅拌,滤干,水洗只中性;4. 将溶胀好的凝胶脱气后(真空抽滤或超声波)根据装柱要求一次性置入柱内,注意保持湿态装柱,并避免柱内产生气泡或断层;5. 上样前平衡层析柱至少3-5个柱体积直到记录仪基线变得平稳为止(流出液的PH值等于上柱的Buffer的PH值);6. 凝胶过滤的上样量一般为5%的柱床体积,我们建议初次上样控制在1-2%的床体积,视分离情况可以调整;脱盐时上样量可以达到20%的柱床体积,柱高的选择也与分离要求相关,柱高控制在40-50cm 以下,过高的凝胶层会引起较大的反压,应当尽可能避免。
难分离物质要有一定柱高和流速控制,脱盐时高径比为5:1即可;7. 洗脱方法:可以用无盐水,也可以采用上柱时的缓冲液洗脱;在上柱Buffer中加入NaCl等梯度洗脱或盐梯度洗脱也可以完全分离纯化;8. 在位清洗(CIP)凝胶使用十次后作一次CIP,目的是去除柱床内沉淀的及顽固残留的蛋白。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
问:分得效果不是很好,上了有 8 毫升的样,我用甲醇洗脱,结果用 约一个保留体积就洗完了,东西不仅越分越少,而且仍然和没上柱之前差 不多,很让人困惑,郁闷。
了 1g 干态的,Sephadex LH20 对不同溶剂中的保留体积: water 2.1ml MeOH 1.9ml EtOH 1.8ml CHCl3 1.6ml n-BuOH 1.6ml 丙酮 0.8ml 乙酸乙酯 0.4ml 甲苯 0.2ml
2 "还有是不是样品的溶解是不是要与洗脱的起使浓度相同?如何确定样品 在最佳配比的容液中溶呢?"
不要着急,实验是一点一点做出来的,刚开始总是困难的.首先我要说 的是 Sephadex LH20 不是万能的,你的样品不一定适于用它分离,
1 "结果用约一个保留体积就洗完了",这很正常,这也是 Sephadex LH20 这种填料的特点:"洗脱体积一般为 2-3 个保留体积,对特殊保留强的化合 物,可洗脱 5 个保留体积",
3. 样品的处理和洗脱溶剂的选择。
如果样品极性大,选用反相溶剂洗脱(甲醇--水),样品用最少体积 的甲醇--水(尽可能甲醇少一些)溶解,过滤后,湿法上样(必须要进 行过滤!否则把 Sephadex LH-20 堵塞,就必须将 Sephadex LH-20 的柱头 部分弃去,造成不必要的浪费)。
如果样品极性小,这选用正相溶剂洗脱(氯仿--甲醇),样品用最少 体积的氯仿--甲醇溶解,过滤后,湿法上样。
当然有影响,Sephadex LH20 在不同的溶剂中的吸涨程度是不同的(任何 填料都是这样,只是 Sephadex LH20 很明显),一般在丙酮,乙酸乙酯 中收 缩很厉害,所以一般不用丙酮,乙酸乙酯 作溶剂,如果前后使用的两种洗脱 溶剂对 Sephadex LH20 的吸涨程度相差很大,还会产生大量气泡.以下列举
样品的溶解最好与洗脱的起使浓度相同,但有时(其实是多数情况下), 都办不到。对 Sephadex LH20 上样样品的要求是:
1 样品一定要溶解(Sephadex LH20 很贵,要保护填料,我看植化的同 志对好填料看得都很重,职业问题,哈哈哈;同时,避免样品不溶解造成 的脱尾)
2 溶解样品的体积尽可能小(色谱分离理论的基本要求,减小原始谱带 宽度)
Sephadex LH20 使用心得谈:
分离的技巧,最后说说我的使用心得 (1) 流速不可太快,切切不可新急,所谓欲速则不达。 (2)柱子尽可能长, Sephadex LH20 柱长的增加将极大地改善分离,所 不要吝惜填料,宁可将填料全装在一根大柱子中,不要将填料装成几根小 柱。所谓集中优势兵力,打击敌人。 (3) 馏分一定要接的细,可 1/10,或 1/20 个保留体积接成一馏分。 (4) 洗脱体积一般为 2-3 个保留体积,对特殊保留强的化合物,可洗脱 5 个保留体积。 (5)鞣质成分死吸附严重,如不在乎填料者,可用 Sephadex LH20 分鞣质。 (6)Sephadex LH20 对黄酮类成分的分离效果极佳,方法很成型,有大量 文献参考。 (7)填料反复使用,每次用完,一般可用甲醇将柱子洗干净,然后用下一 次分离的起步溶剂将甲醇替换出来,待用
3 样品的溶解最好与洗脱的起使浓度相同(若样品的溶解溶剂比洗脱的 起使浓度洗脱能力强,则会人为增加洗脱起使溶剂的洗脱能力;同时若样 品的溶解溶剂与洗脱的起始溶剂差别很大,样品可能因为溶解性的问题而 析出。)
以上三点是上样的基本要求,有时很难求全,只有根据具体的实际来决 定了。一般我的做法是满足 1,2 点,尽量满足第三点,“如果样品极性大, 这选用反相溶剂洗脱(甲醇--水),样品用最少体积的甲醇--水(尽 可能甲醇少一些)溶解”,请注意我的陈述“尽可能”,
1. 葡聚糖凝胶 LH-20 的原理。
葡聚糖凝胶 LH-20 的分离原理主要有两方面:以凝胶过滤作用为主, 兼具反相分配的作用(在反相溶剂中)。因为凝胶过滤作用,所以大分子 的化合物保留弱,先被洗脱下来,小分子的化合物保留强,最后出柱。
如果使用反相溶剂洗脱, Sephadex LH-20 对化合物还起反相分配的 作用,所以极性大的化合物保留弱,先被洗脱下来,极性小的化合物保留 强,后出柱。
2) 冷凝液一般使用水,如果配一台冷阱,使用半量的水配比上办量的 汽车冷冻液, 效果棒极了
3) 提高蒸发温度当然可以提高蒸发的效率,但可能发生物质的变化, 国产旋转薄膜,水泵,用水冷,当然就只好提高蒸发温度了。我用东京理化的 旋转薄膜,1/2 汽车冷冻液冷凝,隔膜泵,蒸水不到 45 度,很爽!
3 向要蒸的水溶液中加甲醇,使甲醇占到 30%,蒸出速度将大大提高! Sephadex LH20 柱子被弄脏了,大多数情况下是由于样品没滤, 将柱头堵住, 或由于样品的死吸附(一般很少发生),使柱子的柱头部分污染,一般的处理 是将被污染的柱头部分的填料弃去,具体做法很简单,只将被污染的柱头部 分的填料用玻棒轻轻搅起,倒掉即可,
3 "还有分到什么程度是用 Sephadex LH20 比较好?"
如果实验室 Sephadex LH20 很珍贵,分道较纯再用, 如果实验室 Sephadex LH20 很普及,只要满足使用的注意事项,较粗的样品可直接使用 Sephadex LH20 分离。日本的师兄都是用 Sephadex LH20 粗分,人家有钱, 所以不在乎。如果硅胶比 Sephadex LH20 还贵,你一定先用 Sephadex LH20 粗分,再用硅胶吧。有很多问题根本不是学术本身的问题,人也不可能在 真空中搞科研。哈哈,跑题了。
2 .像水这种高沸点的溶剂是很难蒸干的,,办法是有的,先看看旋转薄
膜的几个要素: 真空度, 冷凝液, 蒸发温度. 1) 真空度决定于水泵的效率和系统的密闭性.一般的国产水泵就能满
足日常的需要(包括环水,水泵中的水很快就会变得很热,将极大地减少水泵的效率,且会 将抽出的溶剂挥散出来,很不好!国产的旋转薄膜配的垫圈很烂,全不耐氯 仿等有机溶剂,当用国产的旋转薄膜蒸过氯仿等有机溶剂,垫圈就废了.所 以要多预备几个垫圈.
2 "我用甲醇洗脱,而且仍然和没上柱之前差不多",说明你的样品组分 之间分子大小差别不大,所以 Sephadex LH20 的凝胶过滤作用不起作用了, 如果你还用 Sephadex LH20 分离,那你应该利用他反相分配的作用,即先用 低浓度的甲醇/水,逐渐提高甲醇比例,最后才用甲醇洗脱。
1 XX 提到用少量的甲醇/水-甲醇洗脱,但洗出的流份比较难处理,是指 甲醇水难蒸干吗?其实这根本不应成为问题。XX 请想一想,做植化的,哪有遇 不到甲醇水的时候, ODS 柱层用甲醇水洗脱, Sephadex LH20 柱层用甲醇水 洗脱,D101 用乙醇水洗脱, HP20 用甲醇水洗脱, 高效液相最常用的是反相, 流动相还是甲醇水,可见甲醇水是植化同志最亲密的朋友! 所以蒸不干也 要蒸,想想办法吗!
流动相的常用溶剂为:水 甲醇 丙酮 乙酸乙酯 二氯甲烷
上述溶剂的极性依次降低,对带有极性的被分离物而言,保留值和分离度 依次递增;同理选用的凝胶柱高可依次降低,流速可以增大(或上样量可 以增加,树脂体积在低极性溶剂中明显收缩)。
溶剂的溶解性,极性,沸点,毒性都是要考虑到的。 二氯甲烷通常对被分离物质间的极性和碱性差异比较小时采用。甲醇通 常对带环状(包括苯环)物质分离采用,葡聚糖凝胶对环状物质有强烈吸 附。 LH-20 同时具备亲水和亲脂双重性质,且被分离物质的极性在分离过程 中起着重要作用。
使用方法:将干粉浸泡于 60—70%乙醇中过夜(充分搅拌),洗去可 能存在的残留物,抽干然后湿态不间隙装柱,绝对不能出现凝胶断层(否 则要重新装柱),动态用一倍柱体积的 60—70%乙醇淋洗,再用水洗净乙 醇即根据自己选用洗脱液平衡层析柱至少两个柱体积直到基线变得平稳为
止,如改变溶剂应该注意凝胶在新溶剂中的溶胀性质,并根据性质确定柱 高.如使用相同的溶剂,在以后的层析中柱平衡可以省略。
如果使用正相溶剂洗脱,这主要靠凝胶过滤作用来分离。
2. 葡聚糖凝胶 LH-20 洗脱溶剂。
葡聚糖凝胶 LH-20 洗脱溶剂分为两类:反相和正相两种。 用得最多的是反相溶剂洗脱,以甲醇--水系统最为常见,先用水,逐 渐增加甲醇比例,最后用 100%甲醇冲柱。 正相系统以氯仿--甲醇最为常见,先用 50%氯仿--甲醇,逐渐增 加甲醇比例,最后用 100%甲醇冲柱。
问:在不同的溶剂中的吸涨程度是不是不同? 那进行梯度洗脱会不会有影响.还有是不是样品的溶解是不是要与洗脱的 起使浓度相同? 如何确定样品在最佳配比的容液中溶呢? 还有分到什么程度是用 Sephadex LH20 比较好?
解答如下: 1 "在不同的溶剂中的吸涨程度是不是不同?那进行梯度洗脱会不会有影 响."
葡聚糖凝胶 Sephadex LH-20 使用说明
Sephadex G 型葡聚糖凝胶只适合在水中使用,Sephadex G-25 羟丙化 后就是 Sephadex LH-20。此君既有分子筛作用,在由极性与非极性溶剂组 成的溶剂中还有反相层析效果。虽然价位很高,但由性能颇佳,可再生利 用,所以倍受钦睐。此外上柱样品损失很少,对处理小样品较好,这也是 我们实验室常用的原因之一。
Sephadex LH-20 适合用于有机溶剂分离嗜脂性分子,天然产物在有机 溶剂中的纯化。可以非常经济的大规模制备各种天然产物,尤其在中药有 效成分提取中作为大孔吸附树脂解析物的纯化。
结合凝胶过滤﹑分配色谱及吸附层析于一身,能分离结构相近的分子。 因此使用中要考略几种色谱的作用机制。
最高载量可达 250mg 样品/ml 凝胶﹑极少需要再生﹑使用得当,分离效 果可保持不变。上样量视被分离物的结构性能的差异而定:差异大,则大; 差异小,则小。凝胶过滤的上样量一般为 5-7%的床体积,我们建议初次 上样量控制在 1-2%的床体积,视分离情况可以逐步增加;柱高的选择也 与分离要求相关――难分物质要有一定柱高和流速控制;流动相可参考 TLC 的条件,正确的流动相可以提高分离度并缩短分离时间。
