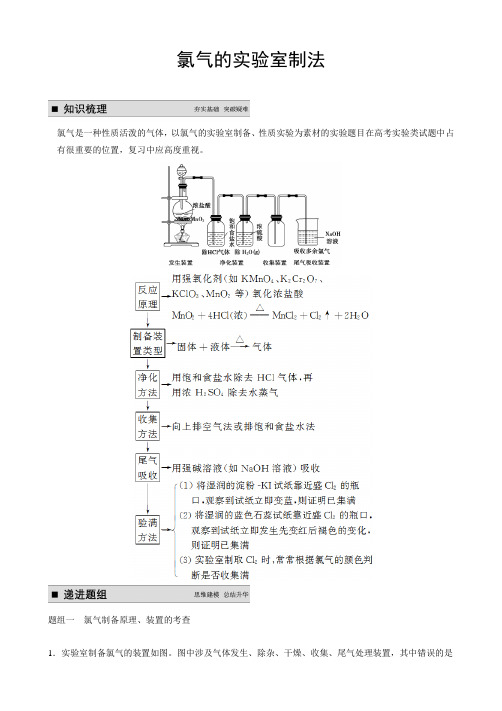
氯气实验室制备装置图
氯气的实验室制法 氯离子的检验PPT课件

二、Cl-的检验
1.在5支试管中分别加入2~3 mL稀盐酸、NaCl溶液、Na2CO3溶液、自来水、蒸馏水,然后各滴入几滴AgNO3溶 液,再分别加入少量稀硝酸,观察现象,填写下表:
实验现象
①稀盐酸 ②NaCl溶液 ③Na2_白_色__沉__淀__生__成_ __有__白_色__沉__淀__生__成_ __有__白__色_沉__淀__生__成_
Ⅱ. 2KMnO4+16HCl(浓)==2KCl+MnCl2+5Cl2↑+8H2O
注意:反应Ⅰ必须加热,反应Ⅱ不需要加热。
2.实验室制备氯气的实验装置
比较:⑴装
置A和B适用 于MnO2与浓 盐酸加热反
应,装置C适 用于KMnO4 与浓盐酸在
常温下反应。
比较:⑵装置B比A多着分液漏斗与烧瓶之间的联通管。这段管的作 用是调节分液漏斗与烧瓶之间的压力平衡。
【提示】 不一定。因为 Ag+也可与 CO23-等反应生成白色的 Ag2CO3 沉淀。
⑵检验 Cl-时为何要加入稀硝酸酸化?
【提示】 加稀硝酸酸化目的是排除 CO23-等的干扰,因为 Ag2CO3 可溶于 稀硝酸,而 AgCl 不溶。
Cl-的一般检验方法
稀硝酸 AgNO3 白色沉淀
AgNO3
溶液中 Cl-的检验注意的问题 (1)要排除 CO23-、PO34-等离子的干扰,它们的银盐沉淀溶于稀硝酸。一般先 在被测液中加入稀硝酸酸化,以排除干扰离子(CO23-、PO34-)。 (2)若被检液中有 SO24-存在,由于 SO24-可以与 Ag+生成白色微溶物 Ag2SO4 且不溶于稀硝酸,则在检验 Cl-之前,需先用 Ba(NO3)2 溶液除去 SO24-,再加入 硝酸酸化的 AgNO3 溶液检验 Cl-的存在。
氯气实验室制取

某化学课外小组设计了如右图 所示的实验装置,进行气体性 质实验.图中箭头表示气体流 向.A表示一种纯净、干燥的 气体,B是另一种气体,反应 进行一段时间后,装置己中有 红棕色气体生成.实验中所用 的药品和干燥剂只能从下列物 质中选取: Na2CO3、NaHCO3、MnO2、 Na2O2、NaCl、无水CaCl2、 NH4HCO3、碱石灰等固体 和H2O2、蒸馏水. 根据图中装置和反应现象请回答:
4:净化装置(除杂,干燥装置)
A
B
C
A中只能装液体干燥剂,并且长进短出 B中只能装固体干燥剂,并且大进小出 C中只能装固体干燥剂,进出无限制
下列杂质的除杂试剂是
1、Cl2(HCl)
2、CO2(HCl)
饱和食盐水 饱和NaHCO3溶液 H2O
饱和NaHCO3溶液 H 2O
3、C2H2(HCl)
4、CO2(SO2) 5、NO(NO2)
三、防堵塞安全装置:为了防止分液漏斗中的液体不
能顺利流出,用橡皮管连接成连通装置[见恒压式(I)];为 防止粉末或糊状物堵塞导气管,可将棉花团置于导管口处
[见防阻式(Ⅱ)、(Ⅲ)]。 四、液封装置:为防止气体从长颈漏斗中逸出,可在发
生装置中的漏斗末端套住一支小试管[见液封式(Ⅳ)]。
五、防污染安全装置:灼烧式可用于除尾气CO;
药品:Na2CO3、NaHCO3、MnO2、Na2O2、 NaCl、无水CaCl2、NH4HCO3、碱石灰 等固体和H2O2、蒸馏水.
⑴丙中发生反应的化学方程式为:
NH4HCO3 = NH3↑+CO2↑+H2O↑
氯气的实验室制法

V(Cl2)=60ml V(Cl2)剩=20ml
V(Cl2)溶=40ml
V(H2O)=20ml
V(H2O):V(Cl2)溶=1:2
• 黄绿色、有刺激性气味的有毒气体; • 密度比空气大; • 易液化(常压下—34.6℃变为液体,称为液 氯); • 可溶于水,常温常压下,1体积水溶解2体 积Cl2,氯水呈浅黄绿色。
随堂练习
3、下图是实验室制备氯气的装置图,请指出其 中的错误。
①长颈漏斗应改成分液漏斗.②烧瓶下应垫石棉网. ③应用酒精灯加热. ④稀盐酸应改为浓盐酸.
⑤多余Cl2应通入NaOH溶液中.
我们的收获
一、 锻炼了3种能力 合作能力 探究能力 二、 知道了2种制法 通电 推理能力
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
• 气体发生装置 依据:反应物状态和反应条件 固体+液体(加热型)
固液不加 热型
固固加热型
固液加热 型
MnO2+4HCl(浓) == MnCl2+2H2O+Cl2↑
• 气体净化装置 思考:此法制得的氯气纯净吗?可能存在 哪些杂质气体?用哪些试剂来除杂,有没有 先后顺序?
除HCl气体 除水蒸气
饱和食盐水
氯气的实验室制法
[科学史]
氯气的发现
1774年,瑞典化学家舍 勒把浓盐酸与软锰矿混
在一起加热时发现氯气。
1810年,英国化学家戴 维将这种元素命名为 Chlorine,此名称来自希 腊文,有“绿色”之意。
舍勒 【瑞典】 公元1742一1786
我国早年译文将其译成
“绿气”,后改为氯气。
戴维【英国】 公元1778一1829
氯气的实验室制备原理及制备装置

氯气的实验室制备原理及制备装置
氯气是一种常见的化学气体,通常在实验室中可以通过以下原理和装置进行制备。
制备原理:
氯气通常是通过盐酸和含氯化合物(如氯化钠)的反应来制备的。
盐酸和含氯化合物反应生成氯气和相应的盐类,化学方程式如下所示:
2 NaCl + 2 HCl → 2 Na+ + 2 Cl+ H2↑。
制备装置:
1. 生成氯气的装置通常由两个瓶子组成,一个瓶子中放置盐酸(浓盐酸或稀盐酸均可),另一个瓶子中放置含氯化合物(如氯化钠)。
2. 两个瓶子通过管道连接,管道中间有一段干燥剂如无水氯化钙,用于吸收生成的气体中的水分。
3. 在实验过程中,首先向含氯化合物的瓶子中加入适量的盐酸,两者反应生成氯气,通过管道流入干燥剂,再由干燥剂进入收集瓶中。
操作步骤:
1. 将盐酸加入含氯化合物瓶中。
2. 等待反应生成氯气,气体通过管道流入干燥剂。
3. 收集瓶中收集氯气,可以通过水柱法或倒吸法等方法收集氯气。
需要注意的是,在实验室中制备氯气时,氯气具有毒性和腐蚀性,操作人员应佩戴防护眼镜和手套,确保实验室通风良好,避免
氯气泄漏。
同时,氯气也是一种强氧化剂,与易燃物质接触时会产
生剧烈反应,因此需要谨慎操作。
以上就是氯气的实验室制备原理及制备装置的相关内容,希望
能够对你有所帮助。
氯气的实验室制法

氯气的实验室制法氯气,化学式为Cl2,是一种黄绿色的有毒气体,在实验室中常用于反应试剂,工业中用于漂白和消毒。
本文将介绍氯气的实验室制法,以及注意事项。
1. 材料准备为了制备氯气,我们需要准备以下材料和设备:- 大理石或盐酸:用于制备生成氯气的原料。
- 硫酸:用于吸收氯气的副产物。
- 密封容器:用于保持试剂的稳定和收集氯气。
- 锥形瓶:用于生成气体反应的装置。
- 水槽:用于收集和密封氯气。
2. 准备反应装置将锥形瓶填充约三分之一的盐酸,然后将大理石碎片或盐酸溶液加入瓶中。
3. 反应过程将大理石碎片或盐酸溶液加入锥形瓶中后,观察到有气泡产生。
将密封容器放置在锥形瓶上方,确保气体无法泄露。
这样一来,氯气会因为化学反应而从锥形瓶中释放出来。
4. 收集氯气将收集容器或水槽中的一段玻璃管倾斜放置在水槽中,其中一端浸入水中。
将倾斜的玻璃管的另一端接入密封容器,在水槽内制造一个气体密封室。
氯气在密封容器中积累,然后可通过打开密封容器的阀门来释放氯气。
5. 安全注意事项制备氯气时要注意以下安全事项:- 操作要戴上安全眼镜和手套,避免直接接触氯气。
- 氯气是一种强氧化剂,要远离易燃物质和可燃性气体。
- 操作实验室应确保通风良好,尽量在排气罩下进行实验。
- 控制氯气产生的速率,以避免过量产生气体导致安全问题。
总结:通过上述实验室制法,我们可以制备氯气。
在操作过程中一定要谨慎,并注意安全事项,以确保实验顺利进行。
同时,在实验室的环境中使用氯气时,要遵守相关安全规定,以保护自己和他人的安全与健康。
【字数:416】。
氯气的实验室制法ppt课件

必须用浓盐酸,浓盐酸中部分Cl-的化合价升高,被氧化,MnO2与 稀盐酸不反应 为了减少制得的Cl2中HCl的含量,加热温度不宜过高,以减少HCl 的挥发
实验结束后,先使反应停止并排出装置中残留的Cl2,再拆卸装置, 避免污染空气
尾气吸收时,不能用澄清石灰水吸收Cl2,因为溶液中Ca(OH)2浓 度小,吸收不完全
气体净 化装置
气体收集或性 质检验装置
任务一:氯气的实验室制法
2.装置
△
MnO2+4HCl(浓)
Cl2↑+MnCl2+2H2O
发生装置
除杂装置
收集装置
尾气处理装置
依据反应物的状态与反应条件选择
固液常温型
固固加热型 固液加热型 液液加热型
任氯务气一的:实氯验气的室实制验法室制法
2.装置
△
MnO2+4HCl(浓)
向上排空气法
向下排空气法
排饱和食盐水 排水法
任务一:氯气的实验室制法
【讨论】如何验满?
方法1.观察到黄绿色气体充满整个集气瓶时; 方法2.将湿润的__蓝__色__石__蕊___试纸放在瓶口,若先变__红___后___褪__色___, 则已满。 方法3.将湿润的淀粉-KI试纸放在瓶口,若变__蓝__则
Na2CO3溶 液
Na2CO3+2AgNO3=Ag2CO3↓+2NaNO3
产生白色沉淀, 后沉淀溶解,产生气泡
2Ag++CO32-===Ag2CO3↓ Ag2CO3+2HNO3=CO2↑+H2O+2AgNO3
Ag2CO3+2H+===CO2↑+H2O
任务二:氯离子的检验
1.检验原理 Ag++Cl-===AgCl↓
氯气的实验室制法
氯气的实验室制法氯气是一种性质活泼的气体,以氯气的实验室制备、性质实验为素材的实验题目在高考实验类试题中占有很重要的位置,复习中应高度重视。
题组一氯气制备原理、装置的考查1.实验室制备氯气的装置如图。
图中涉及气体发生、除杂、干燥、收集、尾气处理装置,其中错误的是()A.①B.②C.③D.④答案 C解析装置③的导气管长短错误,应长进短出。
2.实验室用下列两种方法制氯气:①用含HCl 146 g的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量浓盐酸反应。
所得的氯气()A.①比②多B.②比①多C.一样多D.无法比较答案 B△解析146 g HCl的物质的量为4 mol,87 g MnO2的物质的量为1 mol,由方程式:MnO2+4HCl(浓)=====MnCl2+Cl2↑+2H2O知,1 mol MnO2可以与4 mol HCl反应,但是,应注意稀盐酸与MnO2不反应,也就是说1 mol MnO2与足量浓盐酸反应生成的Cl2多。
归纳总结实验室用MnO2和浓盐酸制取Cl2时应注意以下四点(1)为了减少制得的Cl2中HCl的含量,加热温度不宜过高,以减少HCl的挥发。
(2)必须用浓盐酸加热才可反应,稀盐酸不反应。
(3)实验结束后,先使反应停止并排出残留的Cl2后,再拆卸装置,避免污染空气。
(4)尾气吸收时,用NaOH溶液吸收,不能用澄清石灰水吸收Cl2,因为溶液中含Ca(OH)2量少,吸收不完全。
题组二氯气制备与性质实验的综合考查3.某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),完成下列问题。
(1)装置B、E的作用分别为________,________。
(2)装置C、D的作用分别为________,________。
(3)装置F中AgNO3溶液的作用是________,倒置漏斗的作用是________。
人教版高中化学必修1-4.2《氯气的实验室制备》参考课件

四、制备氯气的其它反应
◆在常温下,高锰酸钾、氯酸钾、漂白粉等固 体与浓盐酸反应能产生氯气。
2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O
KClO3+6HCl (浓) =KCl+3Cl2↑+3H2O Ca(ClO)2+4HCl (浓) =CaCl2+2Cl2↑+2H2O
三种类型气体发生装置
固体反应物加热制气 体
固体和液体混合 制气体
有固、液体混合加 热反应制气体
(一)发生装置
固+液(加热)型 有关仪器的名称:铁架台
(带铁圈铁夹)、酒精灯、 石棉网、烧瓶、双孔塞、 分液漏斗、玻璃导管。 装配原则:自下而上
思考:
AB
C
1、本实验装置有何不足?如何改进?
氯气的实验室制备
通电
氯气的工业制备
通电
通电
工业上用电解饱和食盐水的方法制备氯气
2NaCl+2H2O 通电 2NaOH+Cl2↑+H2↑
课题:氯气的实验室制法
一、反应原理
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
注意
1.二氧化锰为难溶于水的黑色固体。 2.稀盐酸与二氧化锰不反应。 3.此反应必须加热。
二、实验装置
思考
1、一套完整的气体制备装置应包括哪几
个部分?
发生装置 净化装置
收集装置
尾气的处理装置
2、实验室制备气体装置的选择依据是 什么?
1、根据反应物的状态和反应条件为思 路选用气体的发生装置。
实验室制取氯气的装置如图

(Ⅰ)实验室制取氯气的装置如图:
(1)仪器F的名称是___________ ;按图组装好装置后首先要进行的操作是:_____________________.
(2)装置B中盛放的试剂是饱和食盐水,其作用是___ ;装置E中盛放的试剂是氢氧化钠溶液,作用是______ .
(3)写出E中发生反应的化学方程式:_____________________________.(Ⅱ)实验室也可以用浓盐酸与高锰酸钾反应来制取少量的氯气,反应的化学方程式为:____________________________ (1)该反应的氧化剂是_________,氧化产物是___________________.
(2)浓盐酸在反应中显示出来的性质是_______(填编号).
①只有还原性②还原性和酸性
③只有氧化性④氧化性和酸性
(3)若用足量的浓盐酸与一定量的二氧化锰反应,产生的氯气在标准状况下的体积为11.2L,则反应中被氧化的HCl的质量为多少?(要求计算过程)。
实验室制取氯气装置图

实验室制取氯气装置图公司标准化编码 [QQX96QT-XQQB89Q8-NQQJ6Q8-MQM9N]
以下是实验室制取氯气的装置,在图中饱和食盐水的作用是吸收氯化氢
吸收氯化氢
,浓硫酸的作用是干燥
干燥
,F中盛放的溶液是氢氧化钠溶液
氢氧化钠溶液
,起的作用是吸收尾气
吸收尾气
.
考点:气体的净化(除杂);气体的干燥(除水);碱的化学性质.专题:实验性简答题.分析:实验室可以采用加热二氧化锰固体和浓盐酸的方法制取氯气,产生的氯气中混有氯化氢、水蒸气,氯气有毒,必须进行尾气处理,可以使用氢氧化钠溶液吸收.解答:解:加热二氧化锰固体和浓盐酸的方法制取氯气时,产生的氯气中容易混有氯化氢气体,要除去氯化氢气体,所选的除杂试剂只能吸收氯化氢而不能吸收氯气,故可以使用饱和食盐水将其除去,浓硫酸具有吸水性,可以除去氯气中混有的水蒸气,氯气有毒,必须进行尾气处理,防止其造成空气污染.
所以本题答案为:吸收氯化氢,干燥,氢氧化钠溶液,吸收尾气.。
氯气的制取

也可用固体NaCl和浓H2SO4代替浓盐酸与MnO2反应
2NaCl+2 H2SO4+ MnO2==== Na2SO4+MnSO4+Cl2↑+2H2O
△
3 、为什么用浓盐酸和二氧化锰制取氯气时,要缓缓加热, 不能强热 ?
答:浓盐酸有很强的挥发性,强热时能挥发出大量的
难以吸收的可以点燃处理,选用D。
一套完整制氯气的装置
[思考]说出各仪器的名称
组装原则:由下至上,由左至右
饱和食盐水
实验操作步骤及注意事项:
1、检查装置气密性;
2、从分液漏斗中慢慢向烧瓶中注入浓盐
酸,缓缓加热。 3、多余的氯气要用NaOH溶液吸收。
4、通过观察颜色变化停止加热。
5、实验结束应先撤导管后撤酒精灯。
浓硫 酸 ═CaCl2+ 湿润红色 碱石 浓硫 向下 2NH4Cl+Ca(OH)2 ∆ 2NH3↑+H2O 酸 排空 石蕊试纸 灰 气法 变蓝
CaO
∆
2、固+液不加热
制取 气体 装 收集 反应方程式 置 方法
Zn+H2SO4= 排水 ZnSO4+H2 ↑ 向上 排气 向上 CaCO3+2HCl=CaCl2+ B 排气 H2O+CO2 ↑
c d
干燥管
应大口方向 进气,小口 洗气瓶 方向出气 进 气 管“ 长 进 短出 ”
气体的净化与干燥:
该系列装置可用于气—液(或气—固) 反应装置或吸收装置。
干燥剂的选择及使用原则
1、选择原则
①气体在被干燥的过程中要不能被减少(可以增加) ②不要引入新的杂质。
氯气的实验室制法和其装置

加热
NaHSO4 + NaCl ===== Na2SO4 + HCl↑
2NaCl
+
H2SO4(浓)
加热
=====
Na2SO4
+
2HCl↑
发生装置:特点——固体和液体加热型(与Cl2相同)
仪器——烧瓶、分液漏斗、铁架台、酒精灯、导管
搜集装置:特点——向上排空气集气法(与Cl2相同) 仪器——集气瓶、导管
二 氯气旳化学性质
三 1。与金属旳反应
四 2Na + C点l燃2 ===== 2NaCl 燃烧,放热, 有大量白烟生成(是氯化钠
固体 小颗粒)。
五
Cu
+
点燃
Cl2 ======
CuC燃颗l2烧粒,)放。热,有棕黄色旳烟生成(是氯化铜固体小
六 ※氯化铜溶液浓度大时,呈绿色,浓度小时,呈蓝绿色。
2。与非金属旳反应
back
3、浓盐酸旳替代品 NaCl+浓H2SO4
强热
2NaCl+2H2SO4+MnO2==MnSO4+Na2SO4+Cl2+2H2O 4、强氧化剂MnO2可替代品 KMnO4、KClO3、K2Cr2O7、Ca(ClO)2……
2KMnO4+16HCl=2KCl+2MnCl2+8H2O+5Cl2 ↑ KClO3+6HCl=KCl+3H2O+3Cl2 ↑
5、浓盐酸作用:还原性、酸性
6、浓度要求
该反应必须用浓盐酸,因稀盐酸几乎无还原性,伴随反应 进行,浓盐酸将渐稀,一定程度时,会自动停止,HCl不 可能消耗尽。
7、Cl2旳搜集 用向上排气法(排饱和食盐水除HCl)。 干燥:除碱石灰,氧化钙等碱性干燥剂外均可。 检验:⑴用湿润旳KI-淀粉试纸,试纸变蓝。
氯气的实验室制备hu

1、为什么用分液漏斗装盐酸?又让盐酸缓 慢地注入,而不是一次将浓盐酸注入烧 瓶里?
答:用分液漏斗可以控制液体的用量,避 免生成的氯气过多。
2 、为什么用浓盐酸和二氧化锰制取氯气 时,要缓缓加热,不能强热 ?
答:浓盐酸有很强的挥发性,强热时能挥 发出大量的氯化氢气体和水蒸气,而使制 得的氯气中含有大量的杂质;另一方面, 又降低了HCl的利用率。
⑤用向上排空气法收集氯气,尾气导入吸收剂中
A.①②③④⑤ B.④③①②⑤
C.①③④②⑤
D.①④③②⑤
2、下图是实验室制备氯气的装置图,请指出其 中的错误。
①长颈漏斗应改成分液漏斗.②烧瓶下应垫石棉网. ③应用酒精灯加热. ④稀盐酸应改为浓盐酸.
⑤多余Cl2应通入NaOH溶液中
固体和液体 混合制气体 例如: H2、 CO2、H2S等。
固、液体混合加 热反应制气体 例如: HCl、 Cl2 等
(一)发生装置
1、装置类型:固+液(加热)型 2、实验仪器: 铁架台(带铁圈铁夹)、 酒精灯 石棉网、 圆底烧瓶 双孔塞、 分液漏斗 玻璃导管。 3、装配原则:自下而上
(二)净化装置
★、氯气的实验室制法
气体发生
气体净化 气体收集 尾气吸收Cl(浓)
MnO2黑色固体
MnCl2 +Cl2 + 2H2O
不能用稀盐酸,稀盐酸与MnO2 不反应 ;
1、使用的盐酸必须是浓的,随着反应的 进行,盐酸的浓度降低到一定的程度时, 反应自动停止。故,在反应中,浓盐酸 中含的HCl不能全部用尽
A
B
C
D
吸收溶解 速度不很 快,溶解 度也不很 大的气体
若气体在吸 收剂中溶速 快且溶解度 极大,易倒 吸
少量尾 气可以 集于气 球中,
实验室制取氯气装置图

以下是实验室制取氯气的装置,在图中饱和食盐水的作用是吸收氯化氢
吸收氯化氢
,浓硫酸的作用是干燥
干燥
,F中盛放的溶液是氢氧化钠溶液
氢氧化钠溶液
,起的作用是吸收尾气
吸收尾气
.
考点:气体的净化(除杂);气体的干燥(除水);碱的化学性质.专题:实验性简答题.分析:实验室可以采用加热二氧化锰固体和浓盐酸的方法制取氯气,产生的氯气中混有氯化氢、水蒸气,氯气有毒,必须进行尾气处理,可以使用氢氧化钠溶液吸收.解答:解:加热二氧化锰固体和浓盐酸的方法制取氯气时,产生的氯气中容易混有氯化氢气体,要除去氯化氢气体,所选的除杂试剂只能吸收氯化氢而不能吸收氯气,故可以使用饱和食盐水将其除去,浓硫酸具有吸水性,可以除去氯气中混有的水蒸气,氯气有毒,必须进行尾气处理,防止其造成空气污染.
所以本题答案为:吸收氯化氢,干燥,氢氧化钠溶液,吸收尾气.。
高考化学复习考点氯气的实验室及工业制法

考点37 氯气的实验室及工业制法聚焦与凝萃1.掌握氯气的实验室制法; 2.了解氯气的工业制法。
解读与打通常规考点1.氯气的实验室制法(1)反应原理:MnO 2+4HCl(浓)=====△MnCl 2+Cl 2↑+2H 2O①盐酸是浓盐酸,一般为12mol·L -1、1.9g·mL -1,稀溶液中的HCl 不能被MnO 2氧化;HCl 是还原剂,但还表现出酸性。
②必须加热,在常温下,MnO 2与浓盐酸是不反应的。
(2)实验装置图:图中:A 是分液漏斗,加浓盐酸;B 是圆底烧瓶,用于反应,液体不超过容积的2/3,加热时必须垫石棉网;C 是洗气瓶,瓶中装饱和食盐水,除去Cl 2中混有的HCl(氯气在饱和食盐水中比在水中溶解度小,可减少氯气的损耗);D 是洗气瓶,瓶中装浓H 2SO 4,干燥Cl 2;E 为收集装置,用向上排空气法收集Cl 2,进气管伸入集气瓶的底部;F 是尾气吸收装置,因氯气有毒,多余氯气要用NaOH 的溶液将其吸收(用水和石灰水吸收效果都不好。
) (3)氯气的检验:氯气可用湿润的KI 淀粉试纸检验,试纸变蓝,其原理是:Cl 2+2KI=2KCl +I 2,置换出的碘与淀粉反应生成蓝色物质。
隐性考点2.工业制法——电解饱和食盐水法 2NaCl +2H 2O=====通电2NaOH +H 2↑+Cl 2↑融合与应用例1.实验室用如下图所示装置制备Cl 2,并进行Cl 2的性质实验。
(1)A中加入KMnO4固体(反应后产物是MnCl2),B中盛有浓盐酸,烧瓶中发生反应的化学方程式为。
(2)C中盛有紫色石蕊试液,C中的现象是;D中有白色沉淀生成,D中盛放的试剂可能是;E 中溶液由无色变为蓝色,E中盛放的试剂可能是。
(3)F中一般盛放,其作用是。
【答案】(1)2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O(2)先变红后褪色AgNO3溶液KI淀粉溶液(3)NaOH溶液吸收多余的Cl2(2)产生的Cl2通入紫色石蕊试液中,Cl2与水反应产生的盐酸使石蕊由紫色变为红色,产生的HClO又可将红色漂白。
