第2.3.-2.4节 链引发反应
第2章_自由基聚合-2

导分解; 比较稳定,能单独安全保存; 分解时有N2逸出;偶氮化合物易于离解的动力正是在于 生成了高度稳定的N2,而非由于存在弱键。
2、有机过氧类引发剂
最简单的过氧化物:过氧化氢。活化能较高,20kJ/mol, 一般不单独用作引发剂。
HO OH 2 HO 过氧化氢分子中一个氢原子被有机基团取代,称为“氢过 氧化物”,两个氢原子被取代,称为“过氧化物”。均可用作自 由基聚合引发剂。
C O O C
O [2 C O + CO2 ]
[2
+ 2 CO2 ]
+ 笼蔽效应与单体、溶剂、体系黏度等因素均有关。
[
2 CO2 ]
笼蔽效应所引起的引发剂效率降低的程度取决于自由 基的扩散、引发、副反应三者的相对速率。
(1)引发剂本身的影响:偶氮类引发剂(如AIBN)一 般无诱导分解,而过氧类引发剂(如BPO)易发生诱导分 解,使f 值下降。 单体的活性:若单体具有较高的活性,能迅速与自由基 作用,引发增长,因此引发剂效率较高;若单体的活性 较低,对自由基的捕捉能力较弱,为诱导分解创造条件, 则引发剂效率低。 表2 AIBN引发不同烯类单体的引发剂效率f (%)
S2O82
组成氧化—还原体系后,分解活化能大大降低。 例如: 过氧化氢:220kJ/mol;过氧化氢+亚铁盐:40kJ/mol 过硫酸钾:140kJ/mol;过硫酸钾+亚铁盐:50kJ/mol 异丙苯过氧化氢:125kJ/mol;异丙苯过氧化氢+亚铁 盐:50kJ/mol 还原剂用量一般应较氧化剂少,否则还原剂进一步与自 由基反应,使活性消失。
R N R R N R + +
O
O [
第二章 自由基链式聚合2

要分析清楚影响二者的因素和控制方法,首先应该探讨 自由基聚合机理,从研究聚合动力学问题,描述其基元反应 及其特征开始。
2.4.1
链引发反应是形成单体自由基活性种的反应。 引发剂、光能、热能、辐射能等均能使单体生成单体自 由基。
由引发剂引发时,由两步反应组成: (a) (b)
活化能E ( kJ/mol ) 高/约105 ~150
链终止反应受扩散控制
Tab.自由基聚合的终止方式(60℃)
单体 丙烯腈 苯乙烯 甲基丙烯酸甲酯 醋酸乙烯酯
偶合/% 约100 77 21 0
歧化/% 0 23 79 约100
一般而言,单体位阻大,聚合温度高,多以岐化终止为主。
基元反应
速率常数
(s-1)
反应物浓度
(mol/L)
链增长 链终止
102 ~104 106 ~108
2.5.2 引发剂分解动力学
(a) (b)
R·
CH2 = CH0的一半,[I]/[I]0=0.5时 所需的时间,以t1/2表示。
kd和温度T有关,所以,半衰期t1/2也因T的不同而不同
引发剂分解速率常数kd与温度之间的关系遵循阿累 尼乌斯(Arrhenius)经验公式。
水溶性
HO RO
OH + Fe2+ OH + Fe2+ + Fe2+
HO HO SO42
+ HO + Fe3+ + RO + Fe3+ + SO4 + Fe3+
S2O82
亚硫酸盐和硫代硫酸盐常与过硫酸盐构成氧化—还原体系, 形成两个自由基。
S2O82 + SO32 S2O82 + S2O32 SO42 SO42 + SO4 + SO4 + SO3 + S2O3
高分子科学导论第二章

24
第二章 自由基聚合
歧化终止:链自由基夺取另一个自由基上的氢原子或其 他原子而相互终止的反应。此时生成的高分子只有一端为引 发剂碎片,另一端为饱和或不饱和结构,两者各半,聚合度 与链自由基中的单元数相同。
CH2 CH + X CH X CH2 CH2 CH2 + CH X X CH2
25
第二章 自由基聚合
链引发
I R* + M
R* RM* RM2* RM3*
链增长
RM* + M RM2* + M
RMn-1* + M
链终止
RMn* 死聚合物
RMn*
聚合过程中有时还会发生链转移反应,但不是必须经过 的基元反应。
2
第二章 自由基聚合
引发剂分解成活性中心时,共价键有两种裂解形式:均 裂和异裂。 均裂的结果产生两个自由基;异裂的结果形成阴离子和 阳离子。
C O C O
5
ቤተ መጻሕፍቲ ባይዱ
第二章 自由基聚合
烯类单体的碳—碳双键既可均裂,也可异裂,因此可进 行自由基聚合或阴、阳离子聚合,取决于取代基的诱导效应 和共轭效应。 乙烯分子中无取代基,结构对称,因此无诱导效应和共 轭效应。只能在高温高压下进行自由基聚合,得到低密度聚 乙烯。在配位聚合引发体系引发下也可进行常温低压配位聚 合,得到高密度聚乙烯。
卤素原子既有诱导效应(吸电子),又有共轭效应(推 电子),但两者均较弱,因此既不能进行阴离子聚合,也不 能进行阳离子聚合,只能进行自由基聚合。如氯乙烯、氟乙 烯、四氟乙烯均只能按自由基聚合机理进行。 除了少数含有很强吸电子基团的单体(如偏二腈乙烯、 硝基乙烯)只能进行阴离子聚合外,大部分含吸电子基团的 单体均可进行自由基聚合。 含有共轭双键的烯类单体,如苯乙烯、α-苯乙烯、丁二 烯、异戊二烯等,因电子云流动性大,容易诱导极化,因此 既可进行自由基聚合,也可进行阴、阳离子聚合。
2.4 自 由 基 聚 合 的 链 引 发 反 应

2.4.4 引发剂的选择
(1)互溶性 选择水溶性或油溶性引发剂;
(2)半衰期 与温度相配合(确定聚合反应温度);
(3)价格、毒性、对聚合物质量有无影响等。
2.4.5 其他引发作用(一般了解) (1)热聚合 有些单体可在热的作用下无需加引发剂便能自发聚合。常 见的如:苯乙烯及其衍生物、甲基丙烯酸甲酯等。 聚合反应机理: (i)Diels-Alder加成机理:如苯乙烯热聚合
2.4.3 引发剂的引发效率
在链引发中: I ──→ 2 R· R·+ M──→RM· ① ② 反应②不一定100%发生,引发效率 f 一般,f < 1
形成的单体自由基数量 f 产生初级自由基的数量
引发剂分解速率Rd=kd[I], 引发速率 Ri = 2fkd[I] 副反应:使引发剂的引发效率下降。
CH3 N CH3
+
O O C O O C CH3 N + CH3 O C O
+ PhCO2-
(4)含功能基引发剂
含功能基的引发剂可把所含功能基引入聚合物分子链的末端合成末端功能 基化高分子。如:
HOOC O C O O t-Bu HOOC O C O + O t-Bu
HOOC
O C O
H2C CH
X为吸电子取代基:-NO2, -COOR, -COOH, -CN等
CH3 CH3 H3C C N N C CH3 CN CN 偶氮二异丁腈(AIBN) CH3 2 H3C C CN + N2
C―N 是弱键,键能为 290kJ/mol 特点:分解活化能高,活性低;油溶性
(3)氧化还原体系:过氧化物+还原剂
1 [I]0 t1/2 = ln kd [I]0/2 0.693 = kd
第二章自由基聚合

2.3.2 自由基聚合反应的特征
1、由链引发、增长、终止、转移等基元反应组成 特征为:慢引发、快增长、速终止。 引发速率最小,是控制总聚合速率的关键。
2、链增长反应使聚合度增加
反应混合物中仅由单体和聚合物组成 聚合度变化小。
自由基聚合过程中分子量 与时间的关系
3、对分子量的影响 凝胶效应将使分子量增大。
2
CH3 2C +N2 CN
AIBN一般在45~65℃ 下使用;它分解后形成的异丁腈自由 基是碳自由基,缺乏脱氢能力,故不能作接枝聚合的引发剂。
2、有机过氧类引发剂
代表物:过氧化二苯甲酰(BPO) BPO中O—O键部分的电子云密度大而相互排斥,容 易断裂,通常在60~80℃ 分解。
★ 均裂成苯甲酸基自由基,有单体存在时,即引发聚合; ★ 无单体存在时,进一步分解成苯基自由基,并析出CO2 但分解不完全。
弱键的离解能一般为100~170kJ/mol
常用的引发剂有:偶氮化合物、有机过氧化合物、无机盐 过氧化合物和氧化-还原引发体系等。
2.4.1.1 引发剂的种类
1、偶氮类引发剂
几乎全部为一级反应,只形成一种自由 基,无诱导分解; 比较稳定,能单独安全保存;
代表物:偶氮二异丁腈(AIBN)
CH3 2C N N C CH3 CN CN
自由基聚合过程中转化率与时间的关系
4、少量(0.01%~0.1%)阻聚剂足以使自由基聚合反应终止。
2.4 链引发反应
自由基聚合反应的首要条件是:在聚合体系中产生自由基, 常用方法是在聚合体系中引入引发剂,其次是采用热、光 和高能辐射等方法。
2.4.1 引发剂和引发作用
引发剂:分子结构上具有弱键,容易分解成自由基。
链转移反应向单体转移向溶剂

3)X为吸电子基团,-NO2,-CN,容易进行阴离子聚合
4)对于自由基聚合来说,易于与有吸电子基团、双键上电子云密度较低 的单体相互作用
除非取代基吸电子作用太强而只能进行阴离子聚合,如硝基乙烯,二氰基 乙烯等,多数能进行阴离子聚合的单体也能进行阴离子聚合。
取代基的结构: 1)取代基的位阻效应 2)共轭效应 3)强电负性取代基 4)氢键和溶剂化作用
1)取代基的位阻效应
取代基的空间效应对聚合物的影响大于单体 取代基在聚合物中,有键角的变化、键长的伸缩,非键合原子 间的相互作用,从而储藏了部分内能 聚合物链上取代基的空间张力使聚合热降低
2)取代基的共轭效应
第二章 自由基聚合
2.1 链式聚合单体的聚合能力 2.2 自由基聚合机理 2.3 链引发反应 2.4 聚合反应动力学 2.5 分子量与链转移反应 2.6 阻聚和缓聚作用
2.1 链式聚合单体的聚合能力
a. 压力的影响 压力增大,有利于聚合反应进行。
b.
共轭效应
键能变化
乙烯衍生物烯类单体的 值在-30到-160kJ/mol
终止的方式 ------ 单体结构和聚合温度
• 取代基大-----歧化终止的可能性增加
• 聚合温度低----有利于偶合终止反应
• 偶合终止和歧化终止的相对比例:
偶合终止几率 歧化终止几率
(c) (c)
k tc k td
A e te ( E tc Etd ) / RT Atd
著名的阿仑尼乌斯经验公式——— 温度对反应速率的影响
按照乙烯取代基的电负性顺序与聚合倾向:
2.2 自由基聚合机理
第2.3.-2.4节 链引发反应

I I
kd
2I
引发活性种,初级自由基,引发自由基 ki I CH2 CH X M
初级自由基与单体加成, 形成单体自由基
+ H2C CH X
讨 论: 第一步:吸热反应,需要加热、光照等提供能量; 活化能较高,Ed=105~150kJ/mol; 反应速率较小,kd=10-4~10-6s-1。
第二步:活化能较低的放热反应, Ei=20~34kJ/mol,反应速率较大 。 第一步引发剂分解是控制反应速率的一步。
BPO是最重要、最常用的自由基聚合反应引 发剂之一,其分解温度大约为 60 ~ 80℃,分解 活化能大约为 125kJ/mol,属于低活性引发剂。 它必须在含湿状态下保存 ( 含水量大约 10 % ) , 尤其需要避免烘烤、暴晒或与强还原剂、硫酸 等吸水剂接触,以免发生危险。
重要特点:易发生诱导分解,即自由基向引 发剂自身的链转移反应,从而使引发效率降低。 除此之外,用它作引发剂合成的聚合物 过一段时间以后可 能 会慢慢变黄,这是因为 其中残留的引发剂继续与聚合物发生包括氧 化反应在内的复杂化学反应的结果。 因此,在合成光学性能要求较高的聚合 物,如有机玻璃时,应该避免选用BPO。
二、链增长反应 链增长反应是指单体自由基与单体加成生产新 的自由基,如此反复,使聚合度增大的过程。
I CH2 CH + H2C CH X X M kp CH2 CH X 增长链自由基
▲ 链增长反应的特点
a. 链增长反应是多步加成反应,每步反应活化能及
速率相当;
b. 增长反应活化能低(约为20~34kJ/mol);
2+
RO- + RO + Fe3+ OH- + Fe3+ + RO R'COO- + Fe3+ +RO
高分子化学第2章 2.1-2.4.4

I
均裂
R• 链自由基不断 与单体加成使 链增长。
… …
自由基为活性种——自由基连锁聚合。
烯类单体的加聚反应绝大多数属于自由基聚合。
6
CH2=CH
Y
7
2.2 连锁聚合的单体
1. 不同单体对连锁聚合机理有选择性:
单体结构:
(1) 无取代基: CH2 =CH2 [乙烯单体] (2) 带有单个取代基:CH2 =CH--Y (3)1-1-双基取代的烯烃单体:CH2=C--XY (4) 1,2-双取代的烯烃单体:X--CH=CH--Y (5) 三取代和四取代乙烯: 一般不能聚合 (6) 共轭体系
39
结论:
任何自由基聚合都有链引发、链增长、 链终止三步基元反应。 链引发速率最小, 是反应的控制步骤。
链引发
15
——控制步骤
链增长
链终止
40
(4)链转移 在自由基聚合过程中,链自由基有可能 从单体、溶剂、引发剂等低分子或高分子上 夺取一原子而终止,并使这些原子的分解成 为自由基,继续新链的增长,使聚合反应继 续进行,这种反应称做链转移反应。 M
特征: 放热反应,活化能低20~34 KJ/mol ,反 应速度很快。 [比第一步链引发活化能(105~150KJ/mol)低约5倍]。
29
(2)链增长
单体自由基形成后,仍具有活性,继续 打开第二个单体的键与之加成,形成新的 自由基。新的自由基活性并不衰减,继续与 其他单体加成,形成更多的链自由基,这个 过程为链增长反应(加成反应)。
均裂 : R* *R
异裂 : A :B
2 R*
产生自由基
A + + :B- 产生阴、阳离子
(2) 自由基、阳离子、阴离子都可能成为 活性中心,引发相应的自由基、阳离子、阴 离子连锁聚合; 自由基聚合、阳离子聚合、阴离子聚合 都是连锁机理。
自由基反应 反应相

自由基反应反应相
自由基反应又称游离基反应,是自由基参与的各种化学反应。
自由基电子壳层的外层有一个不成对的电子,对增加第二个电子有很强的亲和力,故能起强氧化剂的作用。
自由基反应一般经历三个阶段:
- 链引发阶段:产生自由基的阶段。
由于键的均裂需要能量,所以链引发阶段需要加热或光照。
有些化合物十分活泼,极易产生活性质点自由基,这些化合物称之为引发剂(initiator)。
有时也可以通过单电子转移的氧化还原反应来产生自由基。
- 链转移阶段:由一个自由基转变成另一个自由基的阶段,自由基不断传递下去,像一环接一环的链,所以称之为链反应。
- 链终止阶段:消失自由基的阶段。
自由基两两结合成键,所有的自由基都消失了,自由基反应也就终止了。
自由基反应在大气化学、光化学烟雾形成等领域中起重要作用。
自由基种类繁多,如过氧化氢自由基(HO2-)、烷氧基自由基(RO-)、过氧烷基自由基(RO2-)、酰基自由基(RCO-)等,在反应中可能扮演中间产物的角色。
链反应机理与燃烧半岛现象

第二诱导期:RCH2· +O2=RCH2OO· RCH2OO· =RCHO+OH· RCO· =R· +CO RCH(OO)CH2R=RCHO+RCH2O RCH2O· =R· +HCHO
链锁反应热爆炸理论
1.反应的初期可能是链锁反应。 2.随着反应的进行放出热量,并自动加热。 3.最后变成纯粹的热爆炸。
烃类氧化的链反应
烃类的高温气相氧化有诱导期。表现出明显的阶 段性,即在着火前常出现冷焰的现象。与着火时 的热焰比较,温度较低,辉光较弱,产生的热量 很少,这种现象是烃类气相氧化的特点之一。
支链反应
直链反应:氯与氢
链的开始:Cl2→2Cl· 链的传递:Cl· +H2→HCl+H· H· +Cl2→HCl+Cl· H·+HCl→H2+Cl· 链的终止:H· + Cl·→HCl H·+ H·→H2 Cl· + Cl·→Cl2
支链反应:氢与氧
链的开始:H2+O2→2HO· H2+M→2H·+M 链的传递:HO· + H2→H·+H2O H· + O2→O·+ HO· O· + H2→H·+OH H· + O2+M→HO2· +M HO2· + H2 →H2O+ HO·
烃类的氧化过程
首先生成的烃的过氧化物或过氧化物的自由基 (R-O-O),而氧化物也会分解为自由基。 反应具有链反应的性质,并且由于出现分支而自 动加速。 主要分为两个阶段:第一和第二诱导期
链的引发:RH+M=R· +H· +M RH+O2= R· + HO2· RH+HO2· + R· + H2O2 链的传递: 第一诱导期:R· +O2=ROO· ROO· +RH=ROOH+ R· RCH2OOH=RCH2O· +OH· RCH2O· = R· +HCHO RCH2O· +RH=RCH2OH+R OH· +RH=R· +H2O
燃烧中的链式反应你知道吗?

燃烧中的链式反应你知道吗(题目或者:链式反应---燃烧进行的第四要素)上海市市西中学徐娟摘要:燃烧进行需要几大要素,隔离、减少某一要素可进行灭火。
本文介绍了除可燃物、助燃气、着火点之外的燃烧又一要素—链式反应。
并在此基础上说明了可使燃烧中的链式反应停止从而起到灭火作用的卤代烷灭火剂的灭火原理。
一、前言大家都知道,燃烧作为一种剧烈的化学反应,是可燃物与氧化剂作用发生的放热反应,通常伴有火焰、发热、发光或发烟现象。
可燃物燃烧导致的火灾会给国家、给社会带来巨大的损害,所以,研究人员一直在致力于研究、开发不同种类的灭火剂,对付不同形式的火灾。
通常灭火剂的制造原理,围绕着隔离、除去、减少某一燃烧要素而进行。
在中学化学教材中,认为燃烧的要素是:①可燃物、②氧化剂、③温度(引火源)。
所以在灭火的过程中,采取的主要措施是:冷却灭火,将可燃物冷却到其燃点或闪点以下,使燃烧中止;窒息灭火,燃烧都必须最低氧气浓度以上进行,因此,通过降低燃烧物周围的氧气浓度可以起到灭火的作用;隔离灭火,把可燃物与引火源或氧气隔离开来,燃烧反应就会自动中止。
但是,这些灭火的原理却不能够用来解释现在利用越来越广泛的卤代烷灭火剂的灭火原理。
看来,支持燃烧,还有我们不知道的要素在其中,它就是——链式反应。
二、链式反应1、链式反应:链式反应是化学反应历程中非常重要的一种,它包括三个基本过程:链引发、链增长、链终止。
2、链式反应的基本过程链引发:反应物在一定外界条件作用下,产生具有高度活泼化学形态的自由基的过程。
条件A-A 2A·……链增长:高度活泼的自由基与反应物继续反应,持续不断的生成新的物质与活泼的自由基。
A· + B-C A-B + C·C· + A-A A-C + A·A· + B-C A-B + C·C· + A-A A-C + A·……链终止:活泼自由基与其他活泼微粒结合,形成较稳定的化合物,从而通过自由基的减少,使反应停止。
高分子复合材料第二章

H R CH2 C X
分散正电性, 分散正电性,稳定阳离子
因此带给电子基团的烯类单体易进行阳离子聚合, 因此带给电子基团的烯类单体易进行阳离子聚合,如X = -R, , -OR,-SR,-NR2等。 , ,
2.1
(ii) X为吸电子基团 为吸电子基团
链 式 聚 合 反 应 概 述
H R CH2 C X
2.3 自 由 基 聚 合 反 应 速 率 方 程
2.3.2 速率方程 根据假设( )、( )、(2) ),聚合速率等于链增长速率 根据假设(1)、( )和(4),聚合速率等于链增长速率。 ),聚合速率等于链增长速率。 链增长速率 Rp = -d[M]/dt =kp[M][M•] 根据假设(3), i = Rt ),R 根据假设( ), 2fkd[I] = 2kt[M•]2 [M•] = (fkd/kt)1/2[I]1/2 代入链增长速率方程得 Rp = kp[M] (fkd/kt)1/2[I]1/2
2.3.6 自动加速作用 Rp = kp[M] (fkd/kt)1/2[I]1/2 自动加速现象:随着反应进行,聚合反应速率不仅不随单 自动加速现象:随着反应进行, 体和引发剂浓度的降低而减慢,反而增大的现象。 体和引发剂浓度的降低而减慢,反而增大的现象。 自动加速作用:随着反应进行,本体或高浓度聚合体系的粘 自动加速作用:随着反应进行, 度会明显增大,链自由基扩散速率下降,双基终止困难, 度会明显增大,链自由基扩散速率下降,双基终止困难,kt 下降明显;粘度增加对单体小分子的扩散影响不大, 下降明显;粘度增加对单体小分子的扩散影响不大,链自由 基与单体之间的链增长速率影响不大,因此( 基与单体之间的链增长速率影响不大,因此(kp/kt1/2)显著增 显著增 聚合反应速率不降反升。 大,聚合反应速率不降反升。
化学反应的链反应机理

化学反应的链反应机理化学反应是物质转化的过程,而反应的机理则是描述化学反应过程中,各个步骤之间的关系和能量变化的相关理论模型。
其中,链反应机理是一种重要的反应机理,在很多有机和无机反应中都起着关键的作用。
本文将介绍链反应机理的基本概念、特点、以及常见的链反应类型,以及在一些实际应用中的相关案例。
一、链反应机理的概念和特点链反应机理是指一个分子在反应中开始一个过程,在这个过程中不断地与其他分子发生反应,随着反应的进行,这个过程中的中间物质也在不断地参与反应,并最终释放出足够的能量。
这个过程就好像一条链条一样,每个中间物质都像链条的一个环节,将整个反应的过程连接在一起。
链反应机理具有以下几个主要特点:1. 自由基参与:在链反应机理中,自由基是最常见的反应中间体,它们具有高度的活性和不稳定性,容易与其他分子发生反应。
2. 链传递步骤:链反应机理中的每个步骤都是通过自由基之间的反应传递的,一个自由基的反应会生成另一个活性自由基,不断地形成新的中间物质。
3. 链终止步骤:链反应机理通常还有一个或多个链终止步骤,这些步骤能够终止链反应的继续进行,从而控制整个反应的速率和方向。
二、链反应的类型常见的链反应类型包括:1. 氧化反应:氧化反应是一类重要的链反应,它涉及到氧分子和自由基之间的反应。
例如,燃烧是一种氧化反应,燃料通过与氧气反应产生自由基,并逐步生成水和二氧化碳等产物。
2. 反应机理:一些有机反应也涉及到链反应机理,例如自由基取代反应。
在这种反应中,自由基会从一个分子中夺取一个氢原子,从而形成新的自由基,反应会持续进行,直到链终止步骤发生为止。
3. 光化学反应:光化学反应是一类光能引发的化学反应,其中链反应机理起着重要作用。
光能激发分子产生自由基,这些自由基在反应中不断传递,并形成新的中间物质。
三、链反应机理的应用案例链反应机理在许多实际应用中都有广泛的应用,以下是几个具体的案例:1. 化学合成:链反应机理在有机化学合成中起着重要的作用。
化学反应机理中的链反应

化学反应机理中的链反应在化学反应中,不同类型的反应机理展现出了各自的特点和规律。
其中,链反应是一种重要的反应机理,它在许多化学过程中起着关键作用。
本文将介绍化学反应机理中的链反应,并分析其特点和应用。
1. 概述链反应是指在反应中通过自由基、离子或配对电子的连续生成和消耗,从而形成反应链的过程。
链反应通常由三个步骤组成:初始步骤、链传递步骤和链终止步骤。
初始步骤中生成起初的反应物,链传递步骤中反应链的延伸,链终止步骤中反应链的破坏。
2. 自由基链反应自由基链反应是最常见和典型的链反应。
在自由基链反应中,自由基是反应的关键物种。
它们通过自由基引发剂的作用产生,并参与到反应的采取行动中。
具体步骤为:初始步骤中自由基生成,链传递步骤中自由基与反应物产生反应,链终止步骤中反应链中的自由基与其他物质反应从而中断链的延续。
3. 离子链反应离子链反应是另一种重要的链反应机理。
在离子链反应中,离子是反应的关键物种。
离子链反应一般由两步组成:初始步骤中离子生成,链传递步骤中离子与反应物产生反应。
与自由基链反应不同的是,离子链反应中不需要链终止步骤,因为反应中涉及的离子可以持续传递并参与到反应过程中。
4. 应用链反应在化学中有广泛的应用。
例如,聚合反应就是通过链反应机理进行的。
在聚合反应中,通过不断添加反应单体,形成长链的聚合物。
此外,链反应还可以应用于光化学反应、自由基聚合、自由基反应的氧化和还原等方面。
总结:本文介绍了化学反应机理中的链反应,包括自由基链反应和离子链反应两种典型的链反应机理。
链反应的特点在于连续的生成和消耗关键物种,形成反应链的过程。
链反应在化学中具有重要的应用,如聚合反应、光化学反应和氧化还原反应等。
通过对链反应的研究,可以更好地理解化学反应的机理和规律,为化学工业的发展提供基础支撑。
11-07链反应-精品文档
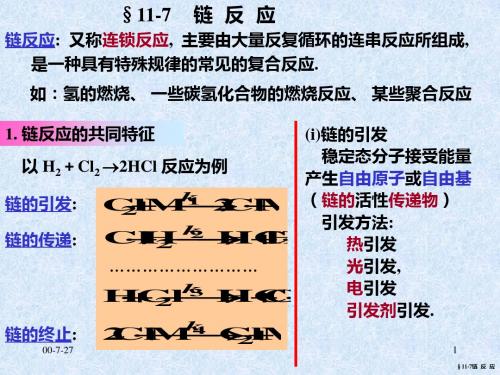
链的终止:
H Cl HCl Cl 2 式中 k 4 1 / 2 2 Cl M Cl M k 2 2 k( k/k)
2 1 4
k 3
d t
kc c l H 2 C2
发生下列现象时可推测反应是否为链反应;
• 增加反应器壁与容积之比, 或加入固体粉末, 使反应速率显著变慢 或停止.
1 /2 1/2 k ( k / k ) c c 2 1 5 H k 2 Br 2 5 链的终止: c 2 Br Br H 2 k c k c 3 Br 4 HBr 2 d c H k c c k c c k c c 0 2 Br H 3 H Br 4 H HBr 2 2 d t ‖ d c 2 Br 2 k c k c c k c c k c c 2 k c 0 1 Br 2 BrH 3 H Br 4 H HBr 5 Br d t
• 加入微量的阻滞物(如NO等), 能对反应起明显的阻滞作用.
00-7-27 NO 含有末配对电子, 很容易与自由原子、自由基反应. 3
链的传递
2. 链反应的机理与速率方程
链的引发:
k
§ 11-7 链 反 应
H2+Br2 2HBr
1906年波登斯坦(Bodenstein)
1 Br 2 Br 2
2
实例
§ 11-7 链 反 应
3. 支链反应与爆炸界限
链反应的分类(按链传递的不同机理分为) ①直链反应:消耗一个活性质点只产生一个新的活性质点 ②支链反应:消耗一个活性质点产生两个或两个以上新的活性质点 爆炸是瞬间即完成的高速化学反应. ①热爆炸:放热反应瞬间放出大量热量且不能很快散出而引起爆炸 ②链爆炸:由支链反应引起,随着支链的发展, 链传递物(活性质点) 剧增, 反应速率激剧增大, 并导致爆炸. 直链
聚合机理

2 . 笼蔽效应(cage effect) 引发剂分解产生的初级自由基,处于周围分子(如溶 剂分子)的包围,像处在笼子中一样,形成稳定分子, 使引发剂效率降低。这一现象称之为笼蔽效应。 大多数引发剂均可观察到些现象,偶氮类引发剂易发生。
引发效率随单体、溶剂和引发剂的特性、种类由不同 程度的变化。
2.5 聚合速率(rate of Polymerization)
2) 无机过氧化物 最常用的无机过氧化物——过硫酸盐 典型代表:水溶性的过硫酸钾(KSP)和过硫酸 铵 一般用于乳液聚合和水溶液聚合
O KO S O O O O S O OK 2KO
O S O OH
3. 氧化—还原体系引发剂(redox initiator)
由氧化剂与还原剂组合在一起,通过电子转移 反应(氧化—还原反应),产生自由基而引发单 体进行聚合的引发体系叫氧化—还原体系 特点:
RCH2CH X
X
•放热反应(exothermal reaction); •Ei低,约20-34KJ/mol;
•反应速率快。
2. 链增长(chain propagation):迅速形成大 分子链
RCH2CH +CH2=CH X X ...... RCH2CHCH 2CH X X
RCH2CH CH2CH nCH2CH X
• 氧化—还原体系
氧化剂、还原剂之间发生电子转移生成自由基
1. 偶氮类引发剂(azo initiator)
R' R C CN N=N R' C R CN
R、R’为烷基,结构可对称或不对称 活性上:对称>不对称,并随着R基团增大,活性 增加
重要的偶氮类引发剂:
偶氮二异丁腈(AIBN,2,2’-Azobisisobutyronitrile)
链锁反应着火理论.ppt

表达式。
如果保持系统温度不变而升高系统压力,P点则
向上垂直移动。这时因氢氧混合气体压力较高,分
子浓度的增大,减少了活化中心与器壁的碰撞机会,
但自由基在扩散过程中,与气体内部大量稳定分子
碰撞而消耗掉自己的能量,自由基结合成稳定分子,
因此自由基主要消毁在气相中。而且,随着压力的
提高,这种机会越来越多,链的中断速度亦就越来
fn gn
W1
(
f
(3-28)
g )n
火极限的影响
令φ=(f-g),上式可写为:
dn dt
W1
n
设t=0时,n=0,积分上式得:
(3-29)
第四节 链锁反 应着火理论
n W1 (et 1) /
(3-30)
如果用a表示在链传递过程中一个自由基参加反
应生成最终产物分子数(如氢氧反应链传递过程中,
W产
afW1
(et 1 )
(e afW1 t
1)
afW1
(
1 e
t
1)
(3-32)
因为t→∞时,1/exp(│φ│t)→0,所以
W产
afW1
const
W0
(3-33)
第四节 链锁反 应着火理论
一、链锁反应的过 程与分类 二、链锁反应着火
条件分析*
三、链锁反应对着 火极限的影响
这说明,在<0的情况下,自由基数目不能积累,
越大(见图3-11),因而当压力增大到某一数值时,
自由基消毁速度W3可能大于链传递过程中因链分支
而产生的自由基增长速度W2(即f-g<0),这时就出
现链锁自燃的着火第二个极限。于是系统由
第四节 链锁反 应着火理论
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H
CH2CH + CH2 C
Cl
Cl
H
CH2CH + CH2 C
Cl
Cl
Cl
H
CH2CH+ CH2 C
Cl
●向引发剂转移
~CH2-CH• + R-R → ~CH2-CHR + R•
Cl
Cl
对聚合的影响:聚合速率基本不变;平均 聚合度降低;引发效率降低。
●向溶剂转移
~CH2-CH• + S-Y → ~CH2-CHY + S•
学习重点 典型引发剂的反应式(AIBN、BPO、氧化还原
体系) 引发剂活性的表征方法 引发剂的引发效率 引发无剂论的工选业择生产还是实验研究,引发剂的选择及 其用量的确定都是影响自由基聚合反应速率和产 物相对分子质量的重要因素。
一、引发剂种类
自由基聚合引发剂通常是一些可在聚合温度下 具有适当的热分解速率,分解生成自由基,并能 引发单体聚合的化合物。大致可分为三大类:
H O O + H2O2 HO + Fe2+
HO + OH - + Fe3+
H O O + H2O HO + H2O + O2
HO- + Fe3+
竞争反应的存在影响H2O2的效率和反应重现性, 多被过硫酸盐体系代替。
常用的是:过硫酸盐 + 低价盐
-O3SOOSO3- + HSO3-
SO42- + SO4- + HSO3
(多为β-H原子),生成稳定大分子的反应,生 成2个大分子链。
歧化终止特点: 产物的聚合度与链自由基的链节数相同;大分
子一端带引发剂残基,其中一个大分子链端为不 饱和结构。
讨论
(1)能量分析:活化能低,Et=8~21kJ/mol,
速率很快,kt=106~108L/mol·s
(2) 两种终止方式的比较
第一步引发剂分解是控制反应速率的一步。
二、链增长反应
链增长反应是指单体自由基与单体加成生产新的 自由基,如此反复,使聚合度增大的过程。
kp I CH2 CH + H2C CH
X
X
M
CH2 CH X
增长链自基
▲ 链增长的特点
a. 链增长反应是多步加成反应,每步反应活化能及速
率相当;
b. 增长反应活化能低(约为20~34kJ/mol);
h
RS SR
2RS
二硫化物
O OH
h
O
OH
Ph C CH Ph
Ph C + CH Ph
安息香酸
OO
h
Ph C C Ph
在聚合过程中,单体浓度逐步降低,聚合物浓 度相应提高,延长聚合时间主要是提高转化率。 换言之,聚合物分子量与反应时间和转化率一般 关系不大。
产
单
物
体
平
转
均
化
聚
率
合
度
反应时间
反应时间
自由基聚合:产物平均聚合度、单体转化率与时间的关系
少量(0.1-0.01%)组聚剂足以使自由基聚合 反应终止。
第2.4节 自由基聚合的链引发反应
c. 增长速度极快(0.01~几秒), kp=102~ 104l/mol·s; d. 放热过程(聚合热为55~95kJ/mol ); e. 增长过程只与单体的本性有关,与引发剂的种 类和介质性质基本无关;
f. 链增长与链转移是一对竞争。
链增长反应是形成大分子的主要反应,该反应 取决于增长活性链末端自由基的性质。
3 无机类过氧化合物
过硫酸钾和过硫酸铵是最常用的无机类过氧 化合物,它们具有良好的水溶性,故常常用于乳 液聚合和水溶液聚合。过硫酸钾的分子式为 K2S2O8,其分解反应式如下:
O
O
KO S OO S OK
O
O
O
O
2KO S O 或 O S O +K
O
O
过硫酸钾是多用于乳液聚合的水溶性的引发 剂,所产生的水溶性自由基应该以负离子的形 态存在。
(3) 由激发态分解为自由基的过程无需活化能, 因此可在低温条件下进行聚合反应,可减少热 引发因温度较高而产生的副反应。
过氧化物和偶氮化合物可以热分解产生自由 基,也可以在光照条件下分解产生自由基,成 为光引发剂。除过氧化物和偶氮化合物外,二 硫化物、安息香酸和二苯基乙二酮等也是常用 的光引发剂。
R'COO- + Fe3+ +RO
常用:过氧化二苯甲酰——叔胺体系
例如: 异丙苯过氧化氢——亚铁体系 该引发剂体系的分解活化能更低,聚合反应可以 在零度或更低的温度下进行。工业上通常被用于合 成橡胶的低温乳液聚合反应中。
<3> 有机物/有机物氧化还原体系: 过氧化二苯甲酰(BPO) + N,N-二甲基苯胺
4 氧化还原体系:过氧化物+还原剂
(1) 氧化还原体系的特点
实践证明,许多过氧化合物在还原剂存在时其 分解反应活化能将大大降低,从而可以在较低的 温度下以较快的速率引发聚合反应。
由于氧化剂和还原剂都是有机物,所以在单 体——聚合物体系中很容易均匀混合,能够保证 聚合反应平稳进行。
引发效率相对较低,至少有一半的引发剂将还 原剂氧化而不产生自由基,并未发挥引发作用。 所以采用氧化还原引发体系时除了严格控制还原 剂的加入量以外,还必须适当增加氧化剂的用量。
带吸电子取代基的偶氮化合物,分对称和不 对称两大类:
R2
R2
R1 C N N C R1
X
X
对称
R
R2
R C N N C R1
X
X
不对称
X为吸电子取代基:-NO2, -COOR, -COOH, CN等
(1) 偶氮二异丁腈(AIBN)
CH3
CH3
H3C C N N C CH3
CN
CN
偶氮二异丁腈(AIBN)
1 过氧化物引发剂
特点:聚合反应可以在比较低的温度下进行而 聚合速率相当快。不过在其储存和使用过程中的 安全性要求也相应高一些。
常用的过氧化物包括:无机过氧化物和有机过氧 化物。
无机过氧化物由于分解活化能高,较少单独使 用。主要包括3种:
(1) 过氧化二苯甲酰(BPO)
过氧化物受热分解时,过氧键均裂生成两个自由 基。
CH3
N
+
CH3
O
O
COOC
CH3 N+ CH3
O C O + PhCO2-
这是一种可以在室温条件下快速完成小批量 聚合物制备的高活性引发体系。该反应生成一种 带正电荷的叔胺阳离子自由基。
(4)含功能基引发剂
含功能基的引发剂可把所含功能基引入聚合 物分子链的末端合成末端功能基化高分子。如:
HOOC H2C CH
CH3 2 H3C C
CN
+ N2
异丁腈自由基
偶氮二异丁腈(AIBN)是最常用的一种偶氮类引 发剂。分解温度在50~70℃,分解活化能为129 kJ/mol,也属于低活性引发剂。
特点:分解反应比较平稳,只产生一种自由基 (而BPO则可能产生两种自由基),因而常用于动力 学研究;
因产生的异丁腈自由基是碳自由基,缺乏脱氢能 力,故不能做接枝聚合的引发剂。
第2.3节 自由基聚合机理
基元反应是指每一种聚合物的每一个大分子 的生成都必然经历的最基本的反应过程。
自由基聚合反应一般都包括三个基元反应,即 链引发、链增长和链终止三步反应。就是人们常 说的所谓“三基元反应”。 此外还伴随有链转移 反应。
一、链引发反应
链引发:形成单体自由基活性中心的反应
链引发反应包括引发剂分解产生初级自由基、初级 自由基与单体加成生成单体自由基的2步反应过程。链 引发反应速率主要由引发剂分解速率决定。
聚合度 端基
反应活化能
偶合
链自由基中单 元数的2倍
RR
低
歧化
链自由基中 单元数相等
R
R
高
(3)丙烯酸甲酯和醋酸乙烯 歧化终止 苯乙烯 偶合终止(几乎100%)
四、链转移反应
链自由基从单体、溶剂、引发剂等低分子或已 形成的大分子上夺取一个原子而终止,并使这些 失去原子的分子成为新的自由基,继续新链的增 长,使聚合反应继续进行下去。这一反应叫链转 移反应。
▲链增长过程中链节的连接形式
CH2 CH CH2 CH
X
X
头-尾连接
CH2 CH CH CH2 XX
头-头连接
CH CH2 CH2 CH
X
X
尾-尾连接
受共轭效应和空间位阻效应的影响,一般以头 -尾连接形式为主。
三、链终止反应
链终止反应是指链自由基失去活性生成聚合 物分子的过程。具有未成对电子的链自由基非常 活泼,当2个链自由基相遇时,极易反应失去活 性,形成稳定大分子的过程,叫双基终止。
kd
I
2I
I + H2C CH X
讨 论:
引发活性种,初级自由基,引发自由基
ki
I CH2 CH 初级自由基与单体加成,
X
形成单体自由基
M
第一步:吸热反应,需要加热、光照等提供能量; 活化能较高,Ed=105~150kJ/mol; 反应速率较小,kd=10- 4~ 10- 6s- 1。
第二步:活化能较低的放热反应, Ei=20 ~ 34kJ/mol,反应速率较大 。
(2) 常见氧化还原体系
水溶性
无机物/无机物:H2O2/FeSO4, (NH4)2S2O8/KHSO3 有机物/无机物:有机过氧化物/低价盐
油溶性:有机物/有机物: BPO/N,N-二甲基苯胺
