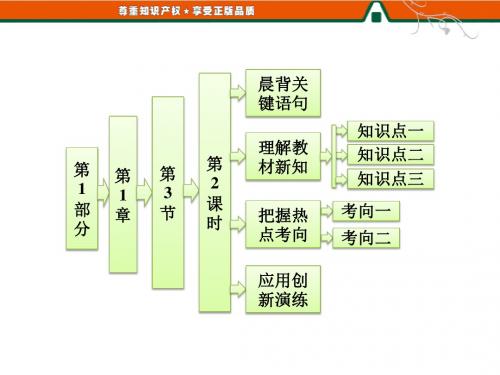
1.3.2 预测同主族元素的性质
【学习方略】高中化学(鲁科)必修2课件:1.3.2预测同主族元素的性质

氢化物的稳定性
减弱 稳定性逐渐_____ HClO4 HBrO4 HIO4
最高价氧化物对应水化 物的酸性
减弱 酸性逐渐_____
2.碱金属元素②原子结构和性质的相似性和递变性:
(1)碱金属元素原子结构和性质的相似性:
1 个电子; ①原子的最外电子层都有__
+1 价; ②最高化合价均为___ ③都是活泼的金属元素,单质都能与氧气、水等物质发生反 应; 碱性 。 ④最高价氧化物对应的水化物一般具有很强的_____
2.问题思考: (1)依据元素周期表推断,自然界中得电子能力最强的元素和失
电子能力最强的元素分别是什么?
分析:自然界中,F是得电子能力最强的元素;Cs是失电子能力
最强的元素。
(2)请分析造成碱金属元素、卤素性质的相似性和递变性的结 构原因。 分析:碱金属元素、卤素性质相似的结构原因是各自的最外层
电子层数相同,最外层电子 数逐渐增多,
同主族(从上→下)
最外层电子数相同,电子层 数递增 逐渐增大 最高正价=主族序数,非金 属最低负价=主族序数-8
原子核外电子排 布 原子半径 元素主要化合价
1→7(第1周期1→2)
逐渐减小(0族除外) 最高正价由+1→+7, 最低负价由-4→-1
项
目
同周期(从左→右)
同主族(从上→下)
原子得、失电子能
力 元素金属性、非金 属性 单质氧化性、还原
得电子能力逐渐增强,失
电子能力逐渐减弱 金属性逐渐减弱 非金属性逐渐增强 氧化性逐渐增强
得电子能力逐渐减弱,失电
子能力逐渐增强 金属性逐渐增强非金属性 逐渐减弱 氧化性逐渐减弱还原性逐
性
最高价氧化物对应 水化物的酸碱性 非金属气态氢化物 的稳定性
(教师参考)高中化学 1.3.2 预测同主族元素的性质课件2 苏教版必修2

5
Sb Te
6
Po At
精选ppt
2
精选ppt
3
怎样证明氮、磷、砷元素的非金属性逐渐减弱?
氮 N2O5 HNO3
酸
NH3
稳 定
磷 P2O5 H3PO4
性 减
PH3
性 降
砷 As2O5 H3AsO4 弱
AsH3
低
为什么氮、磷、砷元素的非金属性逐渐减弱?
电子层数增加,原子半径增大,获得电子的 趋势逐渐减弱,所以非金属性逐渐减弱。
精选ppt
4
氧族元素的原子结构
元素 氧 O
电子层排布
2,6
硫S
2,8,6
硒 Se 碲 Te
2,8,18,6 2,8,18,18,6
相同点: 最外层6个电子
易结合2个电子,非金属性强
核电荷数依次增大(对吸引电子的影响较小)
不同点:
电子层数依次增多 原子半径依次增大
得电子的能力依次减弱 失电子的倾向依次增强 非金属性逐渐减弱 金属性逐渐增强
TeO3 – H2TeO4
+6
+6
RO3 – H2RO4
精选ppt
氧族元素 原子结构的相 似性决定单质 化学性质的相 似性。
6
氧族元素单质化学性质的比较
与氢气反应
生成物 化合条件 稳定性 还原性
H2O 点燃或放电
H2S H2Se
加热 加热
减
增
弱
强
H2Te 不直接化合
氧族元素原子结构的递变性精选决ppt 定单质化学性质的递变7性
氧族元素单质化学性质的比较
最高价氧化物水化物的酸性
化学式 酸性
化学式 稳定性
高一下学期化学第一章3-2《预测同主族元素的性质》课件

2Na + 2H2O ═ 2NaOH + H2 ↑
Mg、水、酚酞
加热前——无明显现象, Mg + 2H2O ═△
加热后——大量气泡,
Mg(OH)2 + H2 ↑
红色明显
(缓慢)
结论:Mg的活泼性不如Na
第二组实验:Mg、Al与盐酸反应
反应物 Mg、盐酸 Al、盐酸
现象
反应迅速,产生 大量气泡
反应较慢,缓 缓产生气泡
(2)同主族元素性质的递变性(以ⅠA、ⅦA为例)
原 子
ⅠA
半
径
金 属 性 依 次 增 强
起 主 要 作
用失
核 电 荷 数 依
电 子 能
次 增 大
原 子 半 径 依 次 增 大
LI Na K Rb
力
依
Cs
次
增
Fr
强
原
ⅦA
子 半
径
F
起
主
Cl Br
原 子 半 径 依 次
核 电 荷 数 依 次
要 作
用得 电 子
结论:核外电子排布呈现周期性变化
2.原子结构中的电子排布
核外电子排布图
结论:核外电子排布呈现周期性变化
核外电子排布呈现周期性变化决定了 元素的性质 必然呈现周期性变化
元素的 性质
原子半径
化合价 金属性 非金属性 氧化性 还原性 电负性
电离能
元素的化合价
原子序数 最高正价
最低负价
特例
1~2
10
3~10 +1 +5 -4 -1 0 F、O 11~18 +1 +7 -4 -1 0 结论:随着原子序数的递增,元素的化合价呈 现 周期性 变化。
高中化学 1.3.2 预测同主族元素的性质课件 鲁科版必修2

3.科学研究发现,地球上化学元素的分布与它们在元素周 期表里的位置有密切关系。例如,相对原子质量较小的元素在
地壳中含量 较多 ,相对原子质量较大的元素在地壳中含量 较少 ;原子序数是 偶数 的元素在地壳中的含量较多,原子序 数是 奇数 的元素在地壳中的含量较少;处于地球表面的元素 多数呈现 高 价态,处于岩层深处的元素多数呈现 低 价态; 碱金属 一般是亲石元素,主要富集于岩石圈的上层。
3.X、Y是元素周期表ⅦA族中的两种元素。下列叙述中 能说明X的非金属性比Y强的是( )
A.X原子的电子层数比Y原子的电子层数多 B.X的氢化物的沸点比Y的氢化物的沸点低 C.X的气态氢化物比Y的气态氢化物稳定 D.Y的单质能将X从NaX的溶液中置换出来
第三十七页,共42页。
解析 根据非金属性的判断依据:非金属元素的单质与氢 气化合的难易程度、气态氢化物的稳定性、非金属元素最高价 氧化物对应的水化物酸性的强弱和非金属间的置换反应。由此 判断只有答案C项符合要求。
第六页,共42页。
二、元素周期表的意义
1.元素周期表成为化学家的得力工具,为研究 物质结构、 发现 新元素 、合成 新物质 提供有价值的指导。
2.根据在元素周期表中位置靠近的元素具有相似的性质这 一规律,可以利用元素周期表寻找新材料。例如我们可以在
金属元素和非金属元素的交界处 寻找半导体材料;可以在 过渡元素 中寻找优良的催化剂。此外还可以利用周期表寻找合 适的 超导材料 、 磁性材料 等。
第十三页,共42页。
4.同主族元素性质递变的原因 同一主族元素的原子,最外电子层上的电子数相同,自上 而下随着核电荷数的增大,电子层数逐渐增加,原子半径逐渐 增大,核与最外层上的电子之间的吸引力减小。所以元素的原 子得电子能力逐渐减小,失电子能力逐渐增大;金属性逐渐增 强,非金属性逐渐减弱。
预测同主族元素的性质
(3)利用同主族元素性质的相似性和递变性规律可推断
不常见元素的性质。 返回3.近年来,我国来自超导研究方面居世界领先地位,铊
答案:D
返回
1.具体应用
(1)在金属元素和非金属元素的交界处寻找半导体材料。 (2)在 过渡元素 中寻找优良的催化剂和特种合金。 (3)对 非金属 元素区域研究,生产新型农药等。 (4)指导探矿。
(5)预测新元素的性质。
返回
2.特别提示
(1)元素分金属元素和非金属元素,但有的金属元素具 有一定的非金属性,如Al、Be等,也有的非金属元素具有 一定的金属性,如Si、As等。 (2)同主族元素原子最外层电子数相同,可推知同主族 元素性质具有相似性;同主族元素原子半径(从上→下)逐 渐增大,可推知同主族元素性质具有递变性。
+ + + + +
返回
[师生互动·解疑难]
同主族元素性质的递变规律(从上到下)
项目 最外层电子数 核电荷数 同主族(从上到下) 相同 依次增大
原子半径
元素的原子得失电子 能力 主要化合价 最高价氧化物对应的 减弱
依次增大
失电子能力逐渐增强,得电子能力逐渐 通常最高正价相同 酸性逐渐减弱,碱性逐渐增强 越来越难与H2化合,稳定性减弱,还原 性增强
返回
(2)卤素单质:
①均为双原子分子(X2)。 ②均能与H2化合:H2+X2===2HX。 ③均能与金属单质反应生成金属卤化物。 ④均能与水不同程度反应,其通式(除F2外)为:X2+
H2O
HX+HXO。
⑤均能与碱溶液反应。
返回
2.递变性(F→Cl→Br→I)
(1)原子序数增大,原子的电子层数增加,原子半径增 大,元素的非金属性减弱。 (2)单质的颜色逐渐加深,状态从气→液→固,熔点、 沸点逐渐升高;单质的氧化性逐渐减弱,与氢气化合由易
(教师参考)高中化学 1.3.2 预测同主族元素的性质课件1 苏教版必修2

精选ppt
11
实验现象
• 钠跟水剧烈反应,钠浮在水 的表面,并迅速的熔成一个 闪亮的小球,在水面四处游 动,发出钾“跟嘶水反嘶应”更剧声烈,,钾但浮未在水的表 见爆炸现面象,,在加水面入四酚处游酞动后,熔,成一个闪 溶液显红亮有色的轻。微火的球,爆发炸出现象紫,色加的入火酚焰酞,后并,伴
溶液显红色。
F2 暗处
Cl2
Br2
光照或 点燃
加热
I2
不断 加热
反应程度 爆炸 剧烈
缓慢
缓慢
氢化物的 稳定性
很稳定
稳定
较稳定 不稳定 易分解
精选ppt
8
小结
• 对ⅦA族元素原子从上到 下,电子层数依次增多,原 子半径逐渐增大,失电子能 力逐渐增强,得电子能力逐 渐减对弱其。它其的单主族质而的言熔适、应沸吗?点
在周期表中元素原子的变化 规律
元素原子序数依次增加,原子半径逐渐减小
元素原子失电子的能力逐渐减弱,得电子的能力逐渐增强
原
元元
子
素素
序
原原
数
子子
递
得失
增
电电
原
子子
子
能能
半
力力
径
减增
增
弱。强,
大
精选ppt
15
随堂练习
1 第四周期某主族元素的原子,它的最外电 子 确的层C是上D (有2个电)子,下列关于此元素的叙述正
A.原子半径比钾的原子半径大
B.氯化物难溶于水
C.原子半径比镁的原子半径大
D.碳酸盐难溶于水
B
2 下列各组中的性质比较正确的是( )
A.稳定性:NH3<PH3 < SiH4
(鲁科版)高中化学必修二:1.3(2)预测同主族元素的性质ppt课件
化学 必修2
第1章 原子结构与元素周期律
自主预习区 互动探究区 巩固训练区 课时作业 专题归纳区
3.结论及解释 相似 递变 (1)结论:同主族元素性质既具有____ 性又有________
性。
(2)预测卤族元素的性质
7 价,最低负价为_____ -1 价; ____ ①最高正价除F外均显+ ②气态氢化物的通式为_____ HX X表示卤素; 相似性 HXO4 F除外。 ③最高价氧化物对应的水化物的通式________ 化合 态形式存在。 ④自然界中均以_____ 由易到难 _________;从上到下,下同 ①与氢气化合的难易程度: ②气态氢化物的稳定性:由强到弱 __________; 递变性 由强到弱 F除外; ___________ ③最高价氧化物的水化物酸性: __________。 ④X-失电子能力:由弱到强
化学 必修2
第1章 原子结构与元素周期律
自主预习区 互动探究区 巩固训练区 课时作业 专题归纳区
答案:(1)2K+2H2O===2KOH+H2↑ Br2+H2O (3)C HBr+HBrO
(2)CsOH HBrO4
化学 必修2
第1章 原子结构与元素周期律
自主预习区 互动探究区 巩固训练区 课时作业 专题归纳区
一、预测同主族元素的性质
[填一填]
1.卤族元素性质的相似性和递变性 (1)预测依据
7 个电子 相似性:最外层均有___ 原子结构 原子半径:从上到下依次增大 递变性 减弱 得电子能力:从上到下依次______
化学 必修2
第1章 原子结构与元素周期律
预测同主族元素的性质

1.3.2预测同主族元素的性质【知能创新导学】【典例导悟】【典例1】以下说法正确的选项是比CH4稳固半径比F-的小与Cs属于第ⅠA族元素,Cs失电子能力比Na的强和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱【标准解答】选C【变式训练】(2010·宜宾高一检测)碱性介于KOH和Mg(OH)2之间的氢氧化物是()(OH)3【解析】选D。
氢氧化物的碱性要介于KOH和Mg(OH)2之间,那么该氢氧化物对应的金属元素的金属性介于K和Mg之间,只有D项符合。
【典例2】短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。
X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或Y原子最外层电子数的3倍。
以下说法正确的选项是的氢化物溶于水显酸性的氧化物是碱性氧化物的氢化物的水溶液在空气中寄存不易变质和Z的最高价氧化物对应的水化物都是弱酸【变式训练】(2010·启东高一检测)X、Y、Z是主族的三种非金属元素,它们在周期表中的位置如下表所示。
试回答:X元素单质的化学式是_________ 。
(2)Y元素的原子结构示用意是_________ 。
(3)Z元素的名称是_______ ;从元素原子得失电子的角度看,Z元素具有________ 性;假设从Z元素在周期表中所处位置看,它具有这种性质的缘故是________。
【解析】X、Y、Z是主族的三种非金属元素,那么X、Y、Z别离为F、S、As。
因为,假设Z为第ⅣA族,那么Z为金属,不符合。
As处于金属元素与非金属元素分界限处,既具有金属性,又具有非金属性。
答案:(1)F2 (2)(3)砷金属性和非金属处于元素周期表金属元素与非金属元故旧壤限周围【学业达标训练】1.以下关于主族元素的说法中错误的选项是()A.同主族元素原子序数递增,元素原子失电子能力慢慢增强B.同主族元素原子序数递增,单质氧化性慢慢增强C.同主族元素原子最外层电子数都相同D.同主族元素的原子半径,随原子序数增大而慢慢增大【解析】选B。
1.3.2同主族元素性质递变规律

Na与水 反应
浮、游、熔、响、 红
2Na+2H2O=2NaOH+H2↑
【结论】钾和钠的化学性质相似,钾比 钠更活泼。 【思考】根据钾和钠的性质,预测ⅠA 族其它金属的性质。
同主族元素的得电子和失电子能力递变规律
H Li Na K Rb Be Mg Ca Sr B Al Ga In C Si Ge Sn N P As Sb O S Se Te F Cl Br I
交流与研讨
在元素周期表中,同主族元素原子 的核外电子排布有什么特点?它对 元素的性质有何影响?
预测结论
1.同主族元素原子的最外层电子数目相 同,具有相似的化学性质。也即相似性。 2.同主族元素从上到下,随着原子核外 电子层数增多,原子半径增大,原子 核对最外层电子的引力减小,元素原 子得电子能力减弱,失电子能力增强。 也即递变性
元素 最高 正价 最低 负价 自然界中存 在形态 最高价 含氧酸 气态氢 化物
F 无
Cl
Br 为+ _____ 7 价 都为 ____ - 1
I
全部以______ 化合 态形式存在
无
HClO _______ 4 HCl _____
HBrO4
HIO4
HF ____
HBr _____
HI ___
卤族元素单质与氢气化合的反应条件
失 电 子 能 力 逐 渐 增 强
Cs
Ba
Tl
Pb
Bi
Po
At
得 电 子 能 力 逐 渐 减 弱
周期表中元素金属性、非金属性的递变
ⅠA ⅡA 1 2 3 4 5 6 7 ⅢA ⅣA ⅤA ⅥA ⅦA 0
非金属性逐渐增强 金 属 性 逐 渐 增 强
第二课时 预测同主族元素的性质

第二课时预测同主族元素的性质第二课时预测同主族元素的性质一、预测同主族元素的性质 1 .同主族元素的相似性在元素周期表中位于同主族的元素原子的最外层电子数_____,因此,同主族元素具有____的性质。
第ⅦA 族元素,该族元素包括___________________等元素,其原子最外层都有______个电子,得电子能力很______,所以第ⅦA 族元素都是________的_______元素。
因此它们在性质上表现出很多共性,如元素的最高化合价为________、最低化合价为________;它们存在的最高价氧化物对应的水化物具有很强的__________性;它们都能形成____________;在氧化还原反应中,它们的单质常做____________。
2 .同主族元素性质的递变规律同主族元素原子从上到下电子层数依次________,原子半径逐渐________,失电子能力逐渐________,得电子能力逐渐____________。
从而引起同主族元素的单质及化合物有关化学性质的_________________。
第 VllA 族元素原子从上到下___________依次增多, _____________逐渐增大,_________逐渐减弱,因此它们在化学性质上表现递变性。
从________到________,单质跟 H2发生的化合反应越来越_____进行:氟气跟 H2 在________就能化合,并发生_______;氯气在__________的条件下,能跟 H 2发生的化合反应;溴蒸气跟 H2 的反应在________时能地进行;而碘跟 H2的反应要在____________下才能进行,生成的碘化氢,同时发生________。
从______到_____,单质的氧化性依次减弱: F :能跟水剧烈反应产生 O2 ,反应方程式为 2F2 + 2H2O =4HF + O2 , C12、 Br2、 I 2都不能置换水中的氧;C12 能跟 NaBr 、 KI 发生______反应,反应的离子方程式为______________; Br 2能跟 KI发生反应,反应的离子方程式为_____________。
预测同主族元素的性质

3.可能存在的第119号元素,有人称“类钫”,依据周期表
结构及元素性质变化趋势,对有关“类钫”的预测说法正确 的是( )
A.“类钫”在化合物中呈+1价 B.“类钫”属过渡元素,具有钫”单质有较高的熔点
【解析】选A。根据“类钫”的原子序数为119,可知该元素在 周期表中的位置在“第8周期”第ⅠA族,在化合物中呈+1价, A正确,B错误;碱金属单质由上到下密度逐渐增大,熔点逐渐 降低,C、D错误。
【规律方法】推断题中的常见“突破口” (1)族序数与周期数相同的短周期元素是H、Be、Al;族序数是 周期数2倍的元素是C、S;族序数是周期数3倍的元素是O;族
序数是周期数3倍多1的元素是F。
(2)周期数是族序数2倍的元素是Li、Ca和Tl;周期数是族序数 3倍的元素是Na和Ba。 (3)最外层电子数是次外层电子数3倍的元素是O;最外层电子 数是次外层电子数2倍的元素是C;最外层电子数等于次外层电 子数的元素是Be、Ar。
是Mg与冷水的反应已是很慢了,则说明铍与冷水的反应很难进 行。
2.(2012·宁波高一检测)下列关于卤族元素由上到下性质递 变的叙述,正确的是( ①单质的氧化性增强 ) ②单质的颜色加深 ③气态氢化物
的稳定性增强
强 A.①②③ C.②④⑤
④单质的沸点升高
⑤阴离子的还原性增
B.②③④ D.①③⑤
【解析】选C。卤族元素由上到下非金属性逐渐减弱,因此单 质的氧化性减弱,气态氢化物稳定性减弱,阴离子的还原性增 强,①、③错,⑤正确;单质的颜色逐渐加深,沸点升高,②、 ④正确。故选C。
【典题训练】
(2012·福建高考)短周期元素R、T、Q、W在元素周期表中的相 对位置如图所示,其中T所处的周期序数与族序数相等。下列 判断不正确的是(
预测同主族元素的性质 (2)

反应生成碱和氢气,D对。
5.(LK必修2·P26改编)下列对铍及其化合物叙述正确的是(
A.铍的金属性比钠强
)
B.氯化铍的氧化性比氯化锂强
C.氢氧化铍的碱性比氢氧化钙的强
D.单质铍易跟冷水反应产生H2
【解析】选B。铍(Be)位于元素周期表中第2周期第ⅡA族,根据周期表 中元素性质的递变规律可知,题中涉及元素的金属性强弱的关系为 Li>Be,Na>Mg>Be,Ca>Mg>Be,还需明确的是Mg与冷水的反应已是很慢 了,则说明铍与冷水的反应很难进行。
的元素在金属元素的非金属性最强(稀有气体除外),同一主族最
上方的元素的非金属性最强,所以非金属性最强的元素在元素周期表 的最右上方,即为氟。
【典题训练】(2014·山东高考)根据原子结构及元素周期律的知识, 下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱 B.核外电子排布相同的微粒化学性质也相同 C.Cl-、S2-、Ca2+、K+半径逐渐减小
2.碱金属元素原子结构和性质的相似性与递变性:
(1)结构、性质的相似性。 1 +1
碱性
(2)单质及化合物性质的递变性。 结构及性质 原子半径 规 律
增大
单质的还原性 与水、氧气反应的 剧烈程度
增强
剧烈
最高价氧化物对应 水化物的碱性
增强
【微点拨】随原子序数的递增,碱金属元素与氧元素形成的化合物种 类越来越多,也越来越复杂。
一、元素周期表中元素性质的递变规律 思考探究: Cl2+2Br-====2Cl-+Br2 ① ②
2 2 +CO2+H2O====H2SiO3↓+ CO3 SiO3
高中化学 1-3-2 预测同主族元素的性质 省优获奖课件 鲁科版必修2

⑦熔、沸点:卤族元素同碱金属元素相反, 自上而下,单质的熔、沸点逐渐升高。 ⑧溶解性:除F2外,卤素单质在水中的溶 解性均不大,均易溶于有机溶剂。 (3)特殊性 ①在常温下,溴是唯一的液态非金属单质, 易挥发。 ②碘为紫黑色固体,易升华,淀粉遇碘变 蓝色。
【例1】关于卤素(用X表示)的下列叙述中, 正确的是 ( )。 A.卤素单质与水反应均可用X2+ H2O===HXO+HX表 示 B.HX都极易溶于水,它们的热稳定性随 着核电荷数的 增加而增强 C.从F2到I2,卤素单质的颜色随着相对分 子质量的增大 而加深 D.X-离子的还原性:F-<Cl-<Br-<I-, 因此,相对 分子质量小的卤素单质可将相 对分子质量大的卤素从 它的盐溶液里置换
强 弱
I
由
由 由
.
. .
得电子能力
X-失电子能 力
由
.
笃学三
碱金属元素性质的相似性和递变性
在所属周期中半径最大稀有气体元素除外 最高正价: +1价 1.相似性 化合态 活泼金属,在自然界中存在形式: 最高价氧化物对应水化物呈 强碱 性
2.递变性 元素 原子半径 失电子能力 与水反应剧烈程 度 与氧气反应剧烈 程度 Li Na K Rb Cs ―→ 小 大 由 到 . 弱 强 ―→ 由 到大 . ―→ 大 剧烈程度变 . 强 ―→ 剧烈程度变 .
2.卤素单质 (1)相似性(用X表示卤族元素)
(2)递变性 ①按从F到I的顺序,原子得电子能力逐渐减 弱。 ②F-、Cl-、Br-、I-的还原性逐渐增强。 ③氢化物的稳定性:HF>HCl>HBr>HI ④氢化物的还原性:HF<HCl<HBr<HI ⑤最高价含氧酸的酸性:HClO4>HBrO4> HIO4,F无正价,故无含氧酸。 ⑥密度:卤族元素,自上而下,单质的密度 逐渐增大。
2020化学新鲁科必修:预测同主族元素的性质含解析

第2课时预测同主族元素的性质[目标导航]1.以ⅠA族和ⅦA族元素为例,掌握同主族元素性质的递变规律,并能运用原子结构的理论初步解释这些递变规律。
2.能够利用同主族元素性质的特点来预测未知元素的性质。
3.了解元素周期表中各区域元素的应用。
一、预测同主族元素的性质1.ⅦA族元素(卤族元素)原子结构与性质的相似性和递变性(1)相似性元素(名称与符号) 氟(F) 氯(Cl) 溴(Br) 碘(I) 原子最外层电子数都为7最高正价无为+7价最低负价都为-1价自然界中存在形态全部以化合态形式存在单质性质都是活泼非金属,在氧化还原反应中常作氧化剂最高价含氧酸化学式无HClO4HBrO4HIO4酸性具有很强的酸性气态氢化物的化学式HF HCl HBr HI (2)递变性元素 F Cl Br I 电子层数逐渐增多原子半径逐渐增大得电子能力逐渐减弱失电子能力逐渐增强单质与H2化合的条件暗处爆炸点燃或光照加热(200 ℃)更高温度下,缓慢反应,可逆氢化物的稳定性逐渐减弱最高价氧化物对应水化物的酸性逐渐减弱(2)比较单质铍和锂,单质铍和钙分别与相同物质的量浓度的盐酸反应的快慢?(3)氢氧化铍是强碱吗?答案(1)铍不与冷水反应,钡能与冷水剧烈反应。
(2)锂比铍、钙比铍与盐酸反应放出氢气快。
(3)氢氧化铍是弱碱。
2.将钾投入到氯化钠或硫酸铜溶液中能否置换出钠或铜?答案不能。
因为钾很活泼,钾容易和水反应。
3.镓(Ga)与铝同族,请写出镓的氯化物和氨水反应的化学方程式。
答案Ga和Al同主族,其最高化合价也应为+3价,镓的氯化物为GaCl3,Ga(OH)3的碱性强于Al(OH)3,根据Al(OH)3难溶于水,可预测Ga(OH)3也难溶于水,所以反应的化学方程式写为GaCl3+3NH3·H2O===Ga(OH)3↓+3NH4Cl。
一、同主族元素原子结构与性质的相似性与递变性同主族元素原子结构与性质的递变规律内容同主族自上而下原子结构电子层数增多最外层电子数相同原子半径逐渐增大元素性质原子得电子能力减弱原子失电子能力增强元素的金属性增强元素的非金属性减弱单质还原性与氧化性还原性增强,氧化性减弱元素的主要化合价最高正价数=主族序数(F无正价,O无最高正价)非金属元素气态氢化物的形成及稳定性形成由易到难,稳定性由强到弱体,B项不正确;卤族元素的原子,最外层上都有7个电子,C项正确;因氧化性:Cl2>At2,所以At2不能从NaCl溶液中置换出Cl2,D项不正确。
高中化学鲁科版必修2课件:1.3.2 预测同主族元素的性质(课件40张)

123456
解析 答案
4.镭(Ra)位于周期表的第7周期ⅡA族。下列关于镭的性质的描述不正确 的是 A.在化合物中呈+2价 B.单质能与水反应产生氢气
√C.氢氧化物呈两性
D.碳酸盐难溶于水 解析 根据ⅡA族Mg、Ca等性质,以及Ra的金属性比Mg、Ca更强可推 测出Ra及其化合物的性质。
123456
碱金属元素的单质都是很强的还原剂,⑤正确。
123456
解析 答案
3.碲(Te)是52号元素,位于周期表中ⅥA族,处于金属区与非金属区的交 界线上。下列叙述错误的是
A.碲的单质具有半导体的性能
√B.碲化氢(H2Te)比H2S更稳定
C.碲可在空气中燃烧生成二氧化碲(TeO2) D.H2TeO4的酸性比H2SO4弱
实验原理 2_K__+__2_H_2_O_=_=_=__2_K_O_H__+__H_2_↑_ _2_N_a_+__2_H_2_O_=__=_=_2_N_a_O_H__+__H_2_↑_
归纳总结
性质 原子半径 原子失电子能力 元素金属性 单质的还原性 金属阳离子氧化性 最高价氧化物对应水化物的碱性
规律(从上到下) 增__大__ 增__强__ _增__强__ _增__强__ _减__弱__ 增__强__
第1章 第3节 元素周期表的应用
第2课时 预测同主族元素的性质
学习目标定位 1.以ⅠA族、ⅦA族元素为例,掌握同主族元素性质的递变规律。 2.能运用原子结构理论初步解释同主族元素性质的递变规律。 3.能根据学习过的一些典型元素的性质预测同主族其他元素的性质。 4.了解元素周期表的应用。
内容索引
新知导学 —— 新知探究 点点落实 达标检测 —— 当堂检测 巩固反馈
解析 答案
高中化学_预测同主族元素的性质教学设计学情分析教材分析课后反思

第三节元素周期表的应用预测同主族元素的性质第2课时教学设计【教学目标】1. ⅦA、ⅠA族元素为例,使学生掌握同主族元素性质递变规律,并能用原子结构理论初步加以解释;2. 通过“观察思考”,培养学生观察实验能力以及对实验结果的分析、处理和总结能力;【教学重点】同主族元素性质递变规律【教学难点】同主族元素性质递变规律【教师具备】多媒体课件【教学方法】实验法讨论法【教学过程】【课后作业】学案元素周期表的应用第二课时预测同主族元素的性质学情分析在本节课学习之前,学生已经掌握了元素周期表的结构以及元素周期表中同一周期元素相关性质的递变规律,包括原子半径、元素原子得失电子能力、最高价氧化物对应水化物的酸碱性、气态氢化物的稳定性等,也知道元素原子得失电子能力强弱的判断方法。
对于周期表中从左往右元素性质从量变向质变的转化已经有了一定的认知。
教材必修1中对卤素单质的性质分散学习过,对卤素单质的氧化性强弱有认识,由此讨论整合出同一主族元素性质的递变规律不困难。
课前需复习元素原子得失电子能力强弱的判断方法,同主族元素原子结构特点,从结构相似性和递变性认识性质。
课后将原子结构、元素周期律和元素周期表及相关元素化合物知识进行整合,体会元素在周期表中的位置、元素的原子结构、元素性质(简称“位、构、性”)三者间的关系,学会运用元素周期律和元素周期表指导化学学习。
学生已经达到的层次是能够利用这些规律来应对试题,但却造成了一种为学周期表而学周期表的状况。
学生对门捷列夫发现元素周期律编制元素周期表的革命性意义没有深刻认识,也没有感受到元素周期表的美和神奇,更谈不上形成利用元素周期表来解决问题指导自身学习的意识。
元素周期表工具的价值还没有得到体现。
效果分析元素周期表及其应用是中学化学教材中重要的基础理论,内容较抽象,理论性强。
学生通过对元素周期表的进一步学习,可以促使其对以前学过的知识进行概括、综合,实现由感性认识上升到理性认识。
但由于本节内容的抽象性,学生学习提不起精神,觉得无趣。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【学习目标】
1、以IA和ⅦA族元素为例,预测同主族元素的性质,初步学会根据元素的原子结构来解释或预测元素的性质。
2、能初步用实验探究的方法来探究同主族元素性质的递变规律。
【预习案】
1、有哪些事实或方法可以证明金属性Na>Al?(至少列举三种方法)
⑴ _______________________________________________________________________________⑵
_______________________________________________________________________________⑶
_______________________________________________________________________________
2、有哪些事实或方法可以证明非金属性Cl>S?(至少列举三种方法)
⑴ _______________________________________________________________________________⑵
_______________________________________________________________________________
⑶ _______________________________________________________________________________
【课堂探究】
一、预测同主族元素的性质
【交流研讨】(参考教材P23~ P24)
⑴有哪些事实或方法可以证明金属性K>Na?
___________________________________________________________________________________________ ___________________________________________________________________
⑵预测钾与水反应的现象与钠与水反应的现象有何不同?为什么?
___________________________________________________________________________________________ ___________________________________________________________________
⑶以IA族元素为例,说明同主族元素性质与元素原子结构的关系是什么。
___________________________________________________________________________________________ ________________________________________________________________
【交流研讨】二、预测同主族元素的性质
阅读教材P23,完成下列表格中内容。
【小结】同主族元素的原子结构与元素性质的关系?(以ⅦA族为例分析)
___________________________________________________________________________________
【学以致用】根据你对同主族元素性质的理解分析第IA族碱金属元素性质的相似性和递变规律。
