化学:3.3《沉淀溶解平衡的应用》(4)(鲁科版选修4)PPT课件
合集下载
鲁科版高中化学选修四第三章第3节 沉淀溶解平衡第二课时沉淀溶解平衡公开课教学课件共15张PPT (共15张PPT)

Ksp=[Mg2+ ][OH-]2
Mg2 + (aq) +2OH- (aq)
② Ksp反映了难溶电解质在水中的溶解度 只与难溶电解质的性质和温度有关。
美丽的珊瑚礁
空气中二氧化碳增多,干扰珊瑚的生长,甚至造成 珊瑚虫的死亡。你知道是为什么吗?
小组合作· 交流讨论(8分钟)
1.运用沉淀溶解平衡理论解释: ①医学上做钡餐透视时为什么用BaSO4而不用BaCO3?可溶性钡盐 中毒,如何处理? ②溶洞的形成并写出有关化学方程式。 ③海洋中多彩的珊瑚为什么濒临灭绝? 2. 合作完成【实验探究2】观察现象 解释原因
【实验探究1】 PbI2的溶解平衡 向PbI2饱和溶液上层清液中滴加几滴0.1mol/L 的(CH3COO)2Pb溶液或者 0.1mol/LKI溶液 注意:在操作过程中不能震荡试管 ①号试管加(CH3COO)2Pb溶液 ②号试管加0.1mol/LKI溶液 观察实验现象
PbI2在水中溶解平衡 速 率 υ溶解 υ沉淀
二、沉淀溶解平衡的应用 1.沉淀的溶解与生成 Q>Ksp, 平衡向生成沉淀的方向移动。 Q=Ksp, 平衡状态 Q<Ksp , 沉淀溶解 2.沉淀的转化 实质:沉淀溶解平衡的移动 规律:一种沉淀可以转化为更难溶的沉淀,两 种难溶物的溶解能力差别越大,越容易转化
利用沉淀转化原理,在工业废水的处理过 程中,常用FeS(s) MnS(s)等难溶物作为沉淀 剂除去废水中的Cu2+、Hg2+、Pb2+等重金属离子。
第3节 沉淀溶解平衡
“桃花流水窅然去,别有天地非人间”
当你外出旅游, 沉醉于神奇的溶洞, 诗仙李白别有洞天的诗句,恰如其分的表现 欣赏着美丽的珊瑚时,一定会惊叹于 出中国古老溶洞的壮观和神奇。 大自然的鬼斧神工。你想知道它们是 如何形成的吗?
Mg2 + (aq) +2OH- (aq)
② Ksp反映了难溶电解质在水中的溶解度 只与难溶电解质的性质和温度有关。
美丽的珊瑚礁
空气中二氧化碳增多,干扰珊瑚的生长,甚至造成 珊瑚虫的死亡。你知道是为什么吗?
小组合作· 交流讨论(8分钟)
1.运用沉淀溶解平衡理论解释: ①医学上做钡餐透视时为什么用BaSO4而不用BaCO3?可溶性钡盐 中毒,如何处理? ②溶洞的形成并写出有关化学方程式。 ③海洋中多彩的珊瑚为什么濒临灭绝? 2. 合作完成【实验探究2】观察现象 解释原因
【实验探究1】 PbI2的溶解平衡 向PbI2饱和溶液上层清液中滴加几滴0.1mol/L 的(CH3COO)2Pb溶液或者 0.1mol/LKI溶液 注意:在操作过程中不能震荡试管 ①号试管加(CH3COO)2Pb溶液 ②号试管加0.1mol/LKI溶液 观察实验现象
PbI2在水中溶解平衡 速 率 υ溶解 υ沉淀
二、沉淀溶解平衡的应用 1.沉淀的溶解与生成 Q>Ksp, 平衡向生成沉淀的方向移动。 Q=Ksp, 平衡状态 Q<Ksp , 沉淀溶解 2.沉淀的转化 实质:沉淀溶解平衡的移动 规律:一种沉淀可以转化为更难溶的沉淀,两 种难溶物的溶解能力差别越大,越容易转化
利用沉淀转化原理,在工业废水的处理过 程中,常用FeS(s) MnS(s)等难溶物作为沉淀 剂除去废水中的Cu2+、Hg2+、Pb2+等重金属离子。
第3节 沉淀溶解平衡
“桃花流水窅然去,别有天地非人间”
当你外出旅游, 沉醉于神奇的溶洞, 诗仙李白别有洞天的诗句,恰如其分的表现 欣赏着美丽的珊瑚时,一定会惊叹于 出中国古老溶洞的壮观和神奇。 大自然的鬼斧神工。你想知道它们是 如何形成的吗?
鲁科版高中化学选修四课件第3章第3节第2课时沉淀溶解平衡的应用.pptx

(1)当QK>sp时有沉淀析出,直至达到沉淀溶解平衡状态。 (2)当Q=Ksp时,达到沉淀溶解平衡状态。 (3)当QK<sp时,再加入难溶电解质就可达到沉淀溶解平衡状 态。
二、沉淀的转化 1.沉淀转化的实质:沉是淀。溶解平衡的移动 2.规律: (1)一般说来,的溶沉解淀能转力化小成的沉淀容易实溶现解。能力更小 (2)两种难溶电解质的溶解能力差别,沉淀转化越容易。
越大
利用溶度积判断沉淀的溶解和生成 通过比较溶度积和溶液中难溶电解质有关离子浓度幂的 乘积Q的相对大小,可判断难溶电解质在给定条件下沉 淀的生成或溶解。
(1)Q>Ksp,生成沉淀 ①分离离子:同一类型的难溶电解质,如AgCl、AgBr 、AgI,向含物质的量浓度相同Cl-、Br-、I-的溶液中
【例2】 某温度时,BaSO4在水中的沉淀溶解平衡曲线 如图所示。下列说法错误的是( )
A.加入适量BaCl2(固体)可以使溶液由d点变到c点 B.通过加水稀释可以使溶液由b点变到a点
C.d点无BaSO4沉淀生成 D.a点对应的Ksp等于c点对应的ห้องสมุดไป่ตู้sp
[反思感悟] (1)沉淀溶解平衡曲线上的点表示的溶液中 Q=Ksp,沉淀与溶解处于平衡状态。 (2)沉淀溶解平衡曲线上方的点表示溶液中Q>Ksp,溶液 过饱和,有沉淀析出,直至饱和,达到新的沉淀溶解平
衡。
再见
(2)Q<Ksp,沉淀溶解 加入物质,使之与溶解平衡体系中的相应离子反应,降 低离子浓度,使平衡向溶解方向移动。
①酸碱溶解:如CaCO3溶于盐酸。 ②盐溶解法:如Mg(OH)2溶于NH4Cl溶液。 ③氧化还原法:如Ag2S溶于稀HNO3溶液。
[反思感悟] 判断沉淀顺序的方法: 哪种离子沉淀需要的沉淀剂离子浓度越小,哪种离子先 沉淀。当开始离子浓度相等,且属同类型的难溶电解质 时,则对应Ksp小的离子需要的沉淀剂离子浓度小,先沉 淀。
二、沉淀的转化 1.沉淀转化的实质:沉是淀。溶解平衡的移动 2.规律: (1)一般说来,的溶沉解淀能转力化小成的沉淀容易实溶现解。能力更小 (2)两种难溶电解质的溶解能力差别,沉淀转化越容易。
越大
利用溶度积判断沉淀的溶解和生成 通过比较溶度积和溶液中难溶电解质有关离子浓度幂的 乘积Q的相对大小,可判断难溶电解质在给定条件下沉 淀的生成或溶解。
(1)Q>Ksp,生成沉淀 ①分离离子:同一类型的难溶电解质,如AgCl、AgBr 、AgI,向含物质的量浓度相同Cl-、Br-、I-的溶液中
【例2】 某温度时,BaSO4在水中的沉淀溶解平衡曲线 如图所示。下列说法错误的是( )
A.加入适量BaCl2(固体)可以使溶液由d点变到c点 B.通过加水稀释可以使溶液由b点变到a点
C.d点无BaSO4沉淀生成 D.a点对应的Ksp等于c点对应的ห้องสมุดไป่ตู้sp
[反思感悟] (1)沉淀溶解平衡曲线上的点表示的溶液中 Q=Ksp,沉淀与溶解处于平衡状态。 (2)沉淀溶解平衡曲线上方的点表示溶液中Q>Ksp,溶液 过饱和,有沉淀析出,直至饱和,达到新的沉淀溶解平
衡。
再见
(2)Q<Ksp,沉淀溶解 加入物质,使之与溶解平衡体系中的相应离子反应,降 低离子浓度,使平衡向溶解方向移动。
①酸碱溶解:如CaCO3溶于盐酸。 ②盐溶解法:如Mg(OH)2溶于NH4Cl溶液。 ③氧化还原法:如Ag2S溶于稀HNO3溶液。
[反思感悟] 判断沉淀顺序的方法: 哪种离子沉淀需要的沉淀剂离子浓度越小,哪种离子先 沉淀。当开始离子浓度相等,且属同类型的难溶电解质 时,则对应Ksp小的离子需要的沉淀剂离子浓度小,先沉 淀。
鲁科版高中化学选修四课件沉淀溶解平衡

入此溶液中,固体将溶解,直到溶液中Qc=Ksp时, 溶液达到饱和。
请你利用沉淀溶解平衡的知识、Qc与Ksp的 关系及所提供的信息解释下列现象:
现象1:医院中进行钡餐透视时,用BaSO4做内 服造影剂,为什么不用BaCO3做内服造影剂?
信息: 1.Ksp(BaSO4)=1.1×10-10mol2·L-2; Ksp(BaCO3)=5.1×10-9mol2·L-2 2.Ba2+有剧毒,; 3.胃酸的酸性很强,pH约为0.9~1.5;
数据:1.几种物质的溶度积常数(Ksp)
物质
CaSO4
CaCO3
Mg(OH)2
MgCO3
Ksp 7.1×10-5 2.8×10-9 5.6×10-12 6.8×10-6
2.Mg(OH)2饱和溶液中,[Mg2+]= 1.1×10-4mol/L MgCO3饱和溶液中,[Mg2+]= 2.6×10-3mol/L
由 c(Fe2+ ) 1.0mol L-1
则 c(S2- ) 6.251018 6.251018 mol L-1 1.0
c(H+ )
1.0 1022 6.25 1018
4 103 mol L-1
pH 2.4
4.氢氧化镁难溶于水,但它所溶解的那一部分 认为在溶液中完全电离。某温度时,饱和氢氧 化镁溶液的pH=11,若不考虑Kw值的变化,则 该温度下氢氧化镁的溶解度为(溶液的密度为 1g/mL。
自然界
生活
沉淀溶解平衡
生产
溶液中的化学反应
♥沉淀溶解与生成:溶度积原理
• 1)若Qc=Ksp • 此时难溶电解质达到沉淀溶解平衡状态,溶液是
饱和溶液。
• 2)若Qc>Ksp • 溶液中将析出沉淀,直到溶液中的Qc=Ksp为止。 • 3)若Qc<Ksp • 溶液为不饱和溶液,将足量的难溶电解质固体放
请你利用沉淀溶解平衡的知识、Qc与Ksp的 关系及所提供的信息解释下列现象:
现象1:医院中进行钡餐透视时,用BaSO4做内 服造影剂,为什么不用BaCO3做内服造影剂?
信息: 1.Ksp(BaSO4)=1.1×10-10mol2·L-2; Ksp(BaCO3)=5.1×10-9mol2·L-2 2.Ba2+有剧毒,; 3.胃酸的酸性很强,pH约为0.9~1.5;
数据:1.几种物质的溶度积常数(Ksp)
物质
CaSO4
CaCO3
Mg(OH)2
MgCO3
Ksp 7.1×10-5 2.8×10-9 5.6×10-12 6.8×10-6
2.Mg(OH)2饱和溶液中,[Mg2+]= 1.1×10-4mol/L MgCO3饱和溶液中,[Mg2+]= 2.6×10-3mol/L
由 c(Fe2+ ) 1.0mol L-1
则 c(S2- ) 6.251018 6.251018 mol L-1 1.0
c(H+ )
1.0 1022 6.25 1018
4 103 mol L-1
pH 2.4
4.氢氧化镁难溶于水,但它所溶解的那一部分 认为在溶液中完全电离。某温度时,饱和氢氧 化镁溶液的pH=11,若不考虑Kw值的变化,则 该温度下氢氧化镁的溶解度为(溶液的密度为 1g/mL。
自然界
生活
沉淀溶解平衡
生产
溶液中的化学反应
♥沉淀溶解与生成:溶度积原理
• 1)若Qc=Ksp • 此时难溶电解质达到沉淀溶解平衡状态,溶液是
饱和溶液。
• 2)若Qc>Ksp • 溶液中将析出沉淀,直到溶液中的Qc=Ksp为止。 • 3)若Qc<Ksp • 溶液为不饱和溶液,将足量的难溶电解质固体放
沉淀溶解平衡的应用公开课用PPT课件

环境科学等,开拓视野,培养创新思维。
感谢您的观看
THANKS
提供参考。
04 沉淀溶解平衡的实际应用 案例
工业废水处理
沉淀剂的应用
利用沉淀剂与废水中的有害物质发生 化学反应,生成难溶于水的沉淀物, 从而达到去除有害物质的目的。
调节pH值
生物处理法
利用微生物的代谢作用,将废水中的 有机物转化为无害的物质,同时利用 微生物的吸附作用促进沉淀物的形成 和分离。
通过调节废水的pH值,改变某些有害 物质的溶解度,促进沉淀物的形成和 分离。
在环境保护领域,沉淀溶解平衡也发挥了重要作用。通过 沉淀反应可以去除水体中的重金属离子和有害物质,净化 水质,保障人类健康。
例如,在污水处理过程中,加入适当的沉淀剂可以促使有 害物质形成沉淀,从而降低水体中有害物质的浓度,达到 净化水质的目的。
生物医学
在生物医学领域,沉淀溶解平衡也具有广泛的应用前景。例如,利用沉淀反应可 以分离和纯化生物大分子,研究其结构和功能;还可以用于药物研发和生产过程 中,提高药物的纯度和稳定性。
04
05
5. 分析实验数据,得出结论 。
实验结果与讨论
01
02
03
04
通过实验观察,记录沉淀物的 形成和溶解情况,以及不同条
件下的变化情况。
分析实验数据,得出沉淀溶解 平衡的规律和影响因素。
讨论沉淀溶解平衡在实际生产 和生活中的具体应用,如水处 理、工业生产、药物制备等。
总结实验结果,提出改进意见 和建议,为今后的实验和研究
,达到平衡状态。
沉淀溶解平衡的意义
沉淀溶解平衡在化学工程、环境科学、医学等领域有广泛应用,对于理解物质在溶 液中的行为和性质具有重要意义。
鲁科版高中化学选修四第三章第3节 沉淀溶解平衡第二课时沉淀溶解平衡的应用公开课教学课件 (共25张PPT)

AgCl AgI Ag2S
实验说明:沉淀可以从溶解度小的向溶解度更小 的方向转化,两者差别越大,转化越容易。
沉淀的转化示意图
AgCl(s)
Ag+ + ClKI = I + K+ AgI(s)
+-
AgCl(s)+I- == AgI(s) + Cls(AgCl)=1.5×10-4g s(AgI)=3.7×10-7g s(Ag2S)=1.3×10-16g
H2O + CO2
2. 沉淀的溶解
(1)原理:通过反应,使溶解平衡体系中的某种离子浓 度减小,平衡向沉淀溶解的方向移动,就达到使沉淀溶 解的目的,即使Q < Ksp , 沉淀溶解 (2)应用: 例如除水垢[主要成分为CaCO3、Mg(OH)2等]
[思考]:写出氢氧化镁的沉淀溶解平衡方程式.
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)
溶液过饱和,沉淀 生成 ,直 至 Q=Ksp ,达到新的沉淀溶解平衡 溶液饱和,沉淀与溶解处于 平衡 状态
溶液未饱和,若加入过量难溶电解质,
则会沉淀 溶解 ,直至溶液 饱和
【思考一】
1、如果误食可溶性钡盐,造成钡中毒,可用给硫酸钠溶 液给患者洗胃,为什么?若要有效地除去胃中的Ba2+,所 用NaSO4溶液的浓度是多少? 已知:Ksp(BaSO4)=1.1×10-10,且当剩余离子即平衡 离子浓度<10-5mol· L-1时,认为离子已沉淀完全或离子 已有效除去。 2、某工厂将溶液pH调节到3~4,可除1mol· L-1 CuSO4溶液中的0.05mol· L-1Fe3+杂质,原因是什么? 已知25℃ 时,Cu(OH)2 Ksp=2.2×10-20,Fe(OH)3的 Ksp=2.6×10-39 。
优课系列高中化学鲁科版选修4 3.3沉淀溶解平衡 课件(26张)

结论和化学方程式
AgCl I- AgI S2- Ag2S
思考:已知AgCl、AgI和Ag2S的Ksp分别为: 1.8×10-10、8.3×10-17、1.6×10-49,分析实验现象 产生的原因,归纳沉淀转化的方向。
三、沉淀的转化
沉淀转化的实质:沉淀溶解平衡的移动。
一般规律:对于组成类似(阴阳离子个数比相同)的难溶电解 质来说,溶解能力相对较强的物质易转化为溶解能力相对较 弱的物质,难溶物的溶解能力相差越大,这种转化的趋势越大。
溶解能力大的沉淀:
溶度积常数大的沉 淀
溶解能力小的沉淀: 溶度积常数小的沉淀
换上有龋齿的牙齿, 美女的她还能笑得 那么美吗?
我们的目标是 ——没有蛀牙!
糖吃多为什么会出现龋齿?如提何示预:糖防在?酶的作用下产 生了一种有机弱酸
生活常识:龋齿和含氟牙膏
(1)存在的溶解平衡
Ca5(PO4)3OH(S)
当我们以一种新的姿态来学习化学、应 用化学的时候,相信化学将会使我们的 生活变得更加美好!
工业废水
金属离子(如Mg2+、Fe2+、 Fe3+等)转化成沉淀
如何进一步处理工业上的废水?
在工业废水的处理过程中,常用FeS(s)、MnS(s)等难 溶物作为沉淀剂除去废水中的Cu2+、Hg2+、Pb2+等重 金属离子。
Ksp(FeS)=6.3×10-18mol2·L-2 Ksp(CuS)=1.3×10-36mol2·L-2 Ksp(HgS)=6.4×10-53mol2·L-2 Ksp(PbS)=3.4×10-28mol2·L-2
•8、教育技巧的全部诀窍就在于抓住儿童的这种上进心,这种道德上的自勉。要是儿童自己不求上进,不知自勉,任何教育者就都不 能在他的身上培养出好的品质。可是只有在集体和教师首先看到儿童优点的那些地方,儿童才会产生上进心。 2021/11/162021/11/162021/11/162021/11/16
AgCl I- AgI S2- Ag2S
思考:已知AgCl、AgI和Ag2S的Ksp分别为: 1.8×10-10、8.3×10-17、1.6×10-49,分析实验现象 产生的原因,归纳沉淀转化的方向。
三、沉淀的转化
沉淀转化的实质:沉淀溶解平衡的移动。
一般规律:对于组成类似(阴阳离子个数比相同)的难溶电解 质来说,溶解能力相对较强的物质易转化为溶解能力相对较 弱的物质,难溶物的溶解能力相差越大,这种转化的趋势越大。
溶解能力大的沉淀:
溶度积常数大的沉 淀
溶解能力小的沉淀: 溶度积常数小的沉淀
换上有龋齿的牙齿, 美女的她还能笑得 那么美吗?
我们的目标是 ——没有蛀牙!
糖吃多为什么会出现龋齿?如提何示预:糖防在?酶的作用下产 生了一种有机弱酸
生活常识:龋齿和含氟牙膏
(1)存在的溶解平衡
Ca5(PO4)3OH(S)
当我们以一种新的姿态来学习化学、应 用化学的时候,相信化学将会使我们的 生活变得更加美好!
工业废水
金属离子(如Mg2+、Fe2+、 Fe3+等)转化成沉淀
如何进一步处理工业上的废水?
在工业废水的处理过程中,常用FeS(s)、MnS(s)等难 溶物作为沉淀剂除去废水中的Cu2+、Hg2+、Pb2+等重 金属离子。
Ksp(FeS)=6.3×10-18mol2·L-2 Ksp(CuS)=1.3×10-36mol2·L-2 Ksp(HgS)=6.4×10-53mol2·L-2 Ksp(PbS)=3.4×10-28mol2·L-2
•8、教育技巧的全部诀窍就在于抓住儿童的这种上进心,这种道德上的自勉。要是儿童自己不求上进,不知自勉,任何教育者就都不 能在他的身上培养出好的品质。可是只有在集体和教师首先看到儿童优点的那些地方,儿童才会产生上进心。 2021/11/162021/11/162021/11/162021/11/16
高中化学 第三章 第3节沉淀溶解平衡精品课件 鲁科版选修4

第3节 沉淀溶解平衡
课程标准导航
1.了解沉淀溶解平衡的建立过程及特点。
2.理解溶度积的概念,能用溶度积规则判断 沉淀的产生和溶解。 3.能够运用平衡移动的观点对沉淀的溶解、 生成与转化进行分析,并能解释生活问题。
新知初探自学导引
自主学习
一、沉淀溶解平衡与溶度积
1.沉淀溶解平衡
离子 的沉积与固体的 ______ 溶解 达到 (1)概念:______ 平衡状态。
(3)意义:Ksp反映了难溶电解质在水中的 溶解 能力,当化学式所表示的组成中阴离 _____ 子与阳离子个数比相同时,Ksp数值越大,难 越强 。 溶电解质在水中的溶解能力_____ 性质 和 (4)影响因素:Ksp只与难溶电解质的_____ 温度 有关,与沉淀的量无关。 ______
3.影响沉淀溶解平衡的因素 (1)内因:难溶电解质本身的性质。 (2)外因
(2)表示方法:如PbI2的沉淀溶解平衡,可表 2+ - PbI (s) Pb (aq) + 2I (aq)。 2 示为_____________________________
2.溶度积 (1) 溶度积是指沉淀溶解平衡的 平衡常数 _________ , Ksp 。 符号为_____ mMn+(aq) n+]m[Am-]n [M m - +nA (aq)来说,Ksp=_______________。 (2)表示方法:对MmAn(s)
② MA2 型 (如 Mg(OH)2 等 ) M2 n+ + 2An- S 2S Ksp= [M2 n+ ][An- ]2= S(2S)2= 4S3 MA2
n- [A ] 3 Ksp 2 n+ S= [M ]= = 2 4
探究导引1 沉淀溶解平衡如何建立? 提示:和其他平衡一样,既可以正向建立, 也可以逆向建立。
课程标准导航
1.了解沉淀溶解平衡的建立过程及特点。
2.理解溶度积的概念,能用溶度积规则判断 沉淀的产生和溶解。 3.能够运用平衡移动的观点对沉淀的溶解、 生成与转化进行分析,并能解释生活问题。
新知初探自学导引
自主学习
一、沉淀溶解平衡与溶度积
1.沉淀溶解平衡
离子 的沉积与固体的 ______ 溶解 达到 (1)概念:______ 平衡状态。
(3)意义:Ksp反映了难溶电解质在水中的 溶解 能力,当化学式所表示的组成中阴离 _____ 子与阳离子个数比相同时,Ksp数值越大,难 越强 。 溶电解质在水中的溶解能力_____ 性质 和 (4)影响因素:Ksp只与难溶电解质的_____ 温度 有关,与沉淀的量无关。 ______
3.影响沉淀溶解平衡的因素 (1)内因:难溶电解质本身的性质。 (2)外因
(2)表示方法:如PbI2的沉淀溶解平衡,可表 2+ - PbI (s) Pb (aq) + 2I (aq)。 2 示为_____________________________
2.溶度积 (1) 溶度积是指沉淀溶解平衡的 平衡常数 _________ , Ksp 。 符号为_____ mMn+(aq) n+]m[Am-]n [M m - +nA (aq)来说,Ksp=_______________。 (2)表示方法:对MmAn(s)
② MA2 型 (如 Mg(OH)2 等 ) M2 n+ + 2An- S 2S Ksp= [M2 n+ ][An- ]2= S(2S)2= 4S3 MA2
n- [A ] 3 Ksp 2 n+ S= [M ]= = 2 4
探究导引1 沉淀溶解平衡如何建立? 提示:和其他平衡一样,既可以正向建立, 也可以逆向建立。
鲁科版高中化学选修4化学反应原理精品课件 3.3 第3节 沉淀溶解平衡

①分离离子:同一类型的难溶电解质,如 AgCl、AgBr、AgI,溶度积小的
2-
a 点以下的曲线上;B 项通过蒸发,水量减小,Ba2+和 SO4 浓度都增大,若达平
衡后,不可能由 d 点变到 c 点,应变到 c 点以下的曲线上;C 项 d 点还没有形
成饱和溶液,因此无 BaSO4 沉淀生成;D 项从图中看出温度相同,a 点与 c 点
的 Ksp 相等。
答案:C
首 页
探究一
X 新知导学 Z 重难探究
首 页
一
X 新知导学 Z 重难探究
INZHI DAOXUE
HONGNAN TANJIU
D 当堂检测
ANGTANG JIANCE
二
2.溶度积
(1)含义:
沉淀溶解平衡的平衡常数称为溶度积常数或溶度积,符号为 Ksp。
(2)表达式:
若难溶强电解质 AmBn 溶于水形成饱和溶液时,建立沉淀溶解平
衡:AmBn(s)
向该饱和溶液中分别加入固体 CH3COONa、NH4Cl 时,固体 Mg(OH)2
的质量有什么变化?
解析:可运用平衡移动原理加以解释。加入固体 CH3COONa 使
Mg(OH)2 固体的质量增加。理由是 CH3COONa 在溶液中水
解:CH3COO-+H2O
CH3COOH+OH-,增大了[OH-],使 Mg(OH)2 的沉淀溶
首 页
探究一
X 新知导学 Z 重难探究
INZHI DAOXUE
HONGNAN TANJIU
D 当堂检测
ANGTANG JIANCE
探究二
变式训练 1某温度时,BaSO
所示,下列说法正确的是(
4 在水中的沉淀溶解平衡曲线如下图
2-
a 点以下的曲线上;B 项通过蒸发,水量减小,Ba2+和 SO4 浓度都增大,若达平
衡后,不可能由 d 点变到 c 点,应变到 c 点以下的曲线上;C 项 d 点还没有形
成饱和溶液,因此无 BaSO4 沉淀生成;D 项从图中看出温度相同,a 点与 c 点
的 Ksp 相等。
答案:C
首 页
探究一
X 新知导学 Z 重难探究
首 页
一
X 新知导学 Z 重难探究
INZHI DAOXUE
HONGNAN TANJIU
D 当堂检测
ANGTANG JIANCE
二
2.溶度积
(1)含义:
沉淀溶解平衡的平衡常数称为溶度积常数或溶度积,符号为 Ksp。
(2)表达式:
若难溶强电解质 AmBn 溶于水形成饱和溶液时,建立沉淀溶解平
衡:AmBn(s)
向该饱和溶液中分别加入固体 CH3COONa、NH4Cl 时,固体 Mg(OH)2
的质量有什么变化?
解析:可运用平衡移动原理加以解释。加入固体 CH3COONa 使
Mg(OH)2 固体的质量增加。理由是 CH3COONa 在溶液中水
解:CH3COO-+H2O
CH3COOH+OH-,增大了[OH-],使 Mg(OH)2 的沉淀溶
首 页
探究一
X 新知导学 Z 重难探究
INZHI DAOXUE
HONGNAN TANJIU
D 当堂检测
ANGTANG JIANCE
探究二
变式训练 1某温度时,BaSO
所示,下列说法正确的是(
4 在水中的沉淀溶解平衡曲线如下图
鲁科版高中化学选修四课件:第3章-第3节《沉淀溶解平衡》ppt课件(共15张ppt)

栏 目 链 接
►变式训练 - 1. 将 AgCl 分别加入盛有: ①5 mL 水; ②6 mL 0.5 mol· L 1 NaCl 溶液; ③10 mL 0.2 mol· L -1 - + CaCl2 溶液;④50 mL 0.1 mol· L 1 盐酸的烧杯中,均有固体剩余,各溶液中[Ag ]从大到小 的顺序排列正确的是(C) A.④③②① B.②③④① C.①④③② D.①③②④
+ -
解析:(1)根据信息,当[Cu2 ]· [OH ]2=2×10
+ -
-20 -
mol3·L
-3
时开始出现沉淀,则[OH ]=
-
2×10
+
-20
mol3·L 3 = + [Cu2 ]
- -
2×10 20 mol3·L 3 - - =10 9 mol·L 1, -1 0.02 mol·L
-
栏 目 链 接
△ △
栏 目 链 接
而水垢中 Mg(OH)2 的形成可以用以下化学方程式或离子方程式来表示: Mg(HCO3)2=====MgCO3↓+H2O+CO2↑ MgCO3 Mg2 +CO2 3 - - 2- CO3 +H2O HCO3 +OH + - Mg2 +2OH Mg(OH)2↓ MgCO3 转化为 Mg(OH)2 的过程涉及盐的水解。 MgCO3 的溶解性大于 Mg(OH)2。
-18
栏 目 链 接
MnS 2.5×10
-13 + +
CuS 1.3×10
-36 +
PbS 3.4×10
-28
HgS 6.4×10
-53
ZnS 1.6×10
-24
某工业废水中含有 Cu2 、 Pb2 、 Hg2 ,最适宜向此工业废水中加入过量的 ________(选填序号)除去它们。 ①NaOH ②FeS ③Na2S
高中化学 3.3.2 沉淀溶解平衡的应用同步课件 鲁科版选修4

探究点二 沉淀的转化
第二页,共21页。
学习(xuéxí) 目标定位
1.能用平衡移动原理分析理解沉淀的溶解与生成、沉淀转化(zhuǎnhuà)的实质。 2.学会用沉淀溶解平衡的移动解决生产、生活中的实际问题。 学习(xuéxí) 沉淀的溶解与生成、沉淀转化的实质。 重难点:
第三页,共21页。
知识(zhī shi)回顾
是什么?
答案 原因是 BaCO3 能溶于胃酸(主要成分为盐酸),反应原理为
BaCO3(s)
Ba2+(aq)+CO23-(aq)
CO23-+2H+===CO2↑+H2O
可见,胃酸消耗 CO23-,使溶液中[CO32-]降低,从而使 BaCO3 的沉淀溶解平衡向右移动,
[Ba2+]增大引起人体重金属中毒。
(2)硬水煮沸形成的水垢主要成分是CaCO3和Mg(OH)2,它们是怎样形成的?
答案 水垢的形成过程涉及到沉淀转化,加热硬水时,Ca(HCO3)2、Mg(HCO3)2 分别分解生 成 CaCO3、MgCO3 沉淀。但 MgCO3 又与 CO32-水解生成的 OH-结合为更难溶的 Mg(OH)2,
故水垢的主要成分不是 CaCO3、MgCO3,而是 CaCO3、Mg(OH)2。 (3)锅炉形成的水垢中常含有 CaSO4,除去方法是 CaSO4(s)N―a―2C→O3CaCO3(s)―盐―酸→Ca2+(aq),
_用___水__洗__涤__使__B_a_S__O_4_的__溶__解__平___衡__向__正__反__应__方__向__移__动__,___造__成__B_a_S_O__4_的__损__失__;__而__用__H_。2SO4洗涤, H2SO4===2H++SO4 ,2-SO4 的2存- 在抑制了BaSO4的溶解,故BaSO4的损失量少
第二页,共21页。
学习(xuéxí) 目标定位
1.能用平衡移动原理分析理解沉淀的溶解与生成、沉淀转化(zhuǎnhuà)的实质。 2.学会用沉淀溶解平衡的移动解决生产、生活中的实际问题。 学习(xuéxí) 沉淀的溶解与生成、沉淀转化的实质。 重难点:
第三页,共21页。
知识(zhī shi)回顾
是什么?
答案 原因是 BaCO3 能溶于胃酸(主要成分为盐酸),反应原理为
BaCO3(s)
Ba2+(aq)+CO23-(aq)
CO23-+2H+===CO2↑+H2O
可见,胃酸消耗 CO23-,使溶液中[CO32-]降低,从而使 BaCO3 的沉淀溶解平衡向右移动,
[Ba2+]增大引起人体重金属中毒。
(2)硬水煮沸形成的水垢主要成分是CaCO3和Mg(OH)2,它们是怎样形成的?
答案 水垢的形成过程涉及到沉淀转化,加热硬水时,Ca(HCO3)2、Mg(HCO3)2 分别分解生 成 CaCO3、MgCO3 沉淀。但 MgCO3 又与 CO32-水解生成的 OH-结合为更难溶的 Mg(OH)2,
故水垢的主要成分不是 CaCO3、MgCO3,而是 CaCO3、Mg(OH)2。 (3)锅炉形成的水垢中常含有 CaSO4,除去方法是 CaSO4(s)N―a―2C→O3CaCO3(s)―盐―酸→Ca2+(aq),
_用___水__洗__涤__使__B_a_S__O_4_的__溶__解__平___衡__向__正__反__应__方__向__移__动__,___造__成__B_a_S_O__4_的__损__失__;__而__用__H_。2SO4洗涤, H2SO4===2H++SO4 ,2-SO4 的2存- 在抑制了BaSO4的溶解,故BaSO4的损失量少
优课系列高中化学鲁科版选修4 3.3沉淀溶解平衡 课件(共20张)

练习:写出FeS(s)与废水中的Cu2+、Hg2+、Pb2+的反应离子方程式。
FeS(s) + Cu2+(aq) = CuS(s) + Fe2+
FeS(s) + Hg2+(aq) = HgS(s) + Fe2+
FeS(s) + Pb2+(aq) = PbS(s) + Fe2+
学以致 用
BaSO4 BaCO3
科目:化 学 课题:第3章 物质在水溶液中的行为
第3节 沉淀溶解平衡
你知道吗?
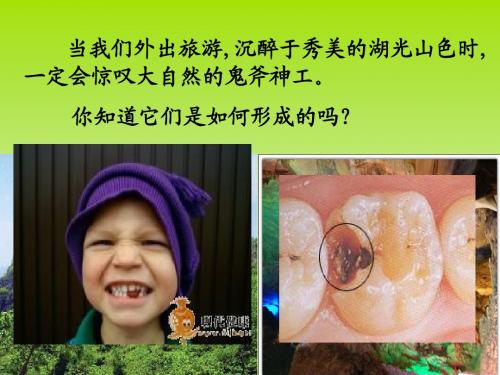
当我们外出旅游,沉醉于秀美的湖光山色时, 一定会惊叹大自然的鬼斧神工。
第3章 物质在水溶液中的行为
第3节 沉淀溶解平衡
1, 将AgNO3溶液与NaCl 溶液混合一定有沉淀析出吗?
如何判断沉淀的溶解和生
成呢?
练习:
将4×10-3mol/L的AgNO3溶液与 4×10-3mol/L的NaCl溶液等体积混合能否有 沉淀析出?Ksp(AgCl)= 1.8×10-10mol2/L2
实验内容
实验现象
相应的离子方程式或结 论
2mlZnSO4溶液 中滴加1mol.L-1 Na2S 向洗涤后的沉淀 中滴加 0.1mol.L-1
CuSO4溶液
产生白色 沉淀
Zn2+ + S2- = ZnS↓
沉淀转化为 黑色
ZnS(s)+Cu2+=CuS(s)+Zn2+
•1、所有高尚教育的课程表里都不能没有各种形式的跳舞:用脚跳舞,用思想跳舞,用言语跳舞,不用说,还需用笔跳舞。 •2、一切真理要由学生自己获得,或由他们重新发现,至少由他们重建。 •3、教育始于母亲膝下,孩童耳听一言一语,均影响其性格的形成。 •4、好的教师是让学生发现真理,而不只是传授知识。 •5、数学教学要“淡化形式,注重实质.
FeS(s) + Cu2+(aq) = CuS(s) + Fe2+
FeS(s) + Hg2+(aq) = HgS(s) + Fe2+
FeS(s) + Pb2+(aq) = PbS(s) + Fe2+
学以致 用
BaSO4 BaCO3
科目:化 学 课题:第3章 物质在水溶液中的行为
第3节 沉淀溶解平衡
你知道吗?
当我们外出旅游,沉醉于秀美的湖光山色时, 一定会惊叹大自然的鬼斧神工。
第3章 物质在水溶液中的行为
第3节 沉淀溶解平衡
1, 将AgNO3溶液与NaCl 溶液混合一定有沉淀析出吗?
如何判断沉淀的溶解和生
成呢?
练习:
将4×10-3mol/L的AgNO3溶液与 4×10-3mol/L的NaCl溶液等体积混合能否有 沉淀析出?Ksp(AgCl)= 1.8×10-10mol2/L2
实验内容
实验现象
相应的离子方程式或结 论
2mlZnSO4溶液 中滴加1mol.L-1 Na2S 向洗涤后的沉淀 中滴加 0.1mol.L-1
CuSO4溶液
产生白色 沉淀
Zn2+ + S2- = ZnS↓
沉淀转化为 黑色
ZnS(s)+Cu2+=CuS(s)+Zn2+
•1、所有高尚教育的课程表里都不能没有各种形式的跳舞:用脚跳舞,用思想跳舞,用言语跳舞,不用说,还需用笔跳舞。 •2、一切真理要由学生自己获得,或由他们重新发现,至少由他们重建。 •3、教育始于母亲膝下,孩童耳听一言一语,均影响其性格的形成。 •4、好的教师是让学生发现真理,而不只是传授知识。 •5、数学教学要“淡化形式,注重实质.
化学鲁科版选修4 3.3《沉淀溶解平衡》课件ppt
练一练
1、石灰乳中存在下列平衡: Ca(OH)2(s) Ca2+(aq)+2 OH― (aq), 加入下列溶液,可使Ca(OH)2减少的是( B A )
A.Na2CO3溶液 C.NaOH溶液 B.AlCl3溶液 D.CaCl2溶液
2、溶度积常数或溶度积(Ksp ): 概念: 难溶固体在溶液中达到沉淀溶解平衡状态时,
Na+ + Cl加入 浓盐酸
可溶的电解质溶液中 存在溶解平衡,难溶 的电解质在水中是否 也存在溶解平衡呢?
实验探究二
实验步骤:
1滴管 同浓度 NaCl 溶液 静置,待上层 液体变澄清
实验现象:
几滴 同浓度 NaCl 溶液 在上层清液中 滴加NaCl溶液 后,有白色沉 淀产生。
结论解释:
AgCl(s) Ag+(aq) + Cl-(aq)
2、牙齿表面由一层硬的、组成为Ca5(PO4)3OH 的物质保护着,它在唾液中存在下列平衡: Ca5(PO4)3OH(s) 5Ca2++3PO43-+OH- 进食后,细菌和 酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其 原因是 生成的有机酸能中和OH-,使平衡向 。 脱矿方向移动,加速腐蚀牙齿
当我们外出旅游,沉醉于秀美的湖光山色时, 一定会惊叹大自然的鬼斧神工。 你知道它们是如何形成的吗?
第3章 物质在水溶液中的行为
第3节 沉淀溶解平衡
一、了解难溶电 解质在水中的溶 解情况。 二、能运用平衡 移动原理分析、 解决沉淀的
溶解和生成的问 题。
三、正确理解和 掌握溶度积KSP 的概念和性质。
Mg(OH)2(s)
Ag+ + I-
Ksp= [Ag+][I-] = 8.3×10-17mol2L-2
高中化学 沉淀溶解平衡及应用课件 鲁科版选修4

等:V溶解=V析出≠0 定:外界条件一定,溶液中各粒子的
浓度保持不变
变:外界条件改变,溶解平衡发生移动。
10
练一练
1、下列有关AgCl的说法正确的是( D ) A. AgCl难溶于水,溶液中没有Ag+和Cl— B. 在AgCl饱和溶液中,AgCl没有再溶解了 C. AgCl是一种难溶物,所以是弱电解质 D.在AgCl饱和溶液中,AgCl生成和溶解不 断进行,但速率相等。
15
三、溶度积常数
❖ 1、定义: 用于描述难溶电解质在水中的沉淀
溶解平衡的平衡常数。
❖ 2、符号:Ksp ❖ 3、意义: 反映了难溶电解质在水中的溶解能
力;阴离子和阳离子个数比相同的物质, Ksp数值越大,难溶电解质在水中的溶 解能力越强。
16
常见难溶电解质的浓度积常数和溶解度(25℃)
难溶物
AgCl AgBr AgI BaSO4 Fe(OH)3 CaCO3
11
二、影响沉淀溶解平衡的条件
❖ 想一想:我们学过哪些因素能够影响化 学平衡,其中哪一些会对沉淀溶解平衡有影 响呢?
1.内因: 沉淀本身的性质
温度:温度升高,多数溶解平衡向
2.外因:
溶解方向移动。 稀释:向溶解方向移动
浓度:
加入相同的离子,向 同离子效应:生成沉淀的方向移动
12
大展身手
2.石灰乳中存在下列平衡:
7
❖ 3、在上述可逆反应中,我们把正反应的速率 (v正)看成AgCl的溶解过程,正反应速率 (v逆)看成Ag+和Cl-结合成AgCl的过程,那 么,请大家画出将AgCl固体投入水中后,v正 和v逆随时间的变化曲线。(独立完成后展示)
试通过这个图像和课本 上的内容,归纳总结出沉淀 溶解平衡的形成过程。
浓度保持不变
变:外界条件改变,溶解平衡发生移动。
10
练一练
1、下列有关AgCl的说法正确的是( D ) A. AgCl难溶于水,溶液中没有Ag+和Cl— B. 在AgCl饱和溶液中,AgCl没有再溶解了 C. AgCl是一种难溶物,所以是弱电解质 D.在AgCl饱和溶液中,AgCl生成和溶解不 断进行,但速率相等。
15
三、溶度积常数
❖ 1、定义: 用于描述难溶电解质在水中的沉淀
溶解平衡的平衡常数。
❖ 2、符号:Ksp ❖ 3、意义: 反映了难溶电解质在水中的溶解能
力;阴离子和阳离子个数比相同的物质, Ksp数值越大,难溶电解质在水中的溶 解能力越强。
16
常见难溶电解质的浓度积常数和溶解度(25℃)
难溶物
AgCl AgBr AgI BaSO4 Fe(OH)3 CaCO3
11
二、影响沉淀溶解平衡的条件
❖ 想一想:我们学过哪些因素能够影响化 学平衡,其中哪一些会对沉淀溶解平衡有影 响呢?
1.内因: 沉淀本身的性质
温度:温度升高,多数溶解平衡向
2.外因:
溶解方向移动。 稀释:向溶解方向移动
浓度:
加入相同的离子,向 同离子效应:生成沉淀的方向移动
12
大展身手
2.石灰乳中存在下列平衡:
7
❖ 3、在上述可逆反应中,我们把正反应的速率 (v正)看成AgCl的溶解过程,正反应速率 (v逆)看成Ag+和Cl-结合成AgCl的过程,那 么,请大家画出将AgCl固体投入水中后,v正 和v逆随时间的变化曲线。(独立完成后展示)
试通过这个图像和课本 上的内容,归纳总结出沉淀 溶解平衡的形成过程。
高中化学2沉淀溶解平衡的应用课件1鲁科高中选修4化学课件

溶解(róngjiě)平衡曲线如图所示。下列说
法正确的是( )
C A.加入Na2SO4可以使溶液由a点变 到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成 D.a点对应的Ksp大于c点对应的Ksp
12/11/2021
第十六页,共二十一页。
3.下列情况下,有无CaCO3沉淀生成?(Ksp(CaCO3)=2.8×10-9 mol2·L-2) (1)往1.0 L纯水中加入0.1 mL浓度(nóngdù)为0.01 mol·L-1的
[S2-]=[Zn2+]=
Ksp
=
12/11/2021
1.6×10-24 mol2·L-2
=1.26×10-12 mol·L-1
第十页,共二十一页。
ZnS沉淀溶解(róngjiě)平衡中:[S2-]=[Zn2+]= 1.26×10-12 mol·L-1
Q=c(Cu2+)·c(S2-) =1.0×10-3 mol·L-1×1.26×10-12 mol·L-1 =1.26×10-15 mol2•L-2
3
x=
Ksp
4
×10-4 mol·L-1
S=1x2/1·1/20211M0 =(1.12×10-4 × 5180)g =6.496×10-4 g
第十三页,共二十一页。
沉淀(chéndiàn)溶解平衡的应用
1.沉淀的生成与溶解
2.沉淀的转化
12/11/2021
第十四页,共二十一页。
1.在100 mL 0.01 mol·L-1 KCl溶液中,加入1 mL
[已知Ksp(Ag2CrO4)=9.0×10-12 mol3·L-3]
解析(jiě xī):等体积混合后, c2(Ag+)c(CrO42-)=[(4×10-3)/2]2×(4×10-3)/2 mol3·L-3 =8×10-9 mol3·L-3>9.0×10-12 mol3·L-3,所以析出Ag2CrO4沉淀。
法正确的是( )
C A.加入Na2SO4可以使溶液由a点变 到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成 D.a点对应的Ksp大于c点对应的Ksp
12/11/2021
第十六页,共二十一页。
3.下列情况下,有无CaCO3沉淀生成?(Ksp(CaCO3)=2.8×10-9 mol2·L-2) (1)往1.0 L纯水中加入0.1 mL浓度(nóngdù)为0.01 mol·L-1的
[S2-]=[Zn2+]=
Ksp
=
12/11/2021
1.6×10-24 mol2·L-2
=1.26×10-12 mol·L-1
第十页,共二十一页。
ZnS沉淀溶解(róngjiě)平衡中:[S2-]=[Zn2+]= 1.26×10-12 mol·L-1
Q=c(Cu2+)·c(S2-) =1.0×10-3 mol·L-1×1.26×10-12 mol·L-1 =1.26×10-15 mol2•L-2
3
x=
Ksp
4
×10-4 mol·L-1
S=1x2/1·1/20211M0 =(1.12×10-4 × 5180)g =6.496×10-4 g
第十三页,共二十一页。
沉淀(chéndiàn)溶解平衡的应用
1.沉淀的生成与溶解
2.沉淀的转化
12/11/2021
第十四页,共二十一页。
1.在100 mL 0.01 mol·L-1 KCl溶液中,加入1 mL
[已知Ksp(Ag2CrO4)=9.0×10-12 mol3·L-3]
解析(jiě xī):等体积混合后, c2(Ag+)c(CrO42-)=[(4×10-3)/2]2×(4×10-3)/2 mol3·L-3 =8×10-9 mol3·L-3>9.0×10-12 mol3·L-3,所以析出Ag2CrO4沉淀。
鲁科版高中化学选修四第三章第3节 沉淀溶解平衡第一课时公开课教学课件共24张PPT (共24张PPT)

B.沉淀溶解达到平衡时,沉淀的速率与溶解的速率 相等
C.沉淀溶解达到平衡时,溶液中离子的浓度相等且 保持不变
D.沉淀溶解达到平衡时,如果再加入该沉淀物,将 促进溶解
4、影响沉淀溶解平衡的因素
(1)内因 沉淀(难溶电解质)本身的性质
(2) a温度 升高温度,多数溶解平衡向溶解方向移动
外 因
b浓度
加水
生成的有机酸能中和OH-,使平衡向右移动,加速 . 腐蚀牙齿
本节小结
一、沉淀溶解平衡与溶度积
沉淀溶解平衡(与化学反应平衡、弱电解质电离平衡、 盐类的水解平衡一样)属于动态平衡,具有平衡的基本 特征,遵循平衡移动原理。
溶度积常数(与化学平衡常数、电离平衡常数、水的离 子积常数一样)只与物质本身的性质和温度有关。
练3习、4溶:度 请写积出的B影aS响O因4 素、 Al(OH)3 的沉淀溶解平衡式
与B溶a度SO(积14)(KKss)SpP表的达大B式小a2。+与+沉S淀O4本2- 身的Ks性p=质[B有a2关+][.SO42-] (2)Ksp 的大小外界条件只与温度有关,与沉淀的
A量l(O无H关)3.(离s)子浓A度l3的+ 改+ 变3O可H使- 平衡Ks发p=生[A移l3 动+ ][,O而H不-]能3 改
一昼夜后…观…察发现:不规则的固体变为规则的 立方体;质量并未发生改变
思考:
你能说出原因吗?
形状不规则
的NaCl固体
饱和
饱和
溶液中
NaCl v(结晶)=v(溶解)
溶液
形状规则
的NaCl固 体
NaCl(S)
Na+ + Cl-
平衡右移
加相同离子 平衡左移
C.沉淀溶解达到平衡时,溶液中离子的浓度相等且 保持不变
D.沉淀溶解达到平衡时,如果再加入该沉淀物,将 促进溶解
4、影响沉淀溶解平衡的因素
(1)内因 沉淀(难溶电解质)本身的性质
(2) a温度 升高温度,多数溶解平衡向溶解方向移动
外 因
b浓度
加水
生成的有机酸能中和OH-,使平衡向右移动,加速 . 腐蚀牙齿
本节小结
一、沉淀溶解平衡与溶度积
沉淀溶解平衡(与化学反应平衡、弱电解质电离平衡、 盐类的水解平衡一样)属于动态平衡,具有平衡的基本 特征,遵循平衡移动原理。
溶度积常数(与化学平衡常数、电离平衡常数、水的离 子积常数一样)只与物质本身的性质和温度有关。
练3习、4溶:度 请写积出的B影aS响O因4 素、 Al(OH)3 的沉淀溶解平衡式
与B溶a度SO(积14)(KKss)SpP表的达大B式小a2。+与+沉S淀O4本2- 身的Ks性p=质[B有a2关+][.SO42-] (2)Ksp 的大小外界条件只与温度有关,与沉淀的
A量l(O无H关)3.(离s)子浓A度l3的+ 改+ 变3O可H使- 平衡Ks发p=生[A移l3 动+ ][,O而H不-]能3 改
一昼夜后…观…察发现:不规则的固体变为规则的 立方体;质量并未发生改变
思考:
你能说出原因吗?
形状不规则
的NaCl固体
饱和
饱和
溶液中
NaCl v(结晶)=v(溶解)
溶液
形状规则
的NaCl固 体
NaCl(S)
Na+ + Cl-
平衡右移
加相同离子 平衡左移
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Ksp(CuS)=1.3×10-36mol2•L-2
Ksp(HgS)=6.4×10-53mol2•L-2
Ksp(PbS)=3.4×10-28mol2•L-2
练习:写出FeS(s)与废水中的Cu2+、Hg2+、Pb2+的反应离子方程 式。
FeS(s) + Cu2+(aq) = CuS(s) + Fe2+
型的难溶电解质的Ksp越小,越( 难溶 )。 Ksp数值大小与
( 难溶电解质的性质)和( 温度 )有关,与( 沉淀量 )无关。
-
1
第2课时 沉淀溶解平衡的应用
学习目标:
1、能结合典型实例,运用平衡移动的一般原理分析沉 淀的溶解、生成和转化过程。
2、知道沉淀转化的本质是沉淀溶解平衡的移动。 3、知道依靠沉淀溶解平衡的移动可以实现沉淀的转化。
FeS(s) + Hg2+(aq) = HgS(s) + Fe2+
FeS(s) + Pb2+(aq) = PbS(s) + Fe2+
-
10
课堂小结
1、沉淀的溶解与生成
(1).当 Q > Ksp时是过饱和溶液,离子生成沉淀即反应向生成沉淀方 向进行,直到平衡状态(饱和为止)。 (2).当 Q = Ksp时是饱和溶液,已达到沉淀溶解平衡状态。 (3).当 Q < Ksp时是不饱和溶液,沉淀溶解即反应向沉淀溶解的方向 进行,直到平衡状态(饱和为止)。
4
(2)沉淀的生成
思考:向PbI2的饱和溶液中滴加几滴KI溶液,又 会出现黄色沉淀,为什么?
PbI2(s)
Pb2+ + 2I-
滴加KI溶液,I-浓度增大, Q > Ksp,平衡
左移,生成沉淀。
-
5
思考: 用5%的Na2SO4溶液能否有效除去误食的Ba2+? 已知: Ksp(BaSO4)=1.1×10-10mol2•L-2 ,
(1)ZnS沉淀转化为CuS沉淀的定性解释
当向ZnS沉淀上滴加CuSO4溶液时, ZnS溶解产生的S2-与 CuSO4溶液中的Cu2+足以满足Q >Ksp(CuS)的条件, S2-与 Cu2+结合产生CuS沉淀并建立沉淀溶解平衡。 CuS沉淀的生成, 使得S2-的浓度降低,导致S2-与Zn2+的Q < Ksp(ZnS),使得ZnS 不断的溶解,结果是ZnS沉淀逐渐转化成为CuS沉淀。
为什么白色的ZnS沉淀会转化成为黑色的CuS沉淀?
-
7
ZnS在水中存在沉淀溶解平衡:
ZnS(s)
Zn2+(aq)+S2-(aq)
Ksp=1.6×10-24mol2•L-2
CuS在水中存在沉淀溶解平衡:
CuS(s)
Cu2+(aq)+S2-(aq)
Ksp=1.3×10-36mol2•L-2
ZnS与CuS是同类难溶物,Ksp(ZnS) >Ksp(CuS),CuS的溶解 度远小于ZnS的溶解度。
Q < Ksp,使BaCO3的沉淀溶解平衡向右移动,使体内的Ba2+
浓度增大而引起人体中毒。
BaCO3
Ba2+ + CO32-
而SO42-不与H+结合生成硫 +
酸,胃酸中的H+对BaSO4的 H+
溶解平衡没有影响,Ba2+浓
所以,不能用BaCO3作 为内服造影剂“钡餐”。
度保持在安全浓度标准下,
所以用BaSO4 作“钡餐”。CO2+H2O -
-
8
ZnS(s)
Zn2+(aq)
平衡向右移动
+ S2-(aq) + Cu2+(aq)
CuS(s) ZnS沉淀转化为CuS沉淀的总反应: ZnS(s) + Cu2+(aq) = CuS(s) + Zn2+
沉淀转化的实质:沉淀溶解平衡的移动。一种沉淀可转 化为更难溶的沉淀,难溶物的溶解度相差越大,这种转化的 趋势越大。
2、沉淀的转化
沉淀转化的实质:沉淀溶解平衡的移动。 一种沉淀可转化为更难溶的沉淀
-
11
-
12
; / 软文 mqw20jnp
第3节 沉淀溶解平衡
第2课时
复习提问: 1、请你描述PbI2固体的溶解平衡。
Pb2+和I-的沉淀速率
与PbI2固体的溶解速率 相等时达到平衡状态
2、写出PbI2的沉淀溶解方程式,并写出它的平衡常数表达式:
( PbI2(s)
Pb2+ + 2I- Ksp =[Pb2+][I-]2
)
3、 Ksp反映了难溶的电解质在水中的( 溶解能力 ),相同类
如:在AgCl(s)中加入NaI溶液可转化为AgI(s)沉淀。
在CaSO4(s)加入Na2CO3溶液可转化为CaCO3(s)沉淀。
-
9
利用沉淀转化原理,在工业废水的处理过程中,常用 FeS(s)、MnS(s)等难溶物作为沉淀剂除去废水中的Cu2+、Hg2+、 Pb2+等重金属离子。
Ksp(FeS)=6.3×10-18mol2•L-2
BaSO4 和BaCO3的沉淀溶解平衡分别为:
BaSO4
Ba2+ + SO42- Ksp=1.1×10-10mol2•L-2
BaCO3
Ba2+ + CO32- Ksp=5.1×10-9mol2•L-2
由于人体内胃酸的酸性较强(pH=0.9-1.5),如果服下BaCO3, 胃酸会与CO32-反应生成CO2和水,使CO32-离子浓度降低,使
-
2
二、沉淀溶解平衡的应用
1、沉淀的溶解与生成 (1)沉淀的溶解
写出BaCO3的沉淀溶解平衡方程式,讨论 向平衡体系中分别加盐酸和水,平衡向那 个方向移动,为什么?
离子的浓度商 Q< Ksp时是不饱和溶液,沉 淀溶解
-
3
思考:为什么医学上常用BaSO4作为内服造影剂“钡餐”,而不 用BaCO3作为内服造影剂“钡餐”?
5% 的Na2SO4溶液中的[SO42-]≈0.36mol/L
注意:当剩余离子即平衡离子浓度≤10-5mol/L时,认为 离子已沉淀完全或离子已有效除去。
解:,当 Q > Ksp时,离子才能生成沉淀。
[Ba2+]=(1.1×10-10mol2•L-2)/ (0.36mol/L)
=3.1×10-10mol•L-1
因为剩余的[Ba2+]< 10-5mol/L
所以有效除去了误食的Ba2+。
-
6Hale Waihona Puke 2.沉淀的转化观察•思考
(1).在1试管中加入ZnSO4溶液,再滴入Na2S溶 液,观察现象。
(2).静置后倾去上层清液,蒸馏水洗涤沉淀2-3次。 (3).向沉淀中滴加适量的CuSO4溶液,观察现象。
实验现象:有白色沉淀出现,白色沉淀转化成为黑色沉淀。
Ksp(HgS)=6.4×10-53mol2•L-2
Ksp(PbS)=3.4×10-28mol2•L-2
练习:写出FeS(s)与废水中的Cu2+、Hg2+、Pb2+的反应离子方程 式。
FeS(s) + Cu2+(aq) = CuS(s) + Fe2+
型的难溶电解质的Ksp越小,越( 难溶 )。 Ksp数值大小与
( 难溶电解质的性质)和( 温度 )有关,与( 沉淀量 )无关。
-
1
第2课时 沉淀溶解平衡的应用
学习目标:
1、能结合典型实例,运用平衡移动的一般原理分析沉 淀的溶解、生成和转化过程。
2、知道沉淀转化的本质是沉淀溶解平衡的移动。 3、知道依靠沉淀溶解平衡的移动可以实现沉淀的转化。
FeS(s) + Hg2+(aq) = HgS(s) + Fe2+
FeS(s) + Pb2+(aq) = PbS(s) + Fe2+
-
10
课堂小结
1、沉淀的溶解与生成
(1).当 Q > Ksp时是过饱和溶液,离子生成沉淀即反应向生成沉淀方 向进行,直到平衡状态(饱和为止)。 (2).当 Q = Ksp时是饱和溶液,已达到沉淀溶解平衡状态。 (3).当 Q < Ksp时是不饱和溶液,沉淀溶解即反应向沉淀溶解的方向 进行,直到平衡状态(饱和为止)。
4
(2)沉淀的生成
思考:向PbI2的饱和溶液中滴加几滴KI溶液,又 会出现黄色沉淀,为什么?
PbI2(s)
Pb2+ + 2I-
滴加KI溶液,I-浓度增大, Q > Ksp,平衡
左移,生成沉淀。
-
5
思考: 用5%的Na2SO4溶液能否有效除去误食的Ba2+? 已知: Ksp(BaSO4)=1.1×10-10mol2•L-2 ,
(1)ZnS沉淀转化为CuS沉淀的定性解释
当向ZnS沉淀上滴加CuSO4溶液时, ZnS溶解产生的S2-与 CuSO4溶液中的Cu2+足以满足Q >Ksp(CuS)的条件, S2-与 Cu2+结合产生CuS沉淀并建立沉淀溶解平衡。 CuS沉淀的生成, 使得S2-的浓度降低,导致S2-与Zn2+的Q < Ksp(ZnS),使得ZnS 不断的溶解,结果是ZnS沉淀逐渐转化成为CuS沉淀。
为什么白色的ZnS沉淀会转化成为黑色的CuS沉淀?
-
7
ZnS在水中存在沉淀溶解平衡:
ZnS(s)
Zn2+(aq)+S2-(aq)
Ksp=1.6×10-24mol2•L-2
CuS在水中存在沉淀溶解平衡:
CuS(s)
Cu2+(aq)+S2-(aq)
Ksp=1.3×10-36mol2•L-2
ZnS与CuS是同类难溶物,Ksp(ZnS) >Ksp(CuS),CuS的溶解 度远小于ZnS的溶解度。
Q < Ksp,使BaCO3的沉淀溶解平衡向右移动,使体内的Ba2+
浓度增大而引起人体中毒。
BaCO3
Ba2+ + CO32-
而SO42-不与H+结合生成硫 +
酸,胃酸中的H+对BaSO4的 H+
溶解平衡没有影响,Ba2+浓
所以,不能用BaCO3作 为内服造影剂“钡餐”。
度保持在安全浓度标准下,
所以用BaSO4 作“钡餐”。CO2+H2O -
-
8
ZnS(s)
Zn2+(aq)
平衡向右移动
+ S2-(aq) + Cu2+(aq)
CuS(s) ZnS沉淀转化为CuS沉淀的总反应: ZnS(s) + Cu2+(aq) = CuS(s) + Zn2+
沉淀转化的实质:沉淀溶解平衡的移动。一种沉淀可转 化为更难溶的沉淀,难溶物的溶解度相差越大,这种转化的 趋势越大。
2、沉淀的转化
沉淀转化的实质:沉淀溶解平衡的移动。 一种沉淀可转化为更难溶的沉淀
-
11
-
12
; / 软文 mqw20jnp
第3节 沉淀溶解平衡
第2课时
复习提问: 1、请你描述PbI2固体的溶解平衡。
Pb2+和I-的沉淀速率
与PbI2固体的溶解速率 相等时达到平衡状态
2、写出PbI2的沉淀溶解方程式,并写出它的平衡常数表达式:
( PbI2(s)
Pb2+ + 2I- Ksp =[Pb2+][I-]2
)
3、 Ksp反映了难溶的电解质在水中的( 溶解能力 ),相同类
如:在AgCl(s)中加入NaI溶液可转化为AgI(s)沉淀。
在CaSO4(s)加入Na2CO3溶液可转化为CaCO3(s)沉淀。
-
9
利用沉淀转化原理,在工业废水的处理过程中,常用 FeS(s)、MnS(s)等难溶物作为沉淀剂除去废水中的Cu2+、Hg2+、 Pb2+等重金属离子。
Ksp(FeS)=6.3×10-18mol2•L-2
BaSO4 和BaCO3的沉淀溶解平衡分别为:
BaSO4
Ba2+ + SO42- Ksp=1.1×10-10mol2•L-2
BaCO3
Ba2+ + CO32- Ksp=5.1×10-9mol2•L-2
由于人体内胃酸的酸性较强(pH=0.9-1.5),如果服下BaCO3, 胃酸会与CO32-反应生成CO2和水,使CO32-离子浓度降低,使
-
2
二、沉淀溶解平衡的应用
1、沉淀的溶解与生成 (1)沉淀的溶解
写出BaCO3的沉淀溶解平衡方程式,讨论 向平衡体系中分别加盐酸和水,平衡向那 个方向移动,为什么?
离子的浓度商 Q< Ksp时是不饱和溶液,沉 淀溶解
-
3
思考:为什么医学上常用BaSO4作为内服造影剂“钡餐”,而不 用BaCO3作为内服造影剂“钡餐”?
5% 的Na2SO4溶液中的[SO42-]≈0.36mol/L
注意:当剩余离子即平衡离子浓度≤10-5mol/L时,认为 离子已沉淀完全或离子已有效除去。
解:,当 Q > Ksp时,离子才能生成沉淀。
[Ba2+]=(1.1×10-10mol2•L-2)/ (0.36mol/L)
=3.1×10-10mol•L-1
因为剩余的[Ba2+]< 10-5mol/L
所以有效除去了误食的Ba2+。
-
6Hale Waihona Puke 2.沉淀的转化观察•思考
(1).在1试管中加入ZnSO4溶液,再滴入Na2S溶 液,观察现象。
(2).静置后倾去上层清液,蒸馏水洗涤沉淀2-3次。 (3).向沉淀中滴加适量的CuSO4溶液,观察现象。
实验现象:有白色沉淀出现,白色沉淀转化成为黑色沉淀。
