ppt 关于博奥定量RT-PCR
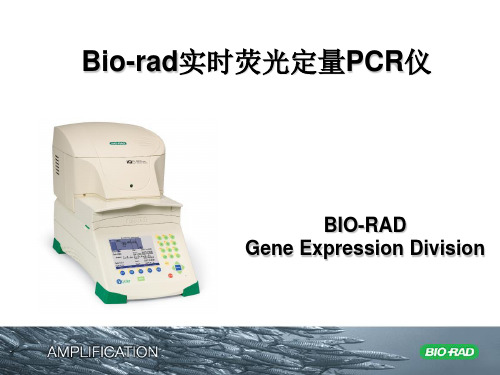
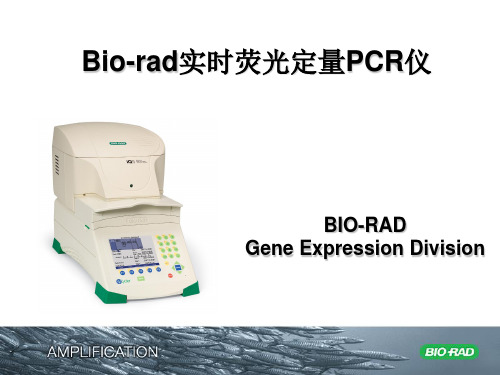
2019年-BioRad定量PCR说明书-PPT精选文档
定量PCR仪应该具备的特点: 先进的光路设计----多孔样品同时检测
Fluorescence Detection
Emission Filtter
Light Source
Multiplexing----同时检测5色荧光
•无法对扩增反应实时检测
PCR: Theory vs. Reality
• C(t)s from 96 replicates are nearly identical, but the final fluorescence varies.
End Point
Cycle
Real-Time PCR
实时定量PCR技术,是指在PCR反应体系中 加入荧光基团,利用荧光信号积累实时监测整个 PCR进程,使每一个循环变得“可见”,最后通 过Ct值和标准曲线对样品中的未知样品 的起始浓 度进行定量的方法。
采用多点温控和传 感技术,可以实现 梯度PCR功能
温度梯度选择可以 允许使用者在同一 次扩增中优化复性 温度。
定量PCR仪应该具备的特点: 消耗品成本低,样品容量大
同时扩增和检测96个样品
采用0.2ml的离心管, 排管和 96 孔PCR反应板。 降低消耗品成 本。
Introduction to Quantitative PCR
Reality vs. Theory
Amplification is exponential, but the exponential increase is limited:
A linear increase follows exponential
Eventually plateaus
Theoretical
定量PCR技术35页PPT

36、如果我们国家的法律中只有某种 神灵, 而不是 殚精竭 虑将神 灵揉进 宪法, 总体上 来说, 法律就 会更好 。—— 马克·吐 温 37、纲纪废弃之日,便是暴政兴起之 时。— —威·皮 物特
38、若是没有公众舆论的支持,法律 是丝毫 没有力 量的。 ——菲 力普斯 39、一个判例造出另一个判例,它们 迅速累 聚,进 而变成 法律。 ——朱 尼厄斯
55、 为 中 华 之 崛起而 读书。 ——周 恩来
40、人类法律,事物有规律,这是不 容忽视 的。于困约 ,而败 于奢靡 。——陆 游 52、 生 命 不 等 于是呼 吸,生 命是活 动。——卢 梭
53、 伟 大 的 事 业,需 要决心 ,能力 ,组织 和责任 感。 ——易 卜 生 54、 唯 书 籍 不 朽。——乔 特
RTPCR(共47张PPT)

实时荧光定量PCR 原理 -------Ct值
Ct值的定义:
PCR扩增过程中,扩增产物的荧光信号达到设定的阈值时所经 过的扩增循环次数
C(t) value
纵轴:荧光信号量
实时荧光定量PCR 原理 -------Ct值的重现性
横轴:PCR反映循环数
Ct值的特点:
EXON 1 EXON 1
INTRON 2 EXON 2
EXON 2
DNA RNA
PRIMER PREMIER 5.0
上机操作
点击
运行程序
保存
结果分析
难以查找原因。
• Buffer and dNTPs Ex:扩增效率
实时荧光定量PCR定义
• Template
cDNA
Real-time PCR
Real-time PCR
引物设计
• 总原则与普通PCR相同 –避免引物二聚体,避免二级结构 • 尽量小些 (70 - 300bp) • 目标区段位置:考虑目标剪接体 • 推荐做跨intron设计
实时荧光定量PCR法
染料法举例
SYBR Green法研究CDK6 在
肺癌组织标本中的表达差异
实验步骤
流程示意图
TaqMan法举例
材料准备
从正常肺组织中提取的总 RNA 从肺癌组织中提取的 总RNA
-Trizol 最常用 -裂解液 (氰酸胍,异硫氰酸呱, SDS) -液氮
-RNA保存液
小心DNA污染! -使用DEPC处理相关器材
TaqMan法
优缺点
25
实时荧光定量PCR原理 相对定量
以各自样本中内参(housekeeping)基因为标杆,
RTPCR实验报告课件

逆转录pcrrt-pcr)和及时为反转录rcr ( reverse transcription pcrpcr ( real time pcr)共同的缩写。
逆转录pcr ,或许称反转录pcr(reversetranscription-pcr, rt-pcr) ,是聚合酶链式反响 (pcr) 中,一条 rna 链被逆转录成为互补 dna ,再以此为模板经过的一种宽泛应用的变形。
在pcr 进行dna 扩增。
rt-pcr由一条rna 单链转录为互补dna(cdna) 称作“逆转录” ,由依靠rna 的dna 聚合酶(逆转录酶)来达成。
随后,dna 的另一条链经过脱氧核苷酸引物和依靠rna 的dna 聚合酶达成,随每个循环倍增,即往常的pcr 。
原来的rt-pcr的指数扩增是一种很敏捷的技术,于遗传病的诊疗,并且能够用于定量监测某种rna 模板被rna 酶 h 降解,留下互补dna 。
能够检测很低拷贝数的rna 。
rt-pcr宽泛应用rna的含量。
(检测基因表达的方法,拜见northern blot 法。
)rt-pcr 作“ 定量有时也会指代及时pcr ” (quantitative pcr)pcr(real-time pcr)。
为了与逆转录或许rtq-pcr(real-time quantitative pcr)pcr 相差别,往常被写。
及时pcr及时为基础进行pcr(real-time pcr)dna 的定量剖析。
,属于定量pcrreal time pcr( q-pcr)的一种,以一准时间内dna 的增幅量的定量使用萤光色素,当前有二种方法。
一种是在ds dna 中插入特异的萤光色素;另一种使用一种能与增幅dna 序列中特定寡核酸序列相联合的一种萤光探针(probe )。
real time pcr 与reverse transcription pcr 相联合,能用微量的rna 来找出特准时间、细胞、组织内的特别表达的遗传基因。
Bio-Rad定量PCR说明书.ppt
Introduction to Quantitative PCR
PCR仪 + 监测、分析系统 + 荧光标记
定量PCR仪应该具备的特点:杰出的温度控制
• 采用半导体加热和制冷 • 加热速度 3.3°C /秒 ,制冷速度
2°C/秒 • 升降温速度可调 • 控温准确性:±0.3℃
定量PCR仪应该具备的特点:梯度PCR功能
采用多点温控和传 感技术,可以实现 梯度PCR功能
温度梯度选择可以 允许使用者在同一 次扩增中优化复性 温度。
定量PCR仪应该具备的特点: 消耗品成本低,样品容量大
同时扩增和检测96个样品
采用0.2ml的离心管, 排管和 96 孔PCR反应板。 降低消耗品成 本。
Introduction to Quantitative PCR
•无法对扩增反应实时检测
PCR: Theory vs. Reality
• C(t)s from 96 replicates are nearly identical, but the final fluorescence varies.
End Point
Cycle
Real-Time PCR
实时定量PCR技术,是指在PCR反应体系中 加入荧光基团,利用荧光信号积累实时监测整个 PCR进程,使每一个循环变得“可见”,最后通 过Ct值和标准曲线对样品中的未知样品 的起始浓 度进行定量的方法。
Quantitative PCR /Real time PCR
▪ Quantitative PCR 或 Real time PCR 是确定样品中DNA (或 cDNA) 拷贝 数最敏感、最准确的方法
PCR: Theory vs Reality
《RTPCR技术原理》课件

RTPCR是一种常用的遗传学分析技术,通过在实验室中模拟自然界的PCR过 程,扩增DNA片段,从而实现对基因的分析和研究。
RTPCR技术原理
什么是RTPCR技术
RTPCR技术是一种基于PCR扩增原理开发而来的遗传学分析方法,可以高效地复制和研究 DNA序列。
RTPCR技术的优点
RTPCR技术具有高灵敏度、高特异性、高通量和快速等优点,成为现代分子生物学研究中 不可或缺的工具。
RTPCR技术利用PCR反应中的循环式 扩增机制,快速复制目标DNA序列, 从而使其在检测中能够得到可靠的结 果。
RTPCR技术原理
RTPCR技术的应用领 域
RTPCR技术在医学领域被 广泛应用于疾病诊断、遗 传性疾病筛查、药物研发 等方面。
RTPCR在食品安全领 域的应用
RTPCR技术可以用于检测 食品中的致病菌、转基因 成分、有害物质等,保障 食品安全。
RTPCR技术原理
1
RTPCR反应体系组成
2
RTPCR反应体系包括RNA、逆转录酶、
引物、酶、核酸酶和缓冲液等多种组
分,以保证反应的高效、特异性和稳
3
Байду номын сангаас
定性。
RTPCR流程介绍
RTPCR技术包括反转录和PCR两个基 本步骤,通过这两个步骤可以将RNA 转录为cDNA并扩增目标DNA序列。
RTPCR放大机制
2 RTPCR技术的发展趋势
RTPCR技术将更加智能化、快速化、低成本化,实现更高效的基因分析和诊断。
3 RTPCR技术的未来应用简述
RTPCR技术有望在个性化医疗、精准农业和环境污染治理等领域得到更广泛的应用。
RTPCR技术原理
定量RT-PCR原理 PPT课件

非竞争性RT-PCR
目前主要采用荧光实时RT-PCR, 放射性标记核苷酸的方法已基本淘汰。
实时RT-PCR
实时RT-PCR就是在PCR扩增的每一个循 环后分别检测其PCR产量,借助计算机数据 处理,可以描绘出PCR扩增循环过程中PCR产 物变化曲线。
主要内容
1. Taqman探针原理 2. CT值和阈值的确定 3. ROX内参比荧光的作用 4. IPC内对照的作用
退火,开始延伸
Forward 5’Primer
3’
5’
TaqMan®
R Probe Q
5’
3’ 5’
Reverse Primer
替换
Forward
R
5’Primer
3’
5’
Q
5’
未知样品 标准品:产生标准曲线
内参比(Internal Standard)-ROX 校正样品管和加样误差
内对照(Internal Control): 校正扩增效率的误差
+/-对照:检验试剂和仪器的可靠性 6次重复:满足统计学要求
多色荧光技术
准确的荧光定量要求ROX校正和IPC校正 检材和对照最好在同一反应管中,误差最小 多重检测要求仪器有多种荧光检测能力 只有ABI的仪器才具有四色检测能力:
William P. Halford:
是否只有竞争性RT-PCR才能精确定量?
竞争性RT-PCR
PCR的终产物量取决于靶序列与竞争性 序列量的起始比例。
理想情况下,靶序列与参照物以相同 的效率扩增,在琼脂糖凝胶电泳中区别开 。
竞争性RT-PCR
参照物片段分两类: - 同源性片段——与靶序列只有微小差 别
《RTPCR技术原理》课件

缺点
对操作人员要求较高
RTPCR技术的操作较为复杂,需要经过专 业培训的操作人员才能保证结果的准确性
。
成本较高
RTPCR技术需要昂贵的仪器和试剂 ,导致检测成本较高,可能限制其
在资源有限地区的普及。
A
B
C
D
可能出现交叉污染
在操作过程中,如果样品或试剂受到污染 ,可能会导致交叉污染,影响检测结果的 准确性。
《rtpcr技术原理》ppt课 件
目录 CONTENT
• RTPCR技术概述 • RTPCR技术原理 • RTPCR实验操作流程 • RTPCR技术的优缺点 • RTPCR技术的应用实例
01
RTPCR技术概述
RTPCR技术定义
实时荧光定量PCR(Real-Time PCR)是一种在PCR反应过程中,通过荧光信号 检测DNA片段的扩增情况,并实时监测其变化的技术。
2000年
ABI公司推出高分辨率熔解曲线分析 技术,提高了SNP分型和突变检测的 准确性。
2004年
基于焦磷酸测序原理的实时荧光定量 PCR技术问世,提高了检测通量和灵 敏度。
RTPCR技术的应用领域
基因表达分析
突变检测
通过比较不同组织或不同处理条件下基因 的表达水平,研究基因的表达调控机制。
用于检测DNA序列中的点突变、插入和缺 失等变异,用于遗传病、肿瘤等疾病的诊 断和监测。
基因突变检测
总结词
RTPCR技术能够高效地检测基因突变,为遗传性疾病的诊断和治疗提供依据。
详细描述
基因突变是许多遗传性疾病的诱因,RTPCR技术通过对特定基因的扩增和荧光 检测,能够快速、准确地检测出基因突变位点及类型。这有助于遗传性疾病的 早期诊断和针对性治疗,为患者提供更好的医疗方案。
PCR技术简介-PPT课件

2 ul
4 ul 2 ul 0.4ul 0.4ul 0.4ul 3.8ul 1 ul 1 ul 5 ul
RT-PCR反应体系
两步法RT-PCR
Components
Volume(µ l)
Components
RNA 5xR.T.buffer dNTPs(10mmol/L)
Primer Rnasin(50U/µ l) AMV-RT((10U/µ l)
目的基因的克隆 基因的体外突变 生成大量DNA以进行序列测定 特异基因表达量分析
PCR反应体系
20ul;25ul;50ul
10× PCR Buffer Mg2+ dNTPs 引物1 引物2 模板 Taq酶 ddH2O
浓度
1.5mmol/L 200umol/L
10pmol 10pmol 0.1~2ug
PCR实验准备--仪器、耗材
PCR仪 移液器 吸头 200ul PCR管 反应程序
94
温
度 72
(℃)
55
22
1
2
3
高温变性 低温退火 适温延伸
DNA 2
形 成
条变
子链延伸
单性
DNA加倍
链
DNA单链
与引物复性
DNA双螺旋
1
2
3
4
时间(min)
重复1~3步 25~30轮 目的DNA片段 扩增100万倍以上
Mg2+ Mg2+是DNA聚合酶的激活剂 1.5mmol/L-2.5mmol/L反应体系(通 常4 l/50 l ) Mg2+浓度过低会使Taq酶活性丧失、 PCR产量下降; Mg2+过高影响反应特 异性
PCR实验准备—试剂
RTPCR常见问题分析ppt课件

精选版课件ppt
26
问题五:信号高于预期,在低 于预期的循环中即可检出产物?
1、 反应中加的样品太多:降低模板的浓度。 2、 模板或PCR残余污染:隔离污染来源,更换试
剂,使用专用的精致移液器。在无DNA区域准备 反应,使用抗气溶胶的吸头。
精选版课件ppt
27
问题六:电泳后出现意外的条带 RNA?
精选版课件ppt
19
1.引物和模版 的非特异性 退火
对策
1.避免引物3’端含有2 个到3个dG或dC’
2.在第一链合成中使用 基因特异性引物,而 不是随即引物或 oligo(dT)。
3.在开始几个循环使用 较高的退火温度,然 后使用较低的退火温 度。
4.使用热启动Taq DNA 酶进行PCR,提高反 应的特异性。
火的GSP;对于>1kb的RT-
PCR产物,保持反应温 度≤65℃。不要在高于 37℃时使用M-MLV;如 果不需要全长cDNA, 在第一链反应中使用
随机引物;
精选版课件ppt
13
7.引物或模板 对残余的RNA 模板敏感
8.靶序列在分 析的组织中不 表达
9.PCR没有起 作用
在PCR前用RNaseH处理。
30
问题九: 扩增产物滞留在加样 孔中
有可能是由于模板量过高而导致PCR结果产生了 高分子量的DNA胶状物。建议将第一链结果至少 稀释100倍再进行二次扩增。
另外,在二次PCR时使用的退火温度如果比引物 的Tm值低5℃,可以将退火温度适当增高或进行 热启动以提高特异性
精选版课件ppt
31
Thank You!
精选版课件ppt
32
精选版课件ppt
33
实时荧光定量PCR(qPCR,RT-PCR)的原理及应用ppt课件

在细胞中的表达量或在基因组中的拷贝数恒定, 受环境因素影响小 内标定量结果代表了样本中所含细胞或基因组数 量
15
RT-PCR技术的数据分析
PCR分四个阶段
16
RT-PCR技术的数据分析如何定量?-ΔΔCt
实时荧光定量PCR技术 的原理及应用
(Real Time Quantitative PCR)
2013-11-26
1
实时荧光定量PCR目录 Contents
一、实时荧光定量PCR的定义 二、RT-PCR技术的原理及试验流程 三、RT-PCR技术的数据分析
四、RT-PCR技术的应用
2
实时荧光定量PCR的定义
RT-PCR技术的数据分析
21
RT-PCR技术的数据分析
相对定量分析方法 -ΔΔCt
前提:目标序列和内参序列的扩增效率接近100% 且偏差在 5%以内 1、用目标基因的CT值减内参基因的CT值:
ΔCT(test)= CT (target, test) - CT (ref, test) ΔCT(control)= CT (target, control) - CT (ref, control)
2、用试验样本的ΔCT值减校准样本的ΔCT值:
ΔΔCT= ΔCT(test/control) - ΔCT(calibrator)
3、计算表达水平比率: 相对表达量RQ= 2 –ΔΔCT
22
RT-PCR技术的数据分析
SYBR Green 熔解曲线分析
23
RT-PCR技术的应用
• 临床疾病诊断:各型肝炎、艾滋病、禽流感等传染病诊断 和疗效评价;肿瘤标志物及瘤基因检测实现肿瘤病诊断; 遗传基因检测实现遗传病诊断。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
确认看家基因起峰的cycle数目不超过2
对照中的看家基因
处理中的看家基因
处理中的靶基因 对照中的靶基因
观点和认识:在设计RT-PCR引物的时候,是跨内含子的,能够根据 PCR产物的大小知道是否有基因组DNA的污染,因此没有必要把抽提 的RNA进行基因组DNA消化。 由于假基因的存在,用基因组DNA为模板进行PCR扩增时,一些常见 的看家基因常有不包含内含子的片段被扩增出来,因此上策还是先进 行基因组DNA的消化,并确认此消化是成功的。
过表达基因
空白对照
可能的原因1:基因组DNA的消化 客户若是通过RT-PCR检测此基因是否表达,可能没有 消化基因组DNA,导致RT-PCR的假阳性。
mRNA
过表达基因
空白对照
可能的原因2:芯片没有检测到此过表达基因的检测 在设计芯片上的探针时,探针的序列往往靠近mRNA的 3’端,理由是?
mRNA 过表达基因
我们的分析过程: 1、客户进行分析的RNA和芯片的RNA是同一份RNA吗?若是来自 生物独立实验的RNA,基因表达完全有可能不吻合; 2、若是同一份RNA,则看客户的qRT-PCR过程 a 看客户是否有确认基因组DNA的消化步骤; b 看客户选择的看家基因在比较的样品中cycle数相差多 少?建议不能超过1.5个cycle。 c 需要看客户验证了几个基因,1、2个基因难以说明问 题,芯片和定量RT-PCR的吻合性有80%就是不错的结果。
microRNA qRT-PCRR实 验中,采用一对引物; 而miRNA qRT-PCR的 RT引物比较特殊,是茎 环结构的引物。
qRT-PCR和半定量RT-PCR的不同
定量RT-PCR
1
400 bp100 bp-
2
3
N C
4
5
6
7
N C
8
N C
-Thy-1
qRT-PCR检测具体流程:实例 qRT-PCR实验流程:
Total RNA 电泳质检
质量良好
消化基因组 DNA,纯化RNA PCR确认消化效果 RNA逆转录 qPCR 数据处理 PCR扩增 终产物电泳
定量RT-PCR和芯片方法对RNA的不同要求
质量好的 RNA样品 应该如此
qRT-PCR客户抱怨例子1:
Nature Biotechnology, 2006, September
qRT-PCR定量检测的技术重复
某些qRT-PCR实验,没有技术重复。实际上,严谨的qRT-PCR实验设计 是需要技术重复的。比如一次实验,用qRT-PCR方法检测对照和处理两 个样品某基因表达是否发生了变化,3次技术重复可能得到以下数据:
1Kb左右设计探针
Poly(A)+ mRNA 5’
完整RNA
ORF UTR
3’ AAAAA…
Untranslaiton region
Promoter
若正好芯片的探针设计在3’UTR区,则检测不到此外源导入基因的 表达情况,而检测到的信号是细胞内源基因的表达情况。
客户抱怨例子3: 在我们这里进行完芯片实验后,回去进行定量或者半定 量RT-PCR验证,发现芯片结果和PCR验证结果不吻合。
Extron Intron Extron Gnomic DNA 表达
mRNA
反转录 Extron,假基因 Gnomic DNA
qRT-PCR不是万能的
在有些情况下qRT-PCR的检测结果是不足为据的,例如MAQC项目中 的检测结果是不足为据的,例如 对qRT-PCR检测结果设定的标准:当进入对数的循环数大于35个循 PCR 环时,检测无效,认为基因没有表达;当进入对数的循环数在3235个循环时,需要有至少3个重复才能判断是否能检测到基因的表 达。
博奥生物公司关于基因qRT-PCR的过程
博奥生物有限公司 生物芯片北京国家工程研究中心
qRT-PCR定量检测原理
常用的qRT-PCR技术大致可以分为2类:一类是以SYBR 类:一类是以 Green为代表的非特异性荧光标记;另一类TaqMan为代 表的特异性荧光标记。
非特异性荧光标记:
1、 SYBR Green
特异性荧光标记:
2、TaqMan
SYBR Green法工作机理
SYBR Green能结合到双链DNA的小沟部位,只有当SYBR Green和双链DNA结合后才发荧光。 当DNA变性时,DNA双链解螺旋,无荧光信号;当DNA复 性和延伸时,形成双链DNA结构,SYBR Green插入DNA 而发荧光,因此必须在复性阶段采集荧光信号。
一客户把组织收获后,直接把组织冻在-80度,自己想 做RT-PCR的时候就取一点组织提取RNA,做RT-PCR 效果都不错,想扩增的基因都能得到扩增。 后来想做芯片分析,就把组织样品送给我们,我们抽提 后发现组织RNA降解,说不能用于芯片分析了。客户 抱怨说,怎么我用来做RT-PCR效果没问题,送到博奥 就不能用了呢?
M N C N C
N C N C N C
半定量RT-PCR
-β-actin
qRT-PCR的具体流程:
总RNA抽提 确认基因 组DNA彻 底被消化
RNA甲醛变性胶检测
基因组DNA消化
以PolyA或 者特异引物 进行反转录 通过看家基 因归一化得 到靶基因的 变化趋势
确认不变的 看家基因
对测试基因进 行PCR扩增
定量RT-PCR
当有多个基因的定量RT-PCR结果,需要和芯片结果作一个相关 性散点图分析,就可以利用定量RT-PCR得到的变化倍数和芯片 结果的倍数作一个散点图进行相关系数R计算。数据引自 Patterson. T.A., et al, Nature Biotechnology, 2006, 24:1140-1151
22.5
重复次数 第一次反应 第二次反应 第三次反应 平均值
1 对照样品CP值 2 处理样品CP值 18.3 19.3 18.5 18.7 21.2 20.9 20.0 20.7
21.5 20.5 19.5 18.5 17.5 16.5 15.5 14.5 1
P=0.0133
2
实际CP值相差2倍,这个基因在处理样品中高表达,相差接近4倍。 若只进行一次qRT-PCR ,由于数据分布的随机性,有可能得到19.3和 20.0这2个数据,那样就可能得不到高表达的结论。
原因:降解RNA和完整RNA的引物差别
Poly(A)+ mRNA 5’
sense
完整RNA
3’ AAAAA… TTTTT...T7 Promoter
Poly(A)+ mRNA 5’
sense
有降解发生RNA
3’ AAAAA…
特异引物进行反转录
客户抱怨例子2:
一客户是进行基因功能研究,把某个基因在细胞中过表达。确认 这个基因表达后的细胞和对照细胞进行表达谱检测分析,但芯片 并没有检测到此基因的高表达,是为什么?
当验证的基因数目不多时,可以用柱状图来展示两种方法的吻 合度。尽管此图是比较Northern和芯片的结果,定量RT-PCR和 芯片的结果的比较可以类似体现。若芯片结果和定量RT-PCR都 有重复实验,则柱状图上可以加上误差线,科学性更强。数据 引自Amibon公司的TechNotes。
芯 片 结 果
与目标序列互补
每扩增一条DNA分子,释放一 个荧光信号,可以在环过程 中任一点检测荧光。
SYBR Green和TaqMan探针技术比较
SYBR Green方法检测的特异性由正向和反向的一对引 物决定,容易受到非特异性扩增影响。但该方法通用 性好,检测成本比较低。 TaqMan探针技术检测的特应性不仅由扩增引物决定, 还由TaqMan探针决定,因而对非特异性扩增的区分能 力更好。但TaqMan探针合成非常昂贵,一条探针都要 在千元以上,限制了其应用。 这两种检测方法都一般都需要每个检测进行3次技术重 复。 对于验证芯片结果,一般认为SYBR Green方法检测已 经可以满足要求。
定量RT-PCR:绝对定量法
另外,在文献上,可以看见一些报道作定量RT-PCR方 法先把基因的模板按照不同稀释度先作标准曲线,然后 按照标准曲线来确定基因的丰度,这种做法需要的反应 数非常多。 而利用所检测基因相对所选择的看家基因丰度来作就相 对简单,而对于验证芯片结果的可靠性是足够的,因此 这种做法也见于大量文献中。我们多选择相对看家基因 丰度的方法来作定量RT-PCR。
因此,在没有技术重复时,由于检测本身的波动性就可能导 致错误结论。
基 因 相 对 于 看 家 基 因 的 表 达 倍 数
0.8 0.7 0.6 0.5 0.4 0.3 0.2 0.1 0
X/Actin
P=0.000022
X
样本: C1 C2 C3 C4 C5 1
T1 T2 T3 T4 T5 2
在文章中写作,可以以柱状图的方式体现,例如朱玉贤 老师06年发表在plant cell上的定量RT-PCR数据格式;这 种体现方式适合定量RT-PCR数目不是很多,让人一眼就 感觉此定量RT-PCR结果是非常可靠的。
SYBR Green
TaqMan探针的工作原理
TaqMan探针:
TaqMan探针:5′端标记有报 告基团(Reporter, R) ,如 FAM、VIC等 ;3′端标记有 荧光淬灭基团 (Quencher, Q) 若探针完整,R所发射的荧光 能量被Q基团吸收 ,无荧 光;若R与Q分开,发荧光。 Taw酶有 5′→3′外切核酸 酶活性,可水解探针,释放R 产生荧光信号。
