高三考前冲刺—化学实验流程真题训练
2020届高三考前冲刺工艺流程题专项训练(含答案)

(6)从废旧碱性锌锰电池中可以回收利用的物质有 _____________________(写两种)。 7.亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、 印染和食品工业.它在碱性环境中稳定存在。某同学查阅资料后 设计生产 NaClO2 主要流程如下:
(1)Ⅰ中发生反应的还原剂是___________,气体 a 的名称是 ___________ (2) Ⅱ 中 反 应 的 离 子 方 程 式 是 _________________________________________ (3)A 的化学式是___________ (4)Ⅲ中电极 X 是___________,(填“阴极”“阳极”),其上 发生的电极反应为 ____________________________。离子交换膜 N 是____(填“阴” “阳”)离子交换膜。(5)ClO2 是一种高效水处理剂,可用亚氯 酸钠和稀盐酸为原料制备: 5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O,该反应中氧化剂和还原剂
(1)反应①的尾气可以再利用,写出应用该尾气制得的两种重 要化学试剂:____________。(2)如果在实验室模拟操作 1 和 操作 2,则需要使用的主要玻璃仪器有:_______________。 (3)钼在空气中灼烧生成三氧化钼,三氧化钼溶于氢氧化钠溶 液生成钼酸钠;三氧化钼不溶于盐酸或稀硫酸。钼酸钠的化学式 为_______________。 (4)工业上制备还原性气体 CO 和 H 2 的反应原理为 CO 2+CH 42CO +2H 2,CH 4+H 2O CO +3H 2。含甲烷体积分数为 80%的 a L(标准状况)天然气与足 量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为 90%,用产生的还原性气体(CO 和 H 2)还原 MoO 3 制钼,理论上 能生产钼的质量为____________。 5.二氟磷酸锂(LiPO 2F 2)作为电解液添加剂能够有效提升锂电 池的循环性能。在氮气气氛下,在 PFA(全氟烷氧基树脂)烧瓶中 加入高纯 LiPF 6 和 Li 2CO 3 固体,以碳酸二甲酯作溶剂制备 LiPO 2F 2,其流程如下:
高三考前冲刺化学实验流程真题训练

实用精锐教育学科教师辅导讲义讲义编号:_文档.实用文档.实用氯化钙结晶水合物熔原理:储热材料的特点点低、无毒循环、原理利用率高、绿色化学理念无毒无害排放原理:氧化铁、氧化铝与盐酸的反应原理:pH值调节除杂方法:氢氧化铁中除去氢氧化铝2006蛇纹石制取碱式碳酸镁绿色化学理念:循环使用重量法基本操作碱式碳酸镁成分重量法的定量计算【归纳】化学实验流程常考考点:1、对流程原理的分析:原料、各步骤的反应原理和现象、滤液与沉淀的成分、杂质的判断、pH 值调节。
2、元素化合物知识:铝、铁及其化合物,硝酸、硫酸,氯和硫及其化合物。
2、化学实验技能:离子检验、除杂的方法(物理方法和化学方法)、滴定基本操作、重量法基本操作、溶液的配制操作。
3、离子方程式的书写4、定量计算:滴定(容量法)的定量计算、重量法的定量计算、误差计算二、典型例题[2011上海高考] 27.CuSO·5HO是铜的重要化合物,有着广泛的应用。
以下是CuSO·5HO的实验室制备2244流程图。
文档.实用文档.实用文档.实用摇动锥形瓶,全凭个人生理习惯。
(3)读数方法:滴定管上标有棕色刻度线,观察背景是白底蓝线,由于光在空气、水中折射率不同,蓝线在液面下变粗,观察时旋转滴定管使蓝线处于一直线,蓝线的粗细交界点所对应的刻度即是准确读数(如图所示)。
3、常考调节pH值的目的(1)中和作用,除去H、OH、HCO、CO等杂质。
2--+-33(2)抑制水解(3)选择性沉淀,如Fe和Cu完全沉淀的溶液pH值要求不同。
2+3+(4)促进平衡的移动四、真题训练[2010上海高考]27.工业生产纯碱的工艺流程示意图如下:完成下列填空:1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A B2)实验室提纯粗盐的实验操作依次为:取样、、沉淀、、、冷却结晶、、烘干。
3)工业生产纯碱工艺流程中,碳酸化时产生的现象是。
碳酸化时没有析出碳酸钠晶体,其原因是。
化学实验 高三化学一轮复习 《化学实验》专题训练(Word版 含答案)

高三化学一轮复习化学实验专题专题训练(综合实验)1、(2020年北京人大附5月份)草酸是一种常用的还原剂,某校高三化学小组探究草酸被氧化的速率问题。
(1)H2C2O4是二元弱酸,写出H2C2O4溶于水的电离方程式:__________________________。
(2)实验Ⅰ试管a中KMnO4最终被还原为Mn2+,该反应的离子方程式为:__________________。
(3)瑛瑛和超超查阅资料,实验Ⅰ试管c中H2C2O4与K2Cr2O7溶液反应需数月时间才能完成,但加入MnO2可促进H2C2O4与K2Cr2O7的反应。
依据此资料,吉吉和昊昊设计如下实验证实了这一点。
实实验Ⅳ的目的是:______________________________________________________。
(4)睿睿和萌萌对实验II继续进行探究,发现溶液中Cr2O72-浓度变化如图:臧臧和蔡蔡认为此变化是通过两个过程实现的。
过程i。
MnO2与H2C2O4反应生成了Mn2+。
过程ii。
______________________________________________。
①查阅资料:溶液中Mn2+能被PbO2氧化为MnO4-。
针对过程i,可采用如下方法证实:将0.0001 mol MnO2加入到6 mL______中,固体完全溶解;从中取出少量溶液,加入过量PbO2固体,充分反应后静置,观察到__________________________________________。
②波波和姝姝设计实验方案证实了过程ii成立,她们的实验方案是_________________________________________________________________。
(5)综合以上实验可知,草酸发生氧化反应的速率与__________________________有关。
解析及答案(1)H2C2O4是二元弱酸,分步电离,用“⇌”连接,所以H2C2O4溶于水的电离方程式为H2C2O4⇌HC2O4-+H+,HC2O4-⇌C2O42-+H+,故答案为:H2C2O4⇌HC2O4-+H+,HC2O4-⇌C2O42-+H+;(2)酸性条件下,MnO4-和H2C2O4反应生成Mn2+和CO2,反应的离子方程式为5H2C2O4+6H++2MnO4-=10CO2↑+2Mn2++8H2O,故答案为:5H2C2O4+6H++2MnO4-=10CO2↑+2Mn2++8H2O;(3)MnO2中Mn的化合价为+4,既有氧化性,又有还原性,可能被K2Cr2O7氧化;H2C2O4具有还原性,能被K2Cr2O7氧化,所以实验Ⅳ是对比实验,目的是排除实验II中MnO2直接还原重铬酸钾的可能性,故答案为:排除实验II中MnO2直接还原重铬酸钾的可能性;(4)由图象可知,2min之前反应缓慢,随着反应进行,反应物浓度降低,反应速率应该降低,但2min后反应速率陡增,在温度变化不大时,说明生成物加快了反应速率,即生成的Mn2+可加快草酸与重铬酸钾的反应,故答案为:Mn2+可加快草酸与重铬酸钾的反应;①实验II中起始时总溶液6ml、c(H2C2O4)==0.1 mol/L、MnO20.0001mol,所以进行对比实验时,将0.0001mol MnO2加入到6mL0.1 mol/L H2C2O4溶液(调至pH=2),根据加入过量PbO2固体,溶液呈紫色以证实Mn2+的存在,故答案为:0.1 mol/L H2C2O4溶液(调至pH=2);上清液为紫色;②证明Mn2+有催化作用,可在H2C2O4和K2Cr2O7浓度不变的条件下,加入与实验IIMnO2等物质的量的可溶性MnSO4,观察6min后溶液变色情况,即方案为:将2mL、0.3mol/LH2C2O4溶液与4mL0.01 mol/LK2Cr2O7溶液混合,调至pH=2,加入0.0001molMnSO4固体,观察6min后溶液颜色变化,故答案为:将2mL、0.3mol/LH2C2O4溶液与4mL0.01 mol/LK2Cr2O7溶液混合,调至pH=2,加入0.0001molMnSO4固体,6min后溶液橙色变浅;(5)根据实验I可知,草酸发生氧化反应的速率与氧化剂种类、溶液酸碱性有关,根据实验II、IV可知草酸发生氧化反应的速率与是否有催化剂有关,所以草酸发生氧化反应的速率与氧化剂种类、溶液酸碱性、是否有催化剂等有关,故答案为:氧化剂种类、溶液pH、是否有催化剂。
高三化学化学实验操作习题集

高三化学化学实验操作习题集一、酸碱中和实验操作题1.1 题目:计算酸碱溶液的浓度实验步骤:1. 取一定体积的酸和一定体积的碱溶液,各自记录初始体积。
2. 将酸和碱溶液分别倒入两个烧杯中。
3. 将烧杯放在白色瓷板上,用滴定管滴加酸碱指示剂。
4. 用滴定管滴加氧化苏丹指示剂,当颜色变为橙色时停滴。
5. 记录滴定过程中酸和碱溶液的体积变化。
实验要求:1. 计算酸和碱溶液的浓度,并填写实验报告。
2. 分析数据,计算反应的摩尔比例和配比。
二、氧化还原反应实验操作题2.1 题目:观察金属氧化反应实验步骤:1. 准备一段钝的铁丝和一些粗砂纸。
2. 将铁丝用砂纸清洁干净,去除表面的锈蚀物。
3. 将铁丝放在烧杯里,加热。
4. 观察铁丝在加热过程中的变化,记录下观察结果。
1. 根据观察结果,判断金属氧化过程中发生的反应类型。
2. 回答观察结果的原因,并解释反应过程中发生的氧化还原反应。
三、电解实验操作题3.1 题目:观察电解铜(II)硫酸溶液实验步骤:1. 准备一个电解槽和两个电极(分别为碳条和铜条)。
2. 将铜(II)硫酸溶液倒入电解槽中。
3. 将铜条连接到电源的正极,碳条连接到电源的负极。
4. 随着电流通入,观察电解槽内的变化。
实验要求:1. 描述电解过程中观察到的现象和变化。
2. 解释电解过程中铜离子的还原和氧化反应。
四、水的分解实验操作题4.1 题目:观察水的电解实验步骤:1. 准备一个电解槽和两个电极(分别为铂电极和铝电极)。
2. 将蒸馏水倒入电解槽中。
3. 将铂电极连接到电源的正极,铝电极连接到电源的负极。
4. 随着电流通入,观察电解槽内的变化。
1. 描述电解过程中观察到的现象和变化。
2. 解释水的分解反应过程以及产生氢气和氧气的原理。
以上是高三化学化学实验操作习题集,希望对你的学习有所帮助。
请按照实验要求进行实验,并填写实验报告。
祝你学业顺利!。
高考化学真题实验题

高考化学真题实验题
一、铜的氧化物实验
实验步骤:
1. 取少量的铜粉放入试管中;
2. 用长颈漏斗倒入足量的浓硫酸,使铜粉完全覆盖;
3. 加热试管,观察观察试管内的反应过程;
4. 将试管放凉后,挥发出的气体通入蓝色的凝固的烧杯中,观察现象,做出适当推断。
实验现象:热硫酸与铜粉反应,生成红褐色气体,并密集红褐色气体随时间增多。
通入蓝色烧杯中,呈现明显的黄色变化。
实验推断:实验原料为铜粉、浓硫酸,观察到产生气体,根据化学反应的规律可推断实验中生成了二氧化硫气体。
通入蓝色烧杯中,观察到蓝色凝固物变为黄色,可能是生成了硫酸铜。
二、氯气实验
实验步骤:
1. 将试管中加入适量氯化钠,然后滴加几滴亚硝酸钠溶液;
2. 混合液体后滴加几滴硫酸;
3. 用玻璃棒搅拌,加热试管;
4. 用玻璃棒沾过无水乙醇,在加热的烧杯内产生物质,迅速把烧杯反射到试管中。
实验现象:加热试管,管口产生白色气体,受到反射造成它们的整体高度上升;取一点过无水乙醇后,燃烧物滴至产生气泡,放在液体的表面上进行燃烧。
实验推断:反应生成氯气与二氧化氮气体混合,再加热分解产生氮气和二氧化氮分支,燃烧后的火焰内燃三氧化氮。
以上是高考化学真题实验题的实验内容,希望同学们认真复习实验操作流程,做好充分准备。
祝愿大家高分通过。
新高考化学考前冲刺卷(一) 学生版

B.电池每吸收22.4LCO2,电路中转移4mole−
C.放电时,外电路中电流由MWCNTs-COOH经酯基电解质流向KSn合金
D.为了更好的吸收温室气体CO2,可用适当浓度的KOH溶液代替酯基电解质
15.25℃时,在10mL 0.1mol·L−1Na2CO3溶液中逐滴加入0.1mol·L−1HCl溶液20mL,溶液中含碳微粒的物质的量随溶液pH的变化如图所示。下列说法错误的是
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H 1 C 12 N 14 O 16Na 23S 32 Cl 35.5V 51 Fe 56Cu 64
一、选择题:每小题2分,共20分。每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与人类生产、生活、社会可持续发展密切相关。下列说法正确的是
A.Na2C2O4溶液中C2O 数目为0.1NA
B.稀硫酸中水电离的c(H+)=10−13mol/L
C.KMnO4溶液浓度为0.1mol/L
D.反应过程中转移电子数为0.2NA
12.最近研究表明,用Sb(CH3)3、Sb(CH3)2Br和Sb(CH3)Br2三种化合物进行重组反应可生成空间位阻最小的离子化合物——[Sb2(CH3)5]2[Sb2(CH3)2Br6]。已知锑(Sb)与砷(As)同主族,下列说法错误的是
A.加酶洗衣粉是洗衣粉中的新产品,从化学反应速率的角度分析,使用温度越高的水洗涤衣服,其去污效果会越好
B.“红烧鱼”是一道常见的四川家常菜,做“红烧鱼”时通常要加入料酒和醋,其最主要的目的是调味,让鱼的味道更加酸辣可口
C.阿司匹林是生活中常见的消炎药,服用阿司匹林出现水杨酸反应时,可用NaHCO3溶液解毒
化学(新高考)2022届高考考前冲刺卷(一)教师版

(新高考)2022届高考考前冲刺卷化学(一)注意事项:1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B 铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。
写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
第Ⅰ卷(选择题)一、选择题:本题共15小题,总计40分。
在每小题给出的四个选项中,第1~10题只有一个选项符合题目要求,每小题2分。
第11~15题为不定项选择题,每小题4分,在每个小题给出的四个选项中,有1~2个是符合题目要求的,全部答对的得4分,选对但不全的得2分,有选错的得0分。
1.2021年9月17日13时30分许,神舟十二号载人飞船安全降落在东风着陆场预定区域,大国重器奔向太空,化学作为一门传统的理科,在神舟12号的研制过程中,同样不可缺少。
下列说法不正确的是A .航空航天工业中应用广泛的化学镀镍,电镀时镀件作阴极,镍作阳极B .使用的热控材料是新型保温材料——纳米气凝胶,纳米气凝胶具有丁达尔效应C .卫星抛物面天线采用的具有负膨胀系数的石墨纤维和芳纶,石墨纤维属于新型无机非金属材料,芳纶是有机高分子材料D .火箭的推进器引燃后的高温气体成分有CO 2、H 2O 、N 2、NO 等,在卫星发射现场看到火箭喷射出大量的红烟,产生红烟的原因是高温下氮气遇到氧气直接反应生成二氧化氮 【答案】D【解析】火箭的推进器引燃后的高温气体成分有CO 2、H 2O 、N 2、NO 等,在卫星发射现场看到火箭喷射出大量的红烟,产生红烟的原因是高温下NO 遇到氧气直接反应生成二氧化氮,故D 错误;答案选D 。
2.实验是化学研究的基础。
下列关于各实验装置的叙述正确的是A .装置①常用于分离互不相溶的液体混合物B .装置②可用于吸收NH 3或HCl 气体,并防止倒吸C .装置③可用于收集H 2、CO 2、Cl 2、NH 3等气体D .装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢 【答案】C【解析】A .装置①是蒸馏装置,常用于分离沸点相差较大且互溶的液体,分离互不相溶的液体常用分液法,故A 错误;B .装置②用于吸收NH 3或HCl 气体时,不能将NH 3或HCl 气体直接通入水中,否则会倒吸,应将苯换成四氯化碳并将导管通入四氯化碳中,故B 错误;C .装置③用于收集H 2、CO 2、Cl 2、NH 3等气体时,这些气体和空气都不反应,同时可以根据密度的情况,导管分别采用长进短出或短进长出的方法,故C 正确;D .装置④中干燥管内装的是碱石灰,可以和HCl 气体反应,故不能用于收集HCl 气体,故D 错误;故答案选C 。
2023届高考化学一轮复习以流程为载体的实验 专项练习(word版含解析)

以流程为载体的实验 专项练习1.常用作杀虫剂、媒染剂,某小组在实验室以铜为主要原料合成该物质的路线如图所示:已知:①()3424Cu NH SO H O⎡⎤⋅⎣⎦为绛蓝色晶体,在溶液中存在以下电离(解离)过程:()()2234234244Cu NH SO H O Cu NH SO H O+-⎡⎤⎡⎤⋅++⎣⎦⎣⎦、()22334Cu NH Cu 4NH ++⎡⎤+⎣⎦。
②()442NH SO 和()3424Cu NH SO H O ⎡⎤⋅⎣⎦在水中均可溶,在乙醇中均难溶。
若向()344Cu NH SO ⎡⎤⎣⎦溶液中加入乙醇,会析出()3424Cu NH SO H O⎡⎤⋅⎣⎦晶体。
请回答下列问题:(1)方案1的实验步骤为蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
该方案存在一定缺陷,因为根据该方案得到的产物晶体中往往含有_____(填化学式)杂质,其原因是__________(从平衡移动的角度回答)。
(2)方案2的实验步骤为向()344Cu NH SO ⎡⎤⎣⎦溶液中加入适量_____(填试剂名称),过滤、洗涤、干燥。
(3)方案1、2中步骤均有过滤、洗涤、干燥。
①过滤的主要目的是将固液混合物进行分离。
中学化学中常见的固液混合物分离的操作有“倾析法”“普通过滤法”和“减压过滤法”等,操作示意图如下:减压过滤法相对于普通过滤法的优点为_________(填序号,下同)。
A.过滤速度相对较快 B.能过滤胶体类混合物 C.得到的固体物质相对比较干燥②下列最适合在“洗涤”步骤中作为洗涤液的是______。
A.蒸馏水B.乙醇与水的混合液C.饱和()442NH SO 溶液2.环己烯是重要的化工原料。
其实验室制备流程如下:回答下列问题: Ⅰ.环己烯的制备与提纯(1)原料环己醇中若含苯酚杂质,检验试剂为________,现象为________。
(2)操作1的装置如图所示(加热和夹持装置已略去)。
①烧瓶A 中进行的可逆反应化学方程式为________,浓硫酸也可作该反应的催化剂,选择32FeCl 6H O ⋅而不用浓硫酸的原因为________(填序号)。
2020届高三化学考前冲刺必刷卷一

D。 g与b可化合生成离子化合物
【答案】C
【解析】
【分析】
氮元素的化合价与其形成物质类别的关系如图所示,a为—3价的盐,则a中含有N3-;b为-3价氢化物,则b为NH3;c为单质,则c为N2;d为+2价氧化物,则d为NO;e为+3价盐,则e为亚硝酸盐;f为+4价氧化物,则f为NO2或N2O4;g为+5价的酸,则g为HNO3,据此结合元素化合物性质解答.
【答案】D
【解析】
【详解】A.明矾不具有杀菌消毒的作用,但可净水只起到除去悬浮物的作用,故A错误;
B.碳酸钠碱性较强,不用于治疗胃酸过多,通常用氢氧化铝和碳酸氢钠,故B错误;
C.C60属于单质,不是化合物,不属于新型无机非金属材料,故C错误;
D.“紫青烟”为钾元素的焰色反应现象,故D正确;
答案选D。
A.根据上述分析,第一次剩余固体中可能含有铁,则A错误;
B.根据分析,第二次剩余固体与第一次加入硝酸的结论一致,一定含有铜,故B正确;
C.根据分析,有固体剩余,说明所得溶液中一定不存在Fe3+,故C正确;
D.根据分析,最后所得混合溶液中可能含有Cu2+,故D正确;
答案选A。
10。下列实验仪器的选择错误的是( )
B.反应中浓硫酸被还原为二氧化硫,则Na234S中硫元素被氧化为34S单质,故B错误;
C.在5NH4NO3═2HNO3+4N2+9H2O的反应中,15N由−3价升高为0价,化合价升高3价,被氧化,进入氮气中,氮元素由硝酸根中+5价降低为0价,化合价降低5价,被还原,根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等可知,发生氧化反应的氮原子与发生还原反应的氮原子的个数之比是5:3,所以15N由−3价升高为0价,全部被氧化进入氮气中,没有氮元素进入HNO3中,故C错误;
2024届高三化学三轮复习++实验大题专项训练卷

实验制备大题1. 己二酸是合成尼龙66的主要原料之一,在塑料和化工行业中有广泛的用途。
通过浓硝酸氧化环己醇制备己二酸,其反应原理简示(未配平)、有关数据、装置示意图(夹持装置已省略)如下:OH浓HNO3O浓HNO370~90℃COOHCOOH+NO2↑+H2O名称相对分子质量熔点/℃沸点/℃密度/(g•mL-1)溶解性环己醇100 25.2 161 0.96 溶于水,易溶于乙醇己二酸146 151 265 1.36 溶于水,热水中溶解度更大,易溶于乙醇步骤一:在三颈烧瓶中加入25 mL水、10 mL浓硝酸,慢慢开启磁力搅拌装置,将溶液混合,并用水浴加热至80 ℃回流。
步骤二:从恒压滴液漏斗中小心逐滴滴加环己醇4.2 mL,水浴温度维持在85~90 ℃,必要时可往水浴中添加冷水。
步骤三:环己醇滴加完毕后,继续反应30分钟。
将三颈烧瓶脱离水浴稍冷,观察到反应液浑浊并出现白色沉淀,再将烧瓶置于冰水浴中冷却20分钟,抽滤,用冷水洗涤烧瓶和滤饼,后将粗品置于85 ℃烘箱鼓风干燥,称重得产品4.2 g。
回答下列问题:(1) 仪器A的名称是____________;仪器B的名称是________________。
(2) 反应开始后,A中的现象是_______________________________;烧杯中发生反应的化学方程式为__________________________________________。
(3) 球形冷凝管的作用是_________________________。
(4)“步骤三”中,再将烧瓶置于冰水浴20分钟的目的是_____________。
(5) 本实验中己二酸的产率约为_________(保留2位有效数字)。
(6) 若要得到纯度更高的己二酸,可通过_____________的方法提纯。
2.(15分)苯乙酮用于制香皂和香烟,也用作纤维素酯和树脂等的溶剂和塑料。
工业生产中的增塑剂,是一种重要的化工原料,可由苯与乙酸酐经下述反应制备:CH3COOH+AlCl3→CH3COOAlCl2+HCl↑相关物质的部分物理性质名称熔点/°C 沸点/°C 密度/g·mL-1溶解度乙酸酐-73 140 1.082 与水反应(生成乙酸)苯 5.5 80.5 0.879 不溶于水苯乙酮20.5 202 1.028 微溶于水实验步骤如下:步骤1:向图所示的仪器A中迅速加入13g粉状无水AlCl3和16mL(14g,0.18mol)无水苯。
近五年经典高考化学实验流程题

高考化学实验题专项精选1、(08全国)醇与氢卤酸反应是制备卤代烃的重要方法。
实验室制备溴乙烷和1-溴丁烷的反应如下:NaBr+H2SO4===HBr+NaHSO4①R-OH+HBr R-Br+H 2O ②—有关数据表如下;请回答下列问题:(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是。
(填字母)a.圆底烧瓶b.量筒c.锥形瓶d.布氏漏斗(2)溴代烃的水溶性(填“大于”、“等于”或“小于”);其原因是。
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在___(填“上层”、“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必需进行稀释,起目的是。
(填字母)a.减少副产物烯和醚的生成b.减少Br2的生成c.减少HBr的挥发d.水是反应的催化剂(5)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是。
(填字母)a.NaI b.NaOH c.NaHSO3d.KCl(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是。
3.(上海高考题)某实验小组用下列装置进行乙醇催化氧化的实验。
⑴实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式、。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是反应。
⑵甲和乙两个水浴作用不相同。
甲的作用是___;乙的作用是__ 。
⑶反应进行一段时间后,干燥管a中能收集到不同的物质,它们是。
集气瓶中收集到的气体的主要成分是。
⑷若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有。
要除去该物质,可现在混合液中加入(填写字母)。
a.氯化钠溶液b.苯c.碳酸氢钠溶液d.四氯化碳然后,再通过(填试验操作名称)即可除去。
4. (上海高考) 明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。
具体实验步骤如下图所示:根据上述图示,完成下列天空:⑴明矾石焙烧后用稀氨水浸出。
高考前化学实验专题讲练
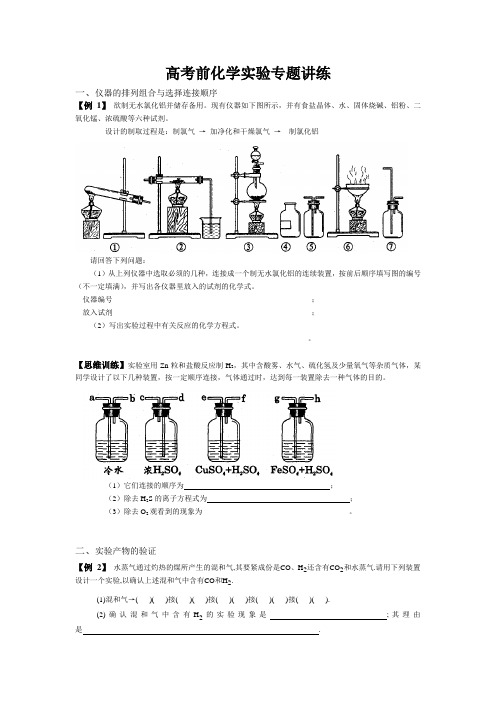
高考前化学实验专题讲练一、仪器的排列组合与选择连接顺序【例1】欲制无水氯化铝并储存备用。
现有仪器如下图所示,并有食盐晶体、水、固体烧碱、铝粉、二氧化锰、浓硫酸等六种试剂。
设计的制取过程是:制氯气→加净化和干燥氯气→制氯化铝请回答下列问题:(1)从上列仪器中选取必须的几种,连接成一个制无水氯化铝的连续装置,按前后顺序填写图的编号(不一定填满),并写出各仪器里放入的试剂的化学式。
仪器编号___________________________________________________;放入试剂___________________________________________________;(2)写出实验过程中有关反应的化学方程式。
__________________________________________________________________________________________。
【思维训练】实验室用Zn粒和盐酸反应制H2,其中含酸雾、水气、硫化氢及少量氧气等杂质气体,某同学设计了以下几种装置,按一定顺序连接,气体通过时,达到每一装置除去一种气体的目的。
(1)它们连接的顺序为;(2)除去H2S的离子方程式为;(3)除去O2观看到的现象为_______________________________________。
二、实验产物的验证【例2】水蒸气通过灼热的煤所产生的混和气,其要紧成份是CO、H2还含有CO2和水蒸气.请用下列装置设计一个实验,以确认上述混和气中含有CO和H2.(1)混和气→( )( )接( )( )接( )( )接( )( )接( )( ).(2)确认混和气中含有H2的实验现象是;其理由是.三、气密性检查和防倒吸【例3】某学生设计一个自动过滤装置,在一般过滤装置的漏斗上安装一个自动加液装置(左图)。
使用时,滤液可不能溢出,过滤又较快,整个过程无须人照管。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
精锐教育学科教师辅导讲义讲义编号:_
根据题意完成下列填空:
稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象:________________。
)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4·5H2O中可能存在的杂质是________ ________。
完成下列填空:
1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A B
2)实验室提纯粗盐的实验操作依次为:
加石灰水前先要加热,原因是
相对误差为[2008
)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要等原料
)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:
)过滤Ⅰ操作所得固体中,除CaCO3外还含有(填化学式)等物质,该固体可用作生产水
阅读上述实验流程,完成下列填空:
加酸溶解应该选用装置(选填a、b、c)。
)在实验操作(Ⅱ),如果用自来水代替蒸馏水进行洗涤,将会发生化学反。
)实验操作(Ⅳ)所需玻璃仪器为(填写三种)。
)实验操作(Ⅶ)从AgNO3溶液获得AgNO3晶体需要进行的实验操作依次为:(多选扣分)。
精锐教育网站: 11 依据上述流程,完成下列填空:
)天然气脱硫时的化学方程式是
n mol CH 4经一次转化后产生CO 0.9n mol 、产生H 2 mol (用含n 的代数式表示)CO 3(aq )和 CO 2反应在加压下进行,加压的理论依据是 (多选扣分) )相似相溶原理 (b )勒沙特列原理 (c )酸碱中和原理
KHCO 3分解得到的CO 2可以用于 的一种重要用途)。
)整个流程有三处循环,一是Fe(OH)3循环,二是K 2CO 3(aq )循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。
