【教育资料】江苏省天一中学苏教版高中化学必修一练习(无答案):专题一2.1 物质的分离与提纯学习精品
江苏省天一中学苏教版高中化学必修一练习(无答案):专题一2.1 物质的分离与提纯-最新教育文档

2.1 物质的分离与提纯【目标诠释】1、掌握溶解、过滤、蒸发、结晶、萃取、分液、蒸馏等的基本操作,理解这些分离方法的基本原理。
2、初步了解根据混合物的性质,选择不同的分离方法对物质进行分离。
一、物质分离、提纯的区别物质的分离:将混合物的各组分分离开来,获得几种纯净物的过程。
物质的提纯:将混合物中的杂质除去而得到纯净物的过程,又叫物质的净化或除杂。
【课前练习】1.为了除去KCl固体中少量MgCl2、K2SO4和CaCl2杂质,下列操作正确的次序是()①加水溶解;②加热蒸发得到晶体;③加入过量BaCl2溶液;④加入过量盐酸;⑤加入过量K2CO3;⑥过滤。
A.①⑤③⑥④②B.①⑤③④⑥②C.①③④⑥⑤②D.①③⑤⑥④②除杂的原则:2.欲除去KNO3溶液中混有的Cu2+、Mg2+、SO42—,下列加入试剂的顺序中正确的是()A. Ba(NO3)2、KOH、K2CO3、HNO3B. K2CO3、Ba(NO3)2、KOH、HNO3C. KOH、K2CO3、Ba(NO3)2、HNO3D. Ba(NO3)2、K2CO3、KOH、HNO3二、物质的分离提纯操作1、过滤:过滤是把_______________________________分离的一种方法。
过滤操作时所需玻璃仪器为:_________________________________。
过滤时要求:2、结晶:通过蒸发溶剂、降温等方法,使固态溶质从其水溶液中以晶体形式析出的过程。
对溶解度受温度变化影响不大的固态溶质,通常采用__________________的方法,使溶质结晶析出,如:_______________;对溶解度受温度变化影响相当大的固态溶质,通常采用________________的方法,使溶质结晶析出,如:_________________。
重结晶:使结晶所得晶体,重新溶解制得热的饱和溶液,再冷却结晶的分离方法。
〖交流与讨论〗(1)已知粗食盐中含有硫酸钠、氯化镁、氯化钙和泥沙等杂质,又知氢氧化镁难溶于水,硫酸钡既难溶于水又难溶于酸,碳酸钡难溶于水,但可溶于盐酸。
苏教版高中化学必修一专题1、2化学试题

高中化学学习材料金戈铁骑整理制作必修1专题1、2化学试题本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,总分100分,考试用时75分钟。
可能需要的原子量:H-1 C-12 N-14 O-16 Na-23 K-39 Cl-35.5 Fe-56 Br-80一、选择题:(本题包括15小题,每小题2分,共30分,每小题只有一个选项符合题意)1、如图所示,下列实验操作与方法正确的是2、下列化学反应中,属于氧化还原反应的是A.Na2CO3+CaCl2===CaCO3↓+2NaClB.Fe+CuSO4===Cu+FeSO4C.2NaHCO3Na2CO3+CO2↑+H2OD.CaO+H2O===Ca(OH)23、用NA表示阿伏加德罗常数的数值,则下列说法中正确的是A.44gCO2所含分子数为2NA个B.标准状况下,11.2L氧气含原子数为NA个C.常温常压下,NA个氦分子的体积为22.4LD.NA个氢分子的质量为1g4、下列氯化物中,不能通过单质与单质直接化合制取的是A.FeCl2 B.FeCl3C.MgCl2D.CuCl25、有关物质的量浓度溶液配制的下列说法中正确的是A.把1mol NaCl溶于1L水中所得溶液物质的量浓度为1mol·L-1B.把0.1molNaCl投入100mL容量瓶中加水至刻度线,充分振荡后,浓度为1 mol·L-1C.把4.0gNaOH放入烧杯并加水搅拌冷却后全部转接到1000mL容量瓶并加水至刻度,所得溶液的浓度为1 mol·L-1D.需要480mL0.1 mol·L-1的Na2CO3溶液,配制时应选用500mL容量瓶6、用特殊方法把固体物质加工到纳米级(1-100nm ,1nm=10-9m )的超细粉末粒子,然后制得纳米材料。
下列分散系中的分散质的微粒直径和这种粒子具有相同数量级的是 A .溶液 B .悬浊液 C .胶体 D .乳浊液7、在氧化还原反应Fe 2O 3+3CO=====2Fe+3CO 2中电子转移的数目是A .2e-B .3e-C .6e-D .8e- 8、在配制一定物质的量浓度的NaOH 溶液时,下列哪个原因会造成所配溶液浓度偏高A .所用NaOH 已经潮解B .移液前,容量瓶中有少量蒸馏水C .有少量NaOH 溶液残留在烧杯里D .定容时观察液面俯视9、已知m mol 某气体的质量为a g ,则b g 该气体在标准状况下的体积(L )为A .22.4am/bB .22.4b/amC .22.4bm/aD .22.4a/bm10、下列关于氯水的叙述中,不正确的是 A .新制氯水中既有分子,又有离子B .新制氯水在光照的条件下,可以产生气体,该气体是氧气C .久置氯水可以使干燥布条褪色D .久置氯水酸性增强11、俄罗斯科学家最近合成第114号元素的原子,该原子的质量数为289,存在时间达到30秒,这项成果具有重要意义。
苏教版高一化学必修一专题一全套习题
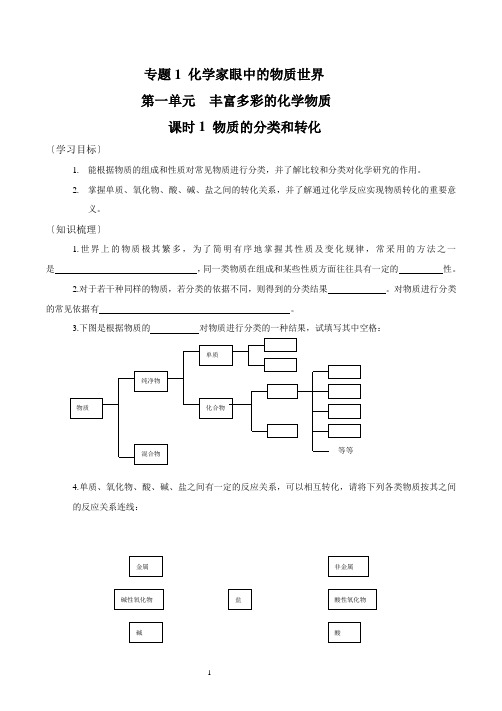
专题1 化学家眼中的物质世界第一单元丰富多彩的化学物质课时1 物质的分类和转化〔学习目标〕1.能根据物质的组成和性质对常见物质进行分类,并了解比较和分类对化学研究的作用。
2.掌握单质、氧化物、酸、碱、盐之间的转化关系,并了解通过化学反应实现物质转化的重要意义。
〔知识梳理〕1.世界上的物质极其繁多,为了简明有序地掌握其性质及变化规律,常采用的方法之一是,同一类物质在组成和某些性质方面往往具有一定的性。
2.对于若干种同样的物质,若分类的依据不同,则得到的分类结果。
对物质进行分类的常见依据有。
3.下图是根据物质的对物质进行分类的一种结果,试填写其中空格:4.单质、氧化物、酸、碱、盐之间有一定的反应关系,可以相互转化,请将下列各类物质按其之间的反应关系连线:[例题解析]例1.现有下列五种物质:锌粒、硫酸锌、氢氧化锌、氧化锌、硫酸,试关于它们回答下列问题:(1)根据它们组成或性质的不同,把它们分成两大类。
(2)写出它们之间转化的化学方程式。
解析:(1)对所给物质进行分类,首先应根据它们在组成、性质、状态等方面的不同,明确分类的依据,然后再针对不同的依据得出不同的分类结果。
从组成上看,镁条是只含一种元素的纯净物,为单质;另四种物质都是含两种或两种以上元素的纯净物,为化合物。
从状态上看,硫酸为液体,另四种物质为固体。
从性质上看,硫酸镁和硫酸都是易溶物,另三种物质为难溶物,等等(2)单质、氧化物、酸、碱、盐之间有一定的转化规律,可先明确上述物质所属物质类型,再根据此类型物质所具有的性质,写出相应的化学方程式(注意复分解反应发生的条件)。
如:锌属于活泼金属,可与酸(或盐)反应生成相应的盐,据此可写出反应式:Zn + H2SO4 == ZnSO4 + H2↑, 依此类推,有:2 Zn + O2 == 2 ZnO,Zn(OH)2 + H2SO4 == ZnSO4 + 2H2O ,ZnO +H2SO4 == ZnSO4 + H2OZn(OH)2 △=ZnO + H2O , ZnO + H2△=Zn + H2O〔基础训练〕1.下列物质中都含有氢元素,按照已学知识判断其中属于酸的是()A.NH3B.CH4C.NaHCO3D.HClO32.同种类型的物质往往具有某些相同的性质。
范文苏教版高一化学必修专题一练习题及答案解析

(本栏目内容,在学生用书中以活页形式分册装订!)一、选择题(本题包括12小题,每题4分,共48分)1.下列各组物质中,第一种是含氧酸,第二种是混合物,第三种是碱的是()A.爆鸣气、硫酸铜、硫酸B.水、空气、纯碱C.氧化铁、胆矾、熟石灰D.硝酸、石灰石、烧碱【解析】A项都不符合题意,B项水不属于含氧酸,纯碱属于盐,C项氧化铁属于氧化物,胆矾属于纯净物。
【答案】 D2.(2008年广东化学)某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②沼气和水煤气都是可再生能源;③冰和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦豆浆和雾都是胶体。
上述说法正确的是() A.①②③④B.①②⑤⑥C.③⑤⑥⑦D.①③④⑦【解析】②沼气属于可再生能源,水煤气是由炽热的煤与水蒸气,反应制得的CO和H2的混合物,因为煤为不可再生能源,所以水煤气也为不可再生能源,错误;③冰为固态水,干冰为固态CO2,两者均既是纯净物又是化合物,正确;⑤盐酸和食醋不是化合物,而是混合物,错误;⑥纯碱为Na2CO3,不是碱而是盐,错误;⑦豆浆和雾都能产生丁达尔效应,均属于胶体,正确。
答案为D项。
【答案】 D3.有五瓶失去标签的溶液,它们分别为:①Ba(NO3)2;②KCl;③NaOH;④CuSO4;⑤Na2SO4。
如果不用其他任何试剂(包括试纸),用最简便的方法将它们一一鉴别开来,则在下列的鉴别顺序中,最合理的是()A.④③①⑤②B.①④③⑤②C.①⑤③④②D.③④①⑤②【答案】 A4.(2009年石家庄高一检测)下列实验操作中错误的是()A.进行蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热B.进行蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处C.进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出D.进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大【解析】A项蒸发操作时水分完全蒸干后,才停止加热是错误的,应该利用余热蒸干;D项萃取剂的密度不一定比水大,只要符合萃取剂与原溶剂互不相溶,溶质在萃取剂中的溶解度比在水中大,且萃取剂与水的密度有差别即可。
苏教版高中化学必修一专题1复习学案知识点整理习题

专题1《化学冢眼中的物质世界》 复习、物质的分类广纯净物物质混合物【例】有以下几种物质:①空气、②液态氧、③硝酸钾溶液、④硫酸铜晶体(CuS04 ・5H2O )、 ⑤二氧化碳、⑥氧化铜、⑦锌、⑧金刚石、⑨氢氧化铜、⑩纯碱、11.甲烷、12.硝酸。
其中,属于纯净物的是 _______________________________________ (填序号,下同),属于混合物的是 _,属于氧化物的是 ,属于盐的是 ,属于有机物的是 _, 属于碱的是 — ,属于单质的是 。
二、 物质的量1、 物质的量是一个物理量,符号为 _________________ ,单位为 ___________2、 1 mol 粒子的数目又叫 _________________________ 常数,符号为 ____________ ,单位 ____________ 。
3、 使用摩尔时,必须指明粒子的种类,可以是分子、原子、离子、电子等。
4、 ___________________________________________ 、微粒数与物质的量的转化公式:注意:(1)物质的量度量的对象是微粒集体,微粒可以是分子、原子、离子、电子、中子、 质子等。
(2)使用物质的量一般 用符号标明微粒,女口 1mol H2O, 5mol 日+等。
摩尔作为物质 的量的单位,不能用来表示宏观物体的多少,使用摩尔时必须指明微粒的种类。
【例】判断下列说法的正误:( ) (1)摩尔为7个基本物理量之一 (2)1 mol氧(3) 1 mol 大米 (4) 0.25 mol CO(5) 0.5 mol H2 有 3.01 x 10 个氢原子 (6)3 mol NH 3有 3mol N 原子,9mol H 原子2•阿伏加德罗常数:1mol 任何微粒集体中所含有的微粒数叫做阿伏加德罗常数。
用符号 _表示,通常使用 近似值mol -1。
三、 摩尔质量1、 定义: _________________________________ 。
苏教版化学必修一专题一第1单元习题资料

高一化学专题一第一单元练习题1、(双选)在以下反响中,既能放出气体又不是氧化复原反响的是( )A.加热KMnO4 B.Mg与盐酸反响C.加热小苏打D.高温灼烧石灰石2、以下说法中错误的选项是( )A.置换反响必定是氧化复原反响B.化合反响不行能是氧化复原反响C.分解反响可能是氧化复原反响D.凡是氧化复原反响,都不行能是复分解反响、以下相关物理量相应的单位表达错误的选项是()A、摩尔质量g/molB、气体摩尔体积L/molC、溶解度g/100gD、密度g/cm3、不属于氧化复原反响的是()A、2Al+Fe2O32Fe+Al2O3B、2Mg+CO22MgO+CC、N2+3H22NH3D、SiO2+CaOCa SiO3、以下对“摩尔(mol)”的表达不正确的选项是()摩尔是一个单位,用于计量物质所含微观粒子的多少B.摩尔既能用来计量纯净物,又能用来计量混淆物任何气体所含的气体分子数目都相等D.用“摩尔”(而不用“个”)计量微观粒子与用“纳米”(而不用“米”)计量原子直径,计量思路都是扩大单位、以下表达正确的选项是()A.lmo102的质量为32g/mo1B.NO3-的摩尔质量为62g/molC.H2SO4的相对分子质量为98gD.lmol任何物质的质量等于该物质的相对分子质量、(双选)以下各组物质中,分子数必定同样的是()A.LH2和molNO2B.2molCO和88gCO2C.4℃时,18mL水和2×105Pa,27℃时32gO2D.1×105Pa,27℃时LCl2和含4mol氧原子的H2SO48、(双选)在必定温度和压强下的理想气体,影响其所占体积大小的主要要素是( )A.分子直径的大小B.分子间距离的大小C.分子间引力的大小 D.分子数目的多少9、以下物质中,含氧原子最多的是()A.标准状态时,的CO2B.200g49%的H3PO4C.32g的SO2气体D.×1023个O2分子10、等质量的CH4和NH3对比较,以下结论错误的选项是()A.它们的分子个数之比为17:16B.它们的原子个数之比为17:16C.它们的氢原子个数之比为17:12D.它们所含氢的质量比为17:1211、以下两种气体的分子数必定相等的是()A质量相等、密度不等的N2和C2H4B等体积等密度的CO和C2H4C等温等体积的O2和N2D等压等体积的N2和CO212、同样情况下,以下气体所占体积最大的是()A.80gSO 3B.16gO2C.32gH2SD.3gH213、以下各物质所含原子数目,按由大到小次序摆列的是①NH3②标准情况下He③4℃9mL水④H3PO4A.①④③②B.④③②①C.②③④①D.①④③②14、等质量的①CH4、②H2、③HCl、④SO2,在标准情况下所占体积由大到小摆列的次序是A②>①>③>④B④>③>①>②C③>②>④>①D①>④>②>③15、在标准情况下①CH4②×1023个HCl分子③H2S④NH3,以下对这四种气体的关系从大到小表达正确的选项是 ( )a.体积②>③>①>④b.密度②>③>④>①c.质量②>③>①>④d.氢原子个数①>③>④>②A.abcB.bcdC.cbaD.abcd16、以下数目的物质中含原子个数最多的是()A.mol氧气B.标准情况下L二氧化碳C.4℃时mL 水D.10g氖17、(双选)以下说法正确的选项是( )A.标准情况下就是气体摩尔体积B.非标准情况下,1mol任何气体的体积不行能为23D.1molH2和O2的混淆气体在标准情况下的体积约为18、以下表达中正确的选项是().同温同压下,同样体积的物质,其物质的量必相等B.1LCO的质量必定比1LCO2的质量小C.等体积、等物质的量浓度的强酸中所含H+的数目属相等D.任何条件下,等物质的量的NH3和SO3所含原子数必相等19、以下表达正确的选项是 ( )、同温同压下,同样体积的物质,它们的物质的量必相等B 、任何条件下,等质量的一氧化二氮( N 2O )和二氧化碳所含的分子数必相等C 、1L 一氧化碳所体必定比 1L氧气质量小D 、等体积、等物质的量浓度的盐酸和醋酸( CH 3COOH )中所含的H +数必定相等 20、用N A 表示阿伏加德罗常数的值,以下表达正确的选项是()A .含有N A 个氦原子的氦气在标准情况下的体积约为53N AB .25℃,×10Pa,64gSO 2中含有的原子数为C .在常温常压下,Cl 2含有的分子数为AD .标准情况下,2O 含有的分子数为A21、能表示阿伏加德罗常数的数值是()A .1mol 金属钠含有的电子数B .标准情况下,22.4L 苯所含的分子数C .0.012g 12C 所含的原子数D .1L1mol/L 的硫酸溶液中所含的H +22、以下表达正确的选项是().必定温度、压强下,气体体积由其分子的大小决定 B .必定温度、压强下,气体体积由其物质的量的多少决定C .气体摩尔体积是指1mol 任何气体所占的体积为D.不一样的气体,若体积不等,则它们所含的分子数必定不等23、以下说法正确的选项是(NA表示阿伏加德罗常数的值)()A.在常温常压下,L氯气含有的分子数为AB.在常温常压下,1mol氮气含有的原子数为NAC.32g氧气所含原子数目为2N AD.在同温同压时,同样体积的任何气体单质所含的原子数目同样24、标准情况下,112mL某气体的质量是g,该气体可能是()A.O2B.N2C.H2S D.CO225、某金属的氧化物化学式为M x O y,那么该金属的氯化物的化学式为()A.MC l xB.MCl2y/xC.MxClyD.MyClx26、同温同压下,同体积的气体单质X2随和体单质Y2化合生成Z,其体积不变,则Z的化学式为()A.X2Y2B.X2YC.XY2D.XY27、以下对于溶液和胶体的表达,正确的选项是()溶液是电中性的,胶体是带电的B.通电时,溶液中的溶质粒子分别向两极挪动,胶体中的分别质粒子向某一极挪动C.溶液中溶质粒子的运动有规律,胶体中分别质粒子的运动无规律,即布朗运动D.一束光芒分别经过溶液和胶体时,后者会出现显然的光带,前者则没有28、以下说法正确的选项是( ).明矾净水过程中不波及化学变化B.由同种元素构成的物质必定是纯净物C.风化、石油分馏和碘的升华都是物理变化D.在化学反响中,反响前后原子种类、数目和质量必定不变29、以下现象中,不可以用胶体知识解说的是 ( ).向豆浆中加入盐卤可制作豆腐B.清早在密林中看到一缕缕光束C.向FeCl3溶液中加入Na2CO3溶液,会出现红褐色积淀D.在河水与海水的交汇处,有沙洲形成30、对于胶体和溶液的差别,以下表达中正确的选项是 ( ).溶液呈电中性,胶体带电荷B.溶液中溶质微粒不带电,胶体中分别质微粒带有电荷C.通电后,溶液中分别质微粒分别向两极运动,胶体中分别质微粒向某一极挪动D.溶液与胶体的实质差别在于分别质微粒直径大小,前者小于1纳米,后者介于1—100纳米之间31、以下分别系中,分别质微粒半径最小的是 ( )A.雾B.蛋白质溶液C.NaCl溶液D.新制Cu(OH)2悬浊液32、二氧化碳的摩尔质量是_____, 1mol二氧化碳的质量是____,它含有_____个二氧化碳分子;____ g二氧化碳中所含的氧原子数与49gH2S04中所含的氧原子数相等。
高中化学苏教版-必修1-__专题1-_课后习题_电子版
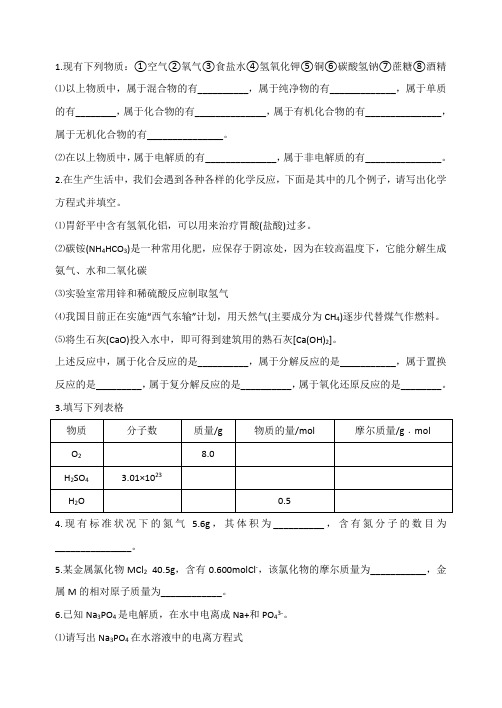
1.现有下列物质:①空气②氧气③食盐水④氢氧化钾⑤铜⑥碳酸氢钠⑦蔗糖⑧酒精⑴以上物质中,属于混合物的有__________,属于纯净物的有_____________,属于单质的有________,属于化合物的有______________,属于有机化合物的有_______________,属于无机化合物的有_______________。
⑵在以上物质中,属于电解质的有______________,属于非电解质的有_______________。
2.在生产生活中,我们会遇到各种各样的化学反应,下面是其中的几个例子,请写出化学方程式并填空。
⑴胃舒平中含有氢氧化铝,可以用来治疗胃酸(盐酸)过多。
⑵碳铵(NH4HCO3)是一种常用化肥,应保存于阴凉处,因为在较高温度下,它能分解生成氨气、水和二氧化碳⑶实验室常用锌和稀硫酸反应制取氢气⑷我国目前正在实施“西气东输”计划,用天然气(主要成分为CH4)逐步代替煤气作燃料。
⑸将生石灰(CaO)投入水中,即可得到建筑用的熟石灰[Ca(OH)2]。
上述反应中,属于化合反应的是__________,属于分解反应的是___________,属于置换反应的是_________,属于复分解反应的是__________,属于氧化还原反应的是________。
3.填写下列表格4.现有标准状况下的氮气5.6g,其体积为__________,含有氮分子的数目为_______________。
5.某金属氯化物MCl240.5g,含有0.600molCl-,该氯化物的摩尔质量为___________,金属M的相对原子质量为____________。
6.已知Na3PO4是电解质,在水中电离成Na+和PO43-。
⑴请写出Na3PO4在水溶液中的电离方程式⑵若将164g Na3PO4溶于足量书中配成溶液,则溶液中Na+的物质的量为多少?7.浊液、溶液和胶体是常见的分散系,他们之间的主要区别是什么?两只烧杯中分别盛有氢氧化铁胶体和氯化铁溶液,如何区别它们?写出实验步骤、实验现象及结论。
苏教版高中化学练习 必修1专题2

苏教版高中化学练习必修1专题2 从海水中获得的化学物质一、选择题(本题包括20小题,每小题只有一个选项符合题意。
)1.将2.3g金属钠放入水中,要使每100个水分子中含有1个Na+,所需水的质量是()A.91.8g B.184g C.181.8g D.183.6g2.下列各组中的两物质作用时,反应条件或反应物用量的改变对生成物没有影响的是()A.Na2O2和CO2B.Na和O2C.NaOH和CO2D.C和O23.分别将一小块钠投入下列溶液中,只有气体放出没有沉淀生成的是()。
A.饱和NaCl溶液B.稀NaHSO4溶液C.MgSO4溶液D.CuSO4溶液4.下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是() A.氢氧化钠与盐酸;氢氧化钠与碳酸B.BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液C.Na2CO3溶液与硝酸溶液;CaCO3溶液与硝酸溶液D.石灰石与硝酸反应;石灰石与盐酸5.某无色溶液中,可大量共存的离子组是()A.Na+、HCO3-、SO42-、Br-B.Cu2+、NO3-、Cl-、SO42-C.H+、Cl-、K+、CO32-D.K+、Mg2+、SO42-、OH-6.下列各组离子在水溶液中能大量共存的是()A.Na+、Ba2+、Cl-、SO42-B.Ca2+、HCO3-、C1-、K+C.Mg2+、Ag+、NO3-、Cl-D.H+、Cl-、Na+、CO32-7.下列反应的离子方程式正确的是A.向Ba(OH)2溶液中滴加稀盐酸:2H++2Cl-+Ba2++2OH-2H2O+BaCl2B.澄清石灰水与少量NaHCO 3溶液混合:Ca2+ + OH-+ HCO3-CaCO3↓+ H2O C.往澄清石灰水中通入过量二氧化碳:C a2++2OH-+CO2CaCO3↓+H2OD.大理石溶于醋酸中:CO23-+2CH3COOH==Ca2++2CH3COO-+CO2↑+H2O8. 实验室用下列两种方法制取氯气:①用含HCl 146 g的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量的浓盐酸反应,则所得Cl2:A.①比②多B.②比①多C.一样多D.无法比较9.实验室可用二氧化锰粉末与浓盐酸共热制取氯气。
苏教版高中化学必修第1册 课后习题 专题1 物质的分类及计量 第一单元 第3课时 化学反应的分类

第3课时化学反应的分类课后篇素养形成合格考达标练1.单晶硅是制作电子集成电路的基础材料。
科学家预计,在一个电脑芯片上将会集成10亿个晶体管,其功能远比我们想象的要大得多,这对硅的纯度要求很高。
用化学方法可制得高纯度硅,其化学方程式为:①SiO2+2CSi+2CO↑②Si+2Cl2SiCl4③SiCl4+2H2Si+4HCl,其中,反应①和③属于( )A.化合反应B.分解反应C.置换反应D.复分解反应2.氨气与氯气相遇时有白烟出现,发生的反应有①2NH3+3Cl26HCl+N2②NH3+HCl NH4Cl,下列说法正确的是( )A.①为化合反应B.②为置换反应C.①为氧化还原反应D.②为复分解反应,②为化合反应,A、B两项错误;反应①中氮元素和氯元素化合价发生变化,为氧化还原反应,C项正确;反应②为化合反应,D项错误。
3.我国化工专家侯德榜发明了“联合制碱法”,其生产过程中发生的主要反应是:①NH3+CO2+H2O NH4HCO3②NH4HCO3+NaCl NaHCO3↓+NH4Cl③2NaHCO3Na2CO3+H2O+CO2↑在上述反应中没有涉及的基本反应类型是( )A.置换反应B.化合反应C.分解反应D.复分解反应解析①NH3+CO2+H2O NH4HCO3为化合反应;②NH4HCO3+NaClNaHCO3↓+NH4Cl为复分解反应;③2NaHCO3Na2CO3+H2O+CO2↑为分解反应。
A正确。
4.下列反应既属于氧化还原反应,又属于置换反应的是( )A.2Fe+3Cl22FeCl3B.Fe2O3+3CO2Fe+3CO2C.CaO+CO2CaCO3D.2H2O+2Na2NaOH+H2↑项中的反应是化合反应,A错误;B项中的反应是氧化还原反应,但不属于四种基本反应类型,B错误;C项中的反应是化合反应,C错误;D项中的反应既是氧化还原反应也是置换反应,D正确。
5.化学概念在逻辑上存在如下关系:针对以上概念的下列说法正确的是( )A.化合物与纯净物属于重叠关系B.化合物与碱性氧化物属于交叉关系C.分解反应与复分解反应属于交叉关系D.置换反应与氧化还原反应属于包含关系,属于包含关系,A错误;碱性氧化物是化合物中的一类化合物,碱性氧化物包含于化合物中,属于包含关系,B错误;分解反应与复分解反应属于并列关系,C错误;置换反应都属于氧化还原反应,与氧化还原反应为包含关系,D正确。
苏教版高中化学必修一单元练习:专题1.docx

高中化学学习材料鼎尚图文收集整理专题1 单元练习 班级: 姓名:一、单选题1.下面是人们对于化学科学的各种常见的认识,其中错误的是 ( ) A .化学将为环境、能源、资源等问题的解决提供有力保障 B .化学正发展成为一门实验与理论互相结合、互相渗透的科学 C .化学是一门具有极强实用性的自然科学D .化学是一门纯实验的自然科学,实验是探究化学过程的唯一途径2.下列反应中属于氧化还原反应,但不属于四种基本反应类型的是 ( )A .CuO + H 2 ==== Cu + H 2OB .2KMnO 4 ==== K 2MnO 4 + MnO 2 + O 2↑C .Fe 2O 3 + 3CO ==== 2Fe + 2CO 2D .NaOH + HCl ==== NaCl + H 2O3.甲、乙、丙、丁分别是Na 2CO 3、AgNO 3、BaCl 2、盐酸四种无色溶液中的一种,它们两两反应后的现象如下:甲 + 乙 → 沉淀;甲 + 丙 → 沉淀;乙 + 丙 → 沉淀;丙 + 丁 →沉淀;乙 + 丁 → 无色无味气体。
则甲、乙、丙、丁四种溶液依次是 ( )A .BaCl 2、Na 2CO 3、AgNO 3、盐酸B .BaCl 2、Na 2CO 3、盐酸、AgNO 3C .Na 2CO 3、盐酸、AgNO 3、BaCl 2D .AgNO 3、盐酸、BaCl 2、Na 2CO 34.加入稀盐酸后,溶液中下列离子数目不减少的是 ( ) A .CO 32— B .SO 42— C .Ag + D .SO 32—5.下列物质的水溶液能导电,但该物质属于非电解质的是 ( ) A .CO 2 B .Cl 2 C .H 2SO 4 D .Na 2O6.下列实验操作中,一般情况下不能相互接触的是 ( ) A .用胶头滴管向试管中滴加液体时,滴管与试管壁 B .分液操作时,分液漏斗下端管口与烧杯内壁 C .过滤操作时,漏斗下端管口与烧杯内壁D .配制一定物质的量浓度的溶液过程中,用玻璃棒引流时,玻璃棒下端与容量瓶内壁 7.欲配制500mL 0.1mol/L HCl 溶液,需标准状况下HCl 气体体积 ( ) A .22.4L B .11.2L C .5.6L D .1.12L8.下列物质的分离方法中,是根据微粒大小确定的分离方法是 ( ) A .萃取 B .结晶 C .过滤 D .蒸馏9.用10mL 0.1mol/L BaCl 2溶液恰好可使相同体积的硫酸铁[ Fe 2(SO 4)3 ]、硫酸锌(ZnSO 4)和硫酸铝钾[ KAl(SO 4)2 ]三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是 ( )A .3 : 2 : 2B .1 : 2 : 3C .1 : 3 : 3D .2 : 6 : 310.以Mg 、MgO 、Mg(OH)2、MgCO 3、MgSO 4、BaCl 2溶液和盐酸为原料,直接制取MgCl 2△△ △可有多种方法,其中运用复分解反应的有()A.二种B.三种C.四种D.五种11.下列说法正确的是()A.摩尔是物质的质量单位B.氢气的摩尔质量是2gC.1mol OH—的质量是17g D.1mol氢气所占体积约为22.4L12.据科学家预测,月球的土壤中吸附着数百万吨32He,100t 32He核聚变所释放出的能量相当于目前人类一年消耗的能量。
苏教版高中化学必修1专题一练习题及答案

一、选择题1.对下列物质分类全部正确的是( )①纯碱②食盐水③石灰水④NaOH ⑤液态氧⑥KClO3A.碱——①④ B.纯净物——③④⑤C.盐——①⑥ D.混合物——②⑤2.下列物质中均为化合物的一组是( )A.金刚石、干冰、SO2 B.KCl、盐酸、NaOHC.CuSO4·5H2O、冰、乙醇 D.臭氧、CaCO3、铝合金3.下列实验现象与氧化还原反应有关的是( )A.碳酸钠中加入CaCl2溶液产生白色沉淀物B.硫酸铜溶液中插入铁片,铁片上出现红色沉淀物C.石灰石溶于盐酸并产生气泡D.铁在氧气中燃烧,剧烈反应火星四射4.X、Y、Z、W各代表一种物质,若X+Y===Z+W,则X和Y之间不可能是( ) A.盐和盐的反应 B.碱性氧化物和水的反应C.酸与碱的反应 D.酸性氧化物和碱的反应5.下列分散系属于胶体的是( )A.石灰水 B.豆浆C.泥水 D.蔗糖水6.下列说法中不正确的是( )A.鉴别Al(OH)3胶体(无色)和食盐水,可以不用任何试剂B.鉴别白糖水和食盐溶液,可以不用任何试剂C.鉴别粉笔末与水、豆油与水组成的浊液,可以不用任何试剂D.鉴别NaCl与CuSO4两种溶液,可以不用任何试剂7. 设阿伏加德罗常数为N A,则下列说法正确的是A.常温常压下,11.2 L甲烷中含有的氢原子数为2N AB. 标准状况下,0.3 mol二氧化碳中含有氧原子数为0.3 N AC. 常温下,2.7 g铝与足量的盐酸反应,失去的电子数0.3 N AD. 常温下,1 L 0.1 mol / L MgCl2溶液中含Mg数为0.2 N A8.通过溶解、过滤、蒸发等操作,可将下列各组混合物分离的是( ) A.硝酸钠、氢氧化钠 B.氧化铜、二氧化锰C.氯化钾、二氧化锰 D.硫酸铜、氢氧化钙9.下列分离物质的方法中,不正确的是( )A .利用分馏的方法从石油中分离出汽油和煤油B .利用分液的方法将水和酒精分离开来C .利用结晶的方法除去硝酸钾中混有的少量氯化钾D .利用过滤的方法除去水中的泥沙10.现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )A .分液、蒸馏、萃取B .萃取、蒸发、分液C .分液、萃取、蒸馏D .蒸馏、萃取、分液11.下列操作能证明溶液中有SO 42-存在的是( )A .加入硝酸酸化的Fe(NO 3)3,产生白色沉淀B .加入BaCl 2溶液,如果产生白色沉淀,则一定含有SO 42-C .先加入HCl 溶液,如果无明显现象,再加入BaCl 2,如果产生白色沉淀,则有SO 42-D .向溶液中加盐酸酸化的BaCl 2,如果产生白色沉淀,则一定有SO 42- 12.氯仿可作全身麻醉剂,但在光照下易被氧化成剧毒的光气:2CHCl 3+O 2=====光照2COCl 2+2HCl ,为了防止事故的发生,使用前要检验是否变质,你认为检验使用的最佳试剂是( )A .溴水B .烧碱溶液C .硝酸银溶液D .碘化钾淀粉试纸13.以下是对某水溶液进行离子检验的方法和结论,其中正确的是( )A .先加入BaCl 2溶液,再加入足量的HNO 3溶液,产生了白色沉淀。
苏教版必修1化学专题一二习题.doc

•将下列物质按酸、碱、盐、电解质分类排列,正确的是()A.硝酸、纯碱、胆矶、盐酸B.硫酸、烧碱、小苏打、纯碱C.盐酸、乙醇、氯化钠、碘酒D.醋酸、漂白粉、石灰石、二氧化碳2.下列反应不属于四种基本反应类型,但属于氧化还原反应的是()A. Fe+CuSO4=FeSO4+CuB. 3CO+Fe2O3 2Fe+3CO2C. AgNO3+NaCl=AgClJ+NaNO3D. 2KMnO4 K2MnO4+MnO2+O2$4.下列叙述正确的是()A.同温同压下,相同体积的物质,其物质的量一定相等B.一氧化碳气体和氮气,若体积相等,则质量一定相等C.1L 一氧化碳气体一定比1L氧气的质量小D.任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等5.有下列物质:①0.5molNH3②标准状况下22.4L氨气③4°C时9mL水④0.2mol H3PO4所含原子数目由多到少的顺序排列正确的是()A.①④③②B.④③②①C.①②③④D.②③④①1.下列物质的提纯方法可能展于化学变化的是()A.蒸t®B.过滤C.分液D.洗气2.NaOH、Na2CO3x NaCk Na2SO4可按某种标准划为类物质,下列分类标准不正确的是()A.钠的化合物B.可与硝酸反应C.可溶于水D.电解质3.下列说法正确的是()A.摩尔是一种國际基木物理量B.标准状况下气体摩尔体积约为22.4LC.Imol氧的质量为16gD.在同温同压下,相同体积的任何气体单质所含分了数相同4.胶体分散系与其它分散系的木质并别是()A.分散质直径大小B.是否有丁达尔现象C.是占稳定D.分散质粒子是古带电6.下列反应肯定不属于氧化还原反应的是()A.化合反应B.分解反应C.置换反应D.复分解反应7.下列物质水溶液能导电,但该物质属于非电解质的是()A. Na2OB. CUC. H2SO4D. C028.在溶液屮能人暈共存,加入OH W沉淀析岀,加入才育气体放岀的是()A. Na+、Cu*、Cl、SO42'B. Fe3+. K+. SO42\ NO3C. H+、Al*、OH\ NO3D. Na+、Cat Cl\ HCO?9.一定温度下,将少量生石灰放入一定最的饱和石灰水中,搅拌并冷却到原温度,下列说法正确的是()A.溶质的质量增大B.溶质的物质的量浓度增大C. Ca (OH) 2溶解度不变D.溶质的质量分数增大10.下列实验基本操作(或实验注意事项)中,是处于实验安全考虑的是①给盛有液体的烧瓶加热时,需要加碎瓷片或沸石②酒精灯内的酒精不能小于酒精灯容积的1/3③点燃可燃性气体前要验纯④稀释浓硫酸时,要将浓硫酸慢慢沿器壁流入水中()A.①®③④B.①③④C.③®D.只有③一下肯能有多个选择11.下列离子方程式正确的是()A.铁和盐酸反应:2Fe+6H+=2Fe3++3H2fB.氯化铁和铜反应:Fe3++Cu=Fe2++Cu2+C.石灰水与碳酸钠溶液混合:Ca2++CO32 =CaCO31D.硫酸氢钠溶液屮加入氢氧化锁溶液至屮性:2H++SO42+B a2++2OH =BaSO4 I +2HQ12.某溶液中含有C「和I-的物质的第:浓度相同。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.1 物质的分离与提纯
【目标诠释】
1、掌握溶解、过滤、蒸发、结晶、萃取、分液、蒸馏等的基本操作,理解这些分离方法的基本原理。
2、初步了解根据混合物的性质,选择不同的分离方法对物质进行分离。
一、物质分离、提纯的区别
物质的分离:将混合物的各组分分离开来,获得几种纯净物的过程。
物质的提纯:将混合物中的杂质除去而得到纯净物的过程,又叫物质的净化或除杂。
【课前练习】
1.为了除去KCl固体中少量MgCl2、K2SO4和CaCl2杂质,下列操作正确的次序是()①加水溶解;②加热蒸发得到晶体;③加入过量BaCl2溶液;④加入过量盐酸;⑤加入过量K2CO3;⑥过滤。
A.①⑤③⑥④②B.①⑤③④⑥②C.①③④⑥⑤②D.①③⑤⑥④②
除杂的原则:
2.欲除去KNO3溶液中混有的Cu2+、Mg2+、SO42—,下列加入试剂的顺序中正确的是()
A. Ba(NO3)2、KOH、K2CO3、HNO3
B. K2CO3、Ba(NO3)2、KOH、HNO3
C. KOH、K2CO3、Ba(NO3)2、HNO3
D. Ba(NO3)2、K2CO3、KOH、HNO3
二、物质的分离提纯操作
1、过滤:过滤是把_______________________________分离的一种方法。
过滤操作时所需玻璃仪器为:_________________________________。
过滤时要求:
2、结晶:通过蒸发溶剂、降温等方法,使固态溶质从其水溶液中以晶体形式析出的过程。
对溶解度受温度变化影响不大的固态溶质,通常采用__________________的方法,使溶质结晶析出,如:_______________;
对溶解度受温度变化影响相当大的固态溶质,通常采用________________的方法,使溶质结晶析出,如:_________________。
重结晶:使结晶所得晶体,重新溶解制得热的饱和溶液,再冷却结晶的分离方法。
〖交流与讨论〗(1)已知粗食盐中含有硫酸钠、氯化镁、氯化钙和泥沙等杂质,又知氢氧化镁难溶于水,硫酸钡既难溶于水又难溶于酸,碳酸钡难溶于水,但可溶于盐酸。
请设计实验方案,从粗盐中提纯氯化钠。
【学法指导】混合物的分离方法取决于组成混合物的各物质的性质差异。
过滤、结晶就是常用的分离方法。
进行物质的分离提纯操作时,常常几种分离方法交替使用。
〖观察与思考〗向3mL溴水中加入1mL四氯化碳(CCl4)或苯或汽油,振荡,静置。
观察现象。
分析“性质差异”:①CCl4与H2O互不相溶②溴易溶于CCl4而难溶于水
现象:
3、萃取和分液
萃取:利用物质在的溶剂中的不同,将物质从一种溶剂中转移到另一种溶
剂中,从而进行分离的方法。
萃取剂的选择原则:①
常见的萃取剂:
(酒精能做萃取剂吗?)
分液:分离的两种液体的方法。
分液漏斗的使用:
1.检验分液漏斗活塞和上口的玻璃塞是否漏
液,如何检漏?
2.分液时,为什么要打开上口塞子,或者是
使塞子上的凹槽对准瓶口的小孔呢?
3.操作:待液体分层后,将分液漏斗上的
________打开,再将分液漏斗下面的________拧开,使下层液体沿__________流下。
上层液体从分液漏斗________倒出。
〖观察与思考〗课本P20某些地区的自来水中含有Fe2+,如何用实验的方法获得少量的纯净的水?
交流与讨论:①方法1:
②方法2:
思考:从可行性和可操作性上分析选择方法。
分析“性质差异”:对几种液体的混合物,将液体加热时,沸点低的先气化,沸点高的后气化,因而,可利用物质的不同,通过“”
的方法,来分离物质。
4、蒸馏(分馏)
(1)定义:将液态物质至沸点,使之,然后将蒸气重新为液体的操作过程。
(2)适用:分离的液体混合物,也可除去水等液体中难挥发或不挥发的杂质。
如:
(4)主要玻璃仪器:
注意事项:
1.碎瓷片的作用是
2.温度计水银球的位置:
3.冷凝水的方向
5、层析
1:层析:根据混合物中各物质被吸附性能的不同,将溶
解在某溶剂中的混合物分离的方法。
2:适用于:微量物质的分离。
纸层析法最初由植物学家发现并用来分离色素。
【迁移应用】
1.进行过滤操作应选用的一组仪器是()
A.滤纸、烧杯、试管夹、漏斗、玻璃棒B.烧杯、酒精灯、试管、漏斗
C.漏斗、玻璃棒、烧杯、铁架台、滤纸D.玻璃棒、滤纸、烧瓶、漏斗、铁架台2.下列混合物能用过滤法分离的是()
A.汽油和水B.食盐和蔗糖
C.泥沙和食盐D.铜粉和铝粉
3.选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.萃取分液法B.加热分解法C.结晶法
D.分液法E.蒸馏法F.过滤法
(1)分离饱和食盐水与沙子的混合物________。
(2)从硝酸钾和氯化钠的混合溶液中获得硝酸钾________。
(3)分离水和汽油的混合物________。
(4)分离四氯化碳(沸点为76.6℃)和甲苯(沸点为110.6℃)的混合物________。
(5)从碘的水溶液里提取碘________。
学习效果评估
1、通过加水溶解、过滤、蒸发可以分离的固体混合物是()A.硝酸钾、食盐B铜粉、硫酸铜C氢氧化铜、氢氧化铁D.氯化钾、氯化银2.下列各组物质中,可按溶解、过滤、蒸发的操作顺序分离的是()
A.氧化铜和炭粉B.硝酸钾和氯化钠
C.水和酒精D.碳酸钠和硫酸钡
3.现有三组溶液:①汽油和氯化钠溶液②39%的乙醇溶液⑧氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是()
A.分液、萃取、蒸馏B.萃取、蒸馏、分液
C.分液、蒸馏、萃取D.蒸馏、萃取、分液
4.已知丙酮(C3H6O)通常是无色液体,可溶于水,密度小于1 g·mL-1,沸点约为56℃。
要从水与丙酮的混合物里将丙酮分离出来,下列方法中,最合理的是()
A.蒸馏B.升华C.过滤D.蒸发
5.将体积比为1∶2的四氯化碳和碘水在试管中充分混合后静置。
右图示现象正确的是()
6.下列制取蒸馏水的实验装置与操作的说法中,不正确的是()
A.温度计的水银球应插入蒸馏烧瓶中的自来水中
B.冷凝管中的水流方向是从下口进入,上口排出
C.实验中需要在蒸馏烧瓶中加入几粒碎瓷片,防止出现暴沸现象
D.蒸馏烧瓶必须垫石棉网
7.下列实验操作中错误的是()
A.进行蒸发操作时,不能使混合物中的水分完全蒸干
B.进行蒸馏操作,有时可不使用温度计
C.进行萃取操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
8.在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。
