化合物[(C36H36N24O12)ErNa(NO3)Cl(H2O)4]·(NO3)2·5H2O的合成和晶体结构
2024年浙江省高中化学奥林匹克竞赛模拟试卷(含答案与解析)_3084

2024年浙江省高中奥林匹克竞赛模拟试题化学考生须知:1.全卷分试题卷和答题卡两部分,所有试题均为选择题,共80题。
2.本卷答案必须做在答题卡上,做在试题卷上无效。
考后交答题卡。
必须在答题卡上写明姓名、学校、考点、考场和准考证号,字迹清楚。
同时用2B铅笔填涂准考证号。
3.答题时,请用2B铅笔将答题卡上对应题目的答案标号涂黑。
4.可以使用非编程计算器。
一、单选题1. 下列物质都能与浓热氢氧化钠溶液反应,产生气体与众不同的是A. AlB. SiC. PD. B2. 某铼(Re)的氯化物,它可由CCl4和Re2O7在封闭管中子400℃反应而成。
在晶态时,用X射线测得其结构为二聚体,该二聚体为两个八面体共用一条棱得到,则该二聚体的化学式为A. ReCl8B. ReCl7C. ReCl6D. ReCl53. 缺铁性贫血是世界上最普遍的营养性问题,一个简单的解决办法是生产铁强化酱油,即在酱油中加入易吸收铁的添加剂——Na2FeY,其中Y4-是乙二胺四乙酸(H4Y)的酸根形式,H4Y结构如下左图。
生产铁强化酱油产生的废水可用绿色消毒剂X(如下图)来杀菌。
下列有关说法正确的是A. 从酸碱质子理论来说,H4Y只有酸性B. H6Y2+只有4个pKa数值C. [FeY]2-即[FeEDTA]2-,亚铁离子周围6配位,形成6个五元环D. X能够杀菌的原因是其水解可产生次氯酸4. 元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),与中学常见的长式元素周期表相比,第一到第十八可看成族,⑩为Fe元素。
由扇形周期表的填充规律,下列有关已填入的元素说法不正确的是A. ⑤处于长式周期表第二周期第VIA族B. ②最高价氧化物水化物能与⑦的最高价氧化物反应C. ①与③均可形成既含极性键又含非极性键的化合物D. ⑩单质能与CO形成两种稳定配合物Fe(CO)5和Fe(CO)65. 胂(AsH3)是非常毒的气体,受热分解成两种单质。
:饲料添加剂安全使用规范(2021修订版)

附件:饲料添加剂平安使用标准注1:由于测定方法存在精密度和准确度的问题,局部维生素类饲料添加剂的含量规格是范围值,假设测量误差为正,那么检测值可能超过100%,故局部维生素类饲料添加剂含量规格出现超过100%的情况。
钴:来自以下化合物硫酸钴Cobalt sulfateCoSO4CoSO4·H2OCoSO4·7H2O化学制备≥≥≥≥≥≥养殖动物牛、羊0.1~0.3鱼类0~12—氯化钴CobaltchlorideCoCl2·H2OCoCl2·6H2O化学制备≥≥≥≥—乙酸钴Cobalt acetateCo(CH3COO)2Co(CH3COO)2·4H2O化学制备≥≥≥≥牛、羊0.1~0.4鱼类—碳酸钴CobaltcarbonateCoCO3化学制备≥≥反刍动物牛、羊—硒:来自以下化合物亚硒酸钠SodiumseleniteNa2SeO3化学制备≥〔以干基计〕〔以干基计〕养殖动物畜禽0.1~0.3鱼类使用时应先制成预混剂,且产品标签上应标示最大硒含量酵母硒Seleniumyeast complex酵母在含无机硒的培养基中发酵培养,将无机态硒转化生成有机硒发酵生产—有机形态硒含量≥产品需标示最大硒含量和有机硒含量,无机硒含量不得超过总硒的2.0%铬:来自以下化合物烟酸铬Chromiumnicotinate化学制备≥≥生长肥育猪饲料中铬的最高限量是指有机形态铬的添加限量吡啶甲酸铬Chromiumtripicolinate化学制备≥常量元素化合物通用名称化合物英文名称化学式或描述来源含量规格,%适用动物在配合饲料或全混合日粮中的推荐添加量,%在配合饲料或全混合日粮中的最高限量,%其他要求以化合物计以元素计。
考研有机化学真题及答案

D. LiAlH4 )
H 3C
A.
CH 3 C C C C2H5
B.
M e2 H C C C2 H5
D.
O CH 3 C C O CH 3
C2 H 5
H 3C
C.
CH3 C C C O C H3
H3 C O
H3 CO C Br
CO CH 3 Br
D. I2 /OH-(aq)
6. 区别安息香和水杨酸可用下列哪种方法?( ) A. NaOH(aq) B. Na2 CO3 (aq) C. FeCl 3 (aq) 7. 比较下列化合物的沸点,其中最高的是( )
Ο 1.(5') O
Ο 2. (5') R 3. (6')
OH H+ OH
NH2 NH 2,KOH R' (HOCH 2 CH 2 )2 O,∆ O R' R-CH2 -R' R' Ο
O R' R' + OH R''O
+ R''OH + CO 2 ↑
4. (6 分)下列反应中 A 、B、 C 三种产物不能全部得到,请判断哪一些化合物不能得到,并写出合适的反 应机理说明此实验结果。
OH A CH3CH2OH B CH3OH C NO2 D O2N
)
2
OH
8. 指出下列哪一个化合物的紫外吸收光谱波长最短(
考研有机化学真题及答案 2010 年 3 月 3 日最后更新
A
B
C
D
)
9. 下列化合物在常温平衡状态下,最不可能有芳香性特征的是(
O A Ο B O
O C
ΝΗ D
二溴-3-次氮基丙酰胺_分子式__概述说明以及解释

二溴-3-次氮基丙酰胺分子式概述说明以及解释1. 引言1.1 概述二溴-3-次氮基丙酰胺(英文名:dibromochloropropanamide,化学式:C₃H₅Br₂ClNO)是一种有机化合物。
它的分子结构中含有两个溴原子和一个氯原子,以及一个次氮基和一个丙酰胺官能团。
由于其独特的结构和性质,二溴-3-次氮基丙酰胺在许多领域具有重要的应用价值。
1.2 文章结构本文首先介绍二溴-3-次氮基丙酰胺的分子式、特性和合成方法,在第二部分探讨其在医药领域、农业领域以及其他相关领域中的应用。
接下来,我们将详细地讨论二溴-3-次氮基丙酰胺的安全性和环境影响,包括毒理学研究、生态风险评估以及相应的安全措施和规范限制。
最后,我们得出结论并展望未来可能的研究方向。
1.3 目的本文旨在提供关于二溴-3-次氮基丙酰胺的全面概述和解释。
通过对其分子式、特性、合成方法以及各个应用领域的讨论,读者可以更好地了解该化合物的基本信息和重要作用。
同时,我们还将关注二溴-3-次氮基丙酰胺的安全性问题,包括毒理学研究和生态风险评估,以提醒人们在使用该化合物时需采取相应的安全措施。
2. 二溴-3-次氮基丙酰胺2.1 分子式二溴-3-次氮基丙酰胺的分子式为C5H7Br2N2O。
它是一种有机化合物,由碳、氢、溴、氮和氧元素组成。
2.2 特性和性质二溴-3-次氮基丙酰胺是一种无色至浅黄色的固体。
其熔点约为50℃,并具有较低的挥发性。
该化合物在常温下相对稳定,并可溶于多种有机溶剂如乙醇、二甲基甲酰胺和甲苯等。
它具有相对较高的表面张力,可溶于水中。
2.3 合成方法二溴-3-次氮基丙酰胺可以通过反应原料丁二醇与亚硝酸铵和两个碘源(如HBr 和亚硫酸钠)在适当反应条件下制得。
合成反应通常在惰性气体保护下进行,以避免空气中存在的湿度引起不必要的反应副产物。
该合成方法需要仔细控制反应温度和时间,以确保产率和产物的纯度。
产生的二溴-3-次氮基丙酰胺可经过晶体化纯化来获得高纯度的产物。
戈那瑞林

化合物简介
基本信息
物化性质
基本信息
中文名称:戈那瑞林 中文别名:黄体激素释放激素 英文名称:gonadorelin 英文别名:Glp-His-Trp-Ser-Tyr-Gly-Leu-Arg-Pro-Gly-NH2;(pyroglutamic acid)-His-Trp-SerTyr-Gly-Leu-Arg-Pro-Gly-NH2;Gonadorelin;GONADERELIN;luteinizing hormone-releasing hormone isoform I; CAS号:-09-2 分子式:C55H75N17O13 分子量:1182. 结构式: 精确质量:1181. PSA:472.
适应症
1.用于诊断下丘脑-垂体-生殖腺功能障碍。 2.治疗闭经与促性腺激素分泌不足和多滤泡性卵巢引起的不孕症。 3.戈那瑞林或其同类物布舍瑞林、戈舍瑞林、亮丙瑞林、那法瑞林和曲普瑞林还可用于避孕、隐睾症、恶性 肿瘤(尤其前列腺癌)、延迟的和提前的青春期。 4.还可用于子宫内膜异位。 5.用于促排卵以治疗下丘脑性闭经所致不孕、原发性卵巢功能不足,特别是对氯米芬无效的患者。 6.还用于小儿隐睾症及雄激素过多、垂体肿瘤等。 。
氨基酸比值取本品约2mg,置10ml量瓶中,加6mol/L盐酸溶液使溶解并稀释至刻度,摇匀,量取1ml置2ml硬 质安瓶中,在-5℃减压封口,置110℃加热24小时,冷却,启封,将内容物移至蒸馏瓶中,在减压下蒸干,残留物 加0.02mol/L盐酸溶液1ml溶解,摇匀,作为供试品溶液;另取与供试品溶液浓度相应的各个氨基酸对照品混合溶 液,作为对照品溶液。精密量取上述两种溶液各20μl,分别注入氨基酸分析仪,记录色谱图,按外标法以峰面 积计算,即得。以L一组氨酸、L一谷氨酸、L一亮氨酸、L一脯氨酸、甘氨酸和L一精氨酸摩尔数之和的七分之一 值为1,供试品溶液中各个氨基酸相应的摩尔比应符合以下规定:L一丝氨酸为0.7—1.05,L一谷氨酸为0.9—l.
2025届重庆高三上学期9月大联考化学试题+答案

名校方案 重庆市2025届高三9月考试化 学 试 题注意事项:1.答卷前,考生务必将自己的姓名、准考证号等填写在答题卡和试卷指定位置上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其他答案标号。
回答非选择题时,将答案写在答题卡上。
写在本试卷上无效。
一、选择题:本题共14小题,每小题3分,共42分。
每小题给出的四个选项,只有一项符合题目要求。
1.化学与生产、生活密切相关,下列说法错误的是A .推广使用可降解塑料聚乳酸,能减少白色污染B .三星堆青铜大立人以合金为材料,其深埋于地下生锈是因为发生了析氢腐蚀C .液晶既有液体的流动性、形变性和黏度,又有类似晶体的各向异性D .汽车防冻液的主要成分为乙二醇,其沸点高的原因是易形成分子间氢键 2.下列化学用语或图示表达正确的是A .3NH 分子的VSEPR 模型:B .硼的基态原子轨道表示式:C .顺-2-丁烯的结构简式:D .()3232CH CH CH CH 的名称:3-甲基戊烷 3.下列相关离子方程式书写正确的是A .向32Mg(HCO )溶液中加入过量的NaOH 溶液:223332Mg 2HCO 2OH MgCO CO 2H O +−−−++=↓++ B .Na[Al (OH )4]溶液与NaHCO 3溶液混合:()()-243-2-33Al OH +HCO =Al OH +H O+CO ↓ C .向硫酸铜溶液中加入NaHS 溶液生成黑色沉淀:Cu 2++S 2-=CuS↓D .3AgNO 与过量浓氨水反应的离子方程式:324Ag NH H O AgOH NH +++⋅=↓+ 4.化合物Z 是一种合成药物的重要中间体,可由X 经两步反应合成,其路线如图。
下列说法正确的是A .Z 的分子式为12152C H NOB .反应①是加成反应C .Y 既能与酸反应又能与碱反应D .X 、Y 、Z 分子中的含氧官能团的种数相等5.我国学者把游离态氮固定在碳上(示踪反应如下),制得的[]2NC N −==离子可用于合成核酸的结构单元。
大学有机化学推断结构试题A及答案解析

3008
化合物A(C6H5NO3SBr2),经重氮化后与H3PO2/H2O共热得到B(C6H4SO3Br2)。B在H2SO4存在下,用过热蒸气处理得到C(C6H4Br2), A可由对氨基苯磺酸经一步反应得到。试推出A,B,C的结构式。
9. 6分(3009)
3009
根据下列反应推出化合物(A)(B)(C)(D)的结构。
18. 8分(3018)
3018
化合物A含C 88.7%,H 11.2%,相对分子质量为108,当以Pd-BaSO4-喹啉催化加氢,能吸收1molH2,得到B若A完全催化还原,则可吸收3molH2。得知A的结构有两个甲基。B经臭氧化再还原水解得到CH2O和一个二醛C,A与Ag(NH3)2+作用有白色沉淀生成。B与马来酐作用时没有Diels-Alder加成物生成。推出A,B,C的可能结构。
4. 4分(3004)
3004
化合物C4H6O2在1721cm-1显示一个很强的吸收带,它的NMR谱只有一个单峰,试推断其结式:
5. 6分(3005)
3005
化合物A(C5H10O4),用Br2/H2O氧化得到酸C5H10O5,这个酸易形成内酯。A与Ac2O反应生成三乙酸酯,与苯肼反应生成脎。用HIO4氧化A,只消耗1molHIO4。试推出A的结构式:
16. 6分(3016)
3016
推测C11H16结构,指明峰的归属。已知其NMR为(/):7.15(5H),单峰;2.48(2H),单峰;
0.9(9H),单峰。
17. 6分(3017)
3017
化合物A和B,分子式都是C6H8。A经臭氧氧化还原水解后再与吐伦试剂作用,只得到一种二元酸。此酸热分解得到乙酸。B用同样方法处理后得到两种二元酸,其中一种能使KMnO4溶液褪色,另一种受热后得到环状酸酐。推出A和B的结构。
有机化学 第四版 课后答案
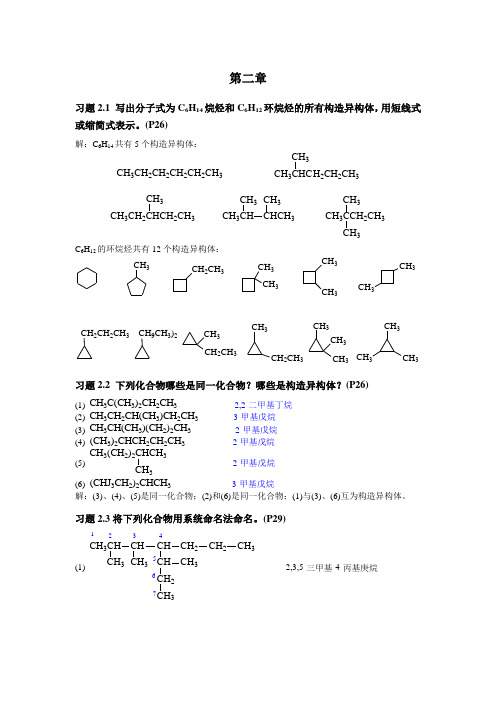
第二章习题2.1 写出分子式为C 6H 14烷烃和C 6H 12环烷烃的所有构造异构体,用短线式或缩简式表示。
(P26)解:C 6H 14共有5个构造异构体:CH 3CH 2CH 2CH 2CH 2CH 3CH 3CHCH 2CH 2CH 3CH 3CH 3CH 2CHCH 2CH 3CH 3CH 3CCH 2CH 3CH 3CH 3CH 3CH CHCH 3CH 3CH 3C 6H 12的环烷烃共有12个构造异构体:CH 3CH 3CH 3CH 3CH 3CH 2CH 3CH 3CH 33CH 2CH 3CH 3CH 2CH 3CH 2CH 2CH 3CH 3CH 3CH 3CH 3CH 3CH 3CH 9CH 3)2习题2.2 下列化合物哪些是同一化合物?哪些是构造异构体?(P26)(1) CH 3C(CH 3)2CH 2CH 3 2,2-二甲基丁烷 (2) CH 3CH 2CH(CH 3)CH 2CH 3 3-甲基戊烷 (3) CH 3CH(CH 3)(CH 2)2CH 3 2-甲基戊烷 (4) (CH 3)2CHCH 2CH 2CH 3 2-甲基戊烷 (5)CH 3(CH 2)2CHCH 3CH 32-甲基戊烷(6) (CHJ 3CH 2)2CHCH 3 3-甲基戊烷解:(3)、(4)、(5)是同一化合物;(2)和(6)是同一化合物;(1)与(3)、(6)互为构造异构体。
习题2.3将下列化合物用系统命名法命名。
(P29)(1)CH 3CH CHCH CH 2CH 2CH 3CH 3CH CH 3CH 2CH3CH 31234567 2,3,5-三甲基-4-丙基庚烷(2)1234567CH 3CH CHCH CH 2CH 2CH 3CH 3CH CH 3CH 3CH 3 2,3-二甲基-4-异丙基庚烷(3)123456CH 3CH CHCH 2CHCH 3CH 3CH 3CH 32,3,5-三甲基己烷习题2.4 下列化合物的系统命名是否正确?如有错误予以改正。
湖大有机化学课后习题及答案

1章思考题1.1 什么是同系列与同分异构现象?1.2 什么叫诱导效应?1.3 影响有机化学反应活性的主要因素有哪些?1.4 在沸点、熔点和溶解度方面,有机化合物和无机盐有哪些差别?1.5 正丁醇的沸点(118℃)比它的同分异构体乙醚的沸点(34℃)高得多,但这两个化合物在水中的溶解度却相同(每100克水溶解8克),怎样说明这些事实?1.6根据共价键的断裂方式推测反应机理的可能类型有哪些?解答1.1 答:具有同一个分子结构通式,且结构和性质相似的一系列化合物称为同系列。
分子式相同而结构相异,因而其性质也各异的不同化合物,称为同分异构体,这种现象叫同分异构现象。
1.2 答:因某一原子或基团的电负性而引起电子云沿着键链向某一方面偏移的效应叫诱导效应。
1.3 答:影响有机化学反应活性的因素主要有三个:底物(反应物)的结构和特性,进攻试剂的性质和反应环境条件(温度、压强、溶剂、反应时间等)。
1.4 答:有机物的沸点、熔点比无机盐低。
在水中的溶解度比无机盐小。
1.5 答:溶解度跟有机物和水分子间形成的氢键有关,因二者和水解都能形成氢键,而沸点与同种物质分子间氢键有关,正丁醇分子间能形成氢键,乙醚分子间不能形成氢键。
1.6 答:自由基反应和离子型的反应。
习题1.1 用系统命名法命名下列化合物。
(1)CH3CH2CHCH3CHOHCHCH2CH2CH3OH(2)CH3CH2CHCH3CHOHCHClCH2CH2CH2CH3(3)CH3CH2CHCH3CHOHCHCH2CH2CH3CH2CH2CH2CH3(4)CH3CH2CHCH3CHCH2CH3CH2CHO(5) COOHCH3CH3(6) COOHCH3NH2(7) COOHNH2NO2(8) COOHNO2(9) COOHCH3(10) NH2(11) COOH(12) NH2CH3(13) SO3HClH2NCH3(14)C Cn-Bun-P rE tM e1.2 写出下列化合物的结构式。
[co(en)3]cl3的命名
![[co(en)3]cl3的命名](https://img.taocdn.com/s3/m/a3eb09ccd1d233d4b14e852458fb770bf78a3b95.png)
标题:[Co(en)3]Cl3的命名一、引言在化学中,命名化合物是十分常见的工作。
正确的命名可以准确地描述化合物的组成和性质,方便科学家之间的交流和理解。
在本文中,我们将探讨一种常见的化合物,即[Co(en)3]Cl3的命名方法。
二、化合物结构和性质1. 结构[Co(en)3]Cl3是一种配位化合物,其中cobalt(Co)离子与三个乙二胺(en)配体形成配合物。
这种化合物的结构十分复杂,其中cobalt 离子与乙二胺配体形成了多个配位键。
2. 性质[Co(en)3]Cl3是一种稳定的化合物,在常温常压下呈现出固体状态。
它具有一定的溶解性,可以溶解于水和一些有机溶剂中。
该化合物具有一定的化学活性,可以发生一系列的化学反应。
三、命名方法根据化学命名的规则,我们可以按照以下步骤来给[Co(en)3]Cl3命名:1. 确定中心离子首先确定中心离子的名称,即含有cobalt的部分。
在这种情况下,中心离子是cobalt离子,其符号为Co。
2. 确定配体名称乙二胺(en)是这种化合物的配体,根据命名规则,我们需要将其按照英文字母的规则转化为名称。
乙二胺的英文名称是ethylenediamine,因此称为ethylenediamine。
3. 确定化合物的综合名称根据配位化合物的命名规则,我们按照中心离子优先的原则,将中心离子的名称放在前面。
然后按照配体的数量,将乙二胺的名称加入到前面所得的名称后面,并在乙二胺的名称前面标明其个数。
结合氯离子,我们可以得到化合物的综合名称为三叔-乙二胺合钴(III)三氯化物。
四、化合物的应用和意义[Co(en)3]Cl3是一种重要的配位化合物,在药物和材料科学领域有着广泛的应用。
由于其良好的稳定性和溶解性,它常被用于合成一些功能性材料,同时也作为一些生物医药品的关键原料之一。
五、结论[Co(en)3]Cl3是一种配位化合物,它的命名方法符合化学命名的基本规则。
对于研究其性质和应用具有重要的意义。
nigellidine结构式

nigellidine结构式"Nigellidine 结构式"是指尼格尔菜碱的结构式。
尼格尔菜碱是一种天然产物,可以从乌药子(Nigella sativa)中提取。
在本文中,我将详细介绍尼格尔菜碱的结构和化学性质,并探讨其在药物研究和医学应用方面的潜力。
首先,我将解释一下尼格尔菜碱的结构。
尼格尔菜碱的分子式为C20H17NO3,它是一个具有独特化学及生物学活性的天然物质。
尼格尔菜碱属于季铵盐类化合物,其分子结构由苯环和咪唑环组成。
苯环上有一个氧原子,而咪唑环上有一个碳氮双键和一个氢原子。
此外,尼格尔菜碱的苯环上还有两个甲基和一个羧基。
接下来,我将讨论尼格尔菜碱的化学性质。
尼格尔菜碱是一种具有碱性的分子,因此它可以和酸反应生成盐。
此外,尼格尔菜碱在水中具有一定的溶解度,但在有机溶剂中更容易溶解。
尼格尔菜碱的热稳定性较高,它可以在高温下保持其化学结构稳定性。
除了尼格尔菜碱的结构和化学性质,它还具有一系列的生物学活性和药理学特性。
尼格尔菜碱具有抗氧化、抗炎和抗肿瘤活性。
研究表明,尼格尔菜碱能够通过多种途径抑制肿瘤细胞的增殖和转移,并诱导肿瘤细胞凋亡。
此外,尼格尔菜碱还具有抗菌、抗病毒和抗真菌活性,对一些致病微生物具有明显的杀菌作用。
尼格尔菜碱在医学上的应用前景也引起了研究人员的关注。
尼格尔菜碱可以作为一种潜在的抗癌药物,用于治疗多种类型的癌症,包括胃癌、肺癌和乳腺癌等。
此外,尼格尔菜碱还被发现对神经退行性疾病具有治疗潜力,如阿尔茨海默病和帕金森病。
尼格尔菜碱还可以用于治疗炎症性疾病,如风湿性关节炎和炎症性肠病。
尽管尼格尔菜碱在药物研究和医学应用方面显示出巨大的潜力,但目前对其药理学机制的研究仍处于早期阶段。
因此,还需要进一步的研究来解析尼格尔菜碱的作用机制,并评估其在临床上的安全性和有效性。
总之,尼格尔菜碱是一种具有独特结构和化学性质的天然产物。
它具有多种生物学活性和药理学特性,包括抗氧化、抗炎、抗肿瘤和抗菌活性。
3,5-二氨基-1,2,4-三氮唑异构体

3,5-二氨基-1,2,4-三氮唑异构体是一种有机化合物,其化学式为C2H4N6。
它可以通过对苯二酸酐与尿素在碱性条件下反应制得。
它是一种重要的化工原料,可用于合成各种有机化合物、药物和染料等。
1. 结构特点3,5-二氨基-1,2,4-三氮唑异构体是一种杂环化合物,其分子中含有两个氨基和三个氮原子。
其分子结构中的三个氮原子呈现出环状排列,其中两个氮原子与相邻的碳原子形成共轭双键,使得分子具有较高的稳定性。
另外,分子中的两个氨基可以参与反应,具有一定的化学活性。
2. 合成方法3,5-二氨基-1,2,4-三氮唑异构体可以通过对苯二酸酐与尿素在碱性条件下反应制得。
其合成过程较为简单,反应条件温和,且反应产率较高。
这种合成方法在工业生产中得到了广泛应用。
3. 应用领域3,5-二氨基-1,2,4-三氮唑异构体是一种重要的化工原料,具有广泛的应用领域。
- 可用于合成化学品。
由于其分子中含有较多的氨基和氮原子,因此可以用于合成具有特殊结构和功能的化学品,如药物、染料、橡胶助剂等。
- 用于制备有机合成试剂。
3,5-二氨基-1,2,4-三氮唑异构体可以作为有机合成试剂的前体,参与碳-氮键的形成,从而制备出具有特殊结构和性能的有机合成试剂。
- 用于农药生产。
在农药生产中,3,5-二氨基-1,2,4-三氮唑异构体可以作为重要的中间体,用于合成具有杀虫、除草、杀菌等作用的农药。
4. 研究进展近年来,对3,5-二氨基-1,2,4-三氮唑异构体的研究逐渐受到重视。
在合成方法上,研究者们不断探索新的合成途径,提高产率,减少污染。
针对其在有机合成和农药领域的应用,也进行了深入研究,通过改良合成方法,拓展其在更多领域的应用。
总结:3,5-二氨基-1,2,4-三氮唑异构体作为一种重要的有机化合物,具有广泛的应用前景。
随着人们对其研究的深入,相信它将在更多领域得到应用,并为化工行业的发展带来新的机遇。
3,5-二氨基-1,2,4-三氮唑异构体在近年来得到了广泛的关注和研究。
1,6-双(N,N′_-二苄基硫代氨基甲酰二硫)己烷的制备及结构表征

500
400
300
200
100
ֽःϘmV
0
5 10 15 20 25 30 35
ௐᫍmin
1 实验 1. 1 主要试剂
二 苄 胺、氢 氧 化 钠、二 硫 化 碳、二 氯 己 烷 和 硫 代硫酸钠,化学纯,天津市科密欧化学试剂有限公 司产品。 1. 2 主要测试仪器
Spectrum100型FTIR仪,美 国 珀 金 埃 尔 默 仪 器 有 限 公 司 产 品;Star System型DSC仪,瑞 士 梅 特 勒-托 利 多 公 司 产 品;LC-20AD型HPLC仪,日
Copyright©博看网. All Rights Reserved.
688
橡 胶 工 业
2020年第67卷
本岛津公司产品;Vario ELⅢ型元素分析仪,德国 Elementar公司产品。 1. 3 试样制备
将40 g二苄胺、8. 4 g氢氧化钠以及适量的去 离子水加入到四口瓶中,充分搅拌,缓慢滴加15. 2 g二硫化碳,滴加过程中应控制滴加速度并保持反 应温度不超过40 ℃,滴加完毕后反应1 h,得到二 苄 胺 二 硫 代 氨 基 甲 酸 钠 中 间 体 水 溶 液,备 用。 将 15. 5 g二氯己烷和25 g硫代硫酸钠加入到另一个 装 有 去 离 子 水 的 四 口 烧 瓶 中,升 温 至 回 流 状 态 下 反应12 h,得到六亚甲基1,6-二硫代硫酸二钠中 间体水溶液。将第1步制备的二苄胺二硫代氨基 甲酸钠中间体水溶液通过恒压漏斗缓慢滴加入该 反应体系,回流状态下反应1. 5 h,对反应物进行过 滤、水洗、干燥,得到目标产物1,6-双(N,N′ -二苄 基硫代氨基甲酰二硫)己烷。 1. 4 测试表征 1. 4. 1 FTIR分析
上海风华初级中学高中化学选修二第二章《分子结构与性质》检测卷(有答案解析)

一、选择题1.(0分)[ID:139530]下列比较正确的是A.电负性:H>BB.键角:PH3>NH3C.第一电离能:I1(S)>I1(P)D.分子的极性:OF2>H2O2.(0分)[ID:139595]下列叙述中正确的是A.能电离出H+的化合物除水外都是酸,分子中含有几个氢原子它就是几元酸B.无机含氧酸分子中含有几个羟基,它就属于几元酸C.H3PO4和H2CO3分子中非羟基氧的个数均为1,但它们的酸性不相近,H3PO4是中强酸而H2CO3是弱酸D.同一元素的含氧酸,该元素的化合价越高,其酸性越强,氧化性也越强3.(0分)[ID:139592]下列说法不正确的是A.C3H8中碳原子都采用的是sp3杂化B.BeCl2、CO2、N2都是非极性分子C.酸性:H2CO3<H3PO4<H2SO4<HClOD.CO的一种等电子体为NO+,它的电子式为[∶N⋮⋮O∶]+4.(0分)[ID:139591]某学生做完实验后,分别采用以下方法清洗仪器,其中应用“相似相溶”规律的是A.用稀硝酸清洗做过银镜反应的试管B.用浓盐酸清洗做过高锰酸钾分解实验的试管C.用氢氧化钠溶液清洗盛过硅酸的试管D.用四氯化碳清洗做过碘升华实验的烧杯5.(0分)[ID:139584]氨基乙酸铜是一种有机原料,其分子结构如图。
下列关于该物质的说法正确的是A.其熔点主要取决于所含化学键的键能B.分子中O和N的杂化方式相同C.其组成元素的基态原子中,含有未成对电子数最多的是ND.分子中所有原子共平面6.(0分)[ID:139583]X、Y、Z、W为四种短周期主族元素,Z的原子序数等于其它三种原子序数之和,它们最外层电子数的关系为n(W)+n(X)=n(Y)=n(Z),化合物M与N均由这四种元素组成,它们有如下性质:下列说法一定正确的是A.原子半径:X>Y B.X、Y、W三种元素形成的酸可能是弱酸C.最简单气态氢化物沸点:Z>Y D.X与W形成的化合物不可能有非极性键7.(0分)[ID:139577]短周期主族元素X、Y、Z、W的原子序数依次增加,K、L、M均是由这些元素组成的氧化物,甲、乙分别是元素Y、W的单质,甲是常见的固体,乙是常见的气体。
[co(nh3)6]br3配合物的名称
![[co(nh3)6]br3配合物的名称](https://img.taocdn.com/s3/m/c89ff2ef2dc58bd63186bceb19e8b8f67d1cef70.png)
[co(nh3)6]br3配合物的名称配位化合物的命名配体的种类很多,必须有统一的名称。
最常见的配体列在下面F-氟Cl-氯OH-羟CN-氰O2-氧 O22-过氧根SO42-硫酸根 N3-叠氮NO2-硝基ONO-亚硝酸根-SCN- 硫氰根-NCS-异硫氰根C6H5 -苯基py ()吡啶en 乙二胺Ph3P 三苯基膦NO 亚硝酰CO 羰基H2O 水NH3 氨(O2)双氧1.配位化合物内外界之间的连缀词在配位化合物中,先阴离子,后阳离子。
[ Co(NH3)5 H2O ] Cl3三氯化五氨•水合钴(III)Cu2 [ SiF6 ]六氟合硅(IV)酸亚铜阴阳离子之间加”化” 字或“ 酸”字,配阴离子看成是酸根。
[ Co(NH3)5 H2O ] Cl3三氯化五氨•水合钴(III)Cu2 [ SiF6 ]六氟合硅(IV)酸亚铜1.配位单元在配位单元中,先配体后中心,配体与中心之间加”合”字。
[ Co(NH3)5 H2O ] Cl3三氯化五氨•水合钴(III)Cu2 [ SiF6 ]六氟合硅(IV)酸亚铜配体前面用二、三、四· · ·[ Co(NH3)5 H2O ] Cl3三氯化五氨•水合钴(III)Cu2 [ SiF6 ]六氟合硅(IV)酸亚铜[ Co(NH3)5 H2O ] Cl3三氯化五氨•水合钴(III)Cu2 [ SiF6 ]六氟合硅(IV)酸亚铜几种不同的配体之间加“ • ”隔开。
[ Co(NH3)5 H2O ] Cl3三氯化五氨•水合钴(III)Cu2 [ SiF6 ]六氟合硅(IV)酸亚铜中心后面加(),内写罗马数字表示中心的化合价。
1.配体的先后顺序在配位单元中,可能涉及多种配体,所以要明确规定命名时配体的次序。
下述的每条规定均以其前一条规定为基础。
① 先无机配体后有机配体。
[ PtCl(2 Ph3P)2 ]二氯•二(三苯基膦)合铂(II)② 先阴离子类配体,后阳离子类配体,最后分子类配体。
中学化学中出现的化合物NCl3的化合价的理论说明

中学化学中出现的化合物NCl3的化合价的理论说明中学化学题中,有时会出现NCl3的身影,但对其分子中各元素的化合价一直存在争议。
目前有两种观点:①氮为+3价,氯为-1价②氮为-3价,氯为+1价观点①:根据鲍林电负性标度,氮的电负性为3.04,氯的电负性为3.16。
说明氯的电负性稍大于氮,根据一般性规则,电负性大的显负价,所以观点①应当是正确的。
据此推测NCl3的水解水解式如下:NCl3+H2O→HNO2+HCl。
但根据实验证实NCl3的水解反应方程式应当如下:第一步:NCl3+H2O→NH3+HClO,由于HClO的强氧化性,再发生第二步反应:NH3+HClO→N2+HCl+ H2O。
可见由理论推出的观点①与实验事实是不相符的。
再来看观点②:根据阿莱-罗周电负性标度给出的ΧN=3.07,ΧCl=2.83(Χ是希腊字母,通常用来表示电负性)可以看出,NCl3中Cl的正电性较大,亲电子能力较强,易接受水中氧原子(亲核体)的进攻。
所以N显-3价,Cl显+1价,这样就能很好解释上述实验证实的水解反应历程。
由此再结合实验事实不难看出观点②比观点①更合理。
另一方面,从Linus Pauling给出的电负性标度同样可以给出合理的解释,使得观点②比①更据说服力。
具体解释如下:氮和氯的电负性差值并不大,而氮原子的半径相对于氯原子来说要小得多。
因此共用电子相对来讲应当更偏向于氮,使得氮显-3价,氯显+1价。
在有些网站上有这样的说法:根据实验得出的第一个方程式,再根据水解反应是非氧化还原反应可得出观点②是正确的。
这种说法是不准确的,因为不是所有的水解反应都是非氧化还原反应。
例如氢化铝锂与水的反应(个人认为这个反应既是一个水解反应又是一个氧化还原反应)综上,观点②应当比观点①更加合理。
所以几乎所有的中学教辅书以及百度百科上在提及该问题时都使用的观点②。
﹉﹉﹉﹉﹉﹉﹉﹉﹉﹉﹉﹉﹉﹉分割线以上仅鄙人目前所知,若有不正确之处还望各位dalao批评指正。
结晶紫分子量

结晶紫分子量结晶紫是一种有机化合物,化学式为C16H12N3Cl,其分子量是多少呢?分子量是指一个分子含有的所有原子的质量之和。
在计算结晶紫的分子量时,我们需要了解每个原子的相对原子质量,并将它们相加。
结晶紫的化学式中包含碳、氢、氮和氯这四种元素。
我们可以通过查找元素周期表获得这些元素的相对原子质量。
根据元素周期表的数据,碳的相对原子质量为12.01,氢的相对原子质量为 1.01,氮的相对原子质量为14.01,氯的相对原子质量为35.45。
根据这些数据,我们可以计算结晶紫的分子量。
首先,我们需要计算出各个原子在分子中的个数。
根据化学式C16H12N3Cl,我们可以得知结晶紫中含有16个碳原子,12个氢原子,3个氮原子和1个氯原子。
然后,我们将每个原子的相对原子质量与其在分子中的个数相乘,然后将所有结果相加。
计算过程如下:(16 × 12.01) + (12 × 1.01) + (3 × 14.01) + (1 × 35.45) = 192.16 + 12.12 + 42.03 + 35.45 = 281.76因此,结晶紫的分子量为281.76。
结晶紫是一种有机染料,常用于染料工业中。
它具有紫色的结晶状外观,因此得名结晶紫。
结晶紫具有很强的染色能力,可以在纺织品、皮革、纸张等材料上形成持久的紫色染料。
由于其良好的染色性能和稳定性,结晶紫被广泛应用于纺织、印刷和染色等行业。
除了用作染料外,结晶紫还具有一定的生物活性。
研究表明,结晶紫具有抗氧化、抗菌和抗肿瘤等作用。
这些特性使得结晶紫在医药领域具有一定的应用潜力。
研究人员正在探索结晶紫作为抗菌剂、抗氧化剂以及抗肿瘤药物的可能性。
结晶紫是一种分子量为281.76的有机化合物。
它是一种常用的染料,具有良好的染色性能和稳定性。
此外,结晶紫还具有一定的生物活性,具有抗氧化、抗菌和抗肿瘤等作用。
随着对结晶紫的研究深入,相信它在染料工业和医药领域的应用会更加广泛。
n-(1-萘基)乙二胺盐酸盐化学式

n-(1-萘基)乙二胺盐酸盐化学式
摘要:
1.n-(1-萘基) 乙二胺盐酸盐的化学式定义
2.化学式中各部分的含义
3.n-(1-萘基) 乙二胺盐酸盐的性质和用途
正文:
-(1-萘基) 乙二胺盐酸盐的化学式为C12H16Cl2N2,是一种有机化合物。
它由一个萘基(-C10H7-) 和一个乙二胺基(-NH2CH2CH2-) 组成,并在两个胺基上各带有一个盐酸基团(-Cl)。
化学式中的各个部分都有其特定的含义。
萘基代表分子中的芳香环结构,通常具有特殊的物理和化学性质。
乙二胺基则是两个胺基(-NH2) 与一个亚甲基(-CH2-) 相连接的结构,具有胺的性质,能与其他分子中的官能团发生反应。
盐酸基团则是氯原子(-Cl) 与氢原子(-H) 的结合,代表了分子中的一部分酸性基团。
-(1-萘基) 乙二胺盐酸盐具有多种性质和用途。
作为一种胺类化合物,它能与其他胺类、酸类和醇类等化合物发生反应,形成新的化合物。
在工业上,它可以用作染料、制药和塑料等行业的原料。
此外,由于其特殊的物理和化学性质,它也可能在生物和医学领域中发挥作用。
然而,需要注意的是,n-(1-萘基) 乙二胺盐酸盐是一种有毒物质,其使用需要严格遵循安全规程。
ncl3的路易斯构式 -回复

ncl3的路易斯构式-回复NCl3的路易斯构式:NCl3是指三氯化氮,它是一种无机化合物,由氮和氯元素组成。
在化学中,路易斯结构是描述分子中原子之间的键和孤对电子的一种有效方法。
通过路易斯结构,我们可以更好地理解分子的化学性质和反应机理。
在本文中,我们将一步一步地讨论NCl3的路易斯构式。
首先,我们需要了解NCl3分子的成分。
根据化学式,NCl3由一个氮原子和三个氯原子组成。
氮元素在化学中通常以"N"表示,氯元素以"Cl"表示。
现在,让我们着眼于氮原子。
氮原子位于周期表的第15族,这意味着它有五个价电子。
根据元素的特点,氮原子可容纳八个价电子,这是通过与其他原子共享或接受电子来实现的。
接下来,我们将考虑氯原子。
氯原子是第17族的元素,拥有七个价电子。
为了确定NCl3的路易斯结构,我们需要将这些电子放置在原子周围。
根据化学键的形成规则,氮原子可以发生多种共享和配位键的形式。
为了简化描述,我们将使用直线来表示共享键和孤对电子。
首先,让我们在氮原子周围放置五个电子,表示氮原子的价电子。
我们可以选择将其中的三个与三个氯原子进行共享,形成氮和氯之间的共价键。
这样,氮原子周围将出现三个共享键。
接下来,让我们考虑氯原子。
由于氯原子处于第17族,它只需要一个电子才能达到八个价电子的稳定状态。
因此,我们可以将氯原子周围的各自共享键与氮原子的一个孤对电子配对,确保每个氯原子都具有八个价电子。
根据以上描述,我们可以得出NCl3的路易斯结构为:ClCl - N - ClCl在这个结构中,氮原子与三个氯原子之间存在三个共价键,每个氯原子都与氮原子的一个孤对电子形成配对。
每个氯原子和氮原子周围都存在八个价电子,满足化学键的形成规则。
通过分析NCl3的路易斯结构,我们可以更好地理解分子的几何形状和化学性质。
此结构中的共价键角度约为107度,因为氮原子的孤对电子对共价键有轻微的斥力影响。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
s as a b 软件 。 d 结构解析采用 S E X L5 0 H L T ( 1 版本) , . 程序 单胞所属晶系和空间群 由 Wi X 1 4 n . 辅助 G 6 验证 , 外加其图形操作软件 O T P 3 R E 一 。所有 的非氢原子采用全矩阵最小二乘法( 1 m tx es f1 ail t u一 r a — surs enm n bsdo 2 q a f e et ae nF ) e ri 进行结构精修。所有非氢原子都做各向异性精修。有机配体上的氢 原子是几何对称产生的(~ = . h N H 0 0 ) C H 0 6 , — = . A 。所有 的氢原子都设定在相同的各 向同性温度因 9 9
关键词 : 瓜环 ; 自组装; 单晶 x 射 线衍射 一
中图分类号 : 6 43 O 1. 文献标 志码 : A 文章编号:0 8 3 2 (0 0 0- 0 6 0 10 — 4 12 1 )2 0 2 — 5
瓜 环 (uu inu l【 超分 子 化学 中继 冠 醚 (rw t r、 糊 精 (yl e i)杯芳 烃 ccr t ] i l b [ r)】 是 c ne e)环 o h ec dtn 、 o r (axr e之后备受瞩 目的一类新型笼状大环主体分子化合物。 clae ) i n 瓜环以其特有的结构特性和广阔 的应用前景 , 越来越受到主客体化学 、 自组装超分子化学、 环境化学 、 催化 、 材料化学、 生物化学等 国内外相关学科研究者的广泛关注 。瓜环 由于其结构特征, 口羰基氧原子与( 端 配位) 水分子可与
各种金属离子以及金属簇合物或配合物通过氢键等方式相互作用, 形成各种结构特异的自组装实 体或超分子结构[。 r m n 5 Fe a 等人【 用六元瓜环与金属离子形成晶体的特点, 出六元瓜环与硫 , e 6 1 利 制备 酸氢钙的配合物, 首先确定了瓜环为桥式亚甲基连接的甘脲构成的环形笼状化合物。Km等人同 i 利
21 00年第 2期
总第 9 期 8
《 福建师范大学福清分校学报》
J U N LO U I G B AN H O U- N N R A N V R IY O R A FF Q N R C FF JA O M LU I E ST I S m .8 u No9
化合物[ 3 3 2 。 r a O)I O4(0)5 2 ( 6 6 4 2 N ( 3 ( )・ 3"H0 CH N 0) E N C H2 ]N 2 的合成和 晶体 结构
林榕光 , 黄水望 , 慧, 李 林雅 芬 , 薛晓芳
( 福建师范大学福清分校生物与化学工程系, 建福 清 3 0 0 ) 福 5 30
摘
要: 本文合成 了 化合物 [, , 。 ra 0) (’)・ 0)5 2 利 用 x射 线衍射 法测定 了单晶 (6  ̄ N ( 3 H04( 3.H0, cH N E N O ]N 2
11 试 剂 .
六水硝酸铒、 盐酸等都是市售分析纯试剂 , 未经纯化而直接使用。六元瓜环则按照文献进行合 成 和纯化 [。 1 O l
1 实验仪 器及 测试 条件 . 2
收稿 日期 :0 9 1— 7 20 — 2 1
作者简介 : 林榕光( 7 一, 福建 闽侯人 , 1 3 )男, 9 博士, 副教授 , 研究方向: 化学及超 分子化 学。 配位 基金项 目: 福建省 自然科 学基金 资助项 目(o 0 90 0 8, 建省教育厅资助项 目(o B 8 5 ) 建省 大学生创新性实验项 目。 N . 0 J 1 1) 2 福 N . 0 2 2, J 福
第2 期
林榕光 北合物[, , (6 CH N
ra N O
z ・ O_HO 咖 ( b5 ,的合成 和晶体结 构 N ・
2 7
化合物( 的晶体结构测定采用 Bu e S at px20 1 ) rkr m rA e 00型衍射仪 , 测定温度为 2 8 。采用经 9K 石墨单色器单色化的 M ~ 射线 = . 03 ) o K 0 17 ̄作为入射光源 , ( 2 7 以 1 0扫描方式收集衍射点 , ) 一 单
两端的锌水合离子形成一个分子胶囊结构, 并通过锌离子上 的配位水分子分别 与相邻两瓜环端 口
的羰基氧原子通过氢键相互作用形成一维超分子链。 这些研究结果预示, 瓜环在 晶态结构定 向组装
应 用方 面具有 独特 的开发 潜力 。 文通 过六 元瓜 环和铒 (I 子 自组 装反 应 , 成 了一 个新 的超分 本 1) l离 合
子化合物[ 3 EN (O)1 2)・ O) 5 2 , ( H6 02 r a , ( 04 ( 3"H0 并测定了它的晶体结构。 c N ) N C H ]N 2 在这个超分子化合 物的结构 中, 六元瓜环的一边端 口被铒离子和钠离子所封闭 , 形成了一个半包 围的分子胶囊结构 , 分子胶囊与分子胶囊之间通过氢键作用形成一维的超分子链 。 1 实验部 分
用瓜环极性羰基开 口对丁二胺的选择 f包结作用, 生 设计并合成一系列以六元瓜环为主体的类轮烷、 金属离子配位多聚轮烷和分子项链。 ei 等人嘲 Fdn 也曾报导六元瓜环一 稀土金属离子以及六元瓜环一 无机金属簇合物体系结构中存在各种结构特异 的超分子结构 。在 国内, 陈慧兰教授研究组网 利用多 元胺与瓜环形成的类轮烷, 通过钴离子连接, 构成了一维多聚轮烷实体。陶朱课题组呀 0 用六元瓜环 与[n :)2 1 二氧六烷分子作用 , Z ( O + , H ]及 4 每一个六元瓜环分子包结了一个 1 二氧六烷分子, , 4 与瓜环
结构。晶体属正交晶系, 空间群为Pa(,=16(A b1. 8),=1 6( ̄ V 57.2 3 =, n21 a3. 9 ),=4 2( ̄ cl. 8 ), =58 (A’ 3F ) 9 5 8 2 7 2 5) Z
(0)2 5 , - .6 0 w ,01 1 。 0 0= 3 2 R10 0 , R - .79 0 -
