人教版初中化学九下复习课:部分酸碱盐的溶解性 课件精选课件
合集下载
新人教版九年级下册9.2溶解度(共53张PPT).ppt

时间
如何判断一种溶液是否饱和呢?
给你一杯氯化钠溶液,请你判断下它是饱 和还是不饱和溶液?
3、判断溶液是否饱和的方法
一般地说,要确定某一溶液是否饱和, 只要看在一定温度下,有没有不能继续 溶解的剩余溶质存在。如有,且溶质的 量不再减少,那么这种溶液就是饱和溶 液。
2020/9/24
4、物质的结晶
溶质从溶液中以
之间的质量比例关系正确的A是( )
A. 溶液:溶质=21:1 B. 溶剂:溶质=19:1 C. 溶液:溶剂=20:21 D. 溶质:溶液=1:20
2020/9/24
(4)、溶解度与溶解性的关系
难(不)
微
可溶
易
溶
溶
. . .
溶
0.01g 1g
10g
2020/9/24
(5)、溶解度的表示方法
列表法
硝酸钾
质多”这句话对不对? 错 2020/9/24
溶液在一定条件下可分为饱 和溶液和不饱和溶液
浓
溶
液
饱和
不饱和
溶液 稀 溶液
溶
液
不给定条件可分为浓溶液和稀溶液。
2020/9/24
1.1000C硝酸钾饱和溶液冷却至300C,滤去晶体后, 所得溶液是_饱__和_____溶液(饱和、不饱和)。
2.把600C时的氯化铵饱和溶液冷却到100C,有氯化
2020/9/24
2、固体溶解度
(1)在一定温度 下,某固体物质在 100g溶剂里达到
饱和状态时所溶解的质量。
(3)影响因素
(2)
四
一定温度 100g溶剂(一般指水)
温度
要 素
达到饱和
溶质、溶剂 本身的性质
人教版九年级化学第十章酸碱盐复习(共36张PPT)

(11)H2SO4+Ba(NO3)2 H2SO4+Ba(NO3)2=BaSO4↓+2HNO3
(12)KOH+MgCl2 2KOH+MgCl2=Mg(OH)2↓+2KCl
(13)NaNO3+Ca(OH)2 ×
(14)HCl+AgNO3 HCl+AgNO3=AgCl↓+HNO3
(15)Fe+CuCO3
(7)Zn+CuSO4
Zn+CuSO4=Cu+ZnSO4
(8)HCl+BaCO3 2HCl+BaCO3=BaCl2+H2O+CO2↑
(9)H2SO4+Cu(OH)2 H2SO4+Cu(OH)2=CuSO4+2H2O
(10)AgNO3+KCl AgNO3+KCl=AgCl↓+KNO3
2021/1/19
实验方案 步骤一 步骤二(选用试剂并写出相关化学方程式)
方案一
取样2ml于 试管中
稀硫酸或稀盐酸
方案二
取样2ml于 试管中
氢氧化钙或氢氧 化钡溶液
方案三
取样2ml于 试管中
氯化钡或硝酸钡溶液
2021/1/19
练习一
在一种溶液中加入氯化钡溶液,产生白 色沉淀,再加酸,沉淀不溶解,则这种 溶液中
A 一定含有SO42B 可能含有SO42-或 Ag+ C 一定含有SO42-和 Ag+
只给你酚酞请鉴别出NaOH、 H2SO4、NaCl三种无色溶液?
2021/1/19
无色酚酞
装入C试管内的 液体是NaOH
AB
C
2021/1/19
人教版初中化学九下复习课:部分酸碱盐的溶解性 课件

Fe(OH)2
Fe(OH)3
Cu(OH)2
-----
三、盐的溶解性规律
加油站
盐的系统命名
硫酸盐:含硫酸根离子的盐 如:Na2 SO4 Mg SO4 Al2 (SO4)3
FeSO4
钠盐:含钠离子的盐
如:NaNO3 Na2 SO4 Na2 CO3
思考:铵盐是含
的盐
如:
NaCl
H+ NH4+ K+ Na+ Ba2+ Ca2+ Mg2+ Al3+ Mn2+ Zn2+ Fe2+ Fe3+ Cu2+ Ag+
C032H2CO3 (NH4)2CO3 K2CO3 Na2CO3 BaCO3 CaCO3 MgCO3 --MnCO3 ZnCO3 FeCO3 ----Ag2CO3
盐
钾盐
盐的溶解
钠盐
性规律
铵盐
都溶
钾钠铵硝溶
氯化物中氯化银
硫酸盐中硫酸钡
酸水都不溶
硝
酸
碳酸盐溶水钾钠
盐
铵
Cu2+
全
Ag+
溶
BaSO4 钾
不溶 钠
Fe(OH)3 Cu(OH)2 ---
碱
NO3HNO3 NH4NO3 KNO3 NaNO3 Ba(NO3)2 Ca(NO3)2 Mg(NO3)2 Al2(NO3)3 Mn(NO3)2 Zn(NO3)2 Fe(NO3)2
Fe(NO3)3 Cu(NO3)2 AgNO3
ClHCl NH4Cl KCl NaCl BaCl2 CaCl2 MCl2 AlCl3 MnCl2 ZnCl2 FeCl2 FeCl3 CuCl2 AgCl
人教版九年级下册 酸碱盐化学性质复习课(共16张ppt)

盐溶液
K、Ca、Na除外
判断下列反应是否发生?
1 银与稀盐酸 2铁与硫酸铜 3铜与硫酸锌 4铜与氯化银 5镁与稀硫酸
Fe + CuSO4 = FeSO4 + Cu Mg + H2SO4 = MgSO4 + H2 ↑
酸、碱、盐的相互关系
使石蕊变红,酚酞无色
活泼金属
酸
金属氧化物
使石蕊变蓝
碱
盐
酚酞变红
碱可溶
酸+金属氧化物 → 盐 + 水
判断物质是否反应
2 、 (2011• 包 头 ) 现 有 Fe 、 Fe2O3 、 H2SO4 、 Mg(OH)2、NaOH溶液、CuCl2溶液六种物质, 两两混合能发生的反应有( )C
A、4个 B、5个 C、6个 D、7个
Fe、Fe2O3、H2SO4、Mg(OH)2、NaOH、CuCl2
盐
非金属氧化物
金属
复分解反应(4个)
酸+碱→盐+水 酸 + 盐 →新酸(H2O+CO2↑)+新盐 碱 + 盐 → 新碱 + 新盐 盐1 + 盐2 → 盐3 + 盐4
条件:
.反应物: 有酸就行,无酸均溶; .生成物: 有 或 或 H2O生成
判断下列反应是否发生?
1 氢氧化钠与稀盐酸 NaOH + HCL =NaCl +H2O 2碳酸钙与稀盐酸CaCO3 + 2HCl =CaCl2 + H2O +CO2↑ 3硫酸铜与氢氧化钠
无色酚酞
装入C试管内的 液体是NaOH
AB
C
A
B
装入A试管内的 液体是NaCl
K、Ca、Na除外
判断下列反应是否发生?
1 银与稀盐酸 2铁与硫酸铜 3铜与硫酸锌 4铜与氯化银 5镁与稀硫酸
Fe + CuSO4 = FeSO4 + Cu Mg + H2SO4 = MgSO4 + H2 ↑
酸、碱、盐的相互关系
使石蕊变红,酚酞无色
活泼金属
酸
金属氧化物
使石蕊变蓝
碱
盐
酚酞变红
碱可溶
酸+金属氧化物 → 盐 + 水
判断物质是否反应
2 、 (2011• 包 头 ) 现 有 Fe 、 Fe2O3 、 H2SO4 、 Mg(OH)2、NaOH溶液、CuCl2溶液六种物质, 两两混合能发生的反应有( )C
A、4个 B、5个 C、6个 D、7个
Fe、Fe2O3、H2SO4、Mg(OH)2、NaOH、CuCl2
盐
非金属氧化物
金属
复分解反应(4个)
酸+碱→盐+水 酸 + 盐 →新酸(H2O+CO2↑)+新盐 碱 + 盐 → 新碱 + 新盐 盐1 + 盐2 → 盐3 + 盐4
条件:
.反应物: 有酸就行,无酸均溶; .生成物: 有 或 或 H2O生成
判断下列反应是否发生?
1 氢氧化钠与稀盐酸 NaOH + HCL =NaCl +H2O 2碳酸钙与稀盐酸CaCO3 + 2HCl =CaCl2 + H2O +CO2↑ 3硫酸铜与氢氧化钠
无色酚酞
装入C试管内的 液体是NaOH
AB
C
A
B
装入A试管内的 液体是NaCl
最新人教版九年级化学下册《录1 部分酸、碱和盐的溶解性表(室温)》精品课课件_2

微溶性盐:CaSO4 Ag2SO4 MgCO3 不溶性盐:AgCl BaSO4 BaCO3 CaCO3 ZnCO3
FeCO3 Ag2CO3
二、酸碱盐的分类
2.从是否具有挥发性的角度分,把酸、碱、盐分别分为几大类?
①酸 挥发性酸:HCl HNO3 H2CO3 无挥发性酸:H2SO4
②碱 挥发性碱: NH3·H2O 无挥发性碱:KOH NaOH Ba(OH)2
H2O HNO3 HCl H2SO4 H2CO3
氧化物
酸
H+ + 酸根离子 → 酸
②OH-和阳离子依次结合成的化合物的化学式,说出它们的类别。
NH4+
Na+
Ba2+ Ca2+
Al3+
Fe3+ Cu2+
OH- NH3·H2O NaOH Ba(OH)2 Ca(OH)2Al(OH)3 Fe(OH)3Cu(OH)2
1.酸 → H+ + 酸根离子
2.碱→金属离子 + OH-
3.盐 → 金属离子 + 酸根离子
二、酸碱盐的分类
1.从溶解性的角度,我们可以把酸、碱、盐分别分为几大类?
①酸 :酸都溶于水
②碱 ③盐
易溶性碱:KOH NaOH Ba(OH)2 微溶性碱:Ca(OH)2 不溶性碱:Mg(OH)2 Al(OH)3 Fe(OH)3 Cu(OH)2 易溶性盐:钾盐 钠盐 铵盐 硝酸盐
CO32-
H+
Ba2+ Ca2+ Mn2+ Zn2+ Fe2+、Ag+
只与CO32-反应金属离子是Ca2+ 选择Ca2+的碱或可溶性盐,如Ca(OH)2或CaCl
FeCO3 Ag2CO3
二、酸碱盐的分类
2.从是否具有挥发性的角度分,把酸、碱、盐分别分为几大类?
①酸 挥发性酸:HCl HNO3 H2CO3 无挥发性酸:H2SO4
②碱 挥发性碱: NH3·H2O 无挥发性碱:KOH NaOH Ba(OH)2
H2O HNO3 HCl H2SO4 H2CO3
氧化物
酸
H+ + 酸根离子 → 酸
②OH-和阳离子依次结合成的化合物的化学式,说出它们的类别。
NH4+
Na+
Ba2+ Ca2+
Al3+
Fe3+ Cu2+
OH- NH3·H2O NaOH Ba(OH)2 Ca(OH)2Al(OH)3 Fe(OH)3Cu(OH)2
1.酸 → H+ + 酸根离子
2.碱→金属离子 + OH-
3.盐 → 金属离子 + 酸根离子
二、酸碱盐的分类
1.从溶解性的角度,我们可以把酸、碱、盐分别分为几大类?
①酸 :酸都溶于水
②碱 ③盐
易溶性碱:KOH NaOH Ba(OH)2 微溶性碱:Ca(OH)2 不溶性碱:Mg(OH)2 Al(OH)3 Fe(OH)3 Cu(OH)2 易溶性盐:钾盐 钠盐 铵盐 硝酸盐
CO32-
H+
Ba2+ Ca2+ Mn2+ Zn2+ Fe2+、Ag+
只与CO32-反应金属离子是Ca2+ 选择Ca2+的碱或可溶性盐,如Ca(OH)2或CaCl
人教版初中化学九下复习课:部分酸碱盐的溶解性 课件最新课件

MnCl2 MnSO4
MnCO3
Zn(NO3)2
ZnCl2
ZnSO4
ZnCO3
Fe(NO3)2
FeCl2
FeSO4
FeCO3
Fe(NO3)3 Cu(NO3)2
FeCl3
Fe2(SO4)3
---
CuCl2
CuSO4
---
盐
AgNO3
AgCl
Ag2SO4
Ag2CO3
硝酸盐 氯化物 硫酸盐 碳酸盐
H+ NH4+ K+ Na+ Ba2+ Ca2+ Mg2+ Al3+ Mn2+ Zn2+ Fe2+ Fe3+ Cu2+ Ag+
Cu(OHห้องสมุดไป่ตู้2是蓝 色固体
部分酸碱盐的溶解性
复习:物质分类
三级 分类
一级 混合物 分类 (多种物质)
物质根据物
质种类
金属 单质 非金属
(一种元素)
稀有气体
纯净物
(一种物质)
根据元 素种类
二级 化合物 分类 (多种元素)
氧化物
(两种元素 一种氧)
酸 碱 盐
复习:酸碱盐的结构特点
酸---H+ +酸根离子 碱--金属离子+OH盐==金属离子 +酸根离子
C032H2CO3 (NH4)2CO3 K2CO3 Na2CO3 BaCO3 CaCO3 MgCO3 --MnCO3 ZnCO3 FeCO3 ----Ag2CO3
盐
钾盐
盐的溶解
钠盐
性规律
铵盐
都溶
钾钠铵硝溶
氯化物中氯化银
人教版九年级化学下册:9.2 溶解度 课件(共19张PPT)1

总结:溶解度曲线的应用
课题2 溶解度
一、固体溶解度: 1.定义;在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的质量,
叫做这种物质在这种溶剂中的溶解度。
①条件:在一定温度下 四要素 ②标准:100g溶剂
③状态:达到饱和状态 ④单位:溶解的质量,单位为克
1)某物质在某温度下。在100克溶剂中达到饱和状态时溶解溶质的质量 (最多溶有溶质的质量)
2.含义 2)某温度下物质的饱和溶液中
m溶质:m溶剂:m溶液= 溶解度:100:(100+溶解度)
3.温度(T)对固体溶解度(S)影响的表示法: 1)列表法 2)溶解度曲线
溶解度曲线 a.建立: 横坐标表示温度,纵坐标表示溶解度。 b.意义:
点:组成曲线的每一个点,表示溶液是对应温度下物质的饱和溶液。
二.气体溶解度
1、定义:
在压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和 状态时的气体体积
2、五要素:
压强为101kPa 一定温度 1体积水 达到饱和 气体的体积
3、影响因素:
温度、压强
气体溶解度一般随压强增大而增大,压强减小而减小。
气体溶解度一般随温度升高而减小,温度降低而增大。
溶解性
100 90 80 70 60 50
40 30 20 10
0 10 20 30
硝 酸 钾
.C 氯化铵 氯化钾 氯化钠
2.B点表示什么意思?? 3.C点表示的是什么状态?
硼酸
温度/℃
40 50 60 70 80 90 100
固体溶解度曲线意义
讨论:
1、比较KNO3 NaNO3 NH4NO3
KCl
和NaCl的溶解度曲线的相同点是?
人教版九年级下册化学《 9.2 溶解度》课件(43张PPT)

3.要使接近饱和溶液的硝酸钾溶液达到饱和溶液,可采
取的措施是:(1)__蒸__发__水___分___;(2)__降__低__温___度____; (3)__增__加__硝__酸___钾___。
人教版九年级下册化学《 9.2 溶解度》课件(43张PPT)
人教版九年级下册化学《 9.2 溶解度》课件(43张PPT)
2.某学生在一定的温度下,进行溶解硝酸钾实验,记录
的数据如下:
实验序号
所用水的质量 加入硝酸钾的质量
所得溶液的质量
1 100g 80g 180g
2 100g 100g 200g
3 100g 120g 210g
4
100g 140g
x
(1)根据上述数据分析,实验1得到的溶液是_________;
(填“饱和”或“不饱和”)溶液。实验3得到的溶液
学习目标
1.理解固体溶解度的涵义。 2.了解溶解度与溶解性的关系。 3.初步学会绘制和查阅溶解度曲线。
人教版九年级下册化学《 9.2 溶解度》课件(43张PPT)
·…······…·…·…....
…··…·..
A
B
C
D
人教版九年级下册化学《 9.2 溶解度》课件(43张PPT)
1.欲将100g不饱和的KNO 溶液变为饱和溶液.可采用的 人教版九年级下册化学《9.2溶解度》课件(43张PPT)
3
方法是( )
①升温 ②降温 ③蒸发水分 ④增加溶质
A ①③ B ②④ C ②③④ D ①②③④
人教版九年级下册化学《 9.2 溶解度》课件(43张PPT)
人教版九年级下册化学《 9.2 溶解度》课件(43张PPT)
6、A、B、C、D四个烧杯里分别盛有质量相等的同种溶 剂,向四个烧杯加入某溶质,且固体溶质质量依次减 少(温度相同),充分溶解,(如下图所示)回答下 列各问(填序号)
人教版九年级下次 酸碱盐总复习课件(28张PPT)

A、硝酸银和氯化钠 B、氯化铜和氢氧化钠 C、氯化钙和硝酸铜 D、碳酸钠和盐酸
提示:物质间可以共存表明它们在该条件下不反应。
5、下列方法:①金属溶于酸 ②碳酸盐溶于酸 ③ 氧化物溶于碱 ④氢氧化物溶于水 ⑤氧化物溶于水,
举例
HCl、 H2SO4 HNO3 、H2CO3
NaOH 、Ca(OH)2 Cu(OH)2 、Fe(OH)3 NH3•H2O
CuSO4、 Na2CO3 、 NaCl 、CaCO3 NH4NO3
判断下列说法是否正确
1、酸中一定含氢元素。
2、碱中一定含氢、氧两种元素。
3、碱中一定含金属元素。 4、盐中一定含金属元素。 5、石灰水是碱。 6、粗盐是盐。
3、将等质量的浓硫酸、浓盐酸同时置于空气中,质量变大 的为浓硫酸。 4、分别将样品溶于水放热的是浓硫酸。
如何用物理方法鉴别 氢氧化钠固体和氢氧化钙固体
1、看外观状态:氢氧化钠白色片状固体、氢 氧化钙白色粉末状固体 。 2、敞口露置于空气中氢氧化钠易潮解。 3、溶入水中(溶多溶少、是否放热) 氢氧化钙微溶于水,氢氧化钠溶于水放热。
九年级化学
学会归纳
一.纯净物的简单分类:
金属
单质
非金属
稀有气体 金属氧化物
纯净物
无
机
化
化合
合物
物
氧化物 酸 碱 盐
非金属氧化物
有机化合物
二.酸碱盐的对比
分类
酸
碱
盐
结构 特点
酸→氢离子 +酸根离子
碱→金属离子 盐→金属离子 +氢氧根离子 +酸根离子
溶液 酸溶液 酸碱性 呈酸性
碱溶液 呈碱性
盐溶液酸、碱 中性都有可能
提示:物质间可以共存表明它们在该条件下不反应。
5、下列方法:①金属溶于酸 ②碳酸盐溶于酸 ③ 氧化物溶于碱 ④氢氧化物溶于水 ⑤氧化物溶于水,
举例
HCl、 H2SO4 HNO3 、H2CO3
NaOH 、Ca(OH)2 Cu(OH)2 、Fe(OH)3 NH3•H2O
CuSO4、 Na2CO3 、 NaCl 、CaCO3 NH4NO3
判断下列说法是否正确
1、酸中一定含氢元素。
2、碱中一定含氢、氧两种元素。
3、碱中一定含金属元素。 4、盐中一定含金属元素。 5、石灰水是碱。 6、粗盐是盐。
3、将等质量的浓硫酸、浓盐酸同时置于空气中,质量变大 的为浓硫酸。 4、分别将样品溶于水放热的是浓硫酸。
如何用物理方法鉴别 氢氧化钠固体和氢氧化钙固体
1、看外观状态:氢氧化钠白色片状固体、氢 氧化钙白色粉末状固体 。 2、敞口露置于空气中氢氧化钠易潮解。 3、溶入水中(溶多溶少、是否放热) 氢氧化钙微溶于水,氢氧化钠溶于水放热。
九年级化学
学会归纳
一.纯净物的简单分类:
金属
单质
非金属
稀有气体 金属氧化物
纯净物
无
机
化
化合
合物
物
氧化物 酸 碱 盐
非金属氧化物
有机化合物
二.酸碱盐的对比
分类
酸
碱
盐
结构 特点
酸→氢离子 +酸根离子
碱→金属离子 盐→金属离子 +氢氧根离子 +酸根离子
溶液 酸溶液 酸碱性 呈酸性
碱溶液 呈碱性
盐溶液酸、碱 中性都有可能
人教版初中化学九年级下册附录1 部分酸、碱和盐的溶解性表的应用 课件
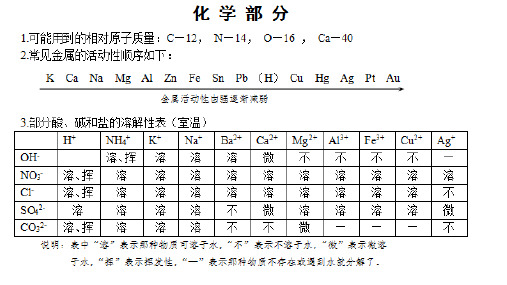
酸、碱、盐的溶解性(室温)
H+ NH4+
K+ Na+ Ba2+ Ca2+ Mg2+ Al3+ Mn2+ Zn2+ Fe2+
Fe3+ Cu2+ Ag+
OH-
溶、挥 溶 溶 溶 微 不 不 不 不 不 不 不 ——
NO3-
溶、挥 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶
溶 溶 溶
Cl-
溶、挥 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶
酸、碱、盐的溶解性(室温)
H+ NH4+
K+ Na+ Ba2+ Ca2+ Mg2+ Al3+ Mn2+ Zn2+ Fe2+
Fe3+ Cu2+ Ag+
OH-
溶、挥 溶 溶 溶 微 不 不 不 不 不 不 不 ——
NO3-
溶、挥 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶
溶 溶 溶
Cl-
溶、挥 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶
(5)一般情况下,不能跟其他物质发生复分解反应的可溶性盐是 NaNO3
。
酸、碱、盐的溶解性(室温)
H+ NH4+
K+ Na+ Ba2+ Ca2+ Mg2+ Al3+ Mn2+ Zn2+ Fe2+
Fe3+ Cu2+ Ag+
OH-
溶、挥 溶 溶 溶 微 不 不 不 不 不 不 不 ——
NO3-
溶、挥 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
MnCl2 MnSO4
MnCO3
Zn(NO3)2
ZnCl2
ZnSO4
ZnCO3
Fe(NO3)2
FeCl2
FeSO4
FeCO3
Fe(NO3)3 Cu(NO3)2
FeCl3
Fe2(SO4)3
---
CuCl2
CuSO4
---
盐
AgNO3
AgCl
Ag2SO4
Ag2CO3
硝酸盐 氯化物 硫酸盐 碳酸盐
H+ NH4+ K+ Na+ Ba2+ Ca2+ Mg2+ Al3+ Mn2+ Zn2+ Fe2+ Fe3+ Cu2+ Ag+
OHH2O NH4OH KOH NaOH Ba(OH)2 Ca(OH)2 Mg(OH)2 Al(OH)3 Mn(OH)2 Zn(OH)2 Fe(OH)2 Fe(OH)3 Cu(OH)2 ---
NO3-
Cl-
SO42-
C032-
HNO3
HCl
H2SO4
H2CO3
NH4NO3
NH4Cl (NH4)2SO4
Fe(OH)3 Cu(OH)2 ---
碱
NO3HNO3 NH4NO3 KNO3 NaNO3 Ba(NO3)2 Ca(NO3)2 Mg(NO3)2 Al2(NO3)3 Mn(NO3)2 Zn(NO3)2 Fe(NO3)2
Fe(NO3)3 Cu(NO3)2 AgNO3
ClHCl NH4Cl KCl NaCl BaCl2 CaCl2 MCl2 AlCl3 MnCl2 ZnCl2 FeCl2 FeCl3 CuCl2 AgCl
碱
盐
Al (OH)3 AlCl3
Al3+ 氢氧化铝 氯化铝
碱
盐
Mg(NO3)2
硝酸镁 盐
Mg SO4 硫酸镁
盐
Al(NO3)3
硝酸铝 盐
Al2 (SO4)3
硫酸铝 盐
H+ NH4+ K+ Na+ Ba2+ Ca2+ Mg2+ Al3+ Mn2+ Zn2+ Fe2+
Fe3+ Cu2+ Ag+
OHH2O NH4OH KOH NaOH Ba(OH)2 Ca(OH)2 Mg(OH)2 Al(OH)3 Mn(OH)2 Zn(OH)2 Fe(OH)2
C032H2CO3 (NH4)2CO3 K2CO3 Na2CO3 BaCO3 CaCO3 MgCO3 --MnCO3 ZnCO3 FeCO3 ----Ag2CO3
盐
钾盐
盐的溶解
钠盐
性规律
铵盐
都溶
钾钠铵硝溶
氯化物中氯化银
硫酸盐中硫酸钡
酸水都不溶
硝
酸
碳酸盐溶水钾钠
盐
铵
Cu2+
全
Ag+
溶
BaSO4 钾
不溶 钠
OH-
铵盐 H2O NH4OH KOH
钾盐 H
Ba(OH)2
钠盐 Ca(OH)2
Mg(OH)2 Al(OH)3 Mn(OH)2 Zn(OH)2 Fe(OH)2 Fe(OH)3 Cu(OH)2 ---
NO3HNO3 NH4NO3 KNO3 NaNO3 Ba(NO3)2 Ca(NO3)2 Mg(NO3)2 Al2(NO3)3 Mn(NO3)2 Zn(NO3)2 Fe(NO3)2 Fe(NO3)3 Cu(NO3)2 AgNO3
ClHCl NH4Cl KCl NaCl BaCl2 CaCl2 MCl2 AlCl3 MnCl2 ZnCl2 FeCl2 FeCl3 CuCl2 AgCl
SO42H2SO4 (NH4)2SO4 K2SO4 Na2SO4 BaSO4 CaSO4) MgSO4 Al2(SO4)3 MnSO4 ZnSO4 FeSO4 Fe2(SO4)3 CuSO4 Ag2SO4
Fe(OH)2
Fe(OH)3
Cu(OH)2
-----
三、盐的溶解性规律
加油站
盐的系统命名
硫酸盐:含硫酸根离子的盐 如:Na2 SO4 Mg SO4 Al2 (SO4)3
FeSO4
钠盐:含钠离子的盐
如:NaNO3 Na2 SO4 Na2 CO3
思考:铵盐是含
的盐
如:
NaCl
H+ NH4+ K+ Na+ Ba2+ Ca2+ Mg2+ Al3+ Mn2+ Zn2+ Fe2+ Fe3+ Cu2+ Ag+
部分酸碱盐的溶解性
复习:物质分类
三级 分类
一级 混合物 分类 (多种物质)
物质根据物
质种类
金属 单质 非金属
(一种元素)
稀有气体
纯净物
(一种物质)
根据元 素种类
二级 化合物 分类 (多种元素)
氧化物
(两种元素 一种氧)
酸 碱 盐
复习:酸碱盐的结构特点
酸---H+ +酸根离子 碱--金属离子+OH盐==金属离子 +酸根离子
---
--Ag2CO3
酸 盐
一、 酸
HNO3、 HCl、
的 H2SO4、
溶 H2CO3
解 性
都易溶 于水
Cu2+ Ag+
不微
CCuu22++ AAgg++
二、碱的溶解性规律
NH4OH
KOH
碱
NaOH
溶
Ba(OH)2
钾
Ca(OH)2
钠
Mg(OH)2
钡
Al(OH)3 Mn(OH)2
钙
Zn(OH)2
铵
AgCl
铵
不溶
溶
不微
口诀:盐、碱的溶解性规律
钾钠铵硝溶, 氯化物中氯化银, 硫酸盐中硫酸钡, 酸水都不溶。 碳酸盐溶水钾钠铵,
碱溶钾钠钡钙铵, 其余不溶于水溶于酸。
不溶物中 大多数为 白色固体
Fe(OH)3是红 褐色固体
Cu(OH)2是蓝 色固体
Cu2+ Ag+
不微
八种常见 的沉淀物
白色固体
Fe(OH)3是红 褐色固体
练习
判断下列物质的类别: 硫酸铜 氢氧化钠 碳酸 水
OH- Cl-
NO3-
SO42-
H+
H2O 水 HCl盐酸 HNO3 硝酸 H2SO4硫酸
氧化物 酸
酸
酸
NaOH NaCl
Na +
氢氧化钠 氯化钠
碱
盐
NaNO3 Na2SO4
硝酸钠 盐 硫酸钠盐
Mg(OH)2 MgCl2
Mg 2+
氢氧化镁 氯化镁
(NH4)2CO3
KNO3
KCl
K2SO4
K2CO3
NaNO3
NaCl
Na2SO4
Na2CO3
Ba(NO3)2
BaCl2
BaSO4
BaCO3
Ca(NO3)2
CaCl2 CaSO4)
CaCO3
Mg(NO3)2
MCl2
MgSO4
MgCO3
Al2(NO3)3
AlCl3
Al2(SO4)3
---
Mn(NO3)2
SO42H2SO4 (NH4)2SO4 K2SO4 Na2SO4 BaSO4 CaSO4 MgSO4 Al2(SO4)3 MnSO4 ZnSO4 FeSO4
Fe2(SO4)3 CuSO4 Ag2SO4
C032H2CO3 (NH4)2CO3 K2CO3 Na2CO3 BaCO3 CaCO3 MgCO3 --MnCO3 ZnCO3 FeCO3
Cu(OH)2是蓝 色固体
