脊髓灰质炎IgG抗体检测试剂参考品的制备及标定
包虫IgG抗体检测试剂用血清国家参考品的研制

中 国药事 2 1 0 0年第 2 4卷 第 9期
81 8
包 虫 IG 抗体 检 测试 剂 用 血 清 国 家 参 考 品 的研 制 g
曹丽梅 ,辛 晓芳 ,薄淑英 ,杨英超 ,王 国治 ( 药品 物制品 定所, 京 1 O ) 中国 生 检 北 0 5 0O
摘要 : 目的 建 立新 的 包虫 IG 抗体 检 测试 剂 用血 清 国 家参 考 品 ,以控 制该 类 试 剂 的质 量 ,促进 包虫病 g
利 于控 制该 类诊 断试 剂 的质量 ,推 动试 剂质 量的提 高。
关 键词 :
包虫病 ;IG 抗体检 测 试 剂 ;国 家参 考品 g
文献标 识 码 :A 文章 编号 :1 0 —7 7 (0 0 90 8 —4 0 27 7 2 1 )0 — 8 10
中图分 类号 :R 5 9
C nr 1 f h r cui l n ilgc l r d cs B in O 0 O o t amae t a a dBoo ia P o u t, e ig1 O 5 ) ooP e j
A S RA T: O jcieT rp r h e n t n l eee c a e fr y ai g n io yda n si BT C bet op e aet en w ai a rfrn ep n l o d t IG a t d ig ot v o h d b c kt.Meh s olc 1 oi v eu smpe o tep t n si ij n g rAuo o u go i s to l t p s iesr m a lsf m h ai t X ni gUy u tn mo sRe in d C e 3 t r e n a
猴脊髓灰质炎病毒抗体IgGPV-IgG酶联免疫分析ELISA
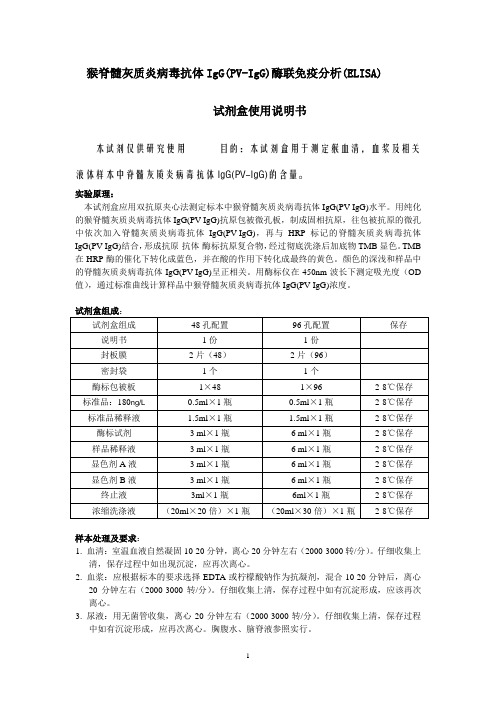
猴脊髓灰质炎病毒抗体IgG(PV-IgG)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定猴血清,血浆及相关液体样本中脊髓灰质炎病毒抗体IgG(PV-IgG)的含量。
实验原理:本试剂盒应用双抗原夹心法测定标本中猴脊髓灰质炎病毒抗体IgG(PV-IgG)水平。
用纯化的猴脊髓灰质炎病毒抗体IgG(PV-IgG)抗原包被微孔板,制成固相抗原,往包被抗原的微孔中依次加入脊髓灰质炎病毒抗体IgG(PV-IgG),再与HRP标记的脊髓灰质炎病毒抗体IgG(PV-IgG)结合,形成抗原-抗体-酶标抗原复合物,经过彻底洗涤后加底物TMB显色。
TMB 在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的脊髓灰质炎病毒抗体IgG(PV-IgG)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD 值),通过标准曲线计算样品中猴脊髓灰质炎病毒抗体IgG(PV-IgG)浓度。
试剂盒组成:试剂盒组成48孔配置96孔配置保存说明书1份1份封板膜2片(48)2片(96)密封袋1个1个酶标包被板1×48 1×96 2-8℃保存标准品:180ng/L0.5ml×1瓶0.5ml×1瓶2-8℃保存标准品稀释液 1.5ml×1瓶 1.5ml×1瓶2-8℃保存酶标试剂 3 ml×1瓶 6 ml×1瓶2-8℃保存样品稀释液 3 ml×1瓶 6 ml×1瓶2-8℃保存显色剂A液 3 ml×1瓶 6 ml×1瓶2-8℃保存显色剂B液 3 ml×1瓶 6 ml×1瓶2-8℃保存终止液3ml×1瓶6ml×1瓶2-8℃保存浓缩洗涤液(20ml×20倍)×1瓶(20ml×30倍)×1瓶2-8℃保存样本处理及要求:1. 血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
脊髓灰质炎的诊断标准

脊髓灰质炎的诊断标准脊髓灰质炎(poliomyelitis)是由脊髓灰质炎病毒(poliovirus)感染引起的一种急性传染病。
该病常见于幼儿,主要通过飞沫传播途径传染给他人。
脊髓灰质炎病毒感染后会引起神经细胞的破坏,导致患者出现肌肉无力、萎缩等症状,严重情况下还可能导致肺部瘫痪和呼吸衰竭。
脊髓灰质炎的诊断主要基于临床表现、病史、病毒学检测和免疫学检测。
以下是脊髓灰质炎的诊断标准及参考内容:1. 临床表现:- 典型表现为急性起病,患者出现发热、咽峡炎、畏寒等上呼吸道感染症状。
- 出现轻度的消化道症状,如食欲减退、呕吐、腹泻等。
- 随后出现神经系统症状,最常见的是肌肉无力和进行性肌肉萎缩。
患者常有肢体无力、运动障碍、肌肉震颤等表现。
2. 病史:- 接触史:患者是否接触过脊髓灰质炎疫区的病人、患病儿童或疑似病例。
- 疫情流行史:是否有类似疫情在周围地区。
3. 实验室检查:- 病毒学检测:从患者的咽拭子或大便样本中分离出脊髓灰质炎病毒。
- 免疫学检测:检测患者血清或脑脊液中的抗体水平,包括病毒特异性IgM抗体、病毒特异性IgG抗体等。
脊髓灰质炎的诊断标准通常依据世界卫生组织(WHO)的标准制定,以下是WHO关于脊髓灰质炎诊断的参考内容:1. 临床诊断:- 头痛、发热和咽痛等上呼吸道感染症状。
- 肢体肌肉力量减退、运动异常或肌肉萎缩。
- 脑脊液检查显示淋巴细胞增多和多形核白细胞增多。
2. 确定诊断:- 上述临床症状和体征符合的同时,检测出病毒特异性IgM抗体阳性。
3. 支持性诊断:- 上述临床表现和病毒学检测结果无法满足诊断标准的情况下,若接触了疫区的病例或患者的样本中检测到脊髓灰质炎病毒,则可作为支持性诊断的依据。
总之,脊髓灰质炎的诊断通常依据临床表现、病史、病毒学检测和免疫学检测。
准确诊断脊髓灰质炎对于及时采取控制传播、治疗和照顾患者具有重要意义。
结核分枝杆菌IgG抗体检测试剂盒(胶体金法)说明书

结核分枝杆菌IgG抗体检测试剂盒(胶体金法)说明书【产品名称】通用名称:康珠生物结核分枝杆菌IgG抗体检测试剂盒(胶体金法)【包装规格】1人份/袋,10人份/盒,20人份/盒,50人份/盒,100人份/盒。
【预期用途】本产品用于体外定性检测人血清、血浆或抗凝指尖末梢血中的结核分枝杆菌IgG抗体。
在临床诊断中作为结核分枝杆菌感染的辅助诊断试剂。
结核分枝杆菌(MTB)是结核病的致病菌,属分枝杆菌属,是一种特殊的圆杆状细菌,细胞壁富含脂类,抗酸染色,又叫抗酸杆菌。
MTB的宿主是人,主要通过结核病人含有该细菌的气溶胶(aerosol)进行传播。
人体除毛发外几乎全身所有组织都可以感染结核病,如肠结核、骨结核、淋巴结核等。
由于结核病主要经呼吸道进行传播,因此肺结核的感染率比其他器官高,占人体结核病的90%,其余组织感染的结核病统称为肺外结核。
常用的细菌学检查方法包括:(1)痰涂片镜检法。
(2)痰结核菌常规培养法。
(3)分枝杆菌菌种鉴定。
(4)痰结核菌快速培养系统等。
【检验原理】本试剂盒是采用胶体金法免疫层析技术原理,在硝酸纤维素膜上的T线包被重组TB抗原,在C线包被羊抗鼠IgG抗体,在金标垫上包被胶体金标记的鼠抗人IgG单抗。
用于定性检测血清(浆)样本中的结核分枝杆菌IgG抗体。
检测阳性样本时,样本中的结核分枝杆菌IgG抗体可与胶体金标记的鼠抗人IgG单抗结合,形成免疫复合物,由于层析作用复合物及样本在硝酸纤维素膜内部向前流动。
当复合物经过T线时与包被的重组TB抗原结合,形成“胶体金标记鼠抗人IgG单抗--TB--IgG--重组抗原”而凝聚显色。
若样本中不含结核分枝杆菌IgG抗体,致使不能形成免疫复合物,(T)线不显色。
无论结核分枝杆菌IgG抗体是否存在于标本中,胶体金标记的鼠抗人IgG扩散到质控线(C)区域被羊抗鼠抗体捕获,在质控区(C)内部都会出现一条红色条带。
质控区(C)内所显示的红色条带是判定是否有足够标本,层析过程是否正常的标准,同时也作为试剂的内控标准。
免疫球蛋白检测作业指导书

免疫球蛋白(IgG、IgA、IgM)检测作业指导书1 检验目的规范免疫球蛋白(IgG、IgA、IgM)检测试验,确保检测结果准确性和重复性。
2 测定方法免疫透射比浊法。
3 检测原理样品中的免疫球蛋白(IgG、IgA、IgM)抗原分别与试剂中的IgG、IgA、IgM抗体发生免疫反应,生成免疫复合物,形成一定浊度,其浊度与免疫球蛋白的含量成正比。
与通过同样处理的校准液比较,即可计算出样品中免疫球蛋白(IgG、IgA、IgM)的含量。
4 样本血清处理方法见生化标本采集程序。
稳定性:2~8℃稳定4天。
5 仪器和试剂5.1 仪器:美国贝克曼-库尔特DXC800全自动生化仪。
5.2 试剂:由武汉元景商贸公司提供原装贝克曼-库尔特试剂(详见试剂说明书),超过失效期的试剂不能使用。
5.3 校准物:Rodan混合校准品,符合WHO标准,贮存、准备严格遵照其说明书。
5.4 质控物:Rodan正常值及病理值质控品,符合WHO 标准,贮存、准备严格遵照说明书。
6 校准6.1 仪器校准:每年由该仪器维修工程师参照厂方的技术规范对仪器进行一次校准。
6.2 项目校准:试剂盒在仪器上放置稳定期后;试剂批号更换后;由质控结果随时决定。
7 操作步骤上机操作,操作程序、质量控制程序见相应生化仪操作程序。
8 参考范围IgG: 7~16.5g/L,IgA: 0.59~3.5g/L,IgM: 0.48~2.12g/L。
9 警告/危急值未规定。
10 性能指标10.1 线形上限:IgG ≤32g/L,IgA ≤7 g/L,IgM≤24g/L。
10.2 精密度:批内CV ≤4%,批间CV≤8%。
10.3 准确度:不准确度≤8%。
10.4试剂贮存:试剂密闭避光贮存2~8℃可稳定12个月。
11 干扰因素及变异的潜在来源标本出现溶血对测定结果有一定影响。
12 临床意义12.1 免疫球蛋白增高:12.1.1 各种感染,特别是慢性细菌感染如骨髓炎、慢性肺脓肿等,血Ig可升高。
麻疹、风疹、脊髓灰质炎IgG抗体检测及影响因素分析

麻疹、风疹、脊髓灰质炎IgG抗体检测及影响因素分析目的:为了了解适龄儿童接种麻疹、风疹、脊髓灰质炎疫苗后IgG抗体产生情况,评价该地区不同人群免疫规划工作质量和水平,及时发现解决免疫规划工作中存在的问题。
方法:根据《呼伦贝尔市儿童免疫效果监测实施方案》,2013年、2014年分别对莫力达瓦达斡尔族自治旗(以下简称莫旗)21个乡镇的0~15岁适龄儿童进行了麻疹、风疹、脊髓灰质炎IgG抗体的检测,利用酶联免疫吸附试验(间接ELISA)法。
结果:2013年共检测4763人,2014年共检测3553人,麻疹IgG阳性率2013年是84.1%,2014年是73.0%;风疹阳性率2013年91.7%,2014年87.6%;脊髓灰质炎阳性率2013年85.4%,2014年88.7%。
经过x2检验,2013年麻疹、风疹、脊髓灰质炎IgG抗体检测结果阳性率各年龄组均有差异,2014年麻疹、风疹IgG抗体阳性率各年龄组有差异,脊髓灰质炎IgG 抗体阳性率各年龄组无差异。
讨论:差异存在的主要原因是两年的抽样数量差距大,还有样品采集和处理、试剂的使用、方法的选择、环境温湿度的控制、仪器的使用、人员操作技术、样品采集的对象的免疫史不同也是主要影响。
在以后的抽样、样品处理、方法的选择、实验的操作等加强管理和合理安排,提高专业人员业务技能、做好实验室的内部质量控制,确保检测结果的准确可靠;计划免疫医生查遗补漏,加强疫苗的接种的及时率和覆盖率,减少或杜绝少种和漏种的现象发生。
标签:IgG抗体;检测;麻疹;风疹;脊髓灰质炎;酶联免疫吸附试验1 研究资料与方法使用ELISA麻疹/风疹/脊髓灰质炎IgG抗体检测试剂盒(酶联免疫法)。
1.1 样品的采集用一次性采血针采集末梢血(手指血或耳垂血)用一次性采血管吸取20ul,加到预先盛有180ul的生理盐水带盖的离心管中,待血球自然沉降到管底后便可直接取上清液检测。
1.2 实验步骤按照麻疹、风疹、脊髓灰质炎IgG抗体检测试剂盒使用说明书的检测方法进行检测。
乙型脑炎病毒IgG抗体检测试剂盒(酶联免疫法)说明书

乙型脑炎病毒IgG抗体检测试剂盒(酶联免疫法)说明书【产品名称】通用名称:康珠生物乙型脑炎病毒IgG抗体检测试剂盒(酶联免疫法)英文名称:Japanese encephalitis virus IgG antibody detection kit (ELISA)【包装规格】96人份/盒,48人份/盒。
【预期用途】本产品用于体外定性检测人体血清、血浆或指尖末梢血中的乙型脑炎病毒IgG抗体。
流行性乙型脑炎是乙型脑炎病毒经库蚊传播而使人体感染的一种传染性疾病,感染患者以2-6岁儿童居多,病死率较高为5%-20%。
人体感染该病毒后,能引起中枢神经系统症状,发生脑炎而俗称乙型脑炎,应用乙型脑炎抗体的稳定,很少变异的特点。
预防免疫效果良好,所以通过免疫接种乙型脑炎病毒疫苗,使机体产生乙型脑炎病毒IgG抗体,达到乙型脑炎的预防效果。
【检验原理】本试剂盒采用酶联免疫间接法原理,用经灭活纯化的乙型脑炎病毒抗原包被酶标板制备固相抗原,样本中乙型脑炎病毒IgG抗体与包被抗原反应,再与辣根过氧化物酶标记的鼠抗人IgG结合, 形成抗原-抗体-酶标抗体复合物,加入底物TMB后产生显色反应,加入终止液后经酶免分析仪测定OD值,再与临界值比较以判定样本中是否含有乙型脑炎病毒IgG抗体。
【主要组成成份】本试剂盒由反应板、酶结合物、阳性对照、阴性对照、浓缩洗涤液、显色液A、显色液B、终止液、样品稀释液、自封袋和封片组成:【储存条件及有效期】试剂盒应置2~8℃保存,有效期为十二个月。
生产日期、有效期至:见包装标签。
【适用仪器】酶免分析仪(检测波长450nm,参考波长630nm)、洗板机、37℃恒温水浴箱、移液器、振荡器。
【样本要求】1. 血清样本按常规方法由静脉采集。
血浆样本可采用常规用量的抗凝剂(EDTA-2Na: 12g/L、肝素:15000IU/L、枸椽酸钠:3.2g/L、草酸钠: 0.01mol/L(1.34g/L))抗凝。
免疫球蛋白(IgG)定量测定试剂盒标准操作程序

免疫球蛋白(IgG)测定标准操作程序1.摘要本试剂盒适用于体外临床检验,用于测定人血清中免疫球蛋白IgG的含量。
IgG的主要功能是与抗原结合,并进一步触发抗原的分解。
2.适用范围程序适用于日立7600自动生化分析仪检测血清、血浆中IgG的浓度。
3.职责使用日立7600自动生化分析仪进行测定IgG浓度的工作人员要严格按照本SOP程序进行,室负责人监督管理;本SOP的改动,可由任一使用本SOP的工作人员提出,并报经生化室负责人、科主任签字批准生效。
4.检测方法上海科华生物工程股份有限公司生产的免疫球蛋白(IgG)试剂盒采用的是免疫透射比浊法。
5.原理样本中的IgG与试剂中相应的抗体相遇,立即形成抗原抗体免疫复合物,在特定的缓冲环境中形成浊度,其浊度在合适的抗体浓度存在时与抗原含量成正比,与相同条件下操作的校准品比较,即可求出样品中IgG的含量。
6.仪器日立7600自动生化分析仪7.试剂7.1试剂来源:上海科华生物工程股份有限公司提供7.2试剂瓶内主要成分:磷酸缓冲液(PH7.2)、Tween20、PEG、NaN3、羊抗人IgG抗体。
7.3试剂稳定性:试剂避光保存于2-8℃,若无污染,可稳定至失效期,本试剂有效期为12个月。
试剂不可冰冻。
R1、R2:打开后冷藏于分析仪中可稳定28天。
7.4试剂准备:试剂为即用式。
8.标准品和质量控制8.1校准程序:使用上海科华生物工程股份有限公司试剂盒内提供的标准品对自动分析仪进行校准。
由a、b、c、d、e五只组成,浓度见瓶签。
校准品可溯源至国际参考物质ERM470。
8.2质控品使用某某公司提供的生化复合定值质控血清做为室内质控品。
每日在测定前做一次质控。
该质控品为干粉包装,在2-8℃冰箱可稳定到失效期,使用前用5ml去离子水复溶,待质控物充分溶解(大约30分钟)后使用。
8.3质控数据管理:按程序对检验后的质控结果进行转换,对质控数据进行分析处理,如出现失控值,应及时分析失控原因,并填写好相关失控记录。
脊髓灰质炎诊断标准和处置原则

脊髓灰质炎诊断标准及处理原则脊髓灰质炎是由脊髓灰质炎病毒引起的急性肠道传染病,临床表现主要为急性弛缓性麻痹,一部分病例可能有永久性的肢体麻痹。
世界卫生大会通过要求在2000年全球消灭脊髓灰质炎。
诊断标准和处理原则的制定,不仅关系到病例的正确诊断、疫情的统计、病人的处理和疾病的预防对策,而且关系到该地区是否已经实现了消灭脊髓灰质炎的目标1 范围本标准规定了脊髓灰质炎的诊断标准和处理原则。
本标准适用于全国各级医疗、卫生、防疫机构和人员对脊髓灰质炎的诊断、报告和处理。
2 诊断原则脊髓灰质炎的诊断必须根据病史、临床症状、体检及实验室检查等进行综合分析,作出诊断。
2.1 病史应注意流行病史及接触史。
2.2 体检应作全面的体格检查,注意全身症状,四肢活动及肌力、肌张力、腱反射等体征,必要时作神经系统及其他系统的全面检查。
2.3 实验室检查2.3.1 粪便查脊髓灰质炎病毒。
2.3.2 脑脊液或血清查特异性IgM、IgG抗体,或中和抗体。
2.3.3 麻痹病人死亡后必要时作病理检查。
3 诊断标准3.1 疑似病例病因不明的任何急性弛缓性麻痹(AFP),包括15岁以下临床初步诊断为格林-巴利综合征的病例。
3.2 脊髓灰质炎临床符合病例和脊髓灰质炎野病毒确诊病例3.2.1 病史与确诊的脊髓灰质炎病人有接触史,经过2~35d(一般为7~14d)的潜伏期;或接触史不明显,有如下临床症状者。
3.2.2 临床表现3.2.2.1 早期可有发热、烦燥不安、多汗、恶心、项背强直及腓肠肌触痛等症状。
热退后出现不对称性弛缓性麻痹。
神经系统检查发现肢体(或/和腹肌)不对称性(单侧或双侧)弛缓性麻痹,躯体或肢体肌张力减弱,深部腱反射减弱或消失,但无明显感觉障碍。
3.2.2.2 麻痹后60d仍残留弛缓性麻痹,且未发现其他病因(后期可呈现肌萎缩)。
3.2.2.3 疑似病人死亡,不能提供否定脊髓灰质炎诊断依据者。
3.2,2.4 疑似病人60d后失访。
包虫IgG抗体检测试剂用血清国家参考品的研制

中国药事 2010 年第 24 卷第 9 期
883
( 续表 2)
血清编号 1次 N4 N5 N6 N7 N8 阴性符合率 P9( 1 2) P9( 1 4) P9( 1 8) P9( 1 16) P9( 1 32) P9( 1 64) 最低检出量 P10P10P10P10P10P10P101 2 3 4 5 6 7 8/ 8 + + + + + + + ∃ ∃ 1 16 + + + + + + + + + + + + + + + + + + + + +
882 快速诊断试剂盒 ( 定性 ) ( 中国新疆贝斯明生物技 术发展有限公司 ) 。 1 2 方法 1 2 1 参考品制备
1
中国药事 2010 年第 24 卷第 9 期 样品作为最低检出量参考品, 标记为 P9, 用生理盐水 将 P9 作倍比稀释, 稀释比例分别为 1 2、1 4、1 将采集的阳性及阴性血清除 8、1 16、1 32 及 1 64; 选取另一份中等强度阳性 反应的样品作为精密度参考品, 标记为 P10。 1 2 4 邀请北京英诺特生物技术有限公司 ( 代码 为 NO 1) 、珠海经济特区海泰生物制药有限公司 ( 代 码 为 NO 2 ) 及 中 检 所 细 菌 一 室 ( 代 码 为 NO 3) 共同对该参考品进行协作标定 , 3 个实验 室同时按照我们统一制定的协作标定作业指导书要 求 , 分别运用点免疫胶体金渗滤法及酶联免疫法对 参考品进行标定。 2 结果 2 1 参考品制备及分装精度检测 测定 , 参考 品包 材安 瓿 10 瓶 的平 均增 重为 0 4935g, 标准差为 0 003048, 分装误差为 0 62% ( 具体结果见表 1) , 达到了 2010 年版 ∀中国药典# 三部对标准分装精确度应在 ∃ 1% 以内的要求
《肺炎支原体IgMIgG抗体检测试剂注册技术指导原则》(征求意见稿)

附件1:肺炎支原体IgM/IgG抗体检测试剂注册技术指导原则(征求意见稿)本指导原则旨在指导注册申请人对肺炎支原体IgM/IgG 抗体检测试剂注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本指导原则是对肺炎支原体IgM/IgG抗体检测试剂的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料,相关人员应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围肺炎支原体(Mycoplasma pneumonia,Mp)属于柔膜体纲,支原体属,是引起人类呼吸道感染的常见病原微生物,是我国儿童和成人社区获得性肺炎(community-acquired pneumonia,CAP)的重要致病原之一。
Mp感染广泛存在于世界各地,平时散在性发病,每隔数年会出现地区周期性流行,每次流行持续数月到数年不等。
对于群聚性发病或初始经验性治疗无效的CAP患者,住院或重症CAP患者,建议进行致病原检查,明确CAP致病原可有助于进行目标性抗感染治疗。
根据肺炎支原体主要黏附基因P1基因的重复序列RepMP2/3或RepMP4,肺炎支原体可分为I型和II型两个基因型,不区分血清型。
肺炎支原体的检测对于支原体肺炎的治疗至关重要,实验室检测方法包括病原体培养、抗原检测、抗体检测和核酸检测。
肺炎支原体培养难度较大,需采用专门的培养基和培养技术,耗时长,敏感性低,但特异性好。
血清特异性抗体检测是目前诊断肺炎支原体肺炎的重要手段,免疫层析法、酶联免疫法和化学发光法抗体检测试剂在临床中广泛应用。
医学检验·检查项目:脊髓灰质炎病毒抗体_课件模板

内容课件模板
医学检验·各论:脊髓灰质炎病毒抗体 >>>
简介:
脊髓灰质炎病毒(polioviurs)可引起 脊髓灰质炎,又名小儿麻痹症。该病毒有 3个血清型。脊髓灰质炎病毒的实验室诊 断方法有病毒的分离鉴定、分子生物学方 法和血清学诊断方法。病毒的分离鉴定虽 是常用方法,但一般的临床实验室难以进 行。分子生物学方法主要是PCR和核酸杂 交。血清学诊断
医学检验·各论:脊髓灰质炎病毒抗体 >>>
相关疾病: 脊髓灰பைடு நூலகம்炎、小儿麻痹症、老年人脊髓压 迫症、小儿哮喘性肌萎缩综合征、脊髓神 经鞘瘤、脊髓蛛网膜炎。
谢谢!
医学检验·各论:脊髓灰质炎病毒抗体 >>>
简介: 方法有中和试验、间接免疫荧光试验、反 向间接血凝试验和ELISA方法等。
医学检验·各论:脊髓灰质炎病毒抗体 >>>
临床意义:
中和抗体为IgG型,出现较晚。脊髓 灰质炎病毒感染后,在发病后2~3周达高 峰,1~2年内逐渐下降,持续时间很长, 一直保持一定水平。恢复期与急性期抗体 效价有4倍或4倍以上增长,可诊断。
医学检验·各论:脊髓灰质炎病毒抗体 >>>
正常值: 阴性。
医学检验·各论:脊髓灰质炎病毒抗体 >>>
相关检查: 颅脑超声检查、颅脑CT检查、脑多普勒超 声(TCD)、脑脊液常规、脑脊液细菌培 养、脑脊液细胞计数。
医学检验·各论:脊髓灰质炎病毒抗体 >>>
相关症状: 脊神经根受损、四肢抽搐、发热伴关节肿 痛、全身过敏和发热皮疹关节痛、脊髓压 迫、不明原因发热。
肺炎支原体抗体IgG金标检测试剂盒作业指导书
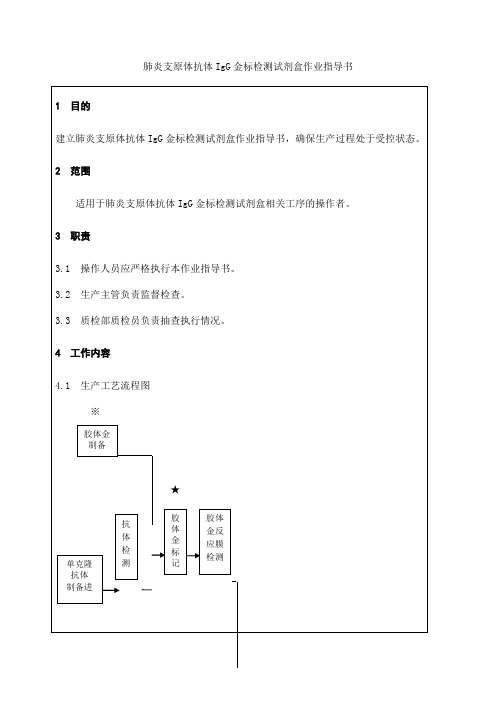
肺炎支原体抗体IgG金标检测试剂盒作业指导书4.2.6.1 反应体组装程序:a) 在S6塑料基板上贴双面胶带S5(29,48mm)二条;b) 在S5上贴反应膜S1(20mm),S1上下缘距S6上下缘各29mm;c) 在S6上贴吸水纸S3(30mm),吸水纸下缘与S1上缘交接1mm,上缘与S5的上边缘对齐;d) 在S5下端贴无纺布S2-1,其上缘压住S1下缘1mm;e) 在S2-1上平放金标抗体反应膜S4(10mm)上缘对齐;f) 在S4上平放无纺布S2-2(30mm)上下缘分别S4、S6对齐;g) 将组装成型的反应体系用电脑可调式切割机切成4.2mm测试条,装入干燥器,待包装。
4.2.6.2 成品包装:每支成品先装聚苯乙烯塑料外壳,再用镀铝膜包装加干燥剂,附说明书,打批号入库,每批留样100人份,以备复检.4.2.7 参比品制备4.2.7.1 肺支Ig-G阳性血清质控品取临床确诊肺衣病人(临床症状明显、肺炎衣原体培养阳性)血清15份,间接ELISA测定肺炎衣原体IgM抗体阳性,0D492≥0.3,混合血清加防腐剂,分装-70℃保存。
4.2.7.2 肺支Ig-G阴性血清质控品取健康人血清(体查健康,培养法和间接ELISA测定肺炎支原体IgG抗体均阴性,0D492<0.10)15份,混合血清加防腐剂,分装-70℃保存。
4.3 成品检测产品技术要求应符合《肺炎支原体抗体IgG金标检测试剂盒》产品注册标要求。
4.3.1 外观4.3.1.1 要求a)检测条:表面应平整、无划伤、开裂、变形及污渍;检测卡各组分附着牢固、内容齐全;b) 检测卡:外壳应平整,上下盖应均匀合拢,无明显间隙;反应芯试条在外壳内应附着牢固;4.3.1.2 检验在自然光线下,用手感和目力观察方法进行检验。
4.3.2 符合率4.3.2.1 阴性符合率4.3.2.1.1要求试剂卡测试肺炎支原体IgG抗体阴性质控血清10份,假阳性判断结果不多于1份,符合率应≥90%。
脊髓灰质炎病毒I型抗体胶体金检测试纸条的研制

脊髓灰质炎病毒I型抗体胶体金检测试纸条的研制王朝元; 黄圣; 尹玉莹; 莫娇; 项雅丽; 尹新涛【期刊名称】《《中南民族大学学报(自然科学版)》》【年(卷),期】2019(038)004【总页数】7页(P509-515)【关键词】脊髓灰质炎病毒I型; 抗体检测; 胶体金试纸条【作者】王朝元; 黄圣; 尹玉莹; 莫娇; 项雅丽; 尹新涛【作者单位】中南民族大学生命科学学院武汉430074; 武汉生命科技股份有限公司武汉430079【正文语种】中文【中图分类】Q939.91脊髓灰质炎病毒(poliovirus,PV)是引起脊髓灰质炎的病原体,主要是通过侵犯中枢神经系统,引发弛缓性肌肉麻痹[1,2].世界卫生组织(WHO)于1988年提出“到2000年全球消灭脊髓灰质炎”的决议后,全球广泛使用脊灰疫苗,为人类提供免疫保障,脊髓灰质炎病例也减少了99%以上.目前世界正处于根除脊髓灰质炎的边缘,世界各国正在为实现全球无脊灰做出努力. 中和试验法(Neutralization test,NT)是病毒感染的血清学诊断和血清流行病学研究中的“金标准”[3],需要利用符合标准的生物安全要求的细胞培养物和活病毒,获得结果耗时较长;EDEVAG G 等[4]建立了脊髓灰质炎病毒结合抑制试验(PoBI) 用于检测服用OPV、IPV疫苗人群中血清中和抗体滴度.在此基础上,SCHEPP R M等[5]开发结合阻断多重免疫测定法(Polio MIA)用于同时针对所有三种脊髓灰质炎病毒类型的血清抗体.PoBI与Polio MIA结果显示与NT的良好相关性,但POBI、Polio MIA对于大规模检测需要相对多的血清,且必须分别确定针对所有三种类型的抗体,实验过程需耗时1~2 d,还需捕获(结合抑制)测定降低与其他肠道病毒抗体的非特异性交叉反应性;整个过程中需要较高水平实验室条件,现场大规模检测免疫效果不及时.胶体金免疫层析技术在临床上应用广泛,具有技术操作简单、快速显示结果、结果判断方便、不需要严格的实验室条件和专业技能培训等优点,在快速高通量检测诊断领域推广迅速.本文拟用脊灰病毒Sabin株I型单克隆抗体研制检测人类血清中脊灰病毒I型抗体的胶体金试纸条,为脊灰的流行病学研究以及快速大规模检测脊灰I型疫苗免疫效果提供参考.1 材料和方法1.1 试剂和仪器DMEM basic (Gibco);1×PBS(Hyclone);青霉素-链霉素溶液(Hyclone);胎牛血清(Biological Industries);DMSO(Biosharp);弗氏不完全佐剂、氯金酸、柠檬酸三钠(Sigma);正辛酸(国药集团化学试剂);SDS-PAGE蛋白上样缓冲液(5×,上海碧云天);硝酸纤维膜180 (NC膜,Millipore);玻璃纤维素膜8965(上海捷宁生物);血清样品、甲型肝炎病毒、乙型肝炎病毒、麻疹病毒、脊髓灰质炎病毒阳性及阴性血清(武汉生命科技公司提供).CO2培养箱(MCO-15AC,SANYO Electric Biology Co, Ltd);酶标仪(BioTek Instruments, Inc);核酸定量仪(NANODROP 2000 Spectrophotometer, Thermo scientific);超高速冷冻离心机(CP100MX,rotor:P40ST-1520, Hitachi);羊抗鼠IgG抗体、鼠抗人IgG抗体(杭州隆基生物);人脊髓灰质炎病毒IgG ELISA测定试剂盒(上海通蔚生物);划膜仪、切条机(杭州峰航科技);221BR半干转仪(Bio-Red Laboratories, Inc.).1.2 细胞、病毒和动物抗脊髓灰质炎病毒Sabin株I型杂交瘤细胞株62-F5由本实验室制备冻存,用含20%胎牛血清的DMEM培养;脊髓灰质炎病毒Sabin I型减毒活疫苗株由本实验室保存;SPF级Balb/c小鼠购自湖北省实验动物研究中心,于中南民族大学实验动物中心饲养.1.3 杂交瘤细胞的培养与效价测定复苏冻存的抗脊灰病毒的杂交瘤细胞62-F5,用含20%胎牛血清的DMEM培养,适时观察更换培养液,当细胞密度达到80%时,用于测定细胞上清效价以及准备在小鼠体内接种杂交瘤细胞.以本实验室建立的间接ELISA方法测定上清抗体效价[6].1.4 小鼠腹水的制备与纯化鉴定8周龄的SPF级Balb/c雌鼠,腹腔注射弗氏不完全佐剂300 μL /只,一周后,小鼠腹腔注射约2×105个交瘤细胞62-F5;小鼠的腹部膨胀后,适时收获腹水.用辛酸-硫酸铵法纯化腹水单抗[7],置于4 ℃,在1×PBS 中透析过夜;收集透析后的样品,通过超滤浓缩收集到约1.5 mL单抗,用OD280法测定单抗浓度,再将纯化的单抗进行效价测定(方法同1.3)、还原性凝胶电泳(12%分离胶、5%浓缩胶)与非还原性凝胶电泳(5%分离胶、4%浓缩胶),并进行Western Blot分析.1.5 胶体金及胶体金标记物的制备与纯化1.5.1 胶体金的制备用柠檬酸三钠还原法[8]制备40 nm的胶体金:99 g去离子水置于磁力搅拌器上加热搅拌,沸腾后加入1 mL 1%氯金酸,煮沸后迅速加入1 mL 1%柠檬酸三钠溶液至溶液颜色变为稳定的酒红色,冷却后定容至100 mL,置于4 ℃避光保存.1.5.2 胶体金标记物的最适标记蛋白pH的确定取10个1.5 ml 离心管,各加入1 mL胶体金溶液,分别加入0, 5, 10, 15, 20, 25, 30, 35, 40, 45 μL的0.2 mol/L K2CO3溶液调节pH,再分别加入10 μg单抗,混匀并静置10 min,加入100 μL 10% NaCl溶液,混匀并静置30 min后,观察EP管中溶液颜色变化.使溶液保持红色的最低pH值确定为最适pH值.1.5.3 单抗最适标记量的确定取9个1.5 mL离心管,各加入1 mL胶体金溶液,用0.2 mol/L K2CO3溶液调节胶体金溶液至最适pH,在以上各EP管中分别加入0, 2, 4, 6, 8, 10, 12, 14, 16 μg的单抗,混匀并静置10 min,再向各管中加入100 μL 10% NaCl溶液,混匀并静置30 min后,观察EP管中溶液颜色变化,溶液保持红色的最低抗体量即为最佳抗体量.在实际操作过程中将标记蛋白的最低用量增加10%~30%作为最佳抗体量.1.5.4 标记取制备好的40 nm胶体金溶液1mL,用0.2 mol/L K2CO3溶液调整至最适pH,将14.4 μL单抗加入溶液中,混匀静置10 min;添加20 μL 20% BSA进行封闭,混匀静置30 min;室温条件下,加入16 μL I型脊灰病毒(PVI)抗原,使之形成金标-抗体-抗原复合物.将金标-抗体-抗原复合物于2,000 r/min离心15 min,弃沉淀,加入1 mL胶体金工作液后用超声重悬;12000 r/min离心20 min,弃上清;重复离心,用100 μL胶体金工作液超声重悬,4 ℃避光保存备用.1.6 胶体金试纸条的制备1.6.1 金标垫的的制备将玻璃纤维素膜裁剪成0.5 cm×30 cm大小的条带,把制备的胶体金标溶液均匀的覆盖在玻璃纤维素膜条带上,置于37 ℃烘箱烘干,放入铝箔袋密封,室温保存.1.6.2 NC膜的处理将硝酸纤维素膜裁剪成2.5 cm×30 cm大小的条带,组装到PVC板上,离膜下端0.7 cm处用划膜机包被1 mg/mL的鼠抗人IgG二抗作为检测线,带宽为2 mm.向上间隔0.7 cm处包被l mg/mL的羊抗鼠IgG二抗作为质控线.置于37 ℃烘箱烘干,放入铝箔袋密封,室温保存.1.6.3 胶体金试纸条的组装在PVC板上粘贴吸水垫、NC膜、金标垫和样品垫,各部分重叠约2 mm,用切条机切成4 mm宽的试纸条,装入塑料外壳中,放入铝箔袋密封中干燥保存. 1.7 灵敏度测试将已知的脊髓灰质炎病毒阳性血清按照1∶5, 1∶10, 1∶20, 1∶40, 1∶80, 1∶160稀释,各加100 μL于加样处,反应15 min,观察结果,以T线显色最浅时的稀释度作为试纸条最低检测浓度.1.8 特异性用制备的检测试纸条分别检测已知的甲型肝炎病毒抗体阳性血清、乙型肝炎病毒抗体阳性血清、麻疹病毒抗体阳性血清、脊灰病毒抗体阳性及阴性血清,将各样品进行10倍稀释,各加100 μL于加样处,反应15 min,观察试纸条显色情况.1.9 试纸条的初步应用用制备的胶体金试纸条和人脊髓灰质炎病毒IgG(PV-IgG)ELISA试剂盒同时分别检测30份血清样品.2 结果2.1 杂交瘤细胞的培养与效价测定复苏的杂交瘤细胞圆润透亮,状态较好(见图1),生长5 d后,细胞密度约80%,培养液颜色由红色变为微黄色,收集细胞上清测定细胞上清中抗体效价.收集上清液,利用间接ELISA法测得此株杂交瘤细胞62-F5的抗体效价为1∶8(见表1). a~d) 细胞培养第1,3,4,5 d 图1 杂交瘤细胞增殖培养Fig.1 Hybridoma cell proliferation culture表1 间接ELISA测定培养细胞上清效价Tab.1 Determination of supernatant titer of hybridoma cells by indirect ELISA腹水单抗P/N原液8.512±0.0011︰25.594±0.0021︰42.877±0.0601︰82.528±0.0131︰162.040±0.024空白平均0.013±0.015阴性对照1.048±0.196阳性对照9.159±0.0532.2 单抗的制备与纯化用辛酸-硫酸铵法纯化腹水单抗,透析过夜,用OD280法测定单抗浓度为15.364 mg/mL,间接ELISA测得腹水单抗效价为l∶51200(见表2).单抗通过还原性与非还原性凝胶电泳,结果显示单抗重链约70 KDa,轻链约23 KDa(见图2a);单抗分子量约800~900 KDa(见图2b),此单抗类型可能为IgM.脊灰病毒PVI的3种结构蛋白VP1, VP2, VP3的分子量大小分别为35, 28, 24 KDa[9].Western Blot结果可见:样品1泳道显示制备的单抗可识别脊灰抗原中28, 35 KDa的蛋白条带,此处条带为脊灰抗原VP1, VP2结构蛋白,且与对照组Vero细胞不发生反应.表2 间接ELISA法测定腹水单抗效价Tab.2 Determination of ascites monoclonal antibody titer by indirect ELISA腹水单抗P/N1︰5014.630±0.1241︰10013.696±0.0431︰20012.953±0.1501︰40012.000±0.0401︰80011.012±0.0241︰16009.954±0.1001︰32008.751±0.0581︰64007.241±0.0061︰128006.533±0.2401︰256004.276±0.1511︰512002.592±0.0491︰1024001.615±0.011空白平均0.013±0.006阴性对照1.000±0.019阳性对照11.587±0.075图2a中:M)蛋白标准品;1)浓缩后的单抗;2)浓缩滤出液;3)浓缩前的单抗图2b中:M1)低分子量蛋白标准品;M2)高分子量蛋白标准品;1~4)单抗不同的上样量a)单抗还原性凝胶电泳图谱;b)单抗非还原性凝胶电泳图谱图2 单抗电泳图谱Fig.2 Monoclonal electrophoresis mapM)蛋白标准品;1) I型脊灰病毒;2) vero细胞图3 Western Blot结果Fig.3 Western Blot results2.3 胶体金的制备采用柠檬酸三钠法制备胶体金颗粒,通过可见分光光度计扫描胶体金溶液最大吸收峰,根据彭剑淳[10]等拟合出胶体金颗粒最大吸收峰波长和胶体金颗粒的粒径之间线性回归方程,测算粒径约为40 nm(见图4a).a)标记前胶体金溶液波长扫描图;b)标记后金标探针波长扫描图图4 可见分光光度计波长扫描图Fig.4 Visible spectrophotometer wavelength scan2.4 胶体金标记单抗的最适pH值加入不同量的K2CO3调整pH,在加入0~15 μL的0.2 mol/L K2CO3后,胶体金溶液颜色由紫红色转变为玫红色;再加入20~45 μL的0.2 mol/L K2CO3后溶液颜色均呈酒红色(见图5),所以选用加入20 μL的0.2 mol/L K2CO3调节节胶体金溶液的pH,经测定其pH为8.5,作为标记单抗的最适pH值.图5 胶体金标记脊灰I型单抗的最适pH值检测Fig.5 Determination of the optimal pH of colloidal gold-labeled polio-type I monoclonal antibody 2.5 胶体金标记单抗最适浓度将胶体金的pH调整到最适pH值后,分别加入不同量的单抗,观察溶液颜色变化(见图6).当抗体量在0~10 μg之间时,溶液颜色由紫黑色渐变为紫红色;当抗体量达到12 μg以上时,胶体金颜色为酒红色,且颜色稳定不再变化,以12 μg单抗的用量为胶体金标记的最低用量,在此基础上增加20%,即每毫升胶体金溶液中加入14.4 μg单抗.图6 胶体金标记脊灰I型单抗的最适浓度的确定Fig.6 Determination of the optimum concentration of colloidal gold-labeled polio-type I monoclonal antibody2.6 胶体金标记的鉴定根据1.5中确定的单抗最适标记条件,pH 8.5、抗体浓度14.4 μg/mL,制备出胶体金探针溶液,通过紫外分光光度计在400~700 nm波长范围内扫描,与标记前波长扫描图比较(见图4b).观察到胶体金标探针的最大吸收峰波长红移,表明抗体已吸附到胶体金上,胶体金探针制备成功.2.7 胶体金组装及结果判定组装胶体金试纸条(见图7a), 在样品垫上滴加约10 μL的待检样品,滴加2滴稀释液,15 min后观察结果.若样品中含有人源性的抗PVI的IgG,则在试纸条的T线与C线处各出现一条色带;若样品中不含人源性的抗PVI的IgG,则只在试纸条的C线处出现一条色带(见图7b).a)试纸条组装图;b)试纸条检测标准图7 试纸条组装图及试纸条检测标准Fig.7 Test strip assembly drawing and test strip detection standard2.8 试纸条灵敏度试验将脊髓灰质炎病毒抗体标准阳性血清作不同倍数稀释,分别为1∶5, 1∶10, 1∶20, 1∶40, 1∶80,1∶160,该试纸条检测敏感度为1∶80(见图8).图8 胶体金试纸条敏感度试验结果Fig.8 Colloidal gold test strip sensitivity test results2.9 试纸条特异性试验用制备的试纸条分别检测已知的甲型肝炎病毒抗体阳性血清、乙型肝炎病毒抗体阳性血清、麻疹病毒抗体阳性血清、脊灰病毒抗体阳性和阴性血清.于试纸条加样处各加入10 μL样品,滴加2滴稀释液,反应15 min,结果显示试纸条对脊灰病毒阳性血清检测为阳性结果,对甲肝阳性血清、乙肝阳性血清、麻疹阳性血清、脊灰阴性血清显示为阴性结果(见图9),说明该试纸条特异性良好.1)脊灰病毒抗体阳性血清;2) 脊灰病毒抗体阴性血清;3) 甲型肝炎病毒抗体阳性血清;4) 乙型肝炎病毒抗体阳性血清;5) 麻疹病毒抗体阳性血清图9 胶体金试纸条特异性试验结果Fig.10 Colloidal gold test strip specificity test results2.10 胶体金试纸条初步应用采用制备的胶体金试纸条和人脊髓灰质炎病毒IgG ELISA试剂盒同时检测30份血清样品.结果显示胶体金试纸条检出阳性样品18份,阴性样品12份;ELISA试剂盒检出阳性样品22份,阴性样品8份(见表3);符合率为86.7%(26/30).表3 样品检测结果Tab.3 Sample test resultsELISA检测结果胶体金检测结果阳性2218阴性812合计30303 讨论脊髓灰质炎是由脊髓灰质炎病毒引起的急性传染病,严重危害儿童健康.脊灰病毒感染儿童后,会造成儿童肢体迟缓性麻痹,又称作“小儿麻痹症”.该病是我国免疫规划里的传染病,接种疫苗是预防和控制该病的有效手段.但疫苗的生产、储运和接种各环节以及接种者的个体差异均能影响疫苗的接种效果,导致接种失败.因此,开展免疫效果监测,可及时发现接种失败、抗体水平低下者,及时采取补种措施;因此,脊灰抗体水平检测对防疫工作有重大意义.但是目前免疫效果监测所用方法复杂、耗时长、专业要求高,不适合大规模检测,因此迫切需要快速高通量检测疫苗接种后抗体水平技术.胶体金免疫层析(GICA)技术是一种简易、快速的免疫学检测技术,一般只需约10 min可得到检测结果.结果显示直观、快速,且不受仪器限制,在疾病检验检疫工作中具有广泛的应用价值.氯金酸与还原剂(如白磷,柠檬酸三钠等)反应,可形成稳定的胶体金颗粒,能与多种生物大分子紧密结合.制备胶体金的方法很多种,最常用的是柠檬酸三钠还原法来制备胶体金,但制备出高质量胶体金颗粒(形状、大小均一、颗粒稳定)受到很多因素影响[11,12],需要高度洁净的玻璃器皿、高质量的化学试剂、熟练操作手法等要素.胶体金颗粒的直径大小受还原剂的种类及用量的影响,粒径的大小影响胶体金的敏感性和稳定性,粒径越小稳定性较好,但敏感性较低.本研究初步研制出I型脊灰病毒抗体检测试纸条,该胶体金试纸条的敏感性为1∶80;特异性检测显示对脊灰抗体阳性血清为阳性结果,对甲型肝炎病毒抗体阳性血清、乙型肝炎病毒抗体阳性血清、麻疹病毒抗体阳性血清、脊灰病毒抗体阴性血清进行检测显示为阴性结果,说明该试纸条特异性良好.与PV-IgG ELISA检测符合率为86.7%,可用于临床快速检测人血清脊灰抗体,对接种疫苗后效果检测具有重要意义.参考文献【相关文献】[1] 金奇. 医学分子病毒学[M]. 北京:科学出版社,2001:497-509.[2] STRAUSS J H, STRAUSS E G. Viruses and human disease[M]. 北京:科学出版社,2006:63-64.[3] TYRRELL D. Guide to poliovirus isolation and serological techniques for poliomyelitis surveillance[J]. J Clin Pathol, 1979, 32(12):1306-1306.[4] EDEVAG G, WAHREN B, OSTERHAUS A D, et al. Enzyme-linkedimmunosorbent assay-based inhibition test for neutralizing antibodies to polioviruses as an alternative to the neutralization test in tissue culture[J]. J Clin Microbiol, 1995,33(11):2927-2930.[5] SCHEPP R M, BERBERS G A M, FERREIRA J A, et al. A novel multiplex poliovirus binding inhibition assay applicable for largeserosurveillance and vaccine studies, without the useof live poliovirus[J]. J Virol Methods, 2017, 241:15-23.[6] 王朝元, 唐永洪, 黄圣, 等. 脊髓灰质炎病毒I型单克隆抗体的制备[J]. 中南民族大学学报(自然科学版), 2018,37(4): 35-39.[7] 金伯泉. 细胞和分子免疫学实验技术[M]. 西安:第四军医大学出版社, 2002.[8] FERENS G. Controlled nucleation for the regulation of the particle size inmonodisperse gold suspensions[J]. Nature Physical Science, 1972, 241(105):20-22.[9] OUELLETTE T, GIARDINA S L, NELSON E. Large-scale chromatographic purification ofan attenuatedchimeric poliovirus[J]. Bioprocessing Journal, 2005, 4(2):31.[10] 彭剑淳, 刘晓达, 丁晓萍, 等.可见光光谱法评价胶体金粒径及分布[J]. 军事医学科学院院刊, 2000,24(3): 211-212,237.[11] 张付贤,王兴龙. 免疫胶体金技术影响因素分析[J].中国畜牧兽医,2009,36(5):199-202.[12] BASSAB C, SYAMAL R. Manufacturing high quality gold sol[J].IVD Technol,2001(8):46-54.。
脊髓灰质炎IgG抗体检测试剂参考品的制备及标定

脊髓灰质炎IgG抗体检测试剂参考品的制备及标定谭振国;杨蓉;罗芳宇;谢忠平;李华;谢天宏;尹晓晓;龙润乡【期刊名称】《中国医药导报》【年(卷),期】2018(015)025【摘要】目的建立脊髓灰质炎IgG抗体检测试剂参考品,为脊髓灰质炎IgG抗体检测试剂盒的性能评价提供可靠的质控品.方法通过中和实验对血清进行确认,获得了符合要求的血清,每个型别参考品有22份样品,包含10份阳性参考品、10份阴性参考品、1份最低检出量参考品、1份精密性参考品.结果脊灰病毒IgG抗体Ⅰ、Ⅱ、Ⅲ型阴性参考品符合率均不低于9/10,阳性参考品符合率均不低于8/10,精密性参考品变异系数均不高于15%,最低检出量参考品均不低于1:8;参考品37℃放置5d,反复冻融5次后稳定性良好.结论制备的脊髓灰质炎IgG抗体检测试剂参考品经各项试验检测结果合格,可用于脊髓灰质炎IgG抗体检测试剂的质控.【总页数】4页(P21-24)【作者】谭振国;杨蓉;罗芳宇;谢忠平;李华;谢天宏;尹晓晓;龙润乡【作者单位】中国医学科学院北京协和医学院医学生物学研究所,云南昆明650118;中国医学科学院北京协和医学院医学生物学研究所,云南昆明650118;中国医学科学院北京协和医学院医学生物学研究所,云南昆明650118;中国医学科学院北京协和医学院医学生物学研究所,云南昆明650118;中国医学科学院北京协和医学院医学生物学研究所,云南昆明650118;中国医学科学院北京协和医学院医学生物学研究所,云南昆明650118;中国医学科学院北京协和医学院医学生物学研究所,云南昆明650118;中国医学科学院北京协和医学院医学生物学研究所,云南昆明650118【正文语种】中文【中图分类】R373.22【相关文献】1.肠道病毒71型抗原检测试剂参考品制备及标定 [J], 龙润乡;李华;杨蓉;杨婷;岳磊;宋晓燕;谢忠平2.日本血吸虫抗体检测试剂盒(IHA法)参考品的制备及标定 [J], 呼明闯;汪天平;王恩木;章乐生;司武敏;杨荣笙;罗俊平;郝晓君;翟杜娟3.人细小病毒B19 IgG抗体检测试剂国家参考品的建立及应用 [J], 周海卫;田亚宾;郭世富;黄颖;张春涛4.IPV-D抗原检测试剂参考品的制备及标定 [J], 谭振国;龙润乡;杨蓉;罗芳宇;李华;谢天宏;杨婷;岳磊;谢忠平5.染色体拷贝数变异国家参考品的制备及标定 [J], JIA Zheng;ZHANG Wenxin;LI Lili;SUN Nan;QU Shoufang;HUANG Jie因版权原因,仅展示原文概要,查看原文内容请购买。
人细小病毒B19 IgG抗体检测试剂国家参考品的建立及应用

人细小病毒B19 IgG抗体检测试剂国家参考品的建立及应用周海卫;田亚宾;郭世富;黄颖;张春涛【期刊名称】《标记免疫分析与临床》【年(卷),期】2018(025)002【摘要】目的建立人细小病毒B19 IgG抗体检测试剂国家参考品并对试剂质量进行评价.方法收集并筛选B19 IgG抗体阳性和阴性样本,建立人细小病毒B19 IgG 抗体检测试剂国家参考品,包括:阳性参考品10份、阴性参考品10份、重复性参考品1份和最低检测限参考品5份,以WHO第二代B19抗体(IgG)参考品进行溯源和标定,并进行稳定性考察.使用建立的参考品对人细小病毒B19 IgG抗体检测试剂盒进行质量评价.结果重复性参考品的标定结果为16 IU/mL,最低检测限参考品(S1 ~S4)的标定结果分别为29、14、7、4 IU/mL,S5为阴性基质血浆;室温(25℃)放置3d、4℃放置5d及反复冻融5次均不影响参考品的稳定性;试剂质量评价结果显示,阴性符合率1家为9/10,其余均为10/10,阳性符合率均为10/10,重复性均符合要求,最低检测限结果1家为14 IU/mL、2家为7 IU/mL、3家为4 IU/mL.结论建立的参考品能够用于人细小病毒B19 IgG抗体检测试剂盒的质量控制.【总页数】5页(P282-285,292)【作者】周海卫;田亚宾;郭世富;黄颖;张春涛【作者单位】中国食品药品检定研究院体外诊断试剂检定所传染病诊断试剂二室,北京100050;中国食品药品检定研究院体外诊断试剂检定所传染病诊断试剂二室,北京100050;中国食品药品检定研究院医疗器械标准管理研究所,北京100050;中国食品药品检定研究院医疗器械标准管理研究所,北京100050;中国食品药品检定研究院体外诊断试剂检定所传染病诊断试剂二室,北京100050【正文语种】中文【相关文献】1.细菌感染多重核酸检测试剂参考品的建立 [J], 刘东来;周海卫;石大伟;沈舒;田亚宾;张春涛2.脊髓灰质炎IgG抗体检测试剂参考品的制备及标定 [J], 谭振国;杨蓉;罗芳宇;谢忠平;李华;谢天宏;尹晓晓;龙润乡3.人细小病毒B19核酸检测试剂国家参考品的建立 [J], 麻婷婷;许四宏;周海卫4.流感嗜血杆菌核酸检测试剂盒国家参考品的建立 [J], 黄洋;李康;徐潇;李江姣;王春娥;梁丽;陈驰;刘茹凤;叶强5.人类免疫缺陷病毒抗体EIA检测试剂质控参考品的建立 [J], 王兵;陆明;宋爱京;尹红章;李德富因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CHINA MEDICAL HERALD Vol.15No.25September 2018[基金项目]云南省重点新产品开发计划项目(2012BC006);云南省应用基础研究面上项目(2010ZC230)。
▲通讯作者脊髓灰质炎是由脊髓灰质炎病毒所造成的传染性极强的疾病,无特效治疗方法,但可通过疫苗预防。
尽管20世纪50年代以来就有有效的脊灰疫苗,在20世纪80年代前,每年仍有>35万儿童因脊髓灰质炎而麻痹。
因此世界卫生组织(WHO)1988年发起全球消灭脊髓灰质炎的倡议。
到1999年,脊髓灰质炎病例已减少了99%,但全球仍未能实现消灭脊髓灰质炎的目标[1]。
目前脊髓灰质炎病毒在巴基斯坦、阿富汗、尼日利亚和印度仍有传播[2-3],使我国脊髓灰质炎野病毒(wild polio virus,WPV)输入性风险持续存在,2011年,我国新疆维吾尔自治区发生了由巴基斯坦输入的WPV引起的暴发疫情[4-7]。
全球消灭脊髓灰质炎形势不容乐观,尤其是与我国相邻国家脊髓灰质炎疫情呈高发态势,我国发生WPV 输入的风险增大[8-9]。
随着WHO 消灭脊髓灰质炎进程的实施,全球首剂Sabin 株脊髓灰质炎灭活疫苗(IPV)在昆明生物所研制成功,IPV 的生产已成为防控脊髓灰质炎感染流行、保持人群高免疫水平并最终消灭脊髓灰质炎的关键[10]。
无论疫苗的效力实验,还是疫苗免疫效果评价都会进行抗体的检测,而脊髓灰质炎病毒抗体参考品的建立目前没有报道,因此,有必要建立脊髓灰质炎病毒IgG 抗体参考品对脊髓灰质炎病毒IgG 抗体检测试剂的质量进行规范。
在此前提下,本实验室制备及标定了三套分别为Ⅰ、Ⅱ、Ⅲ型脊髓灰质炎病毒抗体检测试剂的参考品,用于不同型别脊髓灰质炎病毒IgG 抗体检测试剂的质控,现脊髓灰质炎IgG 抗体检测试剂参考品的制备及标定谭振国杨蓉罗芳宇谢忠平李华谢天宏尹晓晓龙润乡▲中国医学科学院北京协和医学院医学生物学研究所,云南昆明650118[摘要]目的建立脊髓灰质炎IgG 抗体检测试剂参考品,为脊髓灰质炎IgG 抗体检测试剂盒的性能评价提供可靠的质控品。
方法通过中和实验对血清进行确认,获得了符合要求的血清,每个型别参考品有22份样品,包含10份阳性参考品、10份阴性参考品、1份最低检出量参考品、1份精密性参考品。
结果脊灰病毒IgG 抗体Ⅰ、Ⅱ、Ⅲ型阴性参考品符合率均不低于9/10,阳性参考品符合率均不低于8/10,精密性参考品变异系数均不高于15%,最低检出量参考品均不低于1∶8;参考品37℃放置5d,反复冻融5次后稳定性良好。
结论制备的脊髓灰质炎IgG 抗体检测试剂参考品经各项试验检测结果合格,可用于脊髓灰质炎IgG 抗体检测试剂的质控。
[关键词]脊髓灰质炎IgG 抗体;参考品;质量控制;标定[中图分类号]R373.22[文献标识码]A[文章编号]1673-7210(2018)09(a)-0021-04Preparation and characterization of reference products for assay kit of IgG of poliomyelitisTAN Zhenguo YANG Rong LUO Fangyu XIE Zhongping LI Hua XIE Tianhong YIN Xiaoxiao LONG Runxiang ▲Institute of Medical Biology,Chinese Academy of Medical Sciences &Peking Union Medical College,Yunnan Province,Kunming 650118,China[Abstract]Objective Referance products were developed for assay kit of IgG of poliomyelitis to make it possible to re⁃liably control quality of the assay kits in evaluating their properties.Methods Serum was confirmed through a neutral⁃ization test to obtain the serum which met requirements.Twenty-two samples were collected for each type of reference products,including 10positive reference products,10negative ones,1reference product with the minimum detection limit and 1precise reference product.Results The conformity ratio of type Ⅰ,Ⅱand Ⅲnegative reference products of IgG of poliomyelitis was not below 9/10.The conformity ratio of positive reference products was not lower than 8/10,the coefficient of variation of precise reference was not higher than 15%,and the coefficient of variation of precise ref⁃erence products was not lower than 1/8.The reference products were placed at 37℃for 5days.They were still quitestable after 5repetitive freezing and thawing.Conclusion The prepared reference products of assay kit for IgG of po⁃liomyelitis were tested to be qualified in all tests and could be used for quality control over such assay kits.[Key words]Polio IgG antibody;Reference;Quality control;Characterization21将结果报道如下:1材料与方法1.1参考品的组成Ⅰ、Ⅱ、Ⅲ型参考品均包含10份阳参、10份阴参、1份最低检出量参考品、1份精密性参考品。
1.2试剂本实验室制备的脊髓灰质炎IgG抗体检测试剂盒(批号:20170901)。
1.3仪器离心机,水浴锅,隔水式恒温培养箱,二氧化碳培养箱,酶标仪。
1.4中和抗体实验待测样品(1∶4稀释)经56℃灭活30min后,加至96孔板中,50μL/孔,作2倍系列稀释后,分别与100 CCID50的IPV病毒悬液于37℃中和2h;加入(2~3)×105个/mL的Hep-2细胞悬液,100μL/孔,置37℃、5%CO2培养箱中培养7d。
将能抑制50%细胞病变的最高稀释度定为IPV抗体的中和效价,并以稀释倍数的倒数表示。
每次试验均设病毒回滴试验,回滴结果在32~320CCID50/孔时,试验判为成立。
以中和效价≥8判为中和抗体阳性。
1.5酶联免疫吸附测定(ELISA)竞争法标化参考品使用本实验室制备的脊髓灰质炎IgG抗体检测试剂盒(ELISA法)检测,最低检出量参考品Ⅰ、Ⅱ、Ⅲ型均以1∶2、1∶4、1∶8及1∶16,在板上作2倍系列稀释;每型别阴参10份,每份1孔;阳参10孔,每份1孔;每型别精密性参考品1份,连加10孔。
待测样品20μL/孔,设阴性3孔、阳性2孔、空白1孔,各型待标参考品分别加入Ⅰ、Ⅱ、Ⅲ型抗原检测板中,再分别加入Ⅰ、Ⅱ、Ⅲ型IPV-HRP,90μL/孔,37℃保温2h;0.01mol/L PBST洗板5次,TMB37℃显色10min终止反应。
在450nm波长处测量样品吸光度值(A值)。
1.6稳定性试验1.6.1热稳定性试验将3套参考品37℃放置3、5d 后(37℃放置1d,取出检测)。
1.6.2冻融试验将3套参考品反复冻融3、5次后,取出检测。
2结果2.1中和实验制备参考品2.1.1阳性参考品经中和试验确认脊髓灰质炎病毒抗体阳性,人血清(HS)以每名患者的双份血清均可中和脊髓灰质炎病毒,HS抗体效价为1∶8~1∶256,选取高中低不同效价的HS制备成4份阳性参考品,因无法筛到单型别抗体阳性样品,故HS均为三价中和抗体阳性,抗体编号为HS1~HS4,3个型别阳参1~阳参4为相同效价血清;检测不同型别牛血清(CS)和兔血清(RS)的效价,稀释成高中低不同效价的6份阳性参考品,各型阳参编号见表1。
各型别10份阳参2次中和实验检测均为阳性。
表1Ⅰ、Ⅱ、Ⅲ型阳性参考品编号注:HS:人血清;CS:牛血清;RS:兔血清2.1.2阴性参考品经中和实验确认脊髓灰质炎病毒抗体阴性,HS以每名患者的双份血清均不能完全中和脊髓灰质炎病毒,抗体效价<1∶8,制备成6份阴性参考品,编号为HS5~HS10,各型前6份阴参均相同;选取其他型别的CS和RS作为4份阴性参考品,各型阴参编号见表2。
各型别10份阴参2次中和实验检测均为阴性。
表2Ⅰ、Ⅱ、Ⅲ型阴性参考品编号2.1.3最低检出量参考品各型中选取1份2次中和抗体为阳性的血清,经1∶2、1∶4、1∶8及1∶16倍比稀释作为最低检出限参考品。
2.1.4精密性参考品各型中选取1份2次中和抗体为阳性的血清稀释后作为精密性参考品。
2.2ELISA法标定参考品2.2.1阳性参考品标定结果使用3批次脊髓灰质炎病毒抗体检测试剂、9人次对10份阳性参考品进行检测,Ⅰ型阳性参考品符合率为94.4%,Ⅱ型阳性参考品符合率为90.0%,Ⅲ型阳性参考品符合率为97.8%。
见表3。
表3Ⅰ、Ⅱ、Ⅲ型阳性参考品标定结果2.2.2阴性参考品标定结果3批9人次对阴性参考品进行检测,10份阴性参考品符合率为100%。
见表4。
2.2.3最低检出量参考品标定结果3批9人次对最低检出量参考品进行检测,Ⅰ、Ⅱ、Ⅲ型最低检出量参考品9次检测值均在1∶8~1∶32。
见表5。
Ⅰ型Ⅱ型Ⅲ型HS1HS1HS1HS2HS2HS2HS3HS3HS3HS4HS4HS4CSⅠ1CSⅡ1CSⅢ1CSⅠ2CSⅡ2CSⅢ2CSⅠ3CSⅡ3CSⅢ3RSⅠ1RSⅡ1RSⅢ1RSⅠ2RSⅡ2RSⅢ2RSⅠ3RSⅡ3RSⅢ3型别阳参1阳参2阳参3阳参4阳参5阳参6阳参7阳参8阳参9阳参10Ⅰ型Ⅱ型Ⅲ型HS5HS5HS5HS6HS6HS6HS7HS7HS7HS8HS8HS8HS9HS9HS9HS10HS10HS10CSⅡCSⅠCSⅠCSⅢCSⅢCSⅡRSⅡRSⅠRSⅠRSⅢRSⅢRSⅡ型别阴参1阴参2阴参3阴参4阴参5阴参6阴参7阴参8阴参9阴参10Ⅰ型阳参Ⅱ型阳参Ⅲ型阳参9/108/1010/109/109/1010/1010/108/109/109/109/1010/1010/109/1010/109/109/1010/109/1010/109/1010/109/1010/1010/1010/1010/10项目12345678922CHINA MEDICAL HERALD Vol.15No.25September2018表4Ⅰ、Ⅱ、Ⅲ型阴性参考品标定结果表5Ⅰ、Ⅱ、Ⅲ型最低检出量参考品标定结果2.2.4精密性参考品标定结果检测试剂的精密度用变异系数(CV)来衡量。
