实验一-3-5-二硝基水杨酸比色法-复原糖和总糖的测定
3,5-二硝基水杨酸比色法-还原糖和总糖的测定

3,5-二硝基水杨酸比色法-还原糖和总糖的测定3,5-二硝基水杨酸比色法是一种常用的测定还原糖和总糖含量的方法。
本文将介绍该方法的操作步骤、原理及注意事项。
一、操作步骤1. 样品制备:精确称取适量糖样品,加入足量去离子水稀释至1 mL,摇匀。
2. 试剂制备:(1) Na2CO3试液:称取0.5 g Na2CO3加入50 mL去离子水中,溶解并稀释至1 L。
(2) 3,5-二硝基水杨酸(DNS)重量浓度为1 g/L的甲醛溶液:按比例称取适量DNS和甲醛,在去离子水中稀释制成重量浓度为1 g/L的甲醛溶液。
3. 测定步骤:(1) 取3个试管,编号为A、B、C,并进行空白对照。
将A、B、C试管分别加入0.1 mL 样品,每个试管中加入相同量的0.9 mL去离子水。
在空白试管中加入相同量的去离子水代替样品。
(2) 在A试管中加入0.5 mL Na2CO3试液,摇匀。
(3) 将B试管浸于沸水中加热3-5分钟,使其中的还原糖完全还原。
(4) 在A、B两样品试管中加入0.5 mL甲醛溶液,摇匀并置于60℃水浴上加热10分钟。
(6) 加入1.5 mL水后,在空白对照试管和样品试管中均加入0.5 mL DNS溶液,摇匀。
(7) 在95℃水浴加热10分钟,并立即冷却至室温。
(8) 测量吸光度值,通过标准曲线计算样品中还原糖或总糖含量。
二、原理还原糖或总糖与Na2CO3在典型的碱性条件下发生醛基反应,把碳水化合物中的亲电基转化为醛基,再将其还原为对应的醇,生成糖醇和尿素等。
然后,在碱性条件下,醛基与3,5-二硝基水杨酸(DNS)反应,发生环化,生成糖醛酸化合物,这些化合物在pH9.0以下表现为桥形分子,具有紫色的吸收峰。
在高温条件下,DNS与糖醛酸化合物相结合,形成柿子色化合物,进一步增加吸收光的强度。
还原糖或总糖的含量可以通过比较样品的吸光度值和标准曲线来测定。
三、注意事项1. 避免试管附着并确保试管内部表面干净。
3,5-二硝基水杨酸法测定山楂片中还原糖和总糖含量

3,5-二硝基水杨酸法测定山楂片中还原糖和总糖含量3,5-二硝基水杨酸法是一种常用的测定还原糖和总糖含量的方法,其原理基于还原糖在酸性条件下与3,5-二硝基水杨酸反应生成红色化合物,而总糖则在强硫酸存在下加热分解,生成由葡萄糖和六碳糖等组成的还原糖,在酸性条件下与3,5-二硝基水杨酸反应生成红色化合物。
具体操作步骤如下:1. 取一定质量的山楂片粉末,加入适量的蒸馏水,加热水浴至沸腾,过滤,将过滤液冷却至室温。
2. 取0.2 ml 过滤液,加入2 ml 3,5-二硝基水杨酸溶液,摇匀后在60摄氏度恒温水浴中反应10分钟,然后放冷。
3. 吸收液的吸光度在515 nm处测定,还原糖含量的计算公式为:还原糖含量(%)= (As–A0)/(有效光程×C×0.88)×100,其中As为样品吸光度,A0为空白试剂吸光度,有效光程为1 cm,C为样品初始体积,0.88为还原糖的摩尔吸光系数。
4. 取剩余过滤液,加入相当于5倍于样品初始体积的浓硫酸,浸于沸水中煮2小时,浸于水中冷却,并用蒸馏水将瓶口水洗入容量瓶,摇匀。
5. 取0.1ml 还原糖水样稀释液加入容量瓶,加入相当于5倍于样品初始体积的浓硫酸,摇匀后加入适量的蒸馏水到刻度线,摇匀后离心。
6. 取0.1 ml 离心上清液,加入2 ml 3,5-二硝基水杨酸溶液,摇匀后在60摄氏度恒温水浴中反应10分钟,然后放冷。
7. 吸收液的吸光度在515 nm处测定,总糖含量的计算公式为:总糖含量(%)= (As–A0)/(有效光程×C×0.88)×100,其中As为样品吸光度,A0为空白试剂吸光度,有效光程为1 cm,C为样品初始体积,0.88为还原糖的摩尔吸光系数。
总之,3,5-二硝基水杨酸法是一种稳定可靠的方法,能够准确测定山楂片中的还原糖和总糖含量,为山楂片的质量控制提供了重要的参考。
总糖和还原糖的测定及葡萄糖标准曲线的绘制-3,5-二硝基水杨酸法

2、样品中总糖的水解、提取
准确称取0.2g山芋粉置于100ml三角烧瓶中
加3ml蒸馏水,调成糊状
取1~2滴于六凹 反应盘中,加1滴 I2-KI溶液,如果 完全不显蓝色,
即可进行下面的 操作。
再加12ml蒸馏水,5ml 6mol/L HCl 沸水浴,30min (不时搅拌)
冷却至室温 用6mol/L NaOH调pH7.0( pH试纸)
五、操作
1、样品中还原糖的提取
准确称取0.5g山芋粉置于100ml三角烧瓶中
加3ml蒸馏水,调成糊状 再加30ml蒸馏水
50℃水浴,30min (不时搅拌)
转移至50ml离心管中,4000rpm,5min
上清液1 沉淀
加20ml蒸馏水,洗涤沉淀,4000rpm,5min
上清液2 沉淀(弃) 置于容量瓶中,蒸馏水定容至100ml,混匀, 取1ml即可进行还原糖的测定。
还原糖在碱性条件下加热被氧化成糖酸及 其它产物,3,5-二硝基水杨酸则被还原为 棕红色的3-氨基-5-硝基水杨酸。
NaOH 加热
黄色
棕红色
在过量的NaOH碱性溶液中, 3-氨基-5-硝 基水杨酸呈橘红色,在540nm处有最大吸 收,在一定的浓度范围内,还原糖的量与 光吸收值成线性关系。利用比色法,在 540nm 波长下测定光密度值,查对标准曲 线并计算,便可求出样品中还原糖和总糖 的含量。
实验一、总糖和还原糖的测定
——3,5-二硝基水杨酸法
一、实验目的
1、掌握还原糖和总糖测定的基本原理; 2、学习用3,5-二硝基水杨酸法测定还原
糖的方法。
二、实验原理
还原糖是指含有自由醛基或者酮基的糖类, 单糖都是还原糖,双糖和多糖不一定是还 原糖;利用糖的溶解度不同,可将植物样 品中的单糖、双糖和多糖分别提取出来; 对没有还原性的双糖和多糖,可用酸水解 法使其降解成有还原性的单糖进行测定, 再分别求出样品中还原糖和总糖的含量 (还原糖以葡萄糖含量计)。
实验一,3,5-二硝基水杨酸比色法-还原糖和总糖的测定

实验一还原糖和总糖的测定——3,5-二硝基水杨酸比色法一、实验目的掌握还原糖和总糖测定的基本原理,学习比色法测定还原糖的操作方法和分光光度计的使用。
二、实验原理还原糖的测定是糖定量测定的基本方法。
还原糖是指含有自由醛基或酮基的糖类,单糖都是还原糖,双糖和多糖不一定是还原糖,其中乳糖和麦芽糖是还原糖,蔗糖和淀粉是非还原糖。
利用糖的溶解度不同,可将植物样品中的单糖、双糖和多糖分别提取出来,对没有还原性的双糖和多糖,可用酸水解法使其降解成有还原性的单糖进行测定,再分别求出样品中还原糖和总糖的含量(还原糖以葡萄糖含量计)。
还原糖在碱性条件下加热被氧化成糖酸及其它产物,3,5-二硝基水杨酸则被还原为棕红色的3-氨基-5-硝基水杨酸。
在一定范围内,还原糖的量与棕红色物质颜色的深浅成正比关系,利用分光光度计,在540nm波长下测定光密度值,查对标准曲线并计算,便可求出样品中还原糖和总糖的含量。
由于多糖水解为单糖时,每断裂一个糖苷键需加入一分子水,所以在计算多糖含量时应乘以0.9。
三、实验材料、主要仪器和试剂1.实验材料小麦面粉;广范pH试纸。
2.主要仪器(1)大试管:2×20cm×14(2)烧杯:100mL×3(3)三角瓶:100mL×1(4)容量瓶:100mL×3(5)移液管:1mL×3;2mL×2;10mL×4(6)吸耳球、玻璃棒(7)恒温水浴锅(8)漏斗、滤纸(9)白瓷缸、电炉(10)精度天平(11)分光光度计3.试剂(已制备)(1)1mg/mL葡萄糖标准液准确称取90℃烘至恒重的分析纯葡萄糖100mg,置于小烧杯中,加少量蒸馏水溶解后,转移到100mL容量瓶中,用蒸馏水定容至100mL,混匀,4℃冰箱中保存备用。
(2)3,5-二硝基水杨酸(DNS)试剂将6.3g 3,5-二硝基水杨酸(DNS)和2mol\L NaOH溶液262mL,加到500mL含有185g酒石酸钾钠的热水溶液中,再加5g重蒸酚和5g亚硫酸钠,搅拌溶解,冷却后加蒸馏水定容至1000mL,贮于棕色瓶中,7-10天后才能使用。
实验一35二硝基水杨酸比色法还原糖和总糖的测定

实验一还原糖和总糖的测定——3,5-二硝基水杨酸比色法一、实验目的掌握还原糖和总糖测定的基本原理,学习比色法测定还原糖的操作方法和分光光度计的使用。
二、实验原理还原糖的测定是糖定量测定的基本方法。
还原糖是指含有自由醛基或酮基的糖类,单糖都是还原糖,双糖和多糖不一定是还原糖,其中乳糖和麦芽糖是还原糖,蔗糖和淀粉是非还原糖。
利用糖的溶解度不同,可将植物样品中的单糖、双糖和多糖分别提取出来,对没有还原性的双糖和多糖,可用酸水解法使其降解成有还原性的单糖进行测定,再分别求出样品中还原糖和总糖的含量(还原糖以葡萄糖含量计)。
还原糖在碱性条件下加热被氧化成糖酸及其它产物,3,5-二硝基水杨酸则被还原为棕红色的3-氨基-5-硝基水杨酸。
在一定范围内,还原糖的量与棕红色物质颜色的深浅成正比关系,利用分光光度计,在540nm波长下测定光密度值,查对标准曲线并计算,便可求出样品中还原糖和总糖的含量。
由于多糖水解为单糖时,每断裂一个糖苷键需加入一分子水,所以在计算多糖含量时应乘以0.9。
三、实验材料、主要仪器和试剂1.实验材料小麦面粉;广范pH试纸。
2.主要仪器(1)大试管:2×20cm×14(2)烧杯:100mL×3(3)三角瓶:100mL×1(4)容量瓶:100mL×3(5)移液管:1mL×3;2mL×2;10mL×4(6)吸耳球、玻璃棒(7)恒温水浴锅(8)漏斗、滤纸(9)白瓷缸、电炉(10)精度天平(11)分光光度计3.试剂(已制备)(1)1mg/mL葡萄糖标准液准确称取90℃烘至恒重的分析纯葡萄糖100mg,置于小烧杯中,加少量蒸馏水溶解后,转移到100mL容量瓶中,用蒸馏水定容至100mL,混匀,4℃冰箱中保存备用。
(2)3,5-二硝基水杨酸(DNS)试剂将6.3g 3,5-二硝基水杨酸(DNS)和2mol\L NaOH溶液262mL,加到500mL含有185g酒石酸钾钠的热水溶液中,再加5g重蒸酚和5g亚硫酸钠,搅拌溶解,冷却后加蒸馏水定容至1000mL,贮于棕色瓶中,7-10天后才能使用。
实验一35二硝基水杨酸比色法还原糖和总糖的测定

百度文库- 让每个人平等地提升自我实验一还原糖和总糖的测定——3,5-二硝基水杨酸比色法一、实验目的掌握还原糖和总糖测定的基本原理,学习比色法测定还原糖的操作方法和分光光度计的使用。
二、实验原理还原糖的测定是糖定量测定的基本方法。
还原糖是指含有自由醛基或酮基的糖类,单糖都是还原糖,双糖和多糖不一定是还原糖,其中乳糖和麦芽糖是还原糖,蔗糖和淀粉是非还原糖。
利用糖的溶解度不同,可将植物样品中的单糖、双糖和多糖分别提取出来,对没有还原性的双糖和多糖,可用酸水解法使其降解成有还原性的单糖进行测定,再分别求出样品中还原糖和总糖的含量(还原糖以葡萄糖含量计)。
还原糖在碱性条件下加热被氧化成糖酸及其它产物,3,5-二硝基水杨酸则被还原为棕红色的3-氨基-5-硝基水杨酸。
在一定范围内,还原糖的量与棕红色物质颜色的深浅成正比关系,利用分光光度计,在540nm波长下测定光密度值,查对标准曲线并计算,便可求出样品中还原糖和总糖的含量。
由于多糖水解为单糖时,每断裂一个糖苷键需加入一分子水,所以在计算多糖含量时应乘以。
三、实验材料、主要仪器和试剂1.实验材料小麦面粉;广范pH试纸。
2.主要仪器(1)大试管:2×20cm×14(2)烧杯:100mL×3(3)三角瓶:100mL×1(4)容量瓶:100mL×3(5)移液管:1mL×3;2mL×2;10mL×4(6)吸耳球、玻璃棒(7)恒温水浴锅(8)漏斗、滤纸(9)白瓷缸、电炉(10)精度天平(11)分光光度计3.试剂(已制备)(1)1mg/mL葡萄糖标准液准确称取90℃烘至恒重的分析纯葡萄糖100mg,置于小烧杯中,加少量蒸馏水溶解后,转移到100mL容量瓶中,用蒸馏水定容至100mL,混匀,4℃冰箱中保存备用。
(2)3,5-二硝基水杨酸(DNS)试剂将3,5-二硝基水杨酸(DNS)和2mol\L NaOH溶液262mL,加到500mL含有185g酒石酸钾钠的热水溶液中,再加5g重蒸酚和5g亚硫酸钠,搅拌溶解,冷却后加蒸馏水定容至1000mL,贮于棕色瓶中,7-10天后才能使用。
植物组织中总糖及还原糖的测定

3、样品含糖量的测定: 、样品含糖量的测定 取提取液1.0ml,按上表操作。 取提取液 ,按上表操作。
五、计算: 计算
还原糖含量(µg/ g )=
还原糖含量χ1(µg) ×样液总体积 测定用样品液体积×样品鲜重(g)
总糖含量(µg/ g )=
水解后还原糖含量 (µg) ×样液总体积×0.9 测定用样品液体积×样品鲜重(g)
四、实验步骤: 实验步骤:
1、葡萄糖标准曲线的绘制 、 2、还原糖的提取 、 3、样品含糖量的测定: 、样品含糖量的测定
1、葡萄糖标准曲线的绘制: 、葡萄糖标准曲线的绘制
支试管, 取7支试管,按下表操作,以标准葡萄糖含量为横坐标, 支试管 按下表操作,以标准葡萄糖含量为横坐标, 对应的吸光值为纵坐标,绘制标准曲线。 对应的吸光值为纵坐标,绘制标准曲线。
三、实验材料、仪器和试剂: 实验材料、仪器和试剂:
1、实验材料:苹果(约0.5 g) 、实验材料:苹果( ) 2、仪器:水浴锅;可见分光光度计等。 、仪器:水浴锅;可见分光光度计等。 3、试剂: 、试剂:
(1)1 mg/mL葡萄糖标准液 ) 葡萄糖标准液 二硝基水杨酸( 碱性) (2)3,5-二硝基水杨酸(DNS)试剂 碱性 ) 二硝基水杨酸 )试剂(碱性 (3)6M HCl和6M NaOH ) 和
管 号 0(参比溶液 参比溶液) 参比溶液 1 2 3 4 5
还原糖提取液
葡萄糖 蒸馏水 DNS 沸水 蒸馏水 光密度值 标准液 mL mL mL OD540nm 浴 mL 0 0.2 0.4 0.6 0.8 1.0 1.0ml 1 0.8 0.6 0.4 0.2 0 1.0 5min 冷却
4
葡萄糖含 量(µg) ) 0 200 400 600 800 1000
还原糖和总糖的测定3,5-二硝基水杨酸比色法

还原糖和总糖的测定3,5-二硝基水杨酸比色法一、目的掌握还原糖和总糖测定的基本原理,学习比色法测定还原糖的操作方法和分光光度计的使用。
二、原理还原糖的测定是糖定量测定的基本方法。
还原糖是指含有自由醛基或酮基的糖类,单糖都是还原糖,双糖和多糖不一定是还原糖,其中乳糖和麦芽糖是还原糖,蔗糖和淀粉是非还原糖。
利用糖的溶解度不同,可将植物样品中的单糖、双糖和多糖分别提取出来,对没有还原性的双糖和多糖,可用酸水解法使其降解成有还原性的单糖进行测定,再分别求出样品中还原糖和总糖的含量(还原糖以葡萄糖含量计)。
还原糖在碱性条件下加热被氧化成糖酸及其它产物,3,5-二硝基水杨酸则被还原为棕红色的3-氨基-5-硝基水杨酸。
在一定范围内,还原糖的量与棕红色物质颜色的深浅成正比关系,利用分光光度计,在540nm波长下测定光密度值,查对标准曲线并计算,便可求出样品中还原糖和总糖的含量。
由于多糖水解为单糖时,每断裂一个糖苷键需加入一分子水,所以在计算多糖含量时应乘以0.9。
三、实验材料、主要仪器和试剂1. 实验材料小麦面粉;精密pH 试纸。
2. 主要仪器(1)具塞玻璃刻度试管:20mL×11(2)大离心管:50mL×2(3)烧杯:100mL×1(4)三角瓶:100mL×1(5)容量瓶:100mL×3(6)刻度吸管:1mL×1;2mL×2;10mL×1(7)恒温水浴锅(8)沸水浴(9)离心机(10)扭力天平(11)分光光度计3. 试剂(1)1mg/mL 葡萄糖标准液准确称取80℃烘至恒重的分析纯葡萄糖100mg,置于小烧杯中,加少量蒸馏水溶解后,转移到100mL 容量瓶中,用蒸馏水定容至100mL,混匀,4℃冰箱中保存备用。
(2)3,5-二硝基水杨酸(DNS)试剂将6.3gDNS 和262mL 2M NaOH 溶液,加到500mL含有185g 酒石酸钾钠的热水溶液中,再加5g结晶酚和5g亚硫酸钠,搅拌溶解,冷却后加蒸馏水定容至1000mL,贮于棕色瓶中备用。
实验一-3--5--二硝基水杨酸法测定总糖和还原糖

实验一3, 5 -二硝基水杨酸法测定总糖和还原糖1、实验目的:掌握还原糖和总糖测定的基本原理掌握比色法测定还原糖的操作方法和分光光度计的使用。
2、实验原理:在NaOH和丙三醇存在下,3,5-二硝基水杨酸(DNS)与还原糖共热后被还原生成氨基化合物。
在过量的NaOH碱性溶液中此化合物呈桔红色,在540nm波长处有最大吸收,在一定的浓度范围内,还原糖的量与光吸收值呈线性关系,利用比色法可测定样品中的含糖量。
3、实验步骤:(一)葡萄糖标准曲线制作1. 取6个试管,按下表加入1.0mg/ml葡萄糖标准液和蒸馏水2. 向各试管中分别加入DNS试剂1 ml,充分混合,放入沸水浴中加热煮沸2 min 进行显色,取出试管放入盛有冷水的烧杯中迅速冷却。
3.向各管中分别加入8 ml蒸馏水,充分混合。
4.以空白管(0号管)做对照,于540nm 波长下调0,然后测定各管的OD 值。
5.以光吸收值作为纵坐标,葡萄糖含量为横坐标,绘制标准曲线。
如果该直线不通过零点,必须重做。
(二)还原糖的制备1. 称取2g玉米粉,把它放入一个100ml的三角瓶中,然后加入20~30ml蒸馏水,搅拌均匀。
2. 把三角瓶放于一个50℃水浴中保温30 min,不时搅拌。
3. 拿出三角瓶,将三角瓶内含物转入50ml的容量瓶中:过滤,定溶,充分混合,滤出液即为还原糖提取液。
(三) 样品总糖的水解和提取1. 取1g玉米粉,放在100ml三角瓶中,加15ml水溶解,再加10ml 6mol/L 盐酸,混匀。
2. 将三角瓶置于沸水浴中加热煮沸30 min。
3.取出1~2滴置于白瓷板上,加1滴I-KI溶液检查水解是否完全。
如已水解完全,则不呈现蓝色。
4.拿出三角瓶,冷却,过滤,滤出液即为总糖提取液。
5.加入3-5滴酚酞指示剂,混匀,用6mol/L的NaOH中和至溶液呈微红色。
将中和后的溶液转入100 ml的容量瓶中定容。
(四)样品中含糖量的测定1. 取5支试管,编号,按下表向每支试管中加入试剂。
总糖和还原糖的测定及葡萄糖标准曲线的绘制-3,5-二硝基水杨酸法

五、操作
1、样品中还原糖的提取
准确称取0.5g山芋粉置于100ml三角烧瓶中
加3ml蒸馏水,调成糊状 再加30ml蒸馏水
50℃水浴,30min (不时搅拌)
转移至50ml离心管中,4000rpm,5min
上清液1
沉淀
加20ml蒸馏水,洗涤沉淀,4000rpm,5min
上清液2
沉淀(弃)
置于容量瓶中,蒸馏水定容至100ml,混匀, 取1ml即可进行还原糖的测定。
2、样品中总糖的水解、提取
准确称取0.2g山芋粉置于100ml三角烧瓶中
加3ml蒸馏水-KI溶液,如果 完全不显蓝色, 即可进行下面的 操作。
再加12ml蒸馏水,5ml 6mol/L HCl
沸水浴,30min (不时搅拌) 冷却至室温 用6mol/L NaOH调pH7.0( pH试纸) 蒸馏水定容至100ml,混匀
对没有还原性的双糖和多糖,可用酸水解
法使其降解成有还原性的单糖进行测定,
再分别求出样品中还原糖和总糖的含量
(还原糖以葡萄糖含量计)。
还原糖在碱性条件下加热被氧化成糖酸及 其它产物,3,5-二硝基水杨酸则被还原为 棕红色的3-氨基-5-硝基水杨酸。
NaOH 加热
黄色
棕红色
在过量的NaOH碱性溶液中, 3-氨基-5-硝 基水杨酸呈橘红色,在540nm处有最大吸 收,在一定的浓度范围内,还原糖的量与 光吸收值成线性关系。利用比色法,在 540nm 波长下测定光密度值,查对标准曲 线并计算,便可求出样品中还原糖和总糖 的含量。
三、实验器材
1、材料:山芋粉 2、仪器:电子分析天平、水浴锅、V-1100 可见分光光度计、移液器 3、其他:试管、容量瓶、三角烧瓶、量筒、 吸管(移液管)、洗耳球、玻棒、洗瓶、 漏斗、离心管、六凹反应盘、pH试纸(1 ~14)
实验一还原糖和总糖含量的测定
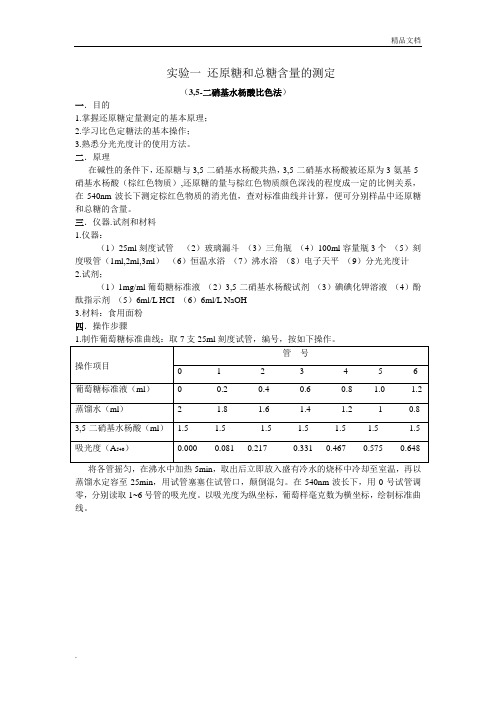
实验一还原糖和总糖含量的测定(3,5-二硝基水杨酸比色法)一.目的1.掌握还原糖定量测定的基本原理;2.学习比色定糖法的基本操作;3.熟悉分光光度计的使用方法。
二.原理在碱性的条件下,还原糖与3,5-二硝基水杨酸共热,3,5-二硝基水杨酸被还原为3-氨基-5-硝基水杨酸(棕红色物质),还原糖的量与棕红色物质颜色深浅的程度成一定的比例关系,在540nm波长下测定棕红色物质的消光值,查对标准曲线并计算,便可分别样品中还原糖和总糖的含量。
三.仪器.试剂和材料1.仪器:(1)25ml刻度试管(2)玻璃漏斗(3)三角瓶(4)100ml容量瓶3个(5)刻度吸管(1ml,2ml,3ml)(6)恒温水浴(7)沸水浴(8)电子天平(9)分光光度计2.试剂;(1)1mg/ml葡萄糖标准液(2)3,5-二硝基水杨酸试剂(3)碘碘化钾溶液(4)酚酞指示剂(5)6ml/L HCI (6)6ml/L NaOH3.材料:食用面粉四.操作步骤将各管摇匀,在沸水中加热5min,取出后立即放入盛有冷水的烧杯中冷却至室温,再以蒸馏水定容至25min,用试管塞塞住试管口,颠倒混匀。
在540nm波长下,用0号试管调零,分别读取1~6号管的吸光度。
以吸光度为纵坐标,葡萄样毫克数为横坐标,绘制标准曲线。
2.样品中还原糖和总糖含量的测定(1)样品中还原糖的提取:准确称取3g使用面粉,放在100ml三角瓶中,先以少量蒸馏水调成糊状,然后加50ml蒸馏水,搅匀,置于50℃恒温水中保温20min,使还原糖浸出。
过滤,用20ml蒸馏水定容至刻度,混匀,作为还原糖待测液。
(2)样品中总糖的水解和提取:准确称取1g使用面粉。
放在100ml的三角瓶中,加入10ml 6mol/L HCI及15ml蒸馏水,置于水浴中加热水解30min。
待三角瓶中水解液冷却后,加入1滴酚酞指示剂。
以6mol/LNaOH中和至微红色,过滤,再用少量蒸馏水冲洗三角瓶及滤纸,将滤纸全部收集砸100ml的容量瓶中,用蒸馏水定容至刻度,混匀。
还原糖和总糖含量的测定

实验一还原糖和总糖含量的测定原理3,5-二硝基水杨酸溶液与还原糖溶液共热后被还原成棕红色的氨基化合物,在一定范实验围内还原糖的量和棕红色物质颜色深浅的程度成一定比例关系,可用比色测定。
操作简便,快速,杂质干扰较少。
实验方法一葡萄糖标准曲线的制定葡萄糖标准曲线的制定:准确称取100mg分析纯的无水葡萄糖(预先在105℃干燥至恒重),用少量蒸馏水溶解后,定量转移至100mL容量瓶中,再定容至刻度,摇匀。
浓度为1mg/Ml。
取9支25mm×250mm的试管,分别按下表加入试剂:(ml)项目0 1 2 3 4 5 6 7 8G标液0 0.2 0.4 0.6 0.8 1.0 1.2 1.4 1.6 G的量0 0.2 0.4 0.6 0.8 1.0 1.2 1.4 1.6 H2O 2.0 1.8 1.6 1.4 1.2 1.0 0.8 0.6 0.4 3,5-二硝基水杨酸加入21.5mL蒸馏水,摇匀。
于520nm波长处测A值。
以葡萄糖mg数为横坐标,光吸收值为纵坐标,绘制标准曲线。
二样品中总糖和还原糖含量的测定以测定山芋中总糖和还原糖含量为例。
1.样品中还原糖的提取:准确称取2g山芋粉,放在100mL烧杯中,先以少量水调成糊状,然后加工50-60mL蒸馏水,于50o C恒温水浴中保温20分钟,过滤,将滤液收集在100mL 容量瓶中,再定容至100mL。
2.样品中总糖的水解及提取:准确称取1g山芋粉,放在锥形瓶中,加入10mL6mol/L 盐酸,15mL水,在沸水浴中加热半小时,取出一、二滴置于白瓷板上,加1滴碘-碘化钾溶液检查水解是否完全。
如已水解完全,则不呈蓝色。
冷却后加1滴酚酞指示剂,以10%氢氧化钠溶液中和至溶液呈微红色,过滤并定容到100mL。
再精确吸取上述溶液10mL于100mL 容量瓶中,定容到刻度,混匀备用。
3.样品中糖含量的测定:取7支队5mm×250mm试管分别按下表加入试剂:加完试剂后,其余操作均与制作标准曲线时相同。
总糖和还原糖的测定

朗伯-比尔(Lambert-Beer)定律
朗伯-比尔定律是比色分析旳基本原理, 这个定律是有色溶液对单色光旳吸收程度与 溶液及液层厚度间旳定量关系。此定律是由 朗伯定律和比尔定律归纳而得。
A或D=㏒I0/I
A或D=光吸收或光密度
I0 =入射光强度 I =透射光强度
三、试剂和器材
试剂:
DNS试剂 葡萄糖原则溶液 ; 6M HCl;碘-碘化钾溶液; 6M NaOH;0.1% 酚酞指示剂。
材料
藕粉,玉米淀粉
器材
容量瓶,试管,移液管,量 筒,胶头滴管,漏斗
50℃水浴,沸水浴,分光 光度计等。
四、操作环节
1.葡萄糖原则曲线制作 2.还原糖旳提取
藕粉改为称1.0克,50℃水浴20min浸出, 水浴锅中进行 3.总糖旳水解及提取 玉米淀粉测总糖,沸水浴20min酸水解,电 磁炉中进行 4.样品含糖量旳测定
试验三 总糖和还原糖旳测定
——3,5二硝基水杨酸(DNS)法
一、目 旳
掌握还原糖和总糖旳测定原理 掌握分光光度计旳使用
二、原 理
还原糖:指具有自由醛基或酮基旳糖类
单糖: 不能被水解成更小分子旳糖,单糖都是还原糖 葡萄糖, 果糖
寡糖: 最主要旳是双糖:Maltose(麦芽糖 ),Sucrose(蔗糖) Lactose(乳糖 ) 但Sucrose不是还原糖 多糖: 能水解成多种单糖分子,如淀粉,糖原和纤 维素
样品旳透射比或吸光度值。样品读数三遍,取平均值。 7).使用分光光度计时带测定样品、洗瓶、废液杯、笔和本。
移液器旳使用手法,两档位
吸液
放液
八、思索题
1.比色时为何要设计空白管?
生化实验一 还原糖的测定

五、操作
1. 葡萄糖标准曲线的制作 取干净试管6支,按下表进行操作。以吸光度作为纵坐标,各标准液浓度
(mg/ml)作为横坐标,作图得标准曲线。(用蒸馏水调零点)
管号 试剂
标准葡萄糖溶液/ml 蒸馏水/ml DNS试剂/ml
蒸馏水/ml 葡萄糖浓度/mg/ml
A540nm
0 1 2 345
0 0.2 0.4 0.6 0.8 1.0 1.0 0.8 0.6 0.4 0.2 0 2.0 2.0 2.0 2.0 2.0 2.0
1
1.2
2. 样品中还原糖提取和测定 准确称取2g红薯,加蒸馏水约3ml,在研钵中磨成匀浆,
转入三角烧瓶中,并用约30ml的蒸馏水冲洗研钵2-3次,洗出 液也转入三角烧瓶中,于50℃水浴中保温0.5h,不时搅拌,使 还原糖浸出。将浸出液(含沉淀)转移到50ml离心管中,于 4000r/min下离心5min,上清转入100ml容量瓶中,沉淀用 20ml蒸馏水洗一次,再离心,将两次离心的上清液合并,用蒸 馏水定容至100ml,混匀,作为还原糖待测液。取1ml进行还 原糖的测定。
四、实验试剂 1. 标准葡萄糖溶液(1.0mg/ml):准确称取 干燥恒重的葡萄糖200mg,溶于蒸馏水并定容 至100ml,混匀,4℃冰箱中保存备用。 2. 3,5-二硝基水杨酸(DNS)试剂:将2.5g DNS和150ml 2mol/L NaOH溶液,加到250ml含 有90g酒石酸钾钠的热水溶液中,再加2.5g结晶 酚和2.5g亚硫酸钠,搅拌溶解,冷却后加蒸馏水 定容至1000ml,存储于棕色瓶中备用。
(用蒸馏水调零点)
试剂 待测溶液/ml
还原糖溶液 1.0
蒸馏水/ml
0
DNS试剂/ml
2.0
总糖和还原糖的测定及葡萄糖标准曲线的绘制-3,5-二硝基水杨酸法

三、实验器材
1、材料:山芋粉 2、仪器:电子分析天平、水浴锅、V-1100
可见分光光度计、移液器 3、其他:试管、容量瓶、三角烧瓶、量筒、
吸管(移液管)、洗耳球、玻棒、洗瓶、 漏斗、离心管、六凹反应盘、pH试纸(1 ~14)
四、实验试剂
1、标准葡萄糖溶液(1.0mg/ml) 2、DNS试剂 3、6mol/L HCl 4、6mol/L NaOH 5、I2-KI溶液
六、计算
C1V1 ω(还原糖)=——×100%
m1 C2V2 ω(总糖)=——×0.9×100%
m2
附:相关仪器使用 1、移液管的使用 2、移液器的使用 3、离心机的使用
注意配平,对称放 4、V-1100可见分光光度计的使用
比色皿
V-1100可见分光光度计 Nhomakorabea开机预热30min 测吸光度 选择波长(540nm)
2、样品中总糖的水解、提取
准确称取0.2g山芋粉置于100ml三角烧瓶中
加3ml蒸馏水,调成糊状
取1~2滴于六凹 反应盘中,加1滴 I2-KI溶液,如果 完全不显蓝色,
即可进行下面的 操作。
再加12ml蒸馏水,5ml 6mol/L HCl 沸水浴,30min (不时搅拌)
冷却至室温 用6mol/L NaOH调pH7.0( pH试纸)
MODE键切换到T,将黑体放入光路中
合上盖,0键校零
MODE键切换到A,参比液放入到光路中
合上盖,100键调零
将待测液依次放入到光路中,即可得出 待测液的吸光度。
比色皿的使用
还原糖在碱性条件下加热被氧化成糖酸及 其它产物,3,5-二硝基水杨酸则被还原为 棕红色的3-氨基-5-硝基水杨酸。
NaOH 加热
生物化学水杨酸比色定糖法

目的和要求 1.掌握3,5—二硝基水杨酸比色法定糖的原理及 方法。 2.用3,5—二硝基水杨酸定糖法测定样品中的总 糖及还原糖。
实验原理
3,5----二硝基水杨酸与还原糖共热后被还原成 棕红色的氨基化合物,在一定范围内,还原 糖的量和反应液的颜色强度呈现比例关系, 利用比色法可测知样品的含糖量。 该方法是半微量测糖法,操作简便,快速, 杂质干扰较小。
3.样品中含糖量的测定:取7支大试管,分别 按下表加入各种试剂:
将各管混匀后,按制作标准曲线时同样的操作 测定各管的光密度,在标准曲线上查出相应 的还原糖含量,按下述公式推算出山芋粉内 还原糖与总糖的百分含量。
还原糖毫克数 样品稀释倍数 还原糖% 100 样品重量
水解后还原糖毫克数 样品稀释倍数 总糖量% 100 样品重量
实验步骤 一、葡萄糖标准曲线的绘制 取9支大试管,分别按下表顺序加入各种试剂:
将上述各管溶液混匀后,用721型分光光度计 (520nm)进行比色测定,用空白管溶液调 零点,记录光密度值。以葡萄糖浓度为横坐 标,光密度值为纵坐标绘制出标准曲线。
二、样品中总糖和还原糖含量的测定
1.样品中还原糖的提取:准确称取1g样品,放 入50或100ml烧杯内,加入85%乙醇30ml,混 匀,在50℃恒温水浴中保温30min,过滤,滤 渣再用85%乙醇提取二次。将滤液合并,蒸 去乙醇,加少量水,移入50ml容量瓶中,用 水定容,备用。
2.样品中总糖的水解及提取:准确称取样品1g, 放入大试管中,加入1ml 6mol/L盐酸和15ml 蒸馏水。混匀,在沸水浴中加热半小时后, 用碘化钾-碘溶液检查水解程度,若已水解 完全,则不呈现蓝色。冷却后加入酚酞指示 剂1滴。以10%氢氧化钠中和至溶液呈微红色。 过滤并定容至100ml。再精确吸取上述溶液 10ml,放入100ml容量瓶中,定容,备用。
3,5-二硝基水杨酸法测定蔓菁中还原糖和总糖含量

3,5-二硝基水杨酸法测定蔓菁中还原糖和总糖含量
蔓菁是一种富含营养的农作物,其含有丰富的还原糖和总糖。
在食品加工和贮藏时,
了解蔓菁中还原糖和总糖的含量对其质量和安全具有重要意义。
因此,本文采用3,5-二硝基水杨酸法测定蔓菁中还原糖和总糖含量。
实验方法:
1.材料准备
蔓菁样品、3,5-二硝基水杨酸、氢氧化钠、硫酸、乙醇、蒸馏水、卡宾试剂、高锰酸钾、磷酸和硫酸铜等。
2.还原糖的含量测定
(1)还原糖的提取
将1克蔓菁样品粉末加入25ml的蒸馏水中,用搅拌器搅拌5分钟,过滤液收集于滤器上,去渣留液。
取上述滤液5ml,加入5ml的3,5-二硝基水杨酸试剂,室温下反应10分钟,加入10ml 的氢氧化钠溶液,放置5分钟。
将溶液体积加至50ml之后,用紫外分光光度计测定吸光值,计算还原糖含量。
(2)总糖的定量
实验结果:
采用硫酸铜法测定,蔓菁样品中总糖含量为12.25g/100g(干重)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验一还原糖和总糖的测定——3,5-二硝基水杨酸比色法
一、实验目的
掌握还原糖和总糖测定的基本原理,学习比色法测定还原糖的操作方法和分光光度计的使用。
二、实验原理
还原糖的测定是糖定量测定的基本方法。
还原糖是指含有自由醛基或酮基的糖类,单糖都是还原糖,双糖和多糖不一定是还原糖,其中乳糖和麦芽糖是还原糖,蔗糖和淀粉是非还原糖。
利用糖的溶解度不同,可将植物样品中的单糖、双糖和多糖分别提取出来,对没有还原性的双糖和多糖,可用酸水解法使其降解成有还原性的单糖进行测定,再分别求出样品中还原糖和总糖的含量(还原糖以葡萄糖含量计)。
还原糖在碱性条件下加热被氧化成糖酸及其它产物,3,5-二硝基水杨酸则被还原为棕红色的3-氨基-5-硝基水杨酸。
在一定范围内,还原糖的量与棕红色物质颜色的深浅成正比关系,利用分光光度计,在540nm波长下测定光密度值,查对标准曲线并计算,便可求出样品中还原糖和总糖的含量。
由于多糖水解为单糖时,每断裂一个糖苷键需加入一分子水,所以在计算多糖含量时应乘以0.9。
三、实验材料、主要仪器和试剂
1.实验材料
小麦面粉;广范pH试纸。
2.主要仪器
(1)大试管:2×20cm×14
(2)烧杯:100mL×3
(3)三角瓶:100mL×1
(4)容量瓶:100mL×3
(5)移液管:1mL×3;2mL×2;10mL×4
(6)吸耳球、玻璃棒
(7)恒温水浴锅
(8)漏斗、滤纸
(9)白瓷缸、电炉
(10)精度天平
(11)分光光度计
3.试剂(已制备)
(1)1mg/mL葡萄糖标准液
准确称取90℃烘至恒重的分析纯葡萄糖100mg,置于小烧杯中,加少量蒸馏水溶解后,转移到100mL容量瓶中,用蒸馏水定容至100mL,混匀,4℃冰箱中保存备用。
(2)3,5-二硝基水杨酸(DNS)试剂
将6.3g 3,5-二硝基水杨酸(DNS)和2mol\L NaOH溶液262mL,加到500mL含有185g酒石酸钾钠的热水溶液中,再加5g重蒸酚和5g亚硫酸钠,搅拌溶解,冷却后加蒸馏水定容至1000mL,贮于棕色瓶中,7-10天后才能使用。
(3)6mol/L HCl和6mol/L NaOH 。
四、操作步骤
1.制作葡萄糖标准曲线
取7支2×20cm大试管编号,按表1分别加入浓度为1mg/mL的葡萄糖标准液、蒸馏水和3,5-二硝基水杨酸(DNS)试剂,配成不同葡萄糖含量的反应液。
将各管摇匀,在沸水浴中准确加热5min,取出,用流动水冷却至室温,用蒸馏水补充至20mL (即各加入16.5mL蒸馏水),震荡混匀,在分光光度计上进行比色。
调波长540nm,用0号管调零点,测出1~6号管的吸光度值。
以吸光度值为纵坐标,葡萄糖含量(mg)为横坐标,在坐标纸上绘出标准曲线。
2.样品中还原糖和总糖的测定
(1)还原糖的提取
准确称取3.00g食用面粉,放入100mL烧杯中,先用少量蒸馏水调成糊状,然后加入50mL蒸馏水,搅匀,置于50℃恒温水浴中保温20min,使还原糖浸出。
将浸出液用100mL容量瓶定容,混匀,过滤,滤液作为还原糖提取液,待测。
(2)总糖的水解和提取
准确称取1.00g食用面粉,放入100mL三角瓶中,加15mL蒸馏水及10mL 6mol/L HCl,置沸水浴中加热水解30min。
待三角瓶中的水解液冷却后,用6mol/L NaOH中和(大约10mL左右),用广范pH试纸测试中和到pH=7,用蒸馏水定容在100mL容量瓶中,混匀。
将定容后的水解液过滤,取滤液1 mL,移入另一9mL水的试管中,混匀,稀释10倍作为总糖待测液。
(3)显色和比色
取7支2×20cm大试管,编号,按表2所示分别加入待测液和显色剂,用7号管进行空白调零。
加热、定容和比色等其余操作与制作标准曲线相同。
五、结果与计算:
利用8、9、10号管吸光度值和11、12、13管吸光度值,在标准曲线上分别查出相应的还原糖毫克数,分别计算出还原糖和总糖的平均值,按下式计算出样品中还原糖和总糖的百分含量。
六、注意事项
1. 试管、烧杯和三角瓶事先要洗净烘干。
2. 试管要提前标号。
3. 移液管使用前要润洗。
4. 移液管要专管专用。
5. 分光光度计要预热30分钟。
6. 比色皿要用擦镜纸擦干,尤其是光滑面,更不能用手碰。
7. 保持环境干净,废液倒在废液缸中,废纸放入垃圾桶中。
8. 标准曲线制作与样品测定尽量同时进行显色,并使用同一参比溶液调零点和比色。
9. 用分光光度计比色时,应注意每次都应该把比色皿用蒸馏水洗两遍,再用待测液润洗,之后再
装待测液。
七、思考题
1.3,5-二硝基水杨酸比色法是如何对总糖进行测定的? 2.比色测定时为什么要设计空白管?
八、预习题
1. 什么是还原性糖
2. 高中学过测定还原性糖的方法是什么?其原理和操作又是什么?
还原糖(%)= 查曲线所得还原糖毫克数×稀释倍数
×100
样品毫克数
总糖(%)= 查曲线所得总糖水解后毫克数×稀释倍数
×0.9×100
样品毫克数。
