GY001人血白蛋白生产工艺规程
人血白蛋白(低温乙醇法)制造及检定规程

人血白蛋白(低温乙醇法)制造及检定规程本品系由乙型肝炎疫苗免疫健康人的血浆或血清经低温乙醇法分离提取,经60℃10小时加温灭活病毒后制成白蛋白含量96%以上,含适宜稳定剂,不含防腐剂和抗生素,专供静脉输注。
主要用于治疗创伤性、出血性休克、严重烧伤以及低蛋白血症等。
1 制造1.1 制造要求1.1.1 新鲜分离的液体血浆、过期血分离的血浆、半成品、成品检定剩余血浆、轻度溶血或脂肪血浆、去除其他血浆蛋白的组分,均可用于制备。
所用之血浆或血清的来源应符合《原料血浆采集(单采血浆术)规程》。
1.1.2 血浆或血清应尽可能保持无菌,否则应及时投料制造或低温冰冻保存。
低温冰冻保存血浆量长保存期不应超过2年。
1.1.3制造工作室应符合工艺流程。
冷库及各生产用具必须专用,严禁与其他异种蛋白质混用。
制造工作室的建筑应便于清洁、消毒、防霉。
在制造过程中防止制品污染热原质,应采取各种有效措施,如降低操作室温度,注意无菌操作等。
各种直接接触制品的用具,用后应立即洗净,用须经除热原质或灭菌处理。
1.1.4 生产用水应符合饮用水标准,直接用于制品的水应符合注射用水标准。
所用各种化学药品应符合《中国生物制品主要原材料试行标准》规定,未纳入试行标准者应不低于化学纯。
1.2 制造工艺1.2.1 采用低温乙醇法。
应含适量的稳定剂(每g蛋白质用0.16mmo l辛酸钠或0.08mmol辛酸钠和0.08mmol乙酰色氨酸钠)。
1.2.2 热处理每批制品必须经60±0.5℃加温10小时处理。
热处理可在除菌过滤前或分装后24小时内进行。
1.2.3 分批同制造工艺、同一容器混合的制品作为一批。
不同滤器除菌过滤或不同机柜冻干的制品应分为亚批。
1.2.4 半成品检定液体制剂于除菌过滤后应做理化检查(残余乙醇含量≤0.03%)及热原质试验,并应按亚批抽样做无菌试验。
直接分装时应留样做上述试验。
1.2.5 冻干除菌过滤后制品应及时分装、旋冻、冻干。
人血白蛋白工艺规程(试行)

目 的:规范人血白蛋白的生产和质量管理。
适用范围:适用于生产技术部、质量保证部及各相关部门责 任人:生产操作人员、质监员、低温车间主任、分包装车间主任、生产技术部长、 质量保证部长。
正 文:一、产品概述1、 产品名称 人血白蛋白2、 剂型、规格2.1剂 型:注射剂2.2规 格2.2.1每瓶含蛋白质10g ,蛋白质浓度为20%2.2.2每瓶含蛋白质5g ,2.2.3每瓶含蛋白质2g ,3、处方或工艺配方3.1人血白蛋白10g3.2人血白蛋白5g3.3人血白蛋白2g 处方依据:《中国药典》2005年版三部4、产品的性状、功能与主治 4.1性 状本品为略黏稠、黄色或绿色至棕色澄明液体,不应出现浑浊4.2功能与主治(1)失血创伤、烧伤引起的休克;(2)脑水肿及损伤引起的颅压升高;蛋白质浓度为20% 蛋白质浓度为20%辛酸钠0.266g 辛酸钠0.133g 辛酸钠0.053g 加注射用水至50ml 加注射用水至25ml 加注射用水至10ml(3)肝硬化及肾病引起的水肿或腹水;(4)低蛋白血症的防治;(5)新生儿高胆红素血症;(6)用于心肺分流术、烧伤的辅助治疗、血液透析的辅助治疗和成人呼吸窘迫综合征。
5、批准文号及标准演变情况5.1批准文号10g :国药准字S1*******5g:国药准字S1*******2g:国药准字S1*******5.2标准演变情况执行标准由《中国生物制品规程》2000年版——《中国药典》2005年版三部6、保存、运输及有效期室温(不超过30C),避光保存和运输。
自分装之日起有效期为3年。
二、基本要求1、厂房设施及生产环境符合《药品生产质量管理规范》(98版)的要求,并取得《GMP 认证证书》。
生产用设施及设备应专用,不得与其他制品混用。
2、关键性设备应经验证合格才能投入使用,已投入使用的设备要定期进行再验证或回顾性验证。
3、生产车间的人流、物流分开。
人流、物流各行其道,洁净区与非洁净区用明显的色标加以区别。
GY001人血白蛋白生产工艺规程

GY001人血白蛋白生产工艺规程广西北生药业股份有限公司柳州生物制品分公司 BZ?GY001?00人血白蛋白生产工艺规程制订人: 审核人: 审阅人: 批准人: 制订日期: 审核日期: 审阅日期: 批准日期: 颁发部门:质量保证执行日期:2006年9月15日发往部门:制品室包装室版次: ?新增 ?替代目录一、人血白蛋白产品概述…………………………………………………………………2页二、人血白蛋白分离分装工艺流程图及环境区域划分…………………………………5页三、人血白蛋白生产操作过程及工艺条件………………………………………………7页四、主要设备一览表及设备生产能力……………………………………………………29页五、原辅料、包装材料、中间品、原液、半成品、成品质量标准和技术参数……………………30页六、包装要求、标签、说明书的使用与贮存方法………………………………………47页七、工艺卫生……………………………………………………………………………48页八、安全和劳动保护………………………………………………………………………52页九、劳动组织与岗位定员…………………………………………………………………54页十、三废处理………………………………………………………………………………56页十一、附录(常用生物制品术语和名词解释) …………………………………………57页十二、附录(常用理化常数、换算表)……………………………………………………59页十三、附页(供修改时登记批准日期、文号和内容用)…………………………………60页prova mitjanes, 第 1 页,共? per punts d'experi 57 ència. Mòdul de compressi页ó Es de veure de deformació cohesionada terra, sorra per EO.3, la distribució de les aigües subterrànies: 3.1, el camp lloc tipus medi ambient classe II. Segons hidrològica geològic dos o tres capa sòl per clay llim, quatre capa de llim General subterràni a enterrat, tipus d'aigua subterrània és quart porus Departament submarinisme, enquesta durant nivell estable d'aigua subterrània de llocs mesurat enterrat profundament 1.10 ~ 2.30 m, principal per precipitació de l'atmosfera i aigües superficials de Xia infiltració subministraments, per evaporació i l'escorrentia metro per manera d'excreció principals; nivell freàtic amb temporada canvia la gamma més evident (canvis anys rang 0,50 ~ 1.50 m), ha recuperat Feng la temporada de l'aigua nivell pot lleugerament.3.2, basat en la experiència regional i resultats de prova de penetració coberta, lloc II clip llim capes de coeficients de permeabilitat franc argila per argila 1x10-4cm/s, de franc interbedded amb coeficients de permeabilitat llims ? per K=6.0x10-4~1.0x10-3cm/s, permeabilitat de franc experiència negra capa valors de coeficient de 6 x 10-3 cm/s. Precipitació negre franc impacte radi és de 253.33 m, per tant, construcció ha de ser uadvantages, facing the Yangtze River Delta, Pearl River Delta, Shandong peninsula, Beijing-Tianjin-Tangshan area, targeted investment promotion several times. Industry-led unit and various town streets are developing detailed promotion plans, the basis of what is specific to each industry, has formed a kind of scale, need to bring in the kind of projects each town street has the kind of resources, what location, focus on the development of the kind of industries. Four stroke technology and science. Determinants of technology is theCounty's economic development through scientific and technological innovation, improve product value-added and improve economic competitiveness, is the inevitable way to achieve leapfrog development. Talent is the city center city's first resource, is the primary industry development, and revitalization of the social protection. So, in terms of skills: to catch ... Competitive. Encouraging enterprises to actively undertake science and technology projects, strengthening research cooperation, using advanced technology to increase the added value of their products to ensure that introduction of transforming scientific and technological achievements during the year ... ... New research enterprises ... ... Home, creating innovative platforms ... ... Generic classifier. In: first, we must strengthen the cultivation of talent, efforts to increase vocational education and training and meet the basic demand of enterprise development. Then introduced a number of the county needed scarce education, health professionals, meet social development needs to invest more in machinery, pharmaceutical manufacturing research and development in higher education, such as the introduction of talent to meet the need. Third, we must rely on ... ... Post-doctoral workstation, ... ... Food research station platform, to the XXUniversity to find experts一、产品概述本品系由乙型肝炎疫苗免疫健康人的血浆经低温乙醇蛋白分离法提取的组分V,经纯化、脱醇、60?10小时加温灭活病毒后,除菌分装而成的液体制剂。
人血白蛋白工艺规程(试行3)

目的:规范人血白蛋白的生产和质量管理。
适用范围:适用于生产技术部、质量保证部及各相关部门。
责任人:生产操作人员、制剂车间主任、生产技术部长、质量监督员、质量检验员、质量检验室主任、质量监督室主任、质量保证部长、质量受权人。
正文:一、产品概述1、产品名称:人血白蛋白2、剂型、规格2.1 剂型:注射剂2.2 规格2.2.1 每瓶含蛋白质10g,蛋白质浓度为20%。
2.2.2 每瓶含蛋白质5g,蛋白质浓度为20%。
2.2.3 每瓶含蛋白质2g,蛋白质浓度为20%。
3、处方或工艺配方3.1 人血白蛋白10g + 辛酸钠0.266g + 加注射用水至50ml3.2 人血白蛋白5g + 辛酸钠0.133g + 加注射用水至25ml3.3 人血白蛋白2g + 辛酸钠0.053g + 加注射用水至10ml处方依据:《中国药典》2010年版三部4、产品的性状、功能与主治4.1 性状本品为略黏稠、黄色或绿色至棕色澄明液体,不应出现浑浊。
4.2 功能与主治(1)失血创伤、烧伤引起的休克;(2)脑水肿及损伤引起的颅压升高;(3)肝硬化及肾病引起的水肿或腹水;(4)低蛋白血症的防治;(5)新生儿高胆红素血症;(6)用于心肺分流术、烧伤的辅助治疗、血液透析的辅助治疗和成人呼吸窘迫综合征。
5、批准文号及标准演变情况5.1 批准文号10g:国药准字S1*******5g:国药准字S1*******2g:国药准字S1*******5.2 标准演变情况执行标准由《中国药典》2005年版三部《中国药典》2010年版三部。
6、保存、运输及有效期室温(不超过30℃),避光保存和运输。
自半成品配制之日起有效期为3年。
二、基本要求1、厂房设施及生产环境符合《药品生产质量管理规范》(98版)的要求,并取得《GMP 认证证书》。
生产用设施及设备应专用。
2、关键性设备应经验证合格才能投入使用,已投入使用的设备要定期进行再验证或回顾性验证。
3、生产车间的人流、物流分开。
人血白蛋白(低温乙醇法)制造及检定规程

人血白蛋白(低温乙醇法)制造及检定规程本品系由乙型肝炎疫苗免疫健康人的血浆或血清经低温乙醇法分离提取,经60℃10小时加温灭活病毒后制成。
白蛋白含量96%以上,含适宜稳定剂,不含防腐剂和抗生素,专供静脉输注。
主要用于治疗创伤性、出血性休克、严重烧伤以及低蛋白血症等。
1 制造1.1 制造要求1.1.1 新鲜分离的液体血浆、过期血分离的血浆、半成品、成品检定剩余血浆、轻度溶血或脂肪血浆、去除其他血浆蛋白的组分,均可用于制备。
所用之血浆或血清的来源应符合《原料血浆采集(单采血浆术)规程》。
1.1.2 血浆或血清应尽可能保持无菌,否则应及时投料制造或低温冰冻保存。
低温冰冻保存血浆量长保存期不应超过2年。
1.1.3制造工作室应符合工艺流程。
冷库及各种生产用具必须专用,严禁与其他异种蛋白质混用。
制造工作室的建筑应便于清洁、消毒、防霉。
在制造过程中为防止制品污染热原质,应采取各种有效措施,如降低操作室温度,注意无菌操作等。
各种直接接触制品的用具,用后应立即洗净,用前须经除热原质或灭菌处理。
1.1.4 生产用水应符合饮用水标准,直接用于制品的水应符合注射用水标准。
所用各种化学药品应符合《中国生物制品主要原材料试行标准》规定,未纳入试行标准者应不低于化学纯。
1.2 制造工艺1.2.1 采用低温乙醇法。
应含适量的稳定剂(每g蛋白质用0.16mmol辛酸钠或0.08mmol辛酸钠和0.08mmol乙酰色氨酸钠)。
1.2.2 热处理每批制品必须经60±0.5℃加温10小时处理。
热处理可在除菌过滤前或分装后24小时内进行。
1.2.3 分批同一制造工艺、同一容器混合的制品作为一批。
不同滤器除菌过滤或不同机柜冻干的制品应分为亚批。
1.2.4 半成品检定液体制剂于除菌过滤后应做理化检查(残余乙醇含量≤0.03%)及热原质试验,并应按亚批抽样做无菌试验。
直接分装时应留样做上述试验。
1.2.5 冻干除菌过滤后制品应及时分装、旋冻、冻干。
人血白蛋白(低温乙醇法)制造及检定规程

人血XX (低温乙醇法)制造及检定规程本品系由乙型肝炎疫苗免疫健康人的血浆或血清经低温乙醇法分离提取,经60C 10小时加温灭活病毒后制成。
白蛋白含量96%以上,含适宜稳定剂,不含防腐剂和抗生素,专供静脉输注。
主要用于治疗创伤性、出血性休克、严重烧伤以及低蛋白血症等。
1 制造1.1 制造要求1.1.1 新鲜分离的液体血浆、过期血分离的血浆、半成品、成品检定剩余血浆、轻度溶血或脂肪血浆、去除其他血浆蛋白的组分,均可用于制备。
所用之血浆或血清的来源应符合《原料血浆采集(单采血浆术)规程》。
1.1.2 血浆或血清应尽可能保持无菌,否则应及时投料制造或低温冰冻保存。
低温冰冻保存血浆量长保存期不应超过 2 年。
1.1.3 制造工作室应符合工艺流程。
冷库及各种生产用具必须专用,严禁与其他异种蛋白质混用。
制造工作室的建筑应便于清洁、消毒、防霉。
在制造过程中为防止制品污染热原质,应采取各种有效措施,如降低操作室温度,注意无菌操作等。
各种直接接触制品的用具,用后应立即洗净,用前须经除热原质或灭菌处理。
1.1.4 生产用水应符合饮用水标准,直接用于制品的水应符合注射用水标准。
所用各种化学药品应符合《中国生物制品主要原材料试行标准》规定,未纳入试行标准者应不低于化学纯。
1.2 制造工艺1.2.1采用低温乙醇法。
应含适量的稳定剂(每g蛋白质用0.16mmol辛酸钠或0.08mmol 辛酸钠和0.08mmol 乙酰色氨酸钠)。
1.2.2热处理每批制品必须经60± 0.&加温10小时处理。
热处理可在除菌过滤前或分装后24 小时内进行。
1.2.3 分批同一制造工艺、同一容器混合的制品作为一批。
不同滤器除菌过滤或不同机柜冻干的制品应分为亚批。
1.2.4 半成品检定液体制剂于除菌过滤后应做理化检查(残余乙醇含量< 0.03%及热原质试验,并应按亚批抽样做无菌试验。
直接分装时应留样做上述试验。
1.2.5 冻干除菌过滤后制品应及时分装、旋冻、冻干。
GY001人血白蛋白生产工艺规程

目录一、人血白蛋白产品概述…………………………………………………………………2页二、人血白蛋白分离分装工艺流程图及环境区域划分…………………………………5页三、人血白蛋白生产操作进程及工艺条件………………………………………………7页四、要紧设备一览表及设备生产能力……………………………………………………29页五、原辅料、包装材料、中间品、原液、半成品、成品质量标准和技术参数……………………30页六、包装要求、标签、说明书的利用与贮存方式………………………………………47页七、工艺卫生……………………………………………………………………………48页八、平安和劳动爱惜………………………………………………………………………52页九、劳动组织与职位定员…………………………………………………………………54页十、三废处置………………………………………………………………………………56页十一、附录(经常使用生物制品术语和名词说明) …………………………………………57页十二、附录(经常使用理化常数、换算表)……………………………………………………59页十三、附页(供修改时记录批准日期、文号和内容用)…………………………………60页一、产品概述本品系由乙型肝炎疫苗免疫健康人的血浆经低温乙醇蛋白分离法提取的组分V,经纯化、脱醇、60℃10小时加温灭活病毒后,除菌分装而成的液体制剂。
白蛋白含量97%以上,用适量辛酸钠作稳固剂,不含防腐剂和抗生素,专供静脉输注。
要紧用于医治创伤性、出血性休克、严峻烧伤和低蛋白血症等。
1 药品名称通用名:人血白蛋白英文名:Human Albumin汉语拼音: Renxue Baidanbai要紧组成成份:人血白蛋白2 性状本品为略粘稠,黄色或绿色至棕色澄明液体。
不该显现混浊。
3 药理作用.增加血容量和维持血浆胶体渗透压:白蛋白占血浆胶体渗透压的80%,要紧调剂组织与血管之间水分的动态平稳。
人血白蛋白工艺规程(试行1)

生产使用。每批投产混合血浆不低于1000人份,并指定产品批号,批号 采用年流水号。复检血浆使用国家批签发合格的检测试剂。 8、原料、辅料、包装材料需检验合格才能投入生产使用。 9、每批制品或者每一工序结束,均应进行彻底清场、消毒,才能进入 下一工序或下一批次生产。 10、不合格中间品或不合格半成品不得进入下一工序生产。 11、人员要求 11.1 生产人员必须经过专业知识及GMP培训,并持有培训合格上岗证。 11.2 从事血液制品生产的工作人员必须身体健康,至少每年进行一次 身体检查,患传染病、皮肤病、体表有伤口者不得从事直接接触药品的 生产。 12、建立完整的生产记录。详细记录生产过程的实际情况,字迹清晰、 数据完整、内容真实,不得随意撕毁。不得随意修改记录内容,若需要 修改时,按规定须用钢笔(蓝黑或碳素墨水)或碱性签字笔(黑色或蓝 色的签字笔)修改,并有修改人签名、修改日期,原修改内容应清晰可 见。执行两人复核制度,由操作者和复核者签名,准确填写日期。
生产前准备 生产指令:生产技术部下达生产指令,指定 投入原料血浆批号、数量,原辅 料领用量,制定生产批号,质保
文件名 称
部复核。 人血白蛋白工艺规程(试行)
原、辅
文件依 据
《中国药典》(2005年版三部)、 《GMP》(98版)
第4页 共33页
水冲洗干净, 经消毒液擦拭
料领取:按定额领取检定合格的 原、辅料。 领浆前准备:周转筐使用前用注射用
融浆间按房间清洁SOP进行清洁。 领浆:原料血浆称重后在规定区域内
后装入洁净周转筐内。 融浆合并:用低温注射用水冲洗 血浆表面,使血浆和血浆袋分 离。用剪刀剪开血浆袋倒入融浆 罐打开融浆罐搅拌及循环水(水 温<35℃)使融浆罐内血浆温度 保持在0~4℃并完全融化。
人血白蛋白制作工艺流程

人血白蛋白制作工艺流程英文回答:The production process of human serum albumin (HSA) involves several steps to ensure the purity and safety of the final product. Here is a detailed explanation of the manufacturing process.1. Collection of human plasma: The first step is to collect human plasma from healthy donors. This plasma is obtained through a process called plasmapheresis, where blood is drawn from the donor, and the plasma is separated from the other blood components.2. Fractionation: The collected plasma is then subjected to fractionation, which involves separating the different proteins present in the plasma. This is typically done using a process called cold ethanol fractionation, where the plasma is mixed with cold ethanol to precipitate the proteins.3. Purification: The next step is to purify the albumin from the fractionated plasma. This is done using various techniques such as ion exchange chromatography, affinity chromatography, and size exclusion chromatography. These techniques help to remove impurities and isolate the albumin.4. Viral inactivation and removal: To ensure the safety of the final product, viral inactivation and removal steps are performed. This involves treating the albumin with a solvent/detergent mixture or subjecting it to heattreatment to inactivate any potential viruses. Additionally, filtration techniques are used to remove any remaining viruses or impurities.5. Formulation and sterilization: Once the albumin is purified and free from contaminants, it is formulated intoa suitable dosage form, such as a liquid or lyophilized powder. Sterilization techniques, such as filtration orheat treatment, are applied to ensure the product is free from any microbial contamination.6. Quality control testing: Before the final product is released for distribution, it undergoes rigorous quality control testing. This includes testing for purity, potency, and safety, as well as checking for the absence of contaminants and viruses.7. Packaging and distribution: The final step involves packaging the human serum albumin into appropriate containers, such as vials or bottles, and labeling them with the necessary information. The product is then distributed to hospitals, clinics, and other healthcare facilities for use in medical treatments.中文回答:人血白蛋白(HSA)的制造过程包括多个步骤,以确保最终产品的纯度和安全性。
人血白蛋白制作工艺流程

人血白蛋白制作工艺流程英文回答:The production process of human serum albumin, also known as human blood albumin, involves several steps. Here, I will explain the process in detail.1. Collection of Blood: The first step is to collect human blood from healthy donors. The blood is usually obtained from blood banks or qualified donors who have undergone thorough screening to ensure their safety and health.2. Separation of Plasma: Once the blood is collected, it is centrifuged to separate the plasma from the other components, such as red blood cells and platelets. The plasma, which contains the human serum albumin, is then collected.3. Purification: The collected plasma undergoes aseries of purification steps to remove impurities and contaminants. This is done through processes likefiltration, chromatography, and fractionation. These techniques help to isolate and purify the human serum albumin from other proteins present in the plasma.4. Sterilization: After purification, the human serum albumin solution is subjected to a sterilization process to eliminate any potential microorganisms or pathogens. Thisis typically done using heat or filtration techniques to ensure the final product is safe for use.5. Formulation and Packaging: Once the human serum albumin is purified and sterilized, it is formulated into a suitable concentration and packaged into vials or bottles. These containers are typically made of glass or plastic and are sealed to maintain the sterility of the product.6. Quality Control: Before the final product is released for distribution, it undergoes rigorous quality control testing. This includes tests for purity, potency, sterility, and other parameters to ensure that it meets therequired standards and specifications.7. Distribution: Once the human serum albumin passesall quality control tests, it is ready for distribution. It is usually stored and transported under controlled conditions to maintain its stability and efficacy.中文回答:人血白蛋白的制作工艺流程包括以下几个步骤。
人血白蛋白生产流程

人血白蛋白生产流程如下:
1.血浆采集筛选:从健康献血员处采集新鲜血浆或保存期不超过
2年的冰冻血浆。
2.分离提取:用低温乙醇蛋白分离法分段沉淀提取白蛋白组分。
3.病毒灭活:将提取的白蛋白组分进行60℃灭活病毒至少10小
时。
4.超滤或冷冻干燥:对经过病毒灭活的白蛋白组分进行超滤或冷
冻干燥脱醇处理。
5.浓缩与稳定剂添加:对处理后的白蛋白组分进行浓缩,并添加
适量稳定剂。
6.灭菌与包装:将白蛋白溶液进行高温高压灭菌或辐射灭菌,然
后分装到无菌注射瓶中。
7.质量检查:逐瓶检查外观是否符合规定,确保产品质量。
人免疫球蛋白生产工艺流程

人免疫球蛋白生产工艺流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!人免疫球蛋白的生产工艺流程可以分为以下几个步骤:1. 原料筛选与处理首先,从健康人的血浆中提取免疫球蛋白。
白蛋白生产工艺

白蛋白生产工艺白蛋白(Albumin)是一种在人和动物血液中广泛存在的血浆蛋白,在医疗和生物工程领域具有重要的应用价值,可以用于临床治疗、细胞培养和疫苗制备等方面。
下面介绍一种常见的白蛋白生产工艺。
首先,白蛋白的生产通常采用重组DNA技术,利用转基因工程将目标基因插入细胞表达系统中,进而实现大规模白蛋白的生产。
常用的表达系统有大肠杆菌、酵母菌、哺乳动物细胞等。
其次,选择合适的表达宿主细胞进行重组DNA表达。
其中,大肠杆菌是常用的宿主细胞,因其易于培养、高复制速度、大产量等特点,而酵母菌常用于产生高密度大规模表达的蛋白。
哺乳动物细胞则适用于生产质量高、具有生物活性的蛋白。
然后,将包含目标基因的质粒导入宿主细胞中,通过培养、诱导等处理使其大量表达目标蛋白。
在培养的过程中,要根据细胞的生长速度、代谢特性、营养需求等因素控制培养条件,如温度、pH值、培养基组成等。
接下来,通过裂解细胞膜,将表达的蛋白从细胞内释放出来。
裂解方法通常采用超声波裂解、冻融法或化学裂解等。
裂解后,通过离心或过滤等方式去除无细胞物质,得到蛋白的原液。
接着,对得到的原液进行纯化和浓缩。
纯化过程通常包括沉淀、过滤、层析等步骤,以去除杂质、除去溶剂、浓缩目标蛋白,并得到高纯度的白蛋白。
通常使用离子交换层析、凝胶过滤层析、亲和层析等方法进行纯化。
最后,对纯化后的蛋白进行检测和分析。
常用的检测方法有SDS-PAGE凝胶电泳、Western blotting等,可以确定白蛋白的分子量、纯度等特性。
总之,白蛋白的生产工艺包括基因克隆、细胞培养、蛋白纯化和检测等多个环节,需要合理选择表达宿主细胞、精确控制培养条件和合适的纯化方法,以获得高产量和高纯度的白蛋白产品。
人血白蛋白工艺规程(试行)
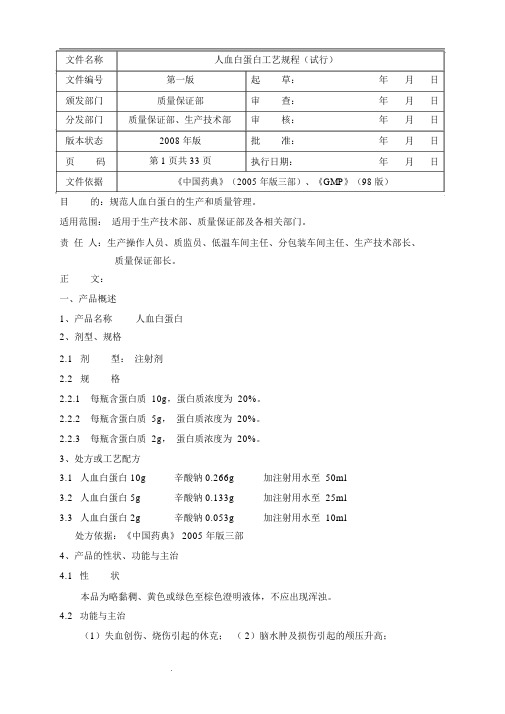
文件名称人血白蛋白工艺规程(试行)文件编号第一版起草:年月日颁发部门质量保证部审查:年月日分发部门质量保证部、生产技术部审核:年月日版本状态2008 年版批准:年月日页码第1页共33页执行日期:年月日文件依据《中国药典》(2005 年版三部)、《GMP》(98 版)目的:规范人血白蛋白的生产和质量管理。
适用范围:适用于生产技术部、质量保证部及各相关部门。
责任人:生产操作人员、质监员、低温车间主任、分包装车间主任、生产技术部长、质量保证部长。
正文:一、产品概述1、产品名称人血白蛋白2、剂型、规格2.1剂型:注射剂2.2规格2.2.1每瓶含蛋白质 10g,蛋白质浓度为 20%。
2.2.2每瓶含蛋白质 5g,蛋白质浓度为 20%。
2.2.3每瓶含蛋白质 2g,蛋白质浓度为 20%。
3、处方或工艺配方3.1人血白蛋白 10g辛酸钠 0.266g加注射用水至 50ml3.2人血白蛋白 5g辛酸钠 0.133g加注射用水至 25ml3.3人血白蛋白 2g辛酸钠 0.053g加注射用水至 10ml处方依据:《中国药典》 2005 年版三部4、产品的性状、功能与主治4.1性状本品为略黏稠、黄色或绿色至棕色澄明液体,不应出现浑浊。
4.2功能与主治(1)失血创伤、烧伤引起的休克;( 2)脑水肿及损伤引起的颅压升高;文件依据《中国药典》( 2005 年版三部)、《GMP》(98 版)第2页共33页(3)肝硬化及肾病引起的水肿或腹水;(4)低蛋白血症的防治;(5)新生儿高胆红素血症;(6)用于心肺分流术、烧伤的辅助治疗、血液透析的辅助治疗和成人呼吸窘迫综合征。
5、批准文号及标准演变情况5.1批准文号10g:国药准字 S1*******5g:国药准字 S1*******2g:国药准字 S1*******5.2标准演变情况执行标准由《中国生物制品规程》2000 年版《中国药典》 2005 年版三部6、保存、运输及有效期室温(不超过 30℃),避光保存和运输。
白蛋白加工工艺流程

白蛋白加工工艺流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor.I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!揭秘白蛋白加工工艺流程:科学与精准的结合白蛋白,作为一种重要的生物制品,广泛应用于医药、食品、化妆品等多个领域。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
人血白蛋白生产工艺规程制订人:审核人:审阅人:批准人:制订日期:审核日期:审阅日期:批准日期:颁发部门:质量保证执行日期:2006年9月15日发往部门:制品室包装室版次:□新增□替代目录一、人血白蛋白产品概述…………………………………………………………………2页二、人血白蛋白分离分装工艺流程图及环境区域划分…………………………………5页三、人血白蛋白生产操作过程及工艺条件………………………………………………7页四、主要设备一览表及设备生产能力……………………………………………………29页五、原辅料、包装材料、中间品、原液、半成品、成品质量标准和技术参数……………………30页六、包装要求、标签、说明书的使用与贮存方法………………………………………47页七、工艺卫生……………………………………………………………………………48页八、安全和劳动保护………………………………………………………………………52页九、劳动组织与岗位定员…………………………………………………………………54页十、三废处理………………………………………………………………………………56页十一、附录(常用生物制品术语和名词解释) …………………………………………57页十二、附录(常用理化常数、换算表)……………………………………………………59页十三、附页(供修改时登记批准日期、文号和内容用)…………………………………60页人血白蛋白生产工艺规程一、产品概述本品系由乙型肝炎疫苗免疫健康人的血浆经低温乙醇蛋白分离法提取的组分V,经纯化、脱醇、60℃10小时加温灭活病毒后,除菌分装而成的液体制剂。
白蛋白含量97%以上,用适量辛酸钠作稳定剂,不含防腐剂和抗生素,专供静脉输注。
主要用于治疗创伤性、出血性休克、严重烧伤以及低蛋白血症等。
1 药品名称通用名:人血白蛋白英文名:Human Albumin汉语拼音: Renxue Baidanbai主要组成成份:人血白蛋白2 性状本品为略黏稠,黄色或绿色至棕色澄明液体。
不应出现混浊。
3 药理作用3.1 .增加血容量和维持血浆胶体渗透压:白蛋白占血浆胶体渗透压的80%,主要调节组织与血管之间水分的动态平衡。
由于白蛋白分子量较高,与盐类及水分相比,透过膜内速度较慢,使白蛋白的胶体渗透压与毛细管的静力压抗衡,以此维持正常与恒定的血容量;同时在血循环中,1g白蛋白可保留18ml水,每5g白蛋白保留循环内水分的能力约相当于100ml血浆或200ml全血的功能,从而起到增加循环血容量和维持血浆胶体渗透压的作用。
3.2 运输及解毒:白蛋白能结合阴离子也能结合阳离子,可以输送不同的物质,也可以将有毒物质输送到解毒器官。
3.3 营养供给:组织蛋白和血浆蛋白可互相转化,在氮代谢障碍时,白蛋白可作为氮源为组织提供营养。
4 适应症4.1 失血创伤、烧伤引起的休克。
4.2 脑水肿及损伤引起的颅压升高。
4.3 肝硬化及肾病引起的水肿或腹水。
人血白蛋白生产工艺规程4.4 低蛋白血症的防治。
4.5 新生儿高胆红素血症。
4.6 用于心肺分流术、烧伤的辅助治疗、血液透析的辅助治疗和成人呼吸窘迫综合症。
5 用法用量5.1 用法:一般采用静脉滴注或静脉推注。
为防止大量注射时机体组织脱水,可采用5%葡萄糖注射液或氯化钠注射液适当稀释作静脉滴注(宜用备有滤网装置的输血器)。
滴注速度应以每分钟不超过2ml为宜,但在开始15分钟内,应特别注意速度缓慢,逐渐加速至上述速度。
5.2 用量:使用剂量由医师酌情考虑,一般因严重烧伤或失血等所致休克,可直接注射本品5-10g,隔4-6小时重复注射1次。
在治疗肾病及肝硬化等慢性白蛋白缺乏症时,可每日注射本品5-10g,直至水肿消失,血清白蛋白含量恢复正常为止。
6 不良反应使用本品一般不会产生不良反应,偶可出现寒颤、发热、颜面潮红、皮疹、恶心呕吐等症状,快速输注可引起血管超负荷导致肺水肿,偶有过敏反应。
7 禁忌7.1 对白蛋白有严重过敏者。
7.2 高血压患者,急性心脏病者、正常血容量及高血容量的心力衰竭患者。
7.3 严重贫血患者。
7.4 肾功能不全者。
8注意事项8.1 药液呈现混浊、沉淀、异物或瓶子有裂纹、瓶盖松动、过期失效等情况不可使用。
8.2 本品开启后,应一次输注完毕,不得分次或给第二人输用。
8.3 输注过程中如发现病人有不适反应,应立即停止输用。
8.4 有明显脱水者应同时补液。
8.5 运输及贮存过程中严禁冻结。
人血白蛋白生产工艺规程9 孕妇及哺乳期妇女用药对孕妇或可能怀孕妇女的用药应慎重,如有必要应用时,应在医师指导和严密观察下使用。
10 药物相互作用本品不宜与血管收缩药,蛋白水解酶或含酒精溶剂的注射液混合使用。
11 药物过量因本品有高渗作用,过量注射时,可造成脱水、机体循环负荷增加、充血性心力衰竭和肺水肿。
12 规格蛋白浓度20%,根据蛋白量分为10g/瓶(20%×50ml/瓶)、5g/瓶(20%×25ml/瓶)、2g/瓶(20%×10ml/瓶)。
13 贮藏2~8℃,避光保存。
14 包装1瓶/盒、100瓶/箱。
15 有效期:五年。
16 批准文号国药准字S1*******(10g/瓶);国药准字S1*******(5g/瓶);国药准字S1*******(2g/瓶)。
17 制造及检定依据《中国药典》三部2005年版。
人血白蛋白生产工艺规程二、人血白蛋白分离分装工艺流程图及环境区域划分1 人血白蛋白分离血浆 E : 8%pH :7.2±0.2T : -2~-3℃P :4.0~6.0%离心沉淀(F I ) 上清 E : 19%pH :5.85±0.05T : -5~-6℃P :3.5~5.5%离心沉淀(F II +III ) 上清 E :40%pH :5.8~5.9T :-7~-8℃P :1.5~3.5%离心沉淀(FIV) 上清 过滤(加0.2%~0.5%硅藻土)E : 40%pH :4..7~4.8T : -7~-8℃P :1.0~3.0%离心沉淀(F V ) 溶解 上清(供回收酒精)4倍体积注射用水(0~1℃)溶解E :10% pH :4.6~ 4.7P : 3.0%~7.0% T:-2~ -3℃过滤(加0.2~0.5%硅藻土)超滤脱醇配制 十万级60℃ 10h 灭活病毒 万级区注: E :乙醇浓度T :温度 P :蛋白含量人血白蛋白生产工艺规程模制瓶 胶 塞 铝 盖 * 灯 检 包 装入 库 2. 人血白蛋白分装60℃ 10h 灭活病毒后蛋白超声波震荡洗瓶机精洗 精洗 精洗0.2微米除菌过滤180℃ 3小时烘干 132℃ 7分钟 132℃ 7分钟湿热灭菌 湿热灭菌30~32℃14天孵育万级百级 非控制区分装 **人血白蛋白生产工艺规程三、人血白蛋白生产操作过程及工艺条件采用低温乙醇蛋白分离法。
参照Kistler-Nitchmann法适当改进。
1 原料血浆领用1.1 生产操作根据生产指令,领取该批生产的足量合格人份的原料血浆,对原料血浆纸箱脱皮后置于已经清洁消毒的塑料筐中,经缓冲走廊送入融浆间,并按照产地批号进行分隔放置,用注射用水对血浆袋表面进行冲洗后,让原料血浆进行自然融化。
领取原料血浆时注意核对产地、批号、人份数、外观、检验报告,对红浆、脂肪浆等外观不合格血浆用经清洁的不锈钢桶收集放置融浆间融化并记录。
1.2 清场把原料血浆脱皮后的外包装纸箱折叠整齐送锅炉房焚烧,血浆脱皮间用0.5%的84消毒液消毒,并对场地及器具进行清洁消毒处理。
1.3 质量控制项目及标准每一人份血浆均经检验并合格。
外观应无溶血、脂血,无肉眼可见的红细胞及其他异物;HBsAg:阴性;抗-HCV:阴性;抗-HIV1+2:阴性;ALT:≤25卡门氏单位(赖氏法);梅毒血清学反应:阴性;血浆蛋白含量:>5.5%。
血浆在常温下自然融化距离投料时间不超过72小时。
1.4异常情况处理发生异常情况影响正常工作,应填写《异常情况处理报告》并及时告知科室负责人及QA进行处理。
1.5 物料平衡血浆人份数的平衡限度为100%。
2 血浆合并2.1 生产操作2.1.1 将投料过程中所专用的不锈钢桶、胶管、筛网、剪刀等用具清洗干净备用,并准备好泵、电子称等器具。
2.1.2将塑料框中把融化完全的血浆倒入装好75%乙醇溶液的塑料盒中浸泡2~3分人血白蛋白生产工艺规程钟,每袋血浆用注射用水冲洗表面,洗净血浆袋表面后用洁净纱布将血浆袋表面擦干置于洁净的塑料框中,用剪刀把血浆袋一端袋口剪开,将血浆倒至不锈钢筛网上,过滤至不锈钢桶中,装满称重后用泵将血浆抽入反应罐中,并及时记录。
2.1.3 投浆完毕,测量反应罐混合血浆体积,核对血浆总量。
待反应罐中血浆搅拌均匀后取样送检。
2.2 清场对不锈钢桶、胶管、筛网、剪刀等用具清洁消毒后置于2%NaOH溶液中;血浆袋用0.5%84消毒液消毒后送锅炉房焚烧;对血浆合并间、塑料筐等进行清洁,清场完毕后开启紫外灯对血浆合并间照射30分钟以上。
2.3质量控制项目及标准反应罐中血浆经搅拌均匀后取样,供测总蛋白含量、白蛋白纯度及抗-HBs。
血浆总蛋白含量应在5.5~6.0%之间,白蛋白纯度不低于65.0%,抗-HBs呈阳性。
2.4异常情况处理发生异常情况影响正常工作,应填写《异常情况处理报告》并及时告知科室负责人及QA进行处理。
2.5物料平衡90%<投料后血浆净重与血浆发放重量的比值<100%3 组分I(F I)的分离3.1 生产操作3.1.1 组分I(F I)的制作3.1.1.1 准备95%的乙醇,启动冷媒系统,预冷降温至-20℃以下;配制AB缓冲液,AB缓冲液配制比例为醋酸钠1197克,冰醋酸2530ml,两者混合加注射用水定容至11升;准备并清洗各种生产用具,准备PH计。
3.1.1.2 启动冷媒系统及搅拌系统,将血浆冷却至0~0.5℃,用pH4.0的AB缓冲液调pH至7.2±0.2,控制流速≤1L/分钟;缓慢滴加已预冷至-20℃以下的95%乙醇使反应液乙醇终浓度为8%;乙醇加入速度不能超过60L/小时,滴加乙醇过程中反应液温度应随之下降,并使最终反应液温度达-2.5±0.5℃,滴加乙醇完毕后,继续搅拌1~3小时,静置1人血白蛋白生产工艺规程小时以上。
3.1.1.3 制作完成后,对反应间进行清场,清洁天面、墙面、清洗地面、地漏。
将制作用具清洗干净后置于2%NaOH溶液中浸泡。
3.1.2 组分I(F I纤原)的离心3.1.2.1 将进液管道,凸轮泵、硅胶管、离心机、不锈钢桶、收集离心上清的反应罐等清洁后,通过管道连接待离心反应罐、离心机、不锈钢桶、凸轮泵、收集离心上清的反应罐。
3.1.2.2 启动冷媒系统,启动离心机,对反应液进行离心, 离心机开始出液后,用止血钳来控制进液速度,离心机出液流量应控制在50-72L/h/台,经离心分离,上清液须澄清,透明,用温度计检测出液温度, F I离心上清液温度控制在-1~-3℃;上清液收集到洁净的10万ml不锈钢桶内,并用凸轮泵将桶里收集的上清液抽到应罐内,现场必须有两位工作人员值班,对离心原液,离心出液速度、温度,澄明度等各项参数进行检测,保证离心效果,并随时观察离心机,进液泵是否正常工作,管道有无漏液等。
