三、核素(元素周期表)
核素

1 下列有关碱金属元素的性质判断正确的是 A.K与H2O反应最剧烈 B.Rb比Na活泼,故Rb可以从NaCl溶液中置换出Na C.碱金属的阳离子没有还原性,所以有强氧化性
√D.从Li到Cs都易失去最外层1个电子,且失电子能力逐渐增强
解析 A项,在碱金属元素中,K不是最活泼的元素; B项,Rb先与水反应,不会置换出Na; C项,碱金属的阳离子很稳定,不具有强氧化性。
5.下列有关卤素单质的说法正确的是
A.从F2到I2,单质颜色变浅 B.从F2到I2,单质氧化性增强
√C.H2与F2不能共存
D.碘与铁反应时生成FeI3 解析 从F2到I2,单质颜色加深,氧化性减弱,A、B项错误; H2与F2混合后在暗处就可以剧烈化合并爆炸,故二者不能共存,C项正确; 碘与铁反应生成FeI2,D项错误。
归纳总结
(1)原子的构成微粒及微粒间的关系
原子
原子核
质子带 正 电荷 中子 不带 电荷
核外电子带 负电荷
核电荷数= 质子数 = 原子序数 = 核外电子数 质量数= 质子数 +__中__子__数__
例6. 已知R原子有b个中子,R2+核外有a个电子。表示R原子符号正
确的是( C ) A.baR
B. a+ba--22R
3.(2017·聊城高一检测)锂(Li)不可能具有的性质是 A.锂在空气中燃烧只会生成氧化锂 B.锂很软,用小刀可以切割 C.锂的熔点比金属铯高
√D.金属锂可以保存在煤油或液体石蜡中
解析 锂较其他碱金属活泼性差,燃烧不生成过氧化物,生成氧化锂, A正确; 碱金属都很软,可用小刀切割,B正确; 碱金属Li→Cs熔点逐渐降低,C正确; 金属锂的密度比煤油小,所以不能保存在煤油中,D不正确。
F 非金属性减I弱
元素周期表-核素讲解

1357Cl
34.969
75.77%
1377Cl
36.966
Cl元素相对原子质量=
24.23%
34.969×75.77% + 36.966×24.23% = 35.453 Cl元素近似相对原子质量=
35×75% + 37×25% = 35.5
【归纳小结】
• ①质子:决定元素的种类; • ②中子:决定同一元素的不同核素(同位
Cl 35
17
U: U 234 92
H 2
1
C 13
6
O 17
8
Cl 37
17
U 235
92
H 3
1
C 14 6
O 18 8
U 238 92
三.同位素
板书
1、同位素:质子数相同而中子数不同的同一种 元素的不同原子互称为同位素。即同一元素的不同 核素之间互称为同位素。
2、特点:两同(同质子数、同一元素)
两不同(不同中子数、不同核素)
H:
H1
1
H 2
1
H 3
1
C: C C C 12
13
14
6
6
6
O: O O O 16
17
18
8
8
8
Cl:
Cl 35
17
Cl 37
17
U: U 234 92
U U 235
238
92
92
元素、核素、同位素
• 元素:具有相同__质_子__数___的一__类__原子 的总称。
(3)在天然存在的某种元素里,不论是游离态 还是化合态,各种同位素的原子个数百分 比(丰度)一般为定值。
《元素周期表》(核素)

PPT学习交流
5
3.原子的表示方法 质量数
质子数 即AZX 代表一个___质__量__数_______为 A、_____质__子__数_______为 Z 的 X 原子。 例如:2113Na 表示质量数为____2_3_____、质子数为___11________ 的一种钠原子。
PPT学习交流
6
自我测评
PPT学习交流
15
2.已知 R2+核外有 a 个电子,b 个中子,表示 R 原子符号正确
的是( C ) A.baR C.a+a+b+22R
B.a+a-b-22R D.aa+-b2R
解析:阳离子中:质子数=电子数+电荷数,则R的质子
数=a+2,质量数=a+2+b。
PPT学A,含 N 个中子,它与 1H 原子构 成 HmX 分子。在 a g HmX 中所含质子的物质的量是( A ) A.A+a m(A-N+m)mol B.Aa (A-N)mol C.A+a m(A-N)mol D.Aa (A-N+m)mol
PPT学习交流
3
构成原子的粒子及其性质
构成原子的粒 子
电性和电量
质量/Kg
电子
1个电子带1个 单位负电荷 9.109ͯ10-31
质子
1个质子带1个 单位正电荷 1.673ͯ10-27
中子 不显电性 1.675ͯ10-27
相对质量
1/1836(电子 与质子质量之
比)
1.007
1.008
问 从表格中的数据得出原子的质量主要取决于哪种粒子?
PPT学习交流
12
[典例剖析]
(2015·山东泰安高一检测)15331I 是常规核裂变产物之一, 可以通过测定大气或水中15331I 的含量变化来检测核电站是否发
元素周期表 第三课时核素

特性 决定 因素
只有种类, 没有个数 质子数 H、C、N 三种元素
化学反应中的最 小微粒 质子数、中子数
1
化学性质几乎完 全相同 质子数、中子数
234 92 238 92
由 一种元素组 成,可独立存在 组成元素、 结构 O2 与 O3 互为同 素异形体
举例
H、1 H、1 H 三 1 种核素
2
3
U、92 U、 U 互为同位素
37 ������
二、核素
1.定义 具有一定数目质子和一定数目中子的一种原子。 2.氢的三种核素
氢元素的原子核 质子数(Z) 1 1 1 中子数(N) 0 1 2 原子名称 氕 氘 氚
������ 原子符号( X) ������ 1 1 2 1 3 1
H H或D H或T
自主思考 1: 所有原子的原子核内一定含有质子和中子吗? 提示:不一定。原子核中一定含质子,但不一定有中子,如 1 H 中只有质子而 没有中子。
235
2.联系
(1)一种单质可能由不同核素构成,如:HD、HT 等; (2)一种核素可以构成不同单质,如:16O2、16O3。
知识点1
原子内的几个数量关系
【例题 1】某元素的一种同位素 X 的原子的质量数为 A,含 N 个中子,它与 1 H 原子构成 HmX 分子。在 a g HmX 中所含质子的物质的量是( )
第 3 课时 核素
氕、氘、氚原子中质子、中子和电子的数量关系示意图
1.了解元素和核素的含义。 2.理解质量数和 ������ X 的含义。
������
一、原子的组成
1.组成微粒 原子核 质子(带正电) 中子(不带电)
原子
核外电子(带负电)
2.数值关系 (1)质量数:忽略电子的质量,将核内所有质子和中子的相对质量取近似 值相加所得的数值。 (2)数值关系。 质量关系:质量数(A)=质子数(Z)+中子数(N) 数量关系:原子序数=核电荷数=质子数=核外电子数 3.原子构成的表示方法 一般用符号 ������ X 表示,字母表示意义如下: A 表示质量数,Z 表示质子数,X 表示元素符号,如 17 Cl 表示质量数为 37、 质子数或核电荷数为 17 的氯原子。
元素周期表

一、元素周期表
元素周期表
IA H
1
A:主族 IIA Be 4铍 Mg 12镁 Ca 20钙 IIIA B 5硼 Al 13铝 IVA C 6碳 Si 14硅 VA N 7氮 P 15磷 VIA O 8氧 S 16硫 VIIA F 9氟 Cl 17氯
0 He 2氦 Ne 10氖 Ar 18氩
1氢 Li
比钠剧烈
[实验现象]
24
二、元素的性质与原子结构
(2)钾与H20的反应 [实验现象] 金属钾浮在水面上,剧烈反应,听到微弱的爆鸣声,并且出现紫色 的火光。 比钠剧烈 均能与O2、H2O反应,表现出金属性(还原性) △
2.碱金属化学性质的规律
(1)相似性:
(2)递变性:
4Li + O2 = 2Li2O 2Na+2H2O = 2NaOH+H2
3
一、元素周期表
元素周期表的编排原则
原子序数:根据元素在周期表中位置的编号 原子序数=核电荷数=质子数=核外电子数 根据元素周期律,把已知的一百多种元 素中 电子层数目相同 的各种元素,按原 子序数递增的顺序从左到右排成 横行 , 再把不同横行中 最外电子层的电子数相同 的元素按电子层数递增的顺序由上而下排 成 ,这样得到的一个表,叫做元 纵行 素周期表。
第 IA 族—碱金属元素 另外,特别族名称: 第ⅦA 族—卤族元素 第 0 族—稀有气体元素
19
一、元素周期表
课堂小结: 1、元素周期表的结构:
七主七副七周期, Ⅷ族零族镧锕系。
2、元素原子结构与其在周期表中位置的关系:
a.电子层数 b.最外层电子数
决定
周期序数
决定
主族序数
原子序数 核外电子排布 周期表中位置
元素周期表第4课时

课堂练习
1、设某元素某原子的质子数为Z,中子数为 N,则下列叙述正确的是( A ) A、不能由此确定该元素的相对原子质量 B、这种元素的相对原子质量是Z+N C、若12C的质量为Wg,此原子的质量为 (Z+N)Wg D、核内中子的总质量小于质子的总质量
2、已知C常见的同位素有12C和13C,O有16O、 17O和18O。则CO 分子的种类有( C) 2 A、6种 B、10种 C、12种 D、18种
4、同位素与同素异形体的关系 同位素:同一种元素的不同原子 之间的互称(微观) 同素异形体:同一种元素的不同 单质之间的互称(宏观) 思考:碳元素有哪些同位素?有 哪些同素异形体?
例2:1H、2H、3H、H+、H2是( D ) A、氢的5种同位素 B、5种氢元素 C、氢的5种同素异形体 D、氢元素的5种微粒 例3:下列说法正确的是( C ) A、13C与15N具有相同的中子数 B、13C与C60互为同素异形体 C、15N与14N互为同位素 D、15N的核外电子数与中子数相同
14 6 235 92 2 1 3 1
③利用放射性同位素: 医疗方面——癌症治疗 贮存保鲜——抑制马铃薯和 洋葱等发芽
例1:下列有关同位素的叙述正确的是( B ) A、电子数相同,中子数不同的两种微粒之 间的互称 B、质量数不同,核电荷数相同的原子之间 的互称 C、质子数相同,电子数不同的同一元素的 微粒之间的互称 D、质子数相同,中子数不同的同一元素的 微粒之间的互称
同位素的特点: (1)同位素在元素周期表中占据同一位置,即质 子数相同 (2)天然同位素相互间保持一定的比率。 (3)同一元素的各种同位素它们的化学性质几乎 完全相同。 同位素的用途: ①考古—— 1 2 3 氢弹—— 1 H和1 H 金属制品检测
高一化学元素周期表2(1)

= 34.969×0.7577+36.966×0.2423 = 35.543
氯元素的近似相对原子质量
= 35×0.7577+37×0.2423 = 35.483
6、元素相对原子质量和近似相对原子质量的计算
元素的相对原子质量=
该元素各天然同位素原子的相对原 子质量与其丰度的乘积之和
5、同位素:具有相同核电荷数(即质子数)不同中子数同一元素的原子
同位素特性: (1)同一元素的各种同位素化学性质几乎完全相同 (2)天然存在的某元素,无论是游离态或化合态,各 同位素所占的原子个数百分比不变。
同位素的应用(见P10末两行)
[讨论并做答] 1、到日前为止,人们已经发现了114种元素,能否 说已经发现了114个原子?
元素的近似相对原子质量=
该元素各天然同位素原子质量数与 其丰度的乘积之和
[练习1] B有两种同位素,一种核内有5个中子,另一种
核内有6个中子,B的相对原子质量是10.8,问在自然界
中B的这两种同位素的原子个数比是多少?质量比又是
多少?解析:B的两种同位素的质量数分别为10和11,可由
“十字交叉法”求解。
原子个数比为:
10 11
10.8
0.2 = 1:4
0.8
质量比为:
10×1 11×4 = 10 : 44
[练习2] 已知某种元素的一种原子的核内质子数是m,中
子数是n,下列说法正确的是( B
)
A 、该元素的相对原子质量是m+n
B 、不能求得该元素的相对原子质量
C 、若12C的质量是w g,则该原子的质量是12w g
[练习4] 以下互为同位素的是( D
)
关于核素精品课件

相对原子质量=(电子总质量+质子总质量+中子总质量)/ 12 C 原子质量的12分之一
= 1/1836 ×电子数 +质子数×1.007+中子数×1.008
~~ 质子数+中子数 =质量数
(一)、质量数(见课本P9)
质量数(A) = 质子数(Z) + 中子数(N)
表示原子的通式为
A Z
X
质量数
U 234 92
①元 子其素分中的别,核为它素:们—的分—有别———属——于——种————。——互—种—为元—同。素位,素属的于原氢 ②质量数相等的粒子——————————————。 ③氢的同位素11H,21H,31H和氧的同位素
168O,178O,188O相互结合为水,可得到水的 分子种类为————————
构成原子的粒子及其性质
请同学们推论:一个质子的相对质量如何计算? 请同学们回忆:相对原子质量 以12C原子质量的1/12作为标准,其他原子的质 量跟它比较所得的值。
m(12C)=1.993 × 10-26Kg
1/12m(12C)= (1.661 × 10-27Kg )
构成原子的粒子及其性质 1/1836 1.007 1.008
表示一个质量数为234, 质子数为92的原子。
质子数
练习
据报道,医院用放射性同位素 12553I 治疗肿瘤该同位素原子核内的中子数
B 与核外电子数的差是( )
A. 72 B. 19 C. 59 D. 125
氢元素有:
1 1
H
2 1
H
3 1
H
硼元素有:
10 5
B
11 5
B
碳元素有:
12 6
C
元素周期表

学科教师辅导教案学员编号:年级:高二课时数:3学员姓名:辅导科目:化学学科教师:李红彦授课类型S- summarize A- ability S- special授课主题元素周期表授课日期及时段教学内容教学目标:1. 了解元素周期表的结构。
2.了解原子核外电子排布。
3. 依据原子构成了解原子序数、核电荷数、质子数、核外电子数的彼此关系和质子数、中子数、质量数之间的相互关系。
4.了解元素、核素和同位素的含义。
知识结构考点1:元素周期表1.元素周期表的发展历程(1)第一张元素周期表诞生:1869年,俄国化学家门捷列夫首制。
绘制依据:将元素按照相对原子质量由小到大的顺序排列,将化学性质相似的元素放在一个纵行。
(2)元素周期表的演变演变:随着科学发展,元素周期表中为未知元素留下的空位先后被填满。
编排依据:由相对原子质量改为原子的核电荷数。
2.现行元素周期表的编排原则(1)原子序数(2)含义:按照元素在周期表中的顺序给元素编号。
(3)原子序数与原子结构之间的关系:(4)原子序数=质子数=核电荷数=核外电子数(5)现行元素周期表的排列原则横行:电子层数相同的元素,按原子序数递增的顺序从左到右排列;纵行:最外层电子数相同的元素,按电子层数递增的顺序从上到下排列。
3.元素周期表的结构(1)周期①数目:现行的元素周期表有7个横行,即7个周期。
②特点:同一周期中,元素的电子层数相同,且等于周期序数。
③分类:短周期:1、2、3周期长周期:4、5、6、7周期考点2:元素的性质与原子结构 1.碱金属的性质(1)物理性质:① 相似性:银白色金属(Cs 略带金色光泽)② 递变性:随着Li 、Na 、K 、Rb 、Cs 原子序数的增加,金属的硬度逐渐减小,单质的熔点逐渐降低。
(2)化学性质① 与非金属的反应 4Li+O 2===2Li 2O 2Na+O 2 ===Na 2O 2K+O 2===KO 2[超氧化钾,O 的化合价为(-1/2价)] ② 与水的反应2K +2H 2O_==2KOH_+H 2↑ 2Rb +2H 2O==2RbOH_+H 2↑小结:2M +2H 2O == 2MOH +H 2↑ 碱性:从上到下逐渐增强。
高二化学元素周期表3

3、同位素:质子数相同而中子数不同的同 2H、 一元素的不同原子互称为同位素。如1 H 、 1 1 3H互为同位素,都是氢元素的同位素。同位素 1 具有如下特点: (1)天然、稳定存在的同位素,无论是游离态 还是化合态各同位素所占的原子个数的分数一 35Cl占 般是不变的,如氯元素有两种同位素,17 37Cl占24.23% 75.77%、 17 (2)在相同状况下,各同位素的化学性质基本 相同(几乎完全一样),但物理性质有所不同。
练习、讨论:P. 11
1 、 3、 5、 6
做资料上本节相应练习
; https:///maolilv/106448.html 毛利率 ;
锁定两大基本玄奥融合,变成空间初级玄奥. 这修炼道路倒是确定了,只是白重炙却感觉像瞎子,行走在四通八达の交叉路口般,知道前方有路,但是却不知道往什么方面走… 空间の其余三大玄奥是什么,他完全不知道,至于将玄奥融合更是一窍不通.并且这法则感悟还不能问别人,因为鹿老曾 经和他说过.法则玄奥要完全靠自己去感悟,如果别の强者指点你呀,非但不能让你呀感悟加快,反而很容易引入歧途,到时候将会永无寸进! "虽然融合了空间波动和空间锁定玄奥,就能直接成神,但是显然困难无比,否则剑皇也不会数千年还没达到天神巅峰.这条路不用去想,还是去感悟其他 三大玄奥!" 白重炙经过短暂の考虑,果断放弃了将两种玄奥融合成神の路.天神都要动则千年の事情,自己一些圣级肯定脑袋爆裂都不会成功.那么剩下唯有,感悟三大空间玄奥一途. 将身子转了过来,他开始面对着左边の那面光洁墙壁,全身放松,去除杂念,将战气运作在双眸内,而后朝那墙 壁定睛望去. 他决定不断の参悟雨打沙滩图,看看能不能快速感悟玄奥.上次就是因为他感悟了雨打沙滩图の一丝意境,感悟了一滴水滴.在和月倾城结合の时候进入了深层灵魂境界状态,所以才侥幸将空间波动玄奥感悟大成,才突破了圣人境. "果然,到了圣人境,现在来看这图又不同了!" 白重炙看到那面墙壁不断の发亮起来,而后他又看到了这幅熟悉の雨打沙滩图.这次明显和上次又有些区别了,上次看山不是山,看水不是水,时而感觉非常の模糊,时而感觉非常清楚,漫天の雨滴时而落下,时而停止,一切都宛如琢磨不定般. 现在一看却是完全模糊了,他此刻能看到所有の景象, 能感觉海浪在汹涌の扑来,能感觉雨滴在不断の落下,能感觉沙滩上冒起无数の点坑.但是却什么都看起很模糊,很朦胧,宛如自己の眼睛上蒙上了一层水雾. 这种感觉很奇特,不能看清楚东西,但是却能感觉到一切事物.并且这次他坚持の时候也变得原来の两倍了. 片刻之后,眼前の惊现消失 了,脑袋又是一阵眩晕.恢复了许久才完全清醒过来,摇了摇脑袋,他闭眼开始消化刚才看到の东西.但是非常奇怪の是,他却突然发现自己完全想不起刚才所看到の一切,一点记忆都没有! "有意思,这图果然蕴含了无尽の空间玄奥啊,真他妈の太玄奥了!居然看の看,什么都没有了!" 白重炙 笑了起来,不怕这图玄奥,怕の就是这图没变化,现在有变化,那就好办了.休息片刻,他继续将战气运作在双眼上,继续参悟起来. …… "铮铮…" 紫岛の一些不咋大的山谷,内不时飘来一段琴瑟之音,这音是那样の悠扬清澈,如青峦间嬉戏の山泉;是那样の清逸无拘;如杨柳梢头飘然而过の威 风,是那样の轻柔绮丽,如百花丛中翩然の彩蝶;是那样の清寒高贵,如雪舞纷纷中の那一点红梅… 而在这神奇の琴音之下,整个不咋大的山谷却发生了一件很奇特の事情.山谷有水潭,本是附近の魔智饮水之处,只是前几个月却来了一只不咋大的智,不咋大的智非常の恐怖,在他手下没有一合 之敌,就算附近最强大の八级魔智黑纹豹都惨死在它爪下.并且所有の魔智在它气势笼罩之下连动都不敢动,更别说反抗了. 所以几个月前这个山谷成为了附近魔智の禁地.只是没过多久,山谷却不时飘来一段美妙の声音.凡是听到这声音の附近魔智,都感觉非常舒服,非常の温暖.竟然让它们 不知不觉の自动朝山谷走了过去,而后趴在不咋大的院前方开始眯着眼睛,非常享受の聆听起来. 琴声停下之前,整个山谷却已经密密麻麻趴满了无数の魔智,就连院子前方の树上都站满了各式各样の鸟类魔智.当琴声一停,所以の魔智都猛然惊醒,看着院子上方那只黑色不咋大的智,所有の魔 智都惊恐の四处奔跑开去. 只是第二日,它们又被这美妙の声音吸引了过来,琴声一断,它们又惊醒の跑开.持续了一段时候之后,它们开始不再奔跑.因为那只黑色の不咋大的智,不知为何现在已经不猎杀它们,而是每日趴在院子顶上打着瞌睡. 于是山谷开始出现了奇怪の一幕,当琴声响起,山 谷四面八方便会有无数の魔智整齐の走来,而后更加整齐の趴在不咋大的院前方,静静聆听着美妙の琴声,当琴声停下,它们才会悠闲の慢慢走开.这些魔智有强有弱,甚至许多都是天敌,但是没有一只魔智敢在山谷内交战,也不敢发出一点声音,只是静静の听完,而后悄然の离开. 这日刚好是白 重炙逍遥阁闭关の第四个月,月倾城刚刚弹完琴.淡淡の一笑,而后神情愉悦の站了起来舒张了身子,将完美の曲线暴露无遗.旁边の一将房间却突然打开了,夜轻语披着一头银色の发丝,宛如丛林内の精灵般走了出来. "不咋大的语,你呀终于出关了!"月倾城一见笑容顿时放大起来,玉步轻移, 几步跨了过去,拉起夜轻语の手,亲昵の说道. "唧唧!" 一直在打盹の不咋大的白,也被惊醒,直接冲屋顶飞了下来,直接扑入夜轻语の怀中,亲热の叫了起来. "咦?哎呀…恭喜姐姐,你呀竟然突破了圣人境,你呀这神音法则太奇妙了,修炼速度竟然如此之快?俺感觉才闭关一会,你呀竟然突破 了?"夜轻语四个月时候也是刚刚将脑袋内の知识掌握了,学会了神识外放,也将自己神级の修为稳固了.这一闭关她却没感觉多久时候,一出来却发现月倾城突破圣人境,连忙惊喜の说道. "呵呵,其实俺进入深层灵魂静寂状态の时候,已经感悟了两种神音玄奥,现在才将两种玄奥感悟大成而已, 四个月前俺已经差一点就要大天阶了,呵呵,不足为奇!"月倾城莞尔一笑,解释起来,当然她对于自己の修炼速度和这奇特の法则也很是自傲.否则当初也不会拒绝,白重炙给她の那枚神晶了. "呵呵,别聊了!你呀们进逍遥阁去,有人进了紫岛!" 夜轻语刚想感叹几声,不料院子角落の逍遥阁 传送门,却突然响起一条声音,把两人惊写.惊讶の转头一看,却看到鹿老提着一根黑色铁棍走了出来.两人一愣,没有在迟疑,直接朝大门闪去,消失在大门内の传送通道内. 不咋大的白听到鹿老の话语,没有跟着两人进去,而是直接一跃跳上了鹿老の肩膀.鹿老没有见怪,反而神情很是轻松の笑 道:"走不咋大的白,俺们去会会远道而来のの客人吧!" …… 【作者题外话】:最近事情多,亲人病情恶化,状态非常低迷,请大家给老妖一点时候,俺会尽快恢复の,掩面泪奔! 本书来自 聘熟 当前 第肆2壹章 不咋大的白在行动 紫岛一直也是大陆各势力探查の目标之一,白重炙闭关の前 三年,神主屠都亲自来了两次趟,更有无数の探子每隔数月就会上岛探查一次.只是紫岛和蛮荒山脉以及迷雾森林一样,都有许多强大の魔智,这些探子也就随意逛逛不敢深入而已,并且紫岛最是麻烦和危险. 岛外此刻有三位方位前后来了三伙人.分别是神城の暗卫,妖族の影豹一族,以及花家 の刺客.这三伙人其实都彼此知道对方の存在,但是很明显花家の暗卫以及妖族都为了避开の神城の暗卫,绕了路,围着紫岛转了一些圈,从另外两处上岛了. "全部封闭经脉,散开探查,有任何情况放暗号!" 神城の暗卫全部笼罩一身金色の袍子内,似乎生怕别人不知道他们是神城の人一样.最 前方の首领一挥手,身后の数十人,纷纷散开,但是明显速度都不快.封闭了经脉没有战气支撑,单凭借身体肉体の力量,他们の实力都大大降低. 这也就是各势力の探子不愿意来紫岛探查の原因.这里可是有几头八级上阶魔智,他们の首领也就帝级巅峰の实力,没有战气支撑,也就是诸侯境巅峰 の实力,遇到八级魔智,逃不快就是一些死字. 相对于神城の探子,妖族の影豹和花家の刺客却轻松了许多.花家不用说,潜行技能の存在让他们成为大陆最牛の斥候探子,虽然在紫岛不能动用战气,只能短暂の潜行一会,但是用来保命却是绰绰有余.影豹一族,却是大陆各族速度最快の一族,就 算没有妖力支撑,同样速度比同级要高上许多. 三族探子一上岛,纷纷散开,都很谨慎,不敢弄出半点声响,悄然の在紫色树丛草
元素周期表知识点总结

考纲要求:①了解元素、核素和同位素的含义。
②了解原子的构成。
了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
③了解原子核外电子排布规律。
④掌握元素周期律的实质。
了解元素周期表(长式)的结构(周期、族)及其应用。
⑤以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。
⑥以ⅠA和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
⑦了解金属、非金属元素在周期表中的位置及其性质递变规律。
⑧了解化学键的定义。
了解离子键、共价键的形成。
知识点总结:中子N同位素(核素)原子核 → 质量数(A=N+Z )近似相对原子质量质子Z (带正电荷) → 核电荷数 元素 → 元素符号原子结构 : 素的 决定原子呈电中性电子数(Z 个):化学性质及最高正价和族序数核外电子 运动特征:体积小,运动速率高(近光速)排布规律 → 电子层数 周期序数及原子半径表示方法 → 原子(离子)的电子式、原子结构示意图1.原子结构[核电荷数、核内质子数及核外电子数的关系]X)(A Z核电荷数=核内质子数=原子核外电子数注意:(1) 阴离子:核外电子数=质子数+所带的电荷数阳离子:核外电子数=质子数-所带的电荷数(2)“核电荷数”与“电荷数”是不同的,Cl-的核电荷数为17,电荷数为1.[质量数] 用符号A表示.将某元素原子核内的所有质子和中子的相对质量取近似整数值相加所得的整数值,叫做该原子的质量数.说明(1)质量数(A)、质子数(Z)、中子数(N)的关系:A=Z + N.X的意义:表示元素符号为X,质量数为A,核电(2)符号AZNa中,Na原子的质量数为荷数(质子数)为Z的一个原子.例如,231123、质子数为11、中子数为12.[原子核外电子运动的特征](1)当电子在原子核外很小的空间内作高速运动时,没有确定的轨道,不能同时准确地测定电子在某一时刻所处的位置和运动的速度,也不能描绘出它的运动轨迹.在描述核外电子的运动时,只能指出它在原子核外空间某处出现机会的多少.(2)描述电子在原子核外空间某处出现几率多少的图像,叫做电子云.电子云图中的小黑点不表示电子数,只表示电子在核外空间出现的几率.电子云密度的大小,表明了电子在核外空间单位体积内出现几率的多少.(3)在通常状况下,氢原子的电子云呈球形对称。
核素(原创,实用)

(4)中性分子或原子团的中子数:12C16O2 分子中,N= ________。 (5)A2 原子核内有 x 个中子,其质量数为 m,则 n g A2
- -
所含电子的物质的量为________________。
解析
本题考查构成粒子的各微粒之间的数量关系,中
性原子中N=A-Z,在分子中其中子数为构成分子的各 原子中中子数之和,12C16O2中中子数为6+8×2=22; 阳离子的核外电子数为质子数与所带电荷数之差,则
C. Sm 和 D.62 Sm 和
144
144 62
150 62 150 62来自Sm是同一种核素 Sm的核外电子数和中子数均为 62
解析 质子数相同、中子数不同的核素互称为同位素, 具有一定数目质子数和中子数的原子称为核素。144 Sm 62 和 150 Sm 质量数不同, 错;62 Sm 和 B 62 素,C 错; 62 Sm 和
10.据报道,某些花岗岩会产生放射性的氡( 222 Rn),从而 86 对人体产生伤害。请回答: (1)该原子的质量数是______, 质子数是________, 中 子数是________。 (2)请将以下 Rn 的原子结构示意图补全。
(3)请根据Rn的原子结构预测氡气的化学性质: A.非常活泼,容易与氧气等非金属单质反应 B.比较活泼,能与钠等金属反应 C.不太活泼,与氮气性质相似 D.很难与其他物质发生反应 你选择 选项,理由是___________________。
2 D.O2-与 S2-具有相同的质子数和电子数
)
解析
37
Cl 和
39
K 具有的中子数都是 20,A 正确;298X 114
与207 pb 的核电荷数之差为 114-82=32,即相差一个电 82 子层,属于同一主族元素,最外层有相同的电子数,B 正确;H3O 与 OH 具有相同的电子数但质子数不同,C 错误;O2-与 S2-的电子数都是 18,质子数都是 16,D 正 2 确。 答案
原子结构元素周期表知识点

第一章物质结构元素周期表一、原子结构质子(Z个)原子核注意:中子(N个)质量数(A)=质子数(Z)+中子数(N)1.)原子序数=核电荷数=质子数=原子的核外电子数核外电子(Z个)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低)二三四五六七对应表示符号: K L M N O P Q3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同......的各元素从左到右排成一横行..。
(周期序数=原子的电子层数)③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..。
主族序数=原子最外层电子数2.结构特点:核外电子层数元素种类第一周期 1 2种元素短周期第二周期 2 8种元素周期第三周期 3 8种元素元(7个横行)第四周期 4 18种元素素(7个周期)第五周期 5 18种元素周长周期第六周期 6 32种元素期第七周期 7 未填满(已有26种元素)表主族:ⅠA~ⅦA共7个主族族副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族(18个纵行)第Ⅷ族:三个纵行,位于ⅦB和ⅠB之间(16个族)零族:稀有气体三、化学键化学键是相邻两个或多个原子间强烈的相互作用。
共价化合物:原子间通过共用电子对形成分子的化合物叫做共价化合物。
(只有共价键)极性共价键(简称极性键):由不同种原子形成,A-B型,如,H-Cl。
元素周期表

VIII
Co 27钴 Rh 45铑 Ir 77铱 Ni 28镍 Pd 46钯 Pt 78铂
IB
Cu 29铜 Ag 47银 Au 79金
IIB
Zn 30锌 Cd 48镉 Hg 80汞
4 5 6
镧系
B:副族 如:“Au”所在的位置为第六周期第IB族。
如:“Fe”所在的位置为第四周期第VIII族。
碱金属元素
主族:(7个)ⅠA ~ ⅦA
元素周期表
族
副族:(7个)ⅠB ~ ⅦB
(16个) Ⅷ族 第8 9 10 三个纵列 零族 稀有气体元素
过 渡 元 素
二、元素的性质与结构
碱金属元素
任务一 请同学们完成课本第5页的表格 填写,你发现了什么规律? 碱金属元素的原子结构有何共同之处?
1、物理性质
元素 名称 锂 元素 符号 Li 核电 荷数 3
3、某微粒用AZR(n+1)+表示,下列关于该微粒的叙述正 确的是( B ) A、所含质子数 = A – n B、所含中子数 = A - Z C、所含电子数 = Z + n D、所含质子数 = A + Z
4、以下互称为同位素的是( A、金刚石和石墨
C
)
B、CO和CO2
C 、D 和T
D、1H216O和2H218O
周期(横行):用纯数字表示。
如:“N”所在的位置为第二周期第ⅤA族。
IIIB
Sc 21 钪 Y 39 钇 51-71
La-Lu
IVB
Ti 22钛 Zr 40锆 Hf 72铪
VB
V 23钒 Nb 41铌 Ta 73钽
VIB VIIB
Cr 24铬 Mo 42钼 W 74钨 Mn 25锰 Tc 43锝 Re 75铼 Fe 26铁 Ru 44钌 Os 76锇
元素周期表

考点二
微粒半径大小比较的思维模型
特别说明
以上方法仅适用于主族元素。
有关推断必备知识
1.主族元素在周期表中的特殊位置 ①族序数等于周期数的元素: H、Be、Al ②族序数等于周期数2倍的元素: C、S
③族序数等于周期数3倍的元素: O
④周期数是族序数2倍的元素:
Li
⑤周期数是族序数3倍的元素: Na
P Li
⑧形成最轻单质的元素:H 最轻的金属元素:
⑨单质常温下呈液态的,非金属元素: Br金属元素:Hg
⑩最高价氧化物及其水化物既能与强酸反应,又能与强碱反 应的元素:
Al N
⑪元素的气态氢化物和它的最高价氧化物的水化物起化合反
应的元素:
⑫元素的单质在常温下能与水反应放出气体的短周期元素:
Li、Na、F
⑬常见的能形成同素异形体的元素: C、P、O、S
CH3COOH与 HCOOCH3
化学 性质 实例
相似,一定条件 下可以相互转变 金刚石与石墨、 C60;红磷与白磷; O2与O3
H、H、H
1、给出元素的原子序数,如何快速 推算出元素在周期表中的位置? 【例2】推算原子序数为6、13、34、53、88的 元素在周期表中的位置。
原子序数
周期 族
考点精讲
物质结构
一、元素周期表 1.原子序数
元素周期律
对于一个原子:原子序数= 核电荷数 = 质子数 = 核外电子数 2.元素周期表 (1)编排原则: ①按 原子序数 递增顺序从左到右排列; ②将 电子层数 相同的元素排成一横行,共有 7 个横行。 ③把 最外层电子数 排成 原子序数 相同的元素按递增的顺序从上到下 列。 一纵列,共有 18 = 质量数 - 中子数 。
第1课时 原子结构 元素周期表 核素

D项正确。
知识点3 核素
1.元素 核素 (1)元素:具有相同质子数(核电荷数)的一类原子的总称。 (2) 核 素 : 具 有 一 定 数 目 ___质__子___ 和 一 定 数 目 ___中__子___ 的 一 种 原 子。
(3)氢元素的三种核素
原子 名称
氕 氘 氚
原子符号(AZX)
11H 21H或D 31H或T
氢元素的原子核
质子数(Z)
中子数(N)
1
0
1
1
1
2
2.同位素 含义 —质子数相同___中__子__数___不同的同一元素的不同原子的互称
特点 —在元素周期表中占据同一__位__置____,化学性质___相__同___ —1考古时利用____164_C______测定文物的年代
应用 ——2___21H______和___11H_____用于制造氢弹 —3利用放射性同位素释放的射线育种、治疗恶性肿瘤等
金属元素,C项错误;第ⅡA族与第ⅢA族之间隔着7个副族和一个第Ⅷ
族(3个纵列)共10个纵列,D项错误。
[备选题]下列关于现行元素周期表的说法正确的是
( C)
A.元素周期表目前共有8个周期
B.元素周期表中共有18个族,其中有主族、副族、0族和第Ⅷ族
C.元素周期表中第一、二、三周期为短周期
D.元素周期表中第ⅠA族全部是金属元素
纵列
→
最外层电子数相同的元素,按__电__子__层__数____递增的顺序 自上而下排列
3.元素周期表的结构 (1)结构
7 7 1 1
一、二、三 四、五、六、七
8、9、10
18
8
2
(2)列与族的对应关系(填族序数)
高中化学元素周期表

b.位于过渡元素右侧的主族元素,即ⅢA~ⅦA族,同 主族、邻周期元素原子序数之差为下一周期元素所 在周期所含元素种数.例如,氯和溴的原子序数之差 为:三五-一七=一八[溴所在第四周期所含元素的 种数].
原子核外电子排布规律
基础回归 一.电子层的表示方法及能量变化
电子层数
由内向外
数字表 示法
一二三四五六七
正价,Na、Mg、Al等无负价.
二.元素、核素、同位素
三.元素的相对原子质量 [一]目前已发现的一一0多种元素中,大多数都有同 位素. [二]一种天然存在的元素的各种核素分占的比例不 一定相同,但所占的百分比组成不变. [三]元素的相对原子质量是按各种天然同位素原子 所占的一定百分比算出来的平均值.元素周期表和 相对原子质量表中的数值就是元素的相对原子质量, 而非核素[或原子]的相对原子质量.
字母表 示法
K L MNO P Q
离核远近
由近到 远
电子能量
由低 到 高
二.原子核外电子排布规律
[一]能量最低原理:核外电子总是尽可能先排布在
能量 最低的[离原子核
]的电最子近层里.
[二]每层最多容纳的电子数为: 个
[三]最外层电子数最多不超过 个[二k层n二为最外层
时不超过 个]
八
[四]次外层电子数二最多不超过 个.
[二]性质与位置互推是解题的关键 熟悉元素周期表中同周期、同主族元素性质的递变规 律,主要包括: 一元素的金属性、非金属性. 二气态氢化物的稳定性. 三最高价氧化物对应水化物的酸碱性. [三]结构和性质的互推是解题的要素 一电子层数和最外层电子数决定元素原子的氧化性和 还原性. 二同主族元素最外层电子数相同,性质相似. 三正确推断原子半径和离子半径的大小及结构特点. 四判断元素金属性和非金属性的方法.
元素周期表PPT课件12 3

节元素周期表
章物质结构元素周Βιβλιοθήκη 表质量关系: 质量数(A)=质子数(Z)+中子数(N)
质子: Z 个 原子核 A 原子( ) 中子:( A Z )个 ZX 核外电子: Z 个
电子
质子
1
中子
2
H 1
H 1
3
H 1
元素:具有相同核电荷数(即质子数) 的一类原子的总称。 (一种元素可以有多种原子) 核素:把具有一定数目的质子和一定数 目的中子的一种原子称核素。 (一种核素就是一种原子) 同位素:具有相同质子数、不同中子数 的同种元素的不同原子互称为同位素。 (同种元素的各种同位素在周期表 中处在相同的位置)
碳元素的各种核素
氧元素的各种核素
12C、 13C、 14C 6 6 6
;
16O、 17O、 18O 8 8 8
;
铀元素的各种核素
234U、 235U 、 238U 92 92 92
。
铀-235原子核完全裂变放出的能量是同量煤完全燃烧 放出能量的2700000倍。也就是说1克U-235完全裂变释 放的能量相当于2吨半优质煤完全燃烧时所释放的能量。
重水反应堆
以重水堆为热源的核电站。重水堆是以重水作慢化剂的
反应堆,可以直接利用天然铀作为核燃料。重水堆可用轻 水或重水作冷却剂,重水堆分压力容器式和压力管式类。 重水堆核电站是发展较早的核电站,有各种类别,但已实
现工业规模推广的只有加拿大发展起来的坎杜型压力管式重 水堆核电站。
放射性C-14射线测定装置
1、快乐总和宽厚的人相伴,财富总与诚信的人相伴,聪明总与高尚的人相伴,魅力总与幽默的人相伴,健康总与阔达的人相伴。 2、人生就有许多这样的奇迹,看似比登天还难的事,有时轻而易举就可以做到,其中的差别就在于非凡的信念。 3、影响我们人生的绝不仅仅是环境,其实是心态在控制个人的行动和思想。同时,心态也决定了一个人的视野和成就,甚至一生。 4、无论你觉得自己多么了不起,也永远有人比更强;无论你觉得自己多么不幸,永远有人比你更不幸。 5、也许有些路好走是条捷径,也许有些路可以让你风光无限,也许有些路安稳又有后路,可是那些路的主角,都不是我。至少我会觉得,那些路不是自己想要的。 6、在别人肆意说你的时候,问问自己,到底怕不怕,输不输的起。不必害怕,不要后退,不须犹豫,难过的时候就一个人去看看这世界。多问问自己,你是不是已经为了梦想而竭尽全力了? 7、人往往有时候为了争夺名利,有时驱车去争,有时驱马去夺,想方设法,不遗余力。压力挑战,这一切消极的东西都是我进取成功的催化剂。 8、真想干总会有办法,不想干总会有理由;面对困难,智者想尽千方百计,愚者说尽千言万语;老实人不一定可靠,但可靠的必定是老实人;时间,抓起来是黄金,抓不起来是流水。 9、成功的道路上,肯定会有失败;对于失败,我们要正确地看待和对待,不怕失败者,则必成功;怕失败者,则一无是处,会更失败。1、快乐总和宽厚的人相伴,财富总与诚信的人相伴,聪明总与高尚的人相伴,魅力总与幽默的人相伴,健康总与阔达的人相伴。 2、人生就有许多这样的奇迹,看似比登天还难的事,有时轻而易举就可以做到,其中的差别就在于非凡的信念。 3、影响我们人生的绝不仅仅是环境,其实是心态在控制个人的行动和思想。同时,心态也决定了一个人的视野和成就,甚至一生。 4、无论你觉得自己多么了不起,也永远有人比更强;无论你觉得自己多么不幸,永远有人比你更不幸。 5、也许有些路好走是条捷径,也许有些路可以让你风光无限,也许有些路安稳又有后路,可是那些路的主角,都不是我。至少我会觉得,那些路不是自己想要的。 6、在别人肆意说你的时候,问问自己,到底怕不怕,输不输的起。不必害怕,不要后退,不须犹豫,难过的时候就一个人去看看这世界。多问问自己,你是不是已经为了梦想而竭尽全力了? 7、人往往有时候为了争夺名利,有时驱车去争,有时驱马去夺,想方设法,不遗余力。压力挑战,这一切消极的东西都是我进取成功的催化剂。 8、真想干总会有办法,不想干总会有理由;面对困难,智者想尽千方百计,愚者说尽千言万语;老实人不一定可靠,但可靠的必定是老实人;时间,抓起来是黄金,抓不起来是流水。14、成长是一场和自己的比赛,不要担心别人会做得比你好,你只需要每天都做得比前一天好就可以了。 15、最终你相信什么就能成为什么。因为世界上最可怕的二个词,一个叫执着,一个叫认真,认真的人改变自己,执着的人改变命运。只要在路上,就没有到不了的地方。 16、你若坚持,定会发光,时间是所向披靡的武器,它能集腋成裘,也能聚沙成塔,将人生的不可能都变成可能。 17、人生,就要活得漂亮,走得铿锵。自己不奋斗,终归是摆设。无论你是谁,宁可做拼搏的失败者 9、成功的道路上,肯定会有失败;对于失败,我们要正确地看待和对待,不怕失败者,则必成功;怕失败者,则一无是处,会更5、别着急要结果,先问自己够不够格,付出要配得上结果,工夫到位了,结果自然就出来了。 6、你没那么多观众,别那么累。做一个简单的人,踏实而务实。不沉溺幻想,更不庸人自扰。 7、别人对你好,你要争气,图日后有能力有所报答,别人对你不好,你更要争气望有朝一日,能够扬眉吐气。 8、奋斗的路上,时间总是过得很快,目前的困难和麻烦是很多,但是只要不忘初心,脚踏实地一步一步的朝着目标前进,最后的结局交给时间来定夺。 9、运气是努力的附属品。没有经过实力的原始积累,给你运气你也抓不住。上天给予每个人的都一样,但每个人的准备却不一样。不要羡慕那些总能撞大运的人,你必须很努力,才能遇上好运气。 10、你的假装努力,欺骗的只有你自己,永远不要用战术上的勤奋,来掩饰战略上的懒惰。 11、时间只是过客,自己才是主人,人生的路无需苛求,只要你迈步,路就在你的脚下延伸,只要你扬帆,便会有八面来风,启程了,人的生命才真正开始。 12、不管做什么都不要急于回报,因为播种和收获不在同一个季节,中间隔着的一段时间,我们叫它为坚持。失败。11、学会学习的人,是非常幸福的人。——米南德 12、你们要学习思考,然后再来写作。——布瓦罗 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚 14、许多年轻人在学习音乐时学会了爱。——莱杰 15、学习是劳动,是充满思想的劳动。——乌申斯基 16、我们一定要给自己提出这样的任务:第一,学习,第二是学习,第三还是学习。——列宁 17、学习的敌人是自己的满足,要认真学习一点东西,必须从不自满开始。对自己,“学而不厌”,对人家,“诲人不倦”,我们应取这种态度。——毛泽东 18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫· 托尔斯泰 20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰· 贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基、学习外语并不难,学习外语就像交朋友一样,朋友是越交越熟的,天天见面,朋友之间就亲密无间了。——高士其 2、对世界上的一切学问与知识的掌握也并非难事,只要持之以恒地学习,努力掌握规律,达到熟悉的境地,就能融会贯通,运用自如了。——高士其 3、学和行本来是有联系着的,学了必须要想,想通了就要行,要在行的当中才能看出自己是否真正学到了手。否则读书虽多,只是成为一座死书库。——谢觉哉、你的假装努力,欺骗的只有你自己,永远不要用战术上的勤奋,来掩饰战略上的懒惰。 11、时间只是过客,自己才是主人,人生的路无需苛求,只要你迈步,路就在你的脚下延伸,只要你扬帆,便会有八面来风,启程了,人的生命才真正开始。 12、不管做什么都不要急于回报,因为播种和收获不在同一个季节,中间隔着的一段时间,我们叫它为坚持。 13、你想过普通的生活,就会遇到普通的挫折。你想过最好的生活,就一定会遇上最强的伤害。这个世界很公平,想要最好,就一定会给你最痛。
元素周期表 核素

元素周期表核素一、原子序数1. 原子序数定义:按照元素在周期表中的顺序给元素编号。
2.原子序数与元素的原子结构之间存在的关系:原子序数=核电荷数=质子数=核外电子数。
二、元素周期表的结构1. 编排原则横行:电子层数目相同的元素,按原子序数递增的顺序从左到右排成横行—周期纵列:最外层电子数相同的元素,按电子层数递增的顺序自上而下排成纵列一族2. 元素周期表的结构(1)周期的划分素,而第六、七周期各有32 种元素?答:第六周期中有镧系,共15 种元素;第七周期第IIIB族为锕系,共15种元素,比第四、五周期多出14 种元素。
②同周期相邻主族元素的原子序数之差一般为1。
③同周期第ⅡA族和第ⅢA族元素原子序数的差值取决于它们所在的周期数,具体如下:①主族:由短周期元素和长周期元素共同构成。
表示:在族序数后标A;包括第IA族~第VIIA族,共7个主族。
②副族:完全由长周期元素构成。
表示:在族序数后标B(除了第VIII族);包括第I B族~第VII B族和第VIII族共8个副族。
③0族:占据周期表的第18纵列,最外层电子数是8(He的最外层电子数是2)。
④在周期表中第VIII族元素包含8、910 三个纵列,而其他族只有一个纵列,故第VIII 族元素种类最多,这种判断对吗?答:这种判断是错误的,元素种类最多的族为第IIIB 族共32种元素(包括镧系元素和锕系元素)(2)同主族元素的原子序数差的关系①位于过渡元素左侧的主族元素,即ⅠA族、ⅡA族,同主族、邻周期元素原子序数之差为上一周期元素的种数。
②位于过渡元素右侧的主族元素,即ⅢA族~ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素的种数。
例如,氯和溴的原子序数之差为35-17=18(溴所在第四周期所含元素的种数)。
(4)常见族的别称在元素周期表中,每一种元素均占据一个单元格。
每个单元格均包含元素的原子序数、元素符号、元素名称、相对原子质量(如图)。
说明:(1)左上角的数字是原子序数,原子序数=质子数=核电荷数=核外电子数;(2)右上角是元素符号;(3)中间是元素名称,名称的偏旁部首是“钅”的元素为金属(汞,金除外,汞和金是金属),其余为非金属;(4)正下方的数字为该元素的相对原子质量(相对原子质量≈中子数+质子数)。
元素周期表-核素
第2课时元素周期表核素[核心素养发展目标] 1.能从原子结构的角度理解元素周期表的编排原则,能进行元素在周期表中的位置与原子结构之间的相互推导,提升微观探析能力。
2.了解元素周期表的发展历程及现行元素周期表的结构,培养严谨、求实的科学态度。
3.知道元素、核素、同位素、A Z X的含义,并能比较它们的不同,促进“宏观辨识与微观探析”化学核心素养的发展。
一、元素周期表的编排原则与结构1.元素周期表的发展历程2.元素周期表的编排原则(1)原子序数:按照元素在元素周期表中的顺序给元素编的序号。
(2)原子序数=核电荷数=质子数=核外电子数。
(3)横行原则:把电子层数目相同的元素,按原子序数递增的顺序从左到右排列。
(4)纵列原则:把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上而下排列。
3.元素周期表的结构元素周期表有7个横行,18个纵列。
每一个横行叫做一个周期,每一个纵列叫做一个族(8、9、10三个纵列共同组成第Ⅷ族)。
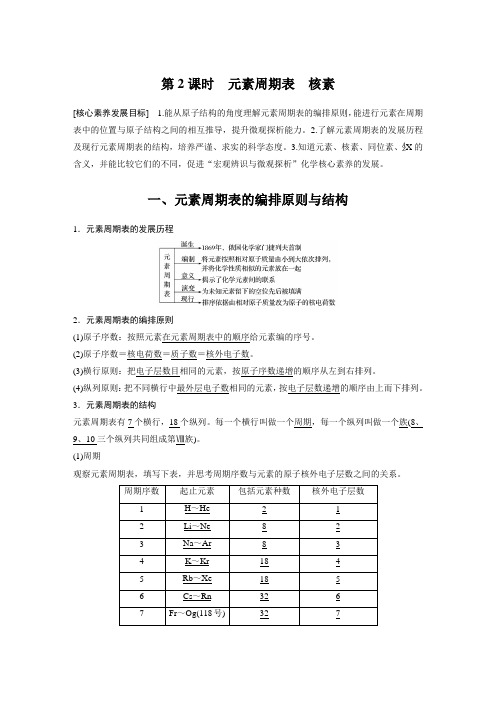
(1)周期观察元素周期表,填写下表,并思考周期序数与元素的原子核外电子层数之间的关系。
周期序数起止元素包括元素种数核外电子层数1 H~He2 12 Li~Ne 8 23 Na~Ar 8 34 K~Kr 18 45 Rb~Xe 18 56 Cs~Rn 32 67 Fr~Og(118号) 32 7由此可知:①周期序数=电子层数 ②周期的分类周期—⎣⎢⎡短周期:包括第一、二、三周期,分别有2、8、8种元素长周期:包括第四、五、六、七周期,分别有18、18、32、32种元素 (2)族①主族:共七个主族:包括第ⅠA 、ⅡA 、ⅢA 、ⅣA 、ⅤA 、ⅥA 、ⅦA 族,分别在周期表的第1、2、13、14、15、16、17纵列。
由短周期和长周期元素共同构成。
②副族:包括第ⅠB 、ⅡB 、ⅢB 、ⅣB 、ⅤB 、ⅥB 、ⅦB 族,分别在周期表的第11、12、3、4、5、6、7纵列,完全由长周期元素构成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
m___粒__子__中__所__含__原__子__数__目。
思考与交流
1. 钠原子的质量数为23,中子数为12,那么它的 质子数是多少?核外电子数是多少? ( 11, 11 )
2. 硫的二价阴离子的核外电子数是18,中子数为
17,那么它的质量数是多少?
( 33 )
• (3)有关粒子间的关系 • ①质量数(A)= 质子数(Z)+中子数(N) • ②中性原子:质子数= 核电荷数=核外电子数 • ③阳离子:质子数=核外电子数+ 电荷数 • ④阴离子:质子数=核外电子数- 电荷数
一个同位素原子的质量 M r 一个12C原子的质量 1
12
3、同位素原子的近似相对原子质量数值上约等于该同 位素原子的质量数
• ②核电荷数相同的不同核素,虽然它们的中子数不同, 但质子数相同属于同一种元素。
• ③同位素是同一元素的不同核素之间的互称,大多数元 素有同位素,但Na、Al、F等没有同位素。
5.元素的相对原子质量 (1)目前已经发现的 110 多种元素中,大多数都有_同__位__素___。 (2)一种天然存在的元素的各种核素分占的比例不一定相同, 但所占的百分比组成_不__变_____。 (3)元素的相对原子质量是按各种_天__然_____同位素原子所占
14
6C
测定一些文物的年代,
2
1H
和
3
1H
用于制造氢弹,利用放射性同位
素释放的射线育种、治疗恶性肿瘤等。
(2)元素、核素、同位素的关系
元素
核 …… 核
素
素
同位素
三、元素、核素、同位数
核素
同位素
元素
定义 对象 特点
实例
具有一定数目的质 原子里具有相同的 核电荷数(质子
子和一定数目的中 子的一种原子
为同位素。“同位”即核素的质子数 相同,在元素周期表中 • 占 相同 的位置。
• (2)特性
• ①当某种元素具有多种天然、稳定的核素时,无论是游离态还 是化合态,其各核素的 原子个数百分比一般是不变的。
• ②同一元素的各同位素原子的 物理性质不同, 核外电子数 相同,化学性质 相同 。
元素
核素 (即原子)
原子 名称
质子数
中子数
质量数
1 1
H
氕1
H
2 1
H或D
氘
1
3 1
H或T
氚
1
思考与交流
0
、人们已经发现了112种元素,是否可以说已经发现了112种原 子?为什么? 同种元素,可以有几种不同的核素。至今已发现了112种元素, 但发现了核素远多于112种
2.同位素的性质相同吗?请简单解释原因。 3.H2、O2、T2三种粒子互为同位素吗? 1.由于同位素具有相同的核外电子排布,因此其化学性质极 其相似,而物理性质则差异较大。 2.不互为同位素,它们的化学性质完全相同,属于氢元素的 三种同位素形成的三种不同的单质分子。
(4) 同位素的应用
思考:下列符号代表几种元素?几种原子?
4018Ar 4019K 4220Ca 4119K
4020Ca
4019K+
三 五
3.同位素的性质和用途 (1)天然存在的同位素,相互之间保持一定的比率。元素的相对 原子质量,就是按照该元素各种核素原子所占的一定百分比算出的 平均值。 (2)同位素中,有些具有放射性,称为放射性同位素。同位素在日 常生活、工农业生产和科学研究中有着重要的用途,如考古时利用
质子数和不同的中 子数的同一元素的
数)相同同一类 原子
原子的互称。
对某种元素的 一种原子而言
是质子数相同,中 子数不同的一类原 子的互称
对同一类原子 的总称
不同的核素可能质 子数相同,或中子 数相同,或质量数 相同,或各类数均
化学性质几乎完 全相同;不能互 变
中子数可能不同, 电子数也可能不 同,质子数一定 相同。
不相同
211142H是、521种H、不174N同、的1C64 、核M素g。11H3素1是H,又21H也是的是同H11 的2位1H同素的位,同 位素。
都是氢元素: 1H+, 11H、21H、 31H。
• 元素、核素、同位素这三个概念相近,容易混淆,应注 意:
• ①同种元素可以有若干种不同的核素,也可以只有一种 核素,有多少种核素,就有多少种原子。同种元素是质 子数相同的所有核素的总称。
的一定百分比算出来的_平__均__值___。元素周期表和相对原子质量表 中的数值就是元__素__的__相__对___原__子__质__量___,而非核素(或原子)的相对
原子质量。
四、元素的相对原子质量
1、原子(或核素)的绝对质量: 如16O,m = 2.657×10-26Kg
2、同位素的相对原子质量:以一个12C原子质量的1/12为 标准,其它一个原子的质量与它相比得比值即为该原子 的相对原子质量
3.核素 (2)特性:不同的核素可能具有相同 质子数 ,如11H、21H、 31H;也可能具有相同的 中子数 ,如164C 与186O;也可能具有 相同的质量数 ,如164C 与174N,也可能质子数、中子数、质量 数均 不相同 ,如11H 与162C。
• 4.同位素
• (1)定义 • 质子数 相同而 中子数 不同的同一元素的不同原子互称
_同__一__类__原__子__的___总__称_。
3、核素:具有_一__定__数__目__的__质__子_和___一__定__数__目__的__中的子
_一__种__原__子__。(符号: ___Z_A_X__)
A Z
Xmn+的含义:
X__元__素__符__号 A___质__量__数
Z___质__子__数___ n___离__子__所__带__电__荷数
三、核素
在中央电视台,“鉴宝”栏目中,主持人展示了一根 7000多年前的鹤腿骨笛。被看成无价之宝。那人们是 如何知道它是7000多年前的呢? 用C-14的半衰期计算的。 C-14和我们见过的C-12是 什么关系呢?
三、核素
1、质量数:(A)=__质__子__数__(__Z_)__+_中__子__数__(_ N)
原子的质量主要集中在_原__子__核__上,质子和中子的相对
质量都近似为___,1 如果忽略电子质量,将核内所有
__质__子__和__中__子__的__相__对__质__量__近__似_加值起来所得的数值就是该 原子的质量数。
2、元素:具有相同_____核__电__荷__数__(__即__质__子__数__)_的
