骨钙素测定试剂盒(荧光免疫层析法)产品技术要求
钙测试预装试剂盒说明书

Millipore- 1.00858页码 1 的 9The life science business of Merck operates as MilliporeSigma in the US化学品安全技术说明书按照GB/T 16483、GB/T 17519编制版本6.2修订日期18.09.2022打印日期18.09.2022最初编制日期19.07.2017SDS 编号Millipore - 1.00858产品编号Millipore - 1.00858钙测试预装试剂盒第1部分:化学品及企业标识1.1 产品标识产品名称: 钙测试预装试剂盒Calcium Cell Test Method: photometric 10 -250 mg/l Ca14 - 350 mg/l CaO25 - 624 mg/l CaCO₃ Spectroquant®产品编号: 1.00858产品编号: 100858品牌: Millipore1.2 安全技术说明书提供者的详情制造商或供应商名称: Sigma-Aldrich (Shanghai) Trading Co.Ltd.509 Renqing RoadZhangjiang High Tech East Park, PudongSHANGHAI201201 SHANGHAICHINA西格玛奥德里奇(上海)贸易有限公司上海市浦东新区仁庆路509号10幢邮政编码:201201默克股份两合公司64271 达姆施塔特德国Millipore - 1.00858 页码 2 的 9The life science business of Merck operates as MilliporeSigma in the USPhone:+49(0)6151 72-2440电话号码 : +86 21 6141-5566 传真: +86 21 6141-55671.3 应急咨询电话紧急联系电话: +86 532 838890901.4 物质或混合物的推荐用途和限制用途已确认的各用途 : 分析用试剂这是此产品概括的物质安全资料表(SDS),如需第16项中所列的每一成分完整的物质安全资料表(SDS),请浏览我们的网站.第2部分:危险性概述2.1 GHS 危险性类别易燃液体 (类别 3), H226 金属腐蚀物 (类别 1), H290严重眼睛损伤/眼睛刺激性 (类别 2A ), H319 生殖毒性 (类别 1B ), H360本部分提及的健康说明(H-)全文请见第16部分。
降钙素原(PCT)测定试剂盒(时间分辨荧光免疫层析法)产品技术要求注册版

医疗器械产品技术要求编号:降钙素原(PCT)测定试剂盒(时间分辨荧光免疫层析法)1.产品型号/规格及其划分说明1.1包装规格25人份/盒。
1.2主要组成成分由PCT测试卡、降钙素原(PCT)质控品、ID卡组成。
其中,PCT测试卡由试纸条、塑料盒组成;试纸条上的主要成分有硝基纤维素膜、吸水纸、样本垫、偶合物垫及PVC板;硝基纤维素膜包被有鼠抗人PCT抗体和羊抗鸡IgY抗体;样本垫上有鼠抗人红细胞抗体;偶合物垫上有荧光标记的鼠抗人PCT抗体和荧光标记的鸡IgY抗体。
降钙素原(PCT)质控品:重组人PCT蛋白。
ID卡:内含校准曲线信息。
1.3适用范围:用于体外定量测定人全血、血浆或血清中降钙素原(PCT)的含量。
临床上主要用于细菌感染性疾病的辅助诊断。
2.产品性能指标2.1试剂盒性能指标2.1.1外观a)试剂盒外观应整洁,文字符号标识清晰,封装无破损,内容物齐全。
b)测试卡外观应平整、色泽均匀、边缘无毛刺,无色斑或污渍,卡固定紧密。
2.1.2膜条宽度膜条宽度应不小于 1.4mm。
2.1.3液体移行速度液体移行速度应不低于10mm/min。
2.1.4准确度测定具有溯源性的PCT工作校准品,测量结果与标定浓度的相对偏差应不超过±10%。
2.1.5空白限应不大于0.04ng/mL。
2.1.6线性范围在0.05ng/mL~100ng/mL区间内,线性相关系数r≥0.9900。
2.1.7批内精密度用同一批次的试剂盒,两个浓度工作校准品测定结果的变异系数CV<10.0%。
2.1.8批间精密度用三个不同批次的试剂盒测试,两个浓度工作校准品测定结果的变异系数CV<15.0%。
2.2质控品性能指标2.2.1外观无色澄清透明液体。
2.2.2装量质控品装量为0.5mL,应不少于标示值。
2.2.3准确度和赋值程序质控品测试结果应在靶值范围之内,赋值程序见附录1。
2.2.4均一性对一瓶质控品重复10次检测,对同一批号的10瓶质控品进行检测,批内瓶间差CV应≤15%。
4.01 降钙素原 ∕ 白介素-6测定试剂盒(荧光免疫层析法)技术要求

医疗器械产品技术要求编号:降钙素原/白介素-6测定试剂盒(荧光免疫层析法)1 产品型号/规格及其划分说明1.1 型号型号:型号G、型号Q。
1.2 规格1人份/盒,2人份/盒,3人份/盒,5人份/盒,10人份/盒,20人份/盒,25人份/盒,30人份/盒,40人份/盒,50人份/盒,100人份/盒,200人份/盒。
1.3 产品型号/规格划分说明产品型号划分主要根据产品注册单元进行划分,其中型号G由检测卡、样本缓冲液组成;型号Q由检测卡、样本缓冲液、质控物组成。
规格划分主要根据产品单人份铝箔包装的检测卡装量来进行规格划分。
产品形式由产品型号和规格组合形成。
产品型号/规格划分类型(例子)2 性能指标2.1 物理检查2.1.1 外观试剂盒各组分齐全、完整,包装无破损;液体组分澄清、无漏液;标签牢固,内容清晰、准确。
质控物应外观均匀,形成完整的冻干品,复溶后清亮,无浑浊及沉淀。
2.1.2 液体移行速度液体移行速度应不小于10mm/min。
2.2 线性2.2.1 PCT项目试剂盒项目PCT线性在0.1ng/mL~50.0ng/mL范围内,线性相关系数|r|应≥0.990。
2.2.2 IL-6项目试剂盒项目IL-6线性在3.0pg/mL~4000.0pg/mL范围内,线性相关系数|r|应≥0.990。
2.3 准确性2.3.1 PCT项目测定回收率应在85%~115%范围内。
2.3.2 IL-6项目用IL-6国际标准品配制的准确性校准品或经标化的准确性校准品进行检测,其检测结果的相对偏差应在±15.0%范围内。
注:国家、省质量监督抽检和风险监测、第三方仲裁检验时应采用国家/国际标准品。
2.4 检出限试剂盒项目PCT检出限不高于0.05ng/mL,项目IL-6检出限不高于1.5pg/mL。
2.5 重复性试剂盒项目PCT和IL-6每个项目的重复性变异系数(CV)不高于10%。
2.6 批间差试剂盒项目PCT和IL-6每个项目的批间变异系数(CV)不高于15%。
降钙素原(PCT)测定试剂盒(胶体金免疫层析法)产品技术要求meikang

降钙素原(PCT)测定试剂盒(胶体金免疫层析法)适用范围:用于体外定量检测人血清中的降钙素原,与南京美宁康诚生物科技有限公司生产的Mokosensor-A300型胶体金免疫分析仪配套使用。
1.1 包装规格20人份/盒、100人份/盒。
1.2 主要组成成分由相应人份的检测卡组成,其中,检测卡:检测线包被来源于小鼠的降钙素原单克隆抗体A、质控线包被羊抗鼠IgG多克隆抗体、金标垫上固定胶体金标记来源于小鼠的降钙素原单克隆抗体B。
2.1外观2.1.1外观平整,材料附着牢固,内容齐全,包装标签应清晰;2.1.2膜条宽度为4mm±0.2mm;2.1.3液体移行速度应不低于10mm/min。
2.2 空白限不高于0.10μg/L。
2.3 线性2.3.1试剂盒线性范围为[0.10,100.00]μg/L,线性相关系数r不低于0.9900;2.3.2 [0.10,0.25]μg/L绝对偏差不超过±0.02μg/L,(0.25,100.00]μg/L 线性偏差在±10%范围内。
2.4重复性检测高、低两个浓度的样本,变异系数(CV)应不大于10% 。
2.5准确度回收率在85%~115%。
2.6分析特异性检测浓度为100.00μg/L超敏C反应蛋白中降钙素原的浓度,计算交叉反应率,应小于10%。
2.7批间差检测一个高浓度的样本,相对极差应在±10%范围内。
2.8稳定性:常温(10℃~30℃)保存,有效期12个月,有效期末分别检测2.2~2.5项,其结果应符合各项要求。
2.9 校准品溯源性试剂盒校准信息所用校准品按照GB/T 21415-2008 《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,溯源到本公司工作校准品,工作校准品通过已上市产品试剂盒比对赋值。
降钙素原(PCT)测定试剂盒(荧光免疫层析法)产品技术要求puenguangde

降钙素原(PCT)测定试剂盒(荧光免疫层析法)
适用范围:用于体外定量测定人血清、血浆或全血中降钙素原(PCT)含量。
1.1包装规格
10人份/盒,25人份/盒,50人份/盒。
1.2主要组成成分
试剂盒由PCT荧光免疫层析检测卡、PCT样品稀释液(F)、PCT校准卡组成,各组分及数量见表1。
表1:试剂盒组成成分
2.1外观
外包装盒应完整,无破损;单包铝箔袋应完整,无破损,保持密封包装;液体组分应澄清透明,无沉淀、无渗漏。
2.2物理性状
2.2.1 试纸条的宽度:应不超于(
3.40±0.10)mm 。
2.2.2 液体移行速度:应不低于5mm/min。
2.3空白检出限
空白检出限浓度应不高于0.05ng/ml。
2.4线性范围
在[0.05,40]ng/ml范围内线性相关系数r≥0.990。
2.5精密度
2.5.1 重复性
变异系数CV不超于15%。
2.5.2 批间差
变异系数CV不超于20%。
2.6准确度
回收率应在85%~115%之间。
2.7分析特异性
测试按表2规定浓度范围的降钙素、白介素-6、C反应蛋白的样品,检测结果应不超过0.1ng/ml。
表2:交叉反应物及浓度列表
2.8效期稳定性试验
试剂盒2℃~30℃保存,铝箔袋密封状态下存放,取有效期满后两个月内的产品进行检测,结果应符合2.2、2.3、2.4、2.5.1、2.6项要求。
降钙素原测定试剂盒(荧光免疫层析法)产品技术要求普迈德

降钙素原测定试剂盒(荧光免疫层析法)适用范围:本产品用于体外定量测定全血、血清或血浆中降钙素原(PCT)含量。
1.1包装规格10人份/盒、20人份/盒、50人份/盒。
1.2主要组成成分每盒含10/20/50人份的试纸条、样品缓冲液(主要成分:0.01 mol/L的PBS缓冲液,pH:7.4±0.2,装量:至少2mL×1支/3mL×1支/6mL×1支)和标曲信息卡。
每人份的试纸条含1份检测卡、1套取样滴管(选配)、1支离心管(选配)和1包干燥剂。
检测卡由样品垫、硝酸纤维素膜(T线包被鼠抗降钙素原单克隆抗体;C线包被羊抗鼠多克隆抗体)、荧光垫(包被荧光标记的鼠抗降钙素原单克隆抗体)、吸水纸、塑料载板组成。
2.1物理性状2.1.1外观测定试剂应整洁完整、无毛刺、无破损、无污染;材料附着牢固;标签字迹清晰,无破损。
2.1.2膜条宽度测定试剂的膜条宽度≥2.5mm。
2.1.3液体移行速度液体移行速度应不低于10 mm/min。
2.2空白限空白限应不高于0.2ng/mL。
2.3重复性分别检测低、中2个浓度的样本,变异系数(CV)应不高于15.0%。
2.4批间差用3个批号试剂分别检测低、中浓度的样本,变异系数(CV)应不高于15.0%。
2.5线性在[0.2,40]ng/mL的范围内,线性相关系数应不低于0.990。
2.6准确度回收率应在85%~115%之间。
2.7分析特异性含浓度为35mg/mL白蛋白的零浓度PCT样本,检测结果不高于0.2ng/mL。
2.8稳定性将测定试剂在4℃~30℃的环境中放置18个月后,取样分别检测2.1.3、2.2、2.3、2.5、2.6、2.7项,结果应符合各项目的要求。
2.9溯源性按照GB/T 21415-2008及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,校准曲线信息溯源至公司内部工作校准品。
降钙素原测定试剂盒(荧光免疫层析法)产品技术要求乐普

降钙素原测定试剂盒(荧光免疫层析法)产品技术要求乐普降钙素原测定试剂盒(荧光免疫层析法)适用范围:该产品用于体外测定全血/血清/血浆中降钙素原的含量。
1.产品规格及其划分说明1.1规格卡型1人份、10人份/盒、20人份/盒、50人份/盒。
1.2组成每盒含1/10/20/50 人份检测卡、1 份批号卡和1/10/20/50 人份样品缓冲液。
其中:每人份检测卡包括1 份降钙素原检测卡和1 包干燥剂。
降钙素原检测卡由样品垫、硝酸纤维素膜(T 线包被鼠抗人降钙素原单克隆抗体;C 线包被羊抗鼠抗体)、荧光垫(含有荧光标记的鼠抗人降钙素原单克隆抗体)、吸水纸、塑料载板组成。
样品缓冲液每支装定量为150ul/支,由0.1%的表面活性剂和0.1mol/L的Tris (pH7.0)溶液组成。
2. 性能指标2.1物理性状2.1.1膜条外观检测卡应整洁完整、无毛刺、无破损、无污染;材料附着牢固;标签字迹清晰,无破损。
2.1.2 膜条宽度检测卡的膜条宽度≥2.5mm。
2.1.3液体移行速度液体移行速度应不低于10mm/min。
2.1.4样品缓冲液样品缓冲液体积应不少于标示值,pH值6.5~8.0 。
2.2空白限空白限应不高于0.5ng/mL。
2.3重复性CV(%)应不高于15.0%。
2.4批间差CV(%)应不高于15.0%。
2.5线性在【0.5,50】ng/ml的范围内,用线性拟合公式拟合,剂量-反应曲线相关系数应不低于0.990。
2.6准确度样本回收率应在85%~115%范围内。
2.7分析特异性检测浓度为100ng/mL的抗钙素、35mg/mL的白蛋白,检测结果应小于0.5ng/mL。
2.8稳定性将检测试剂盒在2℃~8℃的环境中放置18个月后,分别检测2.1、2.2、2.3、2.5、2.6、2.7项,结果应符合各项目的要求。
骨钙素N端中分子片段检测试剂盒(酶联免疫法)说明书

14.洗板机要经常保养,以免试验中由于机械问题导致 试验失败或交叉污染。 15.所有试剂和实验室设备应按传染性物品处理和丢弃。
注意事项:由于不同的实验方法和试剂在识别位点、特
异性及干扰因素等诸方面不尽相同,因此对于某一特定
样本,其测定结果也存在一定差异;所以实验室在向临
床医生提供检测结果的同时也必须包括相应的实验方
如果离失效期不足 8 周,则以有效期为准。 复溶后校准品和质控品应在–18°C 以下保存不超
过 3 个月,且只能冻融两次。当抗体试剂混合后,剩余 混合物应存放在 2-8°C 且不超过 1 个月,或在–18°C 以下冰冻保存。
浓缩洗液在稀释后室温放置可稳定 2 天,在 2~8 ℃保存可稳定 8 周,如果离失效期不足 8 周,则以有效 期为准。
软件 2. 试剂准备
1) 试剂盒内所有组分和样本平衡至室温(18-22 ℃);酶标板铝箔袋每次使用前也需平衡至室 温,以免在酶标板上凝集水珠,从而影响实验 结果。在取出所需的板条后,余下的须尽快放 回铝箔袋,封口后置于 2-8℃保存。
2) 校准品 0 用 5mL 蒸馏水复溶,校准品 1-5 和质 控品各用 0.5mL 蒸馏水复溶。复溶 15 分钟。
骨钙素n端中分子片段检测试剂盒酶联免疫法说明书酶联免疫试剂盒说明书酶免试剂盒说明书小片段dna回收试剂盒酶联免疫试剂盒降钙素原检测试剂盒碱性磷酸酶试剂盒碱性磷酸酶染色试剂盒胃蛋白酶原试剂盒胃蛋白酶检测试剂盒
骨钙素N端中分子片段检测试剂盒(酶联免疫法)说明书
【产品名称】 通用名称:骨钙素 N 端中分子片段检测试剂盒(酶 联免疫法) 英文名称:N-MID Osteocalcin ELISA
良好实验室管理规范(GLP)要求在每轮实验中使 用质控品以检测实验操作质量。质控品应以待测样本对
甲状旁腺激素(PTH)测定试剂盒(荧光免疫层析法)产品技术要求 (3)

甲状旁腺激素(PTH)测定试剂盒(荧光免疫层析法)产品技
术要求
甲状旁腺激素(PTH)测定试剂盒(荧光免疫层析法)的产品技术要求如下:
1. 试剂盒应符合相应的国家或行业标准,如ISO 9001质量管理体系认证等。
2. 试剂盒应具有良好的稳定性和可重复性,能够保证测试
结果的准确性和可靠性。
3. 试剂盒应适用于临床实验室常规设备,如生化分析仪、
荧光免疫分析仪等。
4. 试剂盒应包含所有必要的试剂和材料,如测试用标准品、样本稀释液、质控品等。
5. 试剂盒应提供详细的操作说明书,包括样本制备、试剂配置、试剂盒使用步骤等。
6. 试剂盒应具备良好的灵敏度和特异性,能够检测出PTH 的低浓度和排除其他干扰物的影响。
7. 试剂盒应提供合理的保存条件和有效期,以确保试剂和材料的质量不受损坏。
8. 试剂盒应有完善的质量控制措施和标准化程序,以确保每次测试结果的准确性和可比性。
9. 试剂盒的包装应符合国家或行业标准,以确保产品在运输和储存过程中的安全和完整性。
10. 试剂盒的质量系统应具有完善的售后服务和技术支持,以满足用户的需求和问题解决。
以上是甲状旁腺激素(PTH)测定试剂盒(荧光免疫层析法)产品技术要求的一些基本方面,具体要求可能会根据不同的生产厂商和产品而有所差异。
购买时,建议用户仔细阅读产品说明书,并与厂商进行沟通,以确保所选产品符合实验室的需求和要求。
降钙素原测定试剂盒(荧光免疫层析法)产品技术要求万泰

降钙素原测定试剂盒(荧光免疫层析法)适用范围:本试剂盒与厦门万泰沧海的免疫荧光定量检测仪配套使用,用于体外定量测定人血清或血浆中降钙素原(PCT)的含量。
1.1 包装规格:10人份/盒,50人份/盒1.2 主要组成成分检测卡:附着荧光标记鼠抗人PCT单克隆抗体的玻璃纤维、包被有鼠抗人PCT 单克隆抗体的硝酸纤维素膜、玻璃纤维、塑料背衬。
样本稀释液:0.05M pH9.6碳酸盐缓冲液。
定标代码:贮存有试剂盒批号及对应定标曲线信息。
2.1 外观外包装完整、无破损;液体试剂无杂质、无絮状物、无渗漏,标签应清晰,易识别。
2.2 膜条宽度应不小于2.5mm。
2.3 液体移行速度液体移行速度应不低于10mm/min。
2.4 净含量液体组分的净含量与标示值相对偏差不超过±10%。
2.5 线性范围在线性范围[0.05,20]ng/mL内,线性相关系数r应不低于0.9900;[0.05,4]ng/mL浓度线性绝对偏差不超过±0.6ng/mL;(4,20]ng/mL浓度线性相对偏差应不超过±15%。
2.6 定量限检测0.05ng/mL定量限参考品,变异系数(CV,%)应均不超过20%。
2.7 准确度试剂盒回收率在80%~120%范围内。
2.8 重复性检测低、高两个浓度重复性参考品CV1和CV2,变异系数(CV,%)应均不超过15%。
2.9 批间差用3个批号试剂盒检测低、高两个浓度重复性参考品CV1和CV2,其结果相对偏差(R)应均不超过±15%。
2.10 稳定性效期稳定性:取2℃~30℃干燥处保存18个月以上的留样试剂盒,检测2.1~2.8,2.11项,结果应符合各项目规定的要求。
2.11 特异性检测特异性参考品T1~T4,结果应均<0.5ng/mL。
其中T1为(30±5)ng/mL的降钙激素,T2为(10±2)ng/mL的降钙素,T3为(10±2)μg/mL的CGRPα,T4为(10±2)μg/mL的CGRPβ。
降钙素原(PCT)测定试剂盒(荧光免疫层析法)产品技术要求sz

批间变异系数(CV)应≤15%。
2.6准确度
回收率应在 85%~115%范围内。
1
2.1.3膜条宽度
膜条宽度为 4.00±0.40mm。
2.1.4液体移行速度
液体移行速度应不低于 25mm/min。
2.2线性范围
试剂的线性范围为0.2ng/ml~60ng/ml,在此线性范围内:线性相关系数r应不小于0.990。
2.3检测限
检测限应不大于 0.2ng/ml。
2.4批内精密度
变异系数(CV)应≤15%。
产品适用范围/预期用途
本试剂盒用于体外定量测定人血清、血浆和全血样本中降钙素原(PCT)的含量。临床上主要用于细菌感染性疾病的辅助诊断。
2,材料附着牢固;
样本稀释液为无色透明液体,无悬浮物及沉淀物。
2.1.2样本稀释液净含量
样本稀释液净含量偏差不大于标示量的±10%。
产品名称
降钙素原(PCT)测定试剂盒(荧光免疫层析法)
型号、规格
20人份/盒, 40人份/盒,60人份/盒
结构及组成
试剂盒由检测卡、稀释液和ID卡组成;检测卡主要组成成分有硝酸纤维素膜,玻璃纤维素膜,吸水纸,PVC板,红细胞抗体(RBC);其中硝酸纤维素膜在特定的位置上包被有PCT单克隆抗体和兔IgG,玻璃纤维素膜上喷有荧光微球标记的PCT单克隆抗体和兔IgG抗体。稀释液组分:PB缓冲液;Proclin300。ID卡包含校准曲线和批号。
人(Human)骨钙素(BGP)ELISA试剂盒说明书

上海笃玛生物科技有限公司本试剂盒只能用于科学研究,不得用于医学诊断人(Human)骨钙素(BGP/OCN )ELISA 检测试剂盒使用说明书检测原理试剂盒采用双抗体一步夹心法酶联免疫吸附试验(ELISA)。
往预先包被骨钙素(BGP/OCN )抗体的包被微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育并彻底洗涤。
用底物TMB显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的骨钙素(BGP/OCN )呈正相关。
用酶标仪在450nm 波长下测定吸光度(OD 值),计算样品浓度。
样品收集、处理及保存方法1.血清:使用不含热原和内毒素的试管,操作过程中避免任何细胞刺激,收集血液后,3000转离心10分钟将血清和红细胞迅速小心地分离。
2.血浆:EDTA、柠檬酸盐或肝素抗凝。
3000转离心30分钟取上清。
3.细胞上清液:3000转离心10分钟去除颗粒和聚合物。
4.组织匀浆:将组织加入适量生理盐水捣碎。
3000转离心10分钟取上清。
5.保存:如果样本收集后不及时检测,请按一次用量分装,冻存于-20℃,避免反复冻融,在室温下解冻并确保样品均匀地充分解冻。
自备物品1.酶标仪(450nm)2.高精度加样器及枪头:0.5-10uL、2-20uL、20-200uL、200-1000uL3.37℃恒温箱操作注意事项1.试剂盒保存在2-8℃,使用前室温平衡20分钟。
从冰箱取出的浓缩洗涤液会有结晶,这属于正常现象,水浴加热使结晶完全溶解后再使用。
2.实验中不用的板条应立即放回自封袋中,密封(低温干燥)保存。
3.浓度为0的S0号标准品即可视为阴性对照或者空白;按照说明书操作时样本已经稀释5倍,最终结果乘以5才是样本实际浓度。
4.严格按照说明书中标明的时间、加液量及顺序进行温育操作。
5.所有液体组分使用前充分摇匀。
试剂盒组成上海笃玛生物科技有限公司名称96孔配置48孔配置备注微孔酶标板12孔×8条12孔×4条无标准品0.3mL*6管0.3mL*6管无样本稀释液6mL 3mL 无检测抗体-HRP 10mL 5mL 无20×洗涤缓冲液25mL 15mL 按说明书进行稀释底物A 6mL 3mL 无底物B 6mL 3mL 无终止液6mL 3mL 无封板膜2张2张无说明书1份1份无自封袋1个1个无注:标准品(S0-S5)浓度依次为:0、0.5、1、2、4、8ng/mL试剂的准备20×洗涤缓冲液的稀释:蒸馏水按1:20稀释,即1份的20×洗涤缓冲液加19份的蒸馏水。
骨钙素测定试剂盒(磁微粒化学发光法)产品技术要求利德曼生化
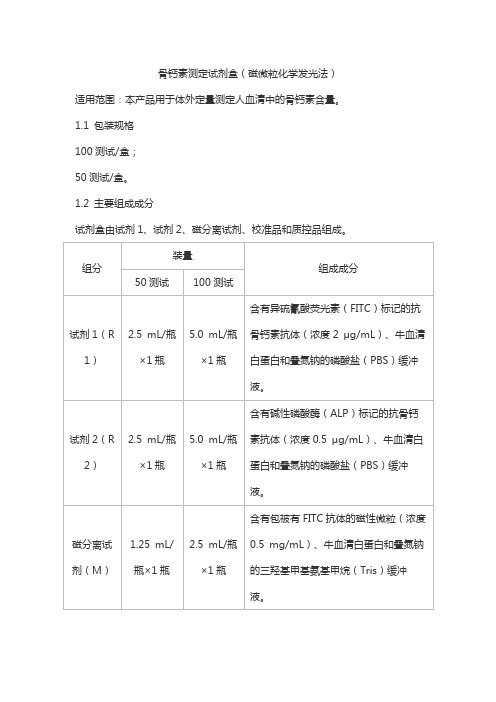
骨钙素测定试剂盒(磁微粒化学发光法)适用范围:本产品用于体外定量测定人血清中的骨钙素含量。
1.1 包装规格100测试/盒;50测试/盒。
1.2 主要组成成分试剂盒由试剂1、试剂2、磁分离试剂、校准品和质控品组成。
注:校准品和质控品浓度具有批特异性,具体数值见瓶标签。
2.1外观2.1.1试剂盒各组分应齐全、完整、液体无渗漏;2.1.2磁分离试剂摇匀后为均匀悬浊液,无明显凝集;2.1.3液体组分应无沉淀或絮状物;2.1.4包装标签应清晰,易识别。
2.2准确度回收率应在85.0%-115.0%范围内。
2.3空白限应不大于0.30 ng/mL。
2.4线性在[0.50,300.00]ng/mL的测量范围内,试剂盒的相关系数r应≥0.9900。
2.5重复性用(10.00±2.00)ng/mL和(100.00±20.00)ng/mL的样本各重复检测10次,变异系数(CV)应不大于10.0%。
2.6批间差用三个批号的试剂盒分别检测(10.00±2.00)ng/mL和(100.00±20.00)ng/mL的样本,其批间变异系数应≤15%。
2.7质控品的赋值有效性质控品的测量值应在质控范围内。
2.8 分析特异性测定浓度为5000pg/mL的甲状旁腺素(iPTH)样本,测定结果≤0.5ng/mL。
2.9 稳定性试剂盒2℃~8℃保存有效期为12个月,在有效期满后检测试剂盒的准确度、空白限、线性、重复性、质控品的赋值有效性,应符合2.2、2.3、2.4、2.5、2.7的要求。
2.10溯源性根据GB/T 21415及有关规定提供校准品的来源、赋值过程以及不确定度等内容,骨钙素校准品溯源至企业校准品,企业校准品已与上市产品比对赋值。
荧光免疫层析分析仪产品技术要求华科泰

荧光免疫层析分析仪适用范围:与本公司生产的荧光免疫层析检测卡配套使用,用于体外定量检测人样本中抗原/抗体含量。
1.1产品型号1.2 组成荧光免疫层析分析仪由光源及光路分配模块、光电转换模块、USB模块、人机互换模块以及电源线组成。
1.3不同型号差异2.1正常工作条件.电源 220V~,50Hz;.环境温度 5℃~40℃;.相对湿度 10%~85%;.大气压力 86.0kPa~106.0kPa;.远离强电磁场干扰源;.避免强光直接照射;.具有良好的接地环境。
2.2准确度检测中国食品药品检定研究院提供的铁蛋白标准品(150540),相对偏差应在±15%以内。
2.3 重复性使用本公司生产的铁蛋白(Fer)检测卡(荧光免疫层析法)测试样本,批内测量重复性(CV)≤20%。
2.4稳定性分析仪开机处于稳定工作状态后第4h、第6h的测试结果与处于稳定工作状态初始时的测试结果的相对偏差应在±10%以内。
2.5 线性范围稀释成在本公司生产的铁蛋白(Fer)检测卡(荧光免疫层析法)线性范围内的5个系列浓度,浓度为0、10、40、100、250、500ng/mL,线性相关系数(r)≥0.950。
2.6 外观:应满足如下要求:a) 外观整洁,无裂缝或划痕,无毛刺等缺陷,文字和标识清晰;b)仪器运动部件应平稳,不应卡住突跳;c) 紧固件连接应牢固可靠,不得有松动。
2.7功能2.7.1设置/设定功能:2.7.1.1 标准测试界面:应能对患者姓名、年龄、性别、检测类型、检测项目进行设定。
Savant-300还应能进行“加条”和“清条”设置。
2.7.1.2结果查询界面:应能够设定查询时间范围、编号、以及姓名信息;应能选定查询结果、删除查询结果、打印测试结果、将结果导出为Excel。
2.7.1.3系统设置界面:应能够设定时间、单位名称、操作者信息,选定需要清除的数据时间范围。
2.7.1.4项目查看界面:应能够删除选定的项目信息。
钙测定试剂盒(邻甲酚酞络合酮法)1产品技术要求zhongshengbeikong

钙测定试剂盒(邻甲酚酞络合酮法)适用范围:本产品用于体外定量测定人血清中钙的浓度。
1.1包装规格液体双剂型(液体Ⅰ型)试剂1(R1):60mL×4,试剂2(R2):60mL×41.2主要组成成分1.2.1 试剂1(R1)(液体)乙醇胺 100mmol/L1.2.2 试剂2(R2)(液体)邻甲酚酞络合酮(OCPC)0.175mmol/L8-羟基喹啉 7.8mmol/L2.1 外观试剂盒中各组件的外观应满足:2.1.1 试剂1(R1)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损;2.1.2 试剂2(R2)应为浅黄色透明溶液,无杂质、无絮状物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度在波长600nm(光径1cm)处,试剂空白吸光度(A)应≤0.300。
2.4 准确度测定锂、钠、钾、镁、钙、氯复合电解质冰冻人血清国家标准品(编号:360018),相对偏差应不超过±5%。
2.5 分析灵敏度对应于浓度为2.5mmol/L (10mg/dL)的Ca所引起的吸光度差值(△A)的绝对值应在0.200~0.500的范围内。
2.6 重复性重复测试同一样本,变异系数(CV)应≤3%。
2.7 批间差测定同一样本,批间差(R)应≤5%。
2.8 线性范围在[0.60,3.75]mmol/L范围内,线性相关系数(r)应≥0.990;线性相对偏差应不超过±10%。
2.9 试剂稳定性2.9.1 效期稳定性:原包装的试剂盒在2℃~8℃避光贮存,有效期为24个月。
试剂有效期满后3个月以内,试剂性能应符合2.1、2.3、2.4、2.5、2.6、2.8的要求。
2.9.2 开盖稳定性:开盖后,在2℃~8℃避光保存,稳定期为12天;稳定期满后3天内,试剂性能应符合2.1、2.3、2.4、2.5、2.6、2.8的要求。
降钙素原(PCT)测定试剂盒(荧光免疫层析法)产品技术要求性能指标创艺

医疗器械产品技术要求编号:降钙素原(PCT)测定试剂盒(荧光免疫层析法)2 性能指标2.1 试剂盒性能指标2.1.1 外观试剂盒外观应整洁,文字符号标识清晰、准确、牢固;检测卡整体应牢固,内部试纸条应表面平整、无缺角、无明显划痕、无污染物等明显可见缺陷;样品稀释液为无色透明液体。
2.1.2 净含量应符合表2的要求。
表2 净含量要求组分允许范围样品稀释液0.091±0.005mL2.1.3 试纸条宽度检测卡内部试纸条宽度应为4.0mm±0.1mm。
2.1.4 液体移行速度液体移行速度应不低于10mm/min。
2.1.5 空白限空白限应小于0.01ng/mL。
2.1.6 精密度2.1.6.1 重复性用两个不同浓度水平的质控品对同一批号试剂盒进行重复检测10次,其变异系数(CV)应不大于15%。
2.1.6.2 批间差用两个不同浓度水平的质控品对三个批号试剂盒各重复检测10次,其批间变异系数(CV)应不大于20%。
2.1.7 线性范围测试血浆/血清样本,线性范围在0.02ng/mL~80.00 ng/mL,线性相关系数(r)应不小于0.990;测试全血样本,线性范围在0.04ng/mL~100.00 ng/mL,线性相关系数(r)应不小于0.990。
2.1.8 准确度检测2个不同浓度水平的内部校准品,其相对偏差(B)应不超过±15%。
2.2 质控品性能指标2.2.1 外观质控品外观应整洁,封盖应紧密,文字符号标识清晰、准确、牢固;质控品为冻干粉,冻干粉复溶后应为澄清透明液体。
2.2.2 装量质控品冻干粉的实际瓶装量应不少于标识瓶装量的95%,每个水平的标示装量为0.036g (0.5mL)。
2.2.3 准确度取同一批号3个水平的降钙素原(PCT)质控品作为样本进行检测,复溶后测得的复溶液检测结果应符合该批质控品包装盒内靶值表上的要求。
2.2.4 均一性2.2.4.1 瓶内均一性:CV ≤15%。
降钙素原(PCT)测定试剂盒(荧光免疫层析法)产品技术要求普菲

降钙素原(P C T)测定试剂盒(荧光免疫层析法)产品技术要求普菲本页仅作为文档封面,使用时可以删除This document is for reference only-rar21year.March降钙素原(PCT)测定试剂盒(荧光免疫层析法)结构组成:预期用途:用于体外定量测定人血清、血浆样本中降钙素原的含量。
2.1.物理性状2.1.1.外观试剂卡外观平整,材料附着牢固;样本稀释液为无色透明液体,无悬浮物及沉淀物;2.1.2.净含量样本稀释液净含量应在标示值的90%~110%之间。
2.1.3.膜条宽度膜条宽度应不小于3.9mm。
2.1.4.液体移行速度液体移行速度应不低于25mm/min。
2.2.空白限空白限≤0.1ng/mL。
2.3 .线性范围试剂的线性范围为 [0.1,60] ng/mL,在此线性范围内,线性相关系数r应不小于0.990。
2.4.测量精密度2.4.1.重复性用质控品重复测试,所得结果的变异系数(CV)≤15%;2.4.2.批间差用质控品重复测试3个批号的试剂盒,所得结果的变异系数(CV)≤15%。
2.5.准确度回收率在85%~115%之间。
2.6 .稳定性试剂在4℃~30℃密封避光保存,原包装存放的试剂有效期为12个月;取效期末的样品检测外观、膜条宽度、液体移行速度、空白限、线性范围、重复性、准确度,应分别符合2.1.1、2.1.3、2.1.4、2.2、2.3、2.4.1、2.5的要求。
2.7.溯源性根据GB/T21415-2008的要求,本产品标准曲线可溯源至企业工作校准品。
降钙素原测定试剂盒(荧光免疫层析法)-产品技术要求性能指标部分

医疗器械产品技术要求编号:降钙素原测定试剂盒(荧光免疫层析法)2. 性能指标2.1 外观2.1.1试剂盒外观应整洁,文字符号标识清晰,封装无破损,内容物齐全。
2.1.2检测卡的外观应符合下列要求:外观平整、色泽均匀、边缘无毛刺,不能有色斑或污渍。
2.1.3稀释液应澄清透明、无沉淀、无悬浮物、无絮状物、无渗漏。
2.1.4检测卡内的膜条要求:宽度为4.0±0.5 mm,长度为67±2 mm。
2.2净含量稀释液瓶装量应≥100μl。
2.3 物理检测样本在检测卡上的移行速度应≥10mm/min。
2.4 准确度分别测定高、中、低三个浓度的PCT企业内部参考品,相对偏差不超过±10%。
2.5检出限检出限应不大于0.1ng/ml2.6线性范围在线性范围[0.1~100]ng/ml内,a)试剂盒检测结果的线性相关系数r≥0.990;b)在[0.1~3]ng/ml区间内测定的线性绝对偏差不超过±0.3ng/ml,在(3~100]ng/ml区间内测定的线性相对偏差应不超过±10%。
2.7批内差用同一批次试剂盒测定低、中两个浓度的参考品,要求批内变异系数CV≤10%。
2.8批间差使用3个不同批号的试剂盒测定低、中两个浓度的参考品,要求批间变异系数CV≤15%。
2.9 质控品2.9.1质控品装量质控品装量符合表1要求。
表1 质控品装量要求2.9.2赋值有效性测定值在质控靶值范围内。
2.9.3瓶内均一性瓶内C V≤10%。
2.9.4瓶间均一性瓶间C V≤15%。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
骨钙素测定试剂盒(荧光免疫层析法)
结构组成:
预期用途:该产品用于体外定量检测人血清、血浆或全血中骨钙素(BGP)的含量。
2.1 外观
试剂盒外观应整洁, 文字符号标识清晰,液体无渗漏,测试卡完整无破损,质控品为冻干疏松体,复溶后为无色至淡黄色液体。
2.2装量
与理论装量偏差不超过±10%。
2.3检出限
应不高于2ng/mL。
2.4线性范围
在[2,150] ng/mL内,相关系数R≥0.990。
2.5 重复性
重复测试(20±4)ng/mL和(50±10)ng/mL的样本,所得结果的变异系数(CV)应不大于15%。
2.6批间差
测试(20±4)ng/mL和(50±10)ng/mL的样本,批间相对极差(R)应不大于15%。
2.7准确度
回收率应在85~115%范围内。
2.8质控品
2.8.1预期结果
试剂盒内的质控品,检测结果均在质控范围内。
2.8.2均匀性
瓶间差≤15%。
2.8.3复溶稳定性
质控品复溶后在2℃~8℃密封避光保存24h。
检测复溶后的质控品,检测结果均在质控范围内。
2.9 效期稳定性
试剂有效期为18个月。
取到效期后3个月内试剂盒进行检测,测定结果应符合2.3、2.4、2.5、2.7、2.8项要求。
2.10溯源性
根据GB/T21415-2008的要求,校准曲线可溯源至企业工作校准品,企业工作校准品与已上市骨钙素测定试剂盒进行对比赋值。
