盐酸滴定液(0.5)改07.5.30
2015版滴定液配制、标定实用标准操作规程

制药企业用滴定液的配制及标定标准操作规程1.目的建立滴定液的配制及标定标准操作规程,并按规程进行操作,保证操作规范性与正确性。
2. 依据《中华人民共和国药典》2015年版四部通则8006。
3.范围本标准适用于本公司滴定液的配制及标定。
4.责任配制者、标定者、复核者、QC主任监督5. 内容5.1 概述滴定液系指在容量分析中用于滴定被测物质含量的标准溶液,具有准确的浓度(通常取4 位有效数字)。
5.2 仪器与用具分析天平其分度值(感量)应为0.l m g或小于0.lmg;毫克组砝码需经校正,并列有校正表备用。
滴定管 10、25和50 ml 应附有该滴定管的校正曲线或校正值。
移液管 10、15、20和25 ml 其真实容量应经校准,并附有校正值。
5.3 试液试剂5.3.1 均应按照《中国药典》2015年版四部通则8006项下的规定取用。
5.3.2 基准试剂应有专人负责保管与领用。
5.4 配制滴定液的配制方法有间接配制法与直接配制法两种,应根据规定选用,并应遵循下列有关规定。
5.4.1所用溶剂“水”,系指蒸馏水或去离子水,在未注明有其他要求时,应符合《中国药典》“纯化水”项下的规定。
5.4.2采用间接配制法时,溶质与溶剂的取用量均应根据规定量进行称取或量取,并且制成后滴定液的浓度值应为其名义值的0.95~1.05;如在标定中发现其浓度值超出其名义值的0.95~1.05范围时,应加人适量的溶质或溶剂予以调整。
当配制量大于1000ml时,其溶质与溶剂的取用量均应按比例增加。
5.4.3采用直接配制法时,其溶质应采用“基准试剂”,并按规定条件干燥至恒重后称取,取用量应为精密称定(精确至 4 ~5 位有效数字),并置1000ml量瓶中,加溶剂溶解并稀释至刻度,摇匀。
配制过程中应有核对人,并在记录中签名以示负责。
5.4.4配制浓度等于或低于0.02 mol / L的滴定液时,除另有规定外,应于临用前精密量取浓度等于或大于0. l mol / L的滴定液适量,加新沸过的冷水或规定的溶剂定量稀释制成。
盐酸滴定液(0.02)改07.5.30

盐酸滴定液(0.02mol/L)配制与标定标准操作程序1.目的:建立盐酸滴定液(0.02mol/L)配制与标定的标准操作程序,保证正确操作。
2.适用范围:本标准规定了盐酸滴定液(0.02mol/L)配制与标定的方法和操作要求;适用于本公司质量控制室盐酸滴定液(0.02mol/L)的配制、标定与复标。
3.责任:配制、标化及复标检验员。
4.内容:4.1 误差要求:4.2试剂与试药:甲基红-溴甲酚绿混合指示液基准无水碳酸钠盐酸4.3试剂的配制:按《化学试剂配制标准操作程序》(SOP-H10-04)相关条款配制4.4仪器与设备:三角烧瓶(250ml) 酸式滴定管(50ml )茂福炉分析天平电热恒温干燥箱4.5 操作步骤:4.5.1 HCL=36.46 3.646g→1000ml4.5.2 配制:取盐酸9ml加水适量使成1000ml,摇匀。
4.5.3 标定:盐酸滴定液(0.1mol/L):取在270~300℃干燥至恒重的基准无水碳酸钠约0.15g精编码:SOP-H08-037-04 共 2 页第 2 页密称定,加50ml使溶解,加甲基红-溴甲酚绿混合指示液10滴,用本液滴定到溶液由绿色转变为紫红色时,煮沸2分钟,冷却至室温,继续滴定至溶液由绿色变为暗紫色。
每1ml盐酸滴定液(0.1mol/L)相当于5.30mg的无水碳酸钠。
根据本液的消耗量与无水碳酸钠的取用量,算出本液的浓度。
即得。
4.5.4用盐酸滴定液(0.02mol/L)时,可精密量取盐酸滴定液(0.1mol/L)200ml置1000ml容量瓶中,加新沸过的冷水稀释至刻度,摇匀。
4.5.5 计算公式:F= V ×m0.0053式中:m 为基准无水碳酸钠质量v 为本滴定液的消耗量(ml)4.5.6反应原理:以酸滴定液,滴定被测物质,以指示剂指示终点,根据消耗滴定液的浓度和毫升数,可计算出被测物的含量。
H++OH- H2O4.7注意事项:4.7.1配制中,盐酸的取用量如按药典的规定量取,则配制成的滴定液的F值常为1.05~1.10;因此,在加水稀释后,宜先与已知浓度的氢氧化钠滴定液作比较试验,求得其粗略浓度,再加水适量稀释,以调节其浓度使其F值为0.95~1.05,而后再进行标定。
盐酸滴定液的配制与标定

学习情境一药物检测前准备工作任务4 盐酸滴定液(0.1 mol/L)的配制与标定一、任务下达1.子任务子任务一:查阅药品质量标准,并根据要求准备好仪器、试药。
子任务二:根据质量标准和标准操作规程,进行盐酸滴定液(0.1 mol/L)的配制与标定操作。
子任务三:正确完成检验原始记录及检验报告。
3.任务目标通过本任务的教学和实施,预期达到以下目标。
(1)技能目标:能根据《中国药典》的要求配置滴定液;能正确标定滴定液。
(2)知识目标:掌握滴定液的配置与标定方法。
二、任务准备1.查找质量标准盐酸滴定液的配制与标定标准收载于《中国药典》2010年版二部附录181页。
【配制】盐酸滴定液(0.1 mol/L)取盐酸90ml,加水适量使成1000ml,摇匀。
盐酸滴定液(0.5 mol/L、0.2 mol/L或0.1 mol/L)照上法配制,但盐酸的使用量分别为45ml、18ml或9.0ml.【标定】盐酸滴定液(1 mol/L)取在270~300℃干燥至恒重的基准无水碳酸钠约1.5g,精密称定,加水50ml使溶解,加甲基红-溴甲酚绿混合指示液10滴,用本液滴定至溶液由绿色转变成紫红色时,煮沸2分钟,冷却至室温,继续滴定至溶液绿色变为暗紫色。
每1ml盐酸滴定液(1mol/L)相当于53.00mg的无水碳酸钠,根据本液的消耗量与无水碳酸钠的取用量算出本液的浓度,即得。
盐酸滴定液(0.1 mol/L)照上法标定,但基准无水碳酸钠的取用量改为约0.15g,每1ml盐酸滴定液(0.1mol/L)相当于5.30mg的无水碳酸钠。
2.准备仪器与试药(1)试验仪器:锥形瓶、万分之一电子天平、称量瓶、酸式滴定管、胶头滴管、洗瓶、电炉等。
(2)试药:浓盐酸1瓶、甲基红1瓶、溴甲酚绿1瓶、95%乙醇1瓶、基准用无水碳酸钠100g(若无可选用普通无水碳酸钠,用前300度干燥至恒重,然后用称量瓶分装好);大张滤纸5张、称量纸1包。
3.配制试液(1)甲基红-溴甲酚绿混合指示液:取0.1%甲基红的乙醇溶液20ml, 0.2%溴甲酚绿的乙醇溶液30ml,摇匀,即得。
盐酸滴定液配制标准操作规程

1.目的:建立本规程旨在为盐酸滴定液的配制、标定提供操作标准。
2.范围:本规程对本公司的中心化验室盐酸滴定液的配制,标定有效。
3.责任:中心化验室滴定液配制人、标定人。
4.检验依据:《中国药典》2015年版四部5.内容:分子式:HCl分子量:36.465.1 配制◆盐酸滴定液(1mol/L):取盐酸90ml,加水适量使成1000ml摇匀。
◆盐酸滴定液(0.5、0.2或0.1mol/L)照上法配制,但盐酸的取用量分别为45 ml、18 ml、或9.0ml。
5.2 标定◆盐酸滴定液(1mol/L):取在270-300℃干燥至恒重的基准无水碳酸钠约1.5 g,精密称定,加水50ml使溶解,加甲基红—溴甲酚绿混合指示液10滴,用本液滴定至溶液由绿色转变为紫红色时,煮沸2分钟,冷却至室温,继续滴定至溶液由绿色变为暗紫色。
每1ml的盐酸滴定液(1mol/L)相当于53.00mg的无水碳酸钠。
根据本液的消耗量与无水碳酸钠的取用量,算出本液的浓度,即得。
◆盐酸滴定液(0.5mol/L)照上法标定,但基准无水碳酸钠的取用量改为约0.8g。
每1ml的盐酸滴定液(0.5mol/L)相当于26.50 mg的无水碳酸钠。
◆盐酸滴定液(0.2mol/L)照上法标定,但基准无水碳酸钠的取用量改为0.3g。
每1ml的盐酸滴定液(0.2mol/L)相当于10.60 mg的无水碳酸钠。
◆盐酸滴定液(0.1mol/L)照上法标定,但基准无水碳酸钠的取用量改为约0.15g。
每1ml的盐酸滴定液(0.1mol/L)相当于5.30 mg的无水碳酸钠。
◆如需用盐酸滴定液(0.05mol/L、0.02mol/L、或0.01mol/L)时,可取盐酸滴定液(1mol/L或0.1mol/L)加水稀释制成。
必要时标定浓度。
5.3 原理Na2CO3+2HCl 2NaCl+CO2+H2O5.4 计算公式m×1000盐酸滴定液的浓度(mol/L):=V×T式中:m为基准无水碳酸钠的称取量(mg);v 为本滴定液的消耗量(ml);T为与每1ml的盐酸滴定液相当的无水碳酸钠的毫克数。
盐酸滴定液法定标准

盐酸滴定液法定标准
为了确保盐酸滴定液法的准确性和可靠性,必须制定严格的法定标准。
根据国家有关标准和规定,盐酸滴定液的法定标准应包括以下方面:
1. 盐酸滴定液的纯度要求,包括其酸度、杂质含量等指标。
2. 盐酸滴定液的浓度标准,一般以1mol/L为标准,但也可以根据不同实验需要制定不同的浓度标准。
3. 盐酸滴定液的制备和保存要求,包括制备方法、保存条件和有效期等。
4. 盐酸滴定液法的操作规程和注意事项,包括样品处理方法、滴定过程中的操作要点、记录要求等。
通过制定严格的盐酸滴定液法定标准,可以有效保证实验结果的准确性和可比性,为科学研究和生产应用提供可靠的数据支撑。
- 1 -。
HCL滴定液配制及标定操作规程
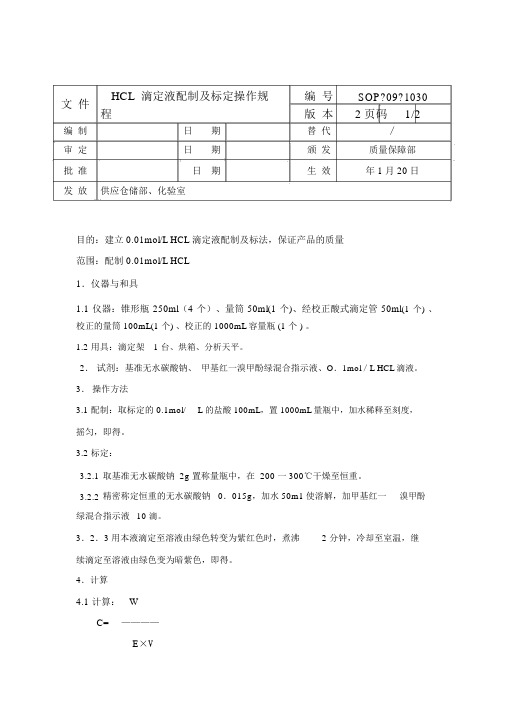
文件HCL 滴定液配制及标定操作规编号SOP?09?1030程版本2页码1/2编制日期替代∕审定日期颁发质量保障部批准日期生效年 1月 20日发放供应仓储部、化验室目的:建立 0.01mol/L HCL 滴定液配制及标法,保证产品的质量范围:配制 0.01mol/L HCL1.仪器与和具1.1 仪器:锥形瓶 250ml(4 个)、量筒 50ml(1 个)、经校正酸式滴定管 50ml(1个)、校正的量筒 100mL(1 个) 、校正的 1000mL容量瓶 (1 个 ) 。
1.2 用具:滴定架 1 台、烘箱、分析天平。
2.试剂:基准无水碳酸钠、甲基红一溴甲酚绿混合指示液、O.1mol/L HCL滴液。
3.操作方法3.1 配制:取标定的 0.1mol/L 的盐酸 100mL,置 1000mL量瓶中,加水稀释至刻度,摇匀,即得。
3.2 标定:3.2.1取基准无水碳酸钠 2g 置称量瓶中,在 200 一 300℃干燥至恒重。
3.2.2精密称定恒重的无水碳酸钠 0.015g,加水 50m1使溶解,加甲基红一溴甲酚绿混合指示液10 滴。
3.2.3 用本液滴定至溶液由绿色转变为紫红色时,煮沸 2 分钟,冷却至室温,继续滴定至溶液由绿色变为暗紫色,即得。
4.计算4.1 计算:WC=————E×V式中: C摩尔浓度; w 取样量; E 相当数: V 消耗毫升数。
5.1 配制时必须精暂量取。
5.2 标定时在相同条件下各作平行试验3 份,3 份平行试验结果的相对偏差,不得大于 0.1%,平均值计算,取 4 位有效数字。
5.3 标定时室温应在 (10 —30℃) 下进行,并应在记录中注明标定的室内温5.4 标定液存放和使用不得超过 3 个月,过期应重新标定。
5.5 当标定与使用时的室温相差超过10℃,应按 (3 .2) 的要求进行重新标定。
5.6 当滴定液出现浑浊或其他异常情况时,该滴定液应即弃去,不得再用。
盐酸滴定液配制与标定操作规程

盐酸滴定液配制与标定操作规程一、实验目的:掌握盐酸滴定液的配制与标定方法,提高实验操作的准确性和实验人员的安全意识。
二、实验仪器与药品:1.仪器:容量瓶、三角漏斗、滴定管、电子天平、计时器、酒精灯等。
2.药品:浓盐酸、去离子水、甲基橙指示剂。
三、实验操作过程:1.盐酸滴定液的配制:(1)称取适量浓盐酸,溶解于1000ml去离子水中,并转移到容量瓶中。
(2)用去离子水冲洗移液管,将水加入容量瓶中至刻度线,摇匀即为盐酸滴定液。
2.盐酸滴定液的标定:(1)准备标定溶液:用准确称量的标准稀钠碱溶液,转移至容量瓶中。
(2)加入几滴甲基橙指示剂,溶液变为橙黄色,摇匀。
(3)滴定操作:将盐酸滴定液装入滴定管中,加入较少量的盐酸滴定液,使溶液颜色由橙黄色变成粉红色。
(4)快速而轻柔地滴加盐酸滴定液,用滴定管的壁上的药液,渐渐溶解,并保持溶液颜色的变化。
(5)滴加盐酸滴定液至溶液颜色由粉红色变成橙黄色,记录滴定液的体积为V1四、实验注意事项:1.实验过程中要佩戴安全眼镜和实验手套,保证个人安全。
2.实验操作中要轻柔均匀地滴加盐酸滴定液,避免误差。
3.盐酸滴定液的配制要准确称取药品和水的质量,保证溶液浓度准确。
4.滴定时要注意滴定速度和滴定液的流动状态,避免过量滴定而造成滴定结果的不准确。
5.滴定前要进行预实验,熟悉滴定操作步骤和滴定液的变化规律,提高实验操作的准确性和信度。
五、实验数据处理与结果分析:1.计算盐酸滴定液的标定结果:滴定实验中记录滴定液的体积为V1,标定溶液的容积为V2C1=(V2/V1)×C2其中,C2为标定溶液的浓度。
2.对滴定结果进行误差分析,比较标定结果与预期结果,分析产生误差的原因,进一步提高实验操作的准确性。
六、实验安全与环保措施:1.实验过程中要戴上实验手套和安全眼镜,避免实验操作对身体和眼部造成伤害。
2.实验中产生的废液要妥善处理,避免对环境造成污染。
HCL滴定液配制及标定操作规程
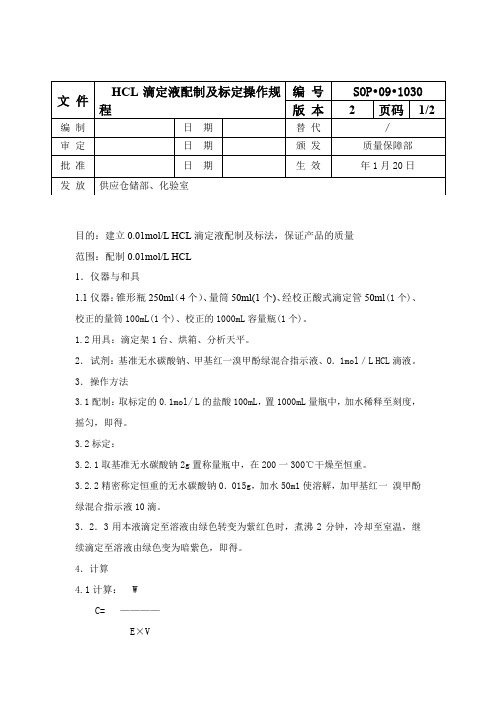
目的:建立0.01mol/L HCL滴定液配制及标法,保证产品的质量
范围:配制0.01mol/L HCL
1.仪器与和具
1.1仪器:锥形瓶250ml(4个)、量筒50ml(1个)、经校正酸式滴定管50ml(1个)、校正的量筒100mL(1个)、校正的1000mL容量瓶(1个)。
1.2用具:滴定架1台、烘箱、分析天平。
2.试剂:基准无水碳酸钠、甲基红一溴甲酚绿混合指示液、O.1mol/L HCL滴液。
3.操作方法
3.1配制:取标定的0.1mol/ L的盐酸100mL,置1000mL量瓶中,加水稀释至刻度,摇匀,即得。
3.2标定:
3.2.1取基准无水碳酸钠2g置称量瓶中,在200一300℃干燥至恒重。
3.2.2精密称定恒重的无水碳酸钠0.015g,加水50m1使溶解,加甲基红一溴甲酚绿混合指示液10滴。
3.2.3用本液滴定至溶液由绿色转变为紫红色时,煮沸2分钟,冷却至室温,继续滴定至溶液由绿色变为暗紫色,即得。
4.计算
4.1计算: W
C= ————
E×V
式中:C摩尔浓度;w取样量;E相当数:V消耗毫升数。
5.1配制时必须精暂量取。
5.2标定时在相同条件下各作平行试验3份,3份平行试验结果的相对偏差,不得大于0.1%,平均值计算,取4位有效数字。
5.3标定时室温应在(10—30℃)下进行,并应在记录中注明标定的室内温
5.4标定液存放和使用不得超过3个月,过期应重新标定。
5.5当标定与使用时的室温相差超过10℃,应按(3.2)的要求进行重新标定。
5.6当滴定液出现浑浊或其他异常情况时,该滴定液应即弃去,不得再用。
食品安全实验室滴定液的管理

食品安全实验室滴定液的管理
1 .为保持检验数据可靠,滴定液要定期标定,必须使用基准物质进行标定。
一般滴定液的有效期限规定为三个月。
到期的滴定液必须进行复标后,方可使用。
2 .配制滴定液时,应控制其实际浓度不超过标准浓度的±5%。
滴定液必须有专人配制,标定,并有第二人进行复标。
3 .滴定液在存放期间,要注意物理性状变化。
若有沉淀、变色等情况,应弃去,重新配制或根据具体情况处理后,再标定使用。
4 .标定和滴定所用的容曜器具均应经过校验,方可使用。
5 .配制及标定滴定液应在规定温度和湿度的环境中进行,若标定温度与使用温度相差过大(一般相差10。
C以上)时,应值新标定滴定液。
6 .移取滴定液应倾出后移取,不宜直接用移液管插入滴定液瓶内。
倾出后的滴定液,不能倒回滴定液瓶内。
移取放出液体时要直放,管壁外不可沾有液体。
7 .滴定液配制、标定必须有记录。
并经复标核对后方可使用。
标定的相对偏差不超过0.1%,复标和标定相对偏差不超过0.1%。
8 .滴定液的标签应注明:标定日期、品名、使用期限、标定者、复标者、标定浓度。
9 .对遇光变色的,不稳定的滴定液应厦于棕色瓶中存放,氢«1化钠存放于塑料桶内。
滴定液应在规定的温度、湿度环境中保存。
10 .滴定液可以从有资质的单位采购。
11 .购进的滴定液应登记在册,并按上述规定进行管理。
13.购进的滴定液按规定在三个月内使用,到期需进行复标。
但超过滴定液瓶上标注的有效期的,必须弃去,不得再使用。
0.5M盐酸滴定液标定
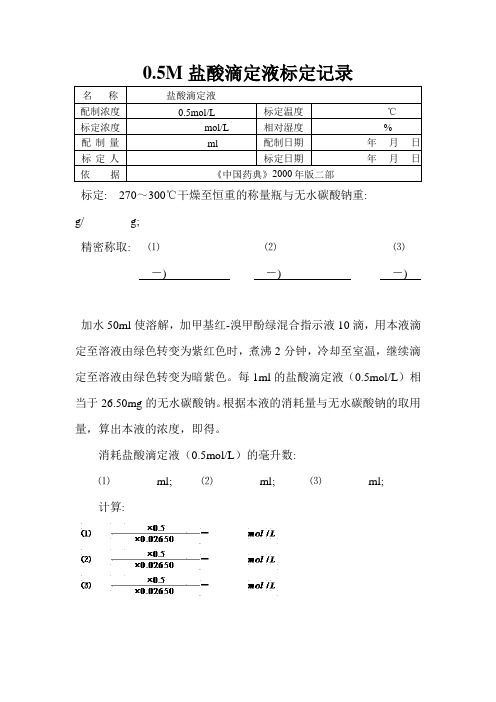
0.5M盐酸滴定液标定记录
标定: 270~300℃干燥至恒重的称量瓶与无水碳酸钠重:
g/ g;
精密称取: ⑴⑵⑶
-) -) -)
加水50ml使溶解,加甲基红-溴甲酚绿混合指示液10滴,用本液滴定至溶液由绿色转变为紫红色时,煮沸2分钟,冷却至室温,继续滴定至溶液由绿色转变为暗紫色。
每1ml的盐酸滴定液(0.5mol/L)相当于26.50mg的无水碳酸钠。
根据本液的消耗量与无水碳酸钠的取用量,算出本液的浓度,即得。
消耗盐酸滴定液(0.5mol/L)的毫升数:
⑴ml; ⑵ml; ⑶ml;
计算:
3分平行试验结果平均值: mol/L;
平行试验最大相对偏差:规定标定结果应
%。
标定结果。
标定人:。
盐酸滴定液配制和标定标准操作规程

目的:制订盐酸滴定液配制和标定的标准操作规程。
适用范围:盐酸滴定液(1、0.5、0.2或0.1 mol/L)的配制和标定。
责任:检验室人员按本规程操作,检验室主任监督本规程的实施。
规程:1.仪器及用具十万分之一分析天平、干燥箱、电炉、容量瓶、锥形瓶、刻度吸管、量筒、滴定管等。
2.试剂及试液盐酸、蒸馏水、基准无水碳酸钠、甲基红-溴甲酚绿混合指示液。
3.配制3.1盐酸滴定液(1 mol/L)取盐酸约90ml,加水适量使成1000ml,摇匀。
3.2盐酸滴定液(0.5 mol/L、0.2 mol/L或0.1 mol/L)照上法配制,但盐酸的取用量分别为45ml,18ml及9ml。
4.标定4.1盐酸滴定液(1 mol/L):取在270-300℃干燥至恒重的基准无水碳酸钠约1.5g,精密称定,加水50ml使溶解,加甲基红-溴甲酚绿混合指示液10滴,用本液滴定至溶液由绿色转变紫红色时,煮沸2分钟,冷却至室温,继续滴定至溶液由绿色变为暗紫色。
每1ml的盐酸滴定液(1mol/L)相当于53.00mg的无水碳酸钠的取用量,算出本液的浓度,即得。
4.2盐酸滴定液(0.5 mol/L):照上法标定,但基准无水碳酸钠的取用量改为0.8g。
每1ml的盐酸滴定液(0.5mol/L)相当于26.50mg的无水碳酸钠。
4.3盐酸滴定液(0.2 mol/L):照上法标定,但基准无水碳酸钠的取用量改为0.3g。
每1ml的盐酸滴定液(0.2 mol/L)相当于10.60mg的无水碳酸钠。
4.4盐酸滴定液(0.1 mol/L):照上法标定,但基准无水碳酸钠的取用量改为0.15g。
每1ml的盐酸滴定液(0.1 mol/L)相当于5.30mg的无水碳酸钠。
4.5如需用盐酸滴定液(0.05 mol/L、0.02 mol/L或0.01 mol/L)时,可取盐酸滴定液(1 mol/L 或0.1 mol/L ),加水稀释制成,必要时标定浓度。
5.结果计算:3232/CO Na HCl CO Na HCl T V W F ⨯=式中:F 表示滴定液的校正因子。
滴定液(标准液)配制、标定、使用管理规程

滴定液(标准液)配制、标定、使⽤管理规程⼀、⽬的:建⽴滴定液(标准液)管理制度,以规范其配制、标定、使⽤分发和贮存管理。
⼆、适⽤范围:适⽤于质检中⼼所有滴定液、标准液。
三、责任者:质检中⼼全体⼈员。
四、内容:1、术语1.1 滴定液:指在容量分析中⽤于滴定被测物质含量的标准溶液,具有准确的浓度(取4位有效数字)。
滴定液的浓度以“mol/L”表⽰,其基本单位应根据药典或GB 标准规定。
1.2 F值:滴定液的浓度值与其名义值之⽐,称为“F”值,常⽤于容量分析中的计算。
1.3 标定:系指根据规定的⽅法,⽤基准物质或已标定的滴定液准确测定滴定液浓度(mol/L)的操作过程。
2、滴定液配制仪器与⽤具:2.1 分析天平其分度值应为0.1mg;毫克组砝码需经校正,并列有校正表备⽤。
2.2 10、25和50ml滴定管应附有该滴定管的校正值。
2.3 10、15、20和25ml移液管其真实容量应经校准,并附有校正值。
2.4 250ml、500ml、1000ml量瓶应符合国家A级标准,或附有校正值。
3、滴定液配制所需试药与试液3.1 使⽤中国药典现⾏版规定试药和试液。
3.2 基准试剂应有专⼈负责保管与领⽤。
4、配制滴定液的配制⽅法有间接配制法与直接配制法两种,应根据规定选⽤,并应遵循下列有关规定。
4.1 配制滴定液所使⽤的试剂为分析纯或基准试剂,配制前检查封⼝及包装情况,应⽆污染。
4.2 在规定的使⽤期内,所⽤溶剂“⽔”,在未注明有其他要求时,应符合中国药典“纯化⽔”项下的规定。
4.3 采⽤间接配制法,溶质与溶剂的取⽤量均应根据规定量进⾏称取或量取,并使制成后滴定液的浓度值应为其名义值的0.95~1.05(即±5%范围);如在标定中发现其浓度值超出其名义值的0.95~1.05范围时,应加⼊适量的溶质或溶剂予以调整。
当配制量⼤于1000ml时,其溶质与溶剂的取⽤量均应按⽐例增加。
4.4 采⽤直接配制法时,其溶质应采⽤“基准试剂”,并按规定条件⼲燥⾄恒重后称取,取⽤量应精密称定,并置1000ml量瓶中,加溶剂溶解并稀释⾄刻度,摇匀。
盐酸滴定液的配制与标定

学习情境一药物检测前准备工作任务4 盐酸滴定液(0.1 mol/L)的配制与标定一、任务下达1.子任务子任务一:查阅药品质量标准,并根据要求准备好仪器、试药。
子任务二:根据质量标准和标准操作规程,进行盐酸滴定液(0.1 mol/L)的配制与标定操作。
子任务三:正确完成检验原始记录及检验报告。
3.任务目标通过本任务的教学和实施,预期达到以下目标。
(1)技能目标:能根据《中国药典》的要求配置滴定液;能正确标定滴定液。
(2)知识目标:掌握滴定液的配置与标定方法。
二、任务准备1.查找质量标准盐酸滴定液的配制与标定标准收载于《中国药典》2010年版二部附录181页。
【配制】盐酸滴定液(0.1 mol/L)取盐酸90ml,加水适量使成1000ml,摇匀。
盐酸滴定液(0.5 mol/L、0.2 mol/L或0.1 mol/L)照上法配制,但盐酸的使用量分别为45ml、18ml或9.0ml.【标定】盐酸滴定液(1 mol/L)取在270~300℃干燥至恒重的基准无水碳酸钠约1.5g,精密称定,加水50ml使溶解,加甲基红-溴甲酚绿混合指示液10滴,用本液滴定至溶液由绿色转变成紫红色时,煮沸2分钟,冷却至室温,继续滴定至溶液绿色变为暗紫色。
每1ml盐酸滴定液(1mol/L)相当于53.00mg的无水碳酸钠,根据本液的消耗量与无水碳酸钠的取用量算出本液的浓度,即得。
盐酸滴定液(0.1 mol/L)照上法标定,但基准无水碳酸钠的取用量改为约0.15g,每1ml盐酸滴定液(0.1mol/L)相当于5.30mg的无水碳酸钠。
2.准备仪器与试药(1)试验仪器:锥形瓶、万分之一电子天平、称量瓶、酸式滴定管、胶头滴管、洗瓶、电炉等。
(2)试药:浓盐酸1瓶、甲基红1瓶、溴甲酚绿1瓶、95%乙醇1瓶、基准用无水碳酸钠100g(若无可选用普通无水碳酸钠,用前300度干燥至恒重,然后用称量瓶分装好);大张滤纸5张、称量纸1包。
3.配制试液(1)甲基红-溴甲酚绿混合指示液:取0.1%甲基红的乙醇溶液20ml, 0.2%溴甲酚绿的乙醇溶液30ml,摇匀,即得。
0.5M盐酸滴定液标定

0.5M盐酸滴定液标定记录
标定: 270~300℃干燥至恒重的称量瓶与无水碳酸钠重:
g/ g;
精密称取: ⑴⑵⑶
-) -) -)
加水50ml使溶解,加甲基红-溴甲酚绿混合指示液10滴,用本液滴定至溶液由绿色转变为紫红色时,煮沸2分钟,冷却至室温,继续滴定至溶液由绿色转变为暗紫色。
每1ml的盐酸滴定液(0.5mol/L)相当于26.50mg的无水碳酸钠。
根据本液的消耗量与无水碳酸钠的取用量,算出本液的浓度,即得。
消耗盐酸滴定液(0.5mol/L)的毫升数:
⑴ml; ⑵ml; ⑶ml;
计算:
3分平行试验结果平均值: mol/L;
平行试验最大相对偏差:规定标定结果应
%。
标定结果。
标定人:。
盐酸标准滴定溶液

盐酸标准滴定溶液盐酸标准滴定溶液是化学实验中常用的一种试剂,用于测定溶液中含量未知的碱溶液的浓度。
在实验室中,我们经常需要进行盐酸标准滴定溶液的配制和使用。
下面将详细介绍盐酸标准滴定溶液的配制方法和使用注意事项。
首先,我们需要准备一定质量分数的盐酸溶液和酚酞指示剂。
盐酸溶液的质量分数一般为0.1mol/L,而酚酞指示剂是一种常用的酸碱指示剂,呈无色,在酸性溶液中呈粉红色。
接下来,我们来介绍盐酸标准滴定溶液的配制方法。
首先,我们需要称取一定质量分数的盐酸溶液,然后将其定容至标定容器所示刻度线。
在配制盐酸标准滴定溶液的过程中,需要注意使用精密天平进行称取,以确保溶液的准确浓度。
在定容的过程中,要确保溶液充分混合,以保证溶液浓度的均匀性。
完成盐酸标准滴定溶液的配制后,接下来我们将介绍盐酸标准滴定溶液的使用注意事项。
在进行滴定实验时,首先需要将待测溶液置于滴定烧杯中,然后加入数滴酚酞指示剂。
接下来,使用标定瓶中的盐酸标准溶液滴定待测溶液,直至溶液由无色变为粉红色。
在滴定的过程中,需要缓慢滴加盐酸标准溶液,并且要不断搅拌待测溶液,以保证反应的充分进行。
在滴定结束后,我们需要记录下滴定所使用的盐酸标准溶液的体积,然后根据滴定反应的化学方程式,计算出待测溶液中碱的浓度。
在进行计算时,需要注意滴定反应的摩尔比例关系,以确保计算结果的准确性。
总之,盐酸标准滴定溶液的配制和使用是化学实验中常见的操作。
通过本文的介绍,相信大家对盐酸标准滴定溶液的配制和使用有了更加清晰的认识。
在进行实验操作时,需要严格按照操作规程进行,并注意安全操作,以保证实验的顺利进行和实验结果的准确性。
希望本文对大家有所帮助,谢谢阅读!。
0.02mol盐酸滴定液配制和标定标准操作规程(3)

0.02mol盐酸滴定液配制和标定标准操作规程(3)
0.02mol/L 盐酸滴定液配制和
标定标准操作规程
1 目的
盐酸滴定液配制和标定标准操作规程。
2 范围
适用于0.02mol/L 盐酸滴定液的配制和标定。
3 责任
质量控制实验室QC 化验员。
4 内容
4.1 仪器及用具
十万分之一分析天平、干燥箱、电炉、容量瓶、玛瑙乳钵、具盖磁坩埚、锥形瓶、刻度吸管、量筒、滴定管等。
4.2 试剂及试液
盐酸、蒸馏水、基准无水碳酸钠、甲基红-溴甲酚绿混合指示液。
4.3 配制
精密量取盐酸滴定液(0.1mol/L )200ml ,加水适量使成1000ml ,摇匀。
4.4 标定
取在270-300℃干燥至恒重的基准无水碳酸钠约0.03 g ,精密称定,加水50ml 使溶解,加甲基红-溴甲酚绿混合指示液10滴,用本液滴定至溶液由绿色转变紫红色时,煮沸2分钟,冷却至室温,继续滴定至溶液由绿色变为暗紫色。
每1ml 的盐酸滴定液(0.02mol/L )相当于1.06mg 的无水碳酸钠的取用量,算出本液的浓度,即得。
4.5 结果计算:
323
2/CO Na HCl CO Na HCl T V W F ?=
式中:F 表示滴定液的校正因子。
W 表示基准物的取样量。
V 表示基准物消耗滴定液的体积。
T表示滴定度。
hcl的标定实验报告数据

hcl的标定实验报告数据HCl 的标定实验报告数据一、实验目的1、掌握用基准物质碳酸钠标定盐酸标准溶液浓度的方法。
2、学会正确使用酸式滴定管,熟练掌握滴定操作。
3、熟悉指示剂的使用和终点的判断。
二、实验原理HCl 溶液的浓度可以用基准物质碳酸钠来标定。
碳酸钠与盐酸反应的化学方程式为:Na₂CO₃+ 2HCl = 2NaCl + H₂O + CO₂↑在化学计量点时,溶液的 pH 约为 39,可选用甲基橙作指示剂。
当溶液由黄色变为橙色时,即为滴定终点。
三、实验仪器与试剂1、仪器酸式滴定管(50mL)、锥形瓶(250mL)、移液管(25mL)、容量瓶(250mL)、电子天平、玻璃棒、烧杯、洗瓶。
2、试剂HCl 溶液(待标定)、基准碳酸钠(分析纯)、甲基橙指示剂。
四、实验步骤1、配制碳酸钠标准溶液(1)用电子天平准确称取约 13g 基准碳酸钠,置于小烧杯中。
(2)用少量蒸馏水溶解后,定量转移至 250mL 容量瓶中,用蒸馏水稀释至刻度,摇匀。
2、标定 HCl 溶液(1)用移液管准确移取 2500mL 碳酸钠标准溶液于 250mL 锥形瓶中,加入 2 滴甲基橙指示剂。
(2)用待标定的HCl 溶液滴定至溶液由黄色变为橙色,即为终点。
记录消耗 HCl 溶液的体积。
(3)平行标定 3 次。
五、实验数据记录与处理1、实验数据记录|测定次数|碳酸钠溶液体积(mL)|消耗 HCl 溶液体积(mL)|||||| 1 | 2500 | 2485 || 2 | 2500 | 2490 || 3 | 2500 | 2488 |2、数据处理(1)计算 HCl 溶液的浓度根据反应方程式,碳酸钠与盐酸的反应比例为 1:2,所以有:\c(HCl) =\frac{2m(Na₂CO₃)}{M(Na₂CO₃) \times V(HCl)}\其中,\(m(Na₂CO₃)\)为碳酸钠的质量(g),\(M(Na₂CO₃)\)为碳酸钠的摩尔质量(10599 g/mol),\(V(HCl)\)为消耗 HCl 溶液的体积(L)。
盐酸准操作规程

盐酸准操作规程目 的:制订盐酸滴定液配制和标定的标准操作规程。
适用范围:盐酸滴定液(1、0.5、0.2或0.1 mol/L )的配制和标定。
责 任:检验室人员按本规程操作,检验室主任监督本规程的实施。
规 程:1.仪器及用具 十万分之一分析天平、干燥箱、电炉、容量瓶、锥形瓶、刻度吸管、量筒、滴定管等。
2.试剂及试液 盐酸、蒸馏水、基准无水碳酸钠、甲基红-溴甲酚绿混合指示液。
3.配制3.1盐酸滴定液(1 mol/L)取盐酸约90ml ,加水适量使成1000ml ,摇匀。
3.2盐酸滴定液(0.5 mol/L 、0.2 mol/L 或0.1 mol/L )照上法配制,但盐酸的取用量分别为45ml ,18ml 及9ml 。
4.标定4.1盐酸滴定液(1 mol/L ):取在270-300℃干燥至恒重的基准无水碳酸钠约1.5g ,精密称定,加水50ml 使溶解,加甲基红-溴甲酚绿混合指示液10滴,用本液滴定至溶液由绿色转变紫红色时,煮沸2分钟,冷却至室温,继续滴定至溶液由绿色变为暗紫色。
每1ml 的盐酸滴定液(1mol/L )相当于53.00mg 的无水碳酸钠的取用量,算出本液的浓度,即得。
4.2盐酸滴定液(0.5 mol/L ): 照上法标定,但基准无水碳酸钠的取用量改为0.8g 。
每1ml 的盐酸滴定液(0.5mol/L )相当于26.50mg 的无水碳酸钠。
4.3盐酸滴定液(0.2 mol/L ): 照上法标定,但基准无水碳酸钠的取用量改为0.3g 。
每1ml 的盐酸滴定液(0.2 mol/L )相当于10.60mg 的无水碳酸钠。
4.4盐酸滴定液(0.1 mol/L ): 照上法标定,但基准无水碳酸钠的取用量改为0.15g 。
每1ml 的盐酸滴定液(0.1 mol/L )相当于5.30mg 的无水碳酸钠。
4.5如需用盐酸滴定液(0.05 mol/L 、0.02 mol/L 或0.01 mol/L )时,可取盐酸滴定液(1 mol/L 或0.1 mol/L ),加水稀释制成,必要时标定浓度。
盐酸滴定液配制、标定及复标记录1

配制记录:取盐酸 计算公式: F W
ml 加水适成
ml,摇匀即可 配制日期:201 年
vt T
式中 W 为基准试剂量(mg) V 为基准物消耗滴定液的读数(ml) 滴定液的 ; ;v
读数(ml) ;
T= 编号 称量瓶+基准物重第一次干燥后重(g) 称量瓶+基准物重第二次干燥后重(g) 倾出基准物后称量瓶重(g) 称取基准物重(g) 滴定管初读数(ml) 滴定管终读数(ml) 消耗滴定液体积(ml) 空白试验消耗滴定液的读数(ml) 滴定管校正体积(ml) 消耗滴定液体积(ml) 计算 F 值: 1、 = 3、 = 1 mg/ml 标定基准物称量、滴定记录 2 3 4
1
2
3
4
3、
=
2、
=
4、
=
F
xx
n x
i
100 %
标定值(F)
复标值(F)
标定与复标的平均值(F) =
标定与复标的相对偏差:
标定值 复标值 标定值 复标值 100 %
×100%=
%
使用期限: 标定者:
年
月
日 至
年
月
日
复标者:
2/2
滴定液配制、标定及复标记录
文件编码:R-QC-003-01 标示浓度: 标定 复标 0.1mol/L 盐酸 无水碳酸钠 201 年 201 年 月 月 日 日 天平编号: 天平编号: 滴定管编号: 滴定管编号: 月 日 室温: 室温: 配制者: ℃ ℃ 配制标定依据: 《中华人民共和国《中国兽药典》2010 年版一部附录 基准试剂名称: 日期: 日期:
2、
=
4、
=
F值平均值 x :
2015版滴定液配制标定标准操作规程

制药企业用滴定液的配制及标定标准操作规程1.目的建立滴定液的配制及标定标准操作规程,并按规程进行操作,保证操作规范性与正确性。
2. 依据《中华人民共和国药典》2015年版四部通则8006。
3.范围本标准适用于本公司滴定液的配制及标定。
4.责任配制者、标定者、复核者、QC主任监督5. 内容5.1 概述滴定液系指在容量分析中用于滴定被测物质含量的标准溶液,具有准确的浓度(通常取4 位有效数字)。
5.2 仪器与用具分析天平其分度值(感量)应为0.l m g或小于0.lmg;毫克组砝码需经校正,并列有校正表备用。
滴定管 10、25和50 ml 应附有该滴定管的校正曲线或校正值。
移液管 10、15、20和25 ml 其真实容量应经校准,并附有校正值。
5.3 试液试剂5.3.1 均应按照《中国药典》2015年版四部通则8006项下的规定取用。
5.3.2 基准试剂应有专人负责保管与领用。
5.4 配制滴定液的配制方法有间接配制法与直接配制法两种,应根据规定选用,并应遵循下列有关规定。
,系指蒸馏水或去离子水,在未注明有其他要求时,应符合《中国药典》“纯化水”项下的规定。
,溶质与溶剂的取用量均应根据规定量进行称取或量取,并且制成后滴定液的浓度值应为其名义值的0.95~1.05;如在标定中发现其浓度值超出其名义值的0.95~1.05范围时,应加人适量的溶质或溶剂予以调整。
当配制量大于1000ml时,其溶质与溶剂的取用量均应按比例增加。
,其溶质应采用“基准试剂”,并按规定条件干燥至恒重后称取,取用量应为精密称定(精确至4 ~5 位有效数字),并置1000ml量瓶中,加溶剂溶解并稀释至刻度,摇匀。
配制过程中应有核对人,并在记录中签名以示负责。
mol / L的滴定液时,除另有规定外,应于临用前精密量取浓度等于或大于0. l mol / L 的滴定液适量,加新沸过的冷水或规定的溶剂定量稀释制成。
5.4. 5 配制成的滴定液必须澄清,必要时可滤过;并按药典中各该滴定液项下的[贮藏]条件贮存,经下述标定其浓度后方可使用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
盐酸滴定液(0.5mol/L)配制与标定
标准操作程序
1.目的:建立盐酸滴定液(0.5mol/L)配制与标定的标准操作程序,保证正确操作。
2.适用范围:本标准规定了盐酸滴定液(0.5mol/L)配制与标定的方法和操作要求;适用于本公司质量控制室盐酸滴定液(0.5mol/L)的配制、标定与复标。
3.责任:配制、标化及复标检验员。
4.内容:
4.1 误差要求:
4.2试剂与试药:甲基红-溴甲酚绿混合指示液基准无水碳酸钠盐酸
4.3试剂的配制:按《化学试剂配制标准操作程序》(SOP-H10-04)相关条款配制
4.4仪器与设备:三角烧瓶(250ml) 酸式滴定管(50ml )茂福炉分析天平
电热恒温干燥箱
4.5操作步骤:
4.5.1 HCL=36.46 18.23g→1000ml
4.5.2 配制:取盐酸45ml加水适量使成1000ml,摇匀。
4.5.3 标定:盐酸滴定液(0.5mol/L):取在270~300℃干燥至恒重的基准无水碳酸钠约0.8g精密
编码:SOP-H08-015-04 共 2 页第 2 页
称定,加50ml使溶解,加甲基红-溴甲酚绿混合指示液10滴,用本液滴定到溶液由绿色转变为紫红色时,沸2分钟,冷却至室温,继续滴定至溶液由绿色变为暗紫色。
每1ml盐酸滴定液(0.5mol/L)相当于26.50mg的无水碳酸钠。
根据本液的消耗量与无水碳酸钠的取用量,算出本液的浓度。
即得。
4.5.4 算公式:
F= V ×m0.0265
式中:m 为基准无水碳酸钠质量
v 为本滴定液的消耗量(ml)
4.5.5反应原理:以酸滴定液,滴定被测物质,以指示剂指示终点,根据消耗滴定液的浓度和毫升数,可计算出被测物的含量。
H++OH- H2O
4.6注意事项:
4.6.1配制中,盐酸的取用量如按药典的规定量取,则配制成的滴定液的F值常为1.05~1.10;因此,在加水稀释后,宜先与已知浓度的氢氧化钠滴定液作比较试验,求得其粗略浓度,再加水适量稀释,以调节其浓度使其F值为0.95~1.05,而后再进行标定。
4.6.2基准无水碳酸钠应在270~300℃干燥至恒重,以除去水分和碳酸氢钠。
具体操作为:取基准无水碳酸钠适量,在玛瑙乳钵中研细后,置具盖磁坩埚内,在270~300℃干燥至恒重;移置称量瓶中,密盖,贮于干燥器中备用。
4.6.3干燥至恒重的无水碳酸钠有引湿性,因此在标定中精密称取基准无水碳酸钠时,宜采用“减量法”称取,并应迅速将称量瓶加盖密闭。
4.6.4甲基红-溴甲酚绿混合指示液的变色阈为PH
5.1,因此在滴定至近终点时,必须煮沸2分钟以除去被滴定液的二氧化碳,待冷却至室温后,再继续滴定至溶液由绿色变为暗紫色。
4.6.5要按规定加入指示液,因指示液本身具有酸性或碱性,能影响指示剂的灵敏度。
4.7引用标准:《中华人民共和国药典》(2005年版二部附录)
《中国药品检验标准操作规范》(2005年版)。
