氢原子光谱及玻尔理论(二)
15-2康普顿效应,氢原子光谱和玻尔理论

--
-
--
很快被卢瑟福的粒子散射实验否定!
粒子散射实验:
粒子
原子核 2. 卢瑟福的原子核式模型(1911年)
原子由原子核和核外电子构成,原子核带正电荷,占据整 个原子的极小一部分空间,而电子带负电,绕着原子核转 动,如同行星绕太阳转动一样。 原子核直径的数量级:10-14m,质量占99.95% 原子直径的数量级:10-10m
1 12
1 32
0.975 107
1 1.025107 m
1 2
1.097 107
1 12
1 22
0.975 107
2 1.216107 m
1 3
1.097 107
1 22
1 32
0.152 107
3 6.579107 m
主要内容
康普顿效应的量子解释
康普顿散射公式:
0
h m0c
h
cc
m0c (1 cos ) ( v v0 ) 0
康普顿散射公式:
0
h m0c
1
cos
康普顿波长:
c
h m0c
2.426
310
241012 m
结论: • 波长的改变量 与散射体无关,
• 波长的改变量 与散射角θ有关,散 射角θ 越大,
也越大。
3. 波长的改变量与入射光的波长无关。
vn
-
+ rn
电子轨道半径:rn
0h2 me2
n2
r1n2
n 1,2,3,
玻尔半径:
r1
0h2 me2
5.291011m
rn r1n2 4r1 , 9r1 ,16r1 , n 1, 2, 3,
氢原子光谱玻尔氢原子理论

根据电子绕核作圆周运动的模型及角动量 量子化条件可以计算出氢原子处于各定态时的 电子轨道半径。
玻尔的氢原子理论
rn n2 (m0he22 ),n 1,2,3,
r1 0.5291010m 玻尔 半径
电子处在半径为 rn的轨道上运动时,可以计
算出氢原子系统的能量 En为
En
1 n2
பைடு நூலகம்
(8m0e2h4 2 ), n
● 量子化条件的引进没有适当的理论解释。 ● 对谱线的强度、宽度、偏振等无法处理。
氢原子光谱
例题18-6 在气体放电管中,用能量为12.5eV的电子通 过碰撞使氢原子激发,问受激发的原子向低能级 跃迁时,能发射那些波长的光谱线?
解: 设氢原子全部吸收电子的能量后最高能激发到第n
个能级,此能级的能量为
态跃迁到另一能量为 Ek的定态时,就要发射
或吸收一个频率为 kn 的光子。
kn
En
Ek h
玻尔频率公式
玻尔的氢原子理论
(3)量子化条件 在电子绕核作圆周运动中,
其稳定状态必须满足电子的角动量 L等于 h
的整数倍的条件。
2
L n h , n 1,2,3,
2
n为量子数
角动量量子化条件
3. 氢原子轨道半径和能量的计算
§18-4 氢原子光谱 玻尔的氢原子理论
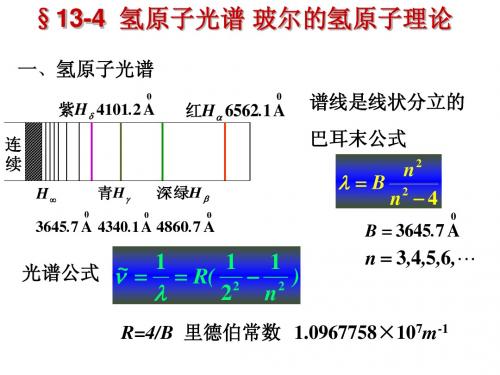
1. 氢原子光谱的规律性
原子发光是重要的原子现象之一, 光谱学 的数据对物质结构的研究具有重要意义。
氢原子谱线的波长可以用下列经验公式表示:
~
R(
1 k2
1 n2
)
~ 1
k 1,2,3, n k 1, k 2, k 3,
波数
R 1.096776 107 m-1 里德伯常量
氢原子光谱的特征

)
1 r 2s in
2θ
2 2φ
]
8π2m
Ze2
h2
(E
)Ψ 0 r
(2)
(2)式即为薛定谔方程在球坐标下的形式。经过坐标变换,
三个变量不再同时出现在势能项中。
如果我们把坐标变换作为解薛定谔方程的第一步,那么变量 分离则是第二步。
解薛定谔方程(2)得到的波函数应是 ( r,, )。
1-3 波函数和原子轨道
波函数 的几何图象可以用来表示微观粒子活动的区域。
1926 年,奥地利物理学家薛定谔(Schodinger ) 提出 一个方程,被命名为薛定谔方程。波函数 就是通过解 薛定谔方程得到的。
薛定谔方程
2 x 2
2 y2
2 z 2
82m h2
(E
我们采取坐标变换的方法来解决(或者说简化)这一问题。 将三维直角坐标系变换成球坐标系。
将直角坐标三变量 x,y,z 变换成球坐标三变量 r,, 。
P 为空间一点
r OP 的长度
(0 — )
z
OP 与 z 轴的夹角 ( 0 — )
OP 在 xoy 平面内的投影 OP′
P
与 x 轴的夹角 ( 0 — 2 )
V)
0
(1)
这是一个二阶偏微分方程
式中 波函数 , E 能量 , V 势能 , m 微粒的质量, 圆周率 , h 普朗克常数
,
,
x
y
z
偏微分符号
2 , x 2
2 , y 2
2 z 2
二阶偏微分符号
解二阶偏微分方程将会得到一个什么结果呢 ?
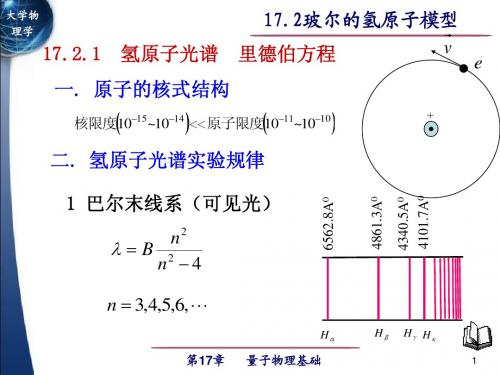
大学物理,量子物理基础21-03 氢原子光谱的实验规律 玻尔理论

第21章 量子物理基础
普芳德系
巴耳末系 赖曼系
波长 5.0
4.0
3.0
2.0
1.0
0.8
0.6 可 见 光
0.4
0.2
mm
红
外
线
紫 外 线
10
21.3 氢原子光谱的实验规律 玻尔理论
第21章 量子物理基础
氢原子光谱有着内在的联系,表现在其波数 可用一普遍公式来表示:
1 1 R 2 2 (广义巴尔末公式) n m 1
实验上的发现成为人们构思原子模型的依据 之一。原子模型如雨后春笋,竞相脱颖而出。 其中最有影响的是汤姆孙的原子模型和卢瑟福 的原子模型。
2
21.3 氢原子光谱的实验规律 玻尔理论
第21章 量子物理基础
早在原子理论建立以前,光谱学已经取得很大发 展,积累了有关原子光谱的大量实验数据。人们已 经知道,原子光谱是提供原子内部信息的重要资料, 不同原子的辐射光谱特征也完全不同。故研究原子 光谱的规律是探索原子结构的重要线索。 应当说,量子论、光谱学、电子的发现这三大 线索,为运用量子论研究原子结构提供了坚实的理 论和实验基础。 在所有的原子中,氢原子是最简单的,这里就 先从氢原子的光谱着手。
8
21.3 氢原子光谱的实验规律 玻尔理论
第21章 量子物理基础
1 1 可见光:巴尔末系 R ( 2 2 ) , n பைடு நூலகம்,4, 2 n 1 1 1 帕邢系 R ( 2 2 ) , n 4,5, 3 n
红外:
1 1 紫外: 莱曼系 R( 2 2 ) , n 2, 3, 1 n
式中: m 1,2,3
n m 1, m 2, m 3,
大学物理(下):2波尔的氢原子模型
3. 卢瑟福原子有核模型
①.原子的中心是原子核,几乎占有原子的全部质量, 集中了原子中全部的正电荷。
4
②.电子绕原子核运动。 ③.原子核的体积比原子的体积小得多。 原子半径~10-10m,原子核半径10-14 ~10-15m
2. 粒子散射实验
粒子
粒子为氦核
2 4
He
在原子中带电物质的电场力作用下,使它偏离 原来的入射方向,从而发生散射现象。
氦核质量是电子质量的 7500倍, 粒子运动不受电
子影响。
3
实验结果表明:绝大部分粒子经金 箔散射后,散射角很小(2~3), 但有1/8000的粒子偏转角大于90
汤姆逊的原子结构模型无法解释 这种现象。
第三节
原子模型 氢原子光谱
1
十九世纪末二十世纪初,一些实验相继发现了电
子、 X 射线和放射性元素,这些发现表明原子是可以
分割的,它具有比较复杂的结构,原子是怎样组成的?
原子的运动规律如何?对这些问题的研究形成了原子
的量子理论。
一、原子结构的探索
E r 3 0
1.汤姆逊原子结构模型 F - e r 1903年 J.J.汤姆逊提出,原子3中 0的正电荷和原子
H
H H H H
氢原子巴尔末线系
n 3 4 5
656 .3 486 .3
364 .566nm
1896年里德伯用波数 ~ 1 来表示谱线,
波数:单位长度中所包含的波形数目。
~
1
1 B
n2 n2
4
氢原子光谱和玻尔的原子结构模型

Hale Waihona Puke 内容:无法同时精确测量粒子的位置和动量 提出者:海森堡 意义:否定了经典物理学的确定性和因果关系 对玻尔原子结构模型的影响:解释了原子光谱的离散性
光的波粒二象性:光既具有波动特性又具有粒子特性 德布罗意波长公式:λ=h/p其中λ是波长h是普朗克常数p是动量 光的粒子性:光子是光的基本单位具有能量和动量 光的波动性:光在空间中传播形成电磁波具有频率和波长
受普朗克、爱因斯坦等物理学家的量子理论启发玻尔提出了自己的原子结构模型。
PRT FIVE
对应原理是玻尔原子结构模型的理论基础它认为电子只能在特定的轨道上运动每个轨道对应 一定的能量。 玻尔引入了量子化的概念认为电子只能存在于具有确定能量的稳定状态中这些状态称为定态。
对应原理还指出当电子从一个定态跃迁到另一个定态时会释放或吸收一定频率的光子。
,
汇报人:
CONTENTS
PRT ONE
PRT TWO
发现者:罗伯特·米立根 时间:19世纪末 实验装置:真空管和棱镜 意义:揭示了氢原子光谱的存在和特征
稳定性:氢原子光谱具有高度的稳定性是研究原子结构的重要手段。 连续性:氢原子光谱线覆盖了从长波到短波的连续范围为研究原子能级提供了重要信息。
PRT SIX
1913年玻尔提出了原子结 构模型
模型基于经典力学和量子 化假设
模型成功解释了氢原子光 谱线
模型为后续原子结构研究 奠定了基础
提出假设:玻尔在1913年提出了氢原子光谱的假设奠定了玻尔原子结构模型的基础。
解释实验现象:玻尔的原子结构模型能够解释氢原子光谱的实验现象如巴尔末公式和里德伯公式等。
玻尔的氢原子理论

玻尔的氢原子理论
为此,J.汤姆孙在1904年提出了原子结构的枣糕式模型.该模型认 为,原子可以看作一个球体,原子的正电荷和质量均匀分布在球内, 电子则一颗一颗地镶嵌其中.1909年,J.汤姆孙的学生卢瑟福为了验证 原子结构的枣糕式模型,完成了著名的α粒子散射实验.实验发现α粒 子在轰击金箔时,绝大多数α粒子都穿透金箔,方向也几乎不变,但 是大约有1/8 000的α粒子会发生大角度偏转,即被反弹回来.这样的 实验结果是枣糕式模型根本无法解释的,因为如果说金箔中的金原子 都是枣糕式的结构,那么整个金箔上各点的性质应该近乎均匀,α粒 子轰击上去,要么全部透射过去,要么全部反弹回来,而不可能是一 些穿透过去,一些反弹回来.
玻尔的氢原子理论
二、 原子结构模型
1897年,J.汤姆孙发现了电子.在此之前,原 子被认为是物质结构的最小单元,是不可分的,可 是电子的发现却表明原子中包含带负电的电子.那 么,原子中必然还有带正电的部分,这就说明原子 是可分的,是有内部结构的.执着的科学家就会继 续追问:原子的内部结构是什么样的?简洁的里德 伯光谱公式是不是氢原子内部结构的外在表现?
玻尔的氢原子理论
三、 玻尔的三点基本假设
为了解决原子结构有核模型的稳定性和氢原子光谱的分 立性问题,玻尔提出以下三个假设:
(1)定态假设.原子中的电子绕着原子核做圆周运动, 但是只能沿着一系列特定的轨道运动,而不能够任意转动, 当电子在这些轨道运动时,不向外辐射电磁波,原子系统处 于稳定状态,具有一定的能量.不同的轨道,具有不同的能 量,按照从小到大的顺序记为E1、E2、E3等.
玻尔的氢原子理论
可是这个模型却遭到很多物理学家的质疑.因为按照当时的物 理理论(包括经典力学、经典电磁理论及热力学统计物理),这 样一个模型是根本不可能的,原因有以下两个:
氢原子光谱实验规律 波尔理论

二、卢瑟福的原子有核模型
1. 卢瑟福的原子有核模型
1911 年卢瑟福根据 α 粒子散射实验结果建立 了原子的有核模型。
① 所有正电荷和几乎所有的原子 质量都集中在原子中心的一个 非 常 小 ( R≤10-15m ) 的 体 积 内, 这就是“原子核”;
② 原子中的电子围绕原子核转动;
③ 带正电的核和带负电的电子间 的静电引力把整个原子结合在 一起。
解: 赖曼系
1
R(112
1 n2
)
1/[R(1n12)] 其 中 R 1 .0 9 7 1 0 2 n m 1
n = 2 时对应最长波长 max 121.5nm
n = ∞时对应最短波长 min 91.2nm
帕邢系
1/[1.097
104
(
1 32
1 n2
)](nm)
53 1282nm
例题2 :
% R(612n 12) n7,8,9,L
3) 氢原子光谱规律
氢原子光谱有着内在的联系,表现在其波数可用 一普遍公式来表示:
v% 1
R
1 k2
1 n2
(广义巴尔末公式)
式中: k1,2,3L, n k 1 ,k 2 ,k 3 ,L
对应一个 k 就构成一个谱线系。
里兹组合原理:任一条谱线的波数都可以写成两 项之差的形式,即
• 每一谱线的波数都可以表示为二个光谱项之差
% T (k)T (n )
%
1
R
1 k2
1 n2
---广义巴尔末公式
表面上如此繁杂的光谱线竟然由一个式 子简单地表示,这不能不说是一项出色的成 果,但公式是凭经验凑出来的,它为什么与 实验符合得如此好,在公式问世将近三十年 内,一直是个谜。
氢原子的玻尔理论

③氢原子的能级 ( energy level ) E1 基态 ( ground state ) E2 , E3 ,… ,激发态 ( excited ) ④由玻尔假设可导出广义巴尔末公式
hν = En- Ek /8ε 1/λ = ν /c = me4/8ε0h3c(1/k2 - 1/n2 ) 1/λ = R (1/k2 - 1/n2 ) , n > k
小结
1.玻尔假设 1.玻尔假设 ①定态假设 跃迁假设 ②跃迁假设 hν = En- Ek 2.德布罗意 德布罗意假设 2.德布罗意假设 λ = h / mv ; E = hν
h 1 1 λ= =h • mv 2qm U
电子的德布罗意波长: 电子的德布罗意波长: 德布罗意波长
λ e = 1.23 •
1 U
(nm)
3.电子衍射
二、电子显微镜
■光学显微镜能分辨的两点间最小距离: 光学显微镜能分辨的两点间最小距离:
λ越小,Z越小,则分辨本领越高。 越小, 越小,则分辨本领越高。 ■但可见光波长较大,即光学显微镜分辨 但可见光波长较大, 本领有限。 本领有限。 ■电子显微镜可提高分辨本领 利用电子射线代替照射光
λ = h / p = h / mv ν =E / h
(德布罗意公式) 德布罗意公式 公式)
2.德布罗意波长 德布罗意波长
设带电粒子的电量:q ,质量:m ,速度: 质量: 速度: 设带电粒子的电量: v ,加速它的电压:U 。则粒子获得的动 加速它的电压: 能为: 能为: 1 2qU 2 mv = qU 则 v = m 2 带电粒子的德布罗意波长: 德布罗意波长 带电粒子的德布罗意波长:
hν = En- Ek
辐射或吸收光子的频率: 辐射或吸收光子的频率: ν =(En- Ek)/ h
玻尔的氢原子理论
~ T( k ) T( n ) T( k )
R R ,T ( n ) 2 称为光谱项 2 k n
从氢原子光谱规律可以看出:
1、光谱是线状的,谱线对应一定的位置,不因观 察方式不同而改变顺序;
2、谱线间有一定的关系,各系可用一个公式表示, 不同线系有共同的光谱项; 3、每一谱线的可以用两光谱项之差表示;
2、频率假设
原子从一较大能量En的定态向另一较低能量Ek的定 态跃迁时,辐射一个光子
h En Ek
跃迁频率条件
原子从较低能量Ek的定态向较大能量En的定态 跃迁时,吸收一个光子 3、轨道角动量量子化假设
h Ln 2
轨道量子化条件
n为正整数,称为量子数
基本假设应用于氢原子:
(1)轨道半径量子化
由图可知,可见光的谱线为 n=4和n=3跃迁到n=2的两条
1 1 ~ 42 R( 2 2 ) 2 4 1 1 1.097 107 ( ) 4 16 0.21 107 m 1
n4 n3 n2 n1
42
o 1 ~ 4861 A 42
1 1 ~ 32 R( 2 2 ) 2 3
2 h rn n 2 ( 0 2 ) me
1 me4 En 2 ( 2 2 ) n 8 0 h
基态能级
(n 1, 2,3, )
E1 13.58 eV
激发态能级 En E1 13.58 eV n2 n2 氢原子的电离能
E电离 E E1 13.58 eV
二、玻尔氢原子理论 原子的核式结构的缺陷:
无法解释原子的稳定性 无法解释原子光谱的不连续性 玻尔原子理论的三个基本假设: 1、定态假设
原子系统存在一系列不连续的能量状态,处于这些状态
玻尔原子理论对氢光谱的解释

三、玻尔原子理论对氢光谱的解释教学目的:◆了解玻尔原子理论的成功之处及局限性1、 知道巴耳末公式2、 了解如何用玻尔原子理论解释氢原子光谱3、 了解玻尔理论的局限性。
教学重点:玻尔原子理论对氢光谱的解释教学过程:(一) 组织教学(二) 复习提问1、玻尔原子理论的内容是什麽?2、玻尔原子理论中计算氢原子电子的各条可能轨道的半径和电子在各条轨道上运动时的能量公式是什麽?1212121E E h E n E r n r n n -===ν (三) 引入:看课本彩图4,找氢原子光谱在可见光区的四条谱线波长:mH mH mH mH μμμμδγβα4101.04340.04861.06562.0(四) 新授1、 氢光谱的实验规律:即巴耳末公式:⎪⎭⎫ ⎝⎛-=221211n R λ, n=3,4,5,┅┅ 其中λ是氢原子光波的波长,R 为里德伯常量实验值为R=1.096776×107m -12、 玻尔理论导出的氢光谱规律:按玻尔的原子理论,氢原子的电子从能量较高的轨道n 跃迁到能量较低的轨道2时辐射出的光子能量:2E E h n -=ν 但:212212,E E n E E n ==, 由此可得: ,121221⎪⎭⎫ ⎝⎛--=n E h ν 由于λνc=,所以上式可写作:⎪⎭⎫ ⎝⎛--=2211211n hc E λ,此式与巴耳末公式比较,形式完全一样,里德伯常量17110097373.1-⨯=-=m hc E R 与实验符合的很好。
由此可知,氢光谱的巴耳末线系是电子从 n=3,4,5,6,等能级跃迁到n=2的能级时辐射出来的。
玻尔原子理论还解释了帕邢系(在红外区),预言了当时未发现的氢原子的其他光谱线系。
氢原子能级图3、 玻尔理论的局限性(1) 玻尔原子模型在解释氢原子光谱上获得成功,而对核外电子较多的原子,理论与实验相差很多,玻尔理论不再成立,取而代之的是量子力学。
(2) 玻尔理论的成功之处在于它引入了量子的观念,失败之处在于它保留了过多的经典物理理论。
17.2 玻尔的氢原子模型
5
大学物 理学
17.2玻尔的氢原子模型
v
行星模型
1 原子能量及频率
e2 v2 Fn F 2 m 4 0 r r 1 e2 Ek 4 0 2r 1
F
e
e2 1 e2 E p EP 4 0 r 4 0 r 1 e2 E Ek EP 4 0 2r v e 1 2r 2 4 0 m r2 1
第17章 量子物理基础
2
大学物 理学
1 1 n 3,4,5 R 2 2 (1)巴尔末线系(可见光): 2 n 1 1 (2)赖曼线系(紫外区): R 2 2 n 2,3,4, 1 n 1 1 (3)帕邢线系(红外区): R 2 2 3 n
(1)极限波长
n , min B 3645 .98A0
(2)频率
1 1 Rc 2 2 2 n c
R 1.09710107 m1
H H
H H
min
---里德伯常量
1 1 R 2 2 (3)波数: 2 n 波数:单位长度上所含完整波的数目 1
hc
2.86ev 1ev 1.6010
量子物理基础
19
J
第17章
20
大学物 理学
17.2玻尔的氢原子模型
(2)En→Ek,n=?,k=?
巴尔末线系 k 2
E1 13.6 Ek 2 3.4eV 2 k 2 E1 En 2 Ek h n
n E1 5 E k h
8
大学物 理学
17.2玻尔的氢原子模型
第二章,氢原子光谱

Back
Next
第五节:玻尔理论的推广
玻尔—索末非模型 碱金属的光谱 Back
第五节:玻尔理论的推广
玻尔—索末非模型
碱金属的光谱
Next
第五节:玻尔理论的推广
玻尔—索末非模型
碱金属的光谱
Back
Next
第五节:玻尔理论的推广
原子实是一个球形对称的 结构,它里边的原子核带 有Ze正电荷和(Z-1)e负 电荷,在原子最外层运动 的价电子好象是处在一个 单位正电荷的库仑场中, 当价电子运动到靠近原子 实时,由于价电子的电场 作用,原子实中带正电的 原子核与带负电的电子的 中心会发生微小的偏移, 于是负电的中心不再在原 子核上,形成一个电偶极 子。这就是原子实的极化。
rnn2a 0
c vnn
n1 ,2 ,3 ,K
a0 4m πee0h22 0.53Å 玻尔半径
En
1 2n2
e2 4π0a0
e2 1 精细结构常数 4π0hc 137
1 2n2
m e
2c 2
n 1 E 1 1 3 . 6 e V r 1 a 0 基态(ground state)
n 2 激发态(excited state)
质心系
核系
En
1 2n2
Z 2e2 4π0a0
1 2n2
Z
2
2c 2
rnn Z 2a0
vnZ nc n1 ,2 ,3 ,K
r1n
me rn
n2
Z
4π0h2
mee2
e4
1
RM4π4π02h3c1m e MR
R1 0 7m 1 M 1 .0 9 73 7 3 1
1 1H 1 .0 9 67 7 58 1 2D 1 .0 9 70 7 42 1 3T 1 .0 9 7 1 7 35 4 2H e 1 .0 9 72 2 27 3 7L i2 1 .0 9 72 8 80 9 4H e3 1 .0 9 73 0 70
8.4.2 玻尔的氢原子理论

1 2
m
v
n
2
e2
8 0rn
En
me4
8
2 0
h
2
1 n2
En
E1 n2
基态能量:
n 1时,
E1 13 6eV
n 1, 2 , 3 , 这种量子化的能量称为能级
4、 氢原子光谱的理论解释
kn
En
h
Ek
1 me4
En
n2
8
2 0
h
2
ν~kn
me4
8
2 0
h
3c
(1 k2
1) n2
RH
则发射或吸收光子的频率为:
kn
En Ek h
称为 玻尔的频率条件
玻尔的氢原子理论
Ek
玻尔的氢原子理论
2、氢原子轨道半径的计算 由量子化条件及牛顿定律:
n=4 v
m n=3
mvr n h , 角动量量子化
e2
40r 2
2 2
mv r
,库仑力=向心力
n=2 n=1 r
r1 4r1
rn
n2
0h2 me2
在这些轨道上运动的电子 不辐射(或吸收)能量而处于 稳定状态,称为定态。
相应的轨道称为定态轨道 与定态相应的能量(能级) 分别为 : E1,E2 ,E3 …
E1 < E2 < E3 < …
玻尔的氢原子理论
E1 E2 E3
玻尔的氢原子理论
一、玻尔的氢原子理论
1、玻尔的氢原子理论
2)角动量量子化条件假设
在定态轨道上运动的电子, 其角动量只能取 h / (2 的 整数倍,即
v
m
氢原子光谱和玻尔的原子模型2(跃迁专题)学案—【新教材】人教版(2019)高中物理选择性必修三

预习案【自主学习】1.观察教材86页图4.4-5,电子从半径大的轨道向半径小的轨道跃迁,是吸收光子还是辐射光子?2.观察教材86页图4.4-6,赖曼系的光子比巴耳未系的光子能量高还低?为什么?【自学检测】(答案附后)如图,用能量为12.09 eV的光子照射一群处于基态的氢原子,则氢原子( )A.不能跃迁到其他能级B.只能跃迁到n=3的能级C.跃迁后只能辐射一种频率的光子D.跃迁后不能再辐射出能量为12.09 eV的光子【学始于疑】(请将预习中不能解决的问题记录下来,供课堂解决。
)课堂案【合作探究一】一个与一群氢原子的区别一个氢原子从n=5的激发态向低能级跃迁时,产生的光子种类可能是( )A.4种 B.10种 C.6种 D.8种课堂练习2:教材91页第4题【合作探究二】11.(多选)欲使处于基态的氢原子激发或电离,下列措施可行的是( )A.用10.2 eV的光子照射 B.用11 eV的光子照射C.用14 eV的光子照射 D.用11 eV的电子碰撞课堂练习1:教材91页第6题总结:【进阶闯关检测】A类基础关1.如图是氢原子能级示意图,具有下列哪一能量的光子能被处在n=2能级的氢原子吸收( )A.1.51 eVB.1.89 eVC.2.16 eVD.2.40 eV2.如图所示为氢原子能级图,已知可见光的能量范围为 1.62 eV~3.11 eV,下列说法正确的是( )A.氢原子从高能级跃迁到第2能级,辐射的光子均为可见光B.处于基态的氢原子可吸收能量较强的可见光跃迁到高能级C.处于第4能级的大量氢原子,向基态跃迁时只能释放出3种不同频率的光子D.处于第3能级的氢原子可以吸收可见光的能量被电离3.根据氢原子的能级图,现让一束单色光照射到一群处于基态(量子数n=1)的氢原子上,受激发的氢原子能自发地发出6种不同频率的光,则照射氢原子的单色光的光子能量为( ) A.13.6 eVB.4 eVC.12.75 eVD.12.09 eVB类能力关4.如图为氢原子的能级示意图,已知锌的逸出功是3.34 eV。
17.3 氢原子光谱 玻尔的氢原子理论2
巴尔末( 巴尔末(Balmer)系 ) 赖曼( 赖曼(Lyman)系 ) + 普芳德( 普芳德(Pfund)系 )
n=1 n=2 n=3 n=4 n=5 n=6
帕邢( 帕邢(paschen)系 )
布喇开( 布喇开(Brackett)系 )
三. 弗兰克 — 赫兹实验
按照玻尔(Bohr)理论,在原子内存在一系列分立的能级 分立的能级. ● 按照玻尔(Bohr)理论,在原子内存在一系列分立的能级. 1914年 夫兰克和赫兹(Frank德国物理学家) ● 1914年,夫兰克和赫兹(Frank-Hertz,德国物理学家) 进行了电子轰击汞原子的实验, 进行了电子轰击汞原子的实验, 证明了原子内部的能级的确是分立的。 证明了原子内部的能级的确是分立的。 充汞原子蒸汽 电子由阴级K发出, 电子由阴级K发出, 与栅极G之间有加速电场, K与栅极G之间有加速电场, 与接收极A之间有减速电场。 G与接收极A之间有减速电场。
h 角动量量子化假设 L = mvr = n = nh 2π
r
r v
2、玻尔对氢原子的诠释
1 e v 库仑力提供向心力 2 =m 4πε0 r r 由上两式得, 由上两式得, 第 n 个定态的轨道半径为 ε0h2 ) = n2r1 n = 1,2,3,L rn = n2 ( r2=4r1 πme 2 2 1 e r3=9r1 玻尔半径 r1 = 0.0529 nm E1 = 8πε0 r1 定态能量: 定态能量: 2 E1 -13.6 eV 1 e2 1 2 1 e2 1 e = 2 =− En = mv − =− 2 8πε0 n r1 n 2 4πε0 rn 8πε0 rn
(2) 跃迁假设 )
原子从一个定态跃迁到另一定态, 原子从一个定态跃迁到另一定态,会 E 跃迁到另一定态 k 发射或吸收频率为 的一个光子
第二章 玻尔氢原子理论

第二章 原子的能级和辐射一、学习要点:1.氢原子光谱:线状谱、五个线系(记住名称、顺序)、广义巴尔末公式)11(~22nm R -=ν、 光谱项()2nR n T =、并合原则:)()(~n T m T -=ν 2.玻尔氢原子理论:(1)玻尔三条基本假设的实验基础和内容(记熟)(2)圆轨道理论(会推导):氢原子中假设原子核静止,电子绕核作匀速率圆周运动02200202220A 529,04,Z Z 4≈===e m a n a n e m r e e n πεπε;13714,Z Z 40202≈===c e n c n e c e n πεααπευ; ()n hcT n hc R n e m E e n --=-=∞22224220Z 2Z )41( πε,n =1.2.3……(3)实验验证:(a )氢原子五个线系的形成)11(Z ~,)4(222232042n m R c h e m R e -==∞∞νπεπ (会推导)非量子化轨道跃迁 )(212n E E mv h -+=∞ν (b )夫-赫实验:装置、.结果及分析;原子的电离电势、激发电势3.类氢离子(+++Li ,He ,正电子偶素.-μ原子等) (1) He +光谱:毕克林系的发现、波数公式、与氢原子巴耳末系的异同等(2)理论处理(会推导):计及原子核的运动,电子和原子核绕共同质心作匀速率圆周运动e e m M m M +⋅=μ, 正负电荷中心之距Ze n r n 22204μπε =. 能量2242202Z )41(n e E n μπε-=,里德伯常数变化Mm R R e A +=∞11 重氢(氘)的发现4.椭圆轨道理论 索末菲量子化条件q q n h n pdq ,⎰=为整数a n nb n e m a n e m E n p e n ϕϕϕπεπε==-==,Z 4,2Z )41(,2220224220 ,n n n ,,3,2,1;,3,2,1 ==ϕn 一定,n E 一定,长半轴一定,有n 个短半轴,有n 个椭圆轨道(状态),即n E 为n 度简并。
4-4 第2课时玻尔理论对氢光谱的解释 氢原子能级跃迁( 课件高中物理人教版(2019)选择性必修三

巴 耳 末 系
氢原子能级跃迁与光谱图
玻尔理论与巴耳末公式
请同学们用这几个公式推出巴耳末公式
结果与实验值符合的很好
玻尔理论与巴耳末公式
Hδ
Hγ
Hβ
Hα
n=2n=1 n=3 n=4
n=5
n=6
玻尔理论与巴耳末公式
Hδ
Hγ
巴尔末系氢吸收光谱
n=2 n=1 n=3 n=4 n=5
n=6
Hβ Hα
玻尔理论解释气体导电发光
光子的发射和吸收
注意一群原子和一个原子
氢原子核外只有一个电子,这个电子在某个时刻只能处在某一个可能 的轨道上,在某段时间内,由某一轨道跃迁到另一个轨道时,可能的 情况只有一种,但是如果容器中盛有大量的氢原子,这些原子的核外 电子跃迁时就会有各种情况出现
注意直接跃迁与间接跃迁
原子从一种能量状态跃迁到另一种能量状态时,有时可能是直接跃迁 ,有时可能是间接跃迁。两种情况的辐射(或吸收)光子的频率不同 ,但都满足频率条件
电子从低能级(如基态)向高能 级(如第一激发态)跃迁时,需 要吸收能量
若给它10.1eV的能量,电子能否 发生跃迁?
不能
若给它13.6的能量,电子将会如 何运动?大于13.6eV的能量呢?
光子的发射和吸收
原子发光现象:原子从较高的激发态向较低的激发态或基态跃迁的过程,是
辐射能量的过程,这个能量以光子的形式辐射出去,这就是原子发光现象。
问题与练习 如图,用玻尔理论解释,当巴耳末公式n=5时计算出的氢原子 光谱的谱线,是哪两个能级之间的跃迁造成的?
根据巴耳末公式,n=5时计算出的氢原 子光谱的谱线是量子数为5的能级跃迁 到量子数为2的能级形成的
问题与练习 请用玻尔理论解释:为什么原子的发射光谱都是一些分立的亮线?
