10-药品包装
包装不合理的例子

包装不合理的例子1. 玻璃瓶的包装:一款玻璃瓶的包装设计采用了大量的纸盒和塑料泡沫,这样不仅增加了包装的重量和体积,还对环境造成了不必要的污染。
相比之下,使用简单的纸盒和纸质内衬即可实现包装的保护功能。
2. 食品盒的包装:某食品品牌的食品盒包装设计过于复杂,包装上印有大量的图案和文字,给消费者阅读和使用带来困扰。
简化包装设计,减少不必要的图案和文字,能够提高包装的易用性和美观度。
3. 饮料瓶的包装:某品牌的饮料瓶采用了过于薄弱的塑料材质,容易破裂和变形,给消费者携带和使用带来困扰。
采用更加坚固耐用的材质制作饮料瓶,能够提高包装的质量和使用寿命。
4. 化妆品的包装:某化妆品品牌的包装设计过于花哨,使用了大量的亮片、珠光和金属质感,给消费者一种过于浮华和低俗的感觉。
简约而高贵的包装设计能够更好地体现化妆品的品质和品味。
5. 电子产品的包装:某电子产品的包装设计过于复杂和庞大,内部填充了大量的泡沫和塑料袋,给消费者拆包和清理带来不便。
采用简约而环保的包装设计,减少包装材料的使用,能够提高包装的可持续性和环保性。
6. 蔬菜水果的包装:某超市的蔬菜水果包装采用了过于厚重的塑料袋,不仅浪费了塑料资源,还对环境造成了污染。
使用可降解的纸质包装或不使用包装,能够减少塑料垃圾的产生,促进环保意识的培养。
7. 药品的包装:某种药品的包装设计过于花哨和夸张,使用了大量的颜色和图案,给消费者一种不严肃和不可靠的感觉。
简洁而专业的包装设计能够提高药品的信赖度和可靠性。
8. 家具的包装:某家具品牌的包装设计过于复杂,使用了大量的纸箱和泡沫填充物,给消费者拆包和安装带来困扰。
简化包装设计,采用简洁而坚固的包装材料,能够提高包装的便捷性和可持续性。
9. 日用品的包装:某品牌的日用品包装设计过于单调和枯燥,没有吸引消费者的注意力。
采用创意而独特的包装设计,能够增加产品的吸引力和竞争力。
10. 酒类的包装:某酒类品牌的包装设计过于普通和平凡,没有体现出产品的品质和独特性。
药品外包装管理制度

药品外包装管理制度一、目的为规范药品外包装管理,确保药品质量和安全,保护消费者健康,制定本制度。
二、适用范围本制度适用于所有药品外包装管理工作。
三、规定1. 外包装设计(1)外包装设计应符合国家药品监管部门的相关规定,严禁使用与药品不符的文字、图案、标志等。
(2)外包装应符合药品贮存、运输、使用等需求,不得出现易破损、易泄露、易受潮、易受阳光直射等缺陷。
(3)外包装应清晰标注药品名称、药品规格、药品批号、生产日期、有效期限等信息,确保消费者能够准确、便捷地了解药品情况。
2. 外包装质量(1)外包装材料应选用符合食品包装安全标准的材料,不得使用有毒有害物质制造外包装。
(2)外包装应保持整洁、完整,不得有开裂、变形、腐蚀等现象。
(3)外包装应符合相关标准,符合表面光泽度、平整度、印刷清晰度等要求。
3. 外包装用墨(1)外包装用墨应使用符合国家标准的油性墨水、水性墨水等。
(2)墨迹应牢固,不得晕开、渗透、掉色等现象。
4. 外包装印刷(1)外包装印刷应符合国家规定的卫生标准,严禁使用劣质油墨、标识不清晰、内容不准确等情况。
(2)外包装印刷的文字、图案、标志等应清晰、准确,不得出现错别字、错漏漆等现象。
5. 外包装贮存(1)外包装应存放在清洁、干燥、通风良好的环境中,避免日晒、雨淋、污渍等情况的发生。
(2)外包装应远离酸碱、有机溶剂等物质,避免发生化学反应,导致外包装质量下降。
(3)外包装应分类存放,避免与有毒有害物质混淆,造成交叉感染。
6. 外包装验收(1)外包装验收应由专门的人员进行,严格按照国家相关标准进行验收。
(2)外包装验收人员应认真履行职责,确保外包装质量合格。
7. 外包装包装(1)外包装包装应由专业的人员进行,按照国家相关标准进行包装。
(2)外包装包装应符合卫生要求,严格控制灰尘、异物等外界污染。
8. 外包装运输(1)外包装运输应选用符合国家标准的包装箱、运输车辆等。
(2)外包装运输应注意防潮、防晒、防压、防碰等,并采取相应的防护措施。
药用包装材料质量标准

药用包装材料质量标准(一)聚酯/铝/聚乙烯药品包装用复合膜、袋来源国家药品监督管理局YBB00172002本品系指聚酯(PET)与铝箔(Al)及聚乙烯(PE)通过黏合剂复合而成的膜。
本品的袋系将上述膜通过热合的方法制成。
本标准适用于固体药品包装用的复合膜、袋。
[外观] 取本品适量,照药品包装用复合膜、袋通则(试行)(YBB00132002)外观项下的方法检查,应符合规定。
[鉴别]红外光谱取本品适量,采用内表面反射方法,照分光光度法(中华人民共和国药典2000年版附录ⅣC)测定,PET及PE层应分别与对照图谱基本一致。
[阻隔性能] 水蒸气透过量照塑料薄膜和片材透水蒸气性试验方法杯式法(GBl037-88)的规定进行。
试验时PE层向湿度低的一侧,试验温度(38±2)℃,相对湿度(90±5)%,不得过0.5(g/m2·24h)。
氧气透过量照塑料薄膜和薄片气体透过性试验方法压差法(GB/T 1038-2000)的规定进行。
试验时PE层向氧气低压侧,试验温度为(23±2)℃,不得过0.5cm3/(m2·24h·0.1MPa)。
[机械性能] PE层与A1层剥离强度照药品包装用复合膜、袋通则(试行)(YBB00132002)内层与次内层剥离强度项下的方法检查,纵、横向剥高强度平均值均不得低于2.5N/15mm。
[热合强度] 膜除另有规定外,裁取100mm×100mm试片四片,将任意两个试片PE面叠合,置热封仪上进行热合,热合温度150℃~170℃,压力0.2~0.3MPa,时间1秒。
从热合的中间部位各裁取3条15mm宽的试样,进行试验。
试样应在温度23℃±2℃,相对湿度50%±5%的环境中,放置4小时以上,并在上述条件下进行试验。
以热合部位为中心线,打开呈180度,把试样的两端夹在试验机的两个夹具上,试样轴线与上下夹具中心线相重合,并松紧适宜,夹具间距离为50mm,试验速度为(300±30)mm/min,读取试样断裂时的最大载荷,平均值不得低于12N/15mm。
药品内包装名词解释

药品内包装名词解释
药品内包装是指包装在药品原包装中的小包装单位,用于保护和包装药品的最小独立单元。
以下是一些常见的药品内包装名词解释:
1. 药品瓶:通常是由玻璃或塑料制成的容器,用于装载液体或固体药品。
药品瓶通常配有密封盖和标签,以确保药品的安全和易于辨识。
2. 药品袋:一种常见的药品内包装形式,通常由塑料薄膜制成,可装载固体药品、粉末或液体。
药品袋常用于单次使用的剂量包装,易于携带和使用。
3. 药品板:药品板是一种由塑料制成的托盘状容器,内部有多个小格,用于装载药片、胶囊或其他形状的固体药品。
药品板能够对药品进行分隔和保护,方便计量和用药。
4. 制剂封(Blister):制剂封是由塑料薄膜和铝箔层构成的一种药品内包装形式。
药品通常在制剂封的每个单元格中单独包装,以确保药品的密封和稳定性。
5. 管装:一种药品内包装形式,通常用于药膏、软膏或眼药水等药品的包装。
管装通常由塑料或金属制成的软管,内部装有药品,通过挤压软管的方式取出药品。
这些是常见的药品内包装名词解释,不同药品可能使用不同的内包装形式,具体的名词和定义可能会有所不同。
在选择和使用药品时,应仔细阅读药品包装上的说明和标签,按照医生或药
师的建议正确使用药品,并妥善处理和储存药品内包装。
药品包装管理规定

药品包装管理规定
是指相关法律法规、政府文件、行业标准等对药品包装进行管理的规定和要求。
以下是一些常见的药品包装管理规定:
1. 国家食品药品监督管理局发布了《药品包装管理办法》,对药品包装的生产、使用、销售等环节进行了详细规定。
2. 药品包装必须符合药品法规和药品包装标准的要求,包括包装材料的选用、包装容积和规格、标签和说明书的要求等。
3. 药品包装必须保证药品的质量和安全性,防止药品受到污染、变质和损坏。
4. 药品包装必须注明药品的名称、规格、生产日期、有效期、批号、生产企业名称等信息,以便用户正确使用和识别药品。
5. 药品包装必须符合环境保护要求,尽量减少包装材料的使用量和废弃物的产生。
6. 药品包装的生产、销售和使用必须符合相关法律法规的要求,不得进行虚假宣传、欺骗消费者等违法活动。
以上是一些常见的药品包装管理规定,具体的管理规定还会根据国家、地区和行业的不同而有所差异。
第 1 页共 1 页。
药品包装\标签有关问题的解释

闫子轩发表于2007-1-30 13:49关于《药品说明书和标签管理规定》有关问题解释的通知国食药监注[2007]49号各省、自治区、直辖市食品药品监督管理局(药品监督管理局):《药品说明书和标签管理规定》(局令24号,以下简称《规定》)及其实施公告(国食药监注〔2006〕100号)、《关于进一步规范药品名称管理的通知》(国食药监注〔2006〕99号)发布后,国家局陆续收到一些省局、协会以及企业的来函,要求对其中的部分内容进行解释。
经研究,现就有关问题明确如下。
一、药品说明书和标签修改的补充申请已经批准注册的药品,其说明书和标签的格式、内容不符合《规定》的,均应当根据《关于实施〈药品说明书和标签管理规定〉有关事宜的公告》(以下简称《公告》)的要求提出补充申请。
化学药品、生物制品说明书和标签修改的补充申请按照《药品注册管理办法》关于补充申请的要求执行。
国产药品由省级药品监督管理部门受理和审批并报国家局备案,省级药品监督管理部门审批日期为核准日期。
进口药品由国家局受理和备案,备案日期为核准日期。
进口分包装药品的说明书和标签应在进口药品说明书和标签同意备案后,报省级药品监督管理部门审批,其内容除分包装信息外,应当与进口药品的说明书和标签一致。
中药、天然药物说明书和标签修改的补充申请按照《关于印发中药、天然药物处方药说明书格式内容书写要求及撰写指导原则的通知》(国食药监注〔2006〕283号)执行。
非处方药说明书和标签修改的补充申请按照《药品注册管理办法》的要求执行,进口药品由国家局受理和备案,备案日期为修订日期。
药品生产企业提出补充申请时提交的药品说明书和标签可以是实样,也可以是设计样稿。
二、药品名称的使用药品通用名称必须使用黑色或者白色,不得使用其他颜色。
浅黑、灰黑、亮白、乳白等黑、白色号均可使用,但要与其背景形成强烈反差。
根据《关于进一步规范药品名称管理的通知》(国食药监注〔2 006〕99号),自2006年6月1日起,属于下列情形的药品可以申请使用商品名称:(一)新化学结构、新活性成份且在保护期、过渡期或者监测期内的药品;(二)在我国具有化合物专利,且该专利在有效期内的药品。
药品包装常识

药包产品国标一、设计要求:1、药品的标签应当以说明书为依据,其内容不得超出说明书的范围,不得印有暗示疗效、误导使用和不适当宣传产品的文字和标识。
2、药品包装必须按照规定印有或者贴有标签,不得夹带其他任何介绍或者宣传产品、企业的文字、音像及其他资料。
3、药品说明书和标签的文字表述应当科学、规范、准确。
4、非处方药说明书还应当使用容易理解的文字表述,以便患者自行判断、选择和使用。
5、药品说明书和标签中的文字应当清晰易辨,标识应当清楚醒目,不得有印字脱落或者粘贴不牢等现象,不得以粘贴、剪切、涂改等方式进行修改或者补充。
6、药品说明书和标签应当使用国家语言文字工作委员会公布的规范化汉字,增加其他文字对照的,应当以汉字表述为准。
7、出于保护公众健康和指导正确合理用药的目的,药品生产企业可以主动提出在药品说明书或者标签上加注警示语,国家食品药品监督管理局也可以要求药品生产企业在说明书或者标签上加注警示语。
8、药品说明书应当包含药品安全性、有效性的重要科学数据、结论和信息,用以指导安全、合理使用药品。
药品说明书的具体格式、内容和书写要求由国家食品药品监督管理局制定并发布。
9、药品说明书对疾病名称、药学专业名词、药品名称、临床检验名称和结果的表述,应当采用国家统一颁布或规范的专用词汇,度量衡单位应当符合国家标准的规定。
10、药品说明书应当列出全部活性成份或者组方中的全部中药药味。
注射剂和非处方药还应当列出所用的全部辅料名称。
药品处方中含有可能引起严重不良反应的成份或者辅料的,应当予以说明。
11、药品说明书应当充分包含药品不良反应信息,详细注明药品不良反应。
药品生产企业未根据药品上市后的安全性、有效性情况及时修改说明书或者未将药品不良反应在说明书中充分说明的,由此引起的不良后果由该生产企业承担。
12、药品说明书核准日期和修改日期应当在说明书中醒目标示。
二、标签要求:1、药品的标签是指药品包装上印有或者贴有的内容,分为内标签和外标签。
各类药品包装规格及尺寸对照表

各类药品包装规格及尺寸对照表药品包装规格
以下是各类药品的常见包装规格:
1. 药片类:常见规格有100片、500片和1000片。
2. 软胶囊类:常见规格有30粒、60粒和90粒。
3. 注射剂类:常见规格有10ml、20ml和50ml。
4. 颗粒剂类:常见规格有5g、10g和20g。
5. 口服液类:常见规格有60ml、100ml和200ml。
6. 头孢类药品:常见规格有0.5g、1g和2g。
7. 针剂类:常见规格有2ml、5ml和10ml。
8. 眼药水类:常见规格有10ml、15ml和30ml。
药品尺寸对照表
以下是药品包装规格与尺寸的对照表:
以上是常见药品的包装规格和尺寸对照表,供参考之用。
请注意,实际产品的尺寸可能会有所不同,具体以实际包装为准。
药品类产品包装设计研究

根据药品的特性和设计要求,选择合适的材料和工艺,如纸质、塑 料、金属等材料,以及印刷、烫金、UV等工艺。
方案评估与优化
内部评审
将草图方案提交给设计团队进行内部评审,从视觉效果、结构合 理性、材料选择等方面对方案进行评估。
修改与优化
根据内部评审的意见,对草图方案进行修改和优化,如调整色彩 搭配、完善结构设计、选择更合适的材料等。
药品包装设计趋势
01 02
趋势一
环保与可持续发展。近年来,越来越多的药品包装设计师开始关注环 保和可持续发展,选择可降解、可循环利用的包装材料,减少不必要 的包装,简化包装结构等。
趋势二
人性化设计。为了提高患者使用体验,药品包装设计越来越注重人性 化因素,如易于开启、易于使用、符合人体工程学等。
03
详细描述
传统中药药品包装设计应融入传统元素和文化特色,如 使用传统的图案和颜色,体现中药文化的独特性。同时 要营造高端感,体现中药药品的高品质形象。
05
药品包装设计的挑战与对 策
设计中的安全性问题
确保包装材料的安全性
01
药品包装应使用符合国家或地区安全标准的材料,避免使用含
有有害物质的材料。
保障药品的密封性
外部评审
邀请相关领域的专家或潜在消费者对优化后的方案进行外部评审 ,收集多方面的意见和建议。
最终方案确定与实施
最终方案确定
综合内部和外部评审的意见,确定最终的包装设计方案。
方案实施
按照最终方案进行实际制作,包括打样、样品测试、小批量生 产等环节。
质量检测
对制作完成的药品包装进行质量检测,确保符合国家相关法规 和标准,如材料的安全性、印刷质量等。
加强产品附加值
药品包装规范

【药品名称】、【规格】、【生产批号】、【生产日期】、【有效期】、【贮藏】、【包装】、【批准文号】、【生产企业】及运输注意事项或其它标记。
七、经批准异地生产的药品,其包装、标签还应标明集团名称、生产企业、生产地点;经批准委托加工的药品,其包装、标签还应标明委托双方企业名称、加工地点。
八、凡在中国境内销售和使用的药品,包装、标签所用文字必须以中文为主并使用国家语言文字工作委员会公布的现行规范文字。民族药可增加本民族文字。企业根据需要,在其药品包装上可使用条形码和外文对照;获我国专利的产品,亦可标注专利标记和专利号,并标明专利许可的种类。
二、药品包装、标签上印刷的内容对产品的表述要准确无误,除表述安全、合理用药的用词外,不得印有各种不适当宣传产品的文字和标识,如“国家级新药”、“中药保护品种”、“GMP认证”、“进口原料分装”、“监制”、“荣誉出品”、“获奖产品”、“保险公司质量保险”、“公费报销”、“现代科技”、“名贵药材”等。
五、麻醉药品、精神药品、医疗用毒性药品、放射性药品等特殊管理的药品、外用药品、非处方药品在其大包装、中包装、最小销售单元和标签上必须印有符合规定的标志;对贮藏有特殊要求的药品,必须在包装、标签的醒目位置中注明。
六、进口药品的包装、标签除按本细则规定执行外,还应标明“进口药品注册证号”或“医药产品注册证号”、生产企业名称等;进口分包装药品的包装、标签应标明原生产国或地区企业名称、生产日期、批号、有效期及国内分包装企业名称等。
2、直接接触内包装的外包装标签内容包括:
【药品名称】、【成份】、【规格】、【适应症】、【用法用量】、【贮藏】、【不良反应】、【禁忌症】、【注意事项】、【包装】、【生产日期】、【生产批号】、【有效期】、【批准文号】及【生产企业】。由于包装尺寸的原因而不能注明不良反应、禁忌症、注意事项,均应注明“详见说明书”字样。对预防性生物制品,上述【适应症】项均应列为【接种对象】。
国家药品包装规范细则

国家药品包装规范细则2008年8月13日一、药品包装、标签必须按照国家药品监督管理局规定的要求印制,其文字及图案不得加入任何未经审批同意的内容。
药品的包装分为内包装和外包装。
药品包装、标签内容不得超出国家药品监督管理局批准的药品说明书所限定的内容。
二、药品包装、标签上印刷的内容对产品的表述要准确无误,除表述安全、合理用药的用词外,不得印有各种不适当宣传产品的文字和标识,如“国家级新药”、“中药保护品种”、“GMP认证”、“进口原料分装”、“监制”、“荣誉出品”、“获奖产品”、“保险公司质量保险”、“公费报销”、“现代科技”、“名贵药材”等。
药品商品名须经国家药品监督管理局批准后方可在包装、标签上使用。
商品名不得与通用名连写,应分行。
商品名经商标注册后,仍须符合商品名管理的原则。
通用名与商品名用字的比例不得小于1:2(指面积)。
通用名字体大小应一致,不加括号。
未经国家药品监督管理局批准作为商品名使用的注册商标,可印刷在包装标签的左上角或右上角,其字体不得大于通用名的用字。
三、同一企业,同一药品的相同规格品种(指药品规格和包装规格两种),其包装、标签的格式及颜色必须一致,并不得使用不同的商标。
同一企业的相同品种如有不同规格,其最小销售单元的包装、标签应明显区别或规格项应明显标注。
四、药品的最小销售单元,系指直接供上市药品的最小包装。
每个最小销售单元的包装必须按照规定印有标签并附有说明书。
五、麻醉药品、精神药品、医疗用毒性药品、放射性药品等特殊管理的药品、外用药品、非处方药品在其大包装、中包装、最小销售单元和标签上必须印有符合规定的标志;对贮藏有特殊要求的药品,必须在包装、标签的醒目位置中注明。
六、进口药品的包装、标签除按本细则规定执行外,还应标明“进口药品注册证号”或“医药产品注册证号”、生产企业名称等;进口分包装药品的包装、标签应标明原生产国或地区企业名称、生产日期、批号、有效期及国内分包装企业名称等。
药品外包装名词解释

药品外包装名词解释
药品外包装指的是药品的包装材料和包装方式。
其功能主要有以下几个方面:
1. 保护药品:药品外包装主要是为了保护药品不受光照、温度、湿度等环境因素的影响,减少药品的质量损失和变化。
同时还能防止药品外泄或被非法使用,保障药品的安全性。
2. 便于携带和使用:药品外包装设计合理,方便携带和储存,便于用户使用。
一般包含药品的包装盒、瓶子或袋子等,可以为用户提供方便的取药或服药方式。
3. 标识和信息传递:药品外包装上通常会标示药品的名称、规格、剂量、生产厂家、批号、有效期等重要信息,方便用户辨识和使用。
其中还会有使用说明书、相关警示标识等,提醒用户正确使用药品,并遵循相应的注意事项。
4. 宣传和推广:药品外包装也可以起到宣传和推广的作用,通过设计精美的包装,可以提升药品的形象和认知度,吸引患者购买和使用。
总的来说,药品外包装不仅仅是为了保护药品的完整性和安全性,还需要考虑用户的方便使用和有效信息的传递,以及提升药品品牌形象和市场竞争力等因素。
药品经营质量管理规范考试试卷(含答案)

药品经营质量管理规范考试试卷姓名:药店名称:分数:一、填空题(共20分)(每空2分)1、企业应按照依法批准的经营方式和经营范围,从事药品经营活动。
2、企业质量管理机构应负责药品质量的查询和药品质量事故或质量投诉的调查、处理及报告。
3、满足药品分类保管和储存要求的库房及常温库温度为10-30℃,阴凉库存温度不高于20℃,冷库存温度为2-10℃,各库房相对湿度应保持在35%-75%之间。
5、验收药品的记录应保存至超过药有效期 1 年,不得少于 5 年。
一、单选提(每小题3分,共30分)1、《药品经营质量管理规范》(卫生部令第 90 号)自起施行。
(D )A.2013 年 02 月 19 日 B.2013 年 01 月 01 日C.2013 年 01 月 22 日 D.2013 年 06 月 01 日2、记录及凭证应当至少保存年。
( C )A.2 年 B.3 年 C.5 年 D.1 年3、储存药品的相对湿度为。
( B )A.45%-75% B.35%-75% C.50%-70% D.35%-70%5、企业销售药品,应当如实开具发票,做到一致。
( D )A.票、账、货 B.票、货、款 C.货、账、款 D.票、账、货、款6、企业应当定期对药品采购的整体情况进行综合评审,建立档案,并进行动态跟踪管理。
( D )A.药品质量 B.药品质量评审C.供货单位 D.药品质量评审和供货单位质量7、企业应当对药品供货单位、购货单位的质量管理体系进行评价,确认其 ,必要时进行实地考察。
( A )A.质量保证能力和质量信誉 B.质量保证能力C.质量信誉 D.药品质量8、企业质量管理体系应当与其经营范围和规模相适应,包括等。
( D )A.组织机构、人员、设施设备、质量管理体系文件B.组织机构、人员、设施设备、计算机系统C.组织机构、人员、质量管理体系文件及相应的计算机系统D.组织机构、人员、设施设备、质量管理体系文件及相应的计算机系统9、药品经营企业应当坚持。
药品包装标签和说明书管理规定

药品包装标签和说明书管理规定
通常由国家食品药品监督管理局或类似机构制定和管理。
以下是一些常见的规定:
1. 标签内容:药品包装标签应包括以下内容:药品名称、药品规格、批准文号、生产企业名称和地址、药品生产日期和有效期、储存条件、使用方法和剂量、不良反应和禁忌、警示语等。
2. 标签格式:药品包装标签应采用易于阅读、清晰明了的字体和图像,并要求标签上的文字和图像不可被磨损、剥落或模糊。
3. 标签语言:药品包装标签的语言应使用国家规定的官方语言,必要时可在标签上使用其他语言的翻译。
4. 说明书内容:药品说明书应提供详细的用药信息,包括适应症、禁忌症、用药方法与剂量、不良反应与预防、药物相互作用、特殊人群用药注意事项等。
5. 说明书格式:药品说明书应采用清晰明了的排版格式,字体大小适中,容易阅读并理解。
6. 修改和更新:药品包装标签和说明书的修改和更新需经过授权或批准,并应及时通知市场和使用者。
7. 警示标识:药品包装标签上可能需要加入警示标识,如儿童不宜、易碎、易爆等。
8. 存档管理:对于药品包装标签和说明书的变更、修改、更新或废弃,应有相应的存档管理。
需要注意的是,具体的药品包装标签和说明书管理规定可能因国家、地区和药品种类的不同而有所差异,以上规定仅供参考。
10放射性药品包装的标签规定

10、技術性指示第01/2005 號
事由:放射性藥品包裝的標籤規定
根據九月十九日第59/90/M 號法令第三條的規定以及九月十九日第
58/90/M 號法令第七十七條所賦與的權限,為了維護公眾健康以及保障消費者,現規定進入澳門特別行政區巿場的所有放射性藥品,其包裝及容器的標籤資料必須符合以下規定:
1. 容器的標籤必須標示:
(1)藥品的名稱;
(2)放射性核素的名稱;
(3)製造商或產品持有人的名稱;
(4)批號;
(5)倘若為液體及氣體製劑,須標示在指定日期及小時(若需要時)容器內所具有的總放射性或每毫升液體中所含的放射性濃度,同時亦須標示容器內液體的容積;
(6)倘若為固體製劑,如凍乾製劑,須標示在指定日期及小時(若需要時)容器內所具有的總放射性;
(7)倘若為膠囊,須標示在指定日期及小時(若需要時)每一膠囊所具有的放射性,同時亦須標示容器內膠囊的總數。
2. 包裝的標籤必須標示:
(1)成份的名稱及含量;
(2)投藥途徑;
(3)有效期;
(4)特殊貯存條件。
3. 以上決定於公布日起生效。
二零零五年五月十三日於衛生局局長瞿國英。
药品包装规格及示意图
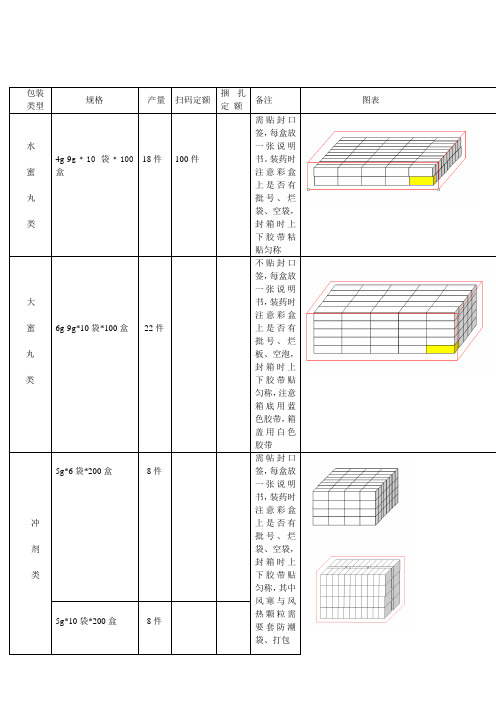
包装类型规格产量扫码定额捆扎定额备注图表水蜜丸类4g-9g﹡10袋﹡100盒18件100件需贴封口签,每盒放一张说明书。
装药时注意彩盒上是否有批号、烂袋、空袋,封箱时上下胶带粘贴匀称大蜜丸类6g-9g*10袋*100盒22件不贴封口签,每盒放一张说明书,装药时注意彩盒上是否有批号、烂板、空泡,封箱时上下胶带贴匀称,注意箱底用蓝色胶带,箱盖用白色胶带5g*10袋*120盒13件8g-11g*10袋*100盒15件87件瓶装类需贴封口签,每盒放一张说明书,装药时注意彩盒上是否有批号、少瓶、斜盖、瓶身无签、瓶盖无感影膜、瓶签贴斜、封口封糊,装箱时漏装,封箱时上下胶带贴匀称,甘草与山渣精红霉素肠溶片须打包100片*10瓶*36盒24件140件复合膜类24片*30袋*18盒31件需贴封口签,每盒放一张说明书,装药时注意彩盒上是否有批号、烂袋、空袋、少袋、多袋,装箱时多盒少盒,封箱时上下胶带粘匀称,其中24片*60袋的放20张说明书36片*30袋*18盒31件24片*40袋*18盒29件24片*60袋*32盒13件50片*20袋*32盒19件铝塑板类10粒*25板*40盒15件需贴封口签,每盒放10张说明书,装药时注意彩盒上是否有批号、数量多装、少装、空泡、烂板装箱时少盒,封箱时上下胶袋粘匀称12粒*30板*32盒17件12片*40板*32盒13件12粒*4板*200盒12件150件不贴封口签,每盒放一张说明书,装药时注意彩盒上是否有见附图2 12片*5板*300盒8件附图2附图1。
11药品包装检查标准

藥品包裝檢查標準目的: 規範藥品包裝的質量監控。
適用範圍: 片劑、膠囊劑的藥品外觀及包裝檢查。
責任:質檢員、車間質量管理人員及包裝操作工人有責任正確實施本藥品包裝驗收標準。
規程:1.药品外观检查:片剂的检验外观检查:主要检查色泽、斑点、异物、麻面、吸潮、粘连、发霉、粘冲、边缘不整、缺角、松片、黑点等。
检查方法:取100片平铺于白纸上,距25cm处检视,只看一面。
要求片形厚薄一致,片面光洁细腻,色均匀,无粘冲、无异物、无吸潮,不得有明显的暗斑。
边缘不整、缺角、松片不超过1%,80~100目杂点不超过3%。
包衣片的验收:包衣片包括糖衣片、肠溶片和薄膜衣片三种,外观检查主要有:色泽、黑点、斑点、异物、花斑、瘪片、异形片、龟裂、脱壳、珠头等。
检查方法:取100片平铺于白纸上,距25cm处检视,只看一面。
包衣应完整、光亮、色均、无明显花斑、珠头、龟裂等不良品不超过1%,大于80目杂点不得有,80~100目杂点不超过2%。
硬胶囊剂的验收:外观检查:主要检查色泽、漏药、破裂、变形、粘连、异臭、霉变等。
检查方法:取100粒胶囊,距25cm处检视,只看一面。
外观整洁,大小长短一致,带色的胶囊颜色应均匀一致,有光泽度,不得有褪色、变色现象,无斑点,无砂眼、破裂、漏药、附粉、变形、异臭、发霉等现象。
梅花、皱皮、缺角、瘪头、气泡等不超过1%。
2.包装检查:装量检查:瓶装:小于100片(粒)装:抽检10个包装单位;判定标准:不得有误差。
如有1个包装单位误差±1片(粒),可进行加倍抽样复查,以复查结果为准,判定标准:同上。
100片(粒)装,抽检10个包装单位;如有2个包装单位出现误差±1片(粒),或有1个包装单位出现误差±2片(粒),可进行加倍抽样复查,以复查结果为准,判定标准:同上。
100~500片装(用天平称量),抽检10个包装单位。
判定标准:允许每瓶误差范围在±5片。
大于500片装(用天平称量),抽检5个包装单位。
药物封包操作流程

药物封包操作流程封包是药品包装过程中的重要环节,确保药物的安全性和完整性。
下面是药物封包的操作流程:1. 准备工作:- 准备所需的封包材料,如密封袋、标签、包装纸等。
- 检查封包设备和工具的正常运行状态。
2. 药物准备:- 按照药物配方,准确测量所需的药物剂量。
- 将药物放置在干净、无菌的中。
3. 密封袋准备:- 打开一个干净的密封袋。
- 根据药物信息,填写标签,并将其粘贴在密封袋上。
4. 药物封包:- 将准备好的药物放入密封袋中,并确保袋内无空气。
- 将药物密封并确保封口牢固。
5. 标签贴附:- 将标签上的信息与药物上的信息进行核对,确保准确无误。
- 将标签粘贴在药物上的适当位置。
6. 包装纸包裹:- 用干净的包装纸将药物进行包裹,并进行固定,防止损坏或变形。
7. 封装:- 确保药物被完全封装在包装纸中。
- 使用适当的封装技术,如热封或胶带封口,确保包装纸的密封性。
8. 检查:- 对封装好的药物进行外观检查,确保包装无破损或污染。
- 核对上的标签信息与封包前的药物配方信息是否一致。
9. 记录:- 记录封包操作的相关信息,包括封包人员、日期和封包结果。
10. 清理:- 完成封包操作后,清理工作区,确保无杂物或污染物。
以上是药物封包的操作流程,按照流程进行封包操作,有助于提高药物的安全性和质量。
在操作过程中,务必保持环境的洁净和无菌,避免任何可能导致药物污染或损坏的因素。
同时,根据相关法律法规和标准进行操作,确保封包符合规定的要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第10节-药品包装Packaging of Pharmaceuticalsthe compliance groupStan O’NeillChapter 3 第三章•Principle 原则•Premises and equipment must be located, designed, constructed, adapted and maintained to suit the operations to be carried out. Their layout and design must aim tominimise the risk of errors and permit effective cleaning and maintenance in order to avoid crosscontamination, build up of dust or dirt and, in general, any adverse effect on thequality of products.•厂房与设备的选址,设计,建造,改造及维护必须适用于所实施的操作。
为避免交叉污染,积灰以及对产品质量不良影响,厂房和设备的设计和布局必须能最大限度降低发生差错的风险,有便于有效清洁和维护。
Chapter 3 第三章• 3.7 Premises should preferably be laid out in such a way as to allow the production to take place in areas connected in a logical order corresponding to the sequence of the operations and to the requisite cleanliness levels.• 3.7款:厂房应当最好按生产工艺流程及相应洁净级别要求合理布局。
Chapter 3 第三章• 3.8 The adequacy of the working and in-process storage space should permit the orderly and logical positioning of equipment and materials so as to minimise the risk ofconfusion between different medicinal products or their components, to avoid cross-contamination and tominimise the risk of omission or wrong application of any of the manufacturing or control steps• 3.8款:工作区和中间物料存贮区应有足够的空间,以有序地存放设备和物料,避免不同药品或组分混淆、避免交叉污染、避免制造或质量控制操作发生遗漏或差错。
Chapter 3 第三章• 3.15 Premises for the packaging of medicinal products should be specifically designed and laid out so as to avoid mix-ups or cross-contamination.• 3.15款:用于药品包装的厂房应专门设计和布局,以避免混淆或交叉污染。
Chapter 3 第三章• 3.16 Production areas should be well lit, particularly where visual on-line controls are carried out.• 3.16款:生产区应有足够的照明,特别是产品在线目检区。
Chapter 3 第三章•Storage Areas 储存区• 3.18 Storage areas should be of sufficient capacity to allow orderly storage of the various categories ofmaterials and products: starting and packagingmaterials, intermediate, bulk and finished products, products in quarantine, released, rejected, returned or recalled.• 3.18款:储存区应有足够的空间,以便有序地存放各类物料和产品:起始物料、包装材料、中间体、半成品与成品,以及待验、合格、不合格、退回或召回的产品等。
Chapter 3 第三章• 3.25 Printed packaging materials are considered critical to the conformity of the medicinal product and special attention should be paid to the safe and secure storage of these materials.• 3.25款:印刷好的包装材料是确保药品标识正确的关键,应特别注意安全贮存。
Chapter 4 第四章•Packaging Instructions 包装指令• 4.16 There should be formally authorised Packaging Instructions for each product, pack size and type. These should normally include, or have a reference to, the following:• 4.16款:每一产品的每一规格,每一包装量及类型均应有各自的经正式批准的包装指令。
包装指令通常应包括下述内容或参照:Chapter 4 第四章•a) name of the product; 产品名称;•b) description of its pharmaceutical form, and strength where applicable;•产品剂型与含量描述;•c) the pack size expressed in terms of the number, weight or volume of the product in the final container;•以最终容器中产品的数量,重量或体积表示的包装量;Chapter 4 第四章•d) a complete list of all the packaging materials required for a standard batch size, including quantities, sizes and types, with the code or reference number relating to the specifications of each packaging material;•标准批量所需全部包装材料的完整清单,包括包装材料的数量,规格,类型以及与质量标准有关的每一包装材料的代码或代号;Chapter 4 第四章•e) where appropriate, an example or reproduction of the relevant printed packaging materials, and specimens indicating where to apply batch number references, and shelf life of the product;•如果可能,印刷好的包装材料样张或复制品,以及标明产品批号,有效期打印位置的样张;Chapter 4 第四章•f) special precautions to be observed, including a careful examination of the area and equipment in order to ascertain the line clearance beforeoperations begin; 需要说明的特别注意事项,包括对生产区和设备进行仔细检查,在包装操作开始前,确认包装生产线的清场已经完成等;•g) a description of the packaging operation, including any significant subsidiary operations, and equipment to be used;•包装操作的说明,包括重要的辅助性操作和所用设备;Chapter 4 第四章•h) details of in-process controls with instructions for sampling and acceptance limits.•中间控制的详细操作,包括取样方法及合格标准。
Chapter 4 第四章•Batch Packaging Records 批包装记录• 4.18 A Batch Packaging Record should be kept for each batch or part batch processed. It should be based on the relevant parts of the Packaging Instructions and the method of preparation of such records should be designed to avoid transcription errors. The record should carry the batch number and the quantity of bulk product to be packed, as well as the batch number and the planned quantity of finished product that will be obtained.Chapter 4 第四章• 4.18款:每批产品或每批部分产品的包装,都应有批包装记录。
包装记录应以包装指令的相关内容为依据。
记录的设计,应注意避免抄录差错。
批包装记录应有待包装产品的批号,数量以及成品的批号和计划数量。
Chapter 4 第四章•Before any packaging operation begins, there should be recorded checks that the equipment and work station are clear of previous products, documents or materials not required for the planned packaging operations, and that equipment is clean and suitable for use.•包装开始前,应进行检查,确保设备和工作场所无上批遗留的产品,文件或与本批包装无关的物料,设备应处于已清洁及待用状态。
