2016高考化学二轮复习习题专题10水的电离和溶液的酸碱性.doc
高考化学讲义水的电离和溶液的酸碱性(含解析)

目夺市安危阳光实验学校第二节水的电离和溶液的酸碱性1.了解水的电离、离子积常数。
(中频)2.了解溶液pH的定义,能进行pH的简单计算。
(中频)3.了解测定溶液pH的方法。
4.掌握酸碱中和滴定的原理及操作方法。
(中频)水的电离1.电离方程式水是一种极弱的电解质,其电离方程式为2H2O H3O++OH-,可简写为H2O OH-+H+。
2.几个重要数据3.外界因素对水的电离平衡的影响(1)温度:温度升高,促进水的电离,Kw增大;温度降低,抑制水的电离,Kw 减小。
(2)酸、碱:抑制水的电离,Kw不变。
(3)能水解的盐:促进水的电离,Kw不变。
溶液的酸碱性与pH1.溶液的酸碱性溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。
c(H+)>c(OH-),溶液呈酸性c(H+)=c(OH-),溶液呈中性c(H+)<c(OH-),溶液呈碱性2.pH(1)定义式:pH=-lg_c(H+)。
(2)pH与溶液c(H+)的关系①由图示关系知,pH越小,溶液的酸性越强。
②pH一般表示c(H+)<1 mol/L的稀溶液。
(3)pH测定①用pH试纸测定把小片试纸放在表面皿上,用玻璃棒蘸取待测液点在干燥的pH试纸上,试纸变色后,与比色卡对比即可确定溶液的pH。
②pH计测定:可精确测定溶液的pH。
酸碱中和滴定1.实验原理(1)用已知浓度的酸(或碱)滴定未知浓度的碱(或酸),根据中和反应的等量关系来测定酸(或碱)的浓度。
(2)利用酸碱指示剂明显的颜色变化表示反应已完全,即反应到达终点。
指示剂变色范围的pH石蕊<5.0红色 5.0~8.0紫色>8.0蓝色甲基橙<3.1红色 3.1~4.4橙色>4.4黄色酚酞<8.2无色8.2~10.0粉红色>10.0红色2.实验用品(1)仪器:酸式滴定管(如图A)、碱式滴定管(如图B)、滴定管夹、铁架台、锥形瓶。
(2)试剂:液、待测液、指示剂、蒸馏水。
高考化学复习高考化学二轮专题提分训练:水的电离和溶液的酸碱性(含详解).docx

高中化学学习材料唐玲出品水的电离和溶液的酸碱性一、选择题(本题包括10小题,每小题6分,共60分)1.(2014·厦门模拟)25℃时水的K W=1.0×10-14,而100℃时水的K W=5.5×10-13。
若在100℃时某溶液的c(H+)=1.0×10-7mol·L-1,则该溶液( )A.呈酸性B.呈中性C.呈碱性D.可能呈酸性,也可能呈碱性2.下列操作中,能使H 2O H++OH-平衡向右移动且溶液呈酸性的是( )A.向水中加入H2SO4溶液B.向水中加入Al2(SO4)3固体C.向水中加入NaHCO3溶液D.向水中通入氨气3.将pH=1的盐酸平均分成两份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液,pH都升高了1,则加入的水与NaOH溶液的体积比为( )A.9B.10C.11D.124.(2014·抚州模拟)已知100℃时,水的离子积常数K W=1×10-12,对于该温度下pH为1的硫酸,下列叙述正确的是( )A.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和B.该溶液中硫酸电离出的c(H+)与水电离出的c(H+)之比为10-10C.等体积的该硫酸与室温下pH为1的硫酸中和碱的能力相同D.该溶液中水电离出的c(H+)是pH为3的硫酸中水电离出的c(H+)的100倍5.(2014·岳阳模拟)能说明0.1 mol·L-1的NaHA溶液一定呈酸性的是( )①稀释时,溶液中c(OH-)增大②溶液的pH<7 ③溶液中c(Na+)=c(A2-) ④溶液可与等体积等物质的量浓度的NaOH溶液恰好反应A.①②③④B.①③④C.①③D.②④6.下列叙述正确的是( )A.将一定体积盐酸溶液加水到原来体积的m倍,则pH增大mB.在NaHCO3溶液中,c(Na+)=c(HC)+c(H2CO3)C.25℃,pH=8的NaOH溶液和pH=8的氨水中,由水电离出的c(OH-)不相等D.25℃,pH=13的Ba(OH)2溶液和pH=1的盐酸中均存在:c(H+)·c(OH-)=1×10-147.T℃下的溶液中,c(H+)=10-x mol·L-1,c(OH-)=10-y mol·L-1,x与y的关系如图所示。
弱电解质的电离、水的电离和溶液的酸碱性知识点总结及习题

弱电解质的电离、水的电离和溶液的酸碱性知识点总结及习题一、弱电解质的电离1、定义:电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。
非电解质:在水溶液中或熔化状态下都不能导电的化合物。
强电解质:在水溶液里全部电离成离子的电解质。
弱电解质:在水溶液里只有一部分分子电离成离子的电解质。
混和物物质单质强电解质:强酸,强碱,大多数盐。
如 HCl 、NaOH、 NaCl、 BaSO4纯净物电解质弱电解质:弱酸,弱碱,极少数盐,水。
如 HClO 、NH 3·H2O、Cu(OH)2、化合物H2O,,。
如 SO3、CO 2、C6H12O6、CCl 4、CH 2=CH2,,非电解质:非金属氧化物,大部分有机物2、电解质与非电解质本质区别:电解质——离子化合物或共价化合物非电解质——共价化合物注意:①电解质、非电解质都是化合物② SO2、NH3、CO2等属于非电解质③强电解质不等于易溶于水的化合物(如BaSO4不溶于水,但溶于水的 BaSO 全部4电离,故 BaSO4为强电解质)——电解质的强弱与导电性、溶解性无关。
3、电离平衡:在一定的条件下,当电解质分子电离成离子的速率和离子结合成时,电离过程就达到了平衡状态,这叫电离平衡。
4、影响电离平衡的因素:A、温度:电离一般吸热,升温有利于电离。
B、浓度:浓度越大,电离程度越小;溶液稀释时,电离平衡向着电离的方向移动。
C、同离子效应:在弱电解质溶液里加入与弱电解质具有相同离子的电解质,会减弱电离。
D、其他外加试剂:加入能与弱电解质的电离产生的某种离子反应的物质时,有利于电离。
9、电离方程式的书写:用可逆符号弱酸的电离要分布写(第一步为主)10、电离常数:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积,跟溶液中未电离的分子浓度的比是一个常数。
叫做电离平衡常数,(一般用 Ka 表示酸, Kb 表示碱。
)表示方法: AB A++B-Ki=[ A+][ B - ]/[AB]11、影响因素:a、电离常数的大小主要由物质的本性决定。
2019高考化学二轮复习-专题10-水的电离和溶液的酸碱性练习

第一部分专题十水的电离和溶液的酸碱性一、选择题1.室温下,水的电离达到平衡:H2++OH-。
下列叙述正确的是( )A.将水加热,平衡向正反应方向移动,K W不变B.向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大C.向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低D.向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)=c(H+)解析:本题考查水的电离平衡的影响因素,意在考查考生的分析能力。
加热时,水的电离平衡正向移动,K W增大,A项错误;加入少量盐酸,水的电离平衡逆向移动,但c(H+)增大,B项正确;加入少量NaOH固体,水的电离平衡逆向移动,但c(OH-)增大,C项错误;加入少量CH3COONa固体,c(H+)减小,水的电离平衡正向移动,c(OH-)增大,c(OH-)>c(H+),D项错误。
答案:B2.(2015·山西山大附中期中)25 ℃时,某溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-18,下列说法正确的是( )A.该溶液的pH可能是5 B.此溶液不存在C.该溶液的pH一定是9 D.该溶液的pH可能为7解析:由题意可知该溶液中水电离产生的c(H+)=c(OH-)=1×10-9mol·L-1,该溶液中水的电离受到抑制,可能是酸溶液,也可能是碱溶液。
若为酸溶液,则pH=5;若为碱溶液,则pH=9,故A项正确。
答案:A3.(2015·河北冀州中学第四次月考)常温下,下列各组离子或分子在指定溶液中能大量共存的是( )A.使甲基橙呈红色的溶液中:MnO-4、Al3+、C2H5OH、SO2-4B.水电离出的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、NH+4、Cl-、SiO2-3C.c(H+)/c(OH-)=1012的溶液中:NH+4、Al3+、NO-3、ClO-D.c(NaHCO3)=0.1 mol·L-1的溶液中:K+、C6H5O-、SO2-4、CO2-3解析:A项,使甲基橙呈红色的溶液呈酸性,酸性条件下MnO-4能与C2H5OH发生氧化还原反应而不能大量共存;B项,水电离出的c(H+)=1×10-14mol·L-1的溶液呈酸性或碱性,酸性条件下SiO2-3不能大量存在,碱性条件下NH+4不能大量存在,且Ca2+与SiO2-3反应生成沉淀而不能大量共存;C项,c(H+)/c(OH-)=1012的溶液呈酸性,ClO-与H+反应生成次氯酸而不能大量共存;D项,所给离子均不反应,能大量共存于溶液中。
《高三化学复习》水的电离和溶液的酸碱性_2023年学习资料

考点1、水的电离-1、水的离子积:-一定温度下,在纯水或任何稀的水溶液中,c-H+·cOH是一个常数-1只 温度影响,与溶质的种类、浓度无关,常-温时Kw=10-14,升温则Kw增大-2cH+和cOH是溶液中所有的 度-3水的电离度
影响水电离平衡的因素-H,OH++OH--条件-方向(电离程度-CH+-COH-Kw-升温-正移-增大-加 -逆移-减小-不变-加碱-NazCO3-NH.CI-CHCOONH-NaCl-都不变-NaHSO4
溶液酸碱性的判定-请指出下列混合溶液的酸碱性-.1moL1醋酸与1moL1NaOH溶液等体积混合-1moL ,SO4与1moL1NaOH溶液等体积混合-pH=2的盐酸与pH=12的NaOH溶液等体积混合-(25℃H=2的盐酸与pH=12的氨水等体积混合25℃
pH的测定:-1酸碱指示剂法:不够精确-指示剂发生颜色变化的pH值范围-变色的pH范围-HIn-过渡-甲基 -红-黄-3.14.4-酚酞-无色-粉红-8.2≈10.0-石蕊-紫-蓝-5~8-甲基红-4.46.2
结论:两強酸混合:抓住H+进行计算-C1V1+C2V2-①若不等体积混合:先求cH+总=-V1+V2-再求 H。-②若等体积混合,且△pH2:pH混=pH小+0.3
I.强碱与强减混合-[例8]在25℃时,pH值等于9和pH值等于13的两-种氢氧化钠溶液等体积混合H值等于 少?-结论:两強碱混合:抓住O进行计算-C1V1+C2V2-①若不等体积混合:先求cOH总=-再求cH+, 后求pH。-V1+V2-②若等体积混合,且△pH2:pH混=pH大0.3
溶液中水电离出cH+或cOH的大小-①中性溶液:cH+=cOH-②酸溶液:水电离c水H+=C水OH=Kw/ 酸H+-③碱溶液:水电离c水H+=C水OH=KwC减OH-④水解呈酸性或碱性的盐溶液:-H+或OH均是水电 的-如pH=4的NH,CI溶液与pH=10的NaAc溶液中,-室温由水电离出的-CH+=104mol/L与 cOH=10-4mol/L
高考化学复习 水的电离和溶液的酸碱性

加强酸弱 →
↑
↓
-
碱盐
加强碱弱 →
↓
↑
-
酸盐
说明:“→(←)”表示平衡向右(左)移动,“↑(↓)”表示离子浓度 增大(减小),“-”表示不变。
3.水电离出的c(H+)与c(OH-) 在酸性或碱性的稀溶液中,由水电离出的c(H+)和c(OH-)总 相等,即c(H+)水=c(OH-)水。如0.1 mol/LHCl或NaOH溶液 中,c(H+)水=c(OH-)水=1×10-13 mol/L。 酸中c(OH-)很小,但完全是由水电离出来的,不能忽略。同样, 碱溶液中的c(H+)也不能忽略。
第二讲 水的电离和溶液的酸碱性
杨爱兰
一、水的电离
1.水的电离
水的电离方程式:H2O+H2O
H3O++OH-。常温下纯水
中c(OH-)=10-7 mol/L,c(H+)=10-7 mol/L。
100 ℃时纯水c(H+)=1×10-6 mol/L,KW=1×10-12,pH=6, 此时溶液显中性。
影响KW的因素是温度,温度升高,KW增大,原因是水的电离
c(O H )
最后求pH。
具体情况(室温下)
(1)酸、碱溶液pH的计算
①强酸溶液,如HnA,设浓度为c mol/L,c(H+)=nc mol/L,pH=-lgc(H+)=-lg(nc)。
②强碱溶液,如B(OH)n,设浓度为c mol/L,
c(H+)= 1 0 1 4
mol/L,pH=-lgc(H+)=14+lg(nc)。
B.c(H+)=1×10-7mol/L的溶液 C.pH=14-pOH的溶液 D.pH=pOH的溶液
高考化学一轮复习:水的电离及溶液的酸碱性专题练习

高考化学一轮复习:水的电离及溶液的酸碱性专题练习一、单选题1.下列实验基本操作正确的是( )A .配制一定浓度的氢氧化钠溶液时,将氢氧化钠固体放在纸片上称量B .用碱式滴定管量取0.10 mol·L -1Na 2CO 3溶液22.10mLC .将滴管垂直伸进试管内滴加液体D .用玻璃棒蘸取溶液滴到湿润的pH 试纸上,测其pH2.设N A 为阿伏加德罗常数的值。
下列有关叙述正确的是 ( )A .25°C ,pH=13的1. 0L Ba(OH)2溶液中含有OH -的数目为0. 2N AB .标准状况下,11.2 L Cl 2溶于水,溶液中Cl -、ClO -和HClO 的微粒数之和为N AC .常温常压下,4.6 g NO 2所含的氮原子数目为0.1N AD .34 g H 2O 2中含有非极性共价键的数目为2N A3.水的电离过程为+-2H OH +OH ,在和时其离子积分别为-141.010⨯、下列说法正确的是( )A .水的电离过程是吸热过程B .()c H +随着温度升高而降低C .水的电离度()()α35C <α25C ︒︒D .在250C 时,纯水中()()c H c OH +-> 4.下列说法正确的是( )A .氯气、硫酸钡和氨水分别属于非电解质、强电解质和弱电解质B .体积不同但 pH 相同的醋酸和盐酸,分别用蒸馏水稀释至原体积的 m 倍和 n 倍,稀 释后两溶液的 pH 仍相同,而 m 和 n 无法确定相对大小C .等 pH 等体积的醋酸和硫酸,分别与足量的碳酸氢钠反应,在相同条件下,硫酸放出气体更多D .用来配制标准 NaOH 溶液的 NaOH 固体含有少量的 KOH ,此时中和测得盐酸的浓 度数值一定偏高 5.用标准的NaOH 溶液滴定未知浓度的盐酸造成测定结果偏高的原因可能是( )A .盛装标准溶液的滴定管中开始没有气泡,结束后出现了气泡B .滴定终点读数时,俯视滴定管刻度C .盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗D .滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液6.水的电离平衡曲线如图所示,下列说法正确的是( )A .图中五点K W 间的关系:B>C>A>D=EB .若从A 点到D 点,可采用在水中加入少量NaOH 的方法C .若从A 点到C 点,可采用温度不变时在水中加入适量H 2SO 4的方法D .若处在B 点时,将pH=2的硫酸与pH=12的KOH 等体积混合后,溶液显碱性7.室温下,已知某溶液中由水电离生成的H +和OH -的物质的量浓度的乘积为10-24mol 2·L -2,则在该溶液中,一定不能大量存在的离子是( )A .SO 23-B .NH 4+C .NO 3-D .HCO 3-8.常温下,下列各组离子在指定溶液中一定能大量共存的是( )A .能使石蕊显红色的溶液:K +、Mg 2+、HCO 3-、SO 24-B .水电离出来的c (H +)=10-13mol·L -1的溶液:NH 4+、Fe 2+、NO 3-、Cl - C .(H )(OH )c c +-=1012的溶液:K +、Fe 3+、Cl -、SO 24- D .加入铝片能放出H 2的溶液:Na +、CH 3COO -、Cu 2+、SO 24-9.下列关于电解质溶液的叙述正确的是( )A .常温下,在pH=7的醋酸钠和醋酸混合溶液中:c (CH 3COO -)>c (Na +)B .在pH=5的氯化钠和稀硝酸的混合溶液中:c (Na +)=c (Cl -)C .稀释醋酸溶液,溶液中所有离子的浓度均降低D .0.1 mol·L -1的硫化钠溶液中:c (H +)=c (OH -)+c (HS -)+c (S 2-)10.下列说法符合事实的是( )A .常温下由水电离产生的c (H +)=10-12mol/L 的溶液中加入铝粉都能够产生氢气B .向Na 2S 溶液中通入SO 2气体,c (H 2S)增大C .用0.2000mol/LNaOH 标准溶液滴定盐酸与CH 3COOH 的混合溶液(混合液中两种酸的浓度均约为0.1mol/L),至中性时,溶液中的酸未被完全中和D .用pH 试纸测量次氯酸钠溶液的pH 为11.511.下列与实验相关的叙述正确的是( )A .酸碱中和滴定时,加入待测液前用待测液润洗锥形瓶,将导致测定结果偏低B .用玻璃棒蘸取待测稀硫酸,点在pH 试纸中部,与标准比色卡对照,测得pH=2.7C .实验室中配制FeC13溶液时,应加入少量稀硫酸,抑制Fe 3+的水解D .测定中和热时,将NaOH 溶液一次性快速倒入装有盐酸的量热计中,搅拌测其温度12.室温时,下列混合溶液的pH 一定小于7的是( )A .pH=3的硝酸溶液和pH=11的氢氧化钾溶液等体积混合B .pH=3的醋酸和pH=11的氢氧化钾溶液等体积混合C .pH=3的硫酸溶液和pH=11的氨水等体积混合D .pH=3的盐酸和pH=11的氨水等体积混合13.已知c (NH 4Cl)<0.1 mol/L 时溶液pH >5.1,现在用0.1 mol/LHCl 滴定10 mL 0.05 mol/L 的氨水,用甲基橙作指示剂,达到终点时所用HCl 的量应是( )A .10 mLB .5 mLC .小于5 mLD .大于5 mL14.下列实验装置能达到相应实验目的的是( )A .装置<用于验证反应是否有CO 2生成B .装置<用于用标准NaOH 溶液测定盐酸浓度C .装置<用于制备少量含NaClO 的消毒液D .装置<用于比较铜、铁活泼性强弱15.下列说法不正确的是()A .在船外壳镶嵌锌块保护船身,锌为原电池的负极B .MgO 的熔点高于NaCl ,是因为MgO 的晶格能大于NaClC .31molFeCl 完全水解将产生236.0210⨯个胶体粒子D .水的离子积常数W K 随着温度的升高而增大,说明水的电离是吸热过程二、填空题16.A 、B 两种物质都是由氢、氮、氧、钠四种元素中的任意三种组成,它们的水溶液分别呈碱性和酸性。
高三化学水的电离和溶液的酸碱性试题

高三化学水的电离和溶液的酸碱性试题1.下列说法正确的是A.c( H+)>c(OH-)的溶液一定显酸性B.常温下, pH =" 6" 的溶液一定是酸溶液C.电解稀硫酸或氢氧化钠溶液的产物不同D.将纯水加热,其KW增大而pH不变【答案】A【解析】A.在任何物质的水溶液中都存在水的电离平衡,若c( H+)>c(OH-)的溶液一定显酸性,制取;B.常温下, pH =" 6" 的溶液可能是酸溶液,也可能是盐水解使溶液显酸性,错误;C.电解稀硫酸或氢氧化钠溶液实质都是电解水,所以电解的产物相同,错误;D.将纯水加热,会促进水的电离,所以其KW增大溶液中c(H+)也增大,pH减小,错误。
【考点】考查弱电解质的电离、盐的水解、电解原理及水的离子积常数和溶液pH的知识。
2.室温下,0.1mol·L-1CH3COONa溶液与 0.1 mol·L-1NaCl溶液等体积混合(忽略溶液体积变化),下列有关叙述正确的是A.混合前CH3COONa溶液中由水电离出来的c(OH—)>1×10-7 mol·L-1B.混合前NaCl溶液中:c(Na+) + c(OH—)= c(Cl-)+c(H+)C.混合溶液中:c(Cl-) >c(CH3COOH) >c(OH—)D.混合溶液中:c(Cl-) + c(CH3COO-) =0.1mol·L-1【答案】AB【解析】A、醋酸钠溶液中醋酸根离子水解会促进水的电离,使水电离产生的c(OH—) >1×10-7 mol·L-1,正确;B、根据电荷守恒,应为c(Na+) + c(H+) = c(Cl-)+ c(OH—),混合前溶液呈中性有c(H+)=c(OH—),所以交换后等式仍成立,正确;C、醋酸根离子水解产生醋酸分子和氢氧根离子,而水解使非常微弱的,所以c(OH—) >c(CH3COOH),错误;D、根据物料守恒,混合溶液中c(Cl-)+ c(CH3COO-)+ c(CH3COOH)=0.1mol/L,错误,答案选AB。
水电离和溶液酸碱性典型例题与习题
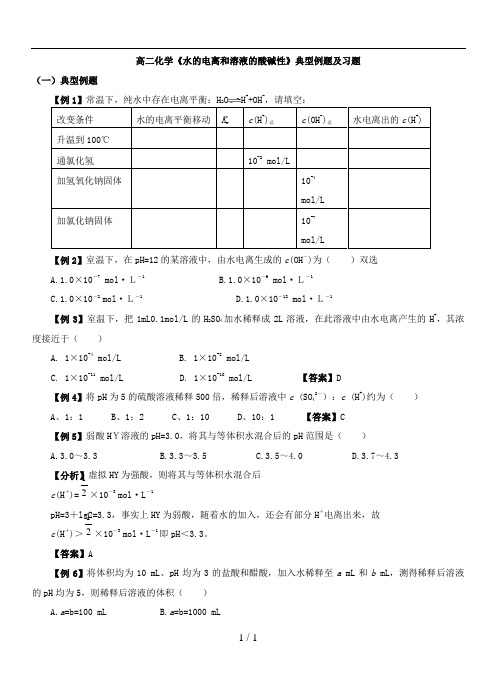
高二化学《水的电离和溶液的酸碱性》典型例题及习题(一)典型例题【例1】常温下,纯水中存在电离平衡:H 2O H ++OH -,请填空:改变条件 水的电离平衡移动 K w c (H +)总c (OH -)总水电离出的c (H +) 升温到100℃通氯化氢 10-2mol/L加氢氧化钠固体10-4mol/L加氯化钠固体 10-7mol/L【例2】室温下,在pH=12的某溶液中,由水电离生成的c (OH -)为( )双选 A.1.0×10-7mol ·L-1B.1.0×10-6 mol ·L-1C.1.0×10-2 mol ·L-1D.1.0×10-12mol ·L-1【例3】室温下,把1mL0.1mol/L 的H 2SO 4加水稀释成2L 溶液,在此溶液中由水电离产生的H +,其浓度接近于( ) A. 1×10-4mol/LB. 1×10-8mol/LC. 1×10-11mol/L D. 1×10-10mol/L 【答案】D【例4】将pH 为5的硫酸溶液稀释500倍,稀释后溶液中c (SO 42-):c (H +)约为( ) A 、1:1 B 、1:2 C 、1:10 D 、10:1 【答案】C 【例5】弱酸H Y溶液的pH=3.0,将其与等体积水混合后的pH 范围是( ) A.3.0~3.3B.3.3~3.5C.3.5~4.0D.3.7~4.3【分析】虚拟HY 为强酸,则将其与等体积水混合后c (H +)=21×10-3 mol ·L -1pH=3+lg2=3.3,事实上HY 为弱酸,随着水的加入,还会有部分H +电离出来,故 c (H +)>21×10-3 mol ·L -1即pH <3.3。
【答案】A【例6】将体积均为10 mL 、pH 均为3的盐酸和醋酸,加入水稀释至a mL 和b mL ,测得稀释后溶液的pH 均为5,则稀释后溶液的体积( )A.a =b=100 mLB.a =b=1000 mLC.a<bD.a>b【分析】盐酸是强电解质,完全电离。
2、水的电离和溶液的酸碱性 知识点讲解及练习(学生版)

(一)水的电离:1、电离方程式:&2、水的离子积Kw:Kw=c(H+)·c(OH-),25℃时,Kw=1×10-14(无单位);100℃时,Kw=3、Kw的影响因素:将纯水加热至较高温度,Kw= pH= 呈性4、影响水电离的因素:(二)溶液的酸碱性与pH:1、知识点:溶液显中性或酸碱性的实质是?2、例题:下列溶液一定呈中性的是()A.pH=7的溶液B.非电解质溶于水得到的溶液C.CH3COOH和NaOH反应后,溶液中[CH3COO-]=[Na+]D.同时含有H+和OH-的溶液E.由强碱和强酸等n混合反应的溶液 F. c(OH-)=√Kw(三)溶液pH的测定方法:1、酸碱指示剂法:只能测出pH 的范围,一般不能准确测定pH。
2、3、pH 试纸法:粗略测定溶液的pH。
4、注意事项:1)测定溶液pH 时,pH 试剂不能用蒸馏水润湿2)不能将pH 试纸伸入待测试液中,以免污染试剂3)pH试纸测定的pH为整数4)不能用pH试纸测定具有漂白性的物质或气体5)标准比色卡的颜色按pH 从小到大依次是:红(酸性),蓝(碱性)6)pH的范围通常是:0~14(四)pH的计算:pH 试纸的使用方法:取一小块pH 试纸放在玻璃片(或表面皿)上,用洁净的玻璃棒蘸取待测液滴在试纸的中部,随即(30s 内)与标准比色卡比色对照,确定溶液的pH。
用pH 判断溶液酸碱性时,要注意条件,即温度。
不能简单地认为pH等于7的溶液一定为中性,如100℃时,pH=6 为中性。
1、单一溶液的计算:例题:1)a :pH=2的HCl 溶液 b :pH=2的CH 3COOH 溶液 c :pH=12的NaOH 溶液 d :pH=12的NH 3·H 2O 溶液 上述四种溶液均稀释100倍,pH 由大到小的顺序为: 2)稀释pH 均为3的H 2SO 4和CH 3COOH 溶液100倍,稀释后溶液的pH 大小为? 稀释浓度相同的NaOH 和NH 3·H 2O 溶液,稀释后pH 大小为?3)①将pH 为5的硫酸溶液稀释500倍,稀释后溶液中c (SO 42-):c (H +)约为( ) ②将pH =1的硫酸溶液稀释500倍,稀释后溶液中c (SO 42-):c (H +)约为( ) A 、1:1 B 、1:2 C 、1:10 D 、10:14)将体积均为10 mL 、pH 均为3的盐酸和醋酸,加入水稀释至a mL 和b mL 后溶液的体积( )a=b=100 mLB.a=b=1000 mLC.a <bD.a >b5)pH 相同的氨水、氢氧化钠和氢氧化钡溶液,分别用蒸馏水稀释到原来的X 倍、Y 倍、Z 倍,稀释后三种溶液的pH 同,则X 、Y 、Z 的关系是( ) A.X =Y =Z B.X >Y =Z C.X <Y =Z D.X =Y <Z3、水电离的计算 1)影响水电离的因素:1.升温2.NaOH3.明矾4.Ba5.NaHCO 36.NaHSO 47.CH 3COOH8.NaCl 9.BaCl 2 10.CH 3COONa 11.NH 3•H 2O 12.H 2SO 4 13.NH 4Cl 14.Na 3PO 4 15.NaH 2PO 4 16. 17.Ba(OH)2 18.NH 4Cl=NH 3·H 2O 19.CH 3COOH=CH 3COONa 20.NaHA[H 2A=H ++HA -,HA -⇋H ++A 2-]促进水电离的有 对水的电离无影响的有 抑制水电离的有2)常温下,由水电离产生的[H +]=1.0×10-10mol/L ,求溶液的pH= 100℃,由水电离产生的[H +]=1.0×10-10mol/L ,求溶液的pH=3)25℃时,向纯水中加入NaOH ,使溶液pH=11,则由NaOH 电离出的OH -离子浓度与水电离出的OH -离子浓度之比为4)25℃时纯水的电离程度为α1,pH=2的醋酸溶液中水的电离程度为α2,pH=12的氢氧化钠溶液中水的电离程度为α3.若将上述醋酸与氢氧化钠溶液等体积混合,所得溶液中水的电离程度为α4.下列关系式中正确的是( ) A. α2=α3<α4<α1 B. α3=α2<α1<α4 C. α2<α3<α1<α4 D. α1<α2<α3<α4 5)4、 混合溶液pH 的计算: 1)同同混合:酸酸混合:pH=1的盐酸和pH=5的硫酸等体积混合,混合后溶液pH=由水电离的 25℃[H +] 100℃[H +] 25℃[OH -] 100℃[OH -]0.05mol/L 硫酸 pH=3NH 4Cl 0.03mol/LNaCl 0.005mol/LBa(OH)2 pH=12 CH 3COONac(H +)aq ·c(OH -)aq =1.0×10-14c(H +)水=c(OH -)水酸碱混合,什么时刻水电离程度最大?pH 差≥2 ,等体积混合 pH 混酸=pH 小+0.3 pH 混碱=pH 大-0.3看到水的电离:I)先写三个字:促、抑、无 II)再算出两个互补数:pH/pOH III)最后对号入座解题关键:准确找到BF 两点中,哪点是真正的显中性。
高考化学复习水的电离和溶液的酸碱性专题练习(含答案)

高考化学复习水的电离和溶液的酸碱性专题练习(含答案)依据是否具有在熔融态或水溶液中导电的能力,可以将化合物分为电解质和非电解质。
以下是高考化学复习水的电离和溶液的酸碱性专题练习,请考生练习。
1.在25 ℃时,分别用pH=9、pH=10的两种氨水中和同浓度、同体积的盐酸,消耗氨水的体积分别为V1和V2,则V1和V2的关系是()A.V1=10V2B.V110V2C.V110V2D.V210V1【答案】B【解析】因为pH1=9,所以c1(OH-)=10-5 mol因为pH2=10,所以c2(OH-)=10-4 molL-1。
根据题意得:c1(NH3H2O)V1=c2(NH3H2O)V2由于弱电解质浓度越大,电离的程度越小,则==10,即V110V2。
2.对于常温下0.1 molL-1氨水和0.1 molL-1醋酸,下列说法正确的是()A.0.1 molL-1氨水,溶液的pH=13B.0.1 molL-1氨水加水稀释,溶液中c(H+)和c(OH-)都减小C.0.1 molL-1醋酸溶液中:c(H+)=c(CH3COO-)D.0.1 molL-1醋酸与0.1 molL-1NaOH溶液等体积混合所得溶液中:c(Na+)c(CH3COO-)c(OH-)c(H+)【解析】NH3H2O是弱碱,0.1 molL-1氨水中,c(OH-)0.1 molL-1,溶液的pH13,A错;NH3H2O??NH+OH-,稀释时,电离平衡正向移动,但c(OH-)降低,则c(H+)增大,B错;醋酸溶液中的电荷守恒式:c(H+)=c(CH3COO-)+c(OH-),C错;0.1 molL-1醋酸与0.1 molL-1 NaOH溶液等体积混合后生成,溶液中离子浓度关系为CH3COONac(Na+)c(CH3COO-)c(OH-)c(H+),D对。
3.(广州质检)25 ℃时,水的电离达到平衡:H2O??H++OH- 0,下列叙述正确的是()A.向平衡体系中加入水,平衡正向移动,c(OH-)增大B.将水加热,Kw增大,pH不变C.向水中加入少量稀硫酸,c(H+)增大,Kw不变D.向水中加入少量NaOH固体,平衡正向移动,c(H+)降低【答案】C4.(山东卷)某温度下,向一定体积0.1 molL-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH[pOH=-lg c(OH-)]与pH的变化关系如下图所示,则()A.M点所示溶液的导电能力强于Q点B.N点所示溶液中c(CH3COO-)c(Na+)C.M点和N点所示溶液中水的电离程度相同D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积【解析】由于醋酸是弱酸,电离程度很小,离子浓度也较小,M点溶液的导电能力最弱,A错;N点所示溶液为碱性,根据溶液电荷守恒判断出此时c(Na+)c(CH3COO-)c(OH-)c(H+),B 错;由于M点的H+浓度等于N点的OH-浓度,对于水的电离程度抑制能力相同,所以两点水的电离程度相同,C正确;Q 点的pOH=pH,溶液为中性,而两者等体积混合后生成醋酸钠,水解显碱性,则所加NaOH溶液体积略小于醋酸溶液的体积,D错。
高考化学真题(2010-2019)专题解析—水的电离和溶液的酸碱性

高考化学真题(2010-2019)专题解析—水的电离和溶液的酸碱性B .c (H +)=c (42H PO -)+2c (4HPO -)+3c (34P 题型一:水的电离平衡与溶液的酸碱性1.(2019·全国Ⅲ·11)设N A 为阿伏加德罗常数值。
关于常温下pH=2的H 3PO 4溶液,下列说法正确的是A .每升溶液中的H +数目为0.02N AO -)+c (OH −)C .加水稀释使电离度增大,溶液pH 减小D .加入NaH 2PO 4固体,溶液酸性增强【答案】B【解析】本题考查阿伏加德罗常数、电离平衡及其影响因素等,考查的核心素养是变化观念与平衡思想。
pH=2的H 3PO 4溶液中c (H +)=10-2mol·L -1,每升溶液中所含N(H+)=0.01N A ,A 错误;由电荷守恒知,该H 3PO 4溶液中存c (H +)=c (42H PO -)+2c (4HPO -)+3c (34PO -)+c (OH −),B 正确;加水稀释能促进H 3PO 4的电离,使其电离度增大,由于以增大溶液体积为主,导致溶液中c(H +)减小,溶液pH 增大,C 错误;向H 3PO 4溶液中加入NaH 2PO 4固体,溶液中c(H 2PO 4-)增大,促使平衡H 3PO 4H++H 2PO 4-逆向移动,抑制H 3PO 4电离,溶液酸性减弱,D 错误。
【命题动向】本题命题角度新颖,在同一道试题中综合考查微粒数目的计算、电离平衡及其影响因素和守恒思想,命题具有前瞻性和导向性。
2.(2019·北京·12)实验测得0.5mol·L -1CH 3COONa 溶液、0.5mol·L -1CuSO 4溶液以及H 2O 的pH随温度变化的曲线如图所示。
下列说法正确的是A.随温度升高,纯水中c(H +)>c(OH -)B.随温度升高,CH3COONa溶液的c(OH-)减小C.随温度升高,CuSO4溶液的pH变化是K W改变与水解平衡移动共同作用的结果D.随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO-、Cu2+水解平衡移动方向不同【答案】C【解析】题考查盐类水解等知识,考查的核心素养是变化观念与平衡思想。
人教版高考化学复习:水的电离,溶液的酸碱性

3
水的电离、溶液的酸碱性
• (3)影响水电离平衡的因素
• ①升高温度,水的电离程度增大,Kw增大。 • ②加入酸或碱,水的电离程度减小,Kw不变。 • ③加入可水解的盐(如FeCl3、Na2CO3),水的电离程度增大,Kw不变。
13
酸碱中和滴定
• (3)“考”指示剂的选择 • ①强酸强碱相互滴定,可选用甲基橙或酚酞; • ②若反应生成强酸弱碱盐溶液呈酸性,则选用酸性变色范围的指示剂(甲基橙),若反应生成
强碱弱酸盐,溶液呈碱性,则选用碱性变色范围的指示剂(酚酞); • ③石蕊溶液因颜色变化不明显,且变色范围过宽,一般不作指示剂。 • (4)“考”误差分析
• 写出计算式,分析操作对V标的影响,由计算式得出对最终测定结果的影响,切忌死记硬背
结论。此外对读数视线问题要学会画图分析。
14
酸碱中和滴定
• 如:用标准盐酸溶液滴定未知浓度的NaOH溶液(酚酞作指示剂),用“偏高”“偏低”或 “无影响”填空。
左移。
8
水的电离、溶液的酸碱性
• 2.溶液的酸碱性 • (1)溶液的酸碱性
• 溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。 • a.酸性溶液:c(H+)>c(OH-),常温下,pH<7。 • b.中性溶液:c(H+)=c(OH-),常温下,pH=7。 • c.碱性溶液:c(H+)<c(OH-),常温下,pH>7。
9
水的电离、溶液的酸碱性
• 试判断下列溶液在常温下的酸、碱性(在括号中填“酸性”“碱性”或“中性”)。
• ①相同浓度的HCl和NaOH溶液等体积混合(
专题10 水的电离和溶液的酸碱性-2019年高考化学---精校解析 Word版

专题10 水的电离和溶液的酸碱性【记忆导图】---知识框架,唤醒记忆【点滴解析】---逐个突击,步步为营知识一水的电离考向一 水电离的影响因素【例1-1】分析下列因素对水电离的影响【变式】1.25 ℃时,水的电离平衡H 2OH ++OH - ΔH >0。
下列叙述正确的是( )A.向水中加入稀氨水,平衡逆向移动,c (OH -)降低 B.向水中加入少量固体NaHSO 4,c (H +)增大,K w 不变 C.向水中加入少量盐酸,平衡逆向移动,c (H +)降低 D.将水加热,K w 增大,c (H +)不变 【答案】B2.水加热至较高温度,下列叙述正确的是( )A .水的离子积变大、PH 变小、呈酸性 B. 水的离子积不变、PH 不变、呈中性 C.水的离子积变小、PH 变大、呈碱性 D.水的离子积变大、PH 变小、呈中性 【答案】D【解析】H 2O 的电离为吸热过程,将纯水加热至较高温度,电离平衡正向移动,c (H +)、c (OH -)增大,则水的离子积K w = c (OH -) c (H +)增大,PH=-lg c (H +)减少,而c (H +)= c (OH -),扔呈中性。
3.水的电离过程为H 2OH ++OH -,在25 ℃时,水的离子积K w =1.0×10-14;在35 ℃时,水的离子积K w=2.1×10-14。
则下列叙述正确的是( )A.c (H +)随着温度的升高而降低 B.35 ℃时,c (H +)>c (OH -) C.35 ℃时的水比25 ℃时的水电离程度小 D.水的电离是吸热过程 【答案】D考向二 水电离c (H +)和c (OH -)浓度计算【例1-2】.某温度下纯水的c (H +)=2×10-7mol·L -1,则此时c (OH -)为 ;若温度不变,滴入稀盐酸使c (H +)=5×10-4mol·L -1,则溶液中c (OH -)为 ,由水电离产生的c (H +)为 ,此时温度 (填“高于”、“低于”或“等于”)25 ℃。
【作业讲评与习题】水的电离和溶液的酸碱性

Kw =c(H+)·c(OH-)= 1×10-14
∴ pH= -lg c(H+) = -lg10-12 = 12
OH -的物质的量浓度的负对数来表示溶液的酸碱性用pOH
pOH = —lg c(OH-) pOH + pH ==14
2、稀的电解质溶液中都存在 Kw=c(H+) . c(OH-) 酸溶液中:Kw≈c(H+)酸 . c(OH-) 碱溶液中:Kw≈c(H+) . c(OH-) 碱
3、由水电离出来的c( H+ )水= c(OH-)水
分清溶液中c(H+)或c(OH-)的来源
溶液的酸碱性与pH值: pH= -lg c(H+)
得溶液的pH=
。
cB
=
nB
V
c(H+)=( 1 × 10—2 +1×10—4) / (1+1) = 5.0×10-3 2.3
酸+酸混合
混合后c(H+)
混合溶液pH
二、溶液混合的pH计算 2、强碱与强碱混合pH的计算
《学习与评价》 P99 11
碱+碱: 求混合后c(OH-) → c(H+) → pH
3、强酸与强碱溶液反应后溶液pH求算: 例. pH=2的盐酸与pH=12的NaOH溶液按体积 比为2:1混合后溶液的pH值?
思路:判断谁过量 酸过量抓住H+进行计算! ①酸过量:则c(H+)= c(H+)V1- c(OH-)V2
V1+V2
练习:99mLpH=1的硫酸与101mL 0.1mol·L-1 的 NaOH溶液混合后溶液的pH值?
水的电离和溶液的酸碱性【八大题型】(学生版)-高中化学

水的电离和溶液的酸碱性【八大题型】【新高考通用】【知识点1水的电离与水的离子积常数】【知识点2溶液的酸碱性与pH 】【知识点3酸碱中和滴定】【题型1水的电离及影响因素】【题型2水的电离的相关计算】【题型3水的电离有关图像】【题型4溶液酸碱性的判断】【题型5有关pH 的简单计算】【题型6中和滴定的操作与指示剂选择】【题型7中和滴定的误差分析】【题型8滴定曲线的分析与应用】【过关测试】考点要求真题统计考情分析1.了解水的电离、离子积常数。
2.了解溶液pH 的含义及其测定方法,能进行pH 的简单计算。
3.能选择实例说明溶液pH 的调控在工农业生产和科学研究中的重要作用。
4.理解酸碱中和滴定,能根据实验试题要求分析或处理实验数据,得出合理结论;能够分析以图像形式考查滴定曲线。
2024·安徽卷7题,3分;2024·安徽卷7题,3分;2024·山东卷10题,2分;2023湖南卷12题,4分;2022辽宁卷15题,3分;2022·浙江卷1题,2分;2022·浙江卷17题,2分2021湖北卷14题,3分;2021海南卷14题,4分;本专题试题主要结合图像考查溶液的酸碱性判断、pH 的计算,以及离子浓度的大小比较等;以酸碱中和滴定为载体,考查微粒浓度的变化。
预测2025年结合图像,考查水的电离平衡与溶液酸碱性的关系,以及pH 的相关计算等;考查氧化还原滴定、沉淀滴定等有关计算,注意滴定现象、操作、误差分析。
【思维导图】【知识点1水的电离与水的离子积常数】1.水的电离(1)水是极弱的电解质,其电离过程吸热(填“吸热”或“放热”)。
水的电离平衡常数的表达式为K=c(H+)·c(OH-)c(H2O)。
(2)影响水的电离平衡的因素①温度:温度升高,水的电离平衡向正方向移动,c(H+)和c(OH-)均增大(填“增大”“减小”或“不变”)。
②加酸或碱会抑制(填“促进”或“抑制”)水的电离。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一部分专题十一、选择题1.室温下,水的电离达到平衡:H2O H++OH-。
下列叙述正确的是()A.将水加热,平衡向正反应方向移动,K W不变B.向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大C.向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低D.向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)=c(H+)解析:本题考查水的电离平衡的影响因素,意在考查考生的分析能力。
加热时,水的电离平衡正向移动,K W增大,A项错误;加入少量盐酸,水的电离平衡逆向移动,但c(H+)增大,B项正确;加入少量NaOH固体,水的电离平衡逆向移动,但c(OH-)增大,C项错误;加入少量CH3COONa固体,c(H+)减小,水的电离平衡正向移动,c(OH-)增大,c(OH-)>c(H+),D项错误。
答案:B2.(2015·山西山大附中期中)25 ℃时,某溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-18,下列说法正确的是()A.该溶液的pH可能是5 B.此溶液不存在C.该溶液的pH一定是9 D.该溶液的pH可能为7解析:由题意可知该溶液中水电离产生的c(H+)=c(OH-)=1×10-9mol·L-1,该溶液中水的电离受到抑制,可能是酸溶液,也可能是碱溶液。
若为酸溶液,则pH=5;若为碱溶液,则pH=9,故A项正确。
答案:A3.(2015·河北冀州中学第四次月考)常温下,下列各组离子或分子在指定溶液中能大量共存的是()A.使甲基橙呈红色的溶液中:MnO-4、Al3+、C2H5OH、SO2-4B.水电离出的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、NH+4、Cl-、SiO2-3C.c(H+)/c(OH-)=1012的溶液中:NH+4、Al3+、NO-3、ClO-D.c(NaHCO3)=0.1 mol·L-1的溶液中:K+、C6H5O-、SO2-4、CO2-3解析:A项,使甲基橙呈红色的溶液呈酸性,酸性条件下MnO-4能与C2H5OH发生氧化还原反应而不能大量共存;B项,水电离出的c(H+)=1×10-14 mol·L-1的溶液呈酸性或碱性,酸性条件下SiO2-3不能大量存在,碱性条件下NH+4不能大量存在,且Ca2+与SiO2-3反应生成沉淀而不能大量共存;C项,c(H+)/c(OH-)=1012的溶液呈酸性,ClO-与H+反应生成次氯酸而不能大量共存;D项,所给离子均不反应,能大量共存于溶液中。
答案:D4.(2015·河北正定模拟)①pH=2的CH3COOH溶液;②pH=2的盐酸;③pH=12的氨水;④pH=12的NaOH溶液。
相同条件下,有关上述溶液的比较中,不正确的是()A.水电离的c(H+):①=②=③=④B.若将②、③溶液混合后pH=7,则消耗溶液的体积:②>③C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大D.向溶液中加入100 mL水后,溶液的pH:③>④>②>①解析:①、②、④相比溶液中的氢离子与氢氧根离子的浓度相等,但醋酸是弱酸,溶液的浓度远大于盐酸的浓度,而2OH-~3H2,2H+~H2,所以②生成的氢气的量最少,C错误。
答案:C5.(2015·广东理综)准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.10000 mol·L-1 NaOH 溶液滴定,下列说法正确的是()A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小解析:A项,滴定管洗涤后还需用NaOH溶液润洗;B项,随着NaOH溶液滴入,溶液的pH由小变大;C项;酚酞滴入待测HCl溶液中,溶液是无色的,当溶液由无色变为红色,且半分钟内不褪色时停止滴定;D项,尖嘴部分的悬滴并未与待测HCl溶液反应,但已被计算在消耗的NaOH溶液的体积中,从而使测定结果偏大。
答案:B6.(2015·山东莱州期末,14)室温时,关于下列溶液的叙述正确的是()A.1.0×10-3 mol·L-1盐酸的pH=3,1.0×10-8 mol·L-1的盐酸pH=8B.pH=a的醋酸溶液稀释1倍后,溶液的pH=b,则a>bC.pH=12的氨水和pH=2的盐酸等体积混合,混合液的pH<7D.1 mL pH=1的盐酸与100 mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH =11解析:室温时酸溶液的pH不可能大于8,故A项错误;醋酸溶液稀释后c(H+)降低,pH增大,所以a<b,B项错误;氨水中溶质只有极少部分电离,pH=12的氨水和pH=2的盐酸等体积混合,氨水过量,pH>7,故C项错误;由混合后pH=7可得1 mL×10-1mol·L-1=100 mL×c(OH-),c(OH-)=10-3 mol·L-1,则NaOH溶液的pH=11,故D项正确。
答案:D7.(2015·重庆理综)下列叙述正确的是()A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度B.25 ℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7C.25 ℃时,0.1 mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱D.0.1 mol AgCl和0.1 mol AgI混合后加入1 L水中,所得溶液中c(Cl-)=c(I-)解析:A项,醋酸电离的方程式为CH3COOH CH3COO-+H+,加入少量CH3COONa,增加了CH3COO-的浓度,从而使醋酸电离平衡逆向移动,抑制了醋酸的电离;B项,等体积等浓度的硝酸与氨水混合生成NH4NO3,NH4NO3中NH+4能水解:NH+4+H2O NH3·H2O +H+,溶液应呈酸性,则pH<7;C项,溶液的导电能力是由溶液中离子总浓度大小决定的,H2S为弱电解质,Na2S为强电解质,所以等浓度的H2S溶液和Na2S溶液,Na2S溶液导电能力强;D项,在相同条件下AgI的溶解度小于AgCl的溶解度,所得溶液中c(Cl-)>c(I-)。
答案:C8.(2015·山东枣庄中学3月模拟)下图为不同温度下水的电离平衡曲线,已知pOH=-lg c(OH -),下列说法正确的是()A.T1和T2的关系是:T1>T2B.K W的关系是:B>C>A=D=EC.A点到D点:加入少量酸可实现D.T2时:pH=2的硫酸与pH=12的NaOH溶液等体积混合,溶液呈中性解析:A点的c(H+)、c(OH-)大于B点,A点K W比B点高,故T1<T2,A项错误;K W只与温度有关,由图象分析,T1到T2温度升高,K W随温度升高而增大,故K W的关系是:A=D =E>C>B,B项错误;A点到D点c(H+)增大,K W不变,加入少量酸可实现,C项正确;若在常温下,pH=2的硫酸与pH=12的NaOH溶液等体积混合,溶液呈中性,T2不是常温,故D项错误。
答案:C9.(2015·山东实验中学第四次诊断)常温下,下列溶液的离子浓度关系式正确的是() A.pH=4的氯化铵溶液中:c(H+)=c(NH2·H2O)=1×10-4 mol·L-1B.pH=a的HCl溶液,稀释10倍后,其pH=b,则a=b-1C.pH=2的HF溶液与pH=12的NaOH溶液体积比1∶1混合:c(Na+)=c(F-)>c(H+)=c(OH -)D.pH相同的①NaOH、②NaClO两种溶液中水的电离程度:①<②解析:氯化铵溶液中的电荷守恒为c(H+)+c(NH+4)=c(OH-)+c(Cl-),物料守恒为c(Cl-)=c(NH+4)+c(NH3·H2O),二者结合可得:c(H+)=c(OH-)+c(NH3·H2O),故A项错误;当a=b 时,pH=6的HCl溶液稀释10倍后,其pH<7,不会等于7,故B项错误;pH=2的HF溶液与pH =12的NaOH 溶液体积比1∶1混合后,HF 过量,溶液显酸性,则c (H +)>c (OH -),故C 项错误;氢氧化钠抑制了水的电离,次氯酸钠溶液中次氯酸根离子水解促进了水的电离,则水的电离程度:①<②,故D 项正确。
答案:D10.(2015·南昌一检)常温下,如图是用0.100 0 mol/L NaOH 溶液滴定20.00 mL 0.100 0 mol/L HA 溶液所得到的滴定曲线。
下列相关的说法错误的是(忽略滴定前后体积变化)( )A .由图可知HA 是一种弱酸,且K a =1.0×10-5B .水电离出的氢离子浓度:a <bC .当NaOH 溶液的体积为10.00 mL 时,有:c (A -)+c (OH -)=c (H +)+c (HA) D .B 点溶液中的离子浓度关系可能为:c (Na +)>c (A -)>c (OH -)>c (H +)解析:本题考查电解质溶液知识,意在考查考生的综合分析能力与计算能力。
由图象中0.1000 mol/L 的HA 溶液的pH =3可知HA 为弱酸,电离常数K a =c H +·c A -c HA =c 2 H +c HA=0.00120.1000=1.0×10-5,A 项正确;酸电离出的H +浓度:a >b ,而酸电离出的H +抑制了水的电离,故水电离出的H +浓度:a <b ,B 项正确;A -的水解常数K h =c HA ·c OH -c A -=K WK a =1.0×10-9,当NaOH 溶液的体积为10 mL 时,得到等物质的量浓度的HA 和NaA 的混合溶液,因K h <K a ,故此时溶液呈酸性,即c (OH -)<c (H +),该溶液中电荷守恒式为c (OH -)+c (A -)=c (H+)+c (Na +),物料守恒式为2c (Na +)=c (HA)+c (A -),整理这两个式子得:2c (OH -)+c (A -)=2c (H +)+c (HA),若选项C 关系成立,则有c (OH -)=c (H +),这与c (OH -)<c (H +)矛盾,故C 项错误;若B 点时消耗NaOH 溶液的体积为20 mL ,则溶液的溶质为NaA ,有c (Na +)>c (A-)>c (OH -)>c (H +),D 项正确。
