高二化学水的电离和溶液的酸碱性
水的电离和溶液的酸碱性典型例题及习题
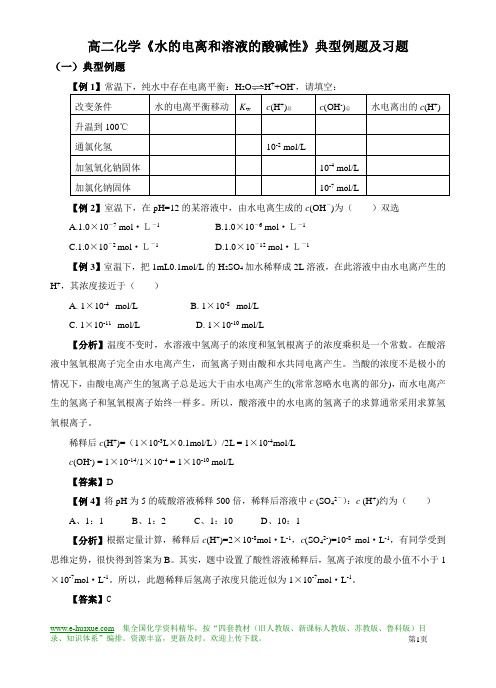
高二化学《水的电离和溶液的酸碱性》典型例题及习题(一)典型例题【例1】常温下,纯水中存在电离平衡:H+-,请填空:改变条件水的电离平衡移动K w c(H+)总c(OH-)总水电离出的c(H+) 升温到100℃通氯化氢10-2 mol/L加氢氧化钠固体10-4 mol/L加氯化钠固体10-7 mol/L【例2】室温下,在pH=12的某溶液中,由水电离生成的c(OH-)为()双选A.1.0×10-7 mol·L-1B.1.0×10-6 mol·L-1C.1.0×10-2 mol·L-1D.1.0×10-12 mol·L-1【例3】室温下,把1mL0.1mol/L的H2SO4加水稀释成2L溶液,在此溶液中由水电离产生的H+,其浓度接近于()A. 1×10-4 mol/LB. 1×10-8 mol/LC. 1×10-11 mol/LD. 1×10-10 mol/L【分析】温度不变时,水溶液中氢离子的浓度和氢氧根离子的浓度乘积是一个常数。
在酸溶液中氢氧根离子完全由水电离产生,而氢离子则由酸和水共同电离产生。
当酸的浓度不是极小的情况下,由酸电离产生的氢离子总是远大于由水电离产生的(常常忽略水电离的部分),而水电离产生的氢离子和氢氧根离子始终一样多。
所以,酸溶液中的水电离的氢离子的求算通常采用求算氢氧根离子。
稀释后c(H+)=(1×10-3L×0.1mol/L)/2L = 1×10-4mol/Lc(OH-) = 1×10-14/1×10-4 = 1×10-10 mol/L【答案】D【例4】将pH为5的硫酸溶液稀释500倍,稀释后溶液中c (SO42-):c (H+)约为()A、1:1B、1:2C、1:10D、10:1【分析】根据定量计算,稀释后c(H+)=2×10-8mol·L-1,c(SO42-)=10-8mol·L-1,有同学受到思维定势,很快得到答案为B。
【优教通】高二人教版化学选修四教案设计:3-2-1《水的电离和溶液的酸碱性》

其次节水的电离和溶液的酸碱性第1课时水的电离和溶液的酸碱性●课标要求1.知道水的离子积常数。
2.初步把握pH测定的方法,知道溶液pH的调控在工农业生产和科学争辩中的重要应用。
●课标解读1.了解水的电离及水的离子积常数。
2.了解溶液的酸碱性与pH的意义。
●教学地位本课时介绍了水是一种弱电解质,在确定条件下水的离子积是常数。
了解测定溶液pH的方法。
利用pH,c(H +),c(OH-)等推断水溶液的酸碱性是本章的基础。
●新课导入建议追求健康长寿是人类共同的愿望。
人们首先要拥有健康,才有可能获得财宝、地位和幸福。
健康从哪里来呢?水是生命之源,假如没有水,就不行能有生命。
风靡日本、欧美等国的活性离子水是一种高品质的饮用水。
离子水比一般水分子团直径小,渗透作用快,有利于消退体内过多的自由基,能够延缓机体年轻,且对多种疾病有预防和挂念治疗的作用。
它的诞生,在全世界掀起了一场饮水领域的革命,善待生命,从水开头。
你知道水中有哪些粒子吗?【提示】水中有H2O、H+、OH-三种微粒。
●教学流程设计课前预习支配:(1)看教材P45~46,填写【课前自主导学】中的“学问1,水的电离”,并完成【思考沟通1】;(2)看教材P46~47页,填写【课前自主导学】中的“学问2,溶液的酸碱性与pH”,并完成【思考沟通2】。
⇒步骤1:导入新课并对本课时教材地位分析。
⇒步骤2:建议对【思考沟通1、2】多提问几个同学,使80%以上的同学都能把握该内容,以利于下一步对该重点学问的探究。
⇓步骤5:在老师指导下同学自主完成【变式训练1】和【当堂双基达标】中的1、4、5三题,验证同学对探究点的理解把握状况。
⇐步骤4:老师通过【例1】和教材P45~46页的讲解研析,对“探究1”的内容进行总结。
⇐步骤3:师生互动完成“探究1,影响水电离平衡的因素及水的离子积”可利用【问题导思】的设问由浅入深的进行,建议老师除【例1】外,再变换一下命题角度,可接受【老师备课资源】,以拓展同学的思路。
高二化学水的电离和溶液的酸碱性试题答案及解析

高二化学水的电离和溶液的酸碱性试题答案及解析1.常温下,柠檬酸水溶液的pH是3,食用醋的pH是2,可乐的pH是6,三种物质的溶液中c(OH-)分别是()A.1×10-11 mol·L-1,1×10-12 mol·L-1,1×10-8 mol·L-1B.1×10-11 mol·L-1,1×10-8 mol·L-1,1×10-12 mol·L-1C.2×10-11 mol·L-1,1×10-10 mol·L-1,1×10-8 mol·L-1D.1×10-8 mol·L-1,1×10-11 mol·L-1,1×10-12 mol·L-1【答案】A=c(H+)·c(OH-)=1.0×10-14。
【解析】常温下,KWpH=3时,c(OH-)==1.0×10-11 mol·L-1,pH=2时,c(OH-)==1.0×10-12 mol·L-1,pH=6时,c(OH-)==1.0×10-8 mol·L-1。
【考点】pH的计算2.下列说法正确的是A.将25℃纯水加热至95℃时,增大B.将pH=11的Na2CO3溶液加水稀释,增大C.室温下,pH=a的盐酸与pH=b的氨水等体积混合后pH=7,则a+b="14"D.0.1mol·L-酸HA与0.1mol·L-NaOH溶液等体积混合后pH>7,则【答案】A【解析】、A、水的电离是吸热的过程,温度升高,水离子积常数增大,氢离子浓度和氢氧根离子浓度随着增大,而一定温度下存在,由氢离子浓度增大可知增大,所以A正确。B.溶液稀释过程,氢氧根离子浓度、碳酸根离子浓度减小,依据一定温度下,离子积常数不变可知,氢离子浓度增大,因此B选项错误。C选项室温下,pH=a的盐酸与pH=b的氨水等体积混合,若a+b=14,平衡状态下氢离子浓度和氢氧根离子浓度相同,反应后,一水合氨继续电离生成氢氧根离子,溶液显碱性,pH=7的溶液中氯离子浓度等于铵根离子浓度,因此C选项错误。D0.1mol·L-酸HA与0.1mol·L-NaOH溶液等体积混合,恰好反应生成醋酸钠,依据物料守恒得到所以D选项错误。【考点】考查了水电离平衡的相关知识点。3.常温下,pH = 12的NaOH溶液与pH =1的HC1溶液按一定比例混合,所得溶液pH =2,则NaOH溶液与HC1溶液的体积比为A.9:2B.2:9C.1:9D.10:1【答案】A【解析】常温下,pH = 12的NaOH溶液与pH =1的HC1溶液按一定比例混合,所得溶液pH=2,则酸过量,设HCl、NaOH的体积分别是V(HCl)、V(NaOH),则[V(HCl)×0.1-V(NaOH)×0.01]÷[V(HCl)+V(NaOH)]=0.01,解得V(NaOH):V(HCl)=9::2,因此选项是A。
水的电离和溶液的酸碱性 (第3课时 酸碱中和滴定(一))高二化学(人教版选修4)
无 淀粉
无色→浅紫红色 无色→蓝色
3.(2022·江西·赣州市第三中学期中)下列实验操作正确的是( D ) A.用图1装置进行KMnO4溶液滴定未知浓度的FeSO4溶液实验
B.如图2所示,记录滴定终点读数为19.90mL C.图3为酸式滴定管,使 用后需洗涤干净,并轻轻放入烘箱烘干 D.碱式滴定管排气泡的操作方法 如图4,然后轻轻挤压玻璃球使尖嘴部分充满碱液
甲基橙 3.1~4.4 红、Байду номын сангаас、黄
石蕊 5.0~8.0 红、紫、蓝
酚酞 8.2~10.0 无色、浅红、红
指示剂的选择和滴定终点的判断
酚酞 强酸滴定强碱
甲基橙
红→无色 黄→橙
酚酞 强碱滴定强酸
无色→粉红
甲基橙 红→橙
强酸滴定弱碱 甲基橙 黄→橙
强碱滴定弱酸 酚酞
无色→粉红
【小试牛刀】(双选)用已知浓度的NaOH溶液滴定某H2SO4溶液的浓度,
2.(2021·鄂尔多斯市第一中学高二月考)下列滴定中,指示剂的选择或滴定 终点颜色变化有错误的是( B )
选项 滴定管中的溶液 锥形瓶中的溶液 指示剂 滴定终点颜色变化
A
NaOH溶液
CH3COOH溶液 酚酞
无色→浅红色
B
HCl溶液
氨水
酚酞
浅红色→无色
C 酸性KMnO4溶液 K2SO3溶液
D
碘水
亚硫酸溶液
【小试牛刀】(2022·湖北·高二期中)某学生用量程为25mL的酸式滴定管量 取0.1mol•L-1的盐酸,开始时俯视液面,读数为1.00mL,取出部分溶液后,平视
液面,读数为13.00mL,该同学在操作中实际取出的液体体积( B )
A.大于12.00mL
水的电离和溶液的酸碱性

高二化学资料(九)强化训练:水的电离和溶液的酸碱性一、选择题1、常温下,某溶液中由水电离的c(H+)=1×10-13mol·L-1,该溶液可能是①二氧化硫水溶液②氯化铵水溶液③硝酸钠水溶液④氢氧化钠水溶液A.①④B.①②C.②③D.③④2、(双选)常温下,某溶液中,由水电离出的c(H+)=1.0×10-11mol/L,该溶液pH可能为A.11B.3C.8D.73、在水电离出的c(H+)=10-14mol/L的溶液中,一定能大量共存的A.K+、Na+、HCO3-、Cl-B.K+、Br+、AlO2-、Cl-C.SO42-、Na+、NO3-、Cl-D.SO42-、NH4+、Al3+、Cl-4、(双选)向纯水中加入少量的KHSO4固体(温度不变),则溶液的()A、pH值升高B、C(H+)和C(OH-)的乘积增大C、酸性增强D、OH-离子浓度减小5、100℃时,K W=1×10-12,对纯水的叙述正确的是()A、pH=6显弱酸性B、C(H+)=10-6mol/L,溶液为中性C、K W是常温时的10-2倍D、温度不变冲稀10倍pH=76、(双选)100℃时,K w=1.0×10-12,若100℃某溶液中的c(H+)=1.0×10-7mol/L,则该溶液A.呈中性B.呈碱性C.呈酸性D.c(OH-)/ c(H+)=10072、pH相同,物质的量浓度最大的酸是A.HCl B.H NO3C.H2SO4D.CH3COOH8、体积相同、pH相同的盐酸和醋酸,与碱中和时消耗的量A.相同B.盐酸多C.醋酸多D.无法比较9、(双选)pH=2的强酸溶液,加水稀释,若溶液体积扩大10倍,则C(H+)或C(OH-)的变化()A、C(H+)和C(OH-)都减少B、C(H+)增大C、C(OH-)增大D、C(H+)减小10、对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是A.加入适量的氯化铵晶体后,两溶液的pH均碱小B.温度下降10o C,两溶液的pH均不变C.分别加水稀释10倍,两溶液的pH仍相等D.用盐酸中和,消耗的盐酸体积相同11、下列叙述正确的是()A.95℃纯水的pH<7,说明加热可导致水呈酸性B.pH=3的醋酸溶液,稀释至10倍后pH=4C.0.2mol/L的盐酸,与等体积水混合后pH=1D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7....的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,下列说法正确的是A.a、b、c三点溶液的pH:c<a<bB.a、b、c三点醋酸的电离程度:a<b<cC.用湿润的pH试纸测量a处溶液的pH,测量结果偏小D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b13、某溶液中含有HCO3-、SO32-、CO32-、CH3COO-等四种阴离子。
高二化学课件第3章第2节水的电离和溶液的PH

小结 3、影响水的电离平衡的因素
影响 因素
水的电离平衡移动 影响结果
方向 原因
c(H+) c(OH-) c(H+)与 c(OH-) KW 变化 变化 的关系
温 升温 右移 水的电离 增大 增大 增大 c(H+)=c(OH-)
度 降温 左移 过程吸热 减小 减小 减小 c(H+)=c(OH-)
加酸
左移 增大了 c(H+)
答:c(H+)来源于酸电离和水电离,且c(H+)酸≫c(H+)水 ,c(H+)水可以 忽略;c(OH-)来源于水的电离,且电离程度很小。由水电离出的
c(H+)与c(OH-)仍然相等;KW=[c(H+)酸+c(H+)水]·c(OH-)水≈c(H+)酸
·c(OH-)水。
1.常温下,0.1 mol·L-1 的 NaOH 溶液中由水电离出的 OH-的
4. 任何水溶液中都有c(H+)=c(OH-)。 × 5. c(H+)等于10-6mol/L的溶液一定呈现酸性。×
6. 对水升高温度电离程度增大,酸性增强。×
7.温度一定时,水的电离常数与水的离子积常数 相等。
×
典例(双选)下列关于溶液酸碱性的说法正确的是 ( AC)
A.常温下,pH=7的溶液呈中性 B.中性溶液中一定有c(H+)=1.0×10-7 mol·L-1 C.c(H+)=c(OH-)的溶液呈中性 D.在100 ℃时,纯水的pH<7,因此呈酸性
KW=
c(H+)·c(OH-)
,25 ℃时,KW=1.0×10-14。
分析表格中的数据,有何规律,得出什么结论?并解释之。
第3章第2节水的电离和溶液的酸碱性

2011-2012学年高二化学选修4(人教版)同步练习第三章第二节水的电离和溶液的酸碱性一. 教学内容:水的电离和溶液的酸碱性二.重点、难点:1. 本节的重点是水的离子积,氢离子浓度、pH与溶液酸碱性的关系2. 本节的难点是水的离子积,相关溶液pH的简单计算三. 具体内容:(一)水的电离1. 水的电离2. 水的电离水准3. 电离平衡常数4. 水的离子积5. 需注意的6. 影响水的电离平衡的因素(二)溶液的酸碱性与pH1. Kw在电解质溶液中的存有2. 溶液的酸碱性与c(H+)、c(OH-)的关系3. 溶液的酸、碱性与pH的关系4. 溶液酸碱性的表示方法5. pH的测量(三)pH的应用1. 医疗上2. 生活上3. 环保领域中4. 农业生产中5. 科学实验和工业生产中(四)酸碱质子理论A. 溶液pH的计算方法B. 实验测定酸碱滴定曲线1. 实验2. 酸碱指示剂在中和滴定中的应用【典型例题】[例1] 将pH=4的酸溶液与pH=10的NaOH溶液等体积混合后,溶液的pH可能是()A. 等于7B. 大于7C. 小于7D. 无法确定答案:AC解析:考虑弱电解质电离的特点和pH的计算。
[例2] 今有HA、H2B、H3C三种弱酸,根据强酸制弱酸的反应规律,它们之间发生以下反应:HA+HC2-(少量)=A-+H2C-;H2B(少量)+2A-=B2-+2HA;H2B(少量)+ H2C-=HB-+H3C,回答以下问题:(1)相同条件下,HA、H2B、H3C三种酸中,酸性最强的是____;(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子中,最容易结合质子(H+)的是_____,最难结合质子的是_____;(3)完成以下反应的离子方程式①H3C+OH-(过量)_______________;②HA(过量)+C3-________________。
答案:(1)H2B;(2)C3-;HB-;(3)H3C+3OH-=C3-+3H2O;2HA+C3-=2A-+H2C-解析:掌握酸碱质子理论。
高二化学水的电离和溶液的酸碱性试题

高二化学水的电离和溶液的酸碱性试题1.下列有关水的电离的说法正确的是A.将水加热,KW增大,pH不变B.向水中加入少量NaHSO4固体,恢复到原温度,水的电离程度增大C.向水中加入少量NH4Cl固体,恢复到原温度,水的电离程度减小D.向水中加少量NaOH固体,恢复到原温度,水的电离被抑制,[OH-]增大【答案】D【解析】选项A、电离是一个吸热的过程,升高温度,促进电离,KW增大,pH相应增大;选项B、加入少量NaHSO4固体,c(H+)增大,水的电离平衡受到抑制,因此电离程度减弱;选项C、加入少量NH4Cl固体,发生反应:NH4++OH—=NH3·H2O;溶液中c(OH—)减少,水的电离平衡受到促进,因此电离程度增大;选项D、正确。
加少量NaOH固体,溶液中c(OH—)增大,水的电离受到抑制。
【考点】水的电离点评:本题主要考查了水的电离以及电离平衡的移动,解题时应明确影响电离平衡移动的因素——离子浓度的大小。
①增大反应物的浓度,平衡向逆反应方向移动;②减少反应物的浓度,平衡向正反应方向移动。
2. (2010·汕头高二检测)下列溶液肯定显酸性的是()A.含H+的溶液B.能使酚酞显无色的溶液C.pH<7的溶液D.c(OH-)<c(H+)的溶液【答案】D【解析】A中酸、碱、盐溶液中同时存在氢离子和氢氧根离子;B中酚酞遇酸性和中性溶液都不变色,遇碱性溶液变红;C中溶液的酸碱性是由氢离子和氢氧根离子浓度的相对大小决定的,而不在于氢离子浓度或氢氧根浓度绝对值大小;D中溶液的酸碱性与氢离子和氢氧根离子浓度的相对大小决定的,故选D。
【考点】溶液pH的定义.点评:本题考查了溶液酸碱性的判断,难度不大,C选项易错,溶液的酸碱性是由氢离子和氢氧根离子浓度的相对大小决定的,而不在于氢离子浓度或氢氧根浓度绝对值大小.3. (2010·徐州检测)t℃时,水的离子积为KW,该温度下将a mol·L-1一元酸HA与b mol·L-1一元碱BOH等体积混合,要使混合液呈中性,必要的条件是()A.混合液中,c(H+)=B.混合液的pH=7C.a=bD.混合液中,c(B+)=c(A-)+c(OH-)【答案】A【解析】A,当c(H+)= c(OH-)时,溶液呈中性,故在中性是c(H+)=,故A正确;B在常温下,中性溶液的PH=7,故B错;C项a=b,则说明一元酸和一元碱刚好完全反应生成盐AB,溶液不一定呈现中性,除非A-和B-不水解,或者两者水解程度相同。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[填空题]公元12、13世纪时兴起的蒙古民族结束了()而永久居住在这个地方。 [单选]根据支付结算法律制度的规定,下列银行卡分类中,以是否具有透支功能划分的是()。A.人民币卡与外币卡B.单位卡与个人卡C.信用卡与借记卡D.磁条卡与芯片卡 [单选]船舶对水航速VL,对地航速VG,船速VE,如果VG>VL>VE,则船舶航行在()情况下。A.顺风顺流B.顶风顶流C.顺风顶流D.顶风顺流 [单选]锁骨骨折常用的治疗方法是()A.切开复位,内固定B.手法复位,横"8"字绷带固定C.牵引治疗D.手法复位,夹板固定E.手法复位,石膏外固定 [单选,A1型题]恶寒较甚,发热,无汗,头痛身楚,咳嗽,痰白,咯痰无力,舌淡苔白,脉浮而无力。治法宜首选()。A.辛温解表B.辛凉解表C.祛湿解表D.益气解表E.滋阴解表 [单选]第二个发展加速期是指()。A.幼儿期B.童年期C.青春期D.青年期 [单选]下列颅骨凹陷性骨折中,不宜采取手术治疗的是()A.合并脑损伤或大面积骨折片陷入颅腔,引起颅内压增高者B.骨折片压迫重要部位引起神经功能障碍者C.非功能部位的大面积凹陷性骨折,凹陷深度超过1cm者D.位于大静脉窦处的凹陷性骨折,尚未引起颅内压增高者E.开放性颅骨骨折 [单选]造成胎儿宫内生长迟缓最常见的原因是().A.脐带绕颈B.本身发育异常C.双胎D.臀位E.妊高征 [判断题]从日本进口非动物源性的化妆品原料时,出口国官方不需出具证书,可凭生产厂商提供“非动物源性产品声明”报检。()A.正确B.错误 [单选]右肾上腺解剖描述中,下列哪一项最确切A.右肾上腺呈半月形,位于右肾上极内上方,下腔静脉后方,膈肌脚前方B.右肾上腺呈三角形,位于右肾上极内上方,下腔静脉后方,膈肌脚前方C.右肾上腺呈半月形,位于右肾上极内上方,下腔静脉后方,膈肌脚后方D.右肾上腺呈半月形,位于右 [填空题]行人持有长电设备带电部分保持()以上的距离。 [判断题]将餐具浸入淘米水、面汤或碱水中比较容易清洗掉餐具上的油腻。A.正确B.错误 [单选]不属于容器结构的是()。A、壳体B、支座C、开孔接管D、封头 [单选,A1型题]人群易感性升高的主要因素是()A.免疫接种B.新生儿增加C.隐性感染D.非易感人群迁入E.传染病流行 [单选,A2型题,A1/A2型题]2~3岁儿童的先天性肌性斜颈的治疗可选择()A.局部热敷,按摩B.手法牵引,头部扳正C.切断胸锁乳突肌胸骨头和锁骨头D.切除胸锁乳突肌E.胸锁乳突肌和斜方肌部分切除 [单选]口对口人工呼吸时,下列哪项操作错误()。A.置仰卧位B.一手捏鼻孔C.另一手托下颚D.头后仰呈直角E.吹气与呼气比为1:2 [单选]以下哪种肺癌副癌综合征的说法是不正确的()A.重症肌无力B.库欣综合征C.中叶综合征D.感觉性神经病E.类癌综合征 [判断题]储蓄存款的所有权发生争议,涉及办理过户的,储蓄机构依据上级行的指示办理过户手续。()A.正确B.错误 [单选]卧式车床最大回转直径参数在型号中是以什么折算系数表示的。()A.1B.1/10C.1/100D.1/1000 [问答题,简答题]何为地基极限承载力(或称地基极限荷载)? [多选]镰刀菌毒素包括()A、单端孢霉烯族化合物B、玉米赤霉烯酮C、丁烯酸内酯D、黄曲霉毒素E、环氯素 [单选]单位时间内无线电波传播的距离称为()。A.频率B.周期C.速度D.波长 [问答题,简答题]胸外心脏按压 [单选]《2007版标准文件》规定,监理人应在收到承包人竣工结算申请后()天内完成核查。A.7B.14C.21D.28 [单选]鄱阳湖生态经济区建设分为几个阶段?()A、两个阶段B、三个阶段C、四个阶段 [单选,A1型题]改善慢性肾小球疾病大量蛋白尿的措施是()A.吲哚美辛(消炎痛)B.肾上腺皮质激素C.开博通D.血液透析E.双嘧达莫 [多选]下列法律法规中,2011年5月1日以后施行的有()。A.《期货交易管理条例》B.《期货公司投资咨询业务试行办法》C.《期货公司管理办法》D.《期货公司资产管理业务试点办法》 [单选]甲是一个夜游症患者,其与乙在某地合伙卖西瓜,并共同居住在丙的一间出租屋中。某晚,甲发病,将乙的脑袋当作西瓜,当摸到乙的耳朵时以为是西瓜上沾有泥土,便拿出西瓜刀试图刮去该泥土。乙在梦中因疼痛惊醒,甲因摸到血迹也惊醒。乙为此花去医药费用2000元,对该费用如何承 [单选]慢性盆腔炎的主要症状是()A.月经量多B.下腹痛反复发作,劳则复发C.腹胀腹泻D.尿频尿急E.白带增多,色黄如脓 [问答题,案例分析题]南淮公司为上市公司,有关股份支付资料如下。(1)2×11年12月31日经董事会批准,南淮公司实施股权激励计划,其主要内容如下:公司向其100名管理人员每人授予10万份股票期权,这些人员从2×12年1月1日起必须在该公司连续服务3年,服务期满时才能以每股3元购买 [单选]9岁小儿患慢性肾功能衰竭,近日出现嗜睡,心音低钝,心电图T波高尖,腱反射消失,考虑可能的原因为()A.感染B.低钠C.低镁D.代谢性酸中毒E.高钾血症 [单选]经济增长论的基本观点是,()是一个国家或地区经济活动的中心内容。A.工业化B.经济增长C.社会化D.信息化 [单选]婴儿期保健预防传染病的最有效措施是()A.增加户外活动时间B.提倡母乳喂养C.补充各种微量元素、预防贫血D.及时添加辅食E.预防接种 [单选]()是美术中最主要的一种艺术形式。A.绘画B.雕塑C.工艺美术D.书法 [填空题]私人课程大多采用()的上课形式。 [单选]一个行业或企业的形象、信用和声誉,往往表现为该行业或企业的服务与产品在()中的信任程度。A、国际市场B、经销商C、社会公众D、政府主管部门 [单选]对于脐带恰当的是()A.脐带表面被绒毛膜覆盖B.脐带长度<20cm为脐带过短C.脐带长度>90cm为脐带过长D.足月妊娠脐带长度平均60~70cmE.脐带缠绕以缠绕胎儿颈部居多 [填空题]()是指催化剂活性丧失后经过某些措施可重新恢复的中毒。 [单选]电力系统中过载和短路故障的保护设备是()。A.负荷开关B.接触器C.熔断器D.隔离开关 [多选]鼠疫的预防A.灭鼠灭蚤,监控鼠间鼠疫B.加强疫情报告C.用来苏水消毒病人排泄物和分泌物D.加强个人防护E.预防服药和预防接种
