2013化学一轮复习课件(考向探究+典例):第23讲 化学平衡的移动(鲁科版)
【高考】化学一轮复习化学平衡状态化学平衡的移动优秀PPTppt课件

原平衡体系―充―入―惰―性―气―体→体系总压强增大―→体系中各组 分的浓度不变―→平衡不移动。
②恒温、恒压条件:
原平衡体系――充―入―惰―性―气―体―→ 容器容积增大,各反 ―→ 应气体的分压减小
(3)同等程度地改变反应混合物中各物质的浓度时,应视为压 强的影响。
典例剖析
1.对可逆反应 2A(s)+3B(g) C(g)+2D(g) ΔH<0,在一定条件下
2HI(g)达到化学平衡状态的 ()
该反应是一个反应前后气体总体积不变的反应,无论是否达到平衡,只要温 度不变,其混合气体的压强就不会改变,A 错误;C 项没有给出表示的化学 反应速率是正反应速率还是逆反应速率,不能确定是否达到平衡,C 错误; 浓度具体比值还与投入起始量有关,不能作为平衡建立的标志,D 错误;由 于三种气体中只有 I2 是有颜色的,颜色不变说明 I2 的质量分数不变,已达到 了平衡,B 正确。
④在单位时间内生成n mol B,同时消耗q mol D,二者变化均表示v(逆)
不一定
典例剖析
1.一定温度下,可逆反应 H2(g)+I2(g) 标志是 A.混合气体的压强不再变化 B.混合气体的颜色不再变化 C.反应速率 v(H2)=12v(HI) D.c(H2)∶c(I2)∶c(HI)=1∶1∶2
②各物质的质量或各物质的质量分 数一定
③各气体的体积或体积分数一定
平衡状态 平衡
平衡 平衡
类型
判断依据
平衡状态
①在单位时间内消耗了m mol A,同时生
平衡
成m mol A,即v(正)=v(逆) 37、让我们享受人生的滋味吧,如果我们感受得越多,我们就会生活得越长久。——法朗士
10.伟大的人物都走过了荒沙大漠,才登上光荣的高峰。
高考化学一轮课件第23讲化学平衡的移动

考点一
栏目索引
压强的改变,但判断平衡移动的方向时,应以浓度的影响去考虑。 (6)“惰性气体”对化学平衡的影响 ①恒温、恒容条件
原平衡体系
体系总压强增大 体系中各组分的浓
度不变 平衡不移动
②恒温、恒压条件
原平衡体系
容器容积增大,各反应气体分压减小
体系中各组分的浓度同倍数减小(相当于减压)
——
考点一
二、化学平衡图像题解题指导 (1)看图像:一看轴,即纵、横坐标的意义;二看点,即起点、拐点、交点、 终点;三看线,即线的走向和变化趋势;四看辅助线,即等温线、等压线、 平衡线等;五看量的变化,如浓度变化、温度变化、转化率变化、物质 的量的变化等。 (2)依据图像信息,利用平衡移动原理,分析可逆反应的特征:吸热还是放 热,气体体积增大、减小还是不变,有无固体或纯液体参加或生成等。 (3)先拐先平数值大:在化学平衡图像中,先出现拐点的先达到平衡,可能 是温度高、压强大或使用了催化剂。 (4)定一议二:图像中有三个变量时,先固定一个量,再讨论另外两个量的 关系。
考点一
栏目索引
典例1 N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5 (g) 4NO2(g)+O2(g) ΔH=+Q kJ/mol,一定温度时,向密闭容器中通入 N2O5,部分实验数据见下表:
时间/s
0
500
1 000
1 500
c(N2O5)(mol/L) 0.50
0.35
0.25
考点突破 栏目索引
考点突破
考点一 化学平衡移动 考点二 与化学平衡有关的图像问题
考点一 化学平衡移动
考点一
栏目索引
1.分析化学平衡移动的一般思路
高考化学一轮复习 第7章 化学反应的方向、限度与速率 第23讲 化学平衡移动原理及应用课件 鲁科版

增大反应物浓度或减小生 向正反应 方向移
成物浓度
动
浓度
逆反应
减小反应物浓度或增大生
向 方向移动
答案
反应前后气 压强(对 体分子数改 有气体 变 存在的
反应前后气 反应)
体分子数不 变
增大压 向气体体减积小
的
强
方向增大移动
减小压 向气体平体衡积不移动 的方
强
吸热向移动
改变压 强
放热 平衡不移动
答案
(2)勒·夏特列原理 如果改变影响化学平衡的条件之一(如温度、压强以及参加反应的 化学物质的浓度),平衡将向着能够 减弱这种改变 的方向移动。
(4)同等程度地改变反应混合物中各物质的浓度时,应视为压强的影响。
深度思考
1.正误判断,正确的划“√”,错误的划“×” (1)化学平衡发生移动,化学反应速率一定改变;化学反应速率改变, 化学平衡也一定发生移动(×) (2)升高温度,平衡向吸热反应方向移动,此时v放减小,v吸增大(×)
答案
2.对于一定条件下的可逆反应
3.化学平衡移动与化学反应速率的关系 (1)v正>v逆:平衡向 正反应方向 移动。 (2)v正=v逆:反应达到平衡状态, 不发生 平衡移动。 (3)v正<v逆:平衡向 不发生 移动。
答案
4.影响化学平衡的外界因素 (1)影响化学平衡的因素 若其他条件不变,改变下列条件对化学平衡的影响如下:
条件的改变(其他条件不变) 化学平衡的移动
答案
12345 6
(3)平衡后,通入a mol SO2,b mol O2,c mol SO3,则SO2的转化率 _增__大_____,O2的转化率__增__大____,SO2的百分含量__减__小____,O2的 百分含量___减__小___,SO3的百分含量__增__大____。 (4)平衡后,通入2 mol SO3,则平衡向_逆__反__应___(填“正反应”或 “ 逆 反 应 ”) 移 动 , SO2 的 百 分 含 量 __减__小____ , O2 的 百 分 含 量 __减__小____,SO3的百分含量__增__大____。 (5)平衡后,升温,则SO2转化率_减__小_____,O2的转化率___减__小___, SO2的百分含量__增__大____,O2的百分含量__增__大____,SO3的百分含量 __减__小____。
《化学平衡的移动》PPT课件

催化剂对化学平衡无影响,但能改变反应 速率。
2024/1/24
6
02 沉淀溶解平衡移动
2024/1/24
7
沉淀生成与溶解过程
01
02
03
沉淀的生成
当溶液中某种离子的浓度 超过其溶度积常数(Ksp )时,就会生成沉淀物。
2024/1/24
沉淀的溶解
当溶液中存在能与沉淀物 发生反应的离子时,沉淀 物会溶解并重新进入溶液 。
电子得失守恒法
适用于较复杂的氧化还原反应。首先分析反应前后元素化合价变化, 找出氧化剂和还原剂,计算得失电子总数,使电子得失总数相等。
2024/1/24
17
氧化还原平衡移动实例分析
沉淀溶解平衡的移动
通过改变离子浓度、温度或加入能与体 系中某些离子反应生成更难溶或更难电 离物质的试剂,使平衡向生成沉淀或溶 解的方向移动。例如,向$AgCl$饱和溶 液中加入$NaI$溶液,由于$AgI$比 $AgCl$更难溶,因此$AgCl$会转化为 $AgI$沉淀。
沉淀溶解平衡的应用
判断沉淀的生成与溶解,计算沉淀的溶解度,以及指导科研和生产实践。
2024/1/24
5
影响化学平衡因素
温度
浓度
升高温度,平衡向吸热方向移动;降低温 度,平衡向放热方向移动。
增大反应物浓度或减小生成物浓度,平衡 向正反应方向移动;反之,平衡向逆反应 方向移动。
压强
催化剂
对于有气体参加的反应,增大压强,平衡 向气体体积减小的方向移动;减小压强, 平衡向气体体积增大的方向移动。
2024/1/24
19
配合物组成和结构特点
01
02
03
04
配合物由中心离子和配 体组成
高考化学大一轮复习 7.23 化学平衡的移动和化学反应进行的方向精讲课件

应用 1 [2012·安徽卷]一定条件下,通过下列反应可实
现燃煤烟气中硫的回收:
催化剂
SO2(g)+2CO(g)
2CO2(g)+S(l) ΔH<0
若反应在恒容的密闭容器中进行,下列有关说法正确的
是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
第三十五页,共78页。
C.平衡时,其他条件不变,升高温度可提高 SO2 的转化 率
D.其他条件不变,使用不同催化剂,该反应的平衡常数 不变
第三十六页,共78页。
解析:本题主要考查外界条件对化学平衡的影响,同时 考查考生应用基础知识解决简单化学问题的能力。因反应前 后气体分子数不相等,达到平衡前容器内压强逐渐变小,A 项错误;硫为纯液体,减少硫的量不影响化学反应速率,B 项错误;升高温度,化学平衡逆向移动,SO2 的转化率降低, C 项错误;只有温度的改变,会影响反应的平衡常数,采用 不同的催化剂,只会改变化学反应速率,对化学平衡无影响, 化学平衡常数不变,D 项正确。
第二十七页,共78页。
核心考点(kǎo diǎn) 引领 通关
考点(kǎo diǎn)分类 点点 击破
第二十八页,共78页。
考点一 化学平衡移动的分析 1.实质 化学平衡移动的实质是外界条件(如浓度、温度、压强)破
坏了原平衡状态,使正、逆反应速率不再相等,当 v(正)>v(逆) 时,平衡向正反应方向移动,当 v(正)<v(逆)时,平衡向逆反 应方向移动,当 v(正)=v(逆)时,平衡不发生移动,然后在新 的条件下达到正、逆反应速率再次相等。
再 如 转 化 关 系 : AgNO3 ―C―l-→ AgCl ―B―r-→ AgBr ――I-→ AgI―S―2-→Ag2S↓得以进行,也是由于打破了各物质的溶解平 衡,生成了更难溶的物质。
化学平衡ppt23 鲁科版

【温馨提示】从化学平衡的特征判断可逆反应是 否达到化学平衡时,要特别注意外界条件的限制 及反应本身的特点,如“恒温、恒容”、“体积可变”、 “体积不变”、“全是气体参加”等。
1.(湖南省长沙市一中2010届高三第五次月考)在一 定温度下,一定体积的密闭容器中有如下平衡: H2(g)+I2(g) 2HI(g),已知H2和I2的起始浓度均 为0.1 mol· L-1时,达平衡时HI的浓度为0.16 mol· L-1。 若H2和I2的起始浓度均变为0.2 mol· L-1,则平衡时 H2的浓度( mol· L-1)是( C ) A.0.16 B.0.08 C.0.04 D.0.02
重要考点2
化学平衡常数的应用
1.判断正在进行的可逆反应是否平衡及反应向何方向进行: 对于可逆反应:mA(g)+nB(g) pC(g)+qD(g),在一定 的温度下的任意时刻,反应物的浓度和生成物的浓度有如 下关系:Qc=[cp(C)· cq(D)]/[cm(A)· cn(B)],叫该反应的浓度 商。 Qc<K,反应向正反应方向进行; Qc=K,反应处于平衡状态; Qc>K,反应向逆反应方向进行。 2.利用K可判断反应的热效应 若升高温度,K值增大,则正反应为吸热反应。 若升高温度,K值减小,则正反应为放热反应。
3.注意 化学平衡常数只与温度有关,与反应物或生成 物的浓度无关。 在平衡常数表达式中:反应物或生成物中固体、 纯液体、稀溶液中水的浓度不写。
C(s)+H2O(g) CO(g)+H2(g), K=c(CO)· c(H2)/c(H2O) FeO(s)+CO(g) Fe(s)+CO2(g), K=c(CO2)/c(CO) 化学平衡常数表达式与化学方程式的书写有关 例如:N2(g)+3H2(g) 2NH3(g)的平衡常数为K1, 1/2N2(g)+3/2H2(g) NH3(g)的平衡常数为K2, NH3(g) 1/2N2(g)+3/2H2(g)的平衡常数为K3; 写出K1和K2的关系式:K1= 。 写出K2和K3的关系式:K2· K3=1。 写出K1和K3的关系式:K1· =1。
高中化学一轮复习第七章第23讲 化学平衡的移动和化学反应进行的方向 PPT100张

见学生用书P157
微考点 1 影响化学平衡移动的因素 一、对平衡移动概念的理解
二、影响化学平衡的外界因素 1.影响化学平衡的因素
条件的改变(其他条件不变) 增大反应物浓度或 减小生成物浓度
浓度 减小反应物浓度或 增大生成物浓度
化学平衡的移动 向 正 反应方向移动 向 逆 反应方向移动
压强(对有 气体存在 的反应)
解析 不导热的密闭容器中,等压时,通入惰性气体,体积增大,x(g) +3y(g) 2z(g)平衡逆向移动,放出热量,体系温度升高,a(g)+b(g) 2c(g) 平衡逆向移动,c 的物质的量减少;B 项,等压时,通入 z 气体,x(g)+ 3y(g) 2z(g)平衡逆向移动,体系温度升高;C 项,等容时,通入惰性气 体,反应物浓度不变,各反应速率不变;D 项,等容时,通入 z 气体,x(g) +3y(g) 2z(g)平衡逆向移动,y 的物质的量浓度增大。
A.升高温度
B.加水稀释
C.增大 Fe2+的浓度
D.常温下加压
解析 正反应放热,升高温度,平衡向逆反应方向移动,A 项错误; 加水稀释,平衡向离子数目增多的方向移动,平衡向逆反应方向移动,B 项错误;常温下加压对水溶液的平衡移动几乎无影响,D 项错误。
答案 C
2.为了探究外界条件对反应 aX(g)+bY(g) cZ(g)的影响,以 X 和 Y 物质的量之比为 a∶b 开始反应,通过实验得到不同条件下达到平衡时 Z 的 体积分数,实验结果如下图所示。以下判断正确的是( )
微诊断
判断正误,正确的画“√”,错误的画“×”。 1.温度改变,平衡一定发生移动。( √ ) 提示 任何反应都伴随着能量的变化,通常表现为吸热或放热,故温
度改变,化学平衡将发生移动。 2.只要 v(正)增大,平衡一定正向移动。( × ) 提示 平衡正向移动是因为 v(正)大于 v(逆),若 v(正)、v(逆)都增大,
高三鲁科化学一轮复习精品练习 第讲 化学平衡的移动 含解析
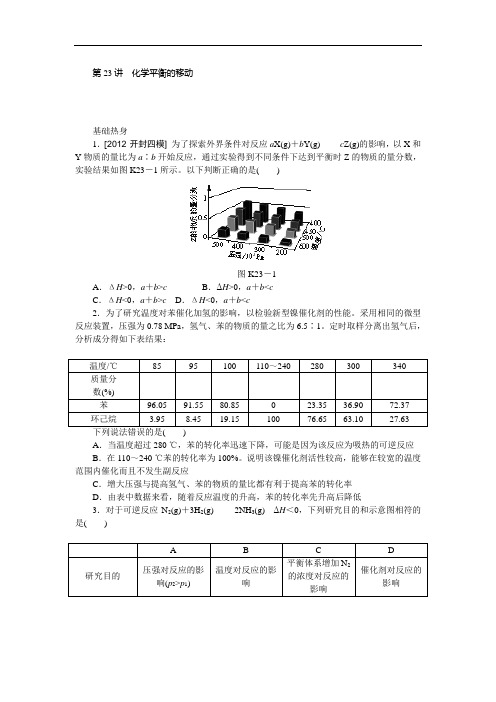
第23讲化学平衡的移动基础热身1.[2012·开封四模]为了探索外界条件对反应a X(g)+b Y(g)c Z(g)的影响,以X和Y物质的量比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图K23-1所示。
以下判断正确的是()图K23-1A.ΔH>0,a+b>c B.ΔH>0,a+b<cC.ΔH<0,a+b>c D.ΔH<0,a+b<c2.为了研究温度对苯催化加氢的影响,以检验新型镍催化剂的性能。
采用相同的微型反应装置,压强为0.78 MPa,氢气、苯的物质的量之比为6.5∶1。
定时取样分离出氢气后,分析成分得如下表结果:温度/℃85 95 100 110~240 280 300 340 质量分数(%)苯96.05 91.55 80.85 0 23.35 36.90 72.37 环己烷 3.95 8.45 19.15 100 76.65 63.10 27.63A.当温度超过280 ℃,苯的转化率迅速下降,可能是因为该反应为吸热的可逆反应B.在110~240 ℃苯的转化率为100%。
说明该镍催化剂活性较高,能够在较宽的温度范围内催化而且不发生副反应C.增大压强与提高氢气、苯的物质的量比都有利于提高苯的转化率D.由表中数据来看,随着反应温度的升高,苯的转化率先升高后降低3.对于可逆反应N2(g)+3H2(g)2NH3(g)ΔH<0,下列研究目的和示意图相符的是()A B C D研究目的压强对反应的影响(p2>p1)温度对反应的影响平衡体系增加N2的浓度对反应的影响催化剂对反应的影响图示4.对于任何一个化学平衡体系,以下变化或采取的措施,平衡一定发生移动的是()①加入一种反应物,②增大体系的压强,③升高温度,④使用催化剂,⑤化学平衡常数减小A.①②③⑤B.①②③④⑤C.③⑤D.①②③5.对处于化学平衡的体系,关于化学平衡与化学反应速率的关系正确的是()A.化学反应速率变化时,化学平衡一定发生移动B.只有在催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况C.正反应进行的程度大,正反应速率一定大D.化学平衡发生移动时,化学反应速率一定变化能力提升6.[2012·厦门模拟]往2 L密闭容器中充入NO2,在三种不同条件下发生反应:2NO2(g) 2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(不考虑生成N2O4)。
【高考】化学一轮复习化学平衡及平衡移动ppt课件

cp (C)cq (D) cm ( A)cn (B)
Q > k,未达平衡,反应逆向进行。
Q = k,反应达平衡。 Q < k,未达平衡,反应正向进行。
(3) 判断反应的热效应。 (4) 平衡常数的计算(平衡计算)
练习1.在一个不传热的固定容积的密闭容器中可逆反应 mA(g)+nB(g) pC(g)+qQ(g) 当m、n、p、q为任意整 数时,达到平衡的标志是 ①体系的压强不再改变 ②体系的温度不再改变 ③各组分的浓度不再改变 ④各组分的质量分数不再改变 ⑤反应速率v(A):v(B):v(C):v(D) =m:n:p:q ⑥单位时间内m mol A断键反应,同时pmol C也断键反应
4、 应用: (1) 利用K可以判断反应的热效应:
若升高温度, K 值增大,正反应是吸热反应; 若升高温度, K 值减小,正反应是放热反应。
(2) 借助K判断在某温度下,某时刻反应是否达平衡。若未达平 衡,反应进行的方向
浓度商Q:
对于可逆反应: mA(g)+nB (g)
pC(g)+qD(g)
Q
=
2NO2 (g)
N2O4 (g) △H<0
升高温度,平衡向吸热方向移动;
降低温度,平衡向放热方向移动。
注:升高温度同时加快正逆反应速率,但吸热 反应的速率增加的更多,故升温使可逆反应向 吸热反应方向移动。即温度对吸热反应的速率 影响更大。
-
温度对化学平衡的影响:
速 率
时
间
关
A
B
系
图
D C
课堂练习
0
t1
t2
t3
V”正 = V”逆 平衡状态Ⅱ
t(s)
高考化学一轮复习(考向探究+典例)第23讲 化学平衡的移动课件 鲁科版

浓 增大 SO2 的浓度 度 减小 SO3 的浓度
减小 SO2 的浓度
增大 SO3 的浓度
增大 不变 减小
不变
不变 减小 不变
增大
v 正>v 逆 v 正>v 逆 v 正<v 逆
v 正<v 逆
正向 逆向
返回目录
第23讲 化学平衡的移动
考
向
互 动
改变一
改变条件瞬间
达到新 平衡前
平衡移
探 究
个条件
v正
v逆
新做平化衡学状平态衡移动。
返回目录
第23讲 化学平衡的移动
考
向• 互•
动 探 究
(2)过程
• (3)平衡移动方向与反应速率的关系
•
①v正_>_______v逆,平衡向正反应方向移动;
•
②v正_=_______v逆,平衡不移动;
•
③v正<________v逆,平衡向逆反应方向移动。
返回目录
第23讲 化学平衡的移动
考
向
互
动
探
究 典
第23讲 化学平衡的移动
型
易
错
必
纠教
师
备
用
习
题
返回目录
考纲要求
1.理解外界条件(浓度、温度、压强、催化剂等)对反应 速率和化学平衡的影响,认识其一般规律。
2.了解化学反应速率和化学平衡的调控在生活、生产 和科学研究领域中的重要作用。
返回目录
网络导图
返回目录
第23讲 化学平衡的移动
2.[2010·北京卷] “NO2 球”浸泡在冷水中,颜色变浅, 2NO2(g) N2O4(g) ΔH<0( )
化学:《化学平衡的移动》教案(鲁科)

第二节化学反应的快慢和限度第三课时化学平衡的移动【教学目标】1. 化学平衡的标志2. 平衡移动的影响因素【教学重点、难点】平衡移动的影响因素【教学方法】实验法讨论法【引入】分析反应2N0 . “ N?O4【问题】反应条件的改变,会影响化学平衡状态吗?化学平衡随条件的变化而变化,哪些条件对化学平衡有影响?【板书】三、化学平衡的移动【观察•思考】温度对NQ与2Q反应平衡状态是如何影响的?为什么条件的改变平衡状态被破坏?【阐述】在2NQ — N2Q4的反应中,已知生成NQ4的反应是放热反应,当温度升高时,气体颜色变深,说明NQ的浓度增大,升高温度有利于NQ的生成。
温度的改变使正、逆反应速率不等,原平衡被破坏,可见化学平衡是在一定条件下建立的,同一可逆反应条件不同平衡状态不同,即化学平衡发生移动。
【板书】1. 化学平衡移动:化学平衡只有在一定的条件下才能保持平衡。
如果一个可逆反应达到平衡状态以后,反应条件(如浓度、压强、温度等)改变了,平衡混合物里各组成物的质量分数也就随之改变而达到新的平衡状态,这叫化学平衡的移动。
化学平衡移动,【讨论】(1) 化学平衡状态改变时,哪些物理量会发生改变?哪个物理量的变化利于观察? (2) 实验过程中,什么现象可以表征各物质的浓度是否发生了变化? 【板书】2. 影响化学平衡移动的因素【实验】温度改变时,反应 2NO 一的化学平衡状态会改变吗? 【实验探究】补充浓度、压强对化学平衡移动的影响 浓度对Fe 3+与SCM 反应平衡状态的影响O.OImol / L FeCI3和 O.OImol / LKSCN 等体积混合 Fe 3+ + 3SCN^ “ Fe(SCN) 3.tUliiiol-lFeCh iDlmol /LKSCN对比压强对NO 与N b C h 反应平衡状态的影响增大压强反应混合物的颜色先变深后变浅,N 2C 4的方向移动;减小压强反应混合物的颜色先变浅后变深, NC 的方向移动。
高三化学第一轮复习课件23讲-化学平衡

探究点三 化学平衡常数 【知识梳理】 温度 1.化学平衡常数概念:在一定______下,一个可逆反 应达到平衡状态时,生成物________________与反应物 浓度幂之积 ________________的比值是一个常数,即为化学平衡常数。 浓度幂之积
2.化学平衡常数的数学表达式 对于一般可逆反应:mA(g)+nB(g)
第23讲 │要点探究
2.利用化学平衡状态的特点来判断 处于平衡状态的化学反应,其特点表现 为“三定”,即:反应物的转化率一定、反应 混合体系中各物质的百分含量一定、反应混合 体系中各物质的浓度一定。上述中的任一种都 能说明反应已达平衡状态。即“特征量一定, 达到平衡”。 3.利用“变量恒定,达到平衡”与“不 变量”来判断 选定反应中“变量”,即随反应进行而变化 的量,当变量不再变化时,反应已达平衡。常 见的变量有:气体的颜色;对于
A①中可换算成“单位时间内生成n mol O2, 同时消耗n mol O2”,正逆反应速率相等,已达 平衡;②、③指的是同一反应方向,不能说明反 应已达平衡,④⑥中均为变量,变量不变时,反 应已达平衡;⑤中为常量,不能说明反应已达平 衡。 [点评] 当题目以直接或间接的形式给出“反应 速率相等”时,要特别注意是否指的是正、逆两 个反应方向,还要注意是否是用同一种物质表示 的反应速率。如该题中v(NO2)正=v(O2)逆时, 则换算成用同一种物质表示的反应速率时是不相 等的,也不能说明反应已达平衡。下面的变式题 从多个角度对化学平衡状态的判断进行了考查。
第23讲 │ 化学平衡
第23讲
化学平衡
第23讲 │ 考纲导学 考纲导学
考纲要求
1.了解化学反应的可 逆性。 2.了解化学平衡建立的 过程。 3.了解化学平衡常数的 含义,能利用化学平衡常数 进行相关计算。
化学平衡的移动PPT课件

化学2(必修)
第二章
第二节 化学反应的快慢和限度(3)
化学平衡的移动
1.化学平衡移动 当条件改变时,原来的化学平衡被破 坏,并在新的条件下建立新的化学平衡。
分小组讨论:
2NO2
N2O4
(无色)
(红棕色)
(1)请你描述上述反应处于化学平衡状态时,在同一瞬间参
加反应的各微粒间的数量关系。
【小结】判断化学反应达到平衡的标志 2、在容积不变密闭容器中,对于合成氨反应是 1) V( 正 )= V( 逆 ) 否达到平衡的标志是 ①正逆反应的描述:同一物质消耗和生成, 1)V(N2)∶V(H2)= 1∶3 反应物和生成物消耗或生成 2) V(N2)∶V(NH3)= 1∶2 ②速率相等:同一物质速率的数值相等, 3) V(NH3)= 2 V(N2) 不NH3)分解= V(NH3)合成 2)混合气体中各组分的体积百分含量不变( 5) C(NH3)= 2 C(N2) 或某物质的物质的量不变) 6)压强不变 3)反应前后气体的体积不等时,压强不变或平均分 7) 每消耗 n mol N2的同时生成 2n mol NH3 子量不变或密度不变 8)密度不变 4)同种物质化学键的断裂与化学键的形成的物质的 9) 混合气体中氮气的体积百分含量不变 量等,体系中含有色物质时,颜色不 随时间的变化而变化
现象:两支试管的溶液颜色均变浅。
– 上述实验说明什么?反应物、生成物浓度的 改变对平衡状态的改变有何影响?
FeCl3 +3KSCN 浅黄色 离子方程式: Fe3+ +3SCN浅黄色
Fe(SCN)3 +3KCl 红色 Fe(SCN)3
红色
浓度对化学平衡的影响
结论:(其它条件不变的情况下)
【化学】23《化学平衡的移动》(最新课件)

N2(g)+ 3H2(g) ⇌ 2NH3(g)
N2O4
2NO2
FeO(s)+CO(g)⇌Fe(s)+
CO2(g)
正向移动 K
c2(NH3) c(N2)c3(H2)
K c 2 ( N O2 ) 逆向移动 c(N 2O4 )
K c (C O 2 ) 不移动
c(C O )
逆向移动 正向移动 不移动
【化学】23《化学平衡的移动》(最新课件)
=
(p+q-m-n)
a
×
[C]p [D]q [A]m [B]n
增大压强,则 a﹥1
若 m+n﹥p+q ,则K’ ﹤ K ,平衡正向移动。 若 m+n﹤p+q ,则K’ ﹥ K ,平衡逆向移动。 若 m+n=p+q ,则K’ =K ,平衡不发生移动。
【化学】23《化学平衡的移动》(最新课件)
13
增大压强,a﹥1
【化学】23《化学平衡的移动》
Dr.Feng
【化学】23《化学平衡的移动》(最新课件)
1
一、化学平衡的移动
1、概念:改变外界条件,破坏原有的平衡状态,建立起新的平 衡状态的过程。
2、移动的原因:外界条件发生变化。
旧平衡 条件改变
v正≠v逆
一段时间后
3、正逆反应速率与平衡移动的方向:
新平衡
①若V正>V逆 , 平衡向正反应方向移动。 ②若V正<V逆 , 平衡向逆反应方向移动。 ③若V正=V逆 , 平衡不移动。
15.3
10 81.5
20 30 86.4 89.9
60 95.4
100 98.8
300
2.2 52.0 64.2 71.0 84.2ห้องสมุดไป่ตู้92.6
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
返回目录
第23讲
考 向 互 动 探 究
化学平衡的移动
探究考向一 反应条件对化学平衡的影响 —— 知 识 梳 理 —— 1.化学平衡移动 (1)概念:可逆反应达到平衡状态以后,若反应条件 浓度 温度 (如________、________、________等)发生了变化,平衡 压强 改变 混合物中各组分的浓度也会随之________,从而在一段时 新的平衡状态 原平衡状态 间内达到________________。这种由________________向 新平衡状态 ________________的变化过程,叫做化学平衡移动。
►
返回目录
第23讲
考 向 互 动 探 究
化学平衡的移动
(2)过程
(3)平衡移动方向与反应速率的关系 ①v正________v逆,平衡向正反应方向移动; > = ②v正________v逆,平衡不移动; < ③v正________v逆,平衡向逆反应方向移动。
返回目录
第23讲
考 向 互 动 探 究
化学平衡的移动
正向 ____移动
返回目录
第23讲 化学平衡的移动
考 向 互 动 探 究
任意平衡
催化剂 ________
增大 ______压强 反应前后气 体化学计量 数和相等的 平衡
减小 ______压强
____移动 不
返回目录
第23讲
考 向 互 动 探 究
化学平衡的移动
2.物质的量浓度与时间图像 由这类图像可判断化学方程式
[答案] 提示:正、逆反应速率同等倍数改变,平衡 不移动,不同等倍数改变,平衡发生移动。平衡发生移 动,化学反应速率一定改变。
返回目录
第23讲
考 向 互 动 探 究
化学平衡的移动
【触摸高考】 高考选项正误判断
1.[2012· 安徽卷] 反应 SO2(g)+2CO(g) 2CO2(g)+ S(l) ΔH<0 在恒容的密闭容器中进行,平衡时,其他条件 不变,分离出硫,正反应速率加快( )
返回目录
第23讲
考 向 互 动 探 究
化学平衡的移动
化学反应速率与化学平衡图像 —— 知 识 梳 理 —— 1.速率—时间图像及其应用 速率—时间图像揭示了v正、v逆随时间(含条件改变对 速率的影响)而变化的规律,体现了外界条件改变对可逆 反应的影响,由此引发的平衡移动。
►
探究考向二
返回目录
第23讲 化学平衡的移动
(3)
(4)
< p2 压强先达到平衡,故 p1______p2, < 加压,C%减小,m+n______p+q
返回目录
第23讲 化学平衡的移动
考 向 互 动 探 究
序 号 (5)
图像
分析反应的特点
> (1)p1______p2,m+n=p+q (2)条件为加入了催化剂 < 由(A)、(B)两线可知,p1____p2, < m+n____p+q,由(B)、(C)两 < 线可知,两线可知,T1______T2, < Δ H_____0
返回目录
第23讲
化学平衡的移动
考 向 2.对勒· 夏特列原理的理解 互 在封闭体系中,如果只改变平衡体系中的一个条件时, 动 探 平衡将向减弱这个条件改变的方向移动。以 2SO2(g)+O2(g) 究 2SO (g) ΔH<0 为例:
3
改变条件瞬间 改变一 个条件 增大 SO2 的浓度 浓 减小 SO3 的浓度 度 减小 SO2 的浓度 v正 增大 不变 减小 v逆 不变 减小 不变
[解析]× 率。
硫为液体,减少其量不影响化学反应速
2. [2010· 北京卷] “NO2 球”浸泡在冷水中, 颜色变浅, 2NO2(g) N2O4(g) ΔH<0( )
[解析] √ 动。 降温平衡向放热的方向,即正反应方向移
返回目录
第23讲
化学平衡的移动
考 —— 核心突破 —— 向 互 1.化学平衡与化学反应速率的关系 动 改变条件 探 究 速率不变:如容积不变时充入稀有气体―→
返回目录
第23讲
考 向 互 动 探 究
化学平衡的移动
(3)压强的影响
气体体积减小
气体体积增大
不移动 ②Δ ν g=0的反应:改变压强,平衡___________。 (4)催化剂的影响 使用催化剂,因其能同等倍数地改变正、逆反应速 不 率,平衡________移动。 3.勒· 夏特列原理 (1)内容 如果改变影响平衡的条件之一(如浓度、压强或温 能够减弱这种改变 度),平衡将向着____________________的方向移动。
增大 SO3 的浓度移 平衡前 v 正与 v 逆关 动方向 系 v 正>v 逆 正向 v 正>v 逆 v 正<v 逆 逆向
v 正<v 逆
返回目录
第23讲
考 向 互 动 探 究
化学平衡的移动
改变一 个条件 缩小容器的体积 压强 扩大容器的体积
改变条件瞬间 v正 增大 减小 v逆 增大 减小
纵坐标 氨气的 转化率 Z 的体 积分数
甲 500 ℃ 充入稀有 气体
乙 400 ℃ 不充稀 有 气体 活性一 般 的催化 剂
在体积可变的恒压容器中,充入体积 C 比 1∶3 的 N2、H2,发生反应 N2(g)+3H2(g) 2NH3(g)
氨气的 浓度
活性高的 催化剂
D
2 mol SO3,在相同温度下发生反应 2SO3(g) 2SO2(g)+O2(g)
由 上 图 可 知 , 反 应 的 方 程 式 为 2C 2A+3B ___________________________。
返回目录
第23讲 化学平衡的移动
考 向 互 动 探 究
3.转化率或百分含量与时间、压强、温度的图像 对于化学反应mA(g)+nB(g) pC(g)+qD(g)
序 号 图像 分析反应的特点
考 向 互 动 探 究 典 型 易 错 必 纠 教 师 备 用 习 题
第23讲 化学平衡的移动
返回目录
考纲要求
1.理解外界条件(浓度、温度、压强、催化剂等)对反应 速率和化学平衡的影响,认识其一般规律。 2.了解化学反应速率和化学平衡的调控在生活、生产 和科学研究领域中的重要作用。
返回目录
网络导图
SO2 物 质的量
2 个大 气压
10 个 大 气压
返回目录
第23讲
考 向 互 动 探 究
化学平衡的移动
[解析] D A项,正反应为吸热反应,温度越高,氨气 转化率越大,且反应速率越快,先达平衡,故该项不符合 图示;容积不变,充入惰性气体对平衡无影响,B项不符 合图示;催化剂不能改变反应的限度,C项错误;D项中压 强越大反应速率越快,先达平衡,同时,压强越大,反应 进行的程度越小,二氧化硫的物质的量也越少,D项符合 图示。 规律技巧 从图像上看,乙首先达到平衡,且两次平衡 时对应纵坐标不相等,说明乙的反应速率快,要么温度 高、要么压强大,故解题时可先排除A、C项,使解题过程 简单化。
逆向 ____移动
正向 ____移动
返回目录
第23讲 化学平衡的移动
考 向 互 动 探 究 平衡 体系 条件变化 平衡变化 速率变化曲线
正反 应方 向为 气体 体积 增大 的放 热反 应
________压强 升高 或________ 温度
增大
逆向 ____移动
减小
_______压强 降低 或_______ 温度
返回目录
第23讲
考 向 互 动 探 究
化学平衡的移动
变式题 [2012· 杭州模拟] 下列事实不能用勒· 夏特列 原理解释的是( ) ①氯化铁溶液加热蒸干最终得不到氯化铁固体; ②铁在潮湿的空气中容易生锈; ③实验室可用排饱和食盐水的方法收集氯气; ④常温下,将1 mL pH=3的醋酸溶液加水稀释至100 mL,测得其pH<5; ⑤二氧化氮与四氧化二氮的平衡体系,加压后颜色加 深 A.①②③④ B.②③⑤ C.②④⑤ D.②⑤
考 向 互 动 探 究 平衡 体系 条件变化 平衡变化 速率变化曲线
增大 ________反 应物的浓度 任一 平衡 体系 减小 ________反 应物的浓度
正向 ____移动
逆向 ____移动
返回目录
第23讲 化学平衡的移动
考 向 互 动 探 究 平衡 体系 条件变化 平衡变化 速率变化曲线
增大 ________生 成物的浓度 任一 平衡 体系 减小 ________生 成物的浓度
化学平衡的移动
—— 典例精析 ——
例 1 下列表格中的各种情况,可以用如图 7-23-1 所示 的曲线表示的是( )
返回目录
第23讲
考 向 互 动 探 究
化学平衡的移动
反应 相同质量的氨,在同一密闭容器中发 A 生反应 2NH3(g) N2(g)+3H2(g) 在温度不变的恒容密闭容器中,体积 B 比为 2∶3 的 X 和 Y 气体发生反应 2X(g)+2Y(g) Z(g)+2W(g) ΔH<0
达到新 平衡移 平衡前 动方向 v 正与 v 逆关系 v 正>v 逆 正向 v 正<v 逆 逆向
升高温度 温度 降低温度 使用催化剂 勒· 夏特列原理
增大 增大 v 正<v 逆 逆向 减小 减小 v 正>v 逆 正向 增大 增大 v 正=v 逆 不移动 改变影响化学平衡的一个条件, 平衡向减弱这种改变的方向移动
> T1温度先达到平衡,故T1______T2, > 升高温度C%增加,ΔH______0
(1)
(2)
< T2温度先达到平衡,故T1______T2, < 升高温度C%减小,ΔH______0
