3.2.P.5.5杂质谱分析模板的整理
化学药品新注册分类申报资料要求新旧对比表

立题目的与依据注册分类2:需要专门说明拟解决的问题和支持其具有明显临床优势的证据。
2号证明性文件申请制剂提供辅料的合法来源证明文件,包括辅料的批准证明文件、标准、检验报告、辅料生产企业的营业执照、《药品生产许可证》、销售发票、供货协议等的复印件4号自评估报告原4号:对主要结果结果的总结与评价的部分内容申请人对主要研究结果进行的总结,从安全性、有效性、质量可控性等方面对所申报品种进行综合评价,判断能否支持拟进行的临床试验或上市申请。
申请人应建立科学委员会,对品种研发过程及结果等进行全面审核,保障数据的科学性、完整性和真实性。
申请人应一并提交对研究资料的自查报告。
上市许可人根据《MAH制度试点方案》,符合试点行政区域、试点品种范围和申请人条件,申请成为药品MAH的申请人,应提交:1)资质证明性文件。
2)药品质量安全责任承担能力相关文件。
说明书相关5.1类药品说明书:提供生产国家或者地区药品管理机构核准的原文说明书,在生产国家或者地区上市使用的说明书实样,并附中文译本。
包装、标签设计样稿:需提供该药品在生产国家或者地区上市使用的包装、标签实样。
药品标准:中文本必须符合中国国家药品标准的格式。
原研药信息提供:合法来源证明(购货发票、赠送证明等)、实物照片、原研上市证明文件、说明书、质量标准(如有,请提供)、检验报告等。
非临床药物临床前研究应当执行有关管理规定,其中安全性评价研究必须执行GLP。
非临床安全性评价研究必须在经过GLP认证,符合GLP要求的机构进行。
2类需在相关研究中增加原研药品对临床报临床:临床试验计划及方案不需事先通过伦理委员会审查鼓励申请人提供的临床试验方案事先通过伦理委员会和科学委员会审查。
3类口服固体制剂:报临床前不需要BE3类口服固体制剂:报临床前进行BE备案及完成BE(疑惑:对已获得临床。
制剂C T D格式药学研究信息汇总表(4、5.2)
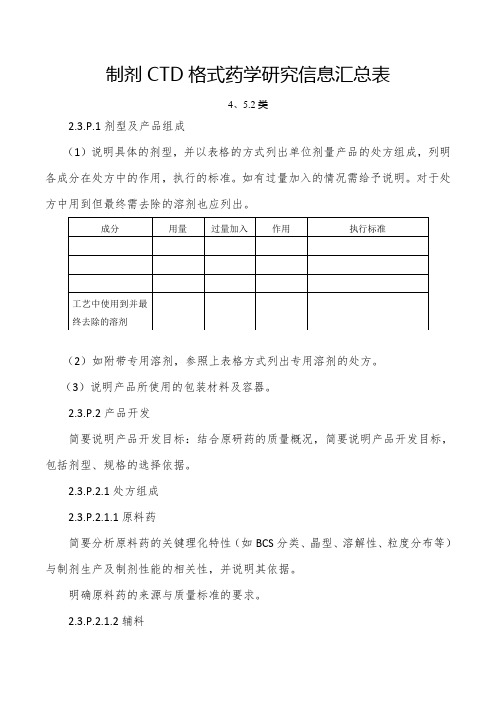
制剂CTD格式药学研究信息汇总表4、5.2类2.3.P.1剂型及产品组成(1)说明具体的剂型,并以表格的方式列出单位剂量产品的处方组成,列明各成分在处方中的作用,执行的标准。
如有过量加入的情况需给予说明。
对于处方中用到但最终需去除的溶剂也应列出。
(2)如附带专用溶剂,参照上表格方式列出专用溶剂的处方。
(3)说明产品所使用的包装材料及容器。
2.3.P.2产品开发简要说明产品开发目标:结合原研药的质量概况,简要说明产品开发目标,包括剂型、规格的选择依据。
2.3.P.2.1处方组成2.3.P.2.1.1原料药简要分析原料药的关键理化特性(如BCS分类、晶型、溶解性、粒度分布等)与制剂生产及制剂性能的相关性,并说明其依据。
明确原料药的来源与质量标准的要求。
2.3.P.2.1.2辅料简述辅料及其用量适合所用的给药途径的依据,结合辅料在处方中的作用简述辅料的与制剂性能相关的关键特性。
简述原料药和辅料的相容性试验的情况,包括试验设计、考察指标、试验结果等。
如未进行原料药和辅料的相容性试验,应提供相应的依据。
2.3.P.2.2 制剂研究2.3.P.2.2.1处方开发过程简述处方研究的主要内容。
包括处方开发的基本思路、试验设计、考察指标和方法、试验结果、与原研药的比较研究情况、处方的放大和调整等。
示例如下:某普通片剂的处方研究小结:参考原研药说明书、原辅料相容性试验情况、相关生产经验等,确定了辅料的基本种类;参考原研药的重量和大小、以及各辅料常规用量,确定了辅料的用量范围,以××××为指标,采用××××方法,对××××的种类和用量进行了比较筛选,对××××处方进行了研究,以原研药为对照药,结果显示××××,根据以上研究确定了初步的处方;在以上研究基础上,进行了影响因素稳定性考察,与原研药进行了××××的质量对比;在批量放大过程中,对××××进行了调整,确定了最终处方。
质谱谱图解析

% OF BASE PEAK
MethylCyclohexane
100
90
M=98
80
70
60
55
50
40
41
30
20
29
10
0
0 10 20 30 40 50
69
60 70
83 98(M )
80 90 100 110
CH3
m/z=98
m/z=83
4.烯烃
CH3
H3C CH C CH2 CH3
CH2 CH3 m/z=55 CH3
二、芳烃的质谱图
% OF BASE PEAK
91
100
90
CH2 CH2 CH2 CH3
80
70
92
60
50
40
30
134(M )
20 10
39 51 65 77
0
0 10 20 30 40 50 60 70 80 90 100 110 120 130 140
苯环能使分子离子稳定分子离子稳定,峰较强;
八、酰胺类化合物
1)分子离子峰较强。 2) α 裂解; γ-氢重排
九、 氨基酸与氨基酸酯
小结:
羰基化合物中 各类化合物的 麦氏重排峰
醛、酮:58+14 n 酯: 74+14 n 酸: 60+14 n 酰胺: 59+14 n
十、双取代芳环的邻位效应
芳环的邻位取代基间容易形成六元环过渡态,发生氢 的重排裂解,该效应称为邻位效应(ortho effect), 通式:
七、羰基化合物
1. 醛 脂肪醛:1)分子离子峰明显。 2)α 裂解生成 (M-1) (-H. ),( M-29) (-CHO) 和强的 m/z 29(HCO+) 的离子峰;同时伴随有 m/z 43、57、71…烃类的特征碎片峰。 3)γ-氢重排,生成 m/z 44(44+14n)的峰。
CTD资料模板

CTD资料模板(常用)资料来自:/download.do?method=list&class_id1=1,(整理:刘)目录CTD格式申报资料撰写格式(制剂) (1)CTD格式申报资料撰写格式(原料药) (2)CTD格式申报主要研究信息汇总表(制剂) (3)CTD格式申报主要研究信息汇总表(原料药) (14)化药综述资料(药学研究) (22)化药综述资料(药理毒理) (22)化药综述资料(立题目的与依据) (23)化药综述资料(主要研究结果的总结及评价) (23)化药综述资料(临床试验) (24)中药、天然药物综述资料(药学研究) (25)中药、天然药物综述资料(药理毒理) (26)中药、天然药物综述资料(临床试验) (27)中药、天然药物综述资料(主要研究结果的总结和评价) (28)化药制剂(说明书) (29)化药OTC说明书 (31)中药“生产现场检查用生产工艺”格式和内容 (33)中药生产现场检查用生产工艺的参考案例 (37)非大容量注射剂生产工艺信息表 (43)大容量注射剂生产工艺信息表 (44)CTD格式申报资料撰写格式(制剂)3.2.P.1 剂型及产品组成3.2.P.2 产品开发3.2.P.2.1 处方组成3.2.P.2.1.1 原料药3.2.P.2.1.2 辅料3.2.P.2.2 制剂3.2.P.2.2.1 处方开发过程3.2.P.2.2.2 制剂相关特性3.2.P.2.3 生产工艺的开发3.2.P.2.4 包装材料/容器3.2.P.2.5 相容性3.2.P.3 生产3.2.P.3.1 生产商3.2.P.3.2 批处方3.2.P.3.3 生产工艺和工艺控制3.2.P.3.4 关键步骤和中间体的控制3.2.P.3.5 工艺验证和评价3.2.P.4 原辅料的控制3.2.P.5 制剂的质量控制3.2.P.5.1 质量标准3.2.P.5.2 分析方法3.2.P.5.3 分析方法的验证3.2.P.5.4 批检验报告3.2.P.5.5 杂质分析3.2.P.5.6 质量标准制定依据3.2.P.6 对照品3.2.P.7 稳定性3.2.P.7.1 稳定性总结3.2.P.7.2 上市后的稳定性研究方案及承诺3.2.P.7.3 稳定性数据CTD格式申报资料撰写格式(原料药)3.2.S 原料药3.2.S.1 基本信息3.2.S.1.1 药品名称3.2.S.1.2 结构3.2.S.1.3 理化性质3.2.S.2 生产信息3.2.S.2.1 生产商3.2.S.2.2 生产工艺和过程控制3.2.S.2.3 物料控制3.2.S.2.4 关键步骤和中间体的控制3.2.S.2.5 工艺验证和评价3.2.S.2.6 生产工艺的开发3.2.S.3 特性鉴定3.2.S.3.1 结构和理化性质3.2.S.3.2 杂质3.2.S.4 原料药的质量控制3.2.S.4.1 质量标准3.2.S.4.2 分析方法3.2.S.4.3 分析方法的验证3.2.S.4.4 批检验报告3.2.S.4.5 质量标准制定依据3.2.S.5 对照品3.2.S.6 包装材料和容器3.2.S.7 稳定性3.2.S.7.1 稳定性总结3.2.S.7.2 上市后稳定性承诺和稳定性方案3.2.S.7.3 稳定性数据CTD格式申报主要研究信息汇总表(制剂)2.3.P.1 剂型及产品组成(1)说明具体的剂型,并以表格的方式列出单位剂量产品的处方组成,列明各成分在处方中的作用,执行的标准。
波谱四种谱图的综合解析

A: CH3 - CH (COOH) - O-Ph-Cl
最后对其推导的结构再进一步确认
• 推导成功!你将得到鲜花和掌声!
从估计分子式:C9H9ClO3中减去—Cl、—C6H4-、 >CH-CH3、—COOH基团,只剩下—O—基团, 因此,可拼出以下结构:
H3CHC
O
Cl
H3CHC Cl
OCOOHຫໍສະໝຸດ COOHAB
检查 MS 谱, m/e=155 、 128 、 111 均含有 C1 原子, 说明 C1 原子与苯环直接相连,因此 C1 原子上的 孤对电子与苯环发生 p-π 共轭,所以不易被丢失, 上述三个离子的裂解可有下图得到合理的解释, 所以未知物的结构应是A:
• 由 IR 谱在 32002500 cm-1 的宽 峰 和 接 近 1700 cm-1 的 强 峰 可 推测分子中可 能含有 -COOH , 在 1200-1250 附 近的强峰可推 测分子中可能 含 有 醚 键 (C-O-C);
• 从 1H-NMR 谱的高场到低场各峰的积分曲线高度比 为3:1:2:2:1,估计分子中可能是9个H,再估计 C 数 为 ( 200-9-16×3-35 ) /12=9 , 估 计 分 子 式 : C9H9ClO3 • 不饱和度=1+n4+1/2×(n3-n1) =1+9+1/2×(0-9-1)=5;
四种谱图的综合解析
• 其它辅助参考: • 物理常数的测定:熔点、沸点、比重、 折射率… … • 元素分析:C、H、N、S、O、P、F、Cl、 Br、I … … • 物理状态的观察:液、固、气味、灼烧--特证火焰颜色… …
四种谱图的综合解析
例1:由如下四种谱图解析C5H10O的结构
注射用XXXX CTD资料模板3.2.P.1~P.5

目录3.2.P.1 剂型及产品组成 (3)3.2.P.1.1剂型和产品组成 (3)3.2.P.1.2专用溶剂 (3)3.2.P.1.3包装 (3)3.2.P.2 产品开发 (3)3.2.P.2.1 处方组成 (4)3.2.P.2.1.1 原料药 (4)3.2.P.2.1.2 辅料 (7)3.2.P.2.2 制剂研究 (7)3.2.P.2.2.1 处方开发过程 (8)3.2.P.2.2.2 制剂相关特性 (14)3.2.P.2.3 生产工艺的开发 (16)3.2.P.2.3.1 小试工艺研究 (16)3.2.P.2.3.2 中试及验证生产工艺研究 (18)3.2.P.2.3.3 工艺变更情况汇总 (19)3.2.P.2.3.4代表性批次汇总 (19)3.2.P.2.4 包装材料/容器 (21)3.2.P.2.4.1 包材类型、来源及相关证明文件 (21)3.2.P.2.4.2 包材的选择依据 (21)3.2.P.2.4.3 包材选择的支持性研究 (22)3.2.P.2.5 相容性 (22)3.2.P.3 生产 (23)3.2.P.3.1 生产商 (23)3.2.P.3.2 批处方 (23)3.2.P.3.3 生产工艺和工艺控制 (23)3.2.P.3.3.1 工艺流程图 (23)3.2.P.3.3.2 工艺描述 (26)3.2.P.3.3.3 主要的生产设备 (26)3.2.P.3.3.4 拟定的大生产规模 (26)3.2.P.3.4关键步骤和中间体的控制 (26)3.2.P.3.4.1 关键步骤和工艺参数 (27)3.2.P.3.4.2 中间体的控制 (27)3.2.P.3.5 工艺验证和评价 (30)3.2.P.3.5.1 冻干粉针剂培养基模拟灌装验证 (30)3.2.P.3.5.2 除菌过滤系统验证 (30)3.2.P.3.5.3 内包材密封完整性验证 ........................................................ 错误!未定义书签。
3.2.P.5.5杂质谱分析模板的整理

3.2.P.5.5杂质谱分析模板的整理-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN3.2.P.5.5杂质谱分析模板的整理格式模板首先列出产品的杂志谱列表,比如:****产品杂质情况分析表反应过程的描述:1、详细的反应方程式,包括结构式,反应温度,所有试剂,助剂,溶剂,催化剂等。
2、结合CTD资料的其他部分,对物料控制进行说明,包括起始物料、其他原料、溶剂、辅料(活性炭,硅藻土,硅胶等。
)。
3、起始物料说明。
起始物料符合广泛、易得、质量稳定,适合保存运输等的原则;还应对多个供应商提供的多批次物料进行质量研究,同供应商签署的质量协议以及供应商工艺变更告知义务等协议。
比如头孢克洛,要对起始物料7-ACCA的工艺、杂质控制和质量情况进行详细的说明。
4、说明制定起始物料的质量控制策略的依据,比如头孢克洛的起始物料7-ACCA的关键杂质△异构体,结合工艺和实验数据,说明杂质产生来源,分布,控制策略等。
第2、3、4内容可以在CTD的其他部分,比如物料说明部分进行。
但是本部分内容讨论的展开需要物料控制说明作为基本的理论依据。
5、关于ICH的杂质鉴定、报告和质控限度:主要参考ICHQ3A(R2)到ICHQ3D的相关规定结合上述反应过程对杂质谱进行分析,主要分起始物料引入杂质,反应杂质,降解杂质等。
第一部分:起始物料引入的杂质分析(比如头孢克洛的起始物料7-ACCA 引入的杂质)N SOH OONO 2OH N OC 22H 19N 3O 7S MW: 469.47NON OH SOOK C 16H 17KN 2O 4S MW: 372.48BrNO 2+NON OH SOONO 2C 23H 23N 3O 6S MW: 469.51C 7H 6BrNO 2MW: 216.03PAA22N OH NOH S OONO 2OC 23H 23N O S MW: 485.51TMP toluene N S NH HOOO23H 21N 3O 5S N S N H HOH OO2OC 22H 19N 3O 6S MW: 453.47CH 2Cl 2/CH 3OHO 3, TMPCH 2Cl 2/TEBAC TsClmorpholineN S N HHN OO2OOC 26H 26N 4O 6S MW: 522.571) Br 2-pyrindineCH 2Cl 2N SCl OONO 2O2NC 14H 12ClN 3O 5S MW: 406.00HClHCl 1) (PhO)3P/CH 2Cl 22) N,N-dimethyl aniline, PCl 5 i BuOHNa 2S 2O 4N SOHOCl OH 2NH C 7H 7ClN 2O 3S MW: 234.661、 无机杂质:说明引入情况和消除渠道;以及相关的控制方法和标准以及依据。
3.2.P.5.5杂质谱分析模板的整理

3.2.P.5.5杂质谱分析模板的整理格式模板首先列出产品的杂志谱列表,比如:****产品杂质情况分析表反应过程的描述:1、详细的反应方程式,包括结构式,反应温度,所有试剂,助剂,溶剂,催化剂等。
2、结合CTD资料的其他部分,对物料控制进行说明,包括起始物料、其他原料、溶剂、辅料(活性炭,硅藻土,硅胶等。
)。
3、起始物料说明。
起始物料符合广泛、易得、质量稳定,适合保存运输等的原则;还应对多个供应商提供的多批次物料进行质量研究,同供应商签署的质量协议以及供应商工艺变更告知义务等协议。
比如头孢克洛,要对起始物料7-ACCA的工艺、杂质控制和质量情况进行详细的说明。
4、说明制定起始物料的质量控制策略的依据,比如头孢克洛的起始物料7-ACCA的关键杂质△异构体,结合工艺和实验数据,说明杂质产生来源,分布,控制策略等。
第2、3、4内容可以在CTD的其他部分,比如物料说明部分进行。
但是本部分内容讨论的展开需要物料控制说明作为基本的理论依据。
5、关于ICH的杂质鉴定、报告和质控限度:主要参考ICHQ3A(R2)到ICHQ3D的相关规定2 克/天结合上述反应过程对杂质谱进行分析,主要分起始物料引入杂质,反应杂质,降解杂质等。
第一部分:起始物料引入的杂质分析(比如头孢克洛的起始物料7-ACCA 引入的杂质)N SOH OONO 2OH N OC 22H 19N 3O 7S MW: 469.47NON OH SOOK C 16H 17KN 2O 4S MW: 372.48Br2+NON OH SOONO 2C 23H 23N 3O 6S MW: 469.51C 7H 6BrNO 2MW: 216.03PAA22N OH NOH S OONO 2OC 23H 23N O S MW: 485.51TMP toluene N S NH HOOO23H 21N 3O 5S N S N H HOH OO2OC 22H 19N 3O 6S MW: 453.47CH 2Cl 2/CH 3OHO 3, TMPCH 2Cl 2/TEBAC TsClmorpholineN S N HHN OONO 2OOC 26H 26N 4O 6S MW: 522.571) Br 2-pyrindineCH 2Cl 2N SCl OO2O2NC 14H 1235MW: 406.00HClHCl 1) (PhO)3P/CH 2Cl 22) N,N-dimethyl aniline, PCl 5 i BuOHNa 2S 2O 42N SOHOCl OH 2NH C 7H 7ClN 2O 3S MW: 234.661、 无机杂质:说明引入情况和消除渠道;以及相关的控制方法和标准以及依据。
杂质谱分析模板的整理

3.2.P.5.5杂质谱分析模板的整理格式模板首先列出产品的杂志谱列表,比如:****产品杂质情况分析表反应过程的描述:1、详细的反应方程式,包括结构式,反应温度,所有试剂,助剂,溶剂,催化剂等。
2、结合CTD资料的其他部分,对物料控制进行说明,包括起始物料、其他原料、溶剂、辅料(活性炭,硅藻土,硅胶等。
)。
3、起始物料说明。
起始物料符合广泛、易得、质量稳定,适合保存运输等的原则;还应对多个供应商提供的多批次物料进行质量研究,同供应商签署的质量协议以及供应商工艺变更告知义务等协议。
比如头孢克洛,要对起始物料7-ACCA的工艺、杂质控制和质量情况进行详细的说明。
4、说明制定起始物料的质量控制策略的依据,比如头孢克洛的起始物料7-ACCA的关键杂质△异构体,结合工艺和实验数据,说明杂质产生来源,分布,控制策略等。
第2、3、4内容可以在CTD的其他部分,比如物料说明部分进行。
但是本部分内容讨论的展开需要物料控制说明作为基本的理论依据。
5、关于ICH的杂质鉴定、报告和质控限度:主要参考ICHQ3A(R2)到ICHQ3D的相关规定结合上述反应过程对杂质谱进行分析,主要分起始物料引入杂质,反应杂质,降解杂质等。
第一部分:起始物料引入的杂质分析(比如头孢克洛的起始物料7-ACCA 引入的杂质)N SOH OONO OH N OC H N O S MW: 469.47NON OH SOOK C H KN O S MW: 372.48BrNO +NON OH SOONO C H N O S MW: 469.51C H BrNO MW: 216.03N OH NOH S OONO OC H N O S MW: 485.51TMP toluene N S NH HOOOH N O S N S N H HOH OOOC H N O S MW: 453.47CH Cl /TEBAC TsClmorpholineN S N HHN OONO OOC H N O S MW: 522.571) Br -pyrindineCH Cl N SCl OOONC H MW: 406.00HClHCl 1) (PhO)P/CH Cl 2) N,N-dimethyl aniline, PCl i BuOHNa S O N SOHOCl OH NH C H ClN O S MW: 234.661、 无机杂质:说明引入情况和消除渠道;以及相关的控制方法和标准以及依据。
原棉杂质分析实验数据汇总

原棉杂质分析实验数据汇总
对原棉杂质分析实验,我们现在要总结以下实验结果。
原棉采取了十二种不同的样本分析,这些样本按细度分为细中粗三个等级,从
粗细度比较细者即为P1到比较粗者即为P12,细度上分别有杂质含量、杂质重量
测定,粗杂质的不同种类也有测算棉及其他物料的比例。
根据实验结果,我们可以得出以下几个要点:
1.各个样本的杂质含量均高于标准规定,且其中P3、P4、P5、P7、P8、P9、P10、
P11、P12杂质含量偏高;
2.杂质重量以P7样本中最高,而P8样本中最低,以P7为原棉含杂量最多,以P8
为最低;
3.从原棉大小粗细度对比来看,随着细度的提高,杂质含量也越来越低,P11、P12处于较高位置;
4.杂质分析结果中,棉籽的含量最多,玉米籽簇、蒜头、杂草、杂质破损的棉絮等占主要比例。
综合上述实验结果,我们确定原始棉质量及其杂质含量超标情况。
此外,粗细
度对杂质含量也有明显影响,分析中发现,棉籽、玉米籽簇、蒜头、杂草及小麦等是棉原纤维的主要杂质。
综上所述,完整的原棉杂质分析实践也为我们的原棉分析提出了正确的方向,
有效地识别原棉中杂质种类、性能和含量,根据实验数据与标准分析对比,我们可以合理控制原棉质量及各个粗度杂质含量,保证质量,提高棉纤维材料的加工价值。
CTD格式申报资料撰写要求

国食药监注〔2010〕 387 号附件:化学药品CTD格式申报资料撰写要求CTD格式申报主要研究信息汇总表(原料药)2.3.S.1 基本信息2.3.S.1.1 药品名称原料药的中英文通用名、化学名2.3.S.1.2 结构原料药的结构式、分子式、分子量2.3.S.1.3 理化性质原料药的主要物理和化学性质:性状(如外观,颜色,物理状态);熔点或沸点;比旋度,溶解性,溶液pH, 分配系数,解离常数,将用于制剂生产的物理形态(如多晶型、溶剂化物、或水合物),生物学活性等。
2.3.S.2 生产信息2.3.S.2.1 生产商生产商的名称(一定要写全称)、地址以及生产场所的地址。
2.3.S.2.2 生产工艺和过程控制(1)工艺流程图:参见申报资料3.2.S.2.2(注明页码)。
(2)工艺描述:按反应路线简述各步反应的反应类型(氧化、还原、取代、缩合、烃化、酰化等),各步反应的原料、试剂、溶剂和产物的名称,终产物的精制方法和粒度控制等;特殊的反应条件(如高温、高压、深冷等)应说明。
详细内容参见申报资料3.2.S.2.2(注明页码)。
(3)生产设备:参见申报资料3.2.S.2.2(注明页码)。
(4)大生产的拟定批量:kg(g)/批。
2.3.S.2.3 物料控制生产用物料(如起始物料、反应试剂、溶剂、催化剂等)的质量控制信息(包括来源、质量标准等),参见申报资料3.2.S.2.3(注明页码)。
2.3.S.2.4 关键步骤和中间体的控制列出所有关键步骤及其工艺参数控制范围。
关键步骤确定依据参见申报资料3.2.S.2.4或3.2.S.2.6(注明页码)。
中间体的质量控制参见申报资料3.2.S.2.4(注明页码)。
2.3.S.2.5 工艺验证和评价无菌原料药:工艺验证方案(编号:--,版本号:--)和验证报告(编号:--,版本号:--)参见申报资料3.2.S.2.5(注明页码)。
其他原料药:工艺验证方案(编号:--,版本号:--)和验证报告(编号:--,版本号:--)参见申报资料3.2.S.2.5(注明页码);或者,工艺验证方案(编号:--,版本号:--)和批生产记录(编号:--,版本号:--)样稿参见申报资料3.2.S.2.5(注明页码),验证承诺书参见申报资料3.2.S.2.5(注明页码)。
P杂质谱分析的

格式模板首先列出产品的杂志谱列表,比如:****产品杂质情况分析表1、详细的反应方程式,包括结构式,反应温度,所有试剂,助剂,溶剂,催化剂等。
2、结合CTD资料的其他部分,对物料控制进行说明,包括起始物料、其他原料、溶剂、辅料(活性炭,硅藻土,硅胶等。
)。
3、起始物料说明。
起始物料符合广泛、易得、质量稳定,适合保存运输等的原则;还应对多个供应商提供的多批次物料进行质量研究,同供应商签署的质量协议以及供应商工艺变更告知义务等协议。
比如头孢克洛,要对起始物料7-ACCA的工艺、杂质控制和质量情况进行详细的说明。
4、说明制定起始物料的质量控制策略的依据,比如头孢克洛的起始物料7-ACCA的关键杂质△异构体,结合工艺和实验数据,说明杂质产生来源,分布,控制策略等。
第2、3、4内容可以在CTD的其他部分,比如物料说明部分进行。
但是本部分内容讨论的展开需要物料控制说明作为基本的理论依据。
5、关于ICH的杂质鉴定、报告和质控限度:主要参考ICHQ3A(R2)到ICHQ3D的相关规定杂质,降解杂质等。
第一部分:起始物料引入的杂质分析(比如头孢克洛的起始物料7-ACCA引入的杂质)1、无机杂质:说明引入情况和消除渠道;以及相关的控制方法和标准以及依据。
比如上述列表中的钯元素控制。
2、普通有机杂质。
3、对映异构体(根据品种的情况具体分析);考察不同的对应异构体对最终产品质量的影响情况。
4、非对映异构体:比如ACCA的△异构体;还包括非对应异构体自身的各种对映体。
第二部分:反应的每个步骤引入的杂质:需要结合实际反应监控(HPLC,LC-MS为主)过程对杂质消除过程以及对后续的影响进行实际说明。
这个内容主要在工艺描述部分进行,本部分引用工艺描述内容。
1、步骤1引入的杂质。
2、步骤2引入的杂质。
3、步骤3引入的杂质。
以及后续的步骤产生的杂质以及消除过程和简单的控制描述……4、精制过程引入的杂质。
第三部分:结合小试中试数据汇总列表、方法适用性、实际检测结果等内容说明各个有机杂质的分布情况。
化学药品CTD格式申报资料撰写要求

(4)说明大生产的拟定批量范围。
3.2.S.2.3 物料控制 按照工艺流程图中的工序,以表格的形式列明生产中用到的所有物料(如 起始物料、反应试剂、溶剂、催化剂等),并说明所使用的步骤 。 提供物料的质量控制信息,明确引用标准,或提供内控标准(包括项目、 检测方法和限度),并提供必要的方法学验证资料。 对于关键的起始原料,尚需根据相关技术指导原则、技术要求提供其制备 工艺资料。
3.2.P.2.4 包装材料/容器
(1)包材类型、来源及相关证明文件: (2)阐述包材的选择依据。 (3)描述针对所选用包材进行的支持性研究。 在常规制剂稳定性考察基础上,需考虑必要的相容性研究,特别是含有有 机溶剂的液体制剂或半固体制剂。
3.2.P.2.5 相容性
提供研究资料说明制剂和附带溶剂或者给药装置的相容性。
3.2.S.5 对照品
药品研制过程中如果使用了药典对照品,应说明来源并提供说明书和批号 。 药品研制过程中如果使用了自制对照品,应提供详细的含量和纯度标定过 程。
3.2.S.6 包装材料和容器 :相当于原15号资料
(1)包材类型、来源及相关证明文件: (2)阐述包材的选择依据。 (3)描述针对所选用包材进行的支持性研究。 3.2.S.7 稳定性:相当于原14号资料 3.2.S.7.1稳定性总结 总结所进行的稳定性研究的样品情况、考察条件、考察指标和考察结果,
(1)工艺流程图:按合成步骤提供工艺流程图,标明工艺参数和所用溶剂 。如为化学合成的原料药,还应提供其化学反应式,其中应包括起始原料 、中间体、所用反应试剂的分子式、分子量、化学结构式。
(2)工艺描述:按工艺流程来描述工艺操作,以注册批为代表,列明各反 应物料的投料量及各步收率范围,明确关键生产步骤、关键工艺参数以及 中间体的质控指标。
药物制剂CTD申报资料(4、5.2类)最新模板.

制剂CTD 格式申报资料4、5.2类3.2.P 制剂3.2.P.1 剂型及产品组成(1)说明具体的剂型,并以表格的方式列出单位剂量产品的处方组成,列明各成分在处方中的作用,执行的标准。
如有过量加入的情况需给予说明。
对于处方中用到但最终需去除的溶剂也应列出。
表1 (注:表格依次编号,下同):处方2)如附带专用溶剂,参照以上表格方式列出专用溶剂的处方。
3)说明产品所使用的包装材料及容器。
3.2.P.2 产品开发说明产品开发目标。
说明原研药上市情况。
详细提供包括原研药的质量概况在内的相关研究资料或文献资料来论证本品的剂型、处方组成、生产工艺、包装材料选择和确定的合理性。
3.2. P.2.1处方组成3.2. P.2.1.1原料药参照《化学药物制剂研究的技术指导原则》,提供资料说明原料药和辅料的相容性,分析原料药的关键理化特性(如BCS分类、晶型、溶解性、粒度分布等)与制剂生产及制剂性能的相关性,并提供相关的研究资料与文献。
3.2. P.2.1.2辅料说明辅料是否适合所用的给药途径结合辅料在处方中的作用分析辅料的哪些性质会影响制剂特性,提供相关的研究资料与文献。
3.2. P.2.2 制剂研究3.2. P.2.2.1处方开发过程参照《化学药物制剂研究的技术指导原则》,提供处方的研究开发过程和确定依据,包括文献信息(如对照药品的处方信息)、研究信息(包括处方设计,处方筛选和优化、处方确定等研究内容)、辅料种类和用量选择的依据、分析辅料用量是否在常规用量范围内,以及自制样品与原研药的质量特性对比研究结果(需说明原研药的来源、批次和有效期,自研样品批次,对比项目、采用方法),并重点说明在药品开发阶段中处方组成的主要变更、原因以及支持变化的验证研究。
如生产中存在过量投料的问题,应提供过量投料的必要性和合理性的相关研究资料。
3.2. P.2.2.2制剂相关特性对与制剂性能相关的理化性质,如pH、离子强度、溶出度、再分散性、复溶、粒径分布、聚合、多晶型、流变学等进行分析。
化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求(试行)2016年第120号通告附件

的验证研究。
如生产中存在过量投料的问题,应提供过量投料的必要性和
合理性的相关研究资料。
8.2.2.2.(3.2.P.2.2.2)生产工艺再研发
提供详细的工艺研究资料(包括实验数据及图谱),重点描
述生产工艺的主要变更(包括工艺类型和参数、批量、设备等的
变化)及相关的支持性验证研究,包括生产工艺变更的基本思路、
否适宜于大生产规模。
8.3.(3.2.P.3)生产信息
8.3.1.(3.2.P.3.1)生产商
生产商的名称(一定要写全称)、地址、电话、传真以及生
产场所的地址、电话、传真等。上述信息应与申请表、证明文件、
生产现场检查报告中的地址与生产线完全一致。
8.3.2.(3.2.P.3.2)批处方
以表格的方式列出典型生产规模产品的批处方组成,列明各
— 8 ——
结合变更情况,应重点阐述针对变更所进行的研究和验证工
作及自我评价。包括关键步骤及其工艺参数的确定依据以及合理
性分析;起始物料、中间体的及工艺参数控制的合理性、变更后
生产工艺的合理性和可放大性、验证工作情况等。同时应阐述处
方工艺变更前后生产规模、主要生产设备是否发生改变及其对产
品质量的影响,如改变,应提供其生产能力、操作参数,说明是
(4)现行生产规模及其依据:说明大生产的批量及其制定 依据。如拟定的批量超出了目前生产的最大批量所用生产设备的 正常批量范围,应提供放大研究的依据。制定依据包括处方工艺 研究放大情况、验证情况、生产设备情况、临床试验/BE 试验样 品情况等。
— 3 ——
国内外上市情况。 提供包括原研药或国际公认的同种药物以及仿制药的质量
概况或文献资料来论证本品剂型、处方组成、生产工艺、包装材 料选择和确定的合理性。
五大波谱分析

(一)紫外光谱解析UV应用时顾及吸收带的位置,强度和形状三个方面。
从吸收带(K带)位置可估计产生该吸收共轭体系的大小;从吸收带的强度有助于K带,B带和R带的识别;从吸收带的形状可帮助判断产生紫外吸收的基团,如某些芳香化合物,在峰形上可显示一定程度的精细结构。
一般紫外吸收光谱都比较简单,大多数化合物只有一、两个吸收带,因此解析较为容易。
可粗略归纳为以下几点:①如果化合物在220~800nm区间无吸收,表明该化合物是脂肪烃、脂环烃或它们的简单衍生物。
②如果在220~250nm间显示强吸收(ε近10000或更大),表明有R带吸收,即分子结构存在共轭双烯或α,β—不饱和醛、酮。
③如果在250~290nm间显示中等强度(ε为200~1000)的吸收带,且常显示不同程度精细结构,表明结构中有苯环或某些杂芳环的存在。
④如果在290nm附近有弱吸收带(ε<100),则表明分子结构中非共轭羰基。
⑤如果在300nm上有***度吸收,说明该化合物有较大的共轭体系;若***度吸收具有明显的精细结构,说明为稠环芳、稠环杂芳烃或其衍生物。
(二)红外光谱1. 解析红外光谱的三要素(位置、强度和峰形)在解析红外光谱时,要同时注意红外吸收峰的位置,强度和峰形。
吸收位置是红外吸收最重要的特点,但在鉴定化合物分子结构时,应将吸收峰的位置辅以吸收峰强度和峰形综合分析。
每种有机化合物均显示若干吸收峰,对大量红外图谱中各吸收峰强度相互比较,归纳出各种官能团红外吸收强度的变化范围。
只有熟悉各官能团红外吸收的位置和强度处于一定范围时,才能准确推断出官能团的存在2 .确定官能团的方法对于任何有机化合物的红外光谱,均存在红外吸收的伸缩振动和多种弯曲振动。
因此,每一个化合物的官能团的红外光谱图在不同区域显示一组相关吸收峰。
只有当几处相关吸收峰得到确认时,才能确定该官能团的存在。
例1. 甲基(CH3):2960cm-1和2870cm-1为伸缩振动,1460cm-1和1380cm-1为其弯曲振动。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.2.P.5.5 杂质谱分析模板的整理格式模板首先列出产品的杂志谱列表,比如:**** 产品杂质情况分析表反应过程的描述:1、详细的反应方程式,包括结构式,反应温度,所有试剂,助剂,溶剂,催化剂等。
2、结合CTD 资料的其他部分,对物料控制进行说明,包括起始物料、其他原料、溶剂、辅料(活性炭,硅藻土,硅胶等。
)。
3、起始物料说明。
起始物料符合广泛、易得、质量稳定,适合保存运输等的原则;还应对多个供应商提供的多批次物料进行质量研究,同供应商签署的质量协议以及供应商工艺变更告知义务等协议。
比如头孢克洛,要对起始物料7-ACCA的工艺、杂质控制和质量情况进行详细的说明。
4、说明制定起始物料的质量控制策略的依据,比如头孢克洛的起始物料7-ACCA的关键杂质△异构体,结合工艺和实验数据,说明杂质产生来源,分布,控制策略等。
第2、3、4 内容可以在CTD 的其他部分,比如物料说明部分进行。
但是本部分内容讨论的展开需要物料控制说明作为基本的理论依据。
5、关于ICH 的杂质鉴定、报告和质控限度:主要参考ICHQ3A (R2)到ICHQ3D 的相关规定阈值(原料药)结合上述反应过程对杂质谱进行分析,主要分起始物料引入杂质,反应杂质,降解杂 质等。
第一部分:起始物料引入的杂质分析(比如头孢克洛的起始物料 7-ACCA 引入的杂质)比如上述列表中的钯元素控制。
3 、 对映异构体(根据品种的情况具体分析);考察不同的对应异构体对最终产品 质量的影响情况。
4、 非对映异构体:比如 ACCA 的△异构体;还包括非对应异构体自身的各种对映体。
第二部分:反应的每个步骤引入的杂质:需要结合实际反应监控( HPLC ,LC-MS 为 主)过程对杂质消除过程以及对后续的影响进行实际说明。
这个内容主要在工艺描述 部分进行,本部分引用工艺描述内容。
1、 步骤 1 引入的杂质。
PAA OHN OHNSOOKC 16 H 17 KN 2 O 4 S MW: 372.48OHNCH 2 ClCH TsClCl /TEBACn-methylmorpholine morpholine1) (PhO) 3 P/CH Cl 2 /Pyridine2) N,N-dimethyl aniline, PCl BuOHBrNO 2C 7 H 6 BrNO MW: 216.03HOO N S OOO OC 23 H 23 N 3 O 7 S MW: 485.512 Cl 2DMF/CH2 Cl 2TMP toluene NOO NONO S O 6S NOC23 H 23 N 3OMW: 469.51C22 H 19 N 3 O 7 S MW:469.47HCl H 2 NNa 2 S 2 O 4 acetone/H2OC 14 H 12 ClN 3O 5 SMW: 406.007H 7 ClN 2 O 3 SMW: 234.661、无机杂质:说明引入情况和消除渠道; 以及相关的控制方法和标准以及依据。
2、 普通有机杂质。
NO 2MW: 522.57H N2 ClO2、步骤2 引入的杂质。
3、步骤3 引入的杂质。
以及后续的步骤产生的杂质以及消除过程和简单的控制描述⋯⋯4、精制过程引入的杂质。
第三部分:结合小试中试数据汇总列表、方法适用性、实际检测结果等内容说明各个有机杂质的分布情况。
第四部分:潜在杂质在成品中的检测结果对上述表格进行综述性总结。
主要是用不同来源的样品的液相图谱和列表数据进行对比性说明。
第六部分:制剂中的特定杂质:主要分析制剂与原料药储存过程中降解产生的杂质,以及因为辅料和原料药相容性而产生的特定杂质:比如纤维素类的曼德拉反应产生的杂质等。
储存降解产生的杂质包括酸碱氧热光降解杂质,空气中水分造成的水解杂质,或者跟空气中二氧化碳反应产生的杂质。
1. 说明各杂质的限度:**** 杂质阈值(举例)2. 3.2.P.5.5.1 潜在杂质的推测由 **** 公司提供 ** 原料药简单工艺路线,分析整理本品的杂质见下表。
表3.2.P.** ,------ 潜在杂质推测3. 潜在杂质特征的鉴定a)原料合成过程带入的相关杂质特征的鉴定由厂家提供的原料药合成过程中所用的起始原料及各步中间产物的色谱行为和紫外光谱特征进行汇总分析,初步鉴定注射用头孢地嗪钠成品中原料合成过程中带入的杂质。
起始原料及各步中间产物鉴定特征如下表:表3.2.P.5-X **** 原料合成过程相关杂质特征鉴定b)注射用头孢地嗪钠强制降解试验中杂质的特征鉴定试品与对照品强制降解试验表3.2.P.** 热破坏试验主要降解产物色谱信息表3.2.P.5-50 酸破坏试验主要降解产物色谱信息表3.2.P.5-51 碱破坏试验主要降解产物色谱信息表氧化破坏试验主要降解产物色谱信息表3.2.P.5-53 光照破坏试验主要降解产物4. 制剂杂质列表a)以列表的方式列明产品中可能含有的杂质,分析杂质的产生来源,结合相关指导原则要求,对于已知杂质给出化学结构并提供结构确证资料,并提供控制限度。
杂质的结构和种类的鉴定在其他模块或者附件中体现。
按照以前惯例,自制杂质的结构确认是通过工艺描述加氢谱确认即可,特殊的需要提供其他佐证手段。
外购杂质的结构确认一般是要提供完整的结构鉴定谱图。
b) 说明各杂质在最终质量标准中是否进行控制以及控制的限度,并提供充分的依据。
报告阈值是指所有高于此阈值的杂质及其含量均应在每批产品的检验报告中记录 , 并在申报资料中反映 ; 鉴定阈值是指所有高于此阈值的杂质均应对其结构进行确证 ; 合理限度是指只要质量标准中制订的杂质限度不高于此限度,就不需要提供该限度的制订依据 , 认为该限度是合理的。
c) 提供详细的降解途径与降解产物研究资料与图谱。
应在对原料药的降解途径与降解产物有充分了解的基础上,进行系统的降解途径与降解产物研究,明确说明本品的降解途径与降解产物5. 对比自制制剂片和原料药杂质谱以及纯度数据6. 对比自制制剂片和参比制剂杂质谱以及纯度数据7. 对比自制制剂片和参比制剂强制降解和长期稳定性考察的杂质谱变化、图谱以及纯度数据。
附件 1 :《CTD 申报资料中杂质研究的几个问题》这篇需要我们认真研究一下:下面做了简单的抄录。
( /dzkw.do?method=largePage&id=312898 )杂志谱研究需要以杂质谱分析为主线,安全性为核心,按照风险控制的策略,将杂质研究与CMC 各项研究,乃至药理毒理及临床安全性研究等环节关联思考、综合考虑,而不仅仅拘泥于提供准确分析数据的传统思维,不是一项孤立的分析工作。
1、杂质控制要做到源头控制、过程控制与终点控制相结合的杂质控制理念:CTD 格式中杂质控制的考虑要体现在CMC 的各个环节,而不是仅仅局限在“质量控制”模块。
比如原辅料首先要满足制剂质量要求;关键工艺步骤及参数的确立、工艺开发过程等要考虑以杂质是否得到有效控制为重点关注。
制剂相关特性中要体现与原研产品杂质谱等的对比情况;包材、贮藏条件以及有效期的确立等也要以杂质是否处于安全合理的可控范围内为核心。
2、关注杂质分析与控制的系统性与整体性,不能割裂各项内容的必然联系和有机统杂质分析与控制的相关内容会分布在分析方法( 3.2.S.4.2 )、方法学验证(3.2.S.4.3 )、杂质对比研究与杂质谱分析( 3.2.S.4.5 )、杂质情况分析总结(3.2.S.3.2 )、样品检测与数据积累( 3.2.S.4.4 )、控制限度( 2.3.S.4.1 )等各模块中,但杂质研究又是一项系统工程,具有统一的整体性。
因此,不要因为申报资料格式的模块化而人为割裂各项研究内容的相互联系。
3、从杂质谱分析入手确立科学的杂质研究基本思路。
杂质谱包括药物中所有杂质的种类、来源及特性等信息。
有针对性地选择合适的杂质分析方法,以确保杂质的有效检出和确认;通过与原研产品杂质谱的对比研究,根据各相应杂质的一致性求证,或跟踪杂质谱对安全性试验或临床试验结果产生的影响,评估各杂质的安全性风险和可接受水平;结合规模化生产时杂质谱的变化情况,确立安全合理的杂质控制水平。
4、分析方法的验证应具备针对性和全面性。
5、杂质限度的确定应符合相关技术指导原则的要求。
在分析方法相同的情况下,各特定杂质应不超过同品种或同类品种法定标准的相应限度;非特定杂质应采用LC/UV 、LC/MS 、PDA 等多种方法与原研产品或ICH 成员国产品进行杂质比较,说明各杂质与原研产品的一致性,相同杂质限度可参考ChP 、USP 、BP/EP 、JP等药典同品种最严格的单个杂质限度确定。
附件 2 :引用的 5.30 文件的要求:化学仿制药电子通用技术文档申报指导原则(征求意见稿)A. 以列表的方式列明产品中可能含有的杂质,分析杂质的产生来源,结合相关指导原则要求,对于已知杂质给出化学结构并提供结构确证资料,并提供控制限度B. 说明各杂质在最终质量标准中是否进行控制以及控制的限度,并提供充分的依据。
C. 提供详细的降解途径与降解产物研究资料与图谱。
应在对原料药的降解途径与降解产物有充分了解的基础上,进行系统的降解途径与降解产物研究,明确说明本品的降解途径与降解产物化学药品新注册分类申报资料要求(试行)-4 类A. 以列表的方式列明产品中可能含有的杂质,分析杂质的产生来源,结合相关指导原则要求,对于已知杂质给出化学结构并提供结构确证资料,并提供控制限度。
可以表格形式整理B. 说明各杂质在最终质量标准中是否进行控制以及控制的限度,并提供充分的依据。
C. 提供详细的降解途径与降解产物研究资料与图谱。
应在对原料药的降解途径与降解产物有充分了解的基础上,进行系统的降解途径与降解产物研究,明确说明本品的降解途径与降解产物化学药品新注册分类申报资料要求(试行)-3 类A. 以列表的方式列明产品中可能含有的杂质,分析杂质的产生来源,结合相关指导原则要求,对于已知杂质给出化学结构并提供结构确证资料,并提供控制限度。
B. 对于最终质量标准中是否进行控制以及控制的限度,应提供依据。
